奥赛辅导溶液
初中化学竞赛专题辅导5:溶液的基本知识

竞赛专题辅导五:溶液的基本知识【内容综述】本期主要讲解有关溶液的基本知识。
溶液知识是初中化学的一个重点和难点知识,其主要重、难点知识要点包括:<1)饱和溶液和不饱和溶液的相互转化<2)溶解度的概念及其计算<3)过滤和结晶知识的理解和应用<4)溶液组成的表示方法及其应用。
AUKnYxbkZu在一些大型考试和竞赛试题中,关于溶液知识的试题往往使众多考生感到困惑和较为棘手。
为此,本期主要从关于溶液知识的重难点知识进行分析,希望能给大家一些帮助。
AUKnYxbkZu【要点讲解】一、灵活应用溶解度概念知识解题【例1】在t1℃时,20克水中最多能溶解15克X,t2℃时50克水中最多能溶解30克Y物质。
则X和Y两种物质的溶解度的关系是< )AUKnYxbkZuA.X>Y B.X<Y C.X==Y D.无法确定【解读】依题意知:本题对溶解度的概念进行了另一种较为抽象的理解,即在一定量的溶剂中最多溶解某物质的质量,说明该溶液已经达到饱和.按照溶解度的定义计算:X物质的溶解度应为:15克/20克×100克==75克;Y物质的溶解度应为:30克/50克×100克==60克.值得注意的是如果本题不对溶解度的定义进行深层次的理解,容易误选A选项.由于X和Y两物质所对应的温度不相同,故溶解度是无法进行比较的.故本题的答案为:D.AUKnYxbkZu【例2】某温度下,将A物质<不含结晶水)的水溶液分成等质量的2份。
向第一份加入9克A物质,充分搅拌,还有1克固体不能溶解;将第二份溶液蒸发掉40克水,并恢复到原温度,溶液恰好饱和<无A析出),则A物质在该温度下的溶解度是< )AUKnYxbkZuA.40克 B.20克 C.8克 D.无法计算【解读】由题意分析可知:本题含有两个隐含条件:<1)分成两等份的溶液中蒸发掉40克水都恰好能形成饱和溶液<2)蒸发掉40克水恰好能溶解9-1==8克A物质。
高中化学竞赛水溶液习题讲解课件

贫不困怕教 路会远贫,困就者怕一志切短。 追让踪自着 己鹿的的内猎心人藏是着看一不条见巨山龙的,。既是一种苦刑,也是一种乐趣。
(C) H2O 生立无志一 是锥事土业,的常大有门四,海工心作。是登门入室的旅程。
=
9.0
10-5
(mol·dm-3)
Ip = c(Mg2+) c(OH)2 = 0.25 (9.0 10-5)2 = 2.0 10-19 > Ksp(Mg(OH)2) 所以可以生成 Mg(OH)2 沉淀。
20
使 Mg(OH)2 沉淀恰好不生成或说刚有沉淀生成,则[Mg2+][OH]2 = 1.2 10-11 [OH] = 1.2 1011 = 6.9 10-6 (mol·dm-3)
多元弱酸第二步质子传递平衡所得的共轭碱的浓度近似等 于Ka2,与酸的浓度关系不大。
1
CaC2O4的Ksp为2.6 10-9,要使0.020 mol·dm-3 CaCl2溶液生成沉淀,至少需要的草酸根离子浓 度是
有志的人战天斗地,无志的人怨天恨地。
不为穷变节,不为贱易志。
志之所向,金石为开,谁能御之?
17
Mg(OH)2(s)
+
2
NH
4
Mg2+ + 2NH3· H2O
初始
0.10
0
0
反应
-2x
x
2x
平衡
0.10-2x
x
2x
K = Ksp 1.2 1011 = 3.7 10-2
K
2 b
(1.8 105 )2
3.7
山东省高中化学奥林匹克竞赛夏令营讲义—物理化学(第三章)

第三章 溶液—多组分体系热力学在溶液中的应用溶液:由两种或两种以上物质均匀混合而彼此呈分子或离子状态分布者均称为溶液。
按聚集状态分为:气态溶液:混合气体。
固态溶液:一种固体以分子或原子状态完全均匀分布在另一种固体中所形成的体系(简称固溶体,如金银合金)。
液态溶液:(简称溶液)本章讨论的重点。
形成方式有三种:(1)气体溶解在液体中。
气体——称作溶质,液体——称作溶剂 (2)固体溶解在液体中。
固体——称作溶质,液体——称作溶剂 (3)液体溶解在液体中。
少者——称作溶质,多者——称作溶剂§3.1 溶液组成的表示法一、物质的量分数X B (又称摩尔分数) X B =∑BBBn n 注:量分数没有量纲。
若以A 表示溶剂,B 表示溶质,则x B =BBA Bn n n ∑+二、质量摩尔浓度m B m B =ABW n (3-2) w A :溶剂A 的质量(单位:千克),m B 的单位:mol·kg -1。
x B ==+∑BB A B n n n ∑+BB A B m M m 1=∑+BBA AM B m M m 1 M A :A 的摩尔质量(kg·mol -1) 三、体积摩尔浓度(物质的量浓度) C BC B =Vn B说明:(1)对极稀的溶液A ρρ≈,当A ρ=1000kg ·m -3时,mB=CB 例如:≈O H 2ρ1000kg ·m -3,(此时CB的单位:mol·dm -3)(2)mB,x B与温度无关。
四、质量分数WB WB=溶液的总质量的质量物质B注:(1)用百分数表示时,称作质量百分数。
(2)质量分数是一个无量纲的量。
§3-2稀溶液的两个定律一、拉乌尔定律(Roault ‘s law )1887年法国化学家拉乌尔从实验探讨稀溶液的性质时发表了一个定律:“定温下,在稀溶液中,溶剂的蒸气压等于纯溶剂的蒸气压乘以溶液中溶剂的摩尔分数。
小学奥数6-2-6 溶液浓度问题(一).专项练习及答案解析(精品)

1、明确溶液的质量,溶质的质量,溶剂的质量之间的关系2、浓度三角的应用3、会将复杂分数应用题及其他类型题目转化成浓度三角形式来解4、利用方程解复杂浓度问题浓度问题的内容与我们实际的生活联系很紧密,就知识点而言它包括小学所学2个重点知识:百分数,比例。
一、浓度问题中的基本量溶质:通常为盐水中的“盐”,糖水中的“糖”,酒精溶液中的“酒精”等溶剂:一般为水,部分题目中也会出现煤油等溶液:溶质和溶液的混合液体。
浓度:溶质质量与溶液质量的比值。
二、几个基本量之间的运算关系1、溶液=溶质+溶剂2、=100%=100%+⨯⨯溶质溶质浓度溶液溶质溶液三、解浓度问题的一般方法1、寻找溶液配比前后的不变量,依靠不变量建立等量关系列方程2、十字交叉法:(甲溶液浓度大于乙溶液浓度)形象表达:A B =甲溶液质量乙溶液质量B A =甲溶液与混合溶液的浓度差混合溶液与乙溶液的浓度差注:十字交叉法在浓度问题中的运用也称之为浓度三角,浓度三角与十字交叉法实质上是相同的.浓度三角的表示方法如下:::乙溶液质量甲溶液质量z-y x-zy %浓度x 混合浓度z%3、列方程解应用题也是解决浓度问题的重要方法.知识精讲 教学目标溶液浓度问题(一)利用十字交叉即浓度三角进行解题(一)简单的溶液浓度问题【例1】某种溶液由40克食盐浓度15%的溶液和60克食盐浓度10%的溶液混合后再蒸发50克水得到,那么这种溶液的食盐浓度为多少?【考点】溶液浓度问题【难度】2星【题型】解答【解析】两种配置溶液共含食盐40×15%+60×10%=12克,而溶液质量为40+60-50=50克,所以这种溶液的浓度为12÷50=24%.【答案】24%【巩固】一容器内有浓度为25%的糖水,若再加入20千克水,则糖水的浓度变为15%,问这个容器内原来含有糖多少千克?【考点】溶液浓度问题【难度】2星【题型】解答【解析】100100207.51525⎛⎫÷-=⎪⎝⎭。
奥赛专题六水和溶液

奥专六水和溶液1.在室温下,将硝酸钠和氯化钾两种饱和溶液混合后无晶体析出,则在加热蒸发时,开始析出的晶体是()A硝酸钾B氯化钾C硝酸钠D氯化钠2.海水中的Na+的质量分数是1.42%,如果其中的Na+全部以氯化钠计算,则海水中氯化钠的质量分数是()A 2.82%B 5.85%C 3.61%D 4.91%3.过氧化氢溶液在存放过程中会缓慢分解,如图为实验室保存的一瓶过氧化氢溶液的标签.某小组同学为了了解过氧化氢的分解情况,取5g该溶液共制得0.64g氧气.试计算这瓶过氧化氢溶液在保存过程中已经分解的过氧化氢的质量4.某物质(仅含一种溶质)的溶液在t度时,恒温蒸发掉10g水,析出了2g晶体,若恒温蒸发掉20g水,析出5g晶体,则下列说法正确的是()A原溶液在t度时是饱和溶液Bt度时该物质的溶解度是20gCt度时该物质的溶解度是25gDt度时该物质的溶解度是30g5.相同质量和质量分数的盐酸分别和足量的下列物质反应后所得的溶液的质量分数最大的是() A镁B氧化镁C氢氧化镁D碳酸镁6.完全中和mg a%的硫酸溶液需要ng a%的氢氧化钠溶液,则m和n的关系是()A m>nB m<nC m=nD 无法确定7. 10%的硫酸铜溶液中氧元素的质量分数是()A80% B 4% C 84% D 90%8.t度时100g质量分数为10%的某溶液,蒸发58g水后,回到t度析出2g不带结晶水的晶体,则t度时该物质的溶解度是()A 3.5gB 8.9gC 31.25gD 25.0g9.有一部分潮解和变质的苛性钠样品Wg,为验证其变质的程度,将其加入98g质量分数为20%的稀硫酸中,充分反应后再加入20g20%的氢氧化钠溶液恰好呈中性,则把溶液蒸干可得到固体的质量为()A19.6g B 14.2g C 28.4g D 30.4 g10.为了增强水的导电性,现采用4%的硫酸溶液135g进行电解水实验,一段时间后,测得硫酸溶液中溶质的质量分数为5%,则电解水生成的氢气的质量是()A1.5g B 3g C 6g D12g11.A,B两种物质的溶解度都随温度升高而增大,在20度时,50g水最多能溶解15gA物质,在30度时,20g水最多能溶解6gB物质.则A,B在20度时的溶解度的关系是()AA<B B A>B C A=B D 温度不同,无法比较奥专七 酸 碱 盐1. 下列各组物质的溶液之间,不能发生得分解反应是的( )A NaCl 和AgNO 3B H 2SO 4 和Na 2CO 3C NaOH 和 HClD KNO 3 和Na 2SO 4 2. 下列离子在pH=2的无色溶液中大量共存的是( )A SO 42- Fe 3+ Na + OH -B K + SO 42- Cu 2+ NO 3-C Cl -K +SO 42- Na +D Ca 2+Cl -CO 32- Na +3. 有一包绿色粉末,进行化学分析如下,将绿色粉末A 加热得无色气体B ,无色液体C 和黑色固体D .①将气体B 通入澄清石灰水,有白色沉淀E 生成②将C 滴到无水硫酸铜上,生成蓝色晶体F ③将氢气通过D 并加热,有红色固体G 生成,将稀硫酸加入装有D 的烧杯微热.D 溶解,再加NaOH 溶液,有蓝色沉淀H 生成.根据上述反应现象,推断A,B,C,D,E,F,G,H 各是什么物质,用化学式表示4. 右图”五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发 生反应,不相连环物质间不能发生反应,请回答,已知A,B,C,D,分别是铁,氧气 ,二氧化碳.氯化钡溶液,氢氧化钠溶液中的一种物质.若A 为氧气,则D 的化学式________,A 与C 发生反应的化学方程式是_____________________________5. 某温度下,硫酸铜的饱和溶液192g 与质量分数为10%的氢氧化钠溶液恰好完全反应,生成蓝色沉淀19.6g,求 (1) 该温度下硫酸铜的溶解度(2)反应后所得溶液中溶质的质量分数6. 为了除去下表内各物质中含有的少量杂质.请分别选取一种试剂除杂.7.某气体可能含有水蒸气,CO,H2,中的一种或几种,为了确定其成分,最佳的实验方案是将气体依次通过下图装置A 甲乙丙B 丙乙甲C 丙甲乙丙D丙甲丙乙8.下列各组物质的溶液,不另加任何试剂就能将它们区别开来的是( )A CuSO4NaCl KNO3BaCl2B KCl AgNO3HCl HNO3C Fe(NO3)3NaOH H2SO4KClD HNO3 NaOH Na2CO3 HCl9.右图A,B,C,D,E是初中化学中常见的五种物质.且它们都含有一种相同的元素.其中D为食盐的主要成分,B,E的溶液都有颜色,其他物质溶液均为无色.转变⑥为置换反应,其他各转变均为复分解反应.(1)写出下列物质的化学式A__________ D__________(2)C属于______(“酸””碱””盐””氧化物”)类物质(3)写出实现下列各转变的化学方程式③_____________________⑥____________________10.根据下列单质与化合物相互转化的关系(如图所示),回答(1)若乙的溶液为浅绿色,Y是红色固体,则X是________,甲是______(2)若Y为无色气体,则X是_____,甲是_________11.有关物质转化关系如图,其中A为一种生活中常见的有机化合物,在通常情况下,X,Y为两种气态单质,Z为固态单质,B,C,D为三种常温下状态各不相同的氧化物(个别反应的条件未注明) ((1)写出有关物质的化学式:A可能是_________(填两种) C_________ D-______(2)写出M的一种用途____________(3)写出反应①的化学方程式______________________12.有一包白色粉末,可能是CuSO4,CaCO3,BaCl2,NaCl,Na2SO4,(NH4)2CO3中的一种或几种.为证明其组成进行如下实验(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色溶液,则白色沉淀可能是__________________,原混合物中一定不含有的_______________________(2)向实验(1)滤出的白色沉淀中加入足量的盐酸,沉淀部分溶解,并产生无色气体.则原混合物中一定含的是______________(3)向实验(1)的滤液中加入足量的氢氧化钠溶液,有刺激性气体放出,证明实验(1)的白色沉淀中一定还有_______________(4)向实验(3)后的溶液中加入稀硝酸酸化,再加入足量的硝酸钡,发现没有沉淀产生,然后加入硝酸银溶液,出现了白色沉淀,有人由此得出原混合物中一定含有氯化钠,你认为_______(“正确”或”不正确”)理由是______________________________1.有X,Y两种元素,使12gX2与XY3反应生成24gC,反应的化学方程式为;X2+XY3====3C,则X,Y 两元素的相对原子质量之比是______2.一定质量的某化合物完全燃烧,消耗9.6g氧气,生成8.8g二氧化碳和5.4g的水.对该化合物的组成,其中判断正确的是( )A 含有C,H,O三种元素B 只含有C,H两种元素C 分子中C,H原子个数比为1:3D 以上答案都不正确.3.某物质在空气中完全燃烧时,生成质量比为11:9的二氧化碳和水,则该物质的化学式可能是( )A C2H6B C2H5OHC C2H2D CH44.CO和O2的混合气体48g,在一定条件下充分反应后,生成C O244g,则原混合气体中CO和O2的质量比可能是( )A 2:1B 7: 4C 7:5D 7;85.在某Na2SO4溶液中,Na+与水分子个数比为1:100,则该溶液中Na2SO4的质量分数为__________6.已知铁的氧化物中通常只有+2,+3两种化合价,氧元素在化合物中通常显-2价,测得铁的某种氧化物晶体的化学式为Fe23O25,则其中Fe3+,Fe2+的粒子个数比为________7.托盘天平两端的烧杯中,各装溶质质量分数和质量都相同的足量稀硫酸,此时天平平衡,然后向一烧杯中加入6g镁粉,向另一烧杯中加入6g铜铝合金,充分反应后,托盘天平仍保持平衡.则铜铝合金中铜的质量有多少克?7.在CO和CO2的混合气体中,氧元素的质量分数为64%,将该混合气体5g通过足量的灼热氧化铜,充分反应后,气体再全部通入足量的澄清石灰水中,得到的白色沉淀的质量是( )A 5gB 10gC 15 gD 20g8.32.33氯化钡溶液和20g硫酸溶液恰好完全反应, 滤去沉淀后得到50g盐酸,则盐酸中溶质的质量分数是____________9.将15g含有少量氯化钠杂质的硫酸钠样品放入100g蒸馏水中,完全溶解后与108.3g某质量分数的氯化钡溶液恰好完全反应,经过滤,干燥,称量,得到23.3g固体粉末.试计算(1)硫酸钠样品中氯化钠的质量分数(2)反应后所得溶液中溶质的质量分数常用的数学方法有差量法,估算法,极值法,假设法,平均值法,等效法,整体法,数形结合法,十字交叉法等.1.现有13.5g氯化铜样品,当它与足量的硝酸银充分反应后,得到AgCl29g,则样品中可能混有的物质是() A BaCl2 B KCl C ZnCl2 D CaCl22.某CO与CO2混合气体,实验测得混合气体的含碳量为40%,此混合气体中,CO与CO2相比较谁的质量分数大?3.4.0g +2价金属的氧化物与足量的稀盐酸反应后,完全转化为氯化物,测得氯化物的质量为9.5g,通过计算指出该金属的名称4.质量相等的某2价金属两片,A放入足量CuSO4溶液中,B放入足量的Hg(NO3)2溶液中,一段时间后取出,洗净,干燥,称量,A减轻3.6%,B增重6.6%,分析知溶解了A,B质量相同,则该金属的相对原子质量为()A 56B 65C 112D 1185.FeO,Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是() A 10% B 25% C 30% D 35%6.在化合物X2Y和YZ2中,Y的质量分数分别经为40%和50%,则在化合物X2YZ3中Y的质量分数约为()A 20%B 25%C 30%D 35%7.由NaHS,MgSO4,NaHSO4组成的混合物中,已知S元素的质量分数w(S)=a%,则O元素的质量分数w(O)为()A 1.75a%B 1-1.75a%C 1.25a%D 无法计算8.把20度时饱和NaNO3溶液150g加热到65度(假设不蒸发),需加入mgNaNO3才能达到饱和,则m为[已知:65度时,S(NaNO3)=130g, 20度时,S(NaNO3)=87.5g]A 20B 24C 30D 349.两种二价金属的混合物4.4g与足量稀硫酸反应产生0.16gH2,则这两种金属可能是()A Fe和MgB Cu和MgC Zn 和AlD Fe 和Zn10.12.4gFe2O3和CuO的混合物与足量CO充分反应后固体减少3.1g,则原混合物中Fe2O3和CuO的质量比是()A 1:1B 2:1C 3:1D 3:211.已知M和N两种物质的溶液混合后能发生反应,设M物质的式量为m,N物质的式量n,当M 和N按质量比m:n反应后,溶液的pH>7,如果M和N按质量比2m:n反应后,溶液的pH=7,则M,N 是下列物质中的( )A NaCl和Ba(OH)2B HCl 和NaOHC HCl和Ba(OH)2D NaOH和H2SO4A NaClB KCl CKClO3 D MgCl213.甲乙两位同学在室温下各取50g某溶液分别做制晶体实验,甲将溶液蒸发掉10g水后冷却至室温得晶体1.2g(晶体不含结晶水), 乙将溶液蒸发掉15g水后冷却至室温,得晶体2.4g,若两人实验结果都正确,则50g某溶液中溶质的质量分数为( )A 1.1%B 17.4%C 22.2%D 36.1%14.下列各组中两种物质的质量相等,分别与跑题的稀盐酸反应,生成二氧化碳气体的质量相等的是( )A Na2CO3和NaHCO3B NaHCO3和Mg CO3C Na2CO3和Mg CO3D CaCO3和KHCO315.有一包不纯CaCO3的样品,其中只含一种杂质.现取该样品5g与足量稀盐酸反应,生成2.3g二氧化碳,则所混杂质可能是( )A K2CO3B NaHCO3C Mg CO3D KHCO316.1.42gR元素柯与氧元素组成2.38g氧化物X,可组成3.66g氧化物Y,则X,Y的化学式可能是( )A R2O和R2O3B R2O3和R2O5C R2O3和R2O7D R2O和R2O317. 已知由Na2S Na2SO3和Na2SO4三种物质组成的混合物中,钠元素的质量分数为46%,则氧元素的质量分数为( )A 46%B 22%C 32%D 64%18.某气体是由SO2 N2 CO中的一种或几种组成,现测得该气体中氧元素的质量分数50%,则该气体的组成情况有(1)_____________(2)_______________(3)___________19.有规律称,强酸溶液每稀释10倍pH增加1,强碱溶液每稀释10倍pH减小1,但此规律有一定的局限性.试问将pH=3的H2SO4(溶液)稀释105倍,则其pH为( )A 8B 7C 2D 320.把70%HNO3(密度为1.40g/mL)加到等体积的水中,稀释后HNO3溶液中溶质的质量分数是( ) A等于0.35 B 小于0.35 C 大于0.35 D 小于等于0.3521.已知由CuS CuSO3CuSO4 组成的混合物中,硫元素的质量分数为x,则混合物中氧元素的质量分数是( )A 1-3xB 1-2xC 1-xD 无法计算22.取3.5g某二价金属的音质投入50g溶质质量分数为18.25%的稀盐酸中,反应结束后,金属仍有剩余;若2.5g该金属投入与上述相同质量,相同质量分数的稀盐酸中,等反应结束后,加入该金属还可以继续反应.则该金属的相对原子质量为( )A 24B 40C 56D 6523.由某物质R和Na2SO4组成的固体混合物放入足量水中,充分搅拌.过滤后得到白色沉淀11.65g,经试验该白色沉淀不溶于稀硝酸,滤液呈碱性.加入稀盐酸中和滤液,当加入146g 5%的盐酸时溶液恰好成中性.求混合物中R 的质量.. 奥专十实验探究1.在学习’NaOH的化学性质”后的一节实验课上,老师让同学们利用所学知识设计一个实验,通过观察到的实验现象,说明CO2与NaOH溶液发生了反应.同学们积极思考大胆创新,设计出多种方案.下图所示的是从中选出的四种方案各方案的操作方法如下,图A:取下玻璃塞,打开活塞,滴下少量NaOH浓溶液.图B:用适当的方法取下橡皮塞,晃动试管;图C:挤压胶头滴管,滴加少量NaOH浓溶液,振荡;图D:将注射器内NaOH溶液注入塑料瓶中A B C D(1)对于图A-D你认为能达到实验目的的装置是____________,并从中任选一种按要求填空.该装置的编号以及对应的实验现象是___________________________________________________(2)如何取下B装置中的橡皮塞?____________(只要求回答一种方法)对于B装置,有的同学心存疑虑,认为CO2可溶于水并能和水发生反应,而B中大量的NaOH溶液中既有NaOH又有H2O,怎么说明它是和NaOH发生反应的呢?请你告诉他,只要补充做个_________________实验,就可消除他的疑虑.2. A,B,C,D,E,五瓶无色透明溶液,分别是HCl溶液,Na2CO3溶液,MgCl2溶液NaNO3溶液,NaOH溶液中的一种.分别进行下列实验:①将A分别滴入B,C,D,E中,均没有明显现象②将B分别滴入A,C,D,E中,C,E中均产生白色沉淀,其余没有明显现象③将C分别A,B,D,E中,B中产生白色沉淀,D中有气泡,其余没有明显现象.(1)A是__________ B _____________ C _______________(2)B加入E的化学方程式___________________________________________(3)C加入D的化学方程式______________________________________3.小波用实验方法区别稀盐酸和硫酸钠溶液(记作A,B)(1)他向A,B两溶液中分别加入Na2CO3溶液,观察到A溶液中产生无色气体.则A是________,发生反应反化学方程式___________________________________(2)他向A,B两溶液中分别加入BaCl2溶液,B溶液中的现象是____________________(3)他还用了下列试剂中的一种区别A,B两溶液,这种试剂是____________①石蕊试剂②CuSO4溶液③醋酸溶液④KCl溶液4.下图中的A-K分别代表初中化学中的常见物质.已知:A,C两种物质组成元素相同,G溶液为某物质的稀溶液.G的浓溶液能使小木棍变黑.图中部分生成物未标出(1)写出J可能的化学式____________(任写一种)(2)写出下列反应的化学方程式A→C+D _________________________F+H→E+C _______________________________I+碱→K _______________________________任写一种)5.某化学小组的同学为验证蜡烛(主要成分是石蜡)的燃烧产物,并测定蜡烛中碳,氢两种元素的质量比,设计的实验装置如下(注:反应前全套装置中残留的空气及反应后A瓶内残留的燃烧产物均忽略不计,且各装置均能吸收完全)(1)(2)(3)实验步骤有:①称量②再称量③点燃蜡烛,并通往氧气(控制氧气流量)④停止通入氧气,使蜡烛熄灭⑤按图示连接仪器⑥将装置冷却至室温.则实验步骤的顺序是_____________________(4)可供选择的试剂有:稀硫酸,浓硫酸,盐酸,澄清石灰水,氢氧化钠溶液等.则装置C,D中所放的试剂依次为_________________,装置E的作用是____________________6.现有A-F六种常见物质,其中B是食品包装中常用的干燥剂,A,B,C 三种白色固体都含有同种金属元素,E是固体单质,D,E,F都含有同种非金属元素,它们的转化如图:(1)写出下列物质的化学式C______________ B_________________E__________(2)写出下列变化的化学方程式A→C___________________________________________F→D_________________________________________。
小学奥数教程之-溶液浓度问题

小学奥数教程之-溶液浓度问题在解决浓度问题时,需要明确溶液、溶质和溶剂三者之间的关系。
溶质通常指盐水中的“盐”、糖水中的“糖”或酒精溶液中的“酒精”等,而溶剂一般为水,有时也会出现煤油等。
溶液则是溶质和溶剂的混合液体,而浓度则是溶质质量与溶液质量的比值。
在运算上,可以利用浓度三角和十字交叉法来解决复杂的浓度问题。
解决浓度问题的一般方法是寻找溶液配比前后的不变量,然后建立等量关系列方程。
此外,十字交叉法和浓度三角也是解决浓度问题的有效方法。
在应用题中,列方程解题也是一种重要的方法。
比例是浓度问题的一个重要知识点,而浓度问题与我们的日常生活息息相关,包括小学所学的百分数和浓度问题中的基本量。
举例来说,当需要解决三种溶液混合多次的问题时,可以利用十字交叉法或浓度三角进行解题。
比如,有甲、乙、丙三个,容量为毫升。
甲有浓度为40%的盐水400毫升;乙中有清水400毫升;丙中有浓度为20%的盐水400毫升。
先把甲、丙两中的盐水各一半倒入乙搅匀后,再把乙中的盐水200毫升倒入甲,200毫升倒入丙。
这时甲、乙、丙中盐水的浓度各是多少?通过列出表格和运用浓度三角,可以得出甲、乙、丙中盐水的浓度分别为27.5%、15%和17.5%。
在这个问题中,甲、乙、丙三个中盐水的浓度分别为27.5%、15%和17.5%。
为了解决涉及浓度的应用问题,特别是在多次变化的情况下,常常使用表格的方法,以便清楚地了解溶质质量和溶液质量的变化以及它们之间的关系。
在这个问题中,甲、乙、丙三个中的酒精溶液中纯酒精的含量分别占48%、62.5%和。
已知三个中的酒精溶液总量为100千克,其中甲中的酒精溶液量等于乙、丙两个中酒精溶液的总量。
混合三个中的酒精溶液后,纯酒精的百分含量将达到56%。
那么,丙中纯酒精的量是多少千克?解法1:使用方程法。
设丙中酒精溶液的重量为x千克,则乙中的酒精溶液为50-x千克。
根据纯酒精的含量,可以列出方程式:50*48%+(50-x)*62.5%+x*100%=100*56%。
全国竞赛(9)第九单元溶液-2024-2025学年九年级化学人教版(2024)下册

竞赛(9)第九单元溶液一、选择题1.(2024九下·永兴竞赛)下列图像能正确反映其相应关系的有()①向氢氧化钠溶液中不断加水②向等质量、等质量分数稀盐酸中分别加入CuO、Cu(OH)2至过量③向一定质量稀硫酸中加入锌粒至过量④向氯化铜和盐酸混合溶液中滴加氢氧化钠溶液至过量A.1个B.2个C.3个D.4个二、填空题2.(2024九下·永兴竞赛)t℃时,分别向等质量的甲、乙、丙三种固体中不断加水,加入水的质量与溶质质量的关系如图所示,回答下列问题。
(1)t℃时,甲的溶解度为。
(2)A点对应的溶液是固体乙的(填“饱和”或“不饱和”)溶液。
(3)t℃时,三种固体物质的饱和溶液中质量分数最小的是:(填“甲”、“乙”或“丙”)。
(4)关于该图像,下列说法正确的是(填序号)。
①甲的热的饱和溶液降温,一定会析出固体②t℃时,甲、乙溶液的溶质质量分数一定不相等③t℃时,将10g丙物质加入25g水中,充分搅拌,所得溶液的质量一定小于35g④t℃时,等质量的甲、乙、丙的饱和溶液中,溶剂最多是丙3.(2023九下·蕉岭竞赛)溶液与人们的生产生活密切相关。
(1)将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是________(填字母)。
A.高锰酸钾B.汽油C.面粉D.白糖(2)在盛有水的烧杯中加入以下某种物质,形成溶液过程中,温度没有明显变化的是_____ (填字母)。
A.烧碱B.硝酸铵C.氯化钠D.浓硫酸(3)下图1为甲、乙两种固体物质的溶解度曲线。
①某同学按图2所示进行实验,得到相应温度下的A、B、C溶液,在A、B、C三种溶液中属于饱和溶液的是(填字母)。
向溶液C中再加入25g甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为(结果精确到0.1%)。
②将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数甲乙(填“<”、“=”或“>”)。
三、综合题4.(2023·吴江竞赛)阅读下列有关锂的分段材料,回答相关问题。
化学竞赛辅导课件--溶液

2.在100克水中加入2克氯化 钠和3克氯化钾,完全溶解 后,溶液的质量是———— 克,氯化钠溶质的质量分数
——————。
2/.粗盐中所含的杂质主要是MgCl2 。工业 上常把粗盐晶体粉碎后用饱和食盐水浸洗,
( D)
A. 104.2 g
B. 132.6 g
C. 76.8 g
D. 53.04 g
右图为Na2SO4的溶解度曲线,已知硫酸钠晶体
(Na2SO4·10H2O)在温度为T3 K 时开始分解
为无水硫酸钠。现有142g温度为T2 K的饱和硫
酸钠溶液,当温度降为T1 K或升为T4
K(T4>T3)时析出晶体的质量相等,则温度为
占3/5,乙份的质量占2/5。在 甲份中蒸发M克水或在乙份中 加M克溶质都会成为饱和溶液。 t℃时该物质的溶解度为 ( 150g)
3.将含A物质的溶液450克,蒸 发310克水后溶液恰好饱和, 若另取45克这种溶液加入16克 A,充分搅拌未完全溶解,再 加9克水也恰好饱和(发生以
上变化时溶液的温度均为 t℃),则A物质在t℃时的溶 解度 —40—克
(1) 7.5克胆矾溶于100克水中
(2) 5.1克氢氧化钙放入100克水中
(3) 50克8%氢氧化钠溶液加入50克水
(4) 配制20℃的高锰酸钾饱和溶液(20℃时 高锰酸钾溶解度为6.4克)
(A) (4)(2)(3)(1)
(B) (4)(1)(3)(2)
(C) (1)(4)(3)(2)
(B )
(D) (1)(4)(2)(3)
数的比较一定正确的是 A. 甲(状态2)>甲(状态1) B. 乙(状态1)>甲(状态3) C. 甲(状态1)=乙(状态2) D. 乙(状态3)>丙(状态3)
生物奥赛(竞赛)辅导材料专题第一章植物形态解

生物奥赛(竞赛)辅导材料专题第一章植物形态解剖二、例题解析例1 用简单的显微化学方法鉴定植物细胞中的贮藏物质时,滴加某试剂后,可观察到细胞内的淀粉遇其呈深蓝色反应,蛋白质遇其呈黄色反应,则该试剂是A 碘一碘钾溶液B 苏丹Ⅲ或Ⅳ溶液C 间苯三酚和盐酸溶液D 结晶紫溶液【分析】细胞内的贮藏物质主要有淀粉、蛋白质和脂肪。
用稀释的碘一碘化钾溶液与淀粉作用时,形成碘化淀粉,呈蓝色的特殊反应,所以常用碘一碘化钾溶液鉴定淀粉。
糊粉粒是植物细胞中贮藏蛋白质的主要形式,当碘一碘化钾溶液与细胞中的蛋白质作用时,呈黄色反应,因此鉴定蛋白质常用的方法也是用碘一碘化钾溶液,但浓度较大效果才好。
常用的鉴定脂肪或油滴的方法是将苏丹Ⅲ或Ⅳ的酒精溶液对其染色,呈橘红色,在鉴定过程中稍加热,可使效果更为明显。
用间苯三酚和盐酸溶液,可以鉴定细胞壁中的木质素成分,先将材料用盐酸浸透,再加间苯三酸的酒精溶液,当间苯三酚与细胞壁中的木质素相遇时,即发生樱红色或紫红色的反应。
结晶紫是用于对细菌进行革兰氏染色的常用染色剂。
【参考答案】A。
例2 水稻和小麦等禾本科植物拔节、抽穗时,茎迅速长高,这是借助下列哪种组织的活动?A 顶端分生组织B 侧生分生组织C 居间分生组织D 次生分生组织【分析】顶端分生组织位于茎和根的主轴和侧枝的顶端。
侧生分生组织主要存在于裸子植物和木本双子叶植物中。
居间分生组织是夹在多少已经分化了的组织区域之间的分生组织,它是顶端分生组织在某些器官中局部区域的保留。
典型的居间分生组织存在于许多单子叶植物的茎和叶中,如水稻、小麦等禾谷类作物,在茎的节间基部仍保留居间分生组织,当顶端分化成幼穗后,还能借助于居间分生组织的活动,进行拔节和抽穗,使茎急剧长高。
次生分生组织是由成熟组织的细胞经过反分化后,重新转变而成的分生组织。
【参考答案】C。
例3 大豆、油菜、蓖麻等植物的种子,在萌发形成幼苗时,子叶出土的原因是A 胚芽伸长B 胚根伸长C 上胚轴伸长D 下胚轴伸长【分析】由子叶着生点到第一片真叶之间的一段胚轴,称为上胚轴;由子叶着生点到胚根的一段称为下胚轴。
高中化学奥林匹克竞赛辅导讲座:第2讲《溶液》
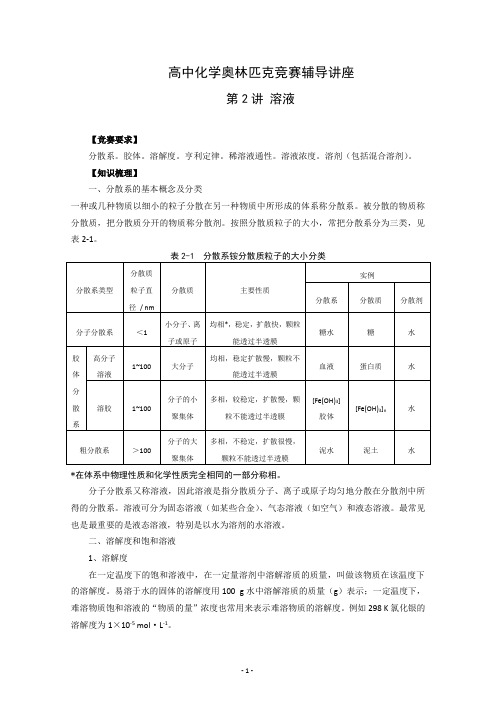
高中化学奥林匹克竞赛辅导讲座第2讲溶液【竞赛要求】分散系。
胶体。
溶解度。
亨利定律。
稀溶液通性。
溶液浓度。
溶剂(包括混合溶剂)。
【知识梳理】一、分散系的基本概念及分类一种或几种物质以细小的粒子分散在另一种物质中所形成的体系称分散系。
被分散的物质称分散质,把分散质分开的物质称分散剂。
按照分散质粒子的大小,常把分散系分为三类,见表2-1。
*在体系中物理性质和化学性质完全相同的一部分称相。
分子分散系又称溶液,因此溶液是指分散质分子、离子或原子均匀地分散在分散剂中所得的分散系。
溶液可分为固态溶液(如某些合金)、气态溶液(如空气)和液态溶液。
最常见也是最重要的是液态溶液,特别是以水为溶剂的水溶液。
二、溶解度和饱和溶液1、溶解度在一定温度下的饱和溶液中,在一定量溶剂中溶解溶质的质量,叫做该物质在该温度下的溶解度。
易溶于水的固体的溶解度用100 g水中溶解溶质的质量(g)表示;一定温度下,难溶物质饱和溶液的“物质的量”浓度也常用来表示难溶物质的溶解度。
例如298 K氯化银的溶解度为1×10-5 mol·L-1。
2、饱和溶液在一定温度下,未溶解的溶质跟已溶解的溶质达到溶解平衡状态时的溶液称为饱和溶液。
在饱和溶液中,存在着下列量的关系:溶质的质量= 常数溶液的质量溶质的质量= 常数溶剂的质量3、溶解度与温度溶解平衡是一个动态平衡,其平衡移动的方向服从勒沙特列原理。
一个已经饱和的溶液,如果它的继续溶解过程是吸热的,升高温度时溶解度增大;如果它的继续溶解过程是放热的,升高温度时溶解度减小。
大多数固体物质的溶解度随温度的升高而增大。
气体物质的溶解度随着温度的升高而减小。
4、溶解度与压强固体或液体溶质的溶解度受压力的影响很小。
气体溶质的溶解度受压力影响很大。
对于溶解度很小,又不与水发生化学反应的气体,“在温度不变时,气体的溶解度和它的分压在一定范围内成正比”,这个定律叫亨利(Henry)定律。
其数学表达式是:C g = K g·p g (2-1)式中p g为液面上该气体的分压,C g为某气体在液体中的溶解度(其单位可用g·L-1、L(气)·L1 (水)、mol·L-1表示),K g称为亨利常数。
【奥赛】小学数学竞赛:溶液浓度问题(一).学生版解题技巧 培优 易错 难

【例 3】甲种酒精溶液中有酒精 千克,水 千克;乙种酒精溶液中有酒精 千克,水 千克;要配制成 的酒精溶液 千克,问两种酒精溶液各需多少千克?
【例 4】将75%的酒精溶液32克稀释成浓度为40%的稀酒精,需加入水多少克?
【巩固】浓度为10%,重量为80克的糖水中,加入多少克水就能得到浓度为8%的糖水?
【巩固】现有浓度为10%的盐水8千克,要得到浓度为20%的盐水,用什么方法可以得到,具体如何操作?
【例 2】有浓度为20%的盐水300克,要配制成40%的盐水,需加入浓度为70%的盐水多少克?
【巩固】现有浓度为10%的盐水20千克,在该溶液中再加入多少千克浓度为30%的盐水,可以得到浓度为22%的盐水?
【例 12】甲容器中有纯酒精11升,乙容器中有水15升,第一次将甲容器中的一部分纯酒精倒入乙容器,使酒精与水混合。第二次将乙容器中的混合液倒入甲容器。这样甲容器中纯酒精含量为62.5%,乙容器中纯酒精的含量为40%。那么第二次从乙容器中倒入甲容器的混合液是多少升?
【巩固】甲杯中有纯酒精 克,乙杯中有水 克,第一次将甲杯中的部分纯酒精倒入乙杯,使酒精与水混合.第二次将乙杯中的部分混合溶液倒入甲杯,这样甲杯中纯酒精含量为 ,乙杯中纯酒精含量为 .问第二次从乙杯倒入甲杯的混合溶液是多少克?
【例 5】浓度为20%的糖水40克,要把它变成浓度为40%的糖水,需加多少克糖?.
【例 6】A、B两杯食盐水各有40克,浓度比是3:2.在B中加入60克水,然后倒入A中________克.再在A、B中加入水,使它们均为100克,这时浓度比为7:3.
【例 7】买来蘑菇10千克,含水量为99%,晾晒一会儿后,含水量为98%,问蒸发掉多少水份?
高一化学竞赛辅导练习二

高一化学竞赛辅导练习二一、选择题:1.下列关于溶液的说法中,正确的是A .凡是均一、稳定的液体,就是溶液B .长期放置后不会分层的液体,就是溶液C .一种物质里分散着另一种物质的液体是溶液D .溶液一定是均一、稳定的混合物2.自然界中存在一种尖晶石,化学式为MgAl O 24,它透明色美,可作为宝石。
已知该尖晶石中混有Fe O 23。
取一定量样品5.4g ,恰好与一定浓度100mL 盐酸反应,盐酸浓度可能是 ( )A. 4.9 mol/LB. 4.3 mol/LC. 2.8 mol/LD. 1.2 mol/L3.在强酸性溶液中能大量共存的无色透明离子组是A .K +、Na +、NO 3-、MnO 4-B .Mg 2+、Na +、Cl -、SO 42-C .K +、Na +、Br -、Cu 2+D .Na +、Ba 2+、OH -、SO 42-4.某同学在家中进行化学实验,按照图1连接好线路发现灯泡亮,由此得出的结论正确的是A .NaCl 是非电解质B .NaCl 溶液是电解质C .NaCl 在水中电离出可以自由移动的离子D .NaCl 溶液中水电离出大量的离子5.下列关于Na 2O 2的说法中,不正确的是A .Na 2O 2可用于呼吸面具中的氧气来源B .Na 2O 2与水反应生成NaOH ,因而是碱性氧化物C . Na 2O 2与水反应时,有热量放出D .Na 2O 2与H 2O 反应的离子方程式为:2Na 2O 2 + 2H 2O = 4Na + + 4OH - + O 2↑6.多硫化钠Na 2S x (x >2)在结构上与Na 2O 2、FeS 2、CaC 2等有相似之处。
Na 2S x 在碱性溶液中可被NaClO 氧化为Na 2SO 4,而NaClO 被还原为NaCl ,反应中Na 2S x 与NaClO 的物质的量之比为1︰16,则x 的值是 ( )A .5 B. 4 C. 3 D. 27.下列说法错误的是 (图1) (图2)A.SiO2是难溶于水的酸性氧化物B.高温下SiO2与碳酸盐反应生成CO2C.SiO2不能与任何酸反应D.碳化硅(SiC)具有金刚石的结构,硬度很大8.用如图所示装置制取表中的四种干燥、纯净的气体(图中加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
初中化学奥赛辅导材料(7)

初中化学奥赛辅导材料(7)1.下列液体是溶液的是( )A.蒸馏水B.稀硫酸 C.碘酒D.石灰浆2.下列关于溶液的叙述不正确的是()A.凡是均一、稳定的液体都是溶液B.溶液均一、稳定,未必无色C.向10g5%的NaCl溶液中加入1L5%的NaCl溶液,混合后的溶液的溶质质量分数仍为5%D.如果温度不变,水不蒸发,食盐溶液久置不会分离出食盐晶体3.把100g10%KNO3溶液的溶质的质量分数增加到20%,可以采用的方法是( ) A.蒸发掉45g 水 B.蒸发掉50g水C.加入10g KNO3 D.加入15g KNO3固体4.有3g 白色粉末,溶于10g 热水中冷至室温析出2g 晶体,将析出的2g 晶体再溶于10g 热水中,冷至室温则析出1.5g晶体。
可知此白色粉末是( )A.纯净物B.混合物 C.化合物D.不能确定5.要从氯酸钾和二氧化锰混合物加热制取氧气后的残留固体中回收二氧化锰,有以下几步操作可供选择:①蒸发溶液;②过滤;③溶解;④水洗;⑤烘干。
正确的操作顺序是( ) A.③②④① B.③②⑤④ C.③②④⑤ D.③②①④6.在t℃时,浓度相同的两份KNO3溶液A和B,A为100g,B为80g,将其各自恒温蒸发掉20g水后,A刚好饱和,对所得的B溶液正确的说法是............. ( )A.也刚好饱和B.仍为不饱和溶液C.是饱和溶液并有晶体析出D.有晶体析出但溶液仍为不饱和溶液7.已知硫酸的浓度越大,密度就越大,现将等体积90%和10%的硫酸溶液混合,所得溶液的溶质质量分数为A. >50% B. = 50% C.< 50% D.不能确定8.向某一饱和硫酸铜溶液中,加入含18O的带标志的无水硫酸铜粉末ag,如果保持温度不变,其结果是( B )A.无水硫酸铜不再溶解,ag粉末不变B.溶液可找到带标志的SO42―,而且白色粉末变为蓝色晶体,其质量大于agC.溶液可找到带标志的SO42―,而且白色粉末变为蓝色晶体,其质量小于agD.溶液找不到带标志的SO42―,但白色粉末变为蓝色晶体,其质量大于ag9.20℃时,把一定质量的硝酸钾饱和溶液分成两等份,一份加热蒸发掉10g水,另一份加热蒸发掉20g 水,都恢复到20℃,分别析出ag和bg硝酸钾晶体。
溶液竞赛辅导

溶液知识网络一、溶液1、“饱和溶液与不饱和溶液”、“浓溶液与稀溶液”是两种不同的分类方法,是两组不同的概念。
浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液;当然,在一定的温度下,同种溶质在同种溶剂中形成的饱和溶液一定比其它不饱和溶液浓。
2、在一定温度下,判断某溶液是否饱和的方法是:放入少量的溶质,如果溶质不再溶解,则该溶液是饱和溶液;如果还能溶解,则该溶液是不饱和溶液。
二、固体物质的溶解度1、固体物质的溶解度:三个条件(一定温度、100克溶剂、达到饱和状态),一个结论(溶质的克数),单位是克。
2、溶解性和溶解度是两个不同的概念。
溶解性是指物质在某种溶剂中溶解能力的大小,常用易溶、可溶、微溶和难溶(不溶)粗略表示,是物质的一种物理性质。
而溶解度是从定量的角度来表示物质溶解性的大小,两者的关系为:难溶 微溶 可溶 易溶20℃溶解度 0.01g 1g 10g3、影响固体溶解度大小的因素:内因是溶质、溶剂本身的性质;外因是外界温度。
大多数物质的溶解度随温度的升高而增大(如硝酸钾)温度对溶解度的影响情况 少数物质的溶解度受温度的影响较小(如氯化钠)极少数物质的溶解度随温度的升高而减少(如氢氧化钙) 4、溶解度的表示方法 (1)溶解度列表法;(2)溶解度曲线:横坐标表示温度,纵坐标表示溶解度。
5、溶解度曲线所代表的意义线— 表示物质在不同温度下的溶解度或溶解度随温度改变而变化的情况。
,(并有晶体未溶)。
三、结晶与结晶水合物1、结晶:固体物质从溶液中以晶体的形式析出的过程。
结晶的方法:(1)蒸发溶剂法,主要适用于溶解度受温度影响不大的固体物质,如从海水中晒制食盐;(2)冷却热饱和溶液,主要适用于溶解度受温度影响相当大的固体物质,如硝酸钾和食盐混合物的分离。
2、结晶水合物有固定的组成,属于化合物。
硫酸铜晶体(胆矾、蓝矾)受热易分解:CuSO4 ·5H2O△CuSO4 +5H2OCuSO4 +5H2O === CuSO4 ·5H2O(白色无水硫酸铜遇水变蓝色,常用于检验酒精中是否含有水以及用作干燥剂)碳酸钠晶体(Na2CO3·10H2O)在干燥空气中容易风化。
资料:竞赛专题辅导5:溶液的基本知识

竞赛专题辅导五:溶液的基本知识【内容综述】本期主要讲解有关溶液的基本知识。
溶液知识是初中化学的一个重点和难点知识,其主要重、难点知识要点包括:(1)饱和溶液和不饱和溶液的相互转化(2)溶解度的概念及其计算(3)过滤和结晶知识的理解和应用(4)溶液组成的表示方法及其应用。
在一些大型考试和竞赛题库中,关于溶液知识的题库往往使众多考生感到困惑和较为棘手。
为此,本期主要从关于溶液知识的重难点知识进行分析,希望能给大家一些帮助。
【要点讲解】一、灵活应用溶解度概念知识解题【例1】在t1℃时,20克水中最多能溶解15克X,t2℃时50克水中最多能溶解30克Y 物质。
则X和Y两种物质的溶解度的关系是()A.X>Y B.X<Y C.X==Y D.无法确定【解析】依题意知:本题对溶解度的概念进行了另一种较为抽象的理解,即在一定量的溶剂中最多溶解某物质的质量,说明该溶液已经达到饱和.按照溶解度的定义计算:X物质的溶解度应为:15克/20克×100克==75克;Y物质的溶解度应为:30克/50克×100克==60克.值得注意的是如果本题不对溶解度的定义进行深层次的理解,容易误选A选项.由于X和Y两物质所对应的温度不相同,故溶解度是无法进行比较的.故本题的答案为:D.【例2】某温度下,将A物质(不含结晶水)的水溶液分成等质量的2份。
向第一份加入9克A物质,充分搅拌,还有1克固体不能溶解;将第二份溶液蒸发掉40克水,并恢复到原温度,溶液恰好饱和(无A析出),则A物质在该温度下的溶解度是()A.40克B.20克C.8克D.无法计算【解析】由题意分析可知:本题含有两个隐含条件:(1)分成两等份的溶液中蒸发掉40克水都恰好能形成饱和溶液(2)蒸发掉40克水恰好能溶解9-1==8克A物质。
因此原题意可以转化为:某温度下,8克A物质(不含结晶水)溶解在40克水中恰好形成饱和溶液,试求A物质在该温度下的溶解度。
人教版高中化学竞赛溶液课件共张

m1
K
V
m0 m1
m 1V m 0 m 1 V
V
即:
m1
m
0
KV KV V
m
2
m
KV
0 KV V
2
mn
m
0
Байду номын сангаас
KV KV V
n
例:9-5
2022/5/6
16
§9-2 非电解质稀溶液的依数性
一、蒸气压下降─拉乌尔定律 •Fe(OH)3 (3)1.58×10-7 (4)4Co(OH)2+O2 2Co2O3+4H2O Co3O4 Na4CoO3
溶 解 度 g()/ 1 0 0 g水
60
50 KNO3 40 30
N a 2S O 4
20 10 0
273
N a 2S O 4· 1 0 H 2O C e 2( S O 4) 3
293 313 333 353 373
溶解度曲线
NaCI
T/K
2022/5/6
11
(2)压强的影响─亨利定律
在中等压强时,气体的溶解度与溶液上面气 相中该气体的分压成正比。Ci=KPi
•可知n(NOSO4H)=0.004 mol× =0.01 mol,所以样品的纯度为
溶剂中的溶解度大;具有与气体 •4.B 连接N的电极上H+得电子产生H2,则为阴极,N为电源的负极,M为电源的正极。A项正确;电解过程中,阳极上Co2+失电子产生
Co3+,Co3+与甲醇反应产生Co2+,Co2+可循环使用,不需要向溶液中补充Co2+,B项错误;CH3OH在溶液中被Co3+氧化生成CO2,发生反
高中化学奥赛

丹凤中学2014届高一化学奥赛辅导资料高中化学奥林匹克竞赛辅导讲座第1讲化学实验基础【竞赛要求】溶液配制(按浓度的精确度选择仪器)。
重结晶及溶质、溶剂相对量的估算。
过滤与洗涤(洗涤液选择、洗涤方式选择)【知识梳理】一、常用仪器及其使用方法1、反应容器(1)直接加热的仪器①试管适用于试剂用量极少的反应,也可用于溶解、气体的制取、净化和收集。
试管可分为:普通试管和耐高温的硬质试管;一般试管和具支试管……等。
试管必须用试管夹夹持或固定在铁架台的铁夹上加热。
开始加热时,应注意受热均匀。
②蒸发皿适用于蒸发和浓缩溶液,也可用于干炒固体物质。
蒸发皿可直接加热也可放在石棉网上加热。
用坩埚钳移动,在石棉网上冷却。
③坩埚适用于灼热或熔融固体物质。
坩埚可分为:瓷质坩埚、铁坩埚和石英坩埚。
使用时应放在泥三角上直接加热。
坩埚温度较高时,应用预热的坩埚钳夹持移动,放置石棉网上自然冷却。
④燃烧匙适用于点燃的固体和气体反应。
⑤燃烧管适用于高温下的固体和气体反应。
(2)垫石棉网加热的仪器①烧杯适用于试剂用量较多的反应,也可用于溶解、结晶和配制溶液。
在蒸发或结晶时,烧杯的上方应放置一个表面皿,防止液体飞溅或落入灰尘。
②烧瓶适用于加热条件下、试剂用量较多、由液态物质参加的反应,也可用于蒸馏和气体发生装置。
烧瓶可分为:圆底烧瓶、平底烧瓶、蒸馏烧瓶、两口烧瓶……等。
③锥形瓶适用于滴定反应。
(3)不加热的仪器启普发生器适用于不需加热的固、液制备气体的反应。
粉末状固体(或生成粉末状固体)不能用启普发生器。
2、称量仪器(1)量筒一种粗量量器,适用于量取精确度要求不高的一定体积的液体,可根据需要选用不同容量的量筒,避免操作次数过多造成误差太大。
量取液体时,使视线与量筒内液体的弯月面的最低处保持水平。
量筒不能加热或用于稀释溶液。
(2)移液管和吸量管移液管一般用于准确量取一定体积的液体。
移液管是中间有一膨大部分(称为球部)的玻璃管。
吸量管上带有分刻度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液的沸点升高
溶液沸点升高的根本原因是溶液的蒸气压下降
含难挥发溶质的溶液的沸点比纯溶剂的沸点高 Tb = Tb (溶液沸点)- Tb0 (溶剂沸点)
△T = Kb· bB
Kb — 摩尔沸点升高常数,K· kg· mol-1,只 与溶剂的本性有关 难挥发非电解质稀溶液的沸点升高Tb和溶液 的质量摩尔浓度成正比,而与溶质的本性无关。
1000 / M
式中K = p · M/1000,M 是溶剂的摩尔质量。
Examples
293K 时水的饱和蒸气压为 2.38kPa, 将 6.840g 蔗糖溶于 100.0g水中,求蔗糖溶液的质量摩尔浓度和蒸气压。 解: 蔗糖的摩尔质量为342.0g· mol-1,质量摩尔浓度 为 6.840g 1 bB 0.1kg 0.200mol kg 342.0g mol 1 水的摩尔分数为
水
粗分散系 (浊液)
>100
泥水
泥土
水
*在体系中物理性质和化学性质完全相同的一部分称相。
二、溶液组分含量的表示方法
1、物质的量浓度 c = n B = mB
V
M BV
2、质量物质的量浓度又叫“质量摩尔浓度” 用1kg溶剂A中所含溶质B的物质的量表示的浓度称为质量摩 尔浓度,用bB 表示,单位为mol· kg-1,即:
溶剂透过半透膜进入溶液的趋向取决于溶液浓度
的大小,溶液浓度大,渗透趋向大。
h
由此产生的净压力称为渗透压,以符号∏表示。
π
反渗透现象:
若额外施加的压力大于 ∏ ,
溶液 溶剂 B
则溶液中的溶剂将向纯溶剂方向渗
透。用于从海水中快速提取淡水和 废水治理中除去有毒有害物质。
溶液的渗透压, ∏ : 为了阻止纯溶剂向溶液方向渗透,必须 在溶液一方额外施加一个适当的压力。
分散系
分散质
分散 剂 水
小分子、 均相*,稳定,扩散快, 离子或原 颗粒能透过半透膜 子 大分子 均相,稳定扩散慢,颗 粒不能透过半透膜
糖水
糖
胶体
1~100
血液
蛋白质
水
分散 系
液
溶胶 1~100
分子的小 多相,较稳定,扩散慢, [Fe(OH)3] [Fe(OH)3]n 聚集体 颗粒不能透过半透膜 胶体 分子的大 聚集体 多相,不稳定,扩散很 慢,颗粒不能透过半透 膜
(1)液体的沸点,boiling-point, Tb 液体的蒸气压随温度升高而升高,当蒸气压与外界 大气压相等时,液体开始沸腾(表面和内部同时气化的
现象)。
液体的沸点指其蒸气压与外界大气压相同时的温度。
液体的正常沸点是指外压为101.3kPa时的沸点。
(2)溶液的沸点升高 (Tb)
1 2 纯水 水溶 的液 蒸的 气蒸 压气 曲压 线曲 线
压等。
(一) 、溶液的蒸气压下降——拉乌尔定律
Vapor phase
蒸发
凝结(液化)
liquid
H2O( l ) H2O( g )
1) 饱和蒸气压
蒸发; 凝聚; 饱和蒸气:水的蒸发与凝聚达到动态平衡时恒定浓度 的水蒸气;
饱和蒸气压p:该温度下液体的饱和蒸气的压力, Pa or kPa,简称蒸气压; 每种固体或液体,温度一定,饱和蒸气压是定值;
-------蔗糖分子
(a) 纯 水(p0)
(b) 蔗糖溶液(p)
溶液蒸气压下降与浓度之间的定量关系 拉乌尔定律,Raoult law (F.M. Raoult, 1887,France) p = p0xA p0——某温度时纯溶剂的蒸气压 p——同温度下稀溶液上面溶剂的蒸气压,即溶 液的蒸气压 xA——溶液中溶剂的摩尔分数。
活学活用--海洋盐差发电
1. 原理:利用不同浓度的海水在半 透膜下产生渗透压
2. 海水的平均盐度为3.5% ,每条 江河入海处的海水渗透压可以相当于2 40米高的水位落差。
3. 位于亚洲西部的死海,渗透压可以达 到上百个大气压 ,流入死海的约旦河, 每注入死海1立方米河水,理论上的发电 功率就可以达到2.7万千瓦。 4. 以色列洛布,他设计出压力延滞渗透能转换装置,效果满意。 5. 美国俄勒冈大学研制出一种新型的渗透压式盐差能发电系统。 6. 全世界海洋内储藏的盐差能总输出功率可以达到35亿千瓦。
10.0 103 8.314 276.15 1 MB 66 . 7 ( kg mol ) 3 344.3 10 1
M B 66.7kg mol 6.67 10 g mol
1 4
1
渗透压力在医学上的意义
1. 测定蛋白质等高分子化合物的相对分子质量。 2. 配制等渗、高渗和低渗溶液 医学上以血浆的渗透压力为标准: 渗透浓度 < 280 mmol·L-1------低渗溶液 渗透浓度=280-320 mmol/L---等渗溶液 渗透浓度 > 320 mmol·L-1-----高渗溶液
第2讲 溶液
竞赛要求:
分散系、胶体、溶解度、
亨利定律、稀溶液通性、
溶液浓度、 溶剂(包括混合溶剂)。
第一节 溶液
一、分散系的基本概念及分类 二、溶液组分含量的表示方法 三、 稀溶液的依数性 四、分配定律
一、分散系的基本概念及分类
分散系: 一种或几种物质以细小的粒子分散在另一 种物质中所形成的体系称分散系。
固体也可以蒸发,但蒸气压很小。
饱和蒸气压的性质
a. 与液体的本质有关; b. 与液体的量以及液面上空的体积无关 ; c. 相同温度下,若液体分子间的引力强,液体分子 难以逸出液面,p低;反之p就高; d. 同一液体,T高,p大;T低,p小。
2)溶液的蒸气压下降
稀溶液蒸气压下降的实验
注:
-----水分子;
• 产生渗透现象的必要条件:① 半透膜; ② 膜两侧单位体积内溶剂分子数不相等。 • 渗透特点:稀溶液→ 浓溶液 溶剂分子 迁移,缩小浓度差 • 渗透产生原因:溶液的蒸气压下降,即 纯溶剂蒸气压高,存在净转移趋势。
(2)Vant’t Hoff定律
非电解质稀溶液的渗透压与温度、浓度的关 系,与理想气体定律完全符合。 ——范特霍甫(Vant’t Hoff,荷兰,1886)
分散质: 被分散的物质称分散质,
分散剂: 把分散质分开的物质称分散剂。
按分散质和分散剂的状态不同把分散系分为九 种。 按照分散质粒子的大小,常把分散系分为三类。
表3-1
分散系铵分散质粒子的大小分类
实例 分散质 主要性质
分散质 分散系类型 粒子直 径 / nm 分子分散系 (溶液) 高分 子溶 <1
三、 稀溶液的依数性
与溶质本性有关:
溶液的性质
酸碱性、颜色、体积等 与溶液浓度有关:
蒸气压、沸点、凝固点、渗透压等
本节内容只和非电解质的稀溶液的性质有关。
当溶液非常稀时,1L溶液≈1Kg,此时,
认为c ≈ bB。
三、 稀溶液的依数性
稀溶液的依数性: 溶液的性质中只与溶质的浓度有关,而与溶 质的本性无关的那些性质称为稀溶液的依数性。 依数性包括: 蒸气压下降、沸点升高、凝固点下降及渗透
bB =
nB = mA
mB M B mA
二、溶液组分含量的表示方法
3. 摩尔分数 某物质的物质的量分数的简称。
nB xB (无单位) i ni
4. 质量分数 溶质B的质量(mB)与溶液质量(m)之比。
mB B (无单位) m
三、 稀溶液的依数性
煮沸的鸡汤很烫? 冰镇可乐很爽? 施肥过多会使作物枯萎? 海鱼不能生活在淡水中 ?
1901,第一个诺贝尔化学奖 ΠV=nRT Π=cRT
Π — 溶液的渗透压, kPa;
V — 溶液的体积, L; n — 溶质的物质的量,mol; R — 摩尔气体常数, 8.314 J ·mol-1 ·K-1 T — 温度,K; C — 溶液的物质的量的浓度,mol积和温度下,非电解质稀溶液
将数据带入,得
1000 0.52 1.09 MB 182 g mol 1 20.0 0.156
在医药中的应用: i. 减压蒸馏:降低蒸发温度,避免破坏;
ii. 热压灭菌:适用于热稳定性好的药品,提
高水蒸气温度,缩短灭菌时间。
iii. ……
(三)、溶液的凝固点下降
1. 液体的凝固点,freezing-point,Tf 在凝固点,固体和液体平衡共存,两相的蒸气 压相等。 溶液的凝固点是溶液中水的蒸气压与冰的蒸气
100 g 18.02 g· mol 5.549 mol -1 = 0.9964 = xA= 100 g (5.549 + 0.0200) mol + 0.0200 mol 18.02 g· mol -1
蒸气压为:p = p0· xA = 2.338 kPa × 0.9964 = 2.330kPa
(二)、溶液的沸点升高
纯 水
在纯水中加入少许蔗糖
渗透现象: 通过半透膜发生的表面上单方向扩散的现象。水 分子会穿过半透膜从水多的一方渗透到水少的一方。 糖水 半透膜
葡萄糖分子
水分子
v右
v左
v左 > v右
H2O水分子 蔗糖分子
由渗透产生一定的静压力,促使水分子向两边
渗透的速率趋于相等,最终溶液与纯溶剂的液面差
达到一定高度,不再改变。
1000K f mB MB mA Tf
1.86 K·kg·mol-1× 0.638g M(CON2H4) = = 0.060 kg·mol-1 = 60 g·mol-1 250g × 0.079K
(四)、溶液的渗透压,osmotic pressure 1 渗透现象与渗透压 扩散现象: 纯溶剂和溶液或不同浓度的溶液互相接 触,一段时间后,由于分子的运动会成为均 匀浓度的溶液。
