第四章 缩合反应(简单版)
第四章 缩合反应 总结

药物合成基础
第四章 缩合反应
总结
主要涉及多种类型的缩合反应, 第四章 主要涉及多种类型的缩合反应,要求掌握如 下内容: 下内容:
1. 了解什么是缩合反应? 了解什么是缩合反应? 2 . 掌握α-羟烷基化、卤烷基化、氨烷基化反应 掌握α 羟烷基化、卤烷基化、氨烷基化反应 反应; 〔1〕重点掌握醛醇缩合及其机理、实例;Prins反应; 〕重点掌握醛醇缩合及其机理、实例; 反应 Reformatsky反应;Blanc反应;Mannich反应;及其相应 反应; 反应; 反应; 反应 反应 反应 的实例。 试剂、 试剂和Normat试 的实例。 Reformatsky试剂、Grignard试剂和 试剂 试剂和 试 剂有何区别? 剂有何区别? 〔2〕知道 〕知道Strecker反应的应用 反应的应用 3 . 掌握β-羟烷基化、 β-碳基羟烷基化反应 掌握β 羟烷基化、 碳基羟烷基化反应 〔1〕重点掌握 〕重点掌握Michael反应及相应的实例 反应及相应的实例 〔2〕知道环氧化合物的反应及有机金属化合物与不饱和 〕 醛酮的加成反应
4 .掌握亚甲基化反应 掌握亚甲基化 掌握亚甲基 〔1〕重点掌握 〕重点掌握Wittig及Horner反应及相应的实例 及 反应及相应的实例 反应、 反应、 〔2〕知道 〕知道Knoevenagel反应、Stobbe反应、 反应 反应 Perkin反应、Erlenmeyer-Plochl反应及有机金属 反应、 反应 反应及有机金属 化合物的亚甲基化 5 .掌握 掌握Darzens缩合反应及实例 掌握 缩合反应及实例 6 .掌握环加成反应 掌握环加成反应 重点掌握diels-alder反应的应用及碳烯和氮烯的加 反应的应用及碳烯和氮烯的加 重点掌握 成
第四章 缩合反应

4
1.自身羟醛缩合
两分子相同的醛或酮在碱的催化下,相互缩合生 成β-羟基醛(酮),或进一步脱水生成α,β-不饱和 醛(酮)。
R
CH2
O
O
O
C
RH(RC'H) 2+
C
R
H(R')
CH2
+R
C
HC(RH'2)
O OCH- Ho(rR. ')H+ OH- or. H+
OO
((动动(动力力力学学学控控控制制制)))
(((热热热力力力学学学控控控制制制)))
OOO
12
(2)羟甲基化反应--Tollens缩合
在碱催化下,甲醛与含α-氢的醛、酮进行交叉羟 醛缩合,在醛、酮的α-碳原子上引入羟甲基,其 产物是β-羟基醛酮或α,β-不饱和醛酮。
HHHCCCHHHOOO +++ CCCHHH333CCCOOOCCCHHH333
2
O O
(65%) (65%)
8
2.A-B型羟醛缩合
(1)Claisen-Schimidt缩合
无α-H的芳醛与含有α-H的醛、酮,在碱或酸的催化 下,脱水缩合成α,β-不饱和醛(酮)的反应。
OO
ArACrHCOHO++RRCCHH2C2C HH((RR')') OOHH--
RR
AArr
HH(R(R')')
一、α-羟烷基化反应 羟醛缩合反应: 含有α-氢的醛或酮,在酸或碱的催化下发生自身 缩合,或与另一分子的醛或酮发生缩合,生成β羟基醛(酮),或进一步脱水生成α,β-不饱和醛 (酮)的反应。
第四章:缩合反应(2,3节)-1
H3CO
CH2CH2COOC2H5
H3CO
2. Perkin 反应
芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合, 芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成 芳基丙烯酸类化合物的反应。 β-芳基丙烯酸类化合物的反应。
O H3C C6H5CHO + H3C C O C O CH3COO C6H5 H C H COOH
O R C O R C C R2 R2 O R C R1 C R2 H2 C C X + BH R O C R1 C R2 H2 C X CH + B CH R2 R1 + C C X R O C O R1 + B R C C R2 R1 C H2 C C X R1 + BH
供电体: 供电体的酸度越大, Michael 供电体: 供电体的酸度越大,越容易 形成碳负离子,活性越大。 形成碳负离子,活性越大。 受电体: Michael 受电体: α,β-不饱和键上所连接的官 能团的吸电子能力越强, 能团的吸电子能力越强,使β-碳原子的电子云密度 降低的越多,其活性亦越大。 降低的越多,其活性亦越大。
R3 C R4 O
+
R1 (C6H5)3P C R2
R3 C R4 C
R1
+ (C6H 5)3P
O
R2
R1 R1 (C6H5)3P C R2
+
R1 (C6H5) 3P C R2 R4 R3
R3 C R4 O
(C6H5) 3P O
C
R2 R4
CR2 C
+ (C6H5)3P
O
R4
R3
硫和磷与碳结合时,碳带负电荷,硫或磷带正电荷彼此相邻,这种结构的化 合物称为Ylide(叶立德)。由磷形成的Ylide称为磷Ylide,又称为Wittig试剂, 其结构可表示如下:
缩合反应

6 缩合反应缩合反应一般指两个或多个有机化合物分子形成较大的分子的反应,此外缩合反应也可以发生在分子内。
缩合过程常伴有小分子消除。
通过缩合反应可以形成碳碳键、碳杂键,进而达到增碳、引入官能团以及成环等目的,在药物合成中占有重要地位。
本章内容主要为含活泼氢化合物(醛、酮和酯)之间的缩合反应。
6.1alpha-羟烷化、alpha-卤烷化和alpha-氨(胺)烷化反应指在底物分子的某位置引入alpha-羟烷基、alpha-卤烷基和alpha-氨烷基的反应。
alpha是指羟基(卤素和氨(胺)基)直接与引入的烷基的碳相连。
6.1.1alpha-羟烷化(1)羰基alpha碳的alpha-羟烷化(羟醛缩合)具活泼氢的醛(酮)在碱(或酸)的催化下,自身或交叉缩合,生成beta-羟基醛或酮的反应。
最初是因为烯醇负离子对一个醛(aldehyde)加成得到醇(alcohol)而得名(aldol)。
反应机理为烯醇(负离子)对羰基的亲核加成。
①具活泼氢的醛或酮的自身缩合反应可以是碱催化的。
根据反应条件的不同,生成的beta-羟基醛或酮可以发生消除而生成烯,如丁醛的羟醛缩合反应。
也可以用酸催化,比如硫酸、盐酸以及离子交换树脂等。
碱能催化的原因在于碱可以夺取底物的质子,使其形成烯醇负离子;酸能催化的原因在于酸既能质子化羰基,使之更容易被亲核试剂进攻,也能帮助烯醇式的形成,又能催化脱水。
对称酮缩合产物单一。
对于不对称酮,不论碱催化或酸催化,反应主要发生在含氢较多的alpha碳原子上,得到beta羟基酮或其脱水物。
②芳醛与具活泼氢的醛或酮的缩合芳醛与具活泼氢的醛或酮的缩合可生成b羟基芳丙醛(酮),并进一步消除生成更稳定的芳丙烯醛(酮),即Claisen-Schmidt反应。
消除产物以反式构型为主,如苯甲醛与苯乙酮的缩合。
这与过渡态的稳定性有关(反式共平面消除)。
芳醛与两个alpha位都含活泼氢的酮反应时,酸催化倾向于在含氢较少的位置缩合,碱催化与此相反。
药物合成反应(第三版_闻韧)第四章 缩合反应总结

R
CH C OH
R'
R
-H
R' R R CH2 C OH
O R'
Hale Waihona Puke CH C- H2O
R'
O C C CR'
CH2R R
Organic Reactions for Drug Synthesis
1)自身缩合 (一般用碱性催化剂)
NaOH 25℃ 2CH3CH2CH2CHO NaOH 80℃ CH3CH2CH2CH OH CH3CH2CH2CH CH CHO CH2CH3 C CHO
试解释上述反应中为什么使用镁?
Organic Reactions for Drug Synthesis
1)
-卤代酸酯的活性顺序为:
R1 R1
ICH2COOC2H5>BrCH2COOC2H5 >ClCH2COOC2H5
X CCOOC2H5 > X CHCOOC H > X CH2COOC2H5 2 5 R2
2) 无水操作:Et2O、THF等。Zn需活化(用20%HCl 处理)
Organic Reactions for Drug Synthesis
Reformatsky反应的应用:
•合成-羟基羧酸酯 •合成-羟基羧酸
•醛、酮增长碳链的方法之一
Organic Reactions for Drug Synthesis
C O Y
Nu
C O Nu
+ Y
Organic Reactions for Drug Synthesis
羰基化合物的结构与反应特征
羰基化合物的结构特征之二: ——羰基C=O的吸电子作用使得a-H具有明显 的酸性,在碱性条件下可以离解,生成烯醇 负离子,从而成为亲核试剂,进攻羰基碳或 卤代烃,发生亲核加成反应、亲核取代反应。
第四章:缩合反应(2,3节)-1
NH2
C (C O O C 2 H 5 ) 2
30%
O R
C
R R1
+
C H 2 (C O O C 2 H 5 ) 2
T iC l 4 / P y C
R1
C (C O O C 2 H 5 ) 2
73~100%
2. Stobbe 反应
丁二酸酯或烃基取代的丁二酸酯在碱性试剂存 在下,与羰基化合物进行缩合生成-烃基亚甲基丁 二酸单酯的反应。
O
C H C O O C 2H 5 + (H 3 C ) 3 C OH
CH CO OC2H5
C 6H 5 C
O H2 C
C CH
O C 2H 5
- O C 2H 5
C O O C 2H 5
C O
O
C
O
(H 3 C ) 3 C
(C 6 H 5 ) 2
OK
(C 6 H 5 ) 2 C CH2
C O O C 2H 5
醚水解
CHO
+ P h3P = C H O C H 3 金 刚
利 用 此 结 构 可 制 醛
O O
+
P h3P
C H
COEt
位 阻 大 ,不 反 应
维生素A的合成-
X
C H 2O H C H
(C 6 H 5 ) 3 P . H X
C H 2 P ( C 6 H 5 )3 C H
C - P H ( C 6 H 5 )3
A ld o le
O OH
H 2O O
2.有机金属化合物的-羰烷基化反应反应
有机金属化合物与,-不饱和羰基化合物加成时, 既可进攻1,2-加成产物,又可与共扼体系反应生成1, 4-加成产物。若生成1,4-加成产物,既在连有金属部 分的碳原子上引入一个-烷基,又称-羰烷基化反应。
缩合反应-4

C
CHNHCOCH3 CH2OH
Original slide prepared for the
第一节 α-羟烷基、卤烷基、氨烷基化反应 一、 α-羟烷基化 1 Aldol缩合 ii)不同的醛酮之间的缩合
卡 尼 查 罗 反 应 : α位 上 无 活 泼 氢 的 醛 类 和 浓 NaOH 或 KOH( 或 醇 ) 作 用 生 成 醇 和 酸 2RCHO + OHRCH2OH + RCOO-
第四章
缩合反应
Condensation Reaction
Original slide prepared for the
1.缩合反应的含义:两个或两个以上有机化合物分子之间 相互作用形成一个新的较大分子,同时释放出简单分子的反 应;或同一个分子内部发生反应形成新的分子的反应可称为 缩合反应。 反应过程中一般同时脱去的小分子是水、醇、氨、卤化氢 等。 2.分类: 碳–碳键
二、环加成反应机理
1 .[4+2]环加成反应 2.1,3-偶极环加成反应
Original slide prepared for the
第一节 α-羟烷基、卤烷基、氨烷基化反应 一、 α-羟烷基化 1 Aldol缩合 (羟醛缩合) 定义:含有α -H的醛或酮,在碱或酸的催化作用下生成 β 羟基醛或β 羟基酮的反应(醛、酮之间的缩合)
第一节 α-羟烷基、卤烷基、氨烷基化反应
二、α-卤烷基化(Blanc反应,氯甲基化反应)
ArH + HCHO
H O+ H+ H C OH H2COH
HCl/ZnCl2
ArCH2Cl
机理:(苯环上有供电子基有利于反应,因为此为亲电反应)
H C H
ArH
《药物合成》第四章缩合反应

具有活性H的化合物与羰基化合物(醛、酮、酯等) 之间的缩合反应。主要包括: α -羟烷基、卤烷基、 氨烷基化反应;β-羟烷基, β-羰烷基化反应
第一节: α-羟烷基、卤烷基、氨烷基化反应
一、α-羟烷基化反应
主要包括 1.羰基α-位碳原子的α-羟烷基化(aldol 缩合) 2. 不饱和烃的α-羟烷基化反应(Prins 反应) 3.芳醛的α-羟烷基化反应(安息香缩合) 4.有机金属化合物的α-羟烷基化
缩合反应
Condensation Reaction
本节主要内容
α-羟烷基化反应 α-卤烷基化反应 α-氨烷基化反应 β-羟烷基化反应 β-羰烷基化反应
前言
缩合:两个或多个有机化合物分子通过反应形成一个 新的较大分子或同一分子内两个官能团重新连接 而生成新的分子的过程,即称为缩合。
反应特点: 有小分子的水或醇等脱去,从而建立新的C—C键 或 C—Y(碳—杂)键。
1、羰基α位碳原子的α羟烷基化(Aldol缩合)
定义:含有α-活性氢原子的醛或酮,在碱或 酸的催化下发生自身缩合,或与另一分子的醛或 酮发生缩合,生成β-羟基醛或酮类化合物的反应, 称α-羟烷基化反应。
但该类反应不稳定,易消除脱水生成α,β-不 饱和醛酮。故此反应又称醛醇缩合(Aldol缩合)反 应。
缩合而生成新的C—C键的一种缩合方法;主要有烯醇 盐法、烯醇硅醚法、亚胺法。
机理①烯醇盐法
②烯醇硅醚法
③亚胺法:将醛与胺类反应生成亚胺,再与LDA作用转变为亚胺锂盐,然
后与另一醛、酮分子发生醛醇缩合而得α,β-不饱和醛。机理如下:
对羰基进行加成
例 (4)甲醛与含有α-活性氢的醛酮之间的缩合(Tollens缩合)
CH3OCH2Cl /ZnCl2、CH3OCH Cl2/lewis酸
药物合成反应_第四章_缩合反应

CH(COOC2H5)2 CH-CH2COCH3
O O δN δ+
加成方式跟底物酮的结构以及格氏试剂所带烷基的位阻有较大关系!
①PhMgBr 1 4
O
2 3
②H2O
位阻2小4大或使用RLi 主要发生1,2加成 Ph 位阻2大4小或使用R2CuLi,亦或 在格氏试剂中添加卤化亚铜 主要发生1,4加成 Ph
OH Ph O
Ph
①C2H5MgBr ②H2O
有 机 金 属 化 合 物 的 反 应
Strecker氨基酸合成反应。
反应机理:
反 应
该反应是制备氨基酸的方便方法。
3
Strecher
应用特点:
可以用氯化铵和氰化钾替代HCN-NH3,还可用氰化三甲基硅Me3SiCN替换氰化钾。
CHO NH2 TMSCN/MeOH 盐酸胍 CN
O O Cl CHO NH2 H3C 催化剂 CN CH2Cl2 NC N CH3
末端烯烃的反应收率相对较好,且主要产物为环状缩醛;
2
Prins
应用特点:
制备1,3-二醇
HCHO HCOOH OOCH H2O OH OH
OOCH
制备1,3-二氧六环
HCHO 酸性树脂 O
反 应
O
2
反应机理:碳负离子对羰基的加成消除。
芳醛在含水乙醇中,以氰化钠(钾)为催化剂,加热后发生双分子缩合生成α -羟基酮。 关键在于如何产生碳负离子。
HO OHC
应用特点: 不同醛可得不同苄氯烃基
HO ClCH2OCH3 AlCl3 NO2 OHC
CH2Cl
卤 烷 基 化
(Blanc)
NO2
CH3CHO O HCl O
第四章 缩合反应

Ph Ph
Ph
CHO + CH CHO CH 3COCH 2CH 3 3 CHO 3COCH 2CH CH COCH CH ++
3 2 3
O O O Ph Ph Ph
O O O
(动力学控制) ( (动力学控制) 动力学控制)
HCl HCl HCl 85% 85% 85%
(热力学控制) (热力学控制) (热力学控制)
R R
OO O
O O
O
OO O O
OO
催化剂是稀硫酸,还可采用磷酸、强酸性离子交 换树脂及ZnCl2, BF3等路易斯酸;
23
(四) 有机金属化合物的a-羟烷基 化反应
(1).Grignard反应 格氏试剂与甲醛、醛和酮加成后再水解可分别得 到伯、仲、叔醇:
O O H C C H H H O O R C C H H R
一、α-羟烷基化反应 羟醛缩合反应: 含有α-氢的醛或酮,在酸或碱的催化下发生自身 缩合,或与另一分子的醛或酮发生缩合,生成β羟基醛(酮),或进一步脱水生成α,β-不饱和醛 (酮)的反应。
3
催化剂的选择
催化剂:弱碱或强碱; 强碱:一般用于活性差、位阻较大的羰基化合 物之间的缩合,且在非质子性溶剂中进行。
18
CN Ar Ar C C H H O O
CN CN H H Ar Ar C C OH OH
+ +
CN CN
-
Ar
C
O
H
CN CN Ar Ar CC
OH OH
O O H H C C Ar' Ar'
H CN H CN Ar Ar
CC
H
Ar' C C Ar'
第四章:缩合反应(1节)-1

O
HOCH2
C H2OH + HC OOH
HOCH2
C H2OH
O
例3. 抗生素氯霉素(chloramphenical)中间体(3)
例4. 利尿酸(Eacrynic Acid,4)
(3)
(4)
例5. 多伦斯缩合中,苦碱的浓度过大,会发生康尼查罗(cannizzaro) 副反应。有时可以 利用这一点,使缩合与康尼查罗反应相继发生, 缩短反应步骤。这是制备多羟基化合物的有效方法。如血管扩张药四 硝酸戊四醇酯(Pentaerythritol Tatranitrate)中间体季戊四醇 (5)和安定药 甲丙氨酯(安宁,Meprobamate)中间体(6)的制备。
芳醛在碱催化下与脂肪族醛、酮缩合而生成 -不饱和醛、酮的反应
O A rC H O+R C H 2C R 1
O H A rC H C H C R 1
R
H 2O
C O R 1
A rC HC
R
O
反
式
RC H
为
: base H
Ph
H
主
Ph
RC H
OH H
O
: base
H H
Ph
H
H
OH CR
Ph
O
O CR
CH 3(CH 2)nC CH CO (CH 2)nCH 3 65% CH 3
例1.催眠镇静药甲丙氨酯(Meprobamate)中间体2— 甲基—2—戊烯醛(1)就是由 两分子丙醛在稀碱中缩 合而成。将丙醛滴入稀的氢氧化钠水溶液中,并控 制温度在40℃ 左右。否则,易发生副反应。
2 ). Claisen-Schimidt 反应
(5)
药物合成反应第四章 缩合反应

CH2
HC
CH2Leabharlann CH2CH2 [4+2]环加成反应 1,3-偶极环加成反应
20
1. [4+2]环加成反应 共轭二烯烃与烯烃、炔烃进行环加成,生成 环己烯衍生物的反应属[4+2]环加成反应,该反应 称为Diels-Alder反应,也称“双烯加成”。 最简单的[4+2]环化加成是1,3-丁二烯与乙 烯加成反应,假定丁二烯分子与乙烯分子面对面 互相接近,丁二烯的最高占有轨道与乙烯的最低 空轨道或丁二烯的最低空轨道与乙烯的最高占有 轨道都可以重叠成键,因此,[4+2]环加成是对称 允许反应。
CH2CH3
31
催化剂的影响: 醛或酮的自身缩合反应常用碱作催化剂,酸催化剂 应用较少。
32
④应用特点 制备长链醛(醇)
例:2-乙基己醇(异辛醇)的生产 2 CH3CH2CH2CHO
CH3CH2CH2CH2-CHCHO OH CH2CH3
CH3CH2CH2CH2=CCHO CH2CH3
33
CH3CH2CH2CH2-CHCH2OH CH2CH3
性条件下可以离解,生成烯醇负离子,从而成为亲核试 剂,进攻羰基碳或卤代烃,发生亲核加成反应、亲核取 代反应。
O C C H
B
C
O C
C
O C
烯醇负离子由于羰基的共轭作用得以稳定 烯醇负离子
4
烯醇中的C=C双键接受亲电试剂进攻,发生α-卤代 反应,醛酮、羧酸和酰卤可以发生该反应。 烯醇负离子作为亲核试剂,进攻卤代烃的缺电子 碳,则发生亲核取代反应;进攻羰基碳则发生亲核 加成反应。
R' +
R
HC
C OH
第四章缩合反应

R'
OH H
产物不稳定
B:
-H2O
R C C R' H O
R' R O
H2 RC C C C
R'
OH
R' R O
H2 RC C CC
R'
4
Original slide prepared for the
第一节 α-羟烷基、卤烷基、氨烷基化反应 一、α-羟烷基化
1 Aldol缩合 机 理 b: 酸催化
Original slide prepared for the
R
5
Original slide prepared for the
第一节 α-羟烷基、卤烷基、氨烷基化反应 一、α-羟烷基化
1 Aldol缩合 1)自身缩合 (一般用碱性催化剂)
2CH3CH2CH2CHO
NaOH 25℃
CH3CH2CH2CH OH
NaOH 80℃
CH3CH2CH2CH
H C CHO CH2CH3
O
H
C6H5
C
C C Ph H 反式
H
H COPh
10
Original slide prepared for the
第一节 α-羟烷基、卤烷基、氨烷基化反应 一、α-羟烷基化
1 Aldol缩合 ii)不同的醛酮之间的缩合
S
CHO
S
+
H2SO4
NO2
O
O
CHO +
O
H3CC CH2CH3
13
KOH H+
CH2
H2O + HCHO
HCOOH
CH CH2 OH CH2OH
第四章缩合反应42
O
Ar CH2CH2OH
H O CH3
PhH/AlCl3
HOH2C
C6H5 H
CH3
常伴随构型翻转
55.8%
2019年7月29日星期一
22
4.2.1.2 活性亚甲基化合物的-羟烷基化
H2C COOC2H5 EtONa
COOC2H5
HC COOC2H5 COOC2H5
O / EtOH
- CH3CH2OH
H2O
CN
+ R NH2
KCl
R(H)
H2O
+ HCN KOH
RO
2019年7月29日星期一
NH4Cl
R(H)
NH3
该法广泛应
用于制备各 种 -氨基酸, 例子见P213
20
新法合成:价廉易得,无毒操作
+ + CHO CHCl3
Na(K)OH
PTC PTC
COOH R
OH
COOH
NH3 H2O R NH2
H
-H
H2C N R2
R' C CH3
R' C CH3
R' C CH2
O
OH
OH
R' C CH2CH2NR2 -H OH
R' C CH2CH2NR2 O
Mannich反应中:
一般使用亲核性:胺类R2NH > 具有活性氢的化合物RH
+ HCHO
R2NH
R2NCH2OH
如果亲核性:胺类R2NH ≤具有活性氢的化合物RH
+ + R'H
HCHO
R2NH
+ R'CH2NR2
药物合成反应-缩合反应PPT课件

在抗生素药物合成中的应用
总结词:广泛使用
详细描述:缩合反应在抗生素药物合成中应用广泛,例如通过酯化、胺化等缩合 反应合成大环内酯类、四环素类抗生素。这些反应能够将不同官能团结合在一起 ,形成具有生物活性的复杂结构。
在生物碱类药物合成中的应用
总结词:关键步骤
详细描述:生物碱是一类天然产物,具有抗肿瘤、抗菌、抗病毒等生物活性。在生物碱类药物合成中,缩合反应常常是关键 步骤,用于将不同的碳架结构连接起来,形成目标分子。
02
在药物合成中,缩合反应是一种 常见的反应类型,用于构建复杂 的有机分子结构。
缩合反应的类型
醛酮缩合反应
醛和酮在催化剂的作用 下,通过加成反应形成 新的碳-碳键,生成β-羟
基酮或烯醇。
酯化反应
酸和醇通过酯化反应生 成酯,同时失去一分子
水。
羟醛缩合反应
醛和醇在弱碱的作用下, 发生羟醛缩合反应,生
成β-羟基醛或酮。
酯的醇解反应
在酸或碱催化下,酯与醇进行反应生 成酯和醇的过程。
氨基化合物缩合反应
曼尼希反应
在甲醛或含甲醛的物质存在下,氨基化合物与含有活泼氢的化合物进行缩合, 生成亚甲基化合物的过程。
施密特反应
在甲醛或含甲醛的物质存在下,氨基化合物与羧酸进成中的应
05
缩合反应的发展趋势与展望
缩合反应的研究现状与进展
01
缩合反应在药物合成中的重要性
缩合反应是药物合成中的重要反应类型之一,对于获得目标分子、提高
药物产量和纯度具有重要意义。
02 03
缩合反应的研究进展
随着科学技术的不断进步,缩合反应的研究也在不断深入。目前,研究 者已经开发出多种新型的缩合反应催化剂和反应条件,提高了反应效率 和选择性。
《缩合反应 》课件

纳米材料合成
在纳米材料合成中,缩合反应也扮演着重要角色 ,例如金属氧化物的合成就可以通过缩合反应实 现。
陶瓷材料合成
陶瓷材料的合成过程中也涉及到缩合反应,例如 硅酸盐陶瓷的合成过程中就涉及到硅酸盐的脱水 缩合反应。
05
CATALOGUE
04
CATALOGUE
缩合反应的应用领域
有机合成
合成醇类
01
缩合反应可以用于合成醇类化合物,例如醛和酮可以通过醇的
脱水反应生成相应的醇。
合成羧酸
02
通过醛或酮与羧酸之间的缩合反应,可以合成羧酸类化合物。
合成胺类
03
胺类化合物的合成也可以通过缩合反应实现,例如醛和氨之间
的反应可以生成亚胺,进一步处理可以得到胺类化合物。
药物合成
合成药物中间体
许多药物在合成过程中需要经过缩合反应来得到关键的中间体。
合成生物碱
生物碱类化合物的合成往往涉及到缩合反应,例如氨基酸和有机酸 之间的缩合反应可以生成生物碱。
合成激素
激素的合成过程中也经常使用到缩合反应,例如雌性激素的合成过 程中就涉及到酯的缩合反应。
材料科学
1 2 3
高分子合成
缩合反应的发展趋势与展望
新反应类型的发现与探索
1
不断探索新的反应类型,以满足不断发展的化学 工业需求。
2
深入研究反应机理,提高反应的效率和选择性。
3
开发高效、环保的催化剂体系,降低生产成本。
绿色化学在缩合反应中的应用
开发绿色、环保的合成方法,减少对环境的污 染。
优化反应条件,降低能耗和资源消耗。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cannizzaro 反应
CH2OH
有机金属化合物的α−羟烷基化反应
(1) Reformatsky reaction: 醛、酮与α−卤代酸酯在锌粉的 存在下缩合而得β−羟基酸酯或脱水得α,β−不饱和酸酯。
O R1 R2 + X H C CO2R H R
1 2
1) Zn 2) H3O+ R
1 2
OH H C C CO2R H -H2O
+
C6H5 C6H5COCH2CHCH2CO2H
O CO2Et + CH CCOCH3
K2CO3/Acetone
O CO2Et COCH3
KOH/EtOH CHCN Et + CH2 CHCN
CN C CH2CH2CN Et
O CO2Et + Yb(OTf)3 CH2 CHCOCH3
O CO2Et COCH3 (95%)
O O HO NH2 CN HO O NH CN Cl OCH3 HO O N
O OCH3 CN
化合物Ⅰ
化合物Ⅱ
O O Ni/H2 HO N OCH3 NH2 NaOH/ref HO O N O NH
化合物Ⅲ(VAM水溶液)
化合物Ⅳ(Wing-B)
2.有机金属化合物的β−羰烷基化反应
有机金属化合物对α,β−不饱和羰基化合物的1,4− 加成−β−位引入烷基。
O R C CH3 + 3NH3 + 3HCHO
O R C C(CH2NH2)3
NH3
+
HCHO
CH2
NH2
Imine (亚胺)
2.Streck反应- a-氨基酸的制备
醛、酮类化合物与ΗCΝ和氨(胺类化合物)反应生成 α−氨基腈,再经酸或碱水解得到α−氨基酸的反应。
O R C R'(H) + NH3 + HCN R (H)R' CN C NH2
O HCHO + CH3 C Ph O OH NaOH/H2O Ph
∗
H
H3O+
Ph O H
H
3HCHO / 25%Ca(OH)2 CH3CHO HOCH2
Tollens condensation
CH2OH C CHO
CH2OH
HCHO/25%Ca(OH)2
CH2OH HOCH2 C CH2OH + HCO2H
定义:醛、酮与含磷试剂 ⎯ 烃代亚甲基三苯基膦(膦叶 立德)反应,醛、酮分子中的羰基的氧原子被亚甲基取 代,生成相应的烯烃和三苯基氧膦。
O R R' + Ph3P R R
1
R R'
R
1
+
2
R2
Ph3P=O
(膦叶立 德)
膦叶立德的制备 膦叶立德的制备
三苯基膦与有机卤化物作用生成季鏻盐⎯烃代三苯基卤化 膦盐,再在非质子性溶剂中加碱处理,失去一份子卤化氢 而成。
OH CH3CH2CCH2CH3 CO2CH3
二、β−羰烷基化反应
1.Michael反应-1,4-addition 定义:活性亚甲基化合物与α,β−不饱和羰基化合物 在碱催化下发生加成缩合反应,生成β−羰烷基类 化合物。
Mechanism Mechanism
O R O R CR'2 + CHR'2 + B O R" R R O CR'2 O + HB
O 2 RCH2 C R' OH or H RCH2 OH H O C β R' R C C R'
-H2O
O RCH2 C R' C R C R'
( 2 )芳醛与含有α− 活性氢的醛、酮之间的缩合反 应⎯Claisen-Schimidt反应
O ArCHO + RCH2 C R'
OH
OH
O R'
Ar CH CH C R
R' C R'
OH R"
O R
R' C R'
OH R" + HB R
O
R' C R'
O R" + B
For example:
N H / EtOH
C6H5CH=CHCOC6H5
+
CH2(COOC2H5)2
C6H5 C6H5COCH2CHCH(CO2Et)2
1) 5% NaOH/H2O 2) H3O ,
C
R
R
C CO2R H
Reformatsky 反应中α−卤代酸酯的活性顺序为: ICH2COOEt > BrCH2COOEt > ClCH2COOEt 其中以溴卤代酸酯使用最多。
Reformatsky 反应中亲电试剂:除了醛、酮之 外,还有酰氯、腈、烯胺发生缩合反应得到β− 酮酸酯、 β−内酰胺。
第四章
缩合反应
(Condensation Reaction) 定义:两个或多个有机化合物分子通过反应形成一 个新的大分子的反应,包括分子间(intermolecular) 缩合反应和分子内(intramolecular)缩合反应。 用途:建立碳-碳键以及碳-杂键。 重点:活性亚甲基化合物与羰基化合物之间的 缩合反应。
第一节 α−羟烷基、卤烷基、氨烷基化反应 一、α−羟烷基化反应 1.羰基α−位碳原子的羟烷基化⎯羟醛缩合反应 (aldol condensation ) 含有α−活泼氢原子的醛或酮,在酸或碱的
定义
催化下发生缩合,生成 β− 羟基醛或 β− 羟 基酮化合物的反应。
反应类型: (1) 含有α−活性氢的
Cl
氯吡格雷
第二节 β−羟烷基、β−羰烷基化反应
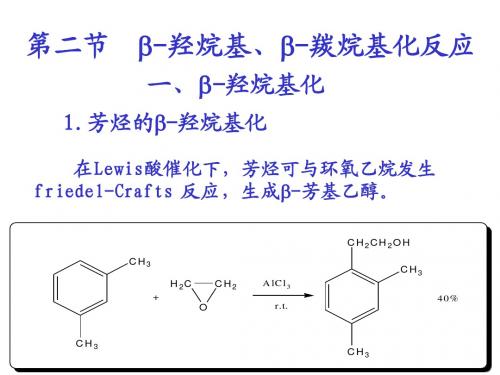
一、β−羟烷基化反应 1. 芳烃的β−羟烷基化反应
在Lewis酸催化下,芳烃可与环氧乙烷发生Friedel -Crafts反应,生成β-芳基乙醇。
CH3 + CH3
O
AlCl3
CH2CH2OH CH3
CH3
2.活性亚甲基化合物的β−羟烷基化反应
+
O R C CHR' CH2NHR"
The The acid-catalyzed acid-catalyzed mechanism mechanism
OH R C CH2R'
H3O
+
OH R"NH R C CH2R' CH2
OH R C CHR' CH2NHR"
-H+
O R C CHR' CH2NHR"
O
Grignard reagent preferentially attacks at the less substituted carbon atom.
For example:
1) MeMgI 2) H2O OH CH3CH2CHCH2CH3
O CH3CH2
O CH3OC CH3CH2 O 1) Me2CuLi 2) H2O
(1) 用膦酸酯代替内鎓盐(膦叶立德)。 (2)在碱作用下膦酸酯与醛、酮类化合物的烯化反应。
R1 Ph3P C ylide R2
O (RO)2P CHR R
1 2
R + O C
3
Base
R
1 2
R3 R
4
R4 solvent 膦酸酯
R
Base: NaNH2, KNH2, t-BuOK, NaH, n-BuLi. Solvent: dioxane, DMF, DME, THF.
活性亚甲基化合物与环氧乙烷在碱催化下也能发生羟乙 基化反应。
CH3COCH2COOC2H5 + ClCH2 O CH3CH2OCH CH2 CH O CH2Cl C OEt CH3CH2OCH CH2 CH CH2Cl O C O O EtONa/EtOH
3.有机金属化合物的β−羟烷基化反应
1) RMgX RCH2CH2OH 2) H2O
R2
Mechanism
R1 Ph3P C ylide R2 + O C
R3 R4
Ph3P R
2
O C R3 R4
Ph3P R2 C R1
O C R3 R4
C
R1
R
1 2
R3 R
4
+
Ph3P=O
R
CH3CH=CHCHO/PhH
CH3CH=CHCH=CHCO2Et
Ph3P=CHCO2Et O / PhH
O (1) C6H5COOCH=CHCHO NaH, THF
C6H5COOCH=CHCH=CHCO2Et
-H
RO RO R' tetraisoquinoline NH
isoquinoline
Pictet-Splengler Reaction在治疗心肌梗 塞、中风药氯吡格雷的合成中的应用
Mg S Br S MgBr O S OH
CO2Me CH3SO2Cl S OMs NH2 Cl S
MeO2C HN
1) Zn (1) Cl COCl + Br C CO2Et H2 CH3 (2) CN + Br C CO2Et H Cl 2) H3O 1) Zn 2) H3O
+ +
O
O OEt
O
O OEt CH3
(3)
N
OMe
1) Zn + Br C CO2Et H2 2) H3O+
MeO N
O
Cl
Cl
O (4) Br O CHO n
苄氯
ZnCl2
