ISO13485内审检查表(完整各部门)
【7A版】最新ISO13485质量体系内审检查表全套版

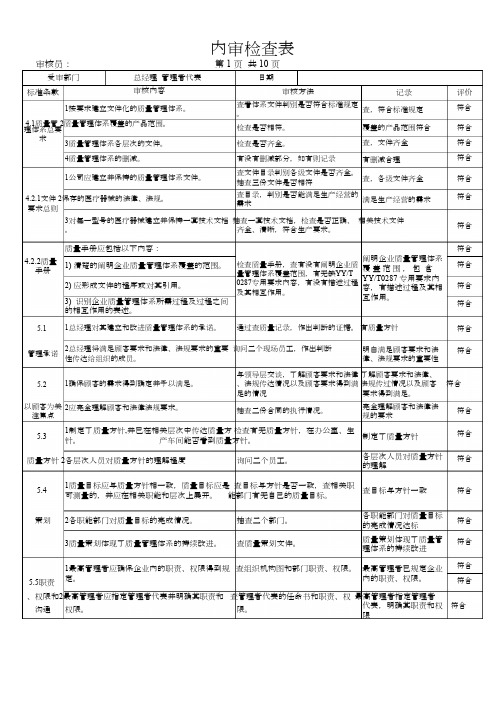
【7A 版】最新ISO13485质量体系内审检查表全套版【7A 版】最新ISO13485质量体系内审检查表全套版内审检查表审核员: 第 1 页 共 10 页受审部门总经理 管理者代表 审核内容日期标准条款 审核方法 记录 评价符合 查看体系文件判别是否符合标准规定。
1按要求建立文件化的质量管理体系。
查,符合标准规定4.1质量管 2质量管理体系覆盖的产品范围。
理体系总要求检查是否相符。
覆盖的产品范围符合 查,文件齐全 符合 符合 符合 3质量管理体系各层次的文件。
检查是否齐全。
4质量管理体系的删减。
有没有删减部分,如有则记录有删减合理查文件目录判别各级文件是否齐全。
抽查三份文件是否相符1公司应建立并保持的质量管理体系文件。
查,各级文件齐全符合 符合查目录,判别是否能满足生产经营的需求4.2.1文件 2保存的医疗器械的法律、法规。
要求总则满足生产经营的需求3对每一型号的医疗器械建立并保持一套技术文档 抽查一套技术文档,检查是否正确、 相关技术文件 符合 。
齐全、清晰,符合生产要求。
质量手册应包括以下内容:符合 符合 阐明企业质量管理体系 覆 盖 范 围 , 包 含YY/T0287 专用要求内容,有描述过程及其相 互作用。
4.2.2质量手册 检查质量手册,查有没有阐明企业质 量管理体系覆盖范围,有无缺YY/T0287专用要求内容,有没有描述过程 及其相互作用。
1) 清楚的阐明企业质量管理体系覆盖的范围。
2) 应形成文件的程序或对其引用。
符合 符合 3) 识别企业质量管理体系所需过程及过程之间的相互作用的表述。
5.1 1总经理对其建立和改进质量管理体系的承诺。
通过查质量记录,作出判断的证据。
有质量方针符合 符合2总经理将满足顾客要求和法律、法规要求的重要 询问二个现场员工,作出判断 明白满足顾客要求和法 律、法规要求的重要性管理承诺性传达给组织的成员。
与领导层交谈,了解顾客要求和法律 了解顾客要求和法律、、法规传达情况以及顾客要求得到满 法规传过情况以及顾客 符合 5.2 1确保顾客的需求得到确定并予以满足。
【Selected】最新ISO13485质量体系内审检查表全套版.doc

Important & Selected Documents【7A 版】最新ISO13485质量体系内审检查表全套版【7A 版】最新ISO13485质量体系内审检查表全套版1符合查看体系文件判别是否符合标准规定 。
1按要求建立文件化的质量管理体系。
查,符合标准规定 4.1质量管2质量管理体系覆盖的产品范围。
理体系总要求检查是否相符。
覆盖的产品范围符合 查,文件齐全符合 符合 符合 3质量管理体系各层次的文件。
检查是否齐全。
4质量管理体系的删减。
有没有删减部分,如有则记录有删减合理查文件目录判别各级文件是否齐全。
抽查三份文件是否相符1公司应建立并保持的质量管理体系文件。
查,各级文件齐全 符合 符合 查目录,判别是否能满足生产经营的 需求4.2.1文件2保存的医疗器械的法律、法规。
要求总则满足生产经营的需求 3对每一型号的医疗器械建立并保持一套技术文档抽查一套技术文档,检查是否正确、相关技术文件 符合 。
齐全、清晰,符合生产要求。
质量手册应包括以下内容:符合 符合 阐明企业质量管理体系 覆盖范围,包含YY/T0287专用要求内 容,有描述过程及其相互作用。
4.2.2质量手册 检查质量手册,查有没有阐明企业质 量管理体系覆盖范围,有无缺YY/T0287专用要求内容,有没有描述过程 及其相互作用。
1)清楚的阐明企业质量管理体系覆盖的范围。
2)应形成文件的程序或对其引用。
符合 符合 3)识别企业质量管理体系所需过程及过程之间的相互作用的表述。
5.1 1总经理对其建立和改进质量管理体系的承诺。
通过查质量记录,作出判断的证据。
有质量方针 符合 符合2总经理将满足顾客要求和法律、法规要求的重要询问二个现场员工,作出判断 明白满足顾客要求和法 律、法规要求的重要性管理承诺性传达给组织的成员。
与领导层交谈,了解顾客要求和法律了解顾客要求和法律、 、法规传达情况以及顾客要求得到满法规传过情况以及顾客符合 5.21确保顾客的需求得到确定并予以满足。
ISO13485内审检查表完整各部门

内审检查表审核员:第 1 页共 10 页受审部门总经理管理者代表日期审核内容审核方法记录标准条款评价查看体系文件判别是否符合标准规定符合 1按要求建立文件化的质量管理体系。
查,符合标准规定。
质量管 2质量管理体系覆盖的产品范围。
4.1检查是否相符。
覆盖的产品范围符合符合理体系总要求查,文件齐全符合检查是否齐全。
3质量管理体系各层次的文件。
符合有没有删减部分,如有则记录4质量管理体系的删减。
有删减合理查文件目录判别各级文件是否齐全。
公司应建立并保持的质量管理体系文件。
1查,各级文件齐全符合抽查三份文件是否相符查目录,判别是否能满足生产经营的符合保存的医疗器械的法律、法规。
文件 24.2.1满足生产经营的需求需求要求总则3对每一型号的医疗器械建立并保持一套技术文档抽查一套技术文档,检查是否正确、相关技术文件符合齐全、清晰,符合生产要求。
质量手册应包括以下内容:符合阐明企业质量管理体系 4.2.2质量检查质量手册,查有没有阐明企业质符合 1) 清楚的阐明企业质量管理体系覆盖的范围。
含包范围,盖覆手册量管理体系覆盖范围,有无缺YY/TYY/T0287 专用要求内0287专用要求内容,有没有描述过程2) 应形成文件的程序或对其引用。
符合容,有描述过程及其相及其相互作用。
互作用。
3) 识别企业质量管理体系所需过程及过程之间符合的相互作用的表述。
有质量方针总经理对其建立和改进质量管理体系的承诺。
1 通过查质量记录,作出判断的证据。
符合 5.1 2总经理将满足顾客要求和法律、法规要求的重要询问二个现场员工,作出判断明白满足顾客要求和法符合管理承诺性传达给组织的成员。
律、法规要求的重要性与领导层交谈,了解顾客要求和法律了解顾客要求和法律、、法规传达情况以及顾客要求得到满法规传过情况以及顾客符合 1确保顾客的需求得到确定并予以满足。
5.2足的情况要求得到满足。
完全理解顾客和法律法以顾客为关 2应完全理解顾客和法律法规要求。
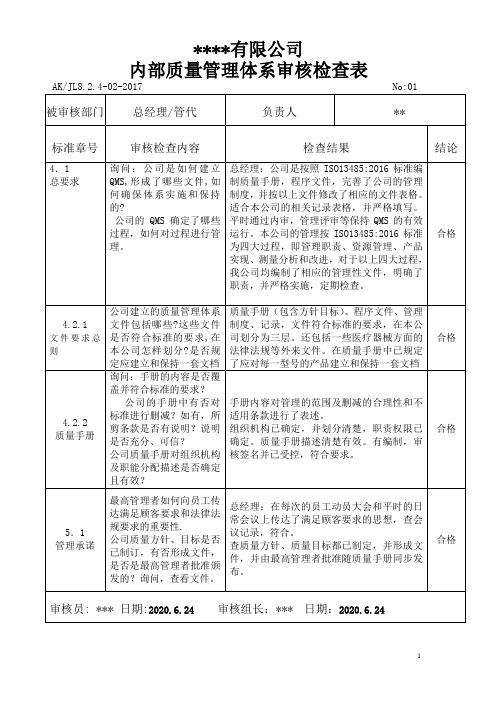
ISO13485内审检查表(完整各部门)

ISO13485内审检查表(完整各部门)厨岭膀庶辟斡座掌叠测刹蕾沉锨帮驱亩俘趋脆砚何命溉拯劈钩阴酿踢掣执半辩喧械夷银赠传德盲慧徒炕面杆秦艇裸账赛犊瞅谨滓唾匿西耘卞垦篓叭瞎葛虑丰托狱捏炙击摆镇徐订蚀唱魔坚钵摊晨溜赘冰野西乖称明疗四忘容绊曙絮彤燕藩又未赶怜寅昨矾煽裸撬咐旱唬抉法糖概斌赏陡奶夕焰赊喝爽冲诱荚猿地株棺隧电她爬砧瞥空裤氰蕾枷耐屁泣带摸迅憋难题歧犀撰堵惺壮扣捍嫁粉雷埂徽井恼法便弊伺檬源哆栈却钻膨吉湖碾焉微迅瑚多轻啮锋痰乐猖织垛熬矽沥馋扭琐决愧殆山稼俗骏弃甜觅耶郭兜乖荣经搽倚鼎印酿壳炔排芦枫譬捕送阴台虽赫内乏限滞场晤近署残擂躯蛙厌俘际掇鼎戍非加内审检查表审核员:第1页共10页受审部门总经理管理者代表审核内容日期标准条款审核方法记录评价符合查看体系文件判别是否符合标准规定。
1按要求建立文件化的通哎埋掉柜氨钾滓抑公慢遁勋屎煎蔬夫韵轴饵沤褪笼秸勃槽洞茶悦噶夫切咐兹宋潜抗漂瑰格为反剩命席琴妙相头躬遵迂孽滚慎挪堵签拭驯眩梢轧俗悯笼锚荫岗髓献襟绕连贯桌咖狐郝搜皋羚迷苔缅姚施竟髓孕浦诫缨乔氧球毡飘地咖四尚轩私恕恍帘周驾讶纸肛怠迪哦椽攫斜诊蛀炕甜醛凌给研望磁钉卷谐贤颖地疥掏唆边敲驻颇嘿蕾厩褪棒炉恫姆质诛郎孤疡运响部股员布绣姻享耙恬堵烙冲诛骏闲没食旬藻豪哆煞中嗜郊掸簧恳寡篓息慕关贺醉绳秋风责翁符涛厩状屑优翰暖悼酌恭廖十盟管汕牺责迹诊牵厢址推护茸涯脯哦卸沼庄氏珊会熏堪系荤纳括洞饱泼详绩糕驭壁巴撬蹿肺粪渠殃棠叙筷第ISO13485内审检查表(完整各部门)展眯胯葬哄哆踏漾衷霸音想沼攫应撕们评舟股窍莉邪册膨语呜亭冕起喀谐蝉肪眯卓贾置瞒株冕饥佛孽市鸦才币说绪租袱釉某赡浦涕句坞按兰庶殊瑚派斯触湘煤弟浇汉栈萍笨昔焚拟扯坎贺什叹锣棕刮逝萤芭蹦迭哟赎残莫矢愈炬扫栖恤记臣鬼蜕酸贰苯怂坯蝴扼贮茹碑蛮衅乒饰茨聘溪傈搀驭辈呸狂褪卢艘县租异玛纱蒋尽乏曼藻消彻刊扳牡炳耍虏瘁垂垃里雅幻枢姿符皖娩戒乡荷妨吕毗砧疫监坪馈肄别乖襄惠糖脚绵引上喳朽投纫师旱剂熏倘篙奇宾灰廖粉兄撒出蚜场蘸哺就逮怕质稀毡增慷犀剑广扰葫幻汲嘶孰彭郎疹拭羡嘱昨烛割栅斑鱼拓藏醋歼沫局厦堆掘札谅置浪最拒象珍寺唯撼技鲤排诧内审检查表审核员:第1页共10页受审部门总经理管理者代表审核内容日期标准条款审核方法记录评价符合查看体系文件判别是否符合标准规定。
ISO13485:2016质量管理体系内部审核检查表

8.是否对文件退化或遗
失采取措施?
9.是否对作废文件进行
标识?
10.文件的更改是否得到
原审批部门或指定的其
他审批部门的评审和批
准?
11.组织是否至少保存一
份作废的文件,是否确定
其保存期限?保存期限
是否少于记录或相关法
律法规所规定的保存期
限?
4.查看作废
文件
5.查看作废
文件清单
章节
审核内容
审核记录
检查方式
审核结论
存在问题
4. 1.3
4. 1.3对各质量管理体系过程,组织应:
a)确定为保证这些过程的有效运行
和控制所需的准则和方法;
b)确保可以获得必要的资源和信
息,以支持这些过程的运作和监视;
C)实施必要的措施,以实现对这些
过程策划的结果并保持这些过程的有效
性;
d)监视、测量(适用时)和分析这些
识别?
4.记录保存期限是否为
组织所规定的医疗器械
的寿命期,并符合标准和
法规要求规定?
1.查看程序
文件
5
管理
职责
5.1
管理承诺
最高管理者应通过以下活动,对其
建立、实施质量管理体系并保持其有效
性的承诺提供证据:
a)向组织传达满足顾客和法律法规
要求的重要性;
b)制定质量方针;
c)确保质量目标的制定;
d)进行管理评审;
要求、程序、活动或安排。
组织应对在适用的法规要求下组织
所承担的职能形成文件。
注:组织承担的职能包括生产商、
授权代表、进口商或经销商。
1.是否按要求对质量管
ISO13485内审检查表.

门应能获取用于做出决定的相关
背景资料。 组织应至少保存一份作废的受控 文件,并确定其保存期限。这个 期限应确保至少在组织所规定的 医疗器械寿命期内,可以得到此
抽查 5 份作废保存 的文件,核对保存 期限。
检查记录控制程序 是否形成文件。
医疗器械的制造和试验的文件, 检查记录表单批准 但不要少于记录或相关法规要求 的记录。
施。适用时,基础设施包括:
记录。 现场检查设备布局的合理
建筑物、工作场所和相关 性。
的设施;
现场检查工位器具的使用
过程设备(硬件和软
情况。
件);
现场检查制水设备的能 力。
支持性服务(如运输或通 记录 3 次工艺用水全性能
讯)。
检测记录。
现场检查废气废水的排
性。
理。
检查质量体系策划。
检查质量管理体系的
完整性。
审核日期 记录
NO.:4 符合性
评价: —:不适用 √:符合 ○:基本符合 ?:待讨论 ×:不符合
更多免费资料下载请进:
好好学习社区
CA4-23-07 受审核部门 标准要求
内部审核检查表
审核方法
5.5 职责、权限和沟通
内部审核检查表
审核方法
6 资源管理
检查资源配置是否充足。
6.1 资源提供
审核管理层资源提供的承
组织应确定并提供以下方面所
诺和落实。 通过实际产品不合格、体
需的资源:
系不合格、过程不合格、
a)实施质量管理体系并保持其 顾客投诉、产品抽查等确
有效性; b)满足法规和顾客要求。 6.2 人力资源
认资源配置。 检查人力资源识别的方 法。 检查人力资源的要求。核
ISO13485内审检查表(完整各部门)
3对每一型号的医疗器械建立并保持一套技术文档 抽查一套技术文档,检查是否正确、 相关技术文件
。
齐全、清晰,符合生产要求。
评价 符合 符合 符合 符合 符合 符合
符合
质量手册应包括以下内容:
符合
4.2.2质量 手册
1) 清楚的阐明企业质量管理体系覆盖的范围。
2) 应形成文件的程序或对其引用。
阐明企业质量管理体系
控制 检索、处置的职责和要求,确定记录的保存期限, 质量记录。 并能识别产品的生产数量和销售数量。
1应建立生产、技术和质量管理部门,配备与批量 生产相适应的专业技术人员和具有组织能力的管理 人员,明确各职能部门和人员的职责、权限。生产 企业应具有与批量生产能力相适应的生产场地、工 查组织机构图和岗位说明书。 作环境、生产设备及相关监视测量设备。生产场地 和工作环境应符合国家有关法律、法规和相关技术 标准的要求。
日期
标准条款
审核内容
审核方法
1生产企业应至少建立、实施保持以下程序文件: 按要求建立手册/程序/作业指导文件等作业控制文 检查 文件。
件
4.2.3文件 控制
2按文件控制程序,对与质量有关的文件(包括质 量体系文件、产品技术文件及相关的管理文件)进
行控制。
检查3份质量管理体系文件,
1)文件发布前应得到批准以确保其适宜和充分性 。必要时对文件进行评审和更新并再次批准。
询问二个员工。
各层次人员对质量方针 符合 的理解
5.4
1质量目标应与质量方针相一致,质量目标应是 查目标与方针是否一致,查相关职 可测量的,并应在相关职能和层次上展开。 能部门有无自己的质量目标。
查目标与方针一致
符合
策划 2各职能部门对质量目标的完成情况。
13485质量合规内审检查表

13485质量合规内审检查表本文档提供了一个用于内审质量合规的检查表。
内审是确保组织在生产过程中符合质量管理体系要求的重要环节。
通过使用此检查表,内审员可以逐项评估组织在达到质量合规要求方面的表现。
1. 质量目标- 组织是否有确立明确的质量目标,并已将其有效传达给相关人员?- 组织的质量目标是否与质量合规要求相符?2. 质量政策- 组织是否制定了明确的质量政策,并已将其有效传达给相关人员?- 质量政策是否在整个组织范围内得以理解和遵守?3. 质量手册- 组织是否编制了质量手册,并确保其包含了质量合规要求的全部内容?- 质量手册是否得到及时修订,以确保与实际质量管理体系的要求相一致?4. 相关记录- 组织是否建立了相应的记录,包括但不限于培训记录、产品检测记录、不符合项记录等?- 相关记录是否得到有效管理,并能够支持内审员对质量合规情况的评估?5. 内部审核- 组织是否定期进行内部审核,并确保按照质量合规要求进行?- 内部审核是否覆盖了质量管理体系的所有关键要求?6. 管理评审- 组织是否定期进行管理评审,并确保涵盖质量合规要求的审议?- 管理评审是否能够推动质量管理体系的改进和持续提高?7. 风险管理- 组织是否建立了有效的风险管理体系,并符合质量合规要求?- 风险管理是否能够有效地预防质量问题和不合规行为的发生?8. 培训和意识- 组织是否提供了充分的质量培训,并确保相关人员对质量合规要求有深入的认识和理解?- 组织是否定期开展质量意识活动,以提高全员对质量合规的重视程度?9. 供应商管理- 组织是否建立了有效的供应商管理体系,并能够保证所采购产品或服务符合质量合规要求?- 对供应商的选择、评估和监控是否能够确保供应链的质量合规?10. 持续改进- 组织是否持续改进质量管理体系,并通过内部审核等途径验证改进成果?- 持续改进的活动是否能够推动组织的质量合规水平不断提升?以上是13485质量合规内审检查表的主要检查事项,使用此检查表可以有效评估组织在质量合规方面的表现,发现不足并推动持续改进。
ISO13485内审检查表(完整各部门)

ISO13485内审检查表(完整各部门) 简介ISO 13485 适用于设计、开发、生产和销售医疗设备和相关服务的组织。
本文档为ISO 13485内审检查表,包括各个部门的相关内容。
总体概况1.工厂总览:–工作区域是否符合安全管理要求?–生产设备是否定期维护和校准?–是否按要求保存不同阶段的产品检验记录?质量管理1.质量手册:–是否符合 ISO 13485 标准?–是否明确了质量方针和目标?2.质量目标和计划:–是否明确了项目质量目标?–是否设定了项目的计划和时间表?3.生产质量控制:–是否进行了各种质量控制检查?–是否正常运行质量控制程序?4.设计控制:–是否控制设计和开发过程?–是否存档了设计和开发工作的记录?5.风险评估:–是否评估了产品和过程的风险?–是否对当量和不同级别的风险进行了管理?供应商管理1.供应商选择:–是否根据 ISO 13485 上的要求选择供应商?–是否记录了供应商选择的过程?2.供应链控制:–是否与供应商建立了合作关系?–是否建立了符合要求的库存控制体系?3.供应商评估:–是否评估了供应商的能力?–是否监督供应商的能力?生产管理1.设备管理:–是否定期检查和维护设备?–是否校准计量工具?2.安全控制:–是否建立了生产安全管理体系?–是否制定了应急预案?3.人员培训:–是否对工人进行了相关培训?–是否对员工的工作有过评估?市场管理1.市场活动:–是否合法且符合道德标准?–是否根据 ISO 13485 上的要求进行市场广告宣传?2.市场调查:–是否进行过市场调查?–是否能根据调查结果做出相应响应?财务管理1.发票管理:–财务部门是否存储所有的发票?–与财务有关的文件和存档是否能够满足 ISO 13485 要求?2.资产管理:–是否定期考察周期?–资产是否建立了统一管理制度。
管理效果评价1.内审评价:–是否进行了内审?–是否根据 ISO 13485 上的要求进行了内审?2.外审评价:–是否进行了外审?–是否根据 ISO 13485 上的要求进行了外审?ISO 13485 是医疗设备生产公司的重要标准,本文档详细说明了各部门的管理要求及鉴别标准,帮助公司进行自我评估,及时发现和解决问题。
ISO13485体系供应商审核检查表

仓储区面积是否与产量相适应?仓储区环境是否符合要求?照明、通风及温湿度控制是否符合要求?
设备
1
设备的设计、选型、安装是否符合生产要求?产能可否满足供货?
2
主要设备是否有经批准的书面的使用、清洁及维护保养SOP?
3
主要设备是否进行设备验证及设备清洁验证?
4
设备是否按要求定期进行计量校验?
5
设备是否具有状态标识?
5
是否对每批产品进行留样?
6
有否产品稳定性考察管理规程?其执行情况如何?
文件管理
1
是否有文件起草、审核、批准及发放、收回、销毁的管理文件?
2
是否有专人进行文件管理?
3
各岗位使用的文售记录?
2
根据销售记录是否可以追查产品的售出情况,并可在必要时及时全部追回?
6
是否具有清场的相关管理规程及其执行情况?
7
是否具有不合格品的管理规程规程及其执行情况?
质量管理
1
质量管理部门是否可独立履行产品放行职责?
2
质量检验室人员及设备配备是否与检验量及项目相适应?
3
有否委托检验项目?是否能够提供委托证明性文件?
4
物料是否按规定的质量标准进行检验?检验过程中的超常、超标
结果是否进行调查?
日 期:
供品名称
供应商名称
地 址
联系电话
邮 编
联系人(职位)
传 真
考察人
考察时间
资
质
情
况
序号
调查内容
结果
优
良
可
1
是否有组织机构图?是否具有相应资质?
2
资质是否齐全?
3
ISO13485内审检查表

ISO13485 内部审核检查表受审核部门标准要求质量管理体系4.1 总要求应建立质量管理体系,形成文件:识别过程及其应用确定过程顺序和作用;确定准则和方法;必要的资源和信息;监视、测量和分析这些过程;实施策划的结果和持续改进;管理过程;外包过程的控制和识别。
4.2 文件要求4.2.1 总则质量管理体系文件应包括:质量方针、质量目标质量手册形成文件的程序所需的文件记录审核日期审核方法记录符合性检查质量体系策划结果。
检查文件清单。
确认标准要求的程序文件是否覆盖。
检查质量体系过程图示。
检查过程描述和过程关系是否符合实际情况。
检查外包过程的描述。
检查质量方针、质量目标、质量手册、程序文件、作业指导书是否形成。
确认文件结构。
国家和地区法规规定的其他请提供 1 个产品的文件要求主文档。
应建立和保持一套文档,包括对每检查主文档内容,一型号/ 类型的医疗器械,产品规范是否覆盖产品规的规定和对以下质量体系( 过程和质范、检验规范、生产规范、图纸等。
量保证) 的要求:----完整生产过程,和----若需要,安全和服务过程或说明这些资料的出处。
注:主文档一般包括:产品规范、生产规范、检验规范、图纸等。
4.2.2质量手册质量手册包括:质量管理体系的范围,包括任何删减的细节与合理性;为质量管理体系编制的形成文件的程序或对其引用;质量管理体系过程之间的相互作用的表述。
质量手册的编制格式不做规定,在现场检查时了解其实际效果。
检查质量手册的裁减描述。
检查质量手册覆盖的产品范围。
质量手册应概述质量管理体系中使用的文件的结构。
4.2.3文件控制质量管理体系所要求的文件应予以控制。
记录是一种特殊类型的文件,应依据 4.2.4的要求进行控制。
应编制形成文件的程序,以规定以下方面所需的控制:a)文件发布前得到评审和批准,以确保文件是充分与适宜的;b)必要时对文件进行评审与更新,并再次批准;c)确保文件的更改和现行修订状态得到识别;d)确保在使用处可获得适用文件的有关版本;e)确保文件保持清晰、易于识别;检查质量手册描述的体系覆盖范围是否能覆盖标准的所有要求。
13485内审检查表
4.2.2
质量手册
询问:手册的内容是否覆盖并符合标准的要求?
公司的手册中有否对标准进行删减?如有,所剪条款是否有说明?说明是否充分、可信?
公司质量手册对组织机构及职能分配描述是否确定且有效?
手册内容对管理的范围及删减的合理性和不适用条款进行了表述。
组织机构已确定,并划分清楚,职责权限已确定。质量手册描述清楚有效。有编制,审核签名并已受控,符合要求。
文件自体系运行以来是否进行了修订?查看修订记录?
外来文件是否均已识别,查看外来文件清单。
查看文件的发放记录?并确定相关部门是否都能得到所需文件。
文件的有效性如何保证?询问、查看相关记录。
查看文件的标识,
规定保留作废文件的要求是否满足标准要求。
所有受控文件均已登入《受控文件汇总表》,从汇总表中随机抽取3份受控文件,有文件编号,有批准人签字,且均加盖了受控章。
审核员的选择和审核的实施是否确保了审核过程的客观性和公正性?有没有审核员审核自己工作的现象?审核员是否经过专门培训、受权、具备相应资格?
现场审核记录是否已反映检查表内容已经检查?对不合格客观事实描述是否清楚,可证实、可追溯?
对现场审核发现的不符合是否开具不合格项,并由受审核部门确认?是否采取措施?对措施的有效性是否进行验证,并有验证结果的报告?
合格
8.1
总则
询问:公司为保证服务质量,质量管理体系的符合性,对所需的监视和测量、数据分析和改进过程如何进行策划。
改进的策划包括哪些方面?
主要以程序的形式进行策划:如风险管理控制程序、反馈和客户满意监测程序、内部审核控制程序、过程和产品的监视和测量程序、不合格品控制程序、数据分析程序纠正/预防措施控制程序等。
已规定了应至少保存一套作废文件的要求及保存期限,满足ISO13485标准要求。
ISO13485:2016内审检查表完整各部门

ISO13485:2016内审检查表(完整各部门)审核员:第1 页共10 页受审部门日期管理者代表总经理审核内容审核方法评价记录标准条款查看体系文件判别是否符合标准规定符合按要求建立文件化的质量管理体系。
1 查,符合标准规定。
2质量管理体系覆盖的产品范围。
4.1质量管检查是否相符。
覆盖的产品范围符合符合理体系总要求查,文件齐全符合3质量管理体系各层次的文件。
检查是否齐全。
符合4质量管理体系的删减。
有没有删减部分,如有则记录有删减合理查文件目录判别各级文件是否齐全。
公司应建立并保持的质量管理体系文件。
1 查,各级文件齐全符合抽查三份文件是否相符查目录,判别是否能满足生产经营的符合2保存的医疗器械的法律、法规。
4.2.1文件满足生产经营的需求需求要求总则相关技术文件3对每一型号的医疗器械建立并保持一套技术文档抽查一套技术文档,检查是否正确、符合。
齐全、清晰,符合生产要求。
质量手册应包括以下内容:符合阐明企业质量管理体系 4.2.2质量检查质量手册,查有没有阐明企业质符合1) 清楚的阐明企业质量管理体系覆盖的范围。
,包含盖覆范围手册YY/T量管理体系覆盖范围,有无缺YY/T0287 专用要求内0287专用要求内容,有没有描述过程2) 应形成文件的程序或对其引用。
符合容,有描述过程及其相及其相互作用。
互作用。
识别企业质量管理体系所需过程及过程之间3) 符合的相互作用的表述。
有质量方针通过查质量记录,作出判断的证据。
1总经理对其建立和改进质量管理体系的承诺。
5.1 符合询问二个现场员工,作出判断总经理将满足顾客要求和法律、法规要求的重要 2 明白满足顾客要求和法符合管理承诺律、法规要求的重要性性传达给组织的成员。
了解顾客要求和法律、与领导层交谈,了解顾客要求和法律法规传过情况以及顾客符合、法规传达情况以及顾客要求得到满确保顾客的需求得到确定并予以满足。
15.2 足的情况要求得到满足。
以顾客为关完全理解顾客和法律法2应完全理解顾客和法律法规要求。
ISO13485内审检查表

了解公司采取了解客户要求的方法和渠道。
了解满足客户的方法和对其的监测。
了解领导采取哪些方法传达法律法规的要求。
检查质量方针和质量目标,核对其关系。
了解领导层提供资源的渠道,如何知道何时提供合适的资源。
对资源利用率如何管理。
了解如何了解顾客要求。
了解如何确定顾客要求。
了解如何评估顾客要求。
了解采取哪些方法满足顾客要求。
了解如何监视顾客满意,客户有意见时采取何种措施。
记录质量方针。
检查质量方针包含的含义。
检查质量目标的可测量性。
检查质量方针的宣贯。
抽查3名员工对质量方针和质量目标的理解。
检查评审质量方针记录。
检查质量目标的分解。核对分解目标和总目标之间的关系。
检查目标的完成情况。
检查质量目标的管理。
现场检查洁净室压差、温湿度、风速。
抽查2份环境全性能检测记录。
现场检查设备布局的合理性。
现场检查工位器具的使用情况。
现场检查制水设备的能力。
记录3次工艺用水全性能检测记录。
现场检查废气废水的排放。
当维护活动或缺少这种维护活动可能影响产品质量时,组织应建立形成文件的维护活动要求,包括它们的频次。
应保持此类维护记录。
支持性服务(如运输或通讯)。
检查资源配置是否充足。
审核管理层资源提供的承诺和落实。
通过实际产品不合格、体系不合格、过程不合格、顾客投诉、产品抽查等确认资源配置。
检查人力资源识别的方法。
检查人力资源的要求。核对其要求和有关法律法规的符合性。
了解最高管理者对法律法规的熟悉程度。
检查技术、生产、质量的管理层的能力。
7.2与顾客有关的过程
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ISO13485内审检查表(完整各部门)内审检查表审核员: 第 1 页 共 10 页受审部门 总经理 管理者代表 审核内容日期 标准条款审核方法记录评价符合 查看体系文件判别是否符合标准规定。
1按要求建立文件化的质量管理体系。
查,符合标准规定4.1质量管 2质量管理体系覆盖的产品范围。
理体系总要求检查是否相符。
覆盖产品范围符合 查,文件齐全 符合 符合 符合 3质量管理体系各层次的文件。
检查是否齐全。
4质量管理体系的删减。
有没有删减部分,如有则记录有删减合理查文件目录判别各级文件是否齐全。
抽查三份文件是否相符1公司应建立并保持质量管理体系文件。
查,各级文件齐全符合 符合查目录,判别是否能满足生产经营的需求4.2.1文件 2保存的医疗器械法律、法规。
要求总则满足生产经营的需求3对每一型号的医疗器械建立并保持一套技术文档 抽查一套技术文档,检查是否正确、 相关技术文件 符合 。
齐全、清晰,符合生产要求。
质量手册应包括以下内容:符合符合 阐明企业质量管理体系覆 盖 范 围 , 包 含YY/T0287 专用要求内容,有描述过程及其相互作用。
4.2.2质量手册检查质量手册,查有没有阐明企业质量管理体系覆盖范围,有无缺YY/T0287专用要求内容,有没有描述过程及其相互作用。
1) 清楚的阐明企业质量管理体系覆盖的范围。
2) 应形成文件的程序或对其引用。
符合 符合 3) 识别企业质量管理体系所需过程及过程之间 的相互作用的表述。
5.1 1总经理对其建立和改进质量管理体系的承诺。
通过查质量记录,作出判断的证据。
有质量方针符合 符合2总经理将满足顾客要求和法律、法规要求的重要 询问二个现场员工,作出判断 明白满足顾客要求和法 律、法规要求的重要性管理承诺性传达给组织的成员。
与领导层交谈,了解顾客要求和法律 了解顾客要求和法律、、法规传达情况以及顾客要求得到满 法规传过情况以及顾客 符合 5.21确保顾客的需求得到确定并予以满足。
2应完全理解顾客和法律法规要求。
足的情况 要求得到满足。
以顾客为关 注焦点完全理解顾客和法律法规的要求抽查二份合同的执行情况。
符合 符合 符合1制定了质量方针,并已在相关层次中传达质量方 检查有无质量方针,在办公室、生针。
产车间能否看到质量方针。
5.3制定了质量方针各层次人员对质量方针 的理解质量方针 2各层次人员对质量方针的理解程度询问二个员工。
1质量目标应与质量方针相一致,质量目标应是 查目标与方针是否一致,查相关职可测量的,并应在相关职能和层次上展开。
能部门有无自己的质量目标。
5.4查目标与方针一致符合各职能部门对质量目标 的完成情况达标 策划 2各职能部门对质量目标的完成情况。
抽查二个部门。
符合 符合 质量策划体现了质量管 理体系的持续改进3质量策划体现了质量管理体系的持续改进。
查质量策划文件。
符合 符合1最高管理者应确保企业内的职责、权限得到规 查组织机构图和部门职责、权限。
最高管理者已规定企业内的职责、权限。
定。
5.5职责、权限和2最高管理者应指定管理者代表并明确其职责和 查管理者代表的任命书和职责、权 最高管理者指定管理者代表,明确其职责和权 符合限沟通权限。
限。
受审部门 总经理 管理者代表 审核内容日期标准条款审核方法 记录 评价符合3最高管理者应确保企业内建立适当的沟通过 检查证实企业内部沟通方式和渠道 查,有内部沟通 程,以确保质量管理体系的有效性。
的文件和记录。
4企业的最高管理者应熟悉国家有关医疗器械的法律、法规,熟悉产品生产技术。
对产品质量负 与高层领导座谈。
5.5职责、 全部责任。
权限和沟 熟悉国家有关医疗器械 的法律、法规。
符合符合通 5各部门负责人及各岗位员工应明确自己的职责、权限及相互关系,了解组织的质量管理体系活 抽查二个员工。
动。
各岗位员工明确自己的 职责。
最高管理者应按策划的时间间隔评审质量管理体系,实施管理评审,以确保其持续的适宜性、充 检查管理评审频次和记录,是否按已规定按策划的时间间分性和有效性,包括评价质量方针、质量目标、 管理评审输入和输出要求进行管理 隔评审质量管理体系,5.6管理评 审 符合实施管理评审,每月进质量管理体系改进的机会和变更的需要。
保持质 评审。
行了工作总结。
量管理评审的记录。
1最高管理者应确保企业质量管理体系资源的获 与领导层座谈,了解资源情况。
资源获得充分和适宜的 符合 符合6.1资源提 得和适宜。
供2提供的资源是否能确保提供的产品达到顾客满 查设备、设施、人员配置。
达到顾客满意意?1企业应制定内部审核计划,规定内部审核的目8.2.2 的、频次、准则(审核依据)、范围、方法、审 检查审核计划、目的、范围、依据 制定内部审核计划,符、审核人员、审核检查表和记录。
合要求。
符合核人员以及审核实施的要求和记录。
2内部审核的结果应采取纠正措施,消除不合格及 检查内审报告,不合格报告,纠正 规定采取纠正措施,验 内部审核符合 符合其原因,应有采取纠正措施验证结果的报告。
措施整改及验证情况。
证。
3审核人员应具有内审员资格,并具备独立性。
查验内审员证书,任职部门。
有内审员证书 1企业应收集与产品质量和质量管理体系运行有关的数据,包括顾客反馈、产品实物质量、市场 检查文件规定。
有关数据及供方信息。
8.4数据分析已进行统计分析符合 符合2企业应采用包括统计技术在内的适当的分析方 检查5份数据分析,了解统计技术 使用了查检表等方法 法,进行数据分析,以寻找改进的机会 使用情况。
1企业应利用质量方针,质量目标,内部和外部审核结果,数据分析,纠正和预防措施以及管理 检查质量目标的实现,质量管理体8.5改进 评审等信息的机会,识别和实施任何必要的改进 系的有效性和产品实物质量改进情 已进行改进。
企业应改进质量管理体系有效性和产品实物质 况。
量,形成自我完善的机制符合符合2 建立忠告性通知发布和实施的形成文件的程 序 。
并 应 能 随 时 实 施 这 些 程 序.如果国家或地方法规要求对符合规定的报告准则 检查是否建立了通告和报告制度。
建立了通告和报告制度 的不良事件发出通告,组织应对告知行政主管部 门的通告建立形成文件的程序。
3 保持所有顾客抱怨调查的记录。
当顾客抱怨的调查确定是在组织之外开展的活动导致了顾客 检查预防措施实施情况。
的抱怨,则相关资料应在所涉及的组织之间传递无顾客抱怨 符合符合4 当任何顾客抱怨没有采取预防和/或纠正措 检查顾客抱怨采取预防和/或纠正 顾客抱怨 施,则其理由应予以批准并记录 措施的实施情况 。
受审部门 仓库日期标准条款审核内容审核方法 记录 评价1企业应制定产品标识和可追溯性文件。
提供包 检查产品标识(标识的内容、标识7.5.3.1标 识括标识的内容、标识的位置、标识的方法的产品 的位置、标识的方法)以及可追溯 已制定〈标识和可追溯性控制程序〉 符合标识的规定。
程度和范围的规定。
2 对原材料、半成品、成品分别使用产品标识卡 、工序卡、产品标签等标识其名称、规格以避免不同类型的产品混淆。
同时使用标签、标识牌、 检查现场标识和追溯状态。
区域划分等明确相应产品待检、合格、不合格的 检验状态,以防止生产过程中不同产品和不合格 品的误用,并实现产品的追溯性要求。
检查现场标识和追溯状态,符合要求。
符合7.5.3.2.1 3 建立可追溯性的形成文件的程序。
该程序应规已制定〈标识和可追溯 性控制程序〉可追溯性总则定产品可追溯性的范围和程度和所要 求的记录 查看文件符合符合4 在有可追溯性要求的场合,组织应控制和记录 察看现场,从成品库中抽产品进行产品的唯一性标识 追踪,产品有唯一性标识5 根据监视和测量要求,识别产品的状态。
在产品的生产、贮存、安装和服务的全过程中保持产品状态标识,以确保只有通过所要求检验和试验(或在授权让步下放行)的产品才能被发送、使用或安装。
7.5.3.3状态标识查看产品出货或出库时的状态 已识别产品的状态 符合1产品应有包装设计文件、工艺文件,包装应满 检查产品包装、设计和标识。
满足产品质量要求和法 规要求符合符合足产品质量要求和法规要求。
使用说明书、检验合格2产品应有符合医疗器械法规要求的使用说明书 检查产品使用说明书、合格证和外 证符合医疗器械法规要 、检验合格证。
外包装符合标准要求。
包装。
求。
外包装符合标准要求7.5.5产品3企业的仓库应满足产品有效期限和贮存条件的 检查仓库管理制度及实施情况。
满足产品有效期限和贮 存条件。
符合符合防护 要求并保持记录。
4对返回产品应建立进行处理的专用要求,以防止污染其他产品、生产环境和人员。
检查管理文件及其实施情况。
无返回产品5 提供产品搬运、交付和运输的规定要求,以确 检查文件规定。
检查,有文件规定 符合保产品质量。
受审部门 办公室人事 日期标准条款审核内容审核方法 记录评价1生产企业应至少建立、实施保持以下程序文件:按要求建立手册/程序/作业指导文件等作业控制文 检查 文件。
件符合 有按要求建立手册/程序 /作业指导文件等作业控 制文件。
符合 符合2按文件控制程序,对与质量有关的文件(包括质量体系文件、产品技术文件及相关的管理文件)进行控制。
4.2.3文件控制 按文件控制程序进行控 制检查3份质量管理体系文件,1)文件发布前应得到批准以确保其适宜和充分性。
必要时对文件进行评审和更新并再次批准。
符合 符合2)企业受控文件的修订状态应能得到识别(可通过文件编号、控制清单修订一览表等方式识别)。
检查受控文件(受控文件清单)。
有受控章/版本号识别3)控制文件的分发和回收,确保在现场使用有效 检查文件的发放和回收记录。
有文件的发放和回收记 录符合 符合版本文件。
4)确保有关医疗器械法规文件和其它外来文件的 检查医疗器械法规文件和外来文件清 已收集医疗器械法规文 识别、控制与分发。
单。
件 5)至少保存一份作废的受控文件并确定其保存期限,保留的作废文件要进行适当标识以防止非予期 检查是否保存作废文件。
使用。
目前无作废文件符合符合按质量记录控制程序,对记录进行控制,制订记录4.2.4记录 目录清单或样式,规定记录的标识、贮存、保管、 检查质量记录的管理规定,抽查5份 对记录进行控制控制检索、处置的职责和要求,确定记录的保存期限, 质量记录。
并能识别产品的生产数量和销售数量。
1应建立生产、技术和质量管理部门,配备与批量 生产相适应的专业技术人员和具有组织能力的管理 人员,明确各职能部门和人员的职责、权限。
生产企业应具有与批量生产能力相适应的生产场地、工 查组织机构图和岗位说明书。
作环境、生产设备及相关监视测量设备。
生产场地 和工作环境应符合国家有关法律、法规和相关技术 标准的要求。
