流式细胞仪上机培训手册(仅供参照)
流式细胞仪培训手册(完成版)_图文

流式细胞仪培训手册序论学习仪器的最好方法是操作仪器,然而在理解原理的基础上进行仪器操作无疑会起到事半功倍的作用。
本书介绍了流式细胞仪的基本知识,并从不同角度详尽阐述了各种台式机(FACScanTM , FACSortTM , FACSCaliburTM ,和 BD LSR与大型机(FACS VantageTM, FACSVantageTM SE, 和 FACStarPLUSTM 之间的不同。
阅读本书有助于增强读者操作仪器的动手能力和经验。
目录第 1章综述…………………………………………………………………… 4 第 2章液流系统………………………………………………………………第 3章散射光信号及荧光信号………………………………………………3.1 散射光信号………………………………………………………3.2 荧光信号…………………………………………………………3.3 荧光补偿第 4章光电系统………………………………………………………………4.1 光平台……………………………………………………………4.2 光学滤片………………………………………………………4.3 信号探测器……………………………………………………4.4 阈值………………………………………………………………第 5章数据分析………………………………………………………………5.1 数据采集及显示…………………………………………………5.2 设门………………………………………………………………5.3 细胞亚群的数据分析…………………………………………5.4 流式细胞仪其它应用的数据分析………………………………5.5 CellQuest软件使用……………………………………………5.6 MutiSet 软件使用………………………………………………5.7 Simultest 软件使用……………………………………………5.8 B27软件使用…………………………………………………5.9 WinMDI软件使用…………………………………………5.10 FACSPress软件使用…………………………………………5.11 System II软件使用…………………………………………5.12 MultiCycle软件使用…………………………………………5.13 Modfit使件使用……………………………………………第 6章流式基本检测项目6.1淋巴细胞亚群检测 (双色、三色、四色,三种软件分析6.2 B27的检测………………………………………………………6.3 血小板抗体检测………………………………………………6.4 网织血小板及红细胞分析……………………………………6.5 干细胞检测……………………………………………………6.6 DNA倍体分析……………………………………………………6.7 凋亡检测…………………………………………………………第 7章分选6.1 分选………………………………………………………………第 8章激光器及光路校正……………………………………………………7.1 激光器的工作原理………………………………………………7.2 光路校正…………………………………………………………第 9章答案………………………………………………………………第一章综述流式细胞术是一项快速检测分析单个粒子多物理特性的高技术,通常指细胞通过激光束时在液流中的特性,即粒子的大小,密度或是内部结构,以及相对的荧光强度。
Get清风BDFACSCalibur流式细胞仪培训手册

BD-FACSCalibur流式细胞仪培训手册BD FACSCalibur流式细胞仪FACS101 Handbook二、开机、关机标准操作2.1 FACS Calibur 开机1. 开启细胞仪电源。
2. 开启其它周边配备电源,如打印机及MO机。
3. 开启计算机。
4. 确认鞘流液筒有八分满的FACSFlow,确实旋紧(鞘液筒容量为4L)。
5. 将废液倒掉,并在废液筒中参加200ml 家用漂白水(废液筒容量为4L)。
6. 将减压阀方向调在加压〔Pressurize〕位置。
7. 排除液流管路与过滤器中的气泡。
8. 取下样品管,执行PRIME 功能两次。
9. 使用1ml PBS,HIGH RUN 两分钟。
10. 可开始分析样品。
2.2 FACS Calibur 关机关机前必要动作:清洗进样管和外套管,防止进样管堵塞、或有染料残留。
1. 将样品支持架左移,取2 mlFACSClean〔10%Bleach〕上样品,让仪器的真空系统抽取约 1 ml 的液体。
2. 将样品支持架回正,按HI RUN,然后让FACSClean 清洗管路10分钟。
3. 按Standby,取下样品管,执行PRIME功能两次。
4. 取2 ml dH2O,重复上述步骤1-3。
5. 注意最后只留约1 ml dH2O 在试管中。
6. 按STANDBY 五分钟,使风扇冷却雷射后,关闭细胞仪〔必要动作,以保护雷射光源。
〕7. 倒掉废液,并回填200 ml漂白水。
8. 将减压阀放在「VENT 漏气」位置。
将鞘流液筒充填至八分满。
9. 退出软件“File〞→“Quit〞(如有对话选项,选择“Don‘t save〞)。
确认退出计算机中所有BD应用软件,所有数据数据已储存备份。
10. 关闭计算机。
“Special〞→“Shutdown〞。
三、上机分析流程建议首次试机防止进行大量试验,仅需准备以下样品。
〔1〕Negative Control〔不加任何抗体〕。
BDFACSCalibur流式细胞仪操作手册

BD FACSCalibur流式细胞仪FACS101 Handbook本课程介绍「表面抗原流式分析」有关之基础工作原理。
如希望进一步了解流式细胞技术应用,请至本公司网站订阅FACSinformation电子报。
如需要本课程手册,欢迎至本公司网站下载。
如需要免疫荧光染色方法,请至本公司网站下载。
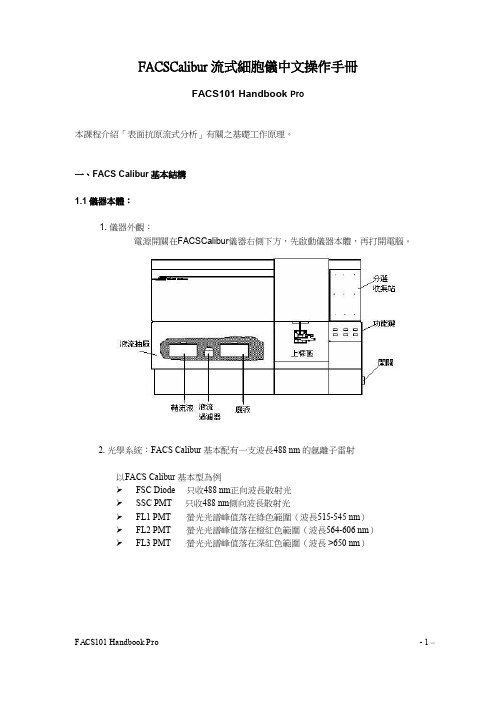
一、BD FACSCalibur基本结构1.1仪器本体:1. 电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机。
2. 光学系统:BD FACSCalibur 基本配有一支波长488 nm 的氩离子雷射以BD FACSCalibur 基本型为例➢FSC Diode 只收488 nm波长散射光➢SSC PMT 只收488 nm波长散射光➢FL1 PMT 荧光光谱峰值落在绿色范围(波长515-545 nm)➢FL2 PMT 荧光光谱峰值落在橙红色范围(波长564-606 nm)➢FL3 PMT 荧光光谱峰值落在深红色范围(波长 >650 nm)3. 仪器面板:仪器前方面板的右下方有三个流速控制键、及三个功能控制键。
流速控制:LO:样品流速:12 μl /minMED:样品流速:35 μl /minHI: 样品流速:60 μl /min功能控制:•RUN:此时上样管加压,使细胞悬液从进样针进入流动室。
(正常显示绿色;黄色时表示仪器不正常,请检查是否失压。
)•STANDBY:无样品或暖机时之正常位置,此时鞘液停止流动,雷射功率自动降低。
•PRIME:去除流动室中的气泡,流动室施以反向压力,将液流从流动室冲入样品管,持续一定时间后,以鞘液回注满流动室。
PRIME 结束,仪器恢复STANDBY状态。
4. 储液箱抽屉:在主机左下方之储液箱抽屉。
可向前拉开,内含鞘流液筒、废液筒、鞘液过滤器Sheath Filter,及空气滤网 Air filter。
请注意气路减压阀VENT TOGGLE之位置。
EPICS-XL流式细胞仪培训资料

注意: 1.
2. 4. 5. 6.
即使每天工作 24 小时,也至少要关机一次 重新启动激光必须在仪器关闭 30 分钟之后 每 2 周~4 周清洗一次空气滤膜 每月清洗鞘液盒一次 每 60 天清洗清洁液盒一次
- 28 -
XL 培训教程
建立方案(PROTOCOL)的方法
• 方案(PROTOCOL)的定义
FL2-X%FL1
放大 放大
- 19 -
分析
XL 培训教程
颜色补偿判断标准: 未作颜色补偿
补偿后
- 20 -
XL 培训教程
- 21 -
XL 培训教程
颜色补偿总结
- 22 -
XL 培训教程
单细胞悬液
标本制备
外周血 骨髓 培养细胞 组织:机械法、酶法
标本浓度
单细胞悬液
106/ml 正常全血
抗凝剂
第五课时
7,ListMode, Multigraph, PCX, Color_Tracker, AutoGate, Logical Gate 等软件功能介绍及练习 (1~2hr)
8,免疫荧光(三标记),示范及练习(1~2hr)
第六课时 9,质控品、自动质控程序及质控数据库介绍:
FlowCheck,FlowSet,CytoTrol,ImmunoTrol, FlowCount,StemTrol
操作步骤:1. 2.
将漂白水(建议使用花王漂白液)与双蒸水 1:1 稀 释,放入 12X75 的试管内 准备 3ml 双蒸水放入 12X75 试管内
- 26 -
XL 培训教程
3. 在 Acquisition 状 态 栏 下 选 择 PANEL-Cleaning Panel
流式细胞仪培训

流式细胞仪培训流式细胞技术流式细胞技术是一种定量分析技术。
定量测量在细胞生物学中之所以重要,是因为要想鉴别出一个细胞群体,主要是依据细胞特殊标记物的数量,而不仅是依据标记物的存在与否。
多参数相关分析可以对细胞固有的性质,例如光散射的测量与定量测定细胞的特征如表面受体、和DNA 同时进行。
当然,必要时还可同时再测定胞浆内抗原、核内抗原等等。
这样,就有可能从一个复杂的细胞混合体中,识别出某一个特定的细胞亚群。
由于只有对大量的细胞进行测量才能发现稀有的亚群并把它分选出来,所以快速测量是必需的。
这里所谓分选即流式细胞分选术,是根据所测定的各种细胞性质的不同组合,从细胞群体中将某个亚群分选出来,以对它进行功能研究、形态学研究、进一步培养或做其它的分析。
流式细胞仪的工作原理流式细胞仪就是进行流式细胞分析的仪器,它集电子技术、计算机技术、激光技术、流体理论于一体,是一种非常先进的检测仪器。
流式细胞仪一般都包括液流系统、光学系统和电子系统,某些机型还可选配分选系统。
待测样本中的细胞经液流系统传送依序地通过流式细胞仪中激光照射的区域,细胞受激光的激发产生信号,被信号接收器接受并放大,这些放大了的信号经计算机分析处理,并以图表的形式直观地显示出来;通过分选系统还可以将某些类型的细胞群体筛选出来。
流式细胞仪产生并分析的信号主要有光散射信号和荧光信号。
光散射信号的强弱可以反映细胞的大小、形态及胞浆颗粒化的程度等。
依荧光素的不同,用不同波长的光激发,发射出不同波长的荧光,可显示不同的颜色,在不同的实验体系中,这些荧光信号就可以反映不同的细胞生物学特性。
将待测细胞染色后制成单细胞悬液。
用一定压力将待测样品压入流动室,不含细胞的平衡缓冲液在高压下从鞘液管喷出,鞘液管入口方向与待测样品流成一定角度,这样,鞘液就能够包绕着样品高速流动,组成一个圆形的流束,待测细胞在鞘液的包被下单行排列,依次通过激光照射区 (液柱与入射的激光束垂直相交点称为检测区),被荧光染色的细胞受强烈的激光照射后发出各色荧光,同时产生光散射。
FACSCalibur流式细胞仪中文操作手册
5. 上樣區: 上樣區是樣本管的上樣位置。它包括三個部 分,一個是進樣針 Sample Injection Tube,將 樣本輸入流動室,還有就是支撐架 Tube Support Arm、和液滴存留系統 Droplet Containment System。 進樣針:是一根不鏽鋼管,將細胞從樣本針中吸入流動室。進樣管外有一套管, 是液滴保留系統的一部分。 支撐架:用於支撐樣本管、並負責啟動液滴存留系統。支撐架有三個位置:位於 樣本管之下的中位,樣本管左側或右側。 液滴存留系統:系統由支撐架、真空幫浦和外套 管組成。當支撐架位於左側或右側位置時,真空 幫浦就會啟動,將液體從外管吸入廢液桶內。上 樣時,須注意將支撐架位於中位,以避免過多樣 品被抽吸到廢液筒內(當支撐架位於中位,真空 幫浦停止工作)。更換樣品時,讓儀器保持 RUN 的模式,使得進樣針可以反沖;切換到 STANDBY 模式前,確保液路已沖洗徹底以免碎片沈積到流 動室中。
FACS101 Handbook Pro
-7–
4. 從 Acquire 功能表中選擇 Connect to Cytometer,建立儀器和電腦之間通訊。此時 會出現 Browser 方框。將之移至適當位置。
5. 從工具板中點擊散點圖圖示。在實驗文件的空白區點擊,拖曳對角線至適當大小, 然後放開滑鼠。此時應可以在右方看到 Inspector:Dot Plot 對話框。
FACS101 Handbook Pro
-8–
6. 從螢幕上方 Edit 功能表中選擇 Duplicate 功能,可複製一個同樣大小的散點圖,完 成後可將重製圖移至原圖右方。
7. 從螢幕上方 Edit 功能表中選擇 Select All 功能,文件中所有圖譜的四角會出現黑色 方塊,表示被選取。可在出現之 Inspector:2 Objects 方框中將 Plot Type 改成 Acquisition。 8. 因應實驗需求來修改所有圖譜中顯示之參數。第一圖 X 和 Y 軸參數分別設為 FSC-H 1024、SSC-H 1024;第二圖 X 和 Y 軸參數分別設為 FL1-H 1024、FL2-H 1024。 修改動作為輕擊圖譜,並在出現之 Inspector 方框依需要選擇。 FSC:細胞大小 SSC:細胞顆粒性 FL1:FITC 綠色螢光 FL2:PE 橙色螢光 FL3:PerCP 紅色螢光 儀器設定 注意:實驗數據品質,取決於最適化儀器設定。儀器設定文件不能在數據收取後再更 改,研究人員必須在第一次就使用正確的儀器設定。 儀器設定(Instrument settings),含偵測器電壓(Detector/ Amps),閾值 (Threshold),螢光補償(Compensation)等儀器條件的組合。一般而言,儀器設 定的順序為 Detector/Amps -- Threshold -- Compensation。
流式细胞仪上机培训手册

流式细胞仪上机操作培训手册一、样本处理以PBMC表面抗原的流式检测步骤为例1)取样。
取新鲜提取或冻存后复苏的PBMC;2)编号。
根据实验设计,标记好流式管,如每份PBMC设两管:a)1号管:相应同型对照;b)2号管:CD3,CD4,CD8,CD56四标管;3)加样。
用移液器取100ul细胞/管(约1×106个细胞/管),分别加到已经标记好的流式管底部;4)洗涤。
加入1ml PBS/管,涡旋1600rpm/min,离心6min;5)染色。
弃上清,加入100 μl PBS/管涡旋混匀细胞,并根据实验设计,向各流式管中加入相应的荧光素标记抗体,混匀,室温避光孵育30min(操作尽量保持在避光条件下进行。
)6)洗涤。
加入1ml PBS/管,涡旋1600rpm/min,离心6min;7)重悬。
弃上清,加入0.5ml PBS/管,混匀,上机检测(可选择BD FACSCantoII或BD Accuri C6)。
(注:若不能及时上机,应加入4%多聚甲醛固定,并于4℃避光保存。
)8)试验结果分析。
(注:实验过程中如果进行多色标记,需要调节荧光补偿)。
参考值:二、上机检测BD FACSCanto II简要操作流程启动流式细胞仪1 打开流式细胞仪电源2 启动计算机,打开软件登录3 确保软件连接到流式细胞仪必要时,点击Cytometer > connect检查液体水平1 启动流式细胞仪后,检查液体水平低液面水平或者废液桶满都用红色指示。
2 如果液流车未自动开启,选择Cytometer > Fluidics Startup。
3 当液流启动完成后,点击OK关闭对话框。
检查气泡1 在检查完液体水平后,开启流动室门,检查流动室中是否有气泡。
2 如果没有看到气泡,进行第5步。
如果看到气泡,点击Cytometer > CleaningModes >De-gas Flow Cell.3 当完成信息出现后,点击OK。
流式细胞仪操作指南手册BD_FACSCalibur中文培训手册

目 录第一章流式细胞仪简介 (1)1.1 流式细胞术发展史 (1)1.2 流式细胞仪构造和工作原理 (2)1.2.1 概述 (2)1.2.2 流式细胞仪构造 (2)1.3 流式细胞仪的主要技术指标 (10)第二章 FACSCalibur 的日常操作 (12)2.1 FACSCalibur系统 (12)2.2 FACSCalibur开机程序 (15)2.3 FACSCalibur关机程序 (16)2.4 FACSCalibur的维护与保养 (17)2.4.1 FACSCalibur的每月维护 (17)2.4.2 FACSCalibur的定期维护 (18)2.5 常见故障排除 (20)第三章 FACSComp软件 (22)3.1 FACSComp简介 (22)3.1.1 FACSComp运行条件 (22)3.1.2 FACSComp的文件类型 (23)3.2 FACSComp的功能 (24)3.2.1 光电倍增管(PMT)电压的调节 (24)3.2.2 荧光补偿的调节 (24)3.2.3 灵敏度的测试 (24)3.2.4 时间延迟的校准(对于双激光,配有FL4 PMT) (25)3.2.5 HLA-B27的校准 (25)3.2.6 LeucoCOUNT (25)3.2.7 优化 (25)3.3 FACSComp的运行 (25)3.3.1 CaliBRITE Beads的准备 (25)3.3.2 软件环境的设置 (26)3.3.3 Beads的检测 (26)3.3.4 Optimization (28)第四章 FACStation 数据管理系统 (30)4.1 FACStation 数据管理系统组成 (30)4.2 FACStation文件组成 (31)4.2.1 如何建立文件夹 (31)4.2.2 FACStation文件的类型 (31)4.2.3 如何管理文件 (32)4.3 实用的Macintosh OS X功能 (34)4.3.1 菜单栏 (35)4.3.2 Dock (37)4.3.3 查找窗口 (37)4.3.4 键盘快捷键 (38)4.4 如何设置模版 (39)4.5 实验练习:如何将ModFit LT的别名添加到Dock菜单下 (40)4.6 可选性存储装置 (40)4.6.1 可选性存储装置的基本工作原则 (40)4.6.2 光驱的维护 (41)4.6.3 光盘的维护 (41)第五章 CellQuest Pro软件 (42)5.1 概述 (42)5.1.1 获取(Acquisition) (42)5.1.2 分析(Analysis) (42)5.1.3 从获取到分析(Acquisition Analysis) (42)5.2 工具栏 (42)5.3 CellQuest Pro 的文件 (43)5.3.1 FCS数据文件 (43)5.3.2 实验文件 (44)5.3.3 仪器条件文件 (44)5.3.4 统计文件 (44)5.4 CellQuest Pro 的仪器控制 (44)5.4.1 探测器 (45)5.4.2 放大器 (45)5.4.3 阈值 (46)5.4.4 补偿 (46)5.6.1 质控-运行FACSComp (48)5.6.2 优化 (50)5.6.3 调出储存的由FACSComp 生成的仪器条件 (52)5.6.4 调节FSC/SSC探测器(电压)及FSC阈值 (53)5.6.5 设置淋巴细胞Region (53)5.6.6 调节FL1、FL2、FL3的探测器(电压) (53)5.6.7 调节荧光补偿 (55)5.7 实验练习:3色/4色预获取 (55)5.7.1 设置Acquisition & Storage 窗口 (56)5.7.2 设置Parameter Description (57)5.7.3 编辑Reagent Panel (58)5.8 实验练习:数据获取 (59)5.9 储存、恢复仪器设置 (60)5.9.1 储存仪器设置 (60)5.9.2 恢复仪器设置 (60)5.10 储存实验模板文件 (60)5.11 练习:数据分析 (60)5.11.1 画Region (61)5.11.2 限定象限marker (61)5.11.3 分析四色 (63)5.11.4 批分析其余数据 (63)5.11.5 分析数据 (64)5.11.6 将分析文件以模板形式保存 (64)5.11.7 创建文具簿(stationery pad) (64)5.11.8 将统计改为电子表格 (65)5.12 Regions 和Gating(画门) (65)5.12.1 设置Region (65)5.12.2 改变Region (65)5.12.3 用Region 统计来分析数据 (66)5.12.4 门 (66)5.12.5 多色门 (66)5.12.6 组合门 (67)5.12.7 在直方图上使用组合门分析 (68)收集系统6.1.2 分选模式 (70)6.2 分选窗口 (71)6.2.1 Sort Setup (71)6.2.2 Sort Counters (72)6.3 准备收集管 (72)6.4 分选 (73)6.4.1 清洗分选管线 (73)6.4.2 准备 (73)6.4.3 收集分选前数据 (74)6.4.4 分选条件设置 (74)6.4.5 分选目的细胞 (74)6.4.6 清洗分选管路 (75)6.4.7 浓缩样本 (76)6.5 检验分选纯度 (76)6.6 分选问题讨论 (77)6.7 FACSCalibur无菌分选 (79)6.8 分选细胞浓缩系统 (80)6.8.1 系统简介 (80)6.8.2 细胞培养基嵌入物和滤膜的制备 (81)6.8.3 确定气压参数 (82)6.8.4 如何用细胞浓缩系统进行分选 (82)6.8.5 分选浓缩细胞 (84)6.8.6 从分选管路中回收细胞 (84)6.8.7 回收细胞做进一步分析 (85)6.8.8 清洗分选管路 (85)6.8.9 清洗浓缩器 (85)第七章 DNA分析 (87)7.1 概述 (87)7.2 细胞周期 (87)7.3 DNA检测的常用术语 (87)7.3.1 Coefficient of Variation(CV):变异系数 (87)7.4.1 分辨率(CV) (88)7.4.2 线性度 (88)7.4.3 碎片 (88)7.4.4 细胞双粘体 (89)7.5 DNA质量控制(DNA QC Particles) (89)7.5.1 样本制备 (89)7.5.2 上机检测 (89)7.5.3 常见错误排除 (90)7.6 用CellQuest Pro软件获取DNA 数据 (91)7.6.1 样本制备 (91)7.6.2 用CellQuest Pro软件上机获取数据 (92)7.6.3 质量控制 (95)7.7 用ModFit 软件分析DNA数据 (95)7.7.1 运用ModFit 进行自动分析 (96)7.7.2 运用ModFit 进行手动分析 (96)7.7.3 运用ModFIT进行同步化分析 (98)7.7.4 运用ModFIT 进行增殖分析 (98)第八章 HLA-B27分析 (99)8.1 检测HLA-B27的意义 (99)8.2 HLA-B27的检测方法 (99)8.2.1 传统方法 (99)8.2.2 流式细胞术 (100)8.2.3 试剂盒介绍 (100)8.2.4 实验原理 (100)8.2.5 样本的收集和准备 (101)8.2.6 流式检测 (102)8.3 质量控制 (110)附录1:组织相容性抗原和疾病的关系 (111)附录2:强直性脊柱炎——一个常见但易被忽略的疾病 (112)第九章 MultiSET软件 (113)9.1 简介 (113)软件内容9.4.1 MultiSET界面功能分区 (116)9.4.2 MultiSET命令菜单 (116)9.4.3 MultiSET实验报告 (117)9.4.4 MultiSET运行程序 (117)9.5 利用Multiset软件的Tools和Preferences (126)9.6 Control Panels (绝对计数质控) (128)9.7 MultiSET画门及Attractor方案 (128)9.8 注意事项及常见问题处理 (129)第十章练习题 (135)10.1 补偿 (135)10.2 流式简介 (135)10.3 CellQuest 获取与分析 (136)10.4 分选 (139)第一章流式细胞仪简介1.1 流式细胞术发展史纵观历史,几乎没有哪一门科学技术象流式细胞术这样凝结了众多不同学术背景、不同科研领域的科学家的心血。
BDFACSCalibur流式细胞仪操作手册

BD FACSCalibur流式细胞仪FACS101 Handbook本课程介绍「表面抗原流式分析」有关之基础工作原理。
如希望进一步了解流式细胞技术应用,请至本公司网站订阅FACSinformation电子报。
如需要本课程手册,欢迎至本公司网站下载。
如需要免疫荧光染色方法,请至本公司网站下载。
一、BD FACSCalibur基本结构1.1仪器本体:1. 电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机。
2. 光学系统:BD FACSCalibur 基本配有一支波长488 nm 的氩离子雷射以BD FACSCalibur 基本型为例➢FSC Diode 只收488 nm波长散射光➢SSC PMT 只收488 nm波长散射光➢FL1 PMT 荧光光谱峰值落在绿色范围(波长515-545 nm)➢FL2 PMT 荧光光谱峰值落在橙红色范围(波长564-606 nm)➢FL3 PMT 荧光光谱峰值落在深红色范围(波长 >650 nm)3. 仪器面板:仪器前方面板的右下方有三个流速控制键、及三个功能控制键。
流速控制:LO:样品流速:12 μl /minMED:样品流速:35 μl /minHI: 样品流速:60 μl /min功能控制:•RUN:此时上样管加压,使细胞悬液从进样针进入流动室。
(正常显示绿色;黄色时表示仪器不正常,请检查是否失压。
)•STANDBY:无样品或暖机时之正常位置,此时鞘液停止流动,雷射功率自动降低。
•PRIME:去除流动室中的气泡,流动室施以反向压力,将液流从流动室冲入样品管,持续一定时间后,以鞘液回注满流动室。
PRIME 结束,仪器恢复STANDBY状态。
4. 储液箱抽屉:在主机左下方之储液箱抽屉。
可向前拉开,内含鞘流液筒、废液筒、鞘液过滤器Sheath Filter,及空气滤网 Air filter。
请注意气路减压阀VENT TOGGLE之位置。
BD FACSCalibur流式细胞仪培训手册

BD FACSCalibur流式细胞仪FACS101 Handbook本课程介绍「表面抗原流式分析」有关之基础工作原理。
如希望进一步了解流式细胞技术应用,请至本公司网站订阅FACSinformation电子报。
如需要本课程手册,欢迎至本公司网站下载。
如需要免疫荧光染色方法,请至本公司网站下载。
一、BD FACSCalibur基本结构1、1仪器本体:1。
电源开关:在BD FACSCalibur仪器右侧下方,先启动仪器本体,再打开计算机。
2。
光学系统:BD FACSCalibur基本配有一支波长488 nm 得氩离子雷射以BD FACSCalibur基本型为例➢FSC Diode 只收488 nm波长散射光➢SSCPMT 只收488 nm波长散射光➢FL1PMT荧光光谱峰值落在绿色范围(波长515—545 nm)➢FL2PMT 荧光光谱峰值落在橙红色范围(波长564—606nm)➢FL3 PMT 荧光光谱峰值落在深红色范围(波长>650nm)3. 仪器面板:仪器前方面板得右下方有三个流速控制键、及三个功能控制键。
流速控制:LO: 样品流速:12 μl/minMED:样品流速:35 μl /minHI: 样品流速:60μl /min功能控制:•RUN:此时上样管加压,使细胞悬液从进样针进入流动室。
(正常显示绿色;黄色时表示仪器不正常,请检查就是否失压、)•STANDBY:ﻩ无样品或暖机时之正常位置,此时鞘液停止流动,雷射功率自动降低、•PRIME:去除流动室中得气泡,流动室施以反向压力,将液流从流动室冲入样品管,持续一定时间后,以鞘液回注满流动室。
PRIME结束,仪器恢复STANDBY状态。
4、储液箱抽屉:在主机左下方之储液箱抽屉。
可向前拉开,内含鞘流液筒、废液筒、鞘液过滤器Sheath Filter,及空气滤网 Airfilter、请注意气路减压阀VENTTOGGLE之位置、•鞘液筒:位于抽屉左侧,容积4升、装八分满鞘液筒,仪器可以运行大约3小时。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
流式细胞仪上机操作培训手册
一、样本处理
以PBMC表面抗原的流式检测步骤为例
1)取样。
取新鲜提取或冻存后复苏的PBMC;
2)编号。
根据实验设计,标记好流式管,如每份PBMC设两管:
a)1号管:相应同型对照;
b)2号管:CD3,CD4,CD8,CD56四标管;
3)加样。
用移液器取100ul细胞/管(约1×106个细胞/管),分别加到已经标记
好的流式管底部;
4)洗涤。
加入1ml PBS/管,涡旋1600rpm/min,离心6min;
5)染色。
弃上清,加入100 μl PBS/管涡旋混匀细胞,并根据实验设计,向各流
式管中加入相应的荧光素标记抗体,混匀,室温避光孵育30min(操作尽量保持在避光条件下进行。
)
6)洗涤。
加入1ml PBS/管,涡旋1600rpm/min,离心6min;
7)重悬。
弃上清,加入0.5ml PBS/管,混匀,上机检测(可选择BD FACSCanto
II或BD Accuri C6)。
(注:若不能及时上机,应加入4%多聚甲醛固定,并于4℃避光保存。
)8)试验结果分析。
(注:实验过程中如果进行多色标记,需要调节荧光补偿)。
参考值:
二、上机检测
BD FACSCanto II简要操作流程启动流式细胞仪
1 打开流式细胞仪电源
2 启动计算机,打开软件登录
3 确保软件连接到流式细胞仪
必要时,点击Cytometer > connect
检查液体水平
1 启动流式细胞仪后,检查液体水平
低液面水平或者废液桶满都用红色指示。
2 如果液流车未自动开启,选择Cytometer > Fluidics Startup。
3 当液流启动完成后,点击OK关闭对话框。
检查气泡
1 在检查完液体水平后,开启流动室门,检查流动室中是否有气泡。
2 如果没有看到气泡,进行第5步。
如果看到气泡,点击Cytometer > Cleaning Modes > De-gas Flow Cell.
3 当完成信息出现后,点击OK。
4 如果还可以看到气泡,重复上述操作。
注意:如果打开流动室细胞进口门时出现错误信息,通过关闭进口门,并等待30秒关闭该信息。
5 当您完成上述操作后,在往下进行之前请先检查激光预热是否已经完成。
创建实验
1 按照需要,在工作区工具栏中点击相应的按钮来显示浏览器、细胞仪、检测器、工作表、获取控制板和双指数编辑器窗口。
2 创建文件夹:
A 在浏览器中选择数据库图标,并点击浏览器工具栏上的New Folder。
B 对该文件夹命名。
3 选择该文件夹,点击New Experriment来创建一个新实验。
4 对该实验进行重命名。
5 选择实验级别的细胞仪设置,然后点击Inspector(检测器)中的Parameters(参数)选项卡。
6 按照需要变更,添加或者删除参数。
