中南大学2010物理化学(下)考试
2010下学期物理化学Ⅰ-1试卷

中南大学考试试卷(A)2010 -- 2011 学年 一 学期 时间100分钟物理化学Ⅰ-1 课程 48 学时 3 学分 考试形式: 闭 卷专业年级: 粉体、材化、化工、应化、制药、矿物、无机等09级 总分100分,占总评成绩 70 %注:此页不作答题纸,请将答案写在答题纸上一、单项选择题(每题2分,共20分)1. 下列物理量中,不属于体系性质的是 ( ) (A) -p d V (B) –p 外d V (C) U + pV (D) U - pV2. 在一恒温的刚性密闭容器中,若有某化学反应发生,则必有 ( ) (A) ∆U = 0 (B) ∆S > 0 (C) ∆G < 0 (D) ∆A < 03. 以下对可逆过程的叙述中,不正确的描述是 ( ) (A) 可逆过程中体系总是处于平衡态 (B)可逆过程发生后环境无任何变化(C) 可逆过程体系对外作最大功 (D)是一种理想过程,实际中没有真正的可逆过程4. 标准压强下,将1kg 0℃的冰投入一个水温为0℃的池塘中直至全部融化,则有 ( ) (A) ∆U = 0 (B) ∆S = 0 (C) ∆G = 0 (D) ∆A = 05. 下列偏微分中是偏摩尔量的是 ( ) (A) i j ,,≠⎪⎪⎭⎫ ⎝⎛∂∂n p T i nT (B) i j ,,≠⎪⎪⎭⎫ ⎝⎛∂∂n p T i nH (C) in p T ≠⎪⎪⎭⎫ ⎝⎛∂∂j ,,i np (D) i j ,,≠⎪⎭⎫ ⎝⎛∂∂n p T H V6. 对稀溶液,下列说法中正确的是 ( ) (A) 溶剂的饱和蒸气压必降低 (B) 沸点必升高 (C) Δmix U = 0,Δmix H = 0 (D) 凝固点必降低7. 化学反应达到平衡时,必有 ( ) (A) Δr G m Θ=0 (B) Δr G m =0 (C) Δr S m = 0 (D) Δr H m = 08. 有气相反应B(g)→C(g),在温度T,压力p时,标准平衡常数为K pΘ(1),B的转化率为α1,在T恒定时,通入惰性气体D,使反应体系压力增加至2p之后,标准平衡常数为K pΘ(2),B 的转化率为α2,则下列关系中正确的是()(A) K pΘ(1) < K pΘ(2),α1=α2 (B) K pΘ(1) > K pΘ(2),α1<α2(C) K pΘ(1) = K pΘ(2),α1>α2 (D) K pΘ(1) = K pΘ(2),α1=α29.已知纯A液体和纯B液体的饱和蒸气压p A*< p B*,且A和B所组成的体系具有最高恒沸点。
中南大学物化试卷2012-2013

中南大学考试试卷2012-2013学年第一学期期末考试试题时间110分钟物理化学课程64学时4学分考试形式闭卷专业年级:材料科学1101-1110班、复合材料1101班满分100分,占总评成绩70%2013年1月7日10:00—11:40一、单项选择题(本题20分,每小题2分)1、关于理想气体,以下说法错误的是()A.1mol 单原子理想气体从273K 、1MPa 绝热向真空膨胀至0.1MPa ,终态温度不变。
B.1mol 单原子理想气体从273K 、1MPa 经绝热可逆膨胀至0.1MPa ,终态温度下降。
C.理想气体的绝热可逆过程方程之一为1122r r TV T V =。
D.理想气体经节流膨胀,温度不变。
2、298K 时有一个飘荡在空气中的肥皂泡,直径为2×10-3m ,已知此温度下肥皂水的表面张力为0,05N ·m -1,则该肥皂泡所受的附加压力为()A.0.10kPaB.0.20kPaC.0.05kPaD.0.40kPa3、下列运算公式中,不正确的是()A.理想气体向真空膨胀:21ln V S nR V ∆=B.恒温恒压可逆电池反应:HS T∆∆=C.水在298K ,p °下蒸发:H G S T∆-∆∆=D.实际气体绝热可逆膨胀:0S ∆=4、在298K 的含下列离子的无限稀释的溶液中,离子的摩尔电导率最大的是()A.3Al + B.2Mg + C.H + D.K +5、比较下列状态的水,化学势最低的是()A.100℃,101.3kPa 液态B.100℃,101.3kPa 气态C.101℃,101.3kPa 液态D.101℃,101.3kPa 气态6、用AgNO 3溶液和KI 溶液制备的AgI 溶胶,在AgNO 3略过量的情况下,下列电解质对溶胶聚沉能力最弱的是()A.FeCl 3B.K 3PO 4C.MgSO 4D.NaCl7、气相反应2A+B →2C 是吸热反应,反应达到平衡后,要使平衡向右移动,T ,p 将如何变化?()A.降低温度和减小压力B.降低温度和增加压力C.升高温度和减小压力D.升高温度和增加压力8、根据图1所作出的下述判断中正确的是()A.精馏组成为K 的体系,最后蒸干的一滴液体的组成为eB.蒸馏组成为K 的体系,两相平衡时气相中B 的浓度大于液相中B 的浓度C.蒸馏组成为M 的体系,两相平衡时气相中A 的浓度小于体系中A 的浓度D.蒸馏组成为M 的体系,两相平衡时液相中A 的浓度大于气相中A 的浓度9、已知32312,0.771,3,0.036Fe e Fe E V Fe e Fe E V ++Θ+Θ+→=+→=-,则232,______Fe e Fe E +Θ+→=。
中南大学物理化学考试试卷2012-2013年

C. 微多相;
D. 动力学稳定。
9、实际电解过程中,在阴极上首先发生还原反应而放电的是(
)。
A. 标准电极电势最大者;
B. 标准电极电势最小者;
C. 不可逆电极电势最小者;
D. 不可逆电极电势最大者。
10、在一定的 T, p 下,将一个大的水滴分散为很多小水滴,基本不变的性质为(
)。
A. 表面张力;
B. 强电解质;
适用于(
)。
C. 无限稀溶液;
D. 强电解质稀溶液。
5、根据下图指出原电池正极的极化曲线是(
)。
A. 曲线 1;
B. 曲线 2;
C.曲线 3;
D.曲线 4。
6、原电池 Ag(s) | AgCl(s) | HCl( a) | Cl 2(g, p) | Pt 的电池反应可写成以下两种形式:
。
4、(4 分)合成氨反应在一定温度和压力下,平衡转化率为
25%。现在加入一种高效催化剂
后,反应速率增加了 3 倍,则其平衡转化率提高
倍,此时平衡转化率为
%。
5、( 2 分)表面超量 Γ是指:单位面积的表面层中所含溶质的物质的量与具有相同质量溶剂
的本体溶液中所含溶质的物质的量之差, 当 dσ/da < 0 时,Γ> 0,此时发生的是
1
⑴ Ag(s) + Cl 2(g) === AgCl(s)
2
ΔrG m⑴
⑵ 2Ag(s) + Cl 2(g) === 2AgCl(s)
ΔrGm⑵
ΔrGm⑴与 ΔrGm⑵的关系是(
A. ΔrGm⑴ = 1 ΔrGm⑵; 2
C. ΔrGm⑴ = ΔrGm⑵;
)。 B. ΔrGm⑴ = 2ΔrGm⑵; D. 说不清楚。
中南大学普通化学2010-2011上期末考试A卷及答案(2010级土建类)

中南大学考试A试卷2010--2011学年1 学期时间100分钟《普通化学》课程32 学时2 学分考试形式:闭卷专业年级:2010级土建类1001-1021、土木试验1001班总分100分,占总评成绩70 %注:此页不作答题纸,请将答案写在答题纸上一、填空题(每空1分,共20分)1、特征电子构型为3d74s2的元素属于区,周期,族,原子序数为。
2、在共价化合物中,键的极性大小与成键原子的差值有关;分子是否为极性由和决定。
3、60ml 0.10mol•dm-3 H3PO4与40ml 0.20 mol•dm-3 NaOH混合配制缓冲溶液(H3PO4的pKa1=2.12、pKa2=7.21 、pKa3=12.67),所配缓冲溶液的缓冲范围为,抗酸成分是。
欲使缓冲能力最大,应在60ml 0.10mol•dm-3 H3PO4中加入0.20 mol•dm-3 NaOH溶液ml。
4、某系统由A态沿途径Ⅰ到B态吸热20J,同时对环境做功50J;当系统由A态沿途径Ⅱ到B态对环境做功80J时,Q为J。
5、温室气体主要是指;酸雨中的酸主要是和。
6、pH=3 的HAc(Ka = 1.8×10-5 )溶液,其浓度为________ mol•dm-3 ,加水稀释一倍,则其解离度a (增大、减小或不变,下同),解离常数Ka ,pH 。
7、根据溶度积规则,沉淀溶解的必备条件是;PbI2的溶度积Ks与溶解度S之间的关系为。
二、是非题(每题1分,共10分)1、金属元素和非金属元素之间形成的键都是离子键。
()2、同一原子内,任意s轨道和p轨道在成键时可以杂化。
()3、PbI2和CaCO3的溶度积均近似为10-9,从而可知在他们的饱和溶液中,前者的Pb2+浓度与后者的Ca2+浓度近似相等。
()4、电子在发生跃迁运动时吸收或放出的能量是量子化的。
()5、难挥发的非电解质的稀溶液凝固点降低,沸点上升都与蒸汽压下降有关。
()6、0.10mol•dm-3 NaCN溶液的pH比相同浓度的NaF溶液的pH要大,这表明CN-的Kb值比F-的Kb值要大。
中南大学物化考试卷4

中南大学考试试卷04一、选择题(每小题2分,共20分)1. 当理想气体反抗一定的外压作绝热膨胀时,则体系的()(A)焓恒定不变(B)热力学一定增加(C)焓一定增加(D)热力学一定减小2. 对于只做膨胀功的封闭体系,其的量值()(A)大于零(B)小于零(C)等于零(D)无法确定3. 某物质溶于互不相溶的两液态溶剂α和β之中,该物质在溶剂α之中以A的形式存在,在溶剂β之中以A2的形式存在,。
则在一定温度、压力下两液相达到平衡时化学势满足()(A)μα(A) = μβ(A2) (B)μα(A) = 2μβ(A2) (C)2μα(A) =μβ(A2) (D)无法确定4. 理想溶液的混合热力学性质是()(A)△mix V = 0, △mix H = 0, △mix S > 0, △mix G < 0(B)△mix V < 0, △mix H < 0, △mix S < 0, △mix G = 0(C)△mix V > 0, △mix H > 0, △mix S = 0, △mix G = 0(D)△mix V > 0, △mix H > 0, △mix S < 0, △mix G > 05. 将20克CaCO3(s)和60克CaCO3(s)分别放入抽真空、同容积的A容器和B容器中,且与同一定温热源相接触,达到化学平衡时CaCO3(s)部分分解成CaO(s)和CO2(g),若忽略固体体积,则两容器中CaCO3(s)的分解量为()(A)A容器中的多(B)B容器中的多(C)一样多(D)无法确定6. 在刚性密闭容器中,理想气体反应A(g) + B(g) === Y(g)达到平衡,若在定温下加入一定量的惰性气体,平衡()(A)正向移动(B)逆正向移动(C)不移动(D)无法确定7. 某反应A —→Y,如果反应物A 的浓度减少一半,它的半衰期也缩短一半,则该反应的级数为()(A)零级(B)一级(C)二级(D)三级8. 催化剂的中毒是指催化剂()(A)对生物体有毒(B)活性减小(C)选择性消失(D)活性或选择性减小或消失9. 不同运动状态的能级间隔不同,对于某一分子而言,其平动(t)、转动(r)和振动(v)的能级间隔大小顺序为()(A)△εv > △εt > △εr(B)△εv > △εr > △εt(C)△εt > △εv > △εr(D)△εr > △εt > △εv10. 某配离子的配位数为n,则其各级稳定常数K稳,i与各级不稳定常数为K不稳,i之间的关系为()(A)K 稳,i =( K不稳,n-i+1)-1(B)K稳,i = K不稳,i(C)K稳,i =( K不稳,n)-1(D)K稳,i = K不稳,i二、填空题(每小题2分,共20分)1. 焦耳-汤姆逊系数的定义式μ=;当μ > 0时,表示经节流膨胀后体系温度节流膨胀前体系温度(填高于、低于或等于)。
物理化学(下)-春季考试模拟真题-1

) ,最小的是(
)
(B) 0.01 mol· kg CaCl2 (D) 0.001 mol· kg KCl
-1
5. 恒温恒压下可逆电池放电过程 (A)ΔH = Q (C)ΔH > Q (B)ΔH < Q (D)ΔH与Q大小关系不确定
(
)
6.二级反应速率常数的单位是 (A)s-1 (B)dm6· s-1· mol-2 (C)s-1· mol-1
-
tCl-(NaCl)。 (填“>” 、 “<”或“=” ) 。 0。 (填
8. 对表面活性剂的水溶液,其表面张力比纯水的表面张力 活性剂在表面层中的浓度比其在本体中的浓度
(高或低) 。
9. 以活性炭吸附CHCl3气体,0℃时的最大单层吸附量为93.8dm3· kg-1。已知该温度 kg-1,则兰缪尔吸附 下,当CHCl3气体分压为1.34×104Pa时的平衡吸附量为82.5dm3· 等温式中的吸附平衡常数 b = 。
10. 实验测得 NaCl 、 Na2SO4 和 Na3PO4 三种电解质溶液对某溶胶的聚沉值分别为 0.512 mol· dm-3、4.31×10-3 mol· dm-3和8.91×10-4 mol· dm-3,说明该胶体带 电。
三、 (本题 15 分)乙酸乙酯与氢氧化钠皂化反应的速率常数在 282.55 K 时为 2.37(mol· L-1)-1· s-1;287.55 K 时增至 6.024(mol· L-1)-1· s-1。 求:(1) 反应的活化能 Ea 及频率因子 A; (2) 利用一上两个温度的数据求范特霍夫公式中的温度系数 γ; (3) 设乙酸乙酯和氢氧化钠的初始浓度均为 0.001mol· L-1, 反应在 298.15 K 下的 半衰期。
物理化学(下)试题库含答案

I 练习题一、填空题电解质溶液1. Pt|Cu 2+,Cu + 电极上的反应为Cu 2+ + e -→Cu +,当有1F 的电量通过电池时,发生反应的Cu 2+ 的物质的量为________。
2. 同一电导池测得浓度为0.01mol·dm -3的A 溶液和浓度为0.1 mol·dm -3的B 溶液的电阻分别为1000Ω和500Ω,则它们的摩尔电导率之比Λm (A )/Λm (B )等于________。
3. 已知m Λ∞(Na +)=50.11×10-4S·m 2·mol -1,m Λ∞(OH -)=198.0×10-4S·m 2·mol -1,在无限稀释的NaOH 溶液中t ∞(Na +)等于________,t ∞(OH -)等于________。
4. 25℃时,在0.002mol·kg -1CaCl 水溶液中离子平均活度系数为γ±1,在0.002mol·kg -1CuSO 4水溶液中离子平均活度系数为γ±2,则γ±1_______γ±2。
5. 已知NaAc 、NaCl 、HCl 水溶液无限稀释时的摩尔电导率分别为Λ1,Λ2,Λ3,则HAc的摩尔电导率为________________。
6. 25℃时,1mol·kg -1的BaCl 2水溶液的γ±=0.399,则a ±= 。
7. 相同温度、相同浓度的NaCl ,MgCl 2,MgSO 4的稀水溶液,其离子平均活度因子的大小是:γ±(NaCl ) γ±(MgCl 2) γ±(MgSO 4)(选填<,=,>)。
8. 电解质的离子强度定义为I = ,1 mol·kg -1的CaCl 2水溶液的I =mol·kg -1。
9. 等量的0.05 mol·kg -1的LaCl 3水溶液及0.05 mol·kg -1的NaCl 水溶液混合后,溶液的离子强度I = 。
物理化学(下)_湖南大学中国大学mooc课后章节答案期末考试题库2023年

物理化学(下)_湖南大学中国大学mooc课后章节答案期末考试题库2023年1.已知25℃时Eɵ(Zn2+êZn) = -0.7620 V,H2在Zn和光亮Pt上的超电压分别约为0.7 V和0.3 V,若分别以Zn和光亮Pt为阴极电解1mol·kg-1 ZnSO4溶液(设为中性),在阴极上首先析出的物质将分别为答案:Zn和H22.随着电流密度由小到大增加,电解池的实际分解电压V(分) 与原电池的端电压V(端) 将答案:V(分)递增,V(端)递减3.已知反应H2(g) + ½O2(g)=H2O(l) 的Δr G mɵ= -237.19 kJ·mol-1,且所用的是可逆电极,溶液搅拌充分,则在25℃时极稀硫酸的分解电压(V)为答案:1.2294.恒温恒压下,电池在以下三种情况下放电:(1)电流趋近于零,(2)一定大小的工作电流,③短路。
下列各式正确的是答案:5.下列反应 AgCl(s) + I-= AgI(s) + Cl-其可逆电池表达式为答案:Ag(s)|AgI(s)|I-||Cl-| AgCl(s)|Ag(s)6.答案:0.0657.在298 K将两个 Zn(s)极分别浸入 Zn2+活度为0.02和0.2的溶液中, 这样组成的浓差电池的电动势为答案:0.0295 V8.在 Hittorff 法测迁移数的实验中,用 Ag 电极电解 AgNO3溶液,测出在阳极部AgNO3的浓度增加了x mol,而串联在电路中的 Ag库仑计上有y mol 的Ag 析出, 则Ag+离子迁移数为答案:(y–x)/y9.答案:10.某电池反应可写成(1)H2(p1)+Cl2(p2)=2HCl 或(2)1/2H2(p1)+1/2Cl2(p2)=HCl,这两种不同的表示式算出的E、E$、Δr G m和K$ 的关系是答案:E1=E2,E1$=E2$,Δr G m,1=2Δr G m,2,K1$=(K2$)211.电解质溶液中离子迁移数(t i)与离子电迁移率(U i)成正比,当温度与溶液浓度一定时,离子电迁移率是一定的,则25℃时,0.1mol dm-3NaOH中Na+的迁移数(t1)与0.1mol dm-3NaCl溶液中Na+的迁移数(t2),两者之间的关系为答案:t1 < t212.当电流通过原电池或电解池时,电极电势将偏离平衡电极电势而发生极化。
物理化学(下)_武汉大学中国大学mooc课后章节答案期末考试题库2023年

物理化学(下)_武汉大学中国大学mooc课后章节答案期末考试题库2023年1.对于金属Fe的防腐措施中,下列哪一种不能发挥作用()答案:使Fe与金属Cu相连2.气固相反应 CaCO3(s)=CaO(s) + CO2(g) 已达平衡。
在其它条件不变的情况下,若把 CaCO3(s) 的颗粒变得极小,则平衡将:()答案:向右移动3.在平行反应中要提高活化能较低的反应的产率,应采取的措施为: ( )答案:降低反应温度4.化学动力学是物理化学的重要分支,它主要研究反应的速率和机理。
下面有关化学动力学和化学热力学的陈述中不正确的是( )答案:化学动力学不涉及状态函数的问题5.反应A─→2B在温度T时的速率方程为 d[B]/d t=k B[A],则此反应的半衰期为:( )答案:2ln 2/k B6.反应 2I-+H2O2→I2+2H2O 的速率方程为 r=k[I-][H2O2], 又知其反应历程为:I-+H2O2→IO-+2H2O I-+IO-→I2+2H2O则对反应 2I-+H2O2→I2+2H2O来说:( )答案:反应级数为2,不存在反应分子数7.一级反应完成99.9%所需时间是完成50%所需时间的多少倍( )答案:108.某一反应只有一种反应物,其转化率达到75%的时间是转化率达到50%的时间的3倍,反应转化率达到64%的时间是转化率达到x的时间的两倍,则x为( )。
答案:47%9.根据范特霍夫经验规则,一般化学反应,温度每上升10℃其反应速率约增大为原来的2~4倍,对于在298K(指室温)左右服从此规则的化学反应,其活化能(单位:kJ/mol)的范围约为( )答案:50~10010.基元反应A+B-C→A-B+C的摩尔反应焓变△rHm>0,B-C键的键能为εB-C,A-B键的键能为εA-B, A为自由基,则反应活化能等于( )。
答案:△rHm +0.055×LεA-B11.简单碰撞理论属基元反应速率理论,以下说法不正确的是: ( )答案:从理论上完全解决了速率常数的计算问题12.根据过渡态理论, Arrhenius公式中的指前因子与以下哪一个因素有关( )。
中南大学物化考试卷2

中南⼤学物化考试卷2中南⼤学考试试卷02⼀、填空题(每⼩题3分,共45分)1. 273.15K,101.325KPa下,固体冰融化为⽔,其过程的Q0,W0,ΔU 0 ,ΔH 0,2. 1mol 25℃的液体苯在弹式量热计中完全燃烧,放热3264KJ,则反应2C6H6(l)+15O2(g)== 12CO2(g)+6H2O(l)的ΔrUm(298K)== KJ·mol-1,ΔrH m(298K)== KJ·mol-13. 298K时某化学反应的ΔrH mθ= -16.74 KJ·mol-1,ΔrCp,m =16.74 J·K·mol-1,则该化学反应在 K温度下反应时的反应热为零。
4. 1mol单原⼦理想⽓体等容从T1冷却到T2,则该过程的ΔS 0,W 0。
5. 1mol的液态⽔由100℃,101.325KPa向真空蒸发为100℃,101.325KPa的⽔蒸⽓,已知此过程的ΔH = 40.6KJ,则该过程的Q = KJ,W = KJ,ΔU = KJ ,ΔS = J·K-1,ΔA = KJ,ΔG = KJ。
6. 在298.15K,101.325KPa下,将0.5 mol苯和0.5 mol甲苯混合形成理想液体混合物,该过程的ΔU = ,ΔH = ,ΔS = 。
7. 2molA和1molB形成的理想液体混合物,已知P A※= 90KPa,P B※=30KPa。
则⽓相中两物质摩尔分数之⽐y A:y B =。
8. 设葡萄糖在⼈体(体温为36.8℃)⾎液中和尿液中的质量摩尔浓度分别为 5.50×10-3mol·Kg-1和5.50×10-5mol·Kg-1,若将1mol葡萄糖从尿中转移到⾎液中,肾脏⾄少须作KJ的功。
9. 已知Δf Gmθ(HCl,g,298K)== -95.625KJ·mol-1,则反应H2(g) + Cl2(g) == 2HCl(g)的Kpθ== ,Kc == ,Ky == 。
中南大学物理化学考试09,10年

中南大学考试试卷2008 -- 2009 学年二学期时间110分钟物理化学课程40 学时2.5 学分考试形式:闭卷专业年级:化工、制药、应化07级总分100分,占总评成绩70 % 注:此页不作答题纸,请将答案写在答题纸上一、选择题(每题2分,共24分)1. 下列关于连串反应的各种说法中正确的是( )(A) 连串反应进行时,中间产物的浓度一定会出现极大值(B) 连串反应的中间产物的净生成速率等于零(C) 所有连串反应都可以用稳态近似法处理(D) 在不考虑可逆反应时,达到稳定态的连串反应受最慢的基元步骤控制2.某反应,无论作用物的初始浓度是多少,在相同时间和温度条件下,无论作用物的消耗浓度为定值,则该反应是( )(A) 负级数反应(B) 零级反应(C) 一级反应(D) 二级反应3. 下列关于催化剂的说法不正确的是( )(A) 催化剂不改变反应热(B) 催化剂不改变化学平衡(C) 催化剂不参与化学反应(D) 催化剂具有选择性4. 若向摩尔电导率为1.4×10-2S·m2·mol-1的CuSO4水溶液加入1 m3的纯水,则稀释后CuSO4水溶液的摩尔电导率将( )(A) 降低(B) 增高(C) 不变(D) 不确定5.电极电势可以改变电极反应速率,其直接原因是改变了( )(A) 反应的活化能(B)电极过程的超电势(C)活性粒子的化学势(D) 电极-溶液界面的双电层6.当电流通过电池时,电极将发生极化。
当电流密度增大时,通常将发生( )(A) 原电池的正极电势增高 (B ) 原电池的负极电势增高(C) 电解池的阳极电势减少 (D) 无法判断7. 已知V 0360Fe Fe 3./-=Θ+E ,V 771023Fe Fe ./=Θ++E ,则Θ+Fe Fe 2/E 等于 ( )(A) 0.735V (B) 0.807V (C ) -0.44 V (D) -0.699 V8.下列电池中,哪个电池的反应为H + + OH - === H 2O ( )(A) Pt, H 2(g) | H + (aq) || OH -(aq) | O 2(g), Pt(B) Pt, H 2(g) | NaOH (aq) | O 2(g), Pt(C ) Pt, H 2(g) | NaOH (aq) || HCl (aq) | H 2(g), Pt(D) Pt, H 2(g,p 1) | H 2O (l) | H 2(g, p 2), Pt9.Langmuir 吸附等温式有很多种形式,而最常见的是bpbp +=1θ,但它不适用于( ) (A ) 多种分子同时被强吸附 (B) 单分子层吸附(C) 物理吸附 (D) 化学吸附10.弯曲液面所产生的附加压强一定 ( )(A) 等于零 (B ) 不等于零 (C) 大于零 (D) 小于零11.溶胶与高分子溶液的主要区别在于 ( )(A) 分散相粒子大小不同 (B) 渗透压不同(C) 外观颜色不同 (D ) 相状态和热力学稳定性不同12. 下列关于电泳现象的各种阐述中正确的是 ( )(A ) 电泳和电解没有本质区别 (B) 外加电解质对电泳的影响很小(C) 胶粒的电泳速度与一般离子的电迁移速度差别很大(D) 胶粒的电泳速度外加电场的电位梯度无关二、填空题(共16分)1. (3分) 链反应是由链的 、链的 和链的 三个基本步骤构成的。
中南大学物化考试卷及答案 4套

ΔvapHm=ΔsubHm-ΔfusHm= 17 580 J·mol-1
-ΔvapHm/RT + B = -3116 K/T + 27.537
B = 22.922
所以液体 CO2 的蒸气压与温度的经验关系为:
ln(p/Pa) = -ΔvapHm/RT + 22.922 = -2115 K/T + 22.922
0, W
0, Δ
U
0 ,ΔH
0,
2. 1mol 25℃的液体苯在弹式量热计中完全燃烧,放热 3264KJ,则反应
Kp =(x NH3 p)2/(x H2 p)3(x N2 p)= 6.818×10-8 kPa2 解得 p = 1115 kPa
(2 分)
(1 分) (2 分)
(2 分)
(3 分)
6
中南大学考试试卷 02
一、填空题(每小题 3 分,共 45 分)
1. 273.15K,101.325KPa 下,固体冰融化为水,其过程的 Q
15. [答] (C)
二、填空题 ( 共 5 题 9 分 )
16. [答] Q=W=nRTln(V2/V1),n=2 mol
17. [答] 吉布斯自由能
18. [答] f = 3
19. [答] xB(g) > xB(总) > xB(l)
xB= 0.6 恒沸混合物
20. [答] T; T, p
三、计算题 ( 共 5 题 60 分 )
3. N2(g),O2(g) 体系中加入一种固体催化剂,可生成几种气态氮的氧化物,则体系的自由
度为
。
4.完全互溶的二组分溶液,在 xB= 0.6 处平衡蒸气压有最高值,那么组成 xB=0.4 的溶液在 气-液平衡时,xB(g),xB(l),xB(总)的大小顺序为________________ 。将 xB=0.4 的溶液进 行精镏,塔顶将得到 ___________ 。
物理化学(下)_湖南大学中国大学mooc课后章节答案期末考试题库2023年

物理化学(下)_湖南大学中国大学mooc课后章节答案期末考试题库2023年1.298 K时,苯蒸气在石墨上的吸附符合Langmuir吸附等温式,在苯蒸气压力为40 Pa时,覆盖率q=0.05,当q=0.5时,苯蒸气的平衡压力为参考答案:760 Pa2.同时具有亲水和亲油基团的分子作为表面活性剂是因为参考答案:在界面上定向排列降低了表面能3.用同一滴管分别滴下1 cm3的NaOH水溶液、水、乙醇水溶液,各自的滴数多少的次序为参考答案:乙醇水溶液>水>NaOH水溶液4.将一毛细管插入水中,毛细管中水面上升125px,在75px处将毛细管折断,这时毛细管上端参考答案:水面呈凹形弯月面5.把细长不渗水的两张纸条平行地放在纯水面上,中间留少许距离,小心地在中间滴一滴肥皂水,则两纸条间距离将参考答案:增大6.同一固体, 大块颗粒和粉状颗粒, 其溶解度哪个大?参考答案:粉状颗粒大7.在气—固相催化反应中常用载体,载体所起的主要作用,下列哪一条是不存在的参考答案:防止催化剂中毒8.在298 K无限稀释的水溶液中,下列离子摩尔电导率最大的是参考答案:H+9.若某反应的恒压反应热效应是负值,那么组成原电池进行可逆工作时,与环境交换的热参考答案:无法确定10.在298 K时离子强度为0.015 mol×kg-1的ZnCl2的溶液中,其平均活度因子是参考答案:0.606711.下列物质的水溶液,在一定浓度下其正离子的迁移数(tB)如 A、B、C、D 所列。
比较之下选用哪种制作盐桥,可使水系双液电池的液体接界电势减至最小?参考答案:KNO3,t(K+ )= 0.510312.随着电流密度由小到大增加,电解池的实际分解电压V(分) 与原电池的端电压V(端) 将( )参考答案:V(分)递增,V(端)递减13.电极电势E的改变可以改变电极反应的速度,其直接的原因是改变了参考答案:反应的活化能14.Na + 、H + 的还原电势分别为-2.71V 和-0.83V,但用Hg作阴极电解NaCl溶液时,阴极产物是Na-Hg齐,这个现象的解释是:参考答案:Na和Hg形成液体合金ngmuir吸附等温式满足的条件下,下列不恰当的是参考答案:吸附是多分子层的16.对于物理吸附的描述中,不正确的是参考答案:吸附速率较小17.在两烧杯中各放有25 cm3浓度为0.016 mol·dm-3的AgNO3溶液,分别加入浓度为0.005 mol·dm-3的KBr溶液60 cm3和100 cm3,两烧杯中均制得AgBr溶胶。
中南大学物理化学期末考试试卷合集

0,环境的熵变
3. 含不挥发溶质的稀溶液, 其沸点较纯溶剂的沸点
; 其凝固点较纯溶剂的凝固点_____。
4. 溶液中某组分在其参考态下的活度为
;活度系数为
。
5. 一定温度下,对于给定反应, K p = K y = K n = K c 的条件是 __
和
。
6. 将NH 4 HS(s)和任意量的NH 3 (g)、 H 2 S(g)混合。 当体系达到平衡时, 此体系的独立组分数C =_ _, 相数Φ=_ _,自由度f = _。
S 隔 = S 体 + S 外 = 0
(2) 因恒外压压缩,则
RT RT Q W pV p外 p p 1 2 1 1 607950 8.314 298.15 607950 101325 12394J 12.394kJ
(2 分) (1 分) (1 分) (1 分) (1 分) (1 分) (1 分)
ΔS 体 = Q r / T= (-4441)÷298.15= -14.9 J·K-1 ΔG = ΔH -TΔS 体 = - Q r = 4.44 kJ ΔA =ΔU -TΔS 体 = - Q r = 4.44 kJ ΔS 环 = -Q r / T = 4441÷298.15= 14.9 J·K-1
中南大学考试试卷
2009 -2010 学年 上 学期
时间 110 分钟
物 理 化 学 课程 48 学时 3 学分 考试形式: 闭 卷
专业年级: 化工、应化、制药、粉体、材化、矿物 08 级 总分 100 分,占总评成绩 70 %
注:此页不作答题纸,请将答案写在答题纸上
一、单选题(每题 2 分,共 24 分) 1. 1 mol 理想气体,从始态 (p,V,T ) 出发,分别进行⑴恒温可逆膨胀和⑵绝热可逆膨胀过 程,若两过程所达到的末态体积相同,则两过程体积功的关系是 (A)| W ⑴ | = | W ⑵ | (B)| W ⑴ | > | W ⑵ | (C)| W ⑴ | < | W ⑵ | ( )
物理化学——期末考试复习资料(中南大学)

物理化学——期末考试复习资料(中南大学)《物理化学》课程复习资料一、单项选择题:1.对隔离体系而言,以下说法正确的是 [ A.体系的热力学能守恒,焓不一定守恒 ]2.经下列过程后,体系热力学能变化不为零(ΔU ≠0)的是 [ D.纯液体的真空蒸发过程 ]3.下列关于理想溶液的混合热力学性质正确的是[ C.Δmix S > 0,Δmix G < 0 ]4.理想气体恒压膨胀,其熵值如何变化? [ B.增加 ]5.在下列热力学函数中,可以用于判断过程自动与否的是[ C.ΔG T, ]6.若反应2H 2(g) + O 2(g) ==== 2H 2O(g) 的热效应为△r H m ,则[ B.Δf H m [H 2O(g)] = 0.5Δr H m ]7.已知反应H 2(g) + 0.5O 2(g) == H 2O (g)在298K 、p Θ下的反应焓变为)K 298(m r ΘH ,下列说法中不正确的是[ B.)K 298(m r ΘH H 2(g) 的标准摩尔燃烧焓 ]8.某化学反应在298K 时的标准Gibbs 自由能变化为负值,则该温度时反应的标准平衡常数K Θ值将[B.K Θ>1] 9.合成氨反应 N 2(g )+ 3H 2(g )== 2NH 3(g )达平衡后加入惰性气体,保持体系温度和总压不变(气体为理想气体),则有 [ C.平衡左移,K p Θ不变 ]10.在一定的温度T 和压力p 下,反应3O 2(g) ? 2O 3(g)的以组元分压表示的平衡常数K p 与以组元物质的量分数表示的平衡常数K y 之比为 [ D.p -1]11.在373K 、p Θ下,水的化学势为μl ,水蒸气的化学势为μg ,则[ A.μl = μg ]12.在α、β两相中均含有物质A 和B ,A 和B 在α相中的化学势分别为μA(α)和μB(α),A 和B 在β相中的化学势分别为μA(β)和μB(β),当两相达到平衡时应有[ B.μB(α) = μB(β) ]13.FeCl 3和H 2O 能形成FeCl 3·2H 2O 、FeCl 3·6H 2O 、2FeCl 3·5H 2O 和2FeCl 3·7H 2O 四种水合物,该体系的组元数和在恒压下最多可能平衡共存的相数为 [ B.C = 2,Φ= 4 ]14.下列关于杠杆规则适用对象的说法中,不正确的是[ B.适用于二组元体系的任何相区 ]15.对(基)元反应A +2B → P 而言,其反应速率方程可以用不同反应物浓度对时间的变化率来表示,即有2B A A A d d c c k t c =-,2B A B B d d c c k t c =-和2B A P P d d c c k tc =三种形式,则k A ,k B 和k P 三者之间的关系为[ C.k A =0.5kB =k P ]16.标准氢电极是指 [ C.Pt ,H 2(p H 2=p Θ)| H +(a = 1) ]17.在298K 时,测得浓度为0.1和0.01 mol·kg -1的HCl 溶液构成浓差电池的液接电势为E j(1);若溶液浓度相同,而换用KCl 溶液,则其液接电势为E j(2)。
中南大学大学物理(下)试卷7套
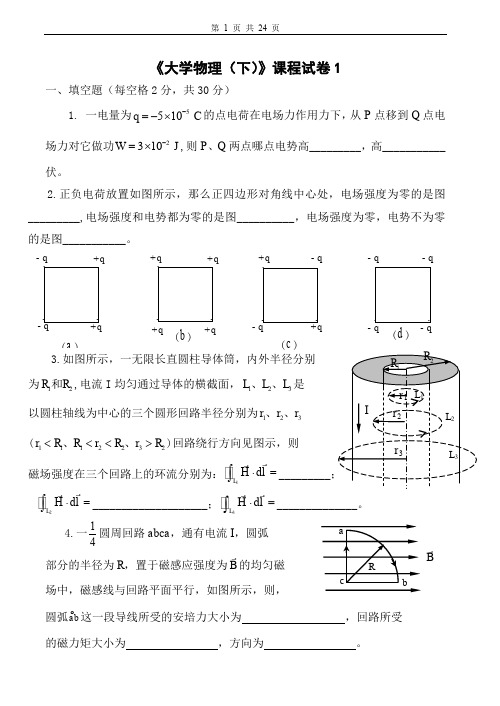
中保持 a = 60o 角不变,C 点与两直导线分别相距 a 和 2a ( a = 0.1m )问:金属杆
CD 中的感应电动势为多大?杆的哪端电势较高?(10 分)
D
V
I
I
L
C
a
a
第 8 页 共 24 页
5.如果用能量为 12.6 eV 的电子轰击氢原子, 将产生哪些波长的光谱线? (10 分)
f 4
(B)
f 8
3 f 8
(D)
f 16
A
a
2.如图所示,一个带电量为 q 的正点电荷位于正方体 的 A 角上,则通过侧面 abcd 的电场强度的通量为( q q q q (A) (B) (C) (D) 6 0 48 0 12 0 24 0 )
d
c
3.如图所示,I1 和 I2 为真空中的稳恒电流,L 为一闭合回
A1
e
I
e
O
B1
A
2 0 I 2R
(B)
0 I
R
(C)
0 I
2R
(D) 0 )
4.关于同时性有人提出以下结论,其中正确的是(
(A)在一惯性系同时发生的两个事件,在另一惯性系一定不同时发生 (B)在一惯性系不同地点同时发生的两个事件,在另一惯性系一定同时发生 (C)在一惯性系同一地点同时发生的两个事件,在另一惯性系一定同时发生 (D)在一惯性系不同地点不同时发生的两个事件,在另一惯性系一定不同时 发生
三、計算題(5 题共 52 分)
)
n1 n2 n3
1.如图所示,半径为 R1 = 0.01m 的金属球,带电量 Q1 11010 c ,球外套一内 外半径分别 R2 3 102 m 和 R3 4 102 m 的同心金属球壳,壳上带电 Q2 111010 c , 求:(1)金属球和金属球壳的电势差;(2)若用导线把球和球壳联接在一起,这时 球和球壳的电势各为多少?(12 分)
中南大学《物理化学》网上(课程)作业一及参考答案

中南大学《物理化学》网上(课程)作业一及参考答案(一) 单选题1. 下列物理量中,不属于体系性质的是()。
(A) -pdV(B) (C) (D)参考答案: (B)2. 在恒压恒温条件下,溶剂A与溶质B形成一定浓度的溶液,若采用不同的浓度表达形式表示溶液中A和B的浓度,则()。
(A) 溶液中A和B的活度不变(B) 溶液中A和B的参考态化学势值不变 (C) 溶液中A和B的活度系数不变 (D) 溶液中A和B的化学势值不变参考答案: (D)3. 在298K下,A和B两种气体单独在某一溶剂中溶解时均遵守Henry定律,Henry 常数分别为kA和kB,且已知,则当A和B压力(平衡时的)相同时,在一定量的该溶剂中溶解的关系为()。
A的量大于BA的量小于B(B) 的量A的量等于B(C) 的量A的量与B的量无(D) 法比较(A) 的量参考答案: (B)4. 当5mol的H2(g)与4mol的Cl2(g)混合,最后生成2mol的HCl(g)。
若以下式为基本单元:1mol (A)2mol (B) 4mol (C) 5mol (D)参考答案: (A)5.凡是孤立系统中进行的变化,其的值一定是()。
(A)(B) (C) (D)参考答案: (D)6.封闭系统中,若某过程的A=WR,应满足的条件是()。
等温、可逆过等容、可逆过(B) 程等温等压、可逆(C) 过程等温等容、可逆(D) 过程(A) 程参考答案: (A)7.某纯物质体系的,当压力升高时其熔点将()。
(A) 升高降低 (B) (C) 不变不确定 (D)参考答案:(A) 8.在温度T时,纯液体A的饱和蒸气压为凝固点为,化学势为,并且已知在下的,当A中溶入少量与A不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为,则()。
(B)(C)(D)参考答案: (D)9. 定义偏摩尔量时规定的条件是()。
(A) 等温等压(B) 等熵等压(C) 等温,溶液浓度不变(D) 等温等压,溶液浓度不变参考答案: (D)10. 盐碱地的农作物长势不良,甚至枯萎,其主要原因是()。
中南大学《物理化学》网上(课程)作业二及参考答案

(一) 单选题1.下面4种电解质溶液,浓度均为0.01mol,现已按它们的摩尔电导率值由大到小排了次序。
请根据你已有的知识,判定下面排序正确的是()(A)(B)(C)(D)参考答案:(B)2. 溶胶的动力性质是由于粒子的不规则运动产生的,在下列各种现象中,不属于溶胶动力性质的是()(A)渗透压(B)扩散(C)沉降平衡(D)电泳参考答案:(D)3. 当表面活性物质加入溶剂后,所产生的结果是()(A)正吸附(B) 负吸附(C) 正吸附(D) 负吸附参考答案:(A)4.在298K时,浓度为0.1和0.01mol的HCl溶液组成浓差电池的液接电势为Ej⑴,浓度相同而电池电解质溶液换用KCl,其液接电势为Ej⑵。
则两液接电势的关系为()(A)(B)(C) Ej⑴=Ej⑵(D) 无法判断参考答案:(A)5. 若算得电池反应的电池电动势为负值,表示此电池反应是()(A)正向进行(B)逆向进行(C)不可能进行(D)反应方向不确定参考答案:(B)6. 液体在毛细管中上升的高度与下列哪一个因素无关?()(A)温度(B)液体密度(C)重力加速度(D)大气压力参考答案:(D)7.以下4种电解质溶液的浓度都是0.01,其中平均活度系数最大的是()(A)KCl (B) CaCl2 (C) Na2SO4 (D) A1C13参考答案:(A)8. 有以下两个电池,电动势分别为E1和E2比较其电动势大小()(A)(B) (C) E1=E2(D) 不能确定参考答案: (C) 9.这两个电池电动势E1和E2的关系为()(A)E1=E2(B)E1=2E2(C)E1=0.5E2(D)无法比较参考答案: (C)10. 将大分子电解质NaR 的水溶液用半透膜和水隔开,达到Donnan 平衡时,膜外水的pH ()(A)大于7(B)小于7(C)等于7(D)不能确定参考答案: (A)11. 当发生极化时,组成电池的两电极的电极电势将会是()(A)阳极电势越来越负,阴极电势越来越正(B) 阳极电势越来越正,阴极电势越来越负(C) 阳极电势和阴极电势均越来越正(D) 阳极电势和阴极电势均越来越负参考答案:(B)12. 下列电池中,电池电动势与Cl-离子的活度无关的是()(A)(B)(C)(D)参考答案:(C)13.某电池反应为,当电池反应达平衡时,电池的电动势E必然()(A)(B) E=(C)(D) E=0参考答案:(C)14. 有一飘荡在空气中的球形液膜,内部也是空气。
中南大学表面物理化学化学试题-答案

1. 什么是毛细凝结? 答:在亲液毛细体系中,液体在毛细管中能够形成凹液面,毛细体系中液体的饱和蒸汽 压远小于正常饱和蒸汽压,使饱和蒸汽压在该体系中易于凝结的现象。
2. 什么是表面自憎现象? 答:某种低能液体在高能表面铺展形成单分子铺展层后,多余低能液体在固体表面不能 铺展而形成液滴的现象叫做表面自憎现象。
种类越少,固体表面的可润湿性相对较差;反之, c 越大,能在固体表面铺展的液体
种类越多,固体表面的可润湿性相对越好。
5. 苯滴在干净平整的水面上,先迅速展开,然后又自动收缩成小液滴漂浮在水面上,根据
下列数据计算解释这种实验现象。 苯/水 35.0mN/m
' ' 苯 28.9mN/m 苯 28.8mN/m 水 72.8mN/m 水 62.2mN/m
3.
请根据 Kelvin
公式 ln Pr
ln P0
2M RT
说明等温蒸馏的基本原理。(5 分)
解:由 Kelvin 公式知,亲液毛细体系中的饱和蒸汽压 Pr P0 ,使饱和蒸汽在该毛细体系中易
于凝结,利用此原理,宏观上可使某液体在等温条件下在毛细体系中纯化或富集的过程 叫做等温蒸馏。
W= · A =11.68J
2. 已知,水-萘体系中,25℃时,接触角为 90°,水的表面张力为 72mN/m,求: 1) 单位面积的萘在水中的浸湿功 Wi; 2) 单位面积的水在萘上的黏附功 Wa; 3) 单位面积的水在萘上的铺展系数 S. (6 分)
解:根据 T.Young 方程有
W i gs ls gl co s
n1s
(1
0.4)10 4 mol 2g
中南大学物理化学期末考试试卷合集[论文资料]
![中南大学物理化学期末考试试卷合集[论文资料]](https://img.taocdn.com/s3/m/e008315e03d8ce2f006623d8.png)
-235.3
SmΘ(298K)/J·K-1·mol-1
282
求 298K下反应的△rGmΘ 、KpΘ及Kp。
C2H4(g) 52.28 219.5
H2O(g) -241.8 188.7
七、(本题 12 分) NaCl—H2O二元系相图如图所示,其中化合物组成为NaCl·2H2O。
T/K 440
M(28%NaCl,433K) 420
平衡。则此体系的独立组分数C = ,条件自由度f * =
,相数Φ =
。
三、(本题 20 分) 将 1 mol O2由 298.15 K,pΘ的压强下经恒温可逆压缩增至压强为 607950 Pa 的末态,试求W、Q、ΔU、ΔH、ΔA、ΔG、ΔS体、ΔS环及ΔS隔。如改为恒外压 607950 Pa压缩至 同一末态,上述各热力学量又为多少?
= (-127.125) + 0.5×8.314×298.15×10-3
(1 分)
= -125.886 kJ·mol-1
(1 分)
五、(本题 12 分) 解:
(1) 因为液体 A 和液体 B 形成理想溶液,所以有
pA = pA*xA= pA*(1-xB)
pB = pB*xB
p = pA + pB 由 1mol的A和 2mol的B所形成的溶液中xB ,1= 2/3, 且p1 = pA,1 + pB,1 = pA*(1-xB,1) + pB*xB1 = 50.663kPa
△rHmΘ [298.15K]⑷ = -285.84kJ·mol-1
五、(本题 12 分)液体 A 和液体 B 形成理想溶液。在 343.15K 时, 由 1mol 的 A 和 2mol 的 B 所形成的溶液的蒸汽压为 50.663kPa, 若在该溶液中再加入 3mol 的 A,则溶液的蒸汽压为 70.928kPa。求:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中南大学考试试卷
2009 2010 学年二学期时间100分钟
物理化学(下)课程32学时2学分考试形式:闭卷
专业年级:粉体、材化、应化、化工、制药、无机、矿物08级总分100 分,占总评成绩 70 %
注:此页不作答题纸,请将答案写在答题纸上
一、单选题(每题2分,共20分)
1. 反应 2A — B + C 由多个基元反应所构成,且速率方程具有幂函数形式。
对该反应,下列说法中正确的是()
(A)单分子反应(B)双分子反应(C)二级反应(D)n级反应
2. 两个一级平行反应:⑴和⑵,已知反应⑴的活化能E1大于反应⑵的活化能E2,以下哪一种措施不能改变获得B 和C的比例?()
(A)提高反应温度(B)延长反应时间(C)加入适当的催化剂(D)降低反应温度3. 下列针对催化反应的描述,不正确的是( )
(A)催化剂能改变反应的途径(B)催化剂能改变反应的速率
(C)催化剂能改变反应的理论产率(D)反应后催化剂的量不会改变
4. 在298K下,含有下列离子的无限稀释的溶液中,离子摩尔电导率最大的是()
(A)3+(B)2+(C)(D)5. 在下列因素中,与电解质溶液中离子淌度无关的是()
(A)压强(B)温度(C)电场强度(D)溶液浓度
6. 与参与电极反应某组分活度无关的是()
(A)电极电势(B)标准电极电势(C)液接电势(D)超电势
7. 下列与极化现象无关的物理量是()
(A)分解电压(B)理论分解电压(C)析出电势(D)极限扩散电流
8. 一般不会产生吸附现象的界面是()
(A)固-液界面(B)固-气界面(C)固-固界面(D)液-气界面
9. 胶体的(丁铎尔)效应产生原因是()
(A)光折射(B)光散射(C)光吸收(D)光激发
10.溶胶的电学性质是由于胶粒带电所致,下列现象中不属于溶胶电学性质的是()
(A)布朗运动(B)电泳(C)电渗(D)沉降电势
二、填空题(每题2分,共20分)
1. 强电解质溶液的摩尔电导率随浓度增加而。
(填“增加”,“减小”或“不变”)
2. 浓度为0.1·1的溶液中,和的离子迁移数的关系为t t。
(填“>”,“<”或“=”)
3. 电极极化的结果是使阳极的电极电势更,阴极的电极电势更。
(填“正”或“负”)
4. 表面活性剂是能使水的表面张力的物质。
5. 按表面张力的大小顺序排列下面四种液体:汞,苯,蒸馏水,食盐水。
表面张力从大到小顺序排列为:。
6. 298K下,有如下两个反应均为(s) + 2+(a2) 2 (a1) 的电池:
⑴ (s) | (a1) (a1), 2+(a2) | ,,
⑵ (s) | 2+(a2) (a1), 2+(a2) | ,,
则两个电池的ΔΘ和EΘ的关系为:,。
(填“=”或“≠”)
7. 若计算得到某电池反应的电池电动势为负值,则表示该电池反应是向进行的。
(填“正”或“逆”)
8. 若某反应半衰期与起始浓度无关,则该反应为级反应。
9. 某反应在一定条件下的平衡转化率为25.3%。
在相同的条件下,当有催化剂存在时,其转化率是。
10.一旦用某种方法(如用光、热、辐射等)引发,反应便通过自由基传递发生一系列的连串反应,使反应自动进行下去,这种反应被称为。
三、(12分)请用ü极限公式计算298K时0.01·1的3和0.001·1的(3)2混合溶液中(3)2的离子平均活度系数,离子平均活度和活度。
四、(16分)在298.15K时,测得下列电池的电动势E为1.228V
2()|H24(0.01·-1)|O
2(),
已知。
⑴试写出该电池的正、负极反应及电池反应;
⑵试计算此电池的温度系数,Δ,Δ,Δ和;
⑶设该电池反应热在此温度范围内为常数,试求此电池在273.15K时的电动势。
五、(8分)用作电极电解134水溶液,298.15K。
设活度系数均为
1,已知H2在电极上的超电势为
= 0.024V,
2()
⑴若溶液为中性,则在阴极上优先析出何物?
⑵请计算在什么条件下,只析出而H2不析出?
六、(12分)在298 K、101.325 下,将直径1 μm的毛细管插入水中,在管内需加多大压强才能防止水面上升?若不加额外压强,则管内液面能升多高?已知该温度下,,接触角θ=0,重力加速度g=9.8 m·2。
若接触角θ=30○,结果又如何?
七、(12分)五氧化二氮的分解为典型的一级反应,分解产物为2和O2,下面的复杂反应历程推断较之单分子反应历程推断来得正确。
⑴试按复杂反应历程推导分解速率方程式,请说明推导过程中所采用的近似处理方法;⑵通过合理处理,给出五氧化二氮分解反应表观活化能与各元反应活化能的关系。
,,
,
参考答案
一、单选题(每题2分,共20分)
1.(D)
2.(B)
3. (C)
4.(C)
5.(A)
6.(B)
7.(B)
8.(C)
9.(B)10.(A)
二、填空题(每题2分,共20分)
1. 减小;
2. = ;
3. 正,负;
4. 显著降低;
5. 汞>食盐水>蒸馏水>苯;
6. = ,≠;
7. 逆;
8. 1 ;
9. 25.3% ;10. 链反应。
三、(12分)解:依题意,该混合溶液中各离子的浓度分别为:
- = 0.012·1
= 0.01·1,2+ = 0.01·1,
3
所以,该混合溶液中离子强度为:
I= ∑2 (2分)
= (0.01´12+ 0.001´22+ 0.012´12) = 0.013 ·1 (2分)
根据ü极限公式
或得:(2分)
,
或, (1分)
根据可计算出该混合溶液中(3)2的平均质量摩尔浓度为:
(2分)
所以,该混合溶液中(3)2的离子平均活度为:
或
(1分)
由=( a±)ν得:
(1分)
或
(1分)
四、(16分)解:⑴该电池的正、负极反应及电池反应为:
负极:H2() →2( =2×0.01 ·1) + 2e (1分)
正极:O2() + 2( =2×0.01·1) + 2e → H2O(l) (1分)
电池反应:H2() + O2() H2O(l) (1分)
⑵Δ= = -2×1.228×96485 = -236967.16J·1
(2分)
或Δ= = -2×1.228×96500 = -237004J·1
而该电池反应就是水的生成反应,故:
(2分)
因为
所以 (2
分)
而,则电池的温度系数为:
(2分)
= TΔ= 298.15×( -163.89) = -48825.04 J· 1
(2分)
⑶若反应热不随温度变化,则Δ也不随温度变化,故:
E273.15 =E298.15 -ΔE = 1.228 - (-2.123×10-2) = 1.249 V (3分)
五、(8分)解:⑴
(2分)
(2分)
由以上计算可知,,所以在阴极上优先析出H2
(2分)
⑵若要只析出而H2不析出,就必须使,即:
(1分)
-0.7628 > -0.05916 - 0.024
解得:> 12.5 (1分)
六、(12分)解:水在毛细管中的上升是因为弯曲水面上的附加压
强所致,
根据杨-拉普拉斯公式,
其中rθ = 5×10-7×1 = 5×10-7m (3分)
所以,
(2分)
再根据毛细管上升公式
(3分)
若接触角θ=30○,则rθ = 5×10-7×0.866 = 4.33×10-7m
故
(2分)
(2分)
七、(12分)解:解法一、
⑴因为总反应为:2N2O5 ⇌ 422,所以, (2分)
又∵ ,其中3为中间产物,
则根据平衡近似和稳态近似得:
(2分)
根据稳态近似又得:
而:
(2分)
联立解得:,
∴
(2分)
⑵因为第三步为慢步骤,所以有k2 >> k3,则
(2分)
所以,表观活化能= E13–E2 (2分)
解法二、
⑴机理中的第三步为慢步骤,则根据速控步骤近似法取:
(3分)
∵ ,其中3为中间产物,根据平衡近似法有:
(3分)
则:
故:
(2分)
⑵因为第三步为慢步骤,所以有k2 >> k3,则
(2分)
所以,表观活化能= E13–E2 (2分)。
