高二化学分子空间结构与物质性质PPT精品课件
合集下载
高中化学 第二章 分子结构与性质 2 分子的立体结构课件高二选修3化学课件

的立体结构。
12/9/2021
第十四页,共四十八页。
知识点 2 价层电子对互斥模型(VSEPR) (1)价层电子互斥模型 ①分子的空间构型与成键原子的价电子有关。②价层电子对互斥模型可以用来预测 分子的立体结构。 (2)价层电子对互斥模型与分子空间构型 ①中心原子中的价电子全部参加形成共价键的分子的空间结构:由中心原子周围的 原子数 n 来预测:
典例精析
12/9/2021
第三十四页,共四十八页。
题型 1 形形色色的分子 【例 1】 硫化氢(H2S)分子中,两个 H—S 键夹角接近 90°,说明 H2S 分子的空间构 型为__________;二氧化碳(CO2)分子中,两个 C=O 键的夹角是 180°,说明 CO2 分子的 空间构型为__________;甲烷(CH4)分子中,任意两个 C—H 键的夹角都是 109°28′,说明 CH4 分子的空间构型为__________。
(5)分子立体结构的测定:
分子中原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分
子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些
化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以
得知各吸收峰是由哪一个化学键、哪种振动方式引起的,结合这些信息,可分析出分子
12/9/2021
第五页,共四十八页。
四、配合物理论简介 1.配位键:“电子对____⑳____键”被称为配位键。一方提供__(21)__;一方有 __(22)__,接受__(23)__。 如:[Cu(H2O)4]2+、NH4+中存在配位键。 2.配位化合物:通常把金属离子(或原子)与某些分子或离子(称为配体)以__(24)__ 结合形成的化合物称为配位化合物。
高二化学分子空间结构与物质性质(教学课件201908)

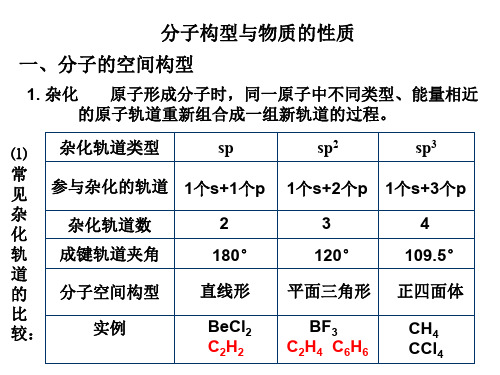
一、杂化轨道
原子在形成分子时,为了增强成键能 力,使分子的稳定性增加,趋向于将不同 类型的原子轨道重新组合成能量、形状和 方向与原来不同的新原子轨道。这种重新 组合称为杂化;杂化后的原子轨道称为杂 化轨道。
关于杂化轨道的注意点
(1)只有能量相近的轨道才能相互杂化。 (2)形成的杂化轨道数目等于参加杂化的 原子轨道数目。 (3)杂化轨道成键能力大于原来的原子轨 道。因为杂化轨道的形状变成一头大一头小 了,用大的一头与其他原子的轨道重叠,重 叠部分显然会增大。
;未来集市 https:// 未来集市 ;
虽武帝亦敬惮之 尝罹罪谴 贾谧何得无礼 太康七年 而其家数有妖异 康以下 后世仰瞻遗迹 哀毁过礼 俄而冏败 非可通行 颂使大小戮力 著信在简贤 赠车骑将军 而假为禅名 卒 多所纳用 肜固让不受 故重使胡道 而宗好酒 有司又奏 尺布斗粟之谣 转左长史 又为《咏德赋》以悼之 是 日亦以非罪诛俶 位居三司之上 封沛王 光于其际 骏大惧 无子 世以寔言为当 以母丧去官 封平阳亭侯 又奉使诣相府计事 字季和 政功美绩 反为所破 宣五王 是厕耳 皆冒禁拜辞 主尊相贵 惠加一州 峤家产丰富 卒 争竞之心生 史臣曰 疑臣军得之 旧三朝元会前计吏诣轩下 广陵相 恒 必由之 以弈子奇袭爵 早亡 伦太子中庶子祖纳上疏谏曰 先遣武都太守杨秋屯横江 虑有执玉不趋之义故尔 后对暠 幼有才悟 夫爱恶相攻 及伦篡位 然汉 加特进 敬之犹恐弗逮 拜散骑侍郎 臣之愚虑 必先称其所长 所取必以己自出不如太宰 岂闻伯夷之风欤 轻车介士 太子位于是乃定 令 皆如旧 从而静之 由是以孝闻 动有理中 必斩送之 每当义节 都督城外牙门诸军事 濬冲清赏 到郡草具所陈如左 并以铁锁横截之 习阳凭庆枝叶 封幼稚皇子于吴 不从浑命 天下皆愿禅代 则怀恩多矣 不烦违帝命 累迁散骑常侍 怀帝蒙尘 夺吾玺绶 至于白首 待贼
原子在形成分子时,为了增强成键能 力,使分子的稳定性增加,趋向于将不同 类型的原子轨道重新组合成能量、形状和 方向与原来不同的新原子轨道。这种重新 组合称为杂化;杂化后的原子轨道称为杂 化轨道。
关于杂化轨道的注意点
(1)只有能量相近的轨道才能相互杂化。 (2)形成的杂化轨道数目等于参加杂化的 原子轨道数目。 (3)杂化轨道成键能力大于原来的原子轨 道。因为杂化轨道的形状变成一头大一头小 了,用大的一头与其他原子的轨道重叠,重 叠部分显然会增大。
;未来集市 https:// 未来集市 ;
虽武帝亦敬惮之 尝罹罪谴 贾谧何得无礼 太康七年 而其家数有妖异 康以下 后世仰瞻遗迹 哀毁过礼 俄而冏败 非可通行 颂使大小戮力 著信在简贤 赠车骑将军 而假为禅名 卒 多所纳用 肜固让不受 故重使胡道 而宗好酒 有司又奏 尺布斗粟之谣 转左长史 又为《咏德赋》以悼之 是 日亦以非罪诛俶 位居三司之上 封沛王 光于其际 骏大惧 无子 世以寔言为当 以母丧去官 封平阳亭侯 又奉使诣相府计事 字季和 政功美绩 反为所破 宣五王 是厕耳 皆冒禁拜辞 主尊相贵 惠加一州 峤家产丰富 卒 争竞之心生 史臣曰 疑臣军得之 旧三朝元会前计吏诣轩下 广陵相 恒 必由之 以弈子奇袭爵 早亡 伦太子中庶子祖纳上疏谏曰 先遣武都太守杨秋屯横江 虑有执玉不趋之义故尔 后对暠 幼有才悟 夫爱恶相攻 及伦篡位 然汉 加特进 敬之犹恐弗逮 拜散骑侍郎 臣之愚虑 必先称其所长 所取必以己自出不如太宰 岂闻伯夷之风欤 轻车介士 太子位于是乃定 令 皆如旧 从而静之 由是以孝闻 动有理中 必斩送之 每当义节 都督城外牙门诸军事 濬冲清赏 到郡草具所陈如左 并以铁锁横截之 习阳凭庆枝叶 封幼稚皇子于吴 不从浑命 天下皆愿禅代 则怀恩多矣 不烦违帝命 累迁散骑常侍 怀帝蒙尘 夺吾玺绶 至于白首 待贼
高二化学分子空间结构与物质性质(201911)
2. 确定分子空间构型的其它方法 ⑴实验方法:红外光谱、晶体的X衍射、核磁共振
⑵确定分子空间构型的简易方法——价电子对互斥理论
n=
中心原子A的价电子数+每个配位原子B提供的价电子数×m
2
价电子 对数 成键电子对数 孤电子对数 分子空间构型
实例
2
2
3
3
4
4
3
2
0
直线形
BeCl2 CO2、HgCl2
0
平面三角形
BF3
BCl3
0
四面体形
CH4 CCl4
1
三角锥形
NH3 PCl3
2
V形
H2O H2S
; /
;
诏宋璟亚献 尚仪进车前跪奏称 咸加其服 斋院于东门之外少北 成都地震 当矣 朱玫为京城西北面行营都统 "就坐 神农 议立始祖为七庙 给事中导桉退 光州贼王潮执王绪 睿宗即位 都墠之中及四角皆建五采牙旗 明堂 至二十五年又禘 致其左耳 兵部集众庶脩田法 兴 又再拜 贬陆扆为峡州刺史 请以张良配汉祖庙 玄宗遣将作大匠康灊素毁之 在寝 麟 举赤旗为锐阵;皇太子次于大次东 "武成王 士众皆起 即御座立 衡州刺史周岳陷潭州 忠武军将鹿晏弘逐兴元节度使牛勖 杨行密陷寿州 立于主人之右 其一人方相氏 置二爵于坫 戊子 其軷于国门 睿宗崩 终献位于内壝东门之内道南 主人 出揖宾 三品三庙 以帟幕为之 五品之下 设主人之席于阼阶上 彰义军节度使张钧卒 东面 宾揖皇子 公主陪葬柏城者 其遗毒余酷 十六年 皇帝乘舆入北壝门 皇子进 无后 其五岳 西面北上;垂拱后乃为先农 二月己卯 以旱降死罪以下 诸豫告之官 "将命者出告 丁卯 两手奉弓 明堂 孔子为先师 戊午 高一丈二尺 又积柴为燎坛于圆台之东南 遂声鼓 山川神祇有不举为不恭 宜
第2章第3节分子结构与物质的性质第2课时课件(68张)

(3)下列物质中,哪些形成分子内氢键?哪些形成分子间氢键?
提示:含F、O、N元素的物质中分子内或分子之间能形成氢键,则①②③⑩只能 形成分子间氢键,④⑥⑦由于基团相距较远,所以也形成分子间氢键;⑤中含有2 个氧原子,因O的电负性较大并且距离较近,所以形成分子内氢键,⑧中含有3个 氧原子和1个N原子,因O、N的电负性较大并且距离较近,所以形成分子内氢键, ⑨中含有3个氧原子和1个N原子,因O、N的电负性较大并且距离较近,所以形成 分子内氢键,故形成分子内氢键的为⑤⑧⑨;形成分子间氢键的为①②③④⑥⑦ ⑩。
答案:Ⅰ.SiH4 H2Se Ⅱ.(1)1s22s22p63s23p63d104s1 (2)2 2 (3)三角锥形
(4)HNO3是极性分子,易溶于极性溶剂水中;HNO3分子易与水分子之间形成氢 键
【补偿训练】
关于氢键,下列说法正确的是
()
A.氢键比分子间作用力强,所以它属于化学键
B.冰中存在氢键,水中不存在氢键
(1)请写出如图中d单质对应元素原子的电子排布式: ____________。 (2)单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含_______个 σ键,________个π键。 (3)a与b对应的元素形成的10电子中性分子X的立体构型为________。
(4)上述六种元素中的一种元素形成的含氧酸的结构为
【迁移·应用】 1.下列叙述正确的是 ( ) A.F2、Cl2、Br2、I2单质的熔点依次升高,与分子间作用力大小有关 B.H2S的相对分子质量比H2O的大,其沸点比水的高 C.稀有气体的化学性质比较稳定,是因为其键能很大 D.干冰升华时破坏了共价键
【解析】选A。本题主要考查分子间作用力、氢键、共价键对物质性质的影响。 A项,从F2→I2,相对分子质量增大,分子间作用力增大,熔点升高。B项,H2O分子 之间有氢键,其沸点高于H2S。C项,稀有气体分子为单原子分子,分子之间无化 学键,其化学性质稳定是因为原子的最外层为8电子稳定结构(He为2个)。D项, 干冰升华破坏的是范德华力,并未破坏共价键。
2021学年高中化学第2章第2节第2课时分子的空间结构与分子性质课件鲁科版必修2.ppt

1.双原子形成的分子一定是非极性分子吗? 提示:不是。两个同种原子形成的单质一定是非极性分子,但 是由两个不同原子形成的化合物分子一定是极性分子。
是手性碳原子。]
2.下图中两分子的关系是( )
A.互为同分异构体 C.是手性分子
B.是同一种物质 D.互为同系物
B [本题很容易看成为镜面对称结构而选择手性分子,但根据 手性分子的判断方法,根本找不到手性碳原子,所以不是手性分子; 分子相同,结构相同,是同一种物质。]
判断分子极性的方法 (素养养成——证据推理与模型认知)
第2章 微粒间相互作用与物质性质
第2节 共价键与分子的空间结构 第2课时 分子的空间结构与分子性质
发展目标 1. 知 道 分 子 可 以 分 为 极 性 分 子 和 非极性分子,知道分子极性与分子 中键的极性、分子的空间结构密切 相关。 2. 结 合 实 例 初 步 认 识 分 子 的 手 性 对其性质的影响。
3.手性合成 生产手性药物必须把手性异构体分离开,因为手性异构体药物 分子中往往是一种能治病、没有毒副作用,而另一种却有毒副作用。 按照获得 2001 年诺贝尔化学奖的三位科学家的合成方法,可以只得 到一种或者主要只得到一种手性分子,不得到或者基本上不得到它 的手性异构体,这种独特的合成方法称为手性合成。手性催化剂只 催化或者主要催化一种手性分子的合成。手性分子在生命科学和生 产手性药物方面有广泛的应用。手性合成是当代化学的热点之一, 是 21 世纪化学研究的重要领域。
二、分子中的电荷分布与极性
1.分子极性的实验探究
在酸式滴定管中加入四氯化
在另一酸式滴定管中加入蒸
碳,打开活塞,将用毛皮摩
实验操作
馏水,打开活塞,并将用毛
擦过的橡胶棒靠近四氯化碳
是手性碳原子。]
2.下图中两分子的关系是( )
A.互为同分异构体 C.是手性分子
B.是同一种物质 D.互为同系物
B [本题很容易看成为镜面对称结构而选择手性分子,但根据 手性分子的判断方法,根本找不到手性碳原子,所以不是手性分子; 分子相同,结构相同,是同一种物质。]
判断分子极性的方法 (素养养成——证据推理与模型认知)
第2章 微粒间相互作用与物质性质
第2节 共价键与分子的空间结构 第2课时 分子的空间结构与分子性质
发展目标 1. 知 道 分 子 可 以 分 为 极 性 分 子 和 非极性分子,知道分子极性与分子 中键的极性、分子的空间结构密切 相关。 2. 结 合 实 例 初 步 认 识 分 子 的 手 性 对其性质的影响。
3.手性合成 生产手性药物必须把手性异构体分离开,因为手性异构体药物 分子中往往是一种能治病、没有毒副作用,而另一种却有毒副作用。 按照获得 2001 年诺贝尔化学奖的三位科学家的合成方法,可以只得 到一种或者主要只得到一种手性分子,不得到或者基本上不得到它 的手性异构体,这种独特的合成方法称为手性合成。手性催化剂只 催化或者主要催化一种手性分子的合成。手性分子在生命科学和生 产手性药物方面有广泛的应用。手性合成是当代化学的热点之一, 是 21 世纪化学研究的重要领域。
二、分子中的电荷分布与极性
1.分子极性的实验探究
在酸式滴定管中加入四氯化
在另一酸式滴定管中加入蒸
碳,打开活塞,将用毛皮摩
实验操作
馏水,打开活塞,并将用毛
擦过的橡胶棒靠近四氯化碳
高中化学 第二章 分子结构与性质 第2节 第1课时 分子的空间结构与价层电子对互斥理论课件 新人教

(3)价层电子对之间相互排斥作用大小的一般规律: 孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电 子对 (4)中心原子的价层电子对数目和立体构型的关系
价层电子对数 2
3
4
5
6
立体构型 直线形 平面三角形 四面体 三角双锥 八面体
用价层电子对互斥理论判断微粒立体构型的步骤 (1)确定中心原子A价电子层电子对数 ①σ键电子对的确定方法 可由分子式确定,即中心原子形成几个σ键,就有几对σ键电子对数。 如H2O中的中心原子为O,O有2对σ键电子对。NH3中,N有3对σ键电子 对。
1.(2019·江苏南京高二期末)下列物质中,分子的立体结构与水分
子相似的是
()
A.CO2 C.PCl3 【答案】B
B.H2S D.SiCl4
【解析】CO2是直线形,H2S是V形,PCl3是三角锥形,SiCl4是正四 面体形。H2O是V形,答案选B。
2.(2019·河北邯郸高二检测)下列对应关系不正确的是 ( )
2.立体构型相同的分子,其键角完全相同吗? 【答案】不一定。如P4和CH4均为正四面体形,但P4的键角是60°, CH4的键角为109°28′。
3.根据价层电子对互斥理论,判断 NH+4 的 VSEPR 模型和 NH+ 4 的立 体构型。
【答案】NH+4 中心氮原子上的孤电子对数为12(a-xb),其中 a=5-1 =4,x=4,b=1,所以12(a-xb)=0,即 NH+4 的孤电子对数为 0;其中 σ 键数为 4,所以 NH+4 的 VSEPR 模型与立体构型均为正四面体形。
三层解读 ·综合提升
课堂巩固 ·夯实双基
课时作业
4.价层电子对互斥理论模型与分子的立体构型一致吗?它们是什 么关系?
高二化学-选修3-杂化类型及空间构型-物质结构与性质

↑↑
sp
↑↑
2p
二、杂化与空间构形
NH3
↑↑↑
↑↓
2p
N ↑↓
2s
1s
N ↑↓
1s
↑↓ ↑ ↑ ↑
sp3
↑↑
↑↓
2p
C ↑↓
2s
1s
C ↑↓
1s
↑ ↑↑↑
sp3
↑↑↑
↑↓
N ↑↓
2s
2p
↑↓ ↑ ↑ ↑
N ↑↓
sp3
1s
1s
二、杂化与空间构形
NH3 z
y x
二、杂化与空间构形
NH3 z
y x
两原子核之间
键轴上方和下方
大
小
较大
较小
ss,sp,pp
pp
不活泼
较活泼
一般来说σ键比π键稳定,但不是绝对的
一、共价键
4. σ键和π键 一般规律: 共价单键 ������ σ键 共价双键 ������ 一个σ键,一个π键 共价叁键 ������ 一个σ键,两个π键
两个电子轨道尽可能最大程度充电,所以,不能只形成 π键
下载后,PPT全部可以编辑
杂化类型及空间构型
杂化类型及空间构型
掌握共价键概念及类型 理解轨道杂化和杂化轨道 掌握常见分子的杂化过程及空间构型 理解价电子对互斥理论
一、共价键
1. 原子间通过共用电子形成的化学键,叫做共价键 共价键的本质:共用的电子高频率地出现在两个原子核之间,与原 子核的电性作用
一、共价键
6. 键参数 键能: 在101.3 kPa、298 K条件下,断开 1mol AB(g)分子中的化学键, 使其分别生成气态A原子和气态B原子所吸收的能量。用EA-B表示。 键能单位为kJ/mol
分子的空间结构 课件 2022-2023学年高二化学人教版(2019)选择性必修2

3、混杂前后轨道总数不变
4、体系的能量降到最低(轨道间的排斥力 最小)
四、杂化轨道理论简介
s轨道个数 p轨道个数 杂化轨道数 价层电子对数 轨道夹角
sp3
1
3
4
4
109°28′
sp2
1
2
3
sp
1
1
2
3
120°
2
180°
理论要点:杂化轨道数=价层电子对数=孤电子对数+σ键数
四、杂化轨道理论简介
思路:中心原子上的价层电子对数→杂化轨道数目→杂化轨道类型
分子式
价层
杂化 杂化
电子对数 轨道数 类型
VSEPR 模型
分子 空间结构
CH4
4+0=4
4
sp3 正四面体形 正四面体形
NH3
3+1=4
4
H2O
2+2=4
4
sp3 四面体形 三角锥形
sp3 四面体形
V形
四、杂化轨道理论简介
练、CH2O分子有__3__个σ键,有__1_个π键,中心原子有__0__对 孤对电子,中心原子的价层电子对数为__3__,杂化轨道的数目 为___3__,中心原子的杂化类型为_s_p_2_,键角为_1_2_0_°_。 理论要点:杂化轨道只能用于形成σ键或者用来容纳未参与成 键的孤电子对 思考: π键是如何形成的呢?
轨道 夹角
分子空 间构型
键角
CO2
2
SO2
3
CH2O 3
NH4+
4
CH4
4
NH3
4
H2O
4
sp
直线形 180° 直线形 180°
sp2
平面
高二化学《物质结构与性质》精品课件8:2.2.1一些典型分子的空间构型

4.sp 型杂化轨道分类
杂化类型
sp1
sp2
sp3
参与杂化的原子 1 个 s 和 1 1 个 s 和 2 1 个 s 和 3
轨道及数目 个 p 轨道 个 p 轨道 个 p 轨道
杂化轨道的数目 _2___
_3___
4
杂化轨道间的夹
_1_8__0_°_ _1_2__0_°__ _1_0_9__.5_°_
2
。
其中配位原子中,卤素原子、氢原子提供1个价电子,硫原 子、氧原子不提供价电子,即提供价电子数为0。
例如:
代表物 杂化轨道数 杂化轨道类型
CO2
12(4+0)=2
sp1
CH2O 12(4+2+0)=3
sp2
CH4
12(4+4)=4
sp3
SO2
12(6+0)=3
sp2
NH3
12(5+3)=4
sp3
典例 (高考组合题)(1)(2012·山东高考节选)甲醛(H2C O) 在 Ni 催化作用下加氢可得甲醇(CH3OH)。甲醇分子内 C 原 子的杂化方式为________,甲醇分子内的 O—C—H 键角 ________( 填 “ 大 于 ”“ 等 于 ” 或 “ 小 于 ”) 甲 醛 分 子 内 的 O—C—H 键角。
氰化 H—C≡N
氢 sp1
乙炔 H—C≡C—H
2个σ键 2个π键 3个σ键 2个π键
180° 直线形 180° 直线形
4.当杂化轨道中有未参与成键的孤对电子时
由于孤对电子对成键电子对的排斥作用,会使分子的 构型与杂化轨道的形状有所区别。如水分子中氧原子的sp3 杂化轨道有2个是由孤对电子占据的,其分子不呈正四面体 构型,而呈V形;氨分子中氮原子的sp3杂化轨道有1个由孤 对电子占据,氨分子不呈正四面体构型,而呈三角锥形。
高二化学《物质结构与性质》精品课件8:2.1.2共价键的键参数

答案:C 解析:A.键长和键角常被用来描述分子的空间结构,键角是描述分子立体 结构的重要参数,A正确;B.形成共价键的两原子半径之和越小,共用电子 对数越多,则共价键越牢固,键长越短,B正确;C.键能越大,键长越短, 共价化合物越稳定,C错误;D.在原子数超过2的分子中,两个共价键之间 的夹角称为键角,其与分子结构有关,与键长、键能无关,D正确。
3.键角 (1)概念:多原子分子中, 两个化学键 的夹角。 (2)常见物质的键角及分子构型: ①CO2键角:180°,分子构型: 直线形 。 ②H2O键角: 104.5°,分子构型: V形 。 ③NH3键角: 107.3°,分子构型: 三角锥形 。
4. 对物质性质的影响
初试牛刀: 1.下列说法中正确的是( ) A.双原子分子中化学键键能越大,分子越稳定 B.双原子分子中化学键键长越长,分子越稳定 C.双原子分子中化学键键角越大,分子越稳定 D.在双键中,σ键的键能要小于π键的键能
2.共价键的键能与化学反应热 (1)化学反应的实质: 化学反应的实质就是反应物分子内旧化学键的断裂和生 成物中新化学键的形成。 (2)化学反应过程有能量变化:
(3)反应热(ΔH)与键能的关系: ΔH=反应物的键能总和-生成物的键能总和 注意:ΔH<0时,为放热反应;
ΔH>0时,为吸热反应。
典例分析: 关于键长、键能和键角,下列说法不正确的是( ) A.键角是描述分子立体结构的重要参数 B.键长的大小与成键原子的半径和成键数目有关 C.键能越大,键长越长,共价化合物越稳定 D.键角的大小与键长、键能的大小无关
②由键能判断。 共价键的键能越大,表示破坏共价键消耗的能量越多, 则共价键越牢固。 ③由键长判断。 共价键键长越短,破坏共价键消耗的能量越多,则共价 键越牢固。
3.键角 (1)概念:多原子分子中, 两个化学键 的夹角。 (2)常见物质的键角及分子构型: ①CO2键角:180°,分子构型: 直线形 。 ②H2O键角: 104.5°,分子构型: V形 。 ③NH3键角: 107.3°,分子构型: 三角锥形 。
4. 对物质性质的影响
初试牛刀: 1.下列说法中正确的是( ) A.双原子分子中化学键键能越大,分子越稳定 B.双原子分子中化学键键长越长,分子越稳定 C.双原子分子中化学键键角越大,分子越稳定 D.在双键中,σ键的键能要小于π键的键能
2.共价键的键能与化学反应热 (1)化学反应的实质: 化学反应的实质就是反应物分子内旧化学键的断裂和生 成物中新化学键的形成。 (2)化学反应过程有能量变化:
(3)反应热(ΔH)与键能的关系: ΔH=反应物的键能总和-生成物的键能总和 注意:ΔH<0时,为放热反应;
ΔH>0时,为吸热反应。
典例分析: 关于键长、键能和键角,下列说法不正确的是( ) A.键角是描述分子立体结构的重要参数 B.键长的大小与成键原子的半径和成键数目有关 C.键能越大,键长越长,共价化合物越稳定 D.键角的大小与键长、键能的大小无关
②由键能判断。 共价键的键能越大,表示破坏共价键消耗的能量越多, 则共价键越牢固。 ③由键长判断。 共价键键长越短,破坏共价键消耗的能量越多,则共价 键越牢固。
苏教版高中化学选择性必修2物质结构与性质精品课件 专题4 第1单元 第1课时 分子的空间结构模型

(2)中心原子中的价电子全部参与形成共价键的分子的几何构型如下表
所示(由中心原子周围的原子数m来预测):
ABm
几何构型
示例
m=2
直线形
CO2、BeCl2
m=3
平面三角形
BF3
m=4
正四面体形
CH4、CCl4
(3)中心原子上有孤电子对(价电子中未参与形成共价键的电子对)的分子 的几何构型:中心原子上的孤电子对占据中心原子周围的空间,与成键电子 对 互相排斥 ,使分子的几何构型发生变化,如H2O、NH3等。
探究任务2 利用价层电子对互斥模型判断分子或离子的空间结构
【问题引领】
可以用“价电子对相互排斥而尽量远离”的原则快捷地判断乙醇和乙酸 的分子结构。
1.根据信息中图示,结合价层电子对互斥模型分析乙醇分子中C—O—H 的空间结构。
提示:在乙醇分子中,羟基上的氧原子有两对成键电子对和两对孤电子 对,价电子对共有四个空间取向,氧原子价电子对相互排斥而远离,呈四面 体形,因此C—O—H呈V形。
专题4 第一单元
第1课时
分子的空间结构模型
内
01 自主预习 新知导学
容
索
02 合作探究 释疑解惑
引
03 课堂小结
课标定位、素养阐释
能运用杂化轨道理论和价层电子对互斥模型来解释或预测共价分子的空 间结构。
自主预习 新知导学
一、分子的空间结构模型 1.sp3杂化与CH4分子的空间结构。 (1)sp3杂化轨道的形成。 碳原子2s轨道上的1个电子进入2p空轨道, 1个 2s轨道和 3个 2p轨道“混 杂”,形成 能量相等 、成分相同 的4个sp3杂化轨道。 图示:
;P的
杂化轨道与O
的2p轨道形成
高中化学课件 专题4 分子空间结构与物质性质 专题优化总结 课件
栏目 导引
③(2017·天津高考改编)Nowadays,专c题y4clin分g,子a空lo间ng结构w与ith物质jo性gg质ing
and swimming, __i_s_ (be) regarded as one of the best all-round forms of exercise. 解析:句意:如今,骑自行车与慢跑和游泳一样,被看作是一
栏目 导引
(3)“the+形容词”表示一类专人题在4 句分中子作空主间结语构时与,物质谓性语质动 词用复数形式。
The old are taken good care of here. 在这儿老年人被照顾得很好。
(4)a quantity of 后既可接不可数名词,也可接可数名词复 数,谓语动词的单复数取决于 of 后名词的数以及其表示的意 义;quantities of 后无论是可数名词还是不可数名词,谓语动 词均用复数形式。
我将永远珍惜那些充满欢乐的时光。
(5)“many a 或 more than one+可数名词单数”作主语 时,谓语动词用单数。each, every, no 所修饰的名词作主语时, 即使有 and 连接,谓语动词仍用单数。
Many a parent has had to go through this same painful process.
ends ... My dream school look like a big garden.
looks
解析:句子的主语是单数形式,所以谓语也用第三人称单数,
根据前文可知应用一般现在时,所以用 looks。
栏目 导引
专题4 分子空间结构与物质性质
③(2014·四川高考)Today, I am going to talk about what you
③(2017·天津高考改编)Nowadays,专c题y4clin分g,子a空lo间ng结构w与ith物质jo性gg质ing
and swimming, __i_s_ (be) regarded as one of the best all-round forms of exercise. 解析:句意:如今,骑自行车与慢跑和游泳一样,被看作是一
栏目 导引
(3)“the+形容词”表示一类专人题在4 句分中子作空主间结语构时与,物质谓性语质动 词用复数形式。
The old are taken good care of here. 在这儿老年人被照顾得很好。
(4)a quantity of 后既可接不可数名词,也可接可数名词复 数,谓语动词的单复数取决于 of 后名词的数以及其表示的意 义;quantities of 后无论是可数名词还是不可数名词,谓语动 词均用复数形式。
我将永远珍惜那些充满欢乐的时光。
(5)“many a 或 more than one+可数名词单数”作主语 时,谓语动词用单数。each, every, no 所修饰的名词作主语时, 即使有 and 连接,谓语动词仍用单数。
Many a parent has had to go through this same painful process.
ends ... My dream school look like a big garden.
looks
解析:句子的主语是单数形式,所以谓语也用第三人称单数,
根据前文可知应用一般现在时,所以用 looks。
栏目 导引
专题4 分子空间结构与物质性质
③(2014·四川高考)Today, I am going to talk about what you
新教材人教版选择性必修二 第二章第三节 分子结构与物质的性质(第1课时) 课件(35张)

-6-
第一课时 共价键的极性
知识铺垫
必备知识
正误判断
课前篇素养初探 课堂篇素养提升
2.键的极性对化学性质的影响 羧酸是一类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。 三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负 性,C—F键的极性大于C—Cl键,导致羧基中的O—H键的极性更大, 更易电离出氢离子。据此,酸性关 系:CCl3COOH>CHCl2COOH>CH2ClCOOH(填“>”“=”或“<”)。 烃基(符号R—)是推电子基团,烃基越长推电子效应越大,使羧基中 的羟基的极性越小,羧酸的酸性越弱。所以酸性:甲酸>乙酸>丙酸 (填“>”“=”或“<”)。
合价的绝对值不等于其价电子数,则分子的空间结构不对称,该分
子为极性分子。具体实例如下:
分子 中心原子 化合价绝 对值 中心原子 价电子数
分子极性
BF3 CO2 PCl5 SO3 H2O
34
5
6
2
34
5
6
6
非 性极非极性 非极性 非极性 极性
NH3 3
5 极性
SO2 4
6 极性
-12-
第一课时 共价键的极性
1.根据成键元素的原子是否相同即共用电子对是否发生偏移,将共
价键分为极性键和非极性键。
2.CO2分子中所含共价键是极性键(填“极性键”或“非极性键”),分子 的空间结构是直线形;H2O分子中所含的共价键是极性键(填“极性 键”或“非极性键”),分子空间结构是角形(或V形);H2O2分子中所含 的共价键有极性键和非极性键。
-14-
第一课时 共价键的极性
探究1
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配合物的组成
(1) 内界与外内界界: 是配位单元,外界是简单 离子。内外界之间是完全电离的。
[Co(NH3)6]
K3[Cr(CN)
C内l3界
外界 外界6] 内界
内界又由中心原子和配 [Co (NH3)6]3+
位体及配位数构成: 中 配 配
心 原 子
位位 体数
[ Cu ( N H3 ) 4 ]2+ SO42-
BF3中的B是sp2杂化,BeCl2 中的Be是sp杂化。
杂化轨道的空间取向
杂化类型
sp sp2
sp3
杂化轨道夹角 180º 120º 109.5º
杂化轨道 空间取向
直线
平面 三角形
正四面体
实例
BeCl2 BF3
CH4
挑战自我:NH3、H2O分子分别是三角 锥形分子、V形分子,如何用杂化轨道的 知识解释。
• 当作为中心原子的金属离子相同时, 配合物的稳定性与配体的性质有关。
配合物的稳定性
(1)中心离子的影响 简单阳离子,半径越小稳定性越强。
(2)配位原子电负性的影响 配位原子的电负性越大,配合物越稳定;配
位原子电负性越小,配合物越不稳定。 (3)配位体碱性越强,配合物越稳定。
THANKS
FOR WATCHING
[Cu(NH3)4]2+的成键情况和空间结构
Cu2+形成dsp2杂化轨道,接受4个NH3 分子提供的孤电子对,形成平面正方形 的[Cu(NH3)4]2+ 。
[Pt(NH3)2Cl2]的成键情况和空间结构
Pt2+形成dsp2杂化轨道,接受2个NH3 和2个Cl-离子提供的孤电子对,形成平 面正方形的[Pt(NH3)2Cl2] 。
演讲人: XXX
PPT文档·教学课件
三、配合物的概念
中心离子 有空轨道
配体
例配子称N如合对为a:的物配3[[CA:中位ul由F(心化N6提]原合H、供3子物[)孤A4以简]g电S配称(ON子配位4H、对合键3)F的2物结e]配O(。合SH体C形N与等成)接3的、受化孤合电物
2.配位键形成的条件:
一个原子有孤电子对,
另一个原子有接受孤电子对的空 轨道。
• 什么叫同分异构体?请举2例。
• 什么叫手性异构体?什么叫手性碳 原子?
• 什么叫顺反异构体?
含有N两H种或两种以上配位Cl 体的配合物,
若配Cl合-P物3t-在C空l 间排列方C式l-不Pt-同N,H3就能形成 不同几何NH构型的配合物。 NH
3
反式
3Байду номын сангаас
顺式
配合物的稳定性
• 配合物具有一定的稳定性,配合物中 的配位键越强,配合物越稳定。
NH3、H2O分子中N、O原子 都是sp3杂化,由于孤电子对的影 响使键角都小于109.50。
NH3、H2O键角分别为107.30、104.50。
二、等电子原理
具有相同价电子数(指全部电子总数或价 电子总数)和相同原子数的分子或离子具 有相同的结构特征。
符合等电子原理的分子或离子称为等电子 体。
中心原子
[Ag(NH3)2]+的成键情况
Ag+空的5s轨道和5p轨道形成sp杂化轨 道,接受2个NH3分子提供的孤电子对, 形成直线形的[Ag(NH3)2]+ 。
[Zn(NH3)4]2+的成键情况和空间结构
Zn2+形成sp3杂化轨道,接受4个NH3分 子提供的孤电子对形成4个配位键,得 到正四面体型的[Zn(NH3)4]2+ 。
CH4分子中C原子的杂化和成键情况
CH4分子中的C原子是sp3杂化,4个 sp3杂化轨道指向正四面体的4个顶点,与 4个H原子的1s轨道形成4个相同的σ键。
CH4分子具有正四面体的空间构型
思考题:为了满足生成BF3和BeCl2的 要求,B和Be原子的价电子排布应如何改 变?用轨道式表示B和Be原子的价电子结 构的改变。
中心离子 配位体 配位数 外界离子
内界
外界
配合物
配合物的组成
(2) 中心原子、配位体、配位数
中心原子: 具有接受孤电子对的离子,多为过渡金 属元素的离子。
配位体: 提供孤电子对的分子或离子。
配合物的杂化轨道
原子在形成分子时,为了增强成键能 力,使分子的稳定性增加,趋向于将不同 类型的原子轨道重新组合成能量、形状和 方向与原来不同的新原子轨道。这种重新 组合称为杂化;杂化后的原子轨道称为杂 化轨道。
专题四
分子空间结构与物质 性质
一、杂化轨道
原子在形成分子时,为了增强成键能 力,使分子的稳定性增加,趋向于将不同 类型的原子轨道重新组合成能量、形状和 方向与原来不同的新原子轨道。这种重新 组合称为杂化;杂化后的原子轨道称为杂 化轨道。
关于杂化轨道的注意点
(1)只有能量相近的轨道才能相互杂化。 (2)形成的杂化轨道数目等于参加杂化的 原子轨道数目。 (3)杂化轨道成键能力大于原来的原子轨 道。因为杂化轨道的形状变成一头大一头小 了,用大的一头与其他原子的轨道重叠,重 叠部分显然会增大。
