2-2蛋白质化学-(结构与功能)
试举例说明蛋白质结构与功能的关系

蛋白质结构与功能的关系蛋白质是生命体中起着关键作用的分子之一。
它们通过其特定的结构来实现多种生物学功能。
本文将探讨蛋白质的不同结构类型以及这些结构与功能之间的关系。
一、蛋白质的结构类型蛋白质的结构可分为四个层次:一级结构、二级结构、三级结构和四级结构。
下面将详细介绍这些结构类型。
1. 一级结构一级结构是蛋白质的线性序列,由氨基酸的顺序组成。
氨基酸是构成蛋白质的基本单元,目前已经发现了20种天然氨基酸。
一级结构的顺序决定了蛋白质的独特性质和功能。
2. 二级结构二级结构是蛋白质中部分氨基酸的局部排列方式。
常见的二级结构包括α-螺旋和β-折叠。
α-螺旋是一种螺旋形状的结构,由蛋白质链的螺旋部分组成。
β-折叠是一种类似于折纸的结构,由蛋白质中的平行或反平行β链组成。
3. 三级结构三级结构是蛋白质整体的立体结构。
它由蛋白质链的折叠和弯曲形成。
三级结构的稳定性由各个氨基酸之间的相互作用决定,如氢键、范德华力和离子键等。
三级结构的稳定性对蛋白质的功能至关重要。
4. 四级结构四级结构是由两个或多个蛋白质链相互作用形成的复合物。
复合物中的蛋白质链可以具有相同的结构或不同的结构。
四级结构的形成使蛋白质具有更加复杂和多样化的功能。
二、蛋白质结构与功能的关系蛋白质的结构与其功能之间存在密切的关系。
不同的结构决定了不同的功能。
下面将详细介绍蛋白质结构与功能之间的关系。
1. 结构决定功能蛋白质的结构决定了其所能够实现的功能。
不同的结构使得蛋白质能够与其他分子发生特定的相互作用。
例如,酶是一种具有特定结构的蛋白质,它能够催化化学反应。
酶的结构确定了其可以与底物结合并加速反应的能力。
2. 结构稳定性与功能的关系蛋白质的结构稳定性对其功能至关重要。
结构稳定性差的蛋白质可能无法正确地完成其生物学功能。
许多蛋白质的结构稳定性受到环境条件的影响。
例如,温度变化可以影响蛋白质的结构稳定性,从而影响其功能表现。
3. 变构与功能的调控许多蛋白质能够通过结构的变化来调控其功能。
蛋白质结构与功能

蛋白质结构与功能蛋白质是生物体内最基础且重要的分子之一,它们在维持生命活动中扮演着关键角色。
蛋白质的结构决定了其功能和活性。
本文将深入探讨蛋白质的结构特征以及与功能之间的关系。
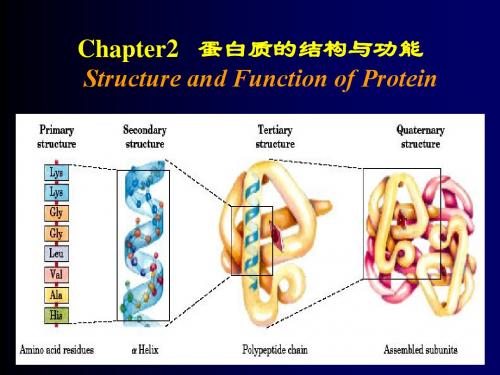
一、蛋白质的结构层次蛋白质的结构可以分为四个层次:一级结构、二级结构、三级结构和四级结构。
1. 一级结构:一级结构是蛋白质的线性序列,由氨基酸组成。
氨基酸的顺序和类型决定了蛋白质的终极结构和功能。
共有20种常见氨基酸,它们的排列方式多种多样,因此不同的蛋白质具有不同的氨基酸序列。
2. 二级结构:二级结构是由蛋白质内部氨基酸间的氢键相互作用所形成的局部结构特征。
最常见的二级结构是α-螺旋和β-折叠。
α-螺旋是由蛋白质链的某一片段呈螺旋形式排列而成,而β-折叠则是由链的不同片段呈折叠形式排列而成。
二级结构的形成大大增强了蛋白质的稳定性。
3. 三级结构:三级结构是蛋白质空间结构的进一步折叠排列。
蛋白质通过各种原子间的相互作用,如疏水作用、静电作用和氢键等,形成特定的三维折叠结构。
这种结构的稳定性非常重要,因为它决定了蛋白质的功能。
4. 四级结构:四级结构指的是由多个蛋白质聚合体组成的复合物。
多个蛋白质单体通过静电作用、亲水作用或共价键连接在一起,形成更复杂的分子结构。
例如,人体中的血红蛋白就是由四个亚单位组成的复合物。
二、蛋白质的功能蛋白质的结构和功能密切相关,不同的结构决定了不同的功能。
1. 结构蛋白质:结构蛋白质是组成细胞和组织的重要组成部分,它们提供了细胞和组织的形态支持。
例如,胶原蛋白是皮肤、骨骼和血管的重要组成成分,使它们具有机械强度和韧性。
2. 功能蛋白质:功能蛋白质是参与生物化学反应和调节生理过程的蛋白质。
例如,酶是生物体内的催化剂,能够加速化学反应的速率。
激素是一类能够在体内传递信号的蛋白质,例如胰岛素可以调节血糖水平。
3. 运输蛋白质:运输蛋白质能够帮助物质在细胞和体液中进行运输。
例如,血红蛋白能够携带氧气从肺部到组织器官,维持正常的呼吸和新陈代谢。
2 蛋白质的结构和功能

目录
二、蛋白质的二级结构
指肽链的主链在空间的 排列,或规则的几何走
向、旋转及折叠。它只
涉及肽链主链的构象及 链内或链间形成的氢键, 并不涉及到氨基酸侧链 R基团的构象。
蛋白质的二级结构类型
α-螺旋结构 β-折叠结构 β-转角 无规卷曲
(1) -螺旋
Pauling和Corey于 1965年提出。
(2) -折叠
也叫 -结构或 -构象,
它是蛋白质中第二种最常见 的二级结构。是一种肽链相
当伸展的结构。肽链按层排 列,依靠相邻肽链上的羰基
和氨基形成的氢键维持结构
的稳定性。肽键的平面性使 多肽折叠成片,氨基酸侧链 伸展在折叠片的上面和下面。
-折叠的特点:
①在-折叠中,-碳原子总是处于折叠的角上,
肽键的特点:
C O
反式
N
H
O
顺式
H N
C
C—N单键键长为0.149nm, C=N双键键长为0.127nm 肽键中C-N键长为0.132nm,具有部分双
键性质,不能自由旋转;
有顺反二型,与C-N相连的H、O均为反式,
形成肽键平面。
肽键平面示意图
* 肽是由氨基酸通过肽键缩合而形成的化 合物。 * 两分子氨基酸缩合形成二肽,三分子氨 基酸缩合则形成三肽…… * 由十个以内氨基酸相连而成的肽称为寡 肽(oligopeptide),由更多的氨基酸相连 形成的肽称多肽(polypeptide)。
第二节 蛋白质的分子结构
The Molecular Structure of Protein
蛋白质的分子结构包括
一级结构(primary structure)
二级结构(secondary structure)
第二章蛋白质的结构和生理功能

二、氨基酸的性质和生理特点 (一)性质 1.物理性质 无味、无色晶体物质; 熔点200-300oC之间,会分解成胺和CO2; 具有较高的介电常数; 一般可溶于水,其水溶液为无色透明液体, 溶解度各不相同; 一般不溶于有机溶剂; 均溶于稀酸或稀碱。
2.氨基酸的晶体存在形式
氨基酸晶体是以离子晶格组成的,维系晶 格中质点的作用力是较强的静电吸引力,因而 熔点高,而一般的有机化合物晶体是由分子晶 格组成,其维系力为较弱的范德华力,此类物 质熔点较低。
蛋白质功能的多样性
• 具有储藏氨基酸的功能。用作有机体及其胚胎 或幼体生长发育的原料。如蛋类中的卵清蛋白、 乳中的酪蛋白、小麦种子中的麦醇蛋白。 • 运输功能。脊椎动物红细胞里的血红蛋白、无 脊椎动物中的血蓝蛋白在呼吸过程中起着输送 氧气的作用;血液中的脂蛋白随血流输送脂质; 生物氧化过程中的某些色素蛋白如细胞色素C 等起电子传递体的作用。
• • • • 氨基酸排列随机性 周期性的重复未发现 二硫键的数目和位置也没有明显的规律 每种蛋白质化学结构的独特性 在同源蛋白质氨基酸顺序中有许多位置的氨基 酸对所有种属来说是相同的(不变残基),但 其他位置的氨基酸却不同(可变残基)。这种 相似性被称为顺序同源现象。
蛋白质一级结构的重要性
氨基酸组成及顺序不同会导致蛋 白质生物功能的改变(病态现象)。如 镰刀形细胞贫血病就是血红蛋白(4个 亚基,582个氨基酸组成)中的一个谷 氨酸变为缬氨酸导致的。 一级结构是立体结构的基础。
在研究蛋白质氨基酸组成时一般先用完全 水解的方法,将蛋白质水解成各种氨基酸的 混合物,然后采用高效液相色谱等方法进行 定量测定。通常采用的水解方法有酸水解、 碱水解和酶水解。
酸水解
用硫酸(6 mol/L)或盐酸(4 mol/L)煮沸回流20小时。
蛋白质二级结构指定和功能分析

蛋白质二级结构指定和功能分析蛋白质二级结构是指蛋白质骨架结构中有规律重复的构象。
由蛋白质原子坐标正确地指定蛋白质二级结构是分析蛋白质结构与功能的基础,二级结构的指定对于蛋白质分类、蛋白质功能模体的发现以及理解蛋白质折叠机制有着重要的作用。
并且蛋白质二级结构信息广泛应用到蛋白质分子可视化、蛋白质比对以及蛋白质结构预测中。
而目前蛋白质二级结构指定方法的一致性较差,因此,蛋白质二级结构指定仍然是结构生物信息学中一个比较活跃的课题。
目前有超过20种蛋白质二级结构指定方法,这些方法大体可以分为两大类:基于氢键和基于几何,不同方法指定结果之间的差异较大。
对于蛋白质中最重要的二级结构之一的螺旋而言,这种差异可能是来源于已有的方法指定螺旋时并没有严格地遵循螺旋的几何特征:它们或者使用不能准确计算的氢键能量,或者使用没有准确范围的残基骨架二面角,或者使用的几何特征(如Cα原子之间距离与夹角)不足以定义一条完整的螺旋曲线。
DSSP(Define Secondary Structure of Proteins)是蛋白质二级结构指定领域比较公认的标准,DSSP是基于氢键的指定方法,它利用静电能量代替氢键能量并且通过近似计算得到氢原子坐标。
蛋白质内部疏水环境的介电常数和蛋白质表面的介电常数差异很大,DSSP并没有考虑残基所处的环境而将介电常数作为一个定值,另外由于氢键模式会有交叉重叠(与多个残基形成氢键),因此DSSP会指定出一些在几何上明显异常与不规则的二级结构。
STRIDE(STRuctural IDEntification)可以看做是DSSP的改进,STRIDE统计了螺旋和片层残基骨架二面角在拉氏图上的分布,在指定时将具有异常骨架二面角的残基排除,即使这些残基形成了螺旋与-片层相应的氢键模式。
但是,STRIDE 关注每个残基局部的几何特征,并没有考虑如何使二级结构整体片段更加一致。
在研究蛋白质二级结构指定时,我们发现,有一些二级结构出现在蛋白质配体结合位点概率很高,并且与蛋白质的功能关系密切,进一步研究发现,拉氏图上不同区域的残基对蛋白质配体结合位点倾向性不同。
2蛋白质空间构象与功能的关系

2-2蛋白质空间构象与功能的关系一、蛋白质分子的空间结构蛋白质分子井非如一级结构那样是完全展开的“线状”,而是处于更高级的水平。
天然蛋白质可折叠、盘曲成—定的空间结构(三维结构)。
蛋白质的空间结构指蛋白质分子内各原子围绕某些共价键的旋转而形成的各种空间排布及相互关系,这种空间结构称为构象。
按不同层次,蛋白质的高级结构可分为二,三和四级结构。
1.蛋白质的二级结构多肽链主链中各原子在各局部的空间排布,即多肽链主链构象称为蛋白质的二级结构。
蛋白质二级结构的基本形式:蛋白质的肽链局部盘曲、折叠的主要有α-螺旋、β-折叠、β-转角和不规则卷曲等几种形式。
1)α-螺旋:肽链的某段局部盘曲成螺旋形结构,称为α-螺旋。
α-螺旋的特征是:①—般为右手螺旋;②每螺旋圈包含3.6个氨基酸残基,每个残基跨距为0.15nm,螺旋上升1圈的距离(螺距)为3.6×0.15=0.54nm;③螺旋圈之间通过肽键上的>C=O和-NH-间形成氢键以保持螺旋结构的稳定;④影响α-螺旋形成的主要因素是氨基酸侧链的大小、形状及所带电荷等性质。
2)β-折叠:为—种比较伸展、呈锯齿状的肽链结构。
两段以上的β-折叠结构平行排布并以氢键相连所形成的结构称为β-片层或β-折叠层。
β-片层可分顺向平行(肽链的走向相同,即N、C 端的方向一致)和逆向平行(两肽段走向相反)结构。
3)β-转角:此种结构指多肽链中出现的一种180的转折。
β-转角通常由4个氨基酸残基构成,由第1个残基的>C=O与第4个残基的-NH-形成氢键,以维持转折结构的稳定。
4)不规则卷曲:此种结构为多肽链中除以上几种比较规则的构象外,多肽链中其余规则性不强的—些区段的构象。
各种蛋白质依其一级结构特点在其多肽链的不同区段可形成不同的二级结构。
如蜘蛛网丝蛋白中有很多α-螺旋及β-折叠层,也有β-转角和不规则卷曲。
二、蛋白质的三级结构多肽链中,各个二级结构的空间排布方式及有关侧链基团之间的相互作用关系,称为蛋白质的三级结构。
e2-2蛋白质结构的柔性

e2-2 蛋白质结构的柔性柔性是蛋白质行使其生物功能所必需的。
一种蛋白质可能因突变而变得对热更加稳定,但如果以柔性的降低为代价,会导致这种蛋白质的功能的降低甚至丧失。
与生活在一般温度下的生物相比,生活在极端温度下的嗜热生物(thermophile)体内的酶具有嗜热的性质。
这些嗜热的酶在常温下活性很低,这是因为一般的温度限制了它们在结构上的柔性。
因为维持二级结构和三级结构的作用力都是弱键,所以在生理温度下有足够能量打破任何特定的次级作用。
当存在的次级键被打破的时候,其释放的基团能够建立新的作用,这些重排发生得极快,很难用一般的测定方法(如X射线衍射)检测到。
因此通过物理方法测定出来的蛋白质的三维结构实际上是一种平均结构。
在生理温度下,大多数蛋白质分子上的原子运动的距离在0.1nm左右,有时更远,这取决于它们在蛋白质中的位置。
在紧密折叠的蛋白质内部,原子运动被限制在0.1nm 以下。
与分子表面越近,运动性越强。
如果位于表面的基团周围没有其他原子,那么它们运动的距离可达零点几个nm。
蛋白质有时被称为半液体(semi-liquid),是因为它们的原子运动大于固体(如NaCl),但小于液体(如水)。
在一个蛋白质分子上,其多聚物的共价结构对原子和基团的运动造成了许多限制,像甲基或芳香族侧链通常表现为集体运动。
蛋白质运动可根据它瞬时的结构与平均结构的关系进行分类:最快的运动是原子的波动,如原子之间的振动和甲基的转动;其次是相邻的成键和没有成键的原子的集体运动,例如长侧链基团的摇摆运动和短肽环的上下翻转运动;最慢的运动是整个结构域发生的大规模构象变化。
结构域的构象变化一般是局部的,在通常的温度下,整个折叠的结构域从来不会发生大的受热驱动的变化。
从一种折叠模体转变成另外一种模体十分罕见,除非是在病理状态下,例如淀粉样斑块(amyloid)疾病和朊病毒引起的疾病(见下一节)。
然而,某些蛋白质会发生小规模的重折叠。
柔性使得某些蛋白质可以同时处在两个差别很大的构象状态。
高一生物必修知识点:2.2.2蛋白质的结构和功能

高一生物必修知识点:2.2.2蛋白质的结构和功能【必修一】高中生物必备知识点:2.2.2蛋白质的结构和功能1、组成及特点:(1) 蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成,一般蛋白质可能还会含有P(磷)、S(硫)、Fe(铁)、Zn(锌)、Cu(铜)、B(硼)、Mn(锰)、I(碘)、Mo(钼)等。
这些元素在蛋白质中的组成百分比约为:碳50% 氢7% 氧23% 氮16% 硫0~3% 其他微量。
(2) 一切蛋白质都含N元素,且各种蛋白质的含氮量很接近,平均为16%。
(3) 氨基酸分子相互结合的方式是:一个氨基酸分子的羧基(-COOH)和另一个氨基酸分子的氨基(— NH 2 )相连接,同时脱去一分子水,这种结合方式叫做脱水缩合。
连接两个氨基酸分子的化学键 (-NH-CO-)叫做肽键。
有两个氨基酸分子缩合而成的化合物,叫做二肽。
肽链能盘曲、折叠、形成有一定空间结构的蛋白质分子。
2、蛋白质的性质:(1) 两性:蛋白质是由α-氨基酸通过肽键构成的高分子化合物,在蛋白质分子中存在着氨基和羧基,因此跟氨基酸相似,蛋白质也是两性物质。
(2) 水解反应:蛋白质在酸、碱或酶的作用下发生水解反应,经过多肽,最后得到多种α-氨基酸。
(3) 胶体性质:有些蛋白质能够溶解在水里(例如鸡蛋白能溶解在水里)形成溶液。
蛋白质的分子直径达到了胶体微粒的大小(10-9~10-7m)时,所以蛋白质具有胶体的性质。
(4) 盐析:少量的盐(如硫酸铵、硫酸钠等)能促进蛋白质的溶解。
如果向蛋白质水溶液中加入浓的无机盐溶液,可使蛋白质的溶解度降低,而从溶液中析出。
这样盐析出的蛋白质仍旧可以溶解在水中,而不影响原来蛋白质的性质,因此盐析是个可逆过程.利用这个性质,采用分段盐析方法可以分离提纯蛋白质。
(5) 变性:在热、酸、碱、重金属盐、紫外线等作作用下,蛋白质会发生性质上的改变而凝结起来.这种凝结是不可逆的,不能再使它们恢复成原来的蛋白质.蛋白质的这种变化叫做变性。
蛋白质的结构与功能

蛋白质的结构与功能蛋白质是生物体中最重要的宏观分子之一,是维持生命活动的基础。
它们在细胞结构、代谢调节、免疫和信号传递等方面发挥着重要作用。
蛋白质的结构与功能是相互关联的,不同的蛋白质结构决定了它们的功能。
一级结构是指蛋白质中氨基酸的线性排列方式。
氨基酸通过肽键连接形成多肽链,组成了蛋白质的一级结构。
一级结构对蛋白质的性质和功能起着决定性作用。
二级结构是指多肽链上相邻的氨基酸通过氢键形成的局部空间排列方式。
常见的二级结构包括α-螺旋和β-折叠。
α-螺旋是一种右旋的螺旋结构,其中氢键固定螺旋的形成。
β-折叠是由平行或反平行的β链排列而成,通过氢键连接起来形成稳定的结构。
三级结构是指蛋白质中氨基酸侧链的相互作用所形成的立体结构。
它由非共价键和共价键相互作用而形成。
非共价键主要包括氢键、疏水作用、电荷作用等。
这些相互作用使蛋白质折叠成特定的立体结构。
四级结构是指多个多肽链相互作用而形成的复合物。
蛋白质可以由单个多肽链组成,也可以由多个多肽链组成。
四级结构对于蛋白质的功能起着重要作用,它决定了多肽链之间的相互作用和空间结构。
蛋白质的功能与其结构密切相关。
蛋白质的结构决定了它们的功能。
不同的蛋白质具有不同的功能,包括催化反应、传输物质、结构支持、免疫调节等。
催化反应是蛋白质最常见的功能之一、酶是一类具有催化反应的蛋白质,它们能够加速生物体内化学反应的速率。
酶通过与底物结合形成酶底物复合物,使底物分子转变为产物,然后释放产物,完成催化反应。
传输物质是蛋白质的另一个重要功能。
例如,血红蛋白是一种负责将氧气从肺部运输到全身组织的蛋白质。
血红蛋白通过与氧气结合形成氧合血红蛋白,然后将氧气释放给组织细胞。
蛋白质还担负着结构支持的功能。
例如,胶原蛋白是一种主要存在于结缔组织中的蛋白质,它能够提供组织的结构框架,并增加组织的强度和柔韧性。
免疫调节是蛋白质的另一个重要功能。
抗体是一类能够与抗原特异性结合的蛋白质,它们能够识别并结合入侵病原体或异常细胞,并协助免疫系统清除它们。
蛋白质的结构与功能的关系

蛋白质的结构与功能的关系蛋白质是生物体中最为重要的大分子有机化合物,担负着各种重要功能。
它们在生体内参与调节代谢、传递信息、结构支持、运输物质等多种生物学过程。
蛋白质的具体功能与其结构密切相关,而蛋白质的结构可以分为四个层次:初级结构、二级结构、三级结构和四级结构。
本文将从这四个层次出发,探讨蛋白质结构与功能之间的关系。
初级结构初级结构是指蛋白质中的氨基酸序列,是蛋白质最基本的结构。
蛋白质的功能很大程度上取决于其氨基酸序列。
氨基酸的种类和排列方式决定了蛋白质的化学性质和功能。
例如,氨基酸中的亲水性残基可以使蛋白质具有溶解性,从而在水相中发挥作用。
此外,氨基酸序列还决定蛋白质的电荷分布,从而影响其与其他分子之间的相互作用。
二级结构二级结构是指蛋白质链中多肽链的局部区域的空间形态。
常见的二级结构有α-螺旋和β-折叠。
二级结构通过氢键等非共价作用力将多肽链上的氨基酸残基连接在一起,形成特定的结构。
这些结构对蛋白质的稳定性和功能起着至关重要的作用。
例如,α-螺旋结构能够增加蛋白质的稳定性,在蛋白质的结构支持和受体配体结合中起到关键作用。
三级结构三级结构是指蛋白质的整体立体结构。
它由氨基酸链的二级结构之间的相互作用所决定。
三级结构的形成几乎由所有非共价作用力共同作用所致,例如氢键、离子键、范德华力和疏水相互作用等。
蛋白质的功能和稳定性取决于其三级结构的正确折叠。
任何对蛋白质结构的破坏可能导致蛋白质失去原有的功能。
四级结构四级结构是指两个或多个亚基(多肽链或聚合物链)在空间上的组织方式。
它表示了蛋白质分子中不同亚基之间的关系。
多肽链的组装形成蛋白质的四级结构,进一步决定了蛋白质的功能。
例如,酶的四级结构决定了其底物与催化活性位点的特异性结合。
综上所述,蛋白质的结构与功能之间密不可分。
蛋白质的功能依赖于其特定的结构,而蛋白质的特定结构是由其氨基酸序列决定的。
初级结构决定了氨基酸的种类和排列方式,二级结构形成了局部的空间结构,三级结构决定了整体立体结构,而四级结构则表示了不同亚基之间的组织方式。
2 蛋白质的结构与功能
但氢键的键能较低(~12kJ/mol),易被破坏。
蛋白质分子中氢键的形成源自2. 疏水键:非极性物质在含水的极性环境中存在时,会产生一种相
互聚集的力,这种力称为疏水键或疏水作用力
(hydrophobic interaction)。
蛋白质分子中的许多氨基酸残基侧链也是非极性的,这 些非极性的基团在水中也可相互聚集,形成疏水键,从 而在蛋白质分子内部形成疏水核心。如Leu,Ile,Val, Phe,Ala等的侧链基团。
• 例如毛发的纤维是由多个原纤维平行排列,并 由氢键和二硫键作为交联键聚集成不溶性的蛋 白质。 • -角蛋白的伸缩性能很好,当-角蛋白被过度 拉伸时,则氢键被破坏而不能复原。此时-角 蛋白转变成-折叠结构,称为-角蛋白。
角 蛋 白 分 子 中 的 二 硫 键
•角蛋白富含半胱氨酸,不溶性、抗伸展
象角。
α-碳原子
非键合原子 接触半径
侧链
Φ=1800,ψ=1800
完全伸展的肽主链构象
Φ=00,ψ=00的多肽主链构象
• 然而 和 同时等于0°时的构象实际上并不能存在, 因为两个相邻平面上的酰胺基H原子和羰基O原子的 接触距离比其范德华半径之和小,因此将发生空间重 叠(steric overlap)。这样的构象是立体化学所不允许的 。 • 二面角(, )所决定的构象否存在,主要取决于两个 相邻肽单位中,非键合原子之间的接近有无阻碍。
3. 离子键: 离子键(salt bond)是由带正电荷基团与带负电 荷基团之间相互吸引而形成的化学键。 在近中性环境中,蛋白质分子中的酸性氨基酸 残基侧链电离后带负电荷,而碱性氨基酸残基 侧链电离后带正电荷,二者之间可形成离子键。
蛋白质分子中离子键的形成
4.范德华力(vander Waals forces): 两个相邻的不带电荷的原子之间存在的相 互作用力。 是一种比较弱的、非特异性的作用力。 主要在蛋白质的三级结构的形成中发挥作
蛋白质的结构与功能

蛋白质的结构与功能蛋白质是生物体中最重要的物质,它们是实现生命活动的机械基础,负责细胞内所有各种化学反应。
蛋白质可以按其结构和功能分为两类:结构性蛋白质和功能性蛋白质。
结构性蛋白质是构成细胞器,参与细胞代谢反应和信号传递,进行细胞间作用的蛋白质。
结构性蛋白质的主要功能是形成细胞的结构,它们的重要性在于控制细胞的功能和运作。
例如,细胞膜上的载脂蛋白家族蛋白可以提供必要的细胞膜结构,从而支持细胞活动和保持细胞完整性。
功能性蛋白质是细胞内产生的有机物,由氨基酸残基组成,用于参与特定生理功能。
功能蛋白质可以分为酶,转录因子,调节因子,抗原和受体等多种类别。
酶是功能性蛋白质中最重要的一类,它们起着催化作用,参与细胞中的许多生理反应,如代谢,合成,分解,抑制等。
同时,酶还能够监控细胞中物质的浓度,保持其稳定性。
转录因子是细胞遗传活动的主要调节因子,可以通过识别DNA序列并激活和抑制基因表达,将遗传信息转换为细胞复杂的生物功能。
它们可以参与细胞分化,发育,表观遗传学的调节,以及对环境变化的响应。
受体蛋白是生物体内最重要的一类蛋白,它能够识别外源信号分子,并刺激细胞进行相应的生理反应。
受体的作用是非常复杂的,它们可以作为药物的靶点介导药物的作用,又可以参与植物抗病虫的过程,激活植物免疫系统。
蛋白质是生物世界中最重要的物质,其结构和功能构成了生物体的主要机制,并为它们提供了各种活动可能。
蛋白质的结构包括了大分子结构,细胞器结构,以及与蛋白质相互作用的分子结构。
它们的功能包括维持外部环境的稳定,承载信息,参与激素的分泌,控制细胞器的构建和功能,参与细胞的新陈代谢和信号转导,促进细胞特界的建立,维护细胞完整性和水平的划分等。
经过几个世纪的研究,对蛋白质的结构及其基本功能取得了显著进展。
研究人员已经开发出一系列可以检测活细胞内蛋白质形成的技术,从而更好地理解蛋白质如何实现其功能。
未来,研究人员将深入研究蛋白质的特殊功能,并开发新的抗病毒药物,以改善人类的健康。
蛋白质的结构与功能-2

---蛋白质二级结构的基础是肽键平面。
肽键平面/肽单元(peptide unit)
由于C=O双键中的π电子云与N原子上
的未共用电子对发生“电子共振”,使
肽键具有部分双键的性质,不能自由旋
转。
O C
O
C N
¨ N
+
共振形式
肽键中C-N键具有部分双键性质 ——组成酰胺的原子处于同一平面
肽单元——由于肽键具有部分双键的性
含有四级结构的蛋白质,单独的亚基一般没有 生物学活性,只有完整的四级结构寡聚体才有生 物学活性
血红蛋白(hemoglobin)分子中亚基的空间排布
牛 胰 岛 素 一 级 结 构
胰岛素分子 的三级结构
胰岛素是两条链通过二硫键 链接起来的,并没有亚基, 也就不存在四级结构了
总结:蛋白质结构的层次
空间位阻的意义
游离在溶液中的铁卟啉结合CO的能力比O2大25000倍,但 在肌红蛋白中,仅比O2大250倍。原因是由于空间位阻 造成的。这样可以防止代谢过程中产生的CO占据O2的结 合部位。 疏水环境的意义 通常O2与Fe(Ⅱ)接触会使Fe(Ⅱ)氧化为Fe(Ⅲ),血红素也 是一样。但在肌红蛋白内部,由于疏水的环境, Fe(Ⅱ)不易被氧化。 微环境的作用:固定血红素基,保护血红素铁免遭氧化; 为O2提供一个合适的结合部位.
胰岛素分子的三级结构
溶菌酶分子的三级结构
• 肌红蛋白 (Mb)
C 端 N端
(二)结构域
大分子蛋白质的三级结构常可分割成一个或 数个球状或纤维状的区域,折叠得较为紧密,各 行使其功能,称为结构域(domain) 。 结构域是三级结构层次上的局部折叠区。
蛋白质的结构与功能(2)

NH3+
+H+
R CH COO - +OH- R CH COO-
NH3 +
+H+
NH2
pH<pI
阳离子
pH=pI
氨基酸的兼性离子
pH>pI
阴离子
38
总结
a、各种aa的pI不同; b、同一pH下,各种aa所带电荷不同;用
离子交换、电泳将aa分开。 pH<pI :aa+ pH>pI:aac、处于pI时,aa溶解度最小,易沉淀; 可分离aa。
26
半胱氨酸
-OOC-CH-CH2-SH + HS -CH 2-CH -COO -
+NH3
-HH
+ NH3
-OOC -CH -CH 2-S S -CH 2-CH -COO -
+ NH 3
+ NH 3
二硫键
胱氨酸
27
28
三、稀有氨基酸(也称修饰氨基酸)
是在蛋白质合成后,由基本氨基酸修饰而来。 (1)4-羟脯氨酸 (2)5-羟赖氨酸 这两种氨基酸主要存在于结缔组织的纤维状蛋白中。 (3)6-N-甲基赖氨酸(存在于肌球蛋白中) (4)г-羧基谷氨酸 存在于凝血酶原及某些具有结合Ca2+离子功能的蛋白质中。 (5)Tyr的衍生物: 3.5 -二碘酪氨酸、甲状腺素 (甲状腺蛋
第二章 蛋白质的结构与功能 Chapter 2 Structure and Function of
Protein
1
第一节 蛋白质的一般概念
生命是蛋白体 的存在方式,这种 存在方式本质上就 在于这些蛋白体的 化学组成部分的不 断自我更新。
恩格斯《反杜林 论》1878
高中生物苏教版必修1课件:2.2.2 蛋白质的结构和功能

【跟踪训练】
1.已知苯丙氨酸的分子式是C9H11O2N,那么该氨基酸的R基 是
()
A.—C7H7O
B.—C7H7
C.—C7H7N
D.—C7H7NO
解析 氨基酸的通用分子式为C2H11O2NR,所以去除共同
部分即是苯丙氨酸的R基。
答案 B
探究点二 脱水缩合及相关计算 1.结合“氨基酸脱水缩合示意图”,思考并探讨:
第二课时 蛋白质的结构和功能
学习目标 1.简述氨基酸的结构特点(重点)。 2.说出脱水缩合过程(重难点)。 3.阐述蛋白质结构多样性的原因,认同蛋白质是生命活动的主
要承担者。
|基础知识|
一、蛋白质的组成和基本单位 1.组成元素 除含有_C__、__H_、__O__、__N_外,大多数蛋白质还含有
__1__
3
__2__
__2__
(2)当参与上述过程的氨基酸数为n,形成3条肽链时: ①3条肽链中所含的肽键数=_n_-__3__。 ②该过程脱去的水分子数=_n_-__3__。
③若氨基酸的平均相对分子质量为a,则该3条肽链的总相 对分子质量=_n__a_-__1_8_(n_-__3_)__。
1.蛋白质的结构层次
________________________________________________ ________________________________________________
★双缩脲试剂先加 A 液,后加 B 液,不需加热 ________________________________________________ ________________________________________________
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
14
3.3.3.1 肽键、肽平面和二面角
(2)二面角( φ和ψ )
定义: 两相邻酰胺平面之间,能
以共同的Cα为定点而旋转,以Cα-N 键为轴旋转的角度称φ角,以C-Cα 键为轴旋转的角度称ψ角。φ和ψ称 作二面角,亦称构象角。
酰胺平面
2 2
ψ
α-碳原子
非键合原子 接触半径
在此中断,形成“结节”
甘氨酸
因为侧链过于简单,导致构象太“柔
7、
顺”
H
H
22
(4条α-螺旋) 原纤维 微原纤维(11条α-螺旋)
头
巨原纤维
发
结 构
皮质 纺锤体型 皮质细胞 角质膜(鳞状细胞)
髓质
毛发在湿热条件下可以拉长到原有长度的2倍
23
烫发实际上是一个生物化学过程
做卷 还原
氧化
24
二、β-折叠(β-pleated sheet)
族和中性脂肪族氨基酸形成 的羧基末端,酶活性与锌有 关。
6、配位键
成键电子由一个原子提供所形成的共价键,即一个有孤对电子,另个有空轨道
3.3.3
蛋白质的二级结构
(secondary structure)
二级结构
定义:肽链主链盘旋折叠而形成的局部空间结构,是蛋白质结
构的构象单元.
3.3.3.1 肽键、肽平面和二面角 (1)肽键和肽平面
特征: 1、两条或多条伸展的多肽链 (或一条多肽链的若干肽段) 侧向集聚,形成锯齿状片层
结构。
2、靠相邻肽链间氢键维持结 构稳定性。 3、相邻肽链长轴相互平行, 链间氢键与长轴接近垂直。
4、分为两类:平行和反平行
0.7nm重复
多肽链几乎完全伸展: Φ=-1390 Ψ=+1350
26
从能量角度 讲,反平行 式更稳定!
前后两个氨基酸的Cα位于肽平面的对角上。
C C O
一般为反式构型
H
N C
12
Juang RH (2004) BCbasics
肽键的顺式和反式构型
反式构型中,两个Cα及其取代基团互相远离,顺式构型 中,两个Cα及其取代基团彼此接近,形成空间位阻,因此 反式构型更稳定。
13
重要的例外,有脯氨酸的亚氨基参与形成的肽键可以是 顺式,也可以是反式,因为四氢吡咯环消去了反式构型的 优势。但反式还是更稳定(通过X-射线晶体分析发现蛋白质中大约有6%
0.124nm(双键) 键长=0.132nm(肽键中的C-N键) 0.148nm(单键)
p 轨道电子共振形成共振杂化体,从而使肽键 具
有了部分双键的特性!!!
C C
O N
H
C
肽键的特性:
肽键虽是单键却有双键性质,不能自由旋转。
肽键周边六个原子位于一个刚性平面上,即形
成了肽平面,也叫酰胺平面。
常见的蛋白质二级结构元件主要 有以下类型:
一、 α-螺旋(α-helix) 二、 β-折叠(β-pleated sheet) 三、 β-转角(β-turn) 四、 无规则卷曲(nonregular coil)
一、α-螺旋(α-helix)
N端
α-螺旋特征:
1、常见的为右 手螺旋 2、螺距0.54nm, 每圈含3.6个AA 残基(0.15nm) 3 、 螺 旋体 中 所 有氨基酸残基R 侧链都伸向外侧 ,链中的全部 > C=0 和 > N-H 几 乎都平行于螺旋 轴
第一套肽段 HCWT CKS ECVE RLA PS
第二套肽段 HC WTCK SEC VERL APS 推断全顺序 HCWTCKSEC VERLAPS
4
3.3.2
蛋白质的构象和维持构象的作用力
3.3.2.1 构型和构象 构型(configuration):分子中各个原子特有的固定的空间排列
(如一对对映体)。构型的改变要经过共价键的断裂,往往使分子的光学 活性发生变化。(如: L-AA和D-AA)
Φ=00,ψ=
00
1
1
φ
侧链
当Φ的旋转轴N1-Cα键两侧的N1-C1和Cα-C2呈 顺式时,规定Φ=00,反式Φ=1800
当ψ的旋转轴Cα-C2键两侧的N2-C2和Cα-N1呈 顺式时,规定ψ=00 ,反式ψ=1800
从Cα向N1看,顺时针转的Φ角规定为正值, 逆时针为负值;同样,从Cα向C2看,顺时针转 的ψ角规定为正值,逆时针为负值
3.3 蛋白质的分子结构
蛋 白 质 结 构 的 主 要 层 次
一级结构
primary structure
secondary structure
二级结构
超二级结构
supersecondary stomain
Tertiary structure
三级结构
四级结构
quariernary structure
形成的有规则的、在空间上能辨认的二级结
构组合体。
35
3.3.5
结构域 (structural domain)
定义:对于较大的蛋白质分子或亚基 ,多肽链往往由两个或两个以上相对独
立的三维实体缔合而成三级结构,这种
相对独立的三维实体称结构域。
由超二级结构组成结构域
丙酮酸激酶:α/β桶结构域
免疫球蛋白中的结构域
C端
α-螺旋的特征
4、第n个氨基酸残 基的C=0与第n+4个 氨 基 酸 残 基 的 -NH 形成氢键(3.613)。 ns表示:n表示螺 旋一圈的残基数, s表示氢键所含原 子数。如310
5、α-螺旋结构主 要靠链内氢键维持
α-螺旋的特征
6、
脯氨酸
N-Cα键无法旋转,且脯氨酸的N上无 H,所以无法形成氢键,因此,螺旋
例:血红蛋白(Hb)
48
血红素(hemechrome)的结构式
2+
49
血 红 素 在 蛋 白 中 的 位 置
氧合过程中血红素 铁原子的变化
F8 Histidine EF
氧合过程中铁原子位移 引发的构象改变
FG
F Helix 空间排斥
Heme F8 Histidine
O2
Fe
Heme
O2
二硫键拆开
AA组成分析(含每种AA 的mol数、末端AA鉴定)
两种以上方法 专一性裂解
测定每个肽碎片的AA顺序
将肽段顺序进行叠联以确定完整的顺序
基本策略: AA顺序直 测+片段重 叠法
片段重叠法确定肽段在多肽链中顺序示意
所得资料: 氨基末端残基 H 羧基末端残基 S 第一套肽段: CKS PS ECVE RLA HCWT 第二套肽段: SEC WTCK VERL APS HC 借助重叠肽确定肽段次序: 末端残基 H S
6400个核苷酸的
单股RNA形成。
(TMV)
3.4 蛋白质结构与功能的关系
结构决定功能,不同蛋白质结构组 成的不同,决定了其生物学功能的多 样性。 蛋白质的结构改变,其功能也随之 改变,甚至丧失。
45
3.4.1 蛋白质一级结构与功能的关系
例证 分子病 定义:由于蛋白质分子一级结构的氨基 酸排列顺序与正常有所不同而形成的遗传 病称为分子病。 突出的例子:镰刀型贫血病。
0.65nm重复
27
28
蚕丝的主要成分是丝心蛋白,而丝心蛋白的主要二级结构 是反平行排列的-折叠。丝心蛋白的一级结构含有长的重复 序列片段,-Gly-Ser-Gly-Ala-Gly-Ala-。Gly侧链氢位于折叠 平面的一侧,而Ala和Ser的甲基侧链和羟甲基侧链位于折叠 平面的另一侧,堆积的折叠片靠侧链之间的van der Waals力 结合在一起。
29
三、β-转角(β-turn)
特征: 多肽链 回折1800
脯氨酸的顺 式构型
第n残基的羰 基与第n+3 残基的氨基 形成氢键
31
四、 无 规 则 卷 曲
细胞色素C的三级结构
无规则卷曲
33
3.3.4
超二级结构 (super-secondary structure)
定义:由相邻的二级结构单位组合在一起,
构象(conformation):指一个分子中,不改变共价键结构,
仅单键旋转时取代基团形成不同的立体结构。构象改变不会改变分子的光 学活性。 (如: DNA的双螺旋)
5
3.3.2.1 维持蛋白质构象的作用力
1、氢键
2、范德华力
3、离子键(盐键)
4、二硫键
5、疏水作用(也称疏水键、疏水相互作用)
羧肽酶A:是水解有芳香
酰胺平面
Φ=1800,ψ=1800
(不可以的构象)
(可以的构象)
17
Ramachandran构象图(拉氏构象图)
允许区
(立体化学所允许)
最大允许 区
(立体化学所允 许,但不稳定)
不允许区
(只有甘氨酸残基 可出现在此区)
3.3.3.2 常见的二级结构元件 (secondary structure element)
链,也有的由二条或二条以上的肽链组成。
四级结构 :指由相同或不同的亚基按照一定排
布方式缔合而成的蛋白质结构。 实例:血红蛋白
烟草花叶病毒的外壳蛋白四级结构
血红蛋白
烟草花叶病毒为 长300nm,直径 18nm的圆柱形结 构,中心有一个直
径4nm的沟槽。
烟草花叶病毒蛋 白外壳由2130个 相同亚基组成,蛋 白外壳围绕一个约
3.3.6
三级结构
在二级结构基础上,肽链的不同区段 的侧链基团相互作用在空间进一步盘绕、 折叠形成的包括主链和侧链构象在内的特 征三维结构。
39
抹香鲸肌红蛋白(Myoglobin)的三级结构
