FT4项目性能验证方案
CL—2000i全自动免疫发光分析FT3、FT4、TSH参考区间验证

CL—2000i全自动免疫发光分析FT3、FT4、TSH参考区间验证目的验证厂家提供的FT3、FT4、TSH参考区间是否适用于该地区,建立该地区的甲状腺功能三项指标的生物学参考区间,为该地区筛查及诊断甲状腺疾病提供依据。
方法参照美国临检实验室标准化委员(NccLs)C28-A2文件中涉及到的有关参考定义,调查,验证的描述,采用迈瑞全自动化学发光仪及其配套试剂、校准品、质控品,对3 172名健康人群的甲状腺功能三项指标进行检测,检测结果按性别差异进行统计学分析处理。
所得结果与试剂说明书提供参考区间,《全国临床检验操作规程》第4版提供的FT3、FT4、TSH参考区间比较。
结果该次验证不包括50岁以上人群,留取男性2273例进行数据分析,得出男性TSH:0.64~5.56 μIU/mL,16~30岁,FT3:3.53~5.65 pmol/L、FT4:7.06~15.38 pmol/L,31~50岁,FT3:3.58~5.78 pmol/L、FT4:6.69~14.81 pmol/L,女性899名得出:TSH:0.9~6.74 μIU/mL,16~30岁,FT3:3.14~5.43 pmol/L、FT4:5.72~14.22 pmol/L,31~50岁,FT3:3.03~5.23 pmol/L、FT4:5.51~13.93 pmol/L,研究结果分别与试剂说明书和《全国临床检验操作规程》第4版提供的FT3、FT4、TSH参考区间进行χ2 检验,为差异有统计学意义(P<0.05)。
结论试剂说明书和《全国临床检验操作规程》第4版提供的FT3、FT4、TSH参考区间均不适用于该地区该实验室,建议使用该研究结果作为该地区实验室参考区间。
标签:FT3;FT4;TSH;健康;生物参考区间生物参考区间是检验结果常用的一项评价指标,为患者疾病的诊断、治疗、预后和筛查提供信息。
游离三碘甲状腺原氨酸(FT3)、游离甲状腺激素(FT4)、促甲状腺激素(TSH)是反映甲状腺功能最常用的检测指标,常称为“甲状腺功能三项”。
不同化学发光免疫分析设备甲功五项检测结果比对分析

Elabscience 游离甲状腺素(fT4)酶联免疫吸附测定试剂盒 说明书

2022年修订第一版(本试剂盒仅供体外研究使用,不用于临床诊断!)产品货号:E-EL-0122c产品规格:96T/48T/24T/96T*5Elabscience 游离甲状腺素(fT4)酶联免疫吸附测定试剂盒使用说明书fT4(Free Thyroxine) ELISA Kit使用前请仔细阅读说明书。
如果有任何问题,请通过以下方式联系我们:销售部电话技术部电话************电子邮箱(销售)********************电子邮箱(技术)**************************网址:具体保质期请见试剂盒外包装标签。
请在保质期内使用试剂盒。
联系时请提供产品批号(见试剂盒标签),以便我们更高效地为您服务。
Copyright ©2021-2022 Elabscience Biotechnology Co.,Ltd. All Rights Reserved目录用途 (3)基本性能 (3)检测原理 (3)试剂盒组成及保存 (4)试验所需自备物品 (5)样品收集方法 (5)注意事项 (6)■ 试剂盒注意事项 (6)■ 样品注意事项 (6)样本稀释方案 (6)检测前准备工作 (7)操作步骤 (8)结果判断 (10)技术资源 (10)典型数据 (10)性能 (11)■ 精密度 (11)■ 回收率 (11)■ 线性 (11)声明 (12)Intended use (13)Character (13)Test principle (13)Kit components & Storage (14)Other supplies required (15)Sample collection (15)Note (16)■ Note for kit (16)■ Note for sample (16)Dilution Method (17)Reagent preparation (17)Assay procedure (18)Calculation of results (20)Technical resources (20)Typical data (20)Performance (21)■ Precision (21)■ Recovery (21)■ Linearity (21)Declaration (22)用途该试剂盒用于体外定量检测 血清、血浆或其他相关生物液体中fT4浓度。
游离T4(FT4)测定

游离T4(FT4)测定1. 原理采用夹心法原理、电化学发光法(EC L)定量检测FT4。
待测样本中的F T4与三联吡啶钌(Ru(bp y)32+)标记的单抗和生物素标记的单抗结合生成抗原抗体复合物。
该复合物与亲和素包被的磁珠结合,吸附于检测室(Ce ll)电极表面,经氧化还原反应,三联吡啶钌与TPA 作用释放光子,以光信号的强弱定量标本中检测物的含量。
2. 标本采集:2.1标本采集前病人准备:受检者应空腹。
2.2标本种类:血清或血浆。
2.3标本要求:采集血清样本,取被检者静脉血,用无菌取血针抽取病人静脉血3ml,收集干燥试管中,室温放置不超过8小时,2000转/分离心20分钟备用.采集血浆样本,用无菌取血针取被检者静脉血3ml,收集于含有E DTA作抗凝剂的试管中,室温放置不超过8小时,2000转/分离心20分钟备用。
3. 标本储存:待测样本室温不超过8小时,4-8℃不超过72小时,-20℃可长期保存,避免反复冻融。
4. 标本运输:室温运输。
5. 标本拒收标准:细菌污染,严重溶血或脂血标本不能作测定。
6. 试剂:6.1试剂名称:游离T4试剂盒。
6.2试剂生产厂家:罗氏公司6.3包装规格:100T est/盒6.4试剂盒组成:游离T4诊断试剂。
6.5试剂储存条件及有效期:试剂盒贮存2-8℃条件,有效期见条形码。
7. 仪器设备:7.1仪器名称:罗氏全自动电化学发光免疫分析仪7.2仪器厂家:罗氏公司7.3仪器型号:c oba s e 4117.4仪器校准:本仪器校准由厂家工程师负责校准8. 操作步骤:8.1样本处理:取待测样本血清或血浆(尿液)置于样本杯中(不能有纤维蛋白,不能有气泡)。
8.2仪器准备:检查纤维杯,反应杯数量满足实验需要,废物桶和废液桶是否连接好,仪器的光路是否正常,环境温度是否符合要求,打印机的连接。
8.3试剂准备与检查:从冰箱取试剂放入仪器,检查所有试剂量是否足够,是否在有效期内。
游离甲状腺素(FT4)测定试剂盒(化学发光免疫分析法)产品技术要求mairui

1性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰,准确、牢固;Ra试剂应为棕色含固体微粒的液体,无板结、无絮状物;Rb试剂应为清澈透明的液体,无沉淀、无悬浮物、无絮状物;Rc试剂应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2净含量
应符合表2的要求。
表 2 净含量误差要求
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差应在±10%范围内。
2.4最低检测限
应不大于0.3 ng/dL。
2.5重复性
变异系数CV应≤10%。
2.6批间差
变异系数CV应≤10%。
2.7分析特异性
当样品中甘油三酯浓度≤ 1800 mg/dL,胆红素浓度≤ 10 mg/dL,血红蛋白浓度≤ 500 mg/dL,总蛋白浓度≤ 10 g/dL测试结果的干扰偏差应在±10 %范围内。
当样品中反T3浓度≤45.0 ng/dL时交叉反应率应≤10%,当样品中一碘酪氨酸浓度≤7.20 ng/dL,3,5 L-T2浓度≤5000000 ng/dL,二碘酪氨酸浓度≤7.60 ng/dL,甲状腺素乙酸浓度≤25000 ng/dL,L-三碘甲状腺氨酸浓度≤2000 ng/dL时交叉反应率应≤3%。
游离甲状腺素(FT4)测定试剂盒(免疫荧光法)临床评价报告-体外诊断试剂

体外诊断试剂临床评价报告产品名称:游离甲状腺素(FT4)测定试剂盒(免疫荧光法)标本类型:血浆-EDTA-K抗凝(参比与考核一致)方案版本:V1.0方案日期:2019年01月08日试验时间:2019年03月至2019年03月试验地点:********医院产品注册申请人(盖章):********生物科技有限公司注册申请联系人:******注册申请联系人电话:******报告版本:V1.0报告日期:2019年04月01日保密声明本报告中所包含的所有信息的所有权归********生物科技有限公司。
因此,仅提供给研究者和监督管理部门等相关的医疗机构审阅。
在未得到申办者书面批准的情况下,严禁将任何信息告知与本研究无关的第三方。
研究摘要目的:评价********生物科技有限公司生产的游离甲状腺素(FT4)测定试剂盒(免疫荧光法)用于游离甲状腺素检测时,其诊断检测能力与已上市的同类试剂盒无差异。
方法:本次临床试验采用同步盲法对比试验。
结果:********医院共检测116例受试者样本,按方案剔除标准共剔除样本1例,其中1例为线性范围外标本,0例为离群值标本,剔除率为0.87%,最终纳入分析115例,其中男性52例,女性63例,平均年龄38.10±18.76岁。
本次临床试验结果的Pearson相关系数接近1,说明两种试剂的相关关系越密切。
回归方程的截距(a)的95%CI包括0,斜率(b)接近1,说明两种试剂的一致性比较好。
根据说明书中对准确度允许偏差的标准,医学决定水平处偏倚均在允许偏差范围内。
考核试剂与参比试剂检测浓度的差值Bland-Altman散点图显示:两种试剂检测浓度差值为-0.0006±1.3532(均值±标准差),两种试剂检测浓度差值的均值±1.96SD范围在-2.7071到2.7059之间。
超出置信区间的百分比为:4.35%。
考核试剂与参比试剂检测浓度的差值百分比Bland-Altman散点图显示:两种试剂检测浓度差值百分比为0.0942%±5.7174%(均值±标准差),两种试剂检测浓度差值百分比的均值±1.96SD范围在-11.3406%到11.5290%之间。
医学检验·检查项目:游离甲状腺素指数(FT4I)_课件模板

(FT4I) 内容课件模板
医学检验·各论:游离甲状腺素指数(FT4I) >>>
简介:
该方法是间接测定FT4的方法。计算 公式为:FT4I=总T4×实测之125I-T3摄取 比值T4或PBI测定受TBG影响;125I-T3摄 取试验也受TBG影响。如妊娠时或服避孕 药后,由于血中TBG浓度增高,而使TT4或 PBI升高,而被误诊为甲状腺机能亢进; TBG增高使125I-T
医学检验·各论:游离甲状腺素指数(FT4I) >>>
正常值: 放射免疫法:2.2~14.0。
医学检验·各论:游离甲状腺素指数(FT4I) >>>
相关检查: 血管紧张素转化酶、唾液皮质醇、游离甲 状腺素、血清甲状腺素、总甲状腺素、促 甲状腺激素。
医学检验·各论:游离甲状腺素指数(FT4I) >>>
相关症状: 甲亢面容、心音异常、食欲异常、体型异 常、消瘦、甲状腺肿。
医学检验·各论:游离甲状腺素指数(FT4I) >>>
相关疾病:
原发性甲状腺恶性淋发的精神障碍、甲状腺 功能亢进伴发的精神障碍、散发性甲状腺 肿、妊娠合并甲状腺功能亢进、小儿慢性 淋巴细胞性甲状腺炎、小儿甲状腺功能亢 进症、甲状腺功能减退、甲亢、甲状腺功 能减低所致贫血。
谢谢!
医学检验·各论:游离甲状腺素指数(FT4I) >>>
简介: 3摄取率相应降低,可被误诊为甲状腺机 能减退。而FT4I可避免TBG增高或降低的 影响。
医学检验·各论:游离甲状腺素指数(FT4I) >>>
临床意义: (1)升高:甲状腺功能亢进、应用甲
游离甲状腺素(FT4)测定试剂盒(化学发光免疫分析法)产品技术要求爱康试剂

游离甲状腺素(FT4)测定试剂盒(化学发光免疫分析法)性能指标2. 性能指标2.1 试剂盒性能指标2.1.1 外观试剂盒各组分应齐全、完整,液体无渗漏,标签应清晰、易识别;试剂条中第7孔内组分应为棕色含固体微粒的液体或含棕色固体沉淀的透明液体;第12孔内化学发光底物应为无色或淡绿色液体;其余皆应为无色透明液体,无悬浮物、无沉淀、无絮状物。
2.1.2 检出限应小于或等于3.0pmol/L。
2.1.3 准确度使用准确度参考品进行测试,实测值与标示值的相对偏差应在±10.0%以内。
2.1.4 线性范围试剂盒在3.0pmol/L~77.2pmol/L区间内,其线性相关系数(r)应不小于0.9900。
2.1.5 重复性变异系数(CV)应不大于10.0%。
2.1.6 批间差变异系数(CV)应不大于15.0%。
2.17 特异性对浓度不低于200ng/mL的3.5.3’-三碘甲腺原氨酸、100ng/mL的3.3.5’-三碘甲腺原氨酸以及200ng/mL的3.3’-二碘甲腺原氨酸样本进行测定,其测定结果应不高于3.0pmol/L。
2.2校准品性能指标2.2.1 外观校准品CAL1、CAL2应为淡黄色或无色透明液体,无悬浮物、无沉淀、无絮状物。
2.2.2 装量校准品CAL1、CAL2装量偏差应在±10.0%之内。
2.2.3 准确度游离甲状腺素(FT4)校准品,测试结果偏差应在±10.0%之内。
2.2.4 均一性对同一瓶校准品1、校准品2分别重复10次检测,对同一批次10瓶校准品1、校准品2进行检测,检测校准品1、校准品2瓶内差CV应≤10.0%,批内瓶间差CV应≤10.0%。
2.3 质控品性能指标2.3.1 外观质控品应为淡黄色或无色透明液体,无悬浮物、无沉淀、无絮状物。
2.3.2装量质控品装量偏差应在±10.0%之内。
2.3.3 准确度游离甲状腺素(FT4)质控品,测试结果应在靶值范围内。
SEROZYME系统测定血清FT3、FT4及其临床评价的开题报告

SEROZYME系统测定血清FT3、FT4及其临床评价的开题报告一、研究背景甲状腺激素是维持人体代谢稳定的重要激素之一,其中游离三碘甲状腺原氨酸(FT3)和游离四碘甲状腺原氨酸(FT4)是其中的代表。
目前常用的甲状腺功能检测方法主要有放射免疫法和化学发光法。
然而,这些方法有一些缺陷,对样本的处理要求高,操作复杂,费用较高等问题。
因此,研究一种快速、准确和经济的测定血清FT3、FT4的新方法,具有重要的临床意义。
二、研究目的本研究旨在探讨SEROZYME系统测定血清FT3、FT4的可行性,比较其与传统方法的结果差异,并评价其临床应用价值。
三、研究内容1. 采集健康人和甲状腺疾病患者的血清标本,分别用SEROZYME系统和放射免疫法/化学发光法测定FT3、FT4水平。
2. 比较SEROZYME系统与传统方法的结果差异,并分析可能影响结果的因素,如红细胞比容、脂质、蛋白质含量等。
3. 收集甲状腺功能异常的患者的临床资料,探讨SEROZYME系统在甲状腺疾病的诊断和治疗方面的应用价值,为临床提供参考依据。
四、研究方法1. 实验材料和设备:SEROZYME系统全自动生化分析仪、放射免疫分析仪、化学发光仪等。
2. 血清样本采集:从健康人和甲状腺疾病患者中采集静脉血样本,分离血清用于实验分析。
3. 实验操作:按照SEROZYME系统、放射免疫法和化学发光法的操作流程进行实验,比较结果差异。
4. 数据处理和分析:采用统计学方法分析实验数据,比较不同方法的结果差异,探讨可能的影响因素。
五、预期结果1. 探索SEROZYME系统测定血清FT3、FT4的可行性,获得其基本测定范围、检测精度和准确度等性能。
2. 比较SEROZYME系统与传统方法的结果差异,探讨可能的因素。
3. 评价SEROZYME系统在甲状腺疾病的诊断和治疗方面的应用价值。
六、研究意义1. 研究开发SEROZYME系统测定血清FT3、FT4的新方法,有望取代传统方法,节省实验室成本,提高检测效率和准确性。
2024甲状腺功能亢进教案X

甲状腺功能亢进教案Xcontents •甲状腺功能亢进概述•甲状腺功能亢进与代谢异常•甲状腺功能亢进检查方法•甲状腺功能亢进治疗方案制定•并发症预防与处理策略•总结回顾与展望未来进展方向目录01甲状腺功能亢进概述定义与发病机制定义甲状腺功能亢进(简称甲亢)是指甲状腺腺体本身产生甲状腺激素过多而引起的甲状腺毒症,导致身体代谢活动加快,神经、循环、消化等系统兴奋性增高和代谢亢进的临床综合征。
发病机制甲亢的发病机制较为复杂,主要包括免疫因素、遗传因素、环境因素等。
其中,免疫因素是最主要的发病机制,由于机体产生针对甲状腺的刺激性抗体,导致甲状腺激素分泌过多。
甲亢是内分泌系统的常见病和多发病,女性发病率高于男性,且好发于20-50岁的中青年人群。
发病率地域分布影响因素甲亢的发病率在不同地区有所差异,一般沿海地区高于内陆地区,城市高于农村。
生活压力、环境污染、饮食习惯等因素都可能影响甲亢的发病率。
030201流行病学特点临床表现及分型临床表现甲亢的典型症状包括怕热、多汗、皮肤潮湿、多食易饥、体重下降、疲乏无力、紧张焦虑、失眠不安、思想不集中、记忆力减退等。
此外,还可出现心悸、气短、心动过速等心血管系统症状,以及眼突、手颤等体征。
分型根据甲亢的临床表现和发病机制,可将其分为多种类型,如弥漫性甲状腺肿伴甲亢(Graves病)、结节性甲状腺肿伴甲亢、自主性高功能性甲状腺腺瘤等。
甲亢的诊断主要依据临床表现、甲状腺功能检查和甲状腺自身抗体测定等。
其中,甲状腺功能检查包括血清总甲状腺素(TT4)、血清总三碘甲腺原氨酸(TT3)、血清游离甲状腺素(FT4)和血清游离三碘甲腺原氨酸(FT3)等指标。
鉴别诊断甲亢需与其他引起甲状腺毒症的疾病进行鉴别,如单纯性甲状腺肿、亚急性甲状腺炎、桥本氏甲状腺炎等。
此外,还需与心血管系统、神经系统等其他系统疾病引起的类似症状进行鉴别。
诊断标准诊断标准与鉴别诊断VS02甲状腺功能亢进与代谢异常能量代谢变化基础代谢率增高甲状腺功能亢进时,患者基础代谢率明显增高,表现为怕热多汗、体重下降等。
FT4

FT4检测1检测目的、原理目的:检测患者体内FT4 的含量,辅助临床治疗诊断。
原理:Access 游离T4检测是一种两步法的竞争抑制的酶免疫方法,样品和与生物素结合的抗T4单抗、蛋白缓冲液和包被了亲和素的磁性颗粒被加入到反应管中。
在第一步孵育中,与生物素结合的抗T4单抗与样品中的游离T4和固相上的亲和素所结合,孵育后在磁性分离系统去除未与磁性颗粒结合的其它物质。
接着,蛋白缓冲液和标记了碱性磷酸酶的T3酶结合物加入到反应管中与残留的抗T4抗体结合位点结合,孵育后在磁性分离系统去除未与磁性颗粒结合的其它物质。
最后在反应管中加入化学发光底物(Lumi-Phos* 530), 已与固相结合的碱性磷酸酶会使该底物脱去磷酸根而发出光子并被光电比色计所检测。
最后,对照仪器中储存的多点定标曲线而计算出样品中的游离T4浓度,反应产生的光子与样品中游离T4的含量成反比。
2方法性能参数不精密度:小于等于10%分析灵敏度: 0.25ng/dl3样本采集及处理A. 建议使用人血清或肝素抗凝血浆标本。
B. 遵循国家委员会制定的临床实验室标准推荐的以下标本处理、运行和储存步骤(5,6):1.用真空采样管采集所有血液标本时须遵守常规注意事项。
2.离心前使标本完全自然形成凝块。
3.全程保证样品管的密闭状态。
4.离心获得血清后的两小时内,至少将500 l血清或血浆转移到一个密闭的储存试管中备用。
5.储存样品,保持样品管完全密闭,在室温(15 到 30°C)条件下不超过8小时。
6.如果8小时内不能完成检测即应将标本放入2 到 8°C冰箱冷藏。
7.如果24小时内不能完成检测即应将标本放入-20°C冰箱冻藏。
8.标本只能复融一次。
C. 样品中至多含有10mg/dl (171 mol/l) 的胆红素和脂血标本中含有相当于1800 mg/dl (20.32 mmol/l)的甘油三脂或最多含400mg/dl的胆固醇和溶血标本含有最多1g/dl(10g/l)的血红蛋白外不影响FT4检测的结果。
新FT4方法学验证报告

促甲状腺素(FT4)检测系统/方法的分析性能验证评价验证的内容:正确度、精密度、线性范围的确认、可报告范围的验证及参考区间的确认验证人员:王爱林马力张卫李琳一、检测系统信息项目:FT4仪器名称全自动电化学发光免疫分析仪仪器型号Cobas e601试剂及厂商:德国罗氏诊断有限公司检测方法:双抗体夹心法二、厂商提供的相关参数三、验证过程1、正确度:精密度和准确度目的:评价仪器测量结果与真值的一致程度。
通过实验室检测数据的偏倚从而评价和验证实验室检测结果的准确性评价方法:参加卫生部临检中心的室间质评,本组参加室间质评的项目一律用回报结果作为评价标准最近一次参加卫生部室间质评正确度验证试验数据记录表(方案2)2精密度(Precision)批内精密度目的:考察仪器检测方法的随机误差原理:在检测系统处于优良的条件下,连续测定20个结果,判断这20个独立结果间的一致程度方法:选择新鲜混合血清标本(病人高值、低值)20份,测量前先定标,再做质控,质控结果在控制范围内,连续重复测定10次,测量结束后再做质控,质控结果在控制范围内,计算SD,CV,得到批内精密度。
标本来源:高低值标本均为混合血清结果:本室FT4批内精密度低值CV为:高值CV为:结果判断方式:批内精密度CV应<1/4最大允许误差(ALE)重复性精密度验证试验数据记录表(方案2)结论: 若本室FT4低值、高值、批内精密度均<1/4 ALE,即该项目的批内精密度可接受。
批间精密度:目的:考察目前实验室检测方法批间精密度原理:在检测系统处于优良的条件下,连续测定10天,取得20个结果,判断这20个独立结果间的一致程度。
方法:新鲜混合血清(高值、低值)分装20份冷冻,每天取一份随标本连续测定10天,测定前定标做质控,测定结束做质控,且结果在控制范围内,计算CV,SD,得到批间精密度。
结果:本室FT4批间精密度平均低值CV:平均高值CV:判断标准:<1/3CV总误差日间精密度验证试验数据记录表结果判断方式:批间精密度CV应小于1/3最大允许误差(ALE)结论:若本室FT4的低值和高值批间精密度CV均<1/3最大允许误差(ALE),即该项目批间精密度可接受。
促甲状腺素检测系统分析灵敏度的验证

促甲状腺素检测系统分析灵敏度的验证执笔人:陈政君指导老师:冯仁丰、顾志冬瑞金临床医学院摘要:目的:对Beckman Dxi800系统TSH项目的检测低限、功能灵敏度等分析性能的验证。
方法:对血清空白、系列低浓度的TSH样品进行批内重复性实验、天间重现性实验,统计确定这些性能。
结果:该系统的TSH检测低限为0.003 mIU/L,功能灵敏度为0.005 mIU/L。
与Beckman的产品说明书的指标有差异。
结论:为了使实验室对甲状腺患者提供可靠的TSH低值结果,实验室必须自己建立适合本实验室条件的可报告低限。
关键词:TSH 、检测系统、检测低限、功能灵敏度、前言甲状腺疾病是目前最为常见的内分泌紊乱疾病之一。
其发病过程通常缓慢而不易被察觉,症状常被患者疏忽,当出现明显的疾病症状时,后果十分严重。
因此采用敏感、特异的检验项目,准确、可靠地为临床提供检验结果,是实验室的责任。
促甲状腺素(TSH)的检测相对于FT4检测来说,对甲状腺功能紊乱更具有特异性。
临床上通常使用TSH检测项目来筛选疑似患者。
出现TSH异常的患者,FT4才是之后最重要的测定项目。
TSH在血清中的含量很低,真实反映TSH的低值是内分泌临床、与众多公司努力的方向。
目前,各大厂商所建立的检测系统的灵敏度均号称达到了10-3 mIU/L的水平。
按照质量管理要求,在实验室开始对患者标本进行检测、报告结果前,应对引进的检测系统进行必要的性能确认。
因此,我们这次短暂的实验,就是对瑞金医院检验科近日使用的Beckman Dxi800型系统,进行分析灵敏度(检测低限与功能灵敏度)的系列实验。
以期为该实验室建立TSH必须的可报告定性与定量低限。
一材料和方法1.检测系统:Beckman Dxi800免疫测定检测系统。
使用双夹心酶免化学发光方法。
试剂为该系统的专用的人促甲状腺素(hTSH)检测试剂,包括专用的hTSH校准品。
所有检测过程完全按照系统规定程序进行校准、质量控制、以及对样品等进行检测。
人游离甲状腺激素(FT4)说明书
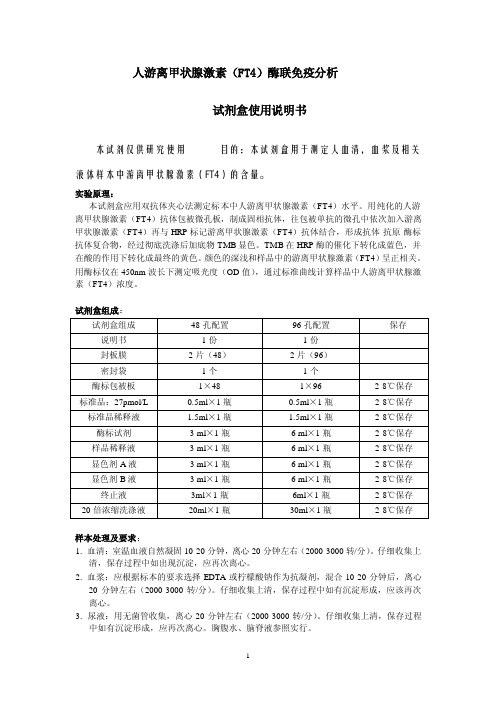
人游离甲状腺激素(FT4)酶联免疫分析试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中游离甲状腺激素(FT4)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人游离甲状腺激素(FT4)水平。
用纯化的人游离甲状腺激素(FT4)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入游离甲状腺激素(FT4)再与HRP标记游离甲状腺激素(FT4)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的游离甲状腺激素(FT4)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人游离甲状腺激素(FT4)浓度。
试剂盒组成:样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
标本融化后仍然保持2-8℃的温度。
ft3、ft4液相色谱质谱方法

标题:FT3、FT4液相色谱质谱方法研究与应用摘要:FT3和FT4是人体内的两种重要甲状腺激素,其浓度变化可反映人体的甲状腺功能。
本文通过深入探讨了液相色谱质谱方法在FT3和FT4测定中的研究和应用,包括方法的原理、样品的制备与处理、仪器的参数设置、分析条件的优化等方面,旨在为临床医学研究和临床诊断提供参考。
一、引言1. 甲状腺激素的重要性甲状腺激素是人体内的重要激素,对人体的新陈代谢、生长发育、能量代谢等起着至关重要的作用。
主要包括甲状腺素(T4)和三碘甲状腺原氨酸(T3)两种形式。
2. FT3和FT4的测定FT3和FT4是自由型甲状腺激素,它们是指在血浆中不与蛋白质结合的甲状腺激素之总量的百分比。
与总T3和总T4相比,测定FT3和FT4对于准确评价甲状腺功能更为准确和敏感。
二、液相色谱质谱方法的原理1. 液相色谱质谱联用技术液相色谱质谱联用技术(LC-MS/MS)是一种高灵敏、高选择性的分析方法,通过结合液相色谱和质谱技术,能够对样品进行快速、准确的分析。
2. FT3和FT4的测定原理FT3和FT4的测定原理主要是通过分析样品中的FT3和FT4的浓度来反映甲状腺功能的变化。
液相色谱质谱方法能够通过准确定量分析,实现对FT3和FT4的高灵敏度检测。
三、液相色谱质谱方法的应用1. 样品的制备与处理在液相色谱质谱分析中,样品的制备与处理是非常关键的步骤。
需要对血清或血浆样品进行蛋白质沉淀、溶解和稀释处理,以保证分析的准确性和稳定性。
2. 仪器的参数设置在液相色谱质谱联用仪器中,需要合理设置离子源、分离柱和质谱检测器的参数,以确保对FT3和FT4的分离和检测。
3. 分析条件的优化针对不同的样品类型和分析要求,需要对分离柱、流动相、离子源温度、碰撞气体等分析条件进行合理的优化,以实现最佳的分析结果。
四、液相色谱质谱方法的优势1. 高灵敏度和高分辨率液相色谱质谱联用技术能够提供高灵敏的分析,对FT3和FT4能够实现低浓度的快速准确测定。
SEROZYME系统测定血清FT3、FT4及其临床评价

SEROZYME系统测定血清FT3、FT4及其临床评价发表时间:2010-08-19T15:38:17.890Z 来源:《中外健康文摘》2010年第14期供稿作者:于海涛[导读] 血清游离3,5,3’-三碘甲状腺氨酸(FT3)、游离四碘甲状腺氨酸(FT4)是甲状腺疾病诊断与疗效评定的重要指标于海涛(黑龙江省林业第二医院肿瘤结核病医院 153100)【中图分类号】R446 【文献标识码】A 【文章编号】1672-5085 (2010)14-0173-02【摘要】目的用SEROZYME系统检测血清FT3、FT4并进行临床与实验室考核。
方法将本系统与放射免疫法(RIA)进行对比研究。
结果健康人(n=68)血清FT3、FT4水平( +SD)分别为4.1±1.1pmol/L、14.1±3.2pmoL/L。
甲减组FT4水平下降(P<0.01);FT3水平与正常对照组无显著差异(P>0.05);初诊甲亢组 FT3、FT4(P均<0.01)水平升高;糖尿病组FT3水平下降(0.05>P>0.01),FT4水平与正常对照组无显著差异(P>0.05);其它各疾病组两项指标与正常对照组均无显著差异(P均>0.05);与RIA对比检测血清FT3、FT4两法符合率分别达81.5%、74.8%;重复性:批内与批间变异系数(CV)FT3分别为2.8%~5.6%、6.8%~9.0%,FT4分别为1.2%~3.4%、4.6%~7.0%;最少检量:FT3为0.9pmol/L,FT4为0.1pmol/L;真实性及诊断价值:FT3与FT4联合对甲亢、甲减诊断的灵敏度分别为92.2%、90.6%。
特异性分别为97.1%、97.1%,总有效率均为95%;阳性预示值分别为95.9%、91.7%;阴性预示值分别为97.1%、95.7%。
结论本检测系统对甲状腺功能的诊断灵敏、特异、可靠,与RIA技术相当,或有更多优点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
游离甲状腺素(FT4) 检测方法学性能验证评价报告
验证内容:正确度、重复精密度、中间精密度、线性范围、临床可报告范围及参考区间的确认验证人员:王绮华、李立
一检测系统信息
项目:FT4
仪器名称:全自动免疫分析仪
仪器型号:Modular E170
试剂及厂商:罗氏公司
检测方法:电化学发光法
二厂商提供的相关参数
三验证过程
1 正确度
1.1 目的:评价仪器测试结果与接受参考值之间的一致程度。
通过实验室检测数据的偏倚从而评价和验证实验室检测结果的准确性。
1.2 评价方法:参加卫生部临检中心的室间质评,本组参加室间质评的项目一律用回报结果作为评价标准,最近一次参加卫生部室间质评卫生部质控值。
1.3 结果判断:<1/2 CLIA’88
正确度验证试验数据记录表
2 精密度
2.1 重复精密度
2.1.1 目的:考察仪器检测方法的随机误差
2.1.2 原理:在检测系统处于优良的条件下,连续测定20个结果,判断这20个独立结果间的
一致程度
2.1.3 评价方法:选择新鲜混合血清标本(病人高值、低值)各20份,测量前先定标,再做
质控,质控结果在控制范围内,连续重复测定20次,计算SD,CV,得到重复
性精密度。
2.1.4 标本来源:高、低值标本均为混合血清。
2.1.5 结果判断:<1/4C LIA’ 88 6.25%
重复性精密度验证试验数据记录表
2.2 中间精密度:
2.2.1 目的:考察目前实验室检测方法中间精密度。
2.2.2 原理:在检测系统处于优良的条件下,连续测定20天,取得20个结果,判断这20个
独立结果间的一致程度。
2.2.3 评价方法:取一个月的室内质控值(高值、低值)计算CV、SD,得到批间精密度。
2.2.4 结果判断:<1/3 CLIA’ 888.33%
中间精密度验证试验数据记录表
3 线性范围(Linearity range, AMR)
3.1 目的:在确定某项目检测上限的同时检测其上下限是否呈线性关系,从而保证该浓度范围
检测结果的准确性。
3.2 标本要求:
高值标本可使用病人混合血清。
一般地样本的高值推荐在AMR上限的90%,低值推荐在AMR下限的10%,但这不是绝对的规则。
最好有5个或以上的系列浓度的实验样品,数据点数不得低于4个,浓度范围遍布整个预期可报告范围。
3.3 评价方法:
a) 以50ul为一个体积单位,将高值标本与低值标本以3:1、2:2、1:3的体积比例混合,
加上高低值标本共5个标本按照由低到高测定,记录结果。
b) 线性统计:以直接测定结果计算得出的相应浓度为X,以通过稀释测定结果为Y,回归方
法学统计,得到a、b及r值。
3.4 结果判断:
①若a在0.97-1.03范围内,r2>0.95,作b与0有无显著性差异的t检验,如果P>0.05,则可直接判断线性范围在实验已涉及浓度。
②若a不在0.97-1.03范围内,b较大,舍去高值或低值组数据,另做回归统计,直至缩小的分析范围其回归方程的a和b的判断符合要求,则该范围为线性范围。
线性范围验证试验数据记录表
4 临床可报告范围(Clinical reportable range ,CRR)
试剂说明书上说明检测范围足够宽,标本不需稀释,所以临床可报告范围即为线性范围pmol/l。
5 灵敏度:
6 干扰物质
干扰物质对本项目的影响大小沿用厂商参数,详细内容见本项目SOP。
7 参考区间(Reference intervals):
7.1 目的:选择20份体检合格的健康人标本,在检测系统上进行测定,对结果进行统计并与仪器说明书提供的参考区间进行比较。
7.2 评价方法:收集20 例正常健康人血清标本及时检测,要求其年龄,性别等均匀分布,对参考范围进行验证,只允许10%的数据超过所验证的参考范围,否则需建立参考范围。
验证范围:66-181 pmol/l
7.3 标本要求:
1) 体检合格健康的筛选者
2) 脂血、溶血均勿用
7.4 结果判断:R ≥90%即合格即合格
生物参考区间数据及验证记录表
7.5 结论:
若本实验室所检测的20个标本其检测结果个均在验证区间12-22 pmol/l内,故本实验室参考区间验证通过。
四总结(Summary)
游离甲状腺素试剂盒在罗氏E170电化学免疫检测系统的精密度、正确度、线性范围、可报告范围及生物参考区间通过验证。
通过以上各项性能验证室验的结论,罗氏E170电化学免疫检测系统达到检测要求,保证检验结果准确可靠,可以满足临床需求。
