甲醇生产工艺原理
甲醇生产工艺

甲醇生产工艺甲醇是一种重要的工业原料,可用于制造烯烃、烷烃、芳香烃、烯烃醇和醚醇等基础化学原料,也可外延应用于制造甲酸、氯乙烯和甲醇酯等衍生产品。
它的生产工艺有多种,主要有氢解法、合成气气压蒸馏法和合成空气蒸馏法。
本文将介绍这三种主要的甲醇生产工艺。
氢解法是用植物油、动物油、煤油或天然气作原料,经过热力学转化,在高温和高压下与水结合,产生甲醇和微量的甲醛。
氢解工艺的优点:(1)产品组分稳定,产品纯度高;(2)生产设备简单,操作容易;(3)工艺流程简单,操作温度低,能耗较低;(4)反应可以循环,可以强化热能。
但是,氢解法的缺点也是明显的:(1)运输成本高,原料易变质;(2)产品成本高;(3)维护和保养费用高;(4)产品的毒副作用较大,不符合生态环境保护要求。
合成气气压蒸馏法是以合成气(甲烷,氢气,乙烯)作原料,利用高温和高压的气相蒸馏分离方法,将气体分离成低碳烃和甲醇两部分,其中低碳烃可以用于烯烃的生产,而甲醇主要用作最终产品。
合成气气压蒸馏法具有以下优点:(1)零污染,不需要化学添加剂;(2)反应速率快,无需长时间的催化;(3)可以同时生产多种低碳烃,降低单一原料的需求;(4)操作简单,能够满足大规模生产的需求;(5)可以节省大量的能源消耗。
不过,合成气气压蒸馏法也有缺点:(1)生产设备昂贵,投资成本高;(2)系统运行复杂,操作困难;(3)由于气体混合物较复杂,反应条件很难控制;(4)由于温度太高,而造成甲烷热裂解,系统出现停滞现象。
合成空气蒸馏法是以空气为原料的甲醇生产工艺,其原理是将含有氧的空气通过催化剂转化为甲醇和水,通过蒸馏工艺分离出来。
合成空气蒸馏法的优点是:(1)反应速率比氢解法快,能耗较低;(2)无毒副作用,符合环保要求;(3)不需要原料运输,投资成本较低;(4)可以多次循环进行反应,提高产品纯度。
合成空气蒸馏法的缺点是:(1)设备复杂,操作复杂;(2)催化剂活化程度要求高,耗费大量的费用;(3)反应温度高,反应压力高,系统的运行复杂,操作技巧高;(4)反应不可控,对设备的控制要求严格。
甲醇生产工艺与操作

甲醇生产工艺与操作甲醇(CH3OH)是一种无色、难燃的液体,是重要的工业原料和溶剂。
甲醇的生产工艺主要有合成气法、天然气法和余热法等。
下面简要介绍甲醇的生产工艺和操作。
1. 合成气法合成气法是目前甲醇生产中最常用的方法。
该方法是通过将天然气或煤转化为合成气(一氧化碳和氢气的混合物),再通过催化剂的作用,将合成气转化为甲醇。
合成气法的主要步骤包括气化、净化、合成、分离和净化等。
2. 天然气法天然气法是利用天然气作为原料生产甲醇的方法。
该方法在气化步骤中,直接利用天然气进行气化,生成合成气,然后经过合成、分离和净化等步骤得到甲醇。
天然气法相对于合成气法,减少了气化步骤,简化了工艺流程。
3. 余热法余热法是利用工业生产中产生的余热来生产甲醇的方法。
该方法在循环床和余热再利用等工艺条件下,通过将废气进行循环利用,使得废气中的有机物充分利用,生成合成气,再经过催化剂的作用转化为甲醇。
甲醇的生产操作包括原料准备、反应、分离、回收和净化等步骤。
1. 原料准备在甲醇生产过程中,对于不同的工艺,相应的原料也不同。
合成气法中,主要原料包括天然气和煤。
天然气法中,主要原料为天然气。
余热法则是利用工业生产中的余热进行甲醇生产。
2. 反应甲醇的合成反应主要通过催化剂的作用进行。
合成气与催化剂在适当的温度和压力条件下进行反应,生成甲醇。
3. 分离在反应后,需要对产物进行分离。
主要的分离操作包括冷凝分离和蒸馏分离。
通过降温,将甲醇从反应气体中分离出来。
4. 回收回收操作主要是对分离得到的甲醇进行回收利用。
通过蒸馏、过滤和再结晶等操作,将甲醇进行纯化。
5. 净化甲醇的净化操作主要是去除杂质。
通过吸附剂或催化剂的作用,去除甲醇中的杂质,提高甲醇的纯度。
总的来说,甲醇的生产工艺主要有合成气法、天然气法和余热法等方法,生产操作包括原料准备、反应、分离、回收和净化等步骤。
这些工艺和操作对于甲醇的生产具有重要意义,能够确保甲醇的质量和产量。
甲醇合成原理方法与工艺

甲醇合成原理方法与工艺
一、甲醇合成原理
甲醇合成的机理简单概括为:催化剂起作用于乙烯,使它在氢气的作
用下发生氢化反应,从而形成甲醇的反应过程。
甲醇合成的反应分为三步:乙烯氢化合成乙醇,乙醇的氢化反应形成乙醇的氢化物,最后由乙醇氢化
物再次氢化反应,形成甲醇。
甲醇合成的主要反应过程为:
1、乙烯氢化反应:乙烯+H2→乙醇
2、乙醇氢化反应:乙醇+H2→乙醇的氢化物+H2O
3、乙醇的氢化物氢化反应:乙醇氢化物+H2→甲醇
二、甲醇合成工艺
1、反应器
甲醇合成反应器主要由容积箱、催化剂填料、表内管、安全阀、加料口、进料口、流量计、温度计等组成。
容积箱用于容纳催化剂和乙烯,表
内管用于分离氢气和乙烯,安定器可以确保反应器的安全,加料口用于进
行乙烯和氢气的进料,进料口用于将反应产物进行收集,流量计可以确定
矿物质的流量,温度计可以控制反应温度和防止温度过高等。
2、催化剂
甲醇合成工艺中使用的催化剂一般是活性碳粉末或负活性氧化铝粉末等。
甲醇的生产工艺流程设计论文

甲醇的生产工艺流程设计论文引言甲醇(化学式:CH3OH)是一种广泛应用于化工、能源和医药等领域的重要有机化合物。
它作为一种多功能的化工产品,被广泛应用于溶剂、燃料和化学品的合成。
在能源领域中,甲醇可以用作替代传统石油燃料的清洁能源,具有良好的经济效益和环境效益。
本文旨在通过对甲醇的生产工艺流程设计进行分析和研究,探讨如何提高甲醇的产率和纯度,降低生产成本,在保证产品质量的同时,最大限度地减少环境污染。
一、甲醇的生产原理甲醇的生产通常基于甲烷(CH4)的合成气反应,如下所示:CH4 + H2O -> CO + 3H2CO + 2H2 -> CH3OH这个过程分为两个步骤:合成气的生成和甲醇的合成。
合成气(Syngas)是由甲烷和水蒸气在一定温度和压力下反应得到的气体混合物,主要由一氧化碳(CO)和氢气(H2)组成。
甲醇的合成是通过将合成气在催化剂的存在下进行反应生成甲醇。
常见的催化剂有氧化锌(ZnO)和铜(Cu)基催化剂。
二、甲醇生产工艺流程设计甲醇的生产工艺流程设计主要包括合成气的制备、甲醇的合成、产品分离、废气处理等环节。
下面将分别介绍每个环节的设计原则和主要过程。
2.1 合成气的制备合成气的制备是甲醇生产的关键步骤之一。
合成气的质量和组成对甲醇的产率和纯度有重要影响。
合成气的制备方法主要有蒸汽重整法和干重整法。
蒸汽重整法是指将甲烷和水蒸气在催化剂的作用下反应生成氢气和一氧化碳。
干重整法是指将甲烷直接与氧气反应生成合成气。
两种方法各有优缺点,根据实际工艺要求选择适当的制备方法。
2.2 甲醇的合成甲醇的合成是将合成气在催化剂的存在下进行反应生成甲醇的过程。
催化剂的选择对反应速率和产物选择性有重要影响。
常用的催化剂有Cu/ZnO/Al2O3和Cu/ZnO/Al2O3/ZrO2等。
甲醇合成反应的操作条件包括温度、压力和气体配比等。
一般来说,较高的温度和压力有利于反应的进行,但过高的温度和压力也会增加能源消耗和设备成本。
甲醇合成原理方法与工艺

甲醇合成原理方法与工艺图1煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。
甲醇合成工艺简析

甲醇合成工艺简析
甲醇是一种重要的有机化学品,广泛应用于化工、医药、农药、染料、涂料、塑料等领域。
甲醇的合成工艺主要有三种:合成气法、天然气法和生物法。
下面将对这三种工艺进行简析。
一、合成气法
合成气法是甲醇工业生产中最主要的工艺路线之一。
该工艺路线是通过气相反应将合成气(一氧化碳和氢气的混合物)转化为甲醇。
该工艺路线主要分为三个步骤:合成气制备、甲醇合成和甲醇精制。
其中,合成气制备主要是通过煤气化、重油加氢、天然气重整等方法制备合成气;甲醇合成主要是通过催化剂将合成气转化为甲醇;甲醇精制则是通过蒸馏、吸附、萃取等方法将甲醇纯化。
二、天然气法
天然气法是近年来发展起来的一种甲醇合成工艺路线。
该工艺路线主要是通过天然气催化转化为合成气,再将合成气转化为甲醇。
该工艺路线相比于合成气法,具有能源消耗低、环保性好等优点。
但是,该工艺路线的技术难度较大,需要高效的催化剂和工艺流程。
三、生物法
生物法是一种新兴的甲醇合成工艺路线。
该工艺路线主要是通过微生物代谢将生物质转化为甲醇。
该工艺路线具有能源消耗低、环保性好等优点,但是目前该工艺路线的技术难度较大,需要进一步的研究和开发。
综上所述,甲醇合成工艺主要有三种:合成气法、天然气法和生物法。
每种工艺路线都有其优缺点,需要根据实际情况进行选择。
合成气制备甲醇原理与工艺

合成气制备甲醇原理与工艺合成气制备甲醇是一种重要的工业化合成过程,它将合成气(一氧化碳和氢气)转化为甲醇。
合成气制备甲醇具有高效能、高选择性、多样性等优点,在化工、医药、能源等领域具有广泛的应用。
本文将介绍合成气制备甲醇的原理和工艺。
一、合成气制备甲醇的原理1.一氧化碳的水合反应:CO+H2O→CO2+H2在反应器中,一氧化碳和水反应生成二氧化碳和氢气。
这一反应是可逆的,所以通过控制反应温度和压力,可以提高反应的转化率。
2.一氧化碳的加氢反应:CO+2H2→CH3OH在适当催化剂的存在下,一氧化碳和氢气进一步反应生成甲醇。
这个反应也是可逆的,所以控制反应条件能够提高反应的选择性和转化率。
3.甲醇水合反应:CH3OH+H2O→CH4+H2O由于甲醇在高温下容易进一步反应生成甲烷和水,所以需要适当控制反应温度和催化剂的存在。
二、合成气制备甲醇的工艺1.合成气的净化合成气中的杂质对反应的选择性和转化率有很大影响,所以需要对合成气进行净化处理。
常见的净化方法包括除硫、去除有机气体、气体冷凝等。
2.反应器的选择反应器的选择对于合成功率和选择性有很大影响。
常见的反应器包括固定床反应器、流动床反应器、随压式反应器等。
不同的反应器有不同的优点和适用范围,需要根据实际情况选择。
3.分离和纯化反应生成的甲醇需要进行分离和纯化,以得到高纯度的甲醇产品。
常见的方法包括蒸馏、吸附、膜分离等。
三、合成气制备甲醇的工艺改进和发展为了提高甲醇的选择性和转化率,研究者们一直在不断改进和发展合成气制备甲醇的工艺。
以下是一些常见的工艺改进和发展:1.催化剂的改进:研究人员通过调整催化剂的组成和结构,改善催化剂的活性和稳定性,提高甲醇的选择性和转化率。
2.反应条件的优化:通过控制反应温度、压力、气体配比等反应条件,提高甲醇的选择性和转化率。
3.催化剂的再生:随着反应的进行,催化剂会逐渐失活,需要进行再生。
研究人员开发了一系列的方法来再生催化剂,延长其使用寿命。
甲醇的生产工艺

甲醇的生产工艺甲醇(化学式CH3OH),也称为木醇,是一种重要的化工原料。
甲醇广泛应用于合成其他有机化合物、制造溶剂、制备钾甲醇和其他甲醇盐,并且还可以作为清洗剂和燃料使用。
甲醇的生产工艺主要有两种,即天然气法和煤制甲醇法。
天然气法是指利用天然气为原料制造甲醇的工艺。
首先,将天然气经过清洗和脱硫处理,去除其中的杂质和硫化物。
然后,通过蒸汽重整反应将天然气转化为一氧化碳和氢气。
接下来,将一氧化碳和氢气经过水煤气化反应转化为合成气。
最后,利用合成气和催化剂进行甲醇合成反应,生成甲醇。
这种方法具有高转化率和产品纯度高的优点,但需要大量的能源和催化剂,加工过程复杂。
煤制甲醇法是指利用煤炭为原料制造甲醇的工艺。
煤炭经过气化和水煤气转化得到合成气,然后将合成气进行氨合成反应,生成尿素和一氧化碳。
接着,将一氧化碳和水进行加热反应,生成甲醛。
最后,将甲醛脱水反应得到甲醇。
这种方法可以直接利用煤炭资源,减少对天然气的依赖,是一种较为经济的方式。
但是,由于煤炭气化过程中产生的废气和废水对环境造成污染,因此需要采取相应的污染物净化措施。
除了以上两种主要的甲醇生产工艺,还有其他次要的生产工艺。
例如,生物质制甲醇法利用生物质作为原料,经过厌氧发酵、产甲烷反应和甲醛合成反应制备甲醇。
这种方法可以有效利用农作物秸秆和木材废料等资源,具有绿色环保的特点。
另外,二氧化碳电化学还原法和引燃碳酸盐法也可以用来制备甲醇,但需要较高的能源消耗。
总的来说,甲醇的生产工艺主要有天然气法和煤制甲醇法,分别利用天然气和煤炭作为原料,经过一系列化学反应合成甲醇。
此外,生物质制甲醇法、二氧化碳电化学还原法和引燃碳酸盐法也可以用于甲醇的生产。
随着科学技术的进步和环保意识的提高,未来甲醇的生产工艺可能会有更多革新和改进,以实现更高效、低耗和环保的生产方式。
甲醇的生产工艺及流程

甲醇的生产工艺及流程甲醇,化学式为CH3OH,是一种重要的有机溶剂和化工原料。
甲醇具有许多优点,它是可再生能源,同时使用甲醇也可以减少大气污染,这也是为什么越来越多的国家开始采用甲醇来代替传统的石油能源的原因之一。
但是,如何生产高质量的甲醇,是一个十分重要的问题。
本篇文章将重点讲述甲醇的生产工艺及流程。
首先,我们需要了解甲醇的生产原理。
甲醇生产主要是通过将一些碳化合物如天然气、科技气等,和水蒸汽一起进行加热反应,生成一定量的合成气。
该合成气中含有大量的氢气、一氧化碳和二氧化碳等组分,而后经过一系列的处理,得到高纯度的甲醇。
其次,我们需要了解甲醇生产过程中的一些关键步骤。
其中最重要的步骤是甲醇的合成反应,一般使用一种称为甲醇合成反应的技术。
该技术利用一种催化剂将合成气中的一氧化碳和氢气反应,生成甲醇。
这是甲醇生产中最重要也最复杂的过程。
在甲醇生产的整个生产过程中,还需要进行一系列的处理,来确保生产过程中产品的高质量。
其中最重要的处理包括甲醇脱气、甲醇制冷、甲醇净化等过程。
这些处理的主要目的是确保甲醇的纯度,并从甲醇中去除杂质和其他有害成分。
最后,我们需要了解甲醇生产的必要条件以及一些重要参数控制。
甲醇生产需要确保一定的温度和压力,这些参数的控制在整个生产过程中非常关键。
此外,还需要进行一些反应物料的转移及倾倒等操作,来确保反应过程的顺利进行。
综上所述,甲醇生产是一个非常复杂的过程,需要使用一种非常精确的技术来控制所有的过程参数。
尽管这些过程可能会增加甲醇生产的成本,但这些过程处理的必要性也是保证甲醇质量的关键所在。
在未来,随着越来越多的国家采用甲醇来代替传统的石油能源,我们相信甲醇生产技术将在未来得到进一步的提高和发展。
甲醇合成原理方法与工艺
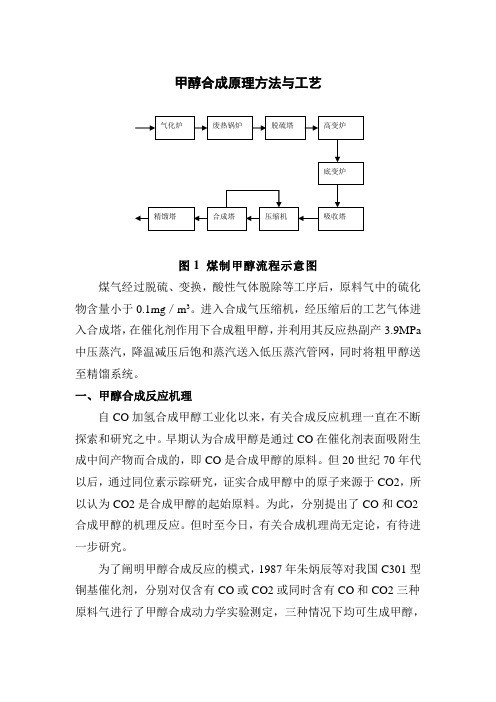
甲醇合成原理方法与工艺图1 煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa 中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。
甲醇合成原理方法与实用工艺

甲醇合成原理方法与工艺图1 煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa 中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。
甲醇合成原理方法与工艺

甲醇合成原理方法与工艺甲醇是一种重要的化学品和能源材料,其合成方法和工艺有多种。
下面将介绍几种常见的甲醇合成原理方法与工艺。
1.一步合成法一步合成法是将合成气(一氧化碳和氢气)在催化剂作用下直接转化为甲醇。
常用的催化剂有氧化锌和铜、氧化物和铁、氧化铬等。
合成气经过低温换热器和冷凝器后,进入氢气含量调节器,以调整合成气中CO和H2的比例。
然后,合成气进入反应器,在催化剂的作用下发生甲醇合成反应。
反应后的混合气经过冷凝器冷却,生成液相产物甲醇。
2.二步合成法二步合成法是将合成气先转化为甲醛,再将甲醛转化为甲醇。
该方法一般采用低温和高压条件进行反应,反应路线较复杂。
首先,合成气通过蒸汽重整反应器进行重整反应,产生含有甲醛的气体混合物。
然后,将气体混合物经过冷凝器冷却,生成液态的甲醛。
接下来,甲醛经过换热器的加热,进入甲醇合成反应器,通过催化剂的作用,甲醛与氢气发生反应生成甲醇。
反应后的产物通过冷却和分离工艺得到甲醇。
3.生物质转化法生物质转化法是利用生物质资源(如木材、秸秆等)通过气化或水解等方式制备合成气,再将合成气转化为甲醇。
在生物质气化过程中,原料经过热解、气化和转化等步骤,最终得到合成气。
合成气进一步通过合成反应,生成甲醇。
该方法可综合利用生物质资源,并具有可持续发展的特点。
甲醇合成的工艺包括前处理、合成反应和后处理三个阶段。
前处理包括合成气净化和控制气体比例,以保证反应物的质量和比例适合甲醇合成反应。
合成反应阶段通过调节反应温度、压力和催化剂的制备和加载等方式,控制甲醇合成反应的速率和选择性。
后处理阶段主要是通过冷却器、冷凝器和分离器等设备,将反应产物分离和纯化,得到高纯度的甲醇。
甲醇合成方法和工艺的选择取决于资源条件、技术水平、经济效益等因素。
不同的方法和工艺都有其优点和局限性,需要根据具体情况进行选择。
随着科学技术的进步和环境保护要求的提高,新的合成方法和工艺也在不断研究和发展中,以提高甲醇合成的效率和环境友好性。
甲醇生产工艺 生产甲醇的工艺

甲醇生产工艺生产甲醇的工艺甲醇,又称甲基醇,是一种无色、有毒、易燃的液体,具有广泛的用途,如用作溶剂、燃料、化学原料等。
甲醇的生产工艺经过多年的发展,已经成为一种成熟的工业化生产过程。
本文将从甲醇生产的原料、反应原理、工艺流程、设备及优化等方面进行介绍。
一、甲醇生产的原料甲醇的生产原料主要是天然气、煤和生物质。
其中,以天然气为原料的甲醇生产占据了世界甲醇总产量的80%以上。
天然气中含有丰富的甲烷,通过化学反应可以制备甲醇。
煤作为甲醇生产原料的优点在于其资源丰富,但煤的制备过程比较复杂,需要经过多步反应才能得到甲醇。
生物质作为甲醇生产原料的优点在于其可再生性和环保性,但其生产成本较高。
二、甲醇生产的反应原理甲醇的生产主要是通过甲烷的催化氧化反应得到,其化学反应式为:CH4 + H2O → CO + 3H2CO + 2H2 → CH3OH该反应过程需要催化剂的存在,一般采用氧化钴、氧化锌等催化剂。
甲醇的生产过程中,还会产生一些副产物,如二甲醚、甲醛等。
三、甲醇生产的工艺流程甲醇生产的工艺流程主要包括甲烷气化、合成气制备、甲醇合成、甲醇精馏等步骤。
1.甲烷气化:将甲烷与氧气进行反应,生成一氧化碳和氢气。
2.合成气制备:将一氧化碳和氢气按一定比例混合,生成合成气。
3.甲醇合成:将合成气和催化剂一起进入甲醇合成反应器进行反应,生成甲醇和一些副产物。
4.甲醇精馏:将反应产生的混合物进行精馏,分离出甲醇和其他有害物质。
四、甲醇生产的设备甲醇生产的设备主要包括气化炉、合成气制备设备、甲醇合成反应器、甲醇精馏塔等。
气化炉是甲烷气化的关键设备,其主要作用是将甲烷和氧气进行反应,生成一氧化碳和氢气。
合成气制备设备是将一氧化碳和氢气按一定比例混合的设备。
甲醇合成反应器是将合成气和催化剂一起进入进行反应的设备。
甲醇精馏塔是将反应产生的混合物进行精馏的设备。
五、甲醇生产的优化甲醇生产的优化主要包括催化剂的改进、反应条件的优化、设备的改进等方面。
甲醇精馏原理和流程简介

甲醇精馏生产原理、工艺流程一、精馏原理把液体混合物经过多次部分气化和部分冷凝,使液体分离成相当纯的组分的操作称为精馏,连续精馏塔可以想象是由一个个简单蒸馏釜串联起来,由于原料液中组分的挥发度不同,每经过一个蒸馏釜蒸馏一次,蒸汽中轻组分的含量就提高一次,即yn+1>yn>x(y代表气相组成,x代表液相组成),增加蒸馏釜的个数就可得到足够纯的轻组分,而塔釜中残液中所含轻组分的量会越来越少,接近于零。
将这些蒸馏釜叠加起来,在结构上加以简化即成为精馏塔。
随着精馏操作压力的提高,液体混合物的沸点相应提高,加压精馏塔顶甲醇的冷凝温度相应提高,利用加压精馏塔塔顶的较高温度的成品甲醇的冷凝热来作为常压精馏塔的再沸器热源,这样可以降低甲醇精馏的蒸汽消耗。
本工序就是利用脱醚塔、加压精馏塔、常压精馏塔分出粗醇中的轻组分物质和重组分物质而得到产品精甲醇。
三塔均采用垂直筛板塔,它比传统的浮阀塔板有更好的传质、传热性能。
二、工艺流程从粗醇工段送来的浓度为90%左右的粗甲醇到粗醇贮槽,经粗醇泵打到粗醇预热器,由蒸汽冷凝液提温至80℃左右进脱醚塔入料口送入脱醚塔。
控制预后比重在0.84~0.87之间。
从脱醚塔顶冷凝器冷凝下来的液体进脱醚塔回流槽,为了便于除去粗甲醇中的杂质,根据萃取的原理,要在脱醚塔回流槽内加入冷软水或蒸汽冷凝水,经脱醚塔回流泵再打入塔顶作为回流。
从排气冷凝器冷凝下来的低沸点液体去杂醇油贮槽。
脱醚塔釜液依次通过加压塔进料泵、预后粗醇预热器进入加压精馏塔两个进料口,控制塔釜温度在130~132℃。
塔顶蒸汽温度约122℃进入常压塔再沸器冷凝,一部分通过加压塔回流泵打回加压精馏塔作为回流液,另一部分经过加压精馏塔冷却器冷却至35~40℃作为产品去精醇贮槽。
塔底较稀的甲醇溶液经减压进入常压精馏塔四个进料口。
常压精馏塔塔釜再沸器由加压塔塔顶蒸汽加热,经常压塔回流泵一部分打入塔顶作为回流液,另一部分取出经常压塔精醇冷却器冷却后作为产品去精醇贮槽。
甲醇原理以及原料来源等

生产原理和原料来源原理甲醇合成是在一定温度、压力和催化剂作用下,CO、CO2与H2反应,主要生成CH3OH和H2O的放热可逆复杂反应过程。
其主要反应方程式如下:CO + 2H2 →CH3OH+102.37kJ/mol副反应:2CO+4H2→(CH3)2O +H2O+200.39kJ/molCO+3H2→CH4+H2O+115.69kJ/mol4CO+8H2→C4H9OH+3H2O+49.62kJ/molCO2+H2→CO+H2O-42.92kJ/mol目前,甲醇生产普遍采用CuO-ZnO-Al2O3或CuO-ZnO-Cr2O3系列催化剂,活性区域在473~563K之间,最佳活性使用温区500~530 K 之间。
活性温区较窄,而甲醇合成反应又是一个强烈放热反应,虽然对化学反应来说,温度升高会使分子运动加快,分子内的有效碰撞增多,并使分子有效结合的机会增加,使甲醇合成反应加快;但是由于CO、CO2与H2生成CH3OH的反应是可逆放热反应,随着温度增高逆反应的化学平衡常数增大,对甲醇生成不利。
因此,要求甲醇反应放出的热量,应及时移走。
另外,从上述化学反应方程式可以看出, CO、CO2与H2生成CH3OH的反应是一个体积缩小的反应,提高合成的压力有利于反应;由于催化剂厂家开发了高活性的催化剂,近年来,低压甲醇合成工艺得到了广泛的应用。
原料来源早期用木材或木质素干馏法制甲醇的方法,今天在工业上已经被淘汰了。
今后,木质以及农作物、有机废料以至城市垃圾等,都可以可以作为制造甲醇的主要原料,这些物质是作为碳资源,转化为碳的化合物,再以人工和成方法而制取甲醇。
工业合成甲醇的原料来源有天然气、石脑油、重油、焦炭、煤、焦炉气、乙炔尾气等。
本世纪50年代以来,原料结构发生了很大变化,以气体、液体燃料为原料生产甲醇原料气,不论从工程投资、能量消耗、生产成本来看都有明显的优越性,很快得到重视。
于是甲醇生产由固体燃料为主转移到以气体、液体燃料为主。
甲醇合成的原理及工艺

一、甲醇合成原理1、化学反应合成甲醇的主要化学反应为CO和H2在多相铜基催化剂上的反应:CO+2H2⇋CH3OH(g)-90.8kJ/mol反应气体中含有CO2时,发生以下反应:CO2+3H2⇋CH3OH(g)+H2O-49.5kJ/mol同时CO2和H2发生CO的逆变换反应:CO2+H2⇋CO+H2O(g)+41.3kJ/mol反应过程中除生成甲醇外,还伴随一些副反应的发生,生成少量的烃、醇、醛、醚、酸和酯等化合物。
这些副反应的产物还可以进一步发生脱水、缩合、酰化或酮化等反应,生成烯烃、酯类、酮类等副产物。
当催化剂中含有碱类化合物时,这些化合物的生成更快。
副产物不仅消耗原料,而且影响甲醇的质量和催化剂的寿命。
尤其是生成甲烷的反应为一个强放热反应,不利于反应温度的操作控制,且甲烷不能随着产品冷凝,在循环系统中循环,更不利于主反应的化学平衡和反应速率。
2、甲醇合成反应的特点(1)放热反应甲醇合成是一个可逆放热反应,为了使反应过程能够向着有利于生成甲醇的方向进行,适应最佳温度曲线的要求,达到较好的产量,需及时移走热量。
(2)体积缩小反应从化学反应可以看出,无论是CO还是CO2分别与H2合成CH3OH,都是体积缩小的反应,因此压力增高,有利于反应向着生成CH3OH的方向进行。
(3)可逆反应即在CO、CO2和H2合成生成CH3OH的同时,甲醇也分解为CO2、CO和H2,合成反应的转化率与压力、温度和氢碳比ƒ=(H2-CO2)/(CO+CO2)有关。
(4)催化反应在有催化剂时,合成反应才能较快进行。
二、甲醇合成催化剂随着英国ICI公司铜‐锌‐铝催化剂的研制成功,甲醇生产进入了低温(220~280℃)、中低压(5~10MPa)时代。
近年来,低压铜基催化剂的使用逐渐普遍,各种新型甲醇催化剂层出不穷,无论活性、选择性、寿命等各方面均大大超过前代产品,从而推动甲醇生产实现了长周期、低能耗、低成本运行。
1、铜基催化剂(1)CuO‐ZnO‐Al2O3催化剂英国ICI公司开发的CuO‐ZnO‐Al2O3催化剂是比较有代表性的铜基催化剂。
甲醇合成工艺简析

甲醇合成工艺简析
甲醇是一种重要的有机化合物,广泛用于化工、医药、农药等领域。
甲醇合成工艺是甲醇生产的重要工艺之一,其基本原理是通过一系列化学反应将合成气转化为甲醇。
甲醇合成工艺的基本步骤是:首先将天然气、煤炭等原料经过气体净化、变换、深度冷却后,进入合成气制备装置。
在合成气制备装置中,原料气体经过加热、反应、冷却、净化等一系列处理,生成合成气。
合成气中主要成分为一氧化碳和氢气,这两种气体是甲醇合成的基础。
接着,将合成气送入甲醇合成反应器中进行反应。
甲醇合成反应器通常采用低温低压的条件,反应器内使用催化剂作为反应介质。
在催化剂的作用下,一氧化碳和氢气发生化学反应,生成甲醇和水。
在甲醇合成反应中,催化剂起着至关重要的作用。
常用的甲醇合成催化剂有氧化锌铬、铜锌铝和铝硅钠等。
这些催化剂具有高催化活性、高选择性、稳定性好等特点。
甲醇合成反应结束后,产物中除了甲醇外还包括一些杂质和水。
因此需要对产物进行后处理,提高甲醇的纯度。
后处理过程通常包括分离、蒸馏、精馏等步骤。
甲醇合成工艺的优点是原料来源广泛,可使用天然气、煤炭等多种
资源进行生产,同时甲醇可以作为清洁能源的替代品,具有广泛的应用前景。
但是该工艺也存在一些问题,如催化剂的活性和稳定性需要进一步提高,后处理过程对能源消耗较大等。
甲醇合成工艺是一项重要的化工工艺,其合成原理和工艺流程相对简单,但对催化剂的选择和后处理过程要求较高。
未来,应该进一步加强研究,提高甲醇合成工艺的效率和环保性,促进其在清洁能源领域的应用。
甲醇的生产原理

甲醇的生产原理
甲醇的生产原理是通过甲烷的催化氧化反应来实现的。
首先,甲烷与空气的混合物被引入催化剂床层中,该催化剂通常由金属氧化物如铜、锌、铳或镍组成。
在催化剂的作用下,甲烷分子被氧气氧化为一氧化碳和水蒸气。
这个反应是一个放热反应,产生的热量可以用于加热反应器。
一氧化碳和水蒸气随后进一步反应生成甲醇。
甲醇的生成反应是一个复杂的化学过程,通常需要在高温(约300-400℃)和高压(约50到100 atm)条件下进行。
此外,
反应速率还受到催化剂的选择、反应物浓度和反应器设计等因素的影响。
为了提高甲醇的产率和选择性,常常采用催化剂的改性和添加一些助剂。
例如,添加锌和铝等金属可提高甲醇选择性,而添加钼和镁等金属可增加甲醇的产量。
需要注意的是,甲醇的生产过程还会产生一些副产物和废气。
这些副产物和废气需要经过处理,以防止对环境造成负面影响。
因此,在甲醇生产过程中需要设立相应的废气处理和环境保护措施。
甲醇生产—甲醇生产原理确定工艺条件

2023/11/2
甲醇生产
1
*
❖3.反应条件:
❖ 2)压力:加压有利于反应。但压力过大,会使 能耗增加,设备材质要求提高。
❖ 3)H2与CO比:CO过量能引起羰基铁在催化剂上积 聚,使催化剂失活,故常用氢气过量的反应。工 业上,用Zn-Cr2O3催化剂时,H2与CO比为 4.5左右;用铜基催化剂,H2与CO比为2.2-3.0。
NaOH溶液浸渍合金, 除去其中部分Al或Si得到活性金属
骨架。即为骨架催化剂。 如骨架镍、骨架钴、骨架铜等
。骨架镍含镍40-50%,活性很高,强度高。
2023/11/2
(甲醇的生产)
5
3.金属氧化物催化剂:其活性比金属催化剂差 ,需较高温度。为提高热稳定性,常加Cr2O3、 MoO3等。主要有MoO3、Cr2O3、ZnO、 CuO等。即 可单独用,产
4
➢ 三.催化剂
作用:为提高反应速度,且尽量降低温度压力( 设备投资降低),必用催化剂。工业常用过渡 元素做加氢催化剂。
1.金属催化剂:Ni、Pd、Pt 。为降低成本,常用载
体:氧化铝、硅胶、硅藻土。
优点:活性高,低温性能好。
缺点:易中毒,对原料杂质要求高。如 S、As、P、N、Cl等。2. 骨架催化剂:将活性重金属和Al或Si制成合金,再以
*
❖3.反应条件:
❖ 1)温度:温度升高对反应不利,且不同活性催 化剂最适宜反应温度不同。 注意:①为延长催化剂寿命,开始易用较低 温度,过一定时间再升至适宜温度,其后随着催 化剂老化程度升高,反应温度也相应高。 ②因反应放热,反应热应及时移出,否则副反 应增加,催化剂易熔解,活性降低。 故,严格控制温度,及时有效地移走反应热 是合成塔设计、操作之关键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一氧化碳加氢为多方向反应,随反应条件及所用催化剂的不同,可生成醇、烃、醚等产物,因而在甲醇合成过程中可能发生以下反应:
●主反应:CO+H2≒CH3OH+Q
CO2+3 H2≒CH3OH+H2O+Q
●副反应:CO+3H2≒CH4+H2O+Q
2CO+4H2≒C2H5OH(乙醇)+H2O+Q
2CO+4H2≒CH3OCH3(甲醚)+H2O+Q
一、甲醇合成反应影响因素有哪些?
1、温度
2、压力
3、空速
4、惰性气
5、CO2含量:CO2也能参加合成甲醇的反应,但对锌铬系催化剂,对于铜系催化剂,CO2的作用比较复杂,即有动力学方面的作用,还可能具有化学助剂的作用,归纳起来,其有利的方面为:
1)含有一定量的CO2可促进甲醇的提高
2)提高催化剂的选择性,可降低醚类等副反应的发生
3)可更有利于调节温度,防止超温,延长催化剂使用寿命
4)防止催化剂结炭
其不利方面:
1)与CO合成甲醇相比,每生成1kg甲醇多消耗0.7m3的H2
2)使粗醇中水含量增加,甲醇浓度降低
总之,在选择操作条件时,应权衡CO2作用的利弊。
通常,在使用初期,催化剂活性较好时,应适当提高原料气中CO2的浓度使合成甲醇反应不致于过分剧烈,以得于床层温度的控制;在使用后期,可适当降低原料气中的CO2浓度,促进合成甲醇反应的进行,控制与稳定床层温度。
二、铜基甲醇催化剂还原方法有几种,优缺点?
铜基甲醇催化剂掺入使用前,必须用氢小心还原使其活化。
其还原过程是一个强放热反应,每消耗1%的H2,引起绝热漫长约28℃,反应式如下:
CuO+H2=Cu+86.7kj/mol
在工作业上,可采用低氢和高氢还原两种方法。
低氢还原特点:床层温度便于控制,有利于提高催化剂的活性,缺点:时间较长(80-100小时)。
高氢还原特点:还原时间较短40小时,缺点:操作必须十分细心严格,稍有不慎,将引起催化剂床层剧烈超温,导致催化剂失活报废。
另外操作不当,催化剂强度易受到损害,造成催化剂部分粉化而引起床层压差大。
有文献认为,在高浓度氢气下,容易发生深度还原,使CuO全部还原成金属铜而引起活性与选择性的下降。
三、何为醇净值?怎样进行估算?
甲醇合成塔出入品甲醇含量的差,被称为醇净值。
一般用下列经验公式进行估算:
△E=(T出-T入)/32×100%。
