有机化学方程式书写
必修二 有机化学 方程式总结

乙烯与HX:C2H4+HX催CH3CH2X
乙烯与H2O:C2H4+H2O催CH3CH2OH
乙烯的加聚:nC2H4催[CH2-CH2]n
苯的燃烧: +15O2点12CO2+6H2O
苯的溴代:+Br2Br
苯的硝化:+HNO3浓硫酸50-60℃NO2+H2O
苯的磺化:+H2SO4(浓)70-80℃SO3H +H2O
乙醇与HX:C2H5OH+HX C2H5OX+H2O
乙酸与钠:2CH3COOH+Na 2CH3COONa+H2O
乙酸与NaOH:CH3COOH+NaOH CH3COONa+H2O
乙酸Na2CO3:CH3COOH+Na2CO3CH3COONa+H2O+CO2
乙醇与乙酸:CH3COOH+C2ห้องสมุดไป่ตู้5OH浓硫酸△CH3COOC2H5+H2O
必修二
甲烷和Cl2:CH4+Cl2CH3Cl+HCl
CH3Cl+Cl2CH2Cl2+HCl
CH2Cl2+Cl2CHCl3+HCl
CHCl3+Cl2CCl4+HCl
甲烷燃烧:CH4+2O2点CO2+2H2O
甲烷分解:CH41000℃C+2H2
乙烯燃烧:C2H4+3O2点2CO2+2H2O
乙烯与Br2:C2H4+Br2C2H4Br2
苯与H2:+3H2Ni△
乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2
(完美版)高中有机化学方程式总结

高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
有机化学基础化学方程式

有机反应方程式一烷烃1.甲烷燃烧: 2·P34CH4 +2O2CO2 + 2H2O2.甲烷与氯气在光照条件下反应2·P56CH4 + 3Cl2CHCl3+ 3HClCH4 + 4Cl2CCl4 + 4HCl CH4 + 2Cl2CH2Cl2 + 2HCl3.甲烷在一定条件下可被氧化成一氧化碳和氢气2·P562CH4+O22CO+4H24.甲烷高温分解2·P56 CH4 C + 2H2二烯烃1.乙烯与溴的四氯化碳溶液反应2·P60 CH2=CH2 + Br2 CH2BrCH2Br3.乙烯与水反应2·P60 CH2=CH2 + H2O CH3CH2OH4.乙烯的催化氧化制乙醛2·P77 2CH2=CH2 + O22CH3CHO5.乙烯的催化氧化制乙酸2·P77 CH2=CH2 + O22CH3COOH6.乙烯的催化加氢2·P64 CH2=CH2 +H2CH3CH38.乙烯的加聚反应2·P78 n CH2=CH29.乙烯与氯气在一定条件下生成氯乙烯3·P46 CH2=CH2 + Cl2CH2=CHCl+HCl10.乙烯与氯气加成3·P46 CH2=CH2 + Cl2 CH2ClCH2Cl12. 1—丁烯与氢气催化加成3·P47 CH2=CH2CH2CH3 +H2CH3CH2CH2CH313.环己烯催化加氢3·P49H2 +14. 1,3环己二烯催化加氢3·P492H2 +16. 1,3-丁二烯与溴在温度较低和较高时的反应3·P42CH2=CH—CH=CH2+Br2 CH2BrCH=CHCH2BrCH2=CH—CH=CH2+Br2CH2BrCHBrCH=CH2 17. 1,1—二氯乙烯加聚3·P47n CCl2=CH218.丙烯加聚3·P47n H2C=CHCH319. 2—甲基—1,3—丁二烯加聚3·P47n三炔烃1.乙炔燃烧2·P37 2C2H2 + 5O24CO2 + 2H2O2.乙炔与足量溴的四氯化碳溶液反应2·P60 CH≡CH + Br2 CHBr2CHBr23.乙炔与氢气催化加成3·P47 CH≡CH + 2H2 CH3CH34.乙炔制聚氯乙烯2·P60CH≡CH +HCl H2C=CHCl n H2C=CHCl四芳香烃1.苯的燃烧2·P62 2C6H6+15O212CO2 + 6H2O2.苯的催化加氢3·P49 + 3H23.苯与液溴催化反应3·P51 + Br2+ HBr4.苯的硝化反应3·P51 +HO-NO2+ H2O9.苯乙烯与溴的四氯化碳溶液反应3·P56+Br210.甲苯与浓硝酸、浓硫酸的混合酸1000C时获得三硝基甲苯3·P53+ 3HO—NO2 + 3H2O六、卤代烃1.氯乙烷在氢氧化钠水溶液中加热反应3·P64CH3CH2Br + NaOH CH3CH2OH + NaBr2.氯乙烷在氢氧化钠醇溶液中加热反应2·P63CH3CH2Br +NaOH CH2=CH2↑+ NaBr + H2O 4. 1—溴丙烷与氢氧化钾醇溶液共热3·P65CH3CH2 CH2Br +KOH CH3CH=CH2↑ + KBr + H2O —氯丙烷与氢氧化钠水溶液共热3·P65CH3CHClCH3 +NaOH CH3CHOHCH3+ NaCl6. 2—甲基—2—溴丁烷消去溴化氢3·P65七、醇类1.乙醇与钠反应3·P672CH3CH2OH + 2Na 2CH3CH2ONa + H2↑2.乙醇的燃烧2·P34 CH3CH2OH+3O22CO2+3H2O3.乙醇的催化氧化2·P662CH3CH2OH + O2 2CH3CHO + 2H2O4.乙醇制乙烯3·P69 CH3CH2OH CH2=CH2↑ + H2O5.乙醇制乙醚3·P69 2CH3CH2OH CH3CH2OCH2CH3 + H2O6.乙醇与红热的氧化铜反应3·P88CH3CH2OH+CuO CH3CHO+H2O7.浓硫酸、乙醇和溴化钠加热反应制溴乙烷3·P68C2H5OH+NaBr+H2SO4C2H5Br+NaHSO4 + H2O八、酚类1.苯酚与氢氧化钠反应3·P73 + NaOH + H2O2.苯酚与溴水反应3·P73+3Br2↓ + 3HBr九、醛类1.乙醛的催化加氢3·P80CH3CHO + H2CH3CH2OH2.乙醛的催化氧化2·P662CH3CHO + O22CH3COOH3.乙醛与银氨溶液反应3·P80CH3CHO + 2AgNH32OH CH3COONH4+ 2Ag↓ + 3NH3 + H2O4.乙醛与新制氢氧化铜反应3·P80CH3CHO + 2CuOH2 +NaOH CH3COONa + Cu2O↓ + 3H2O5.甲醛与苯酚制酚醛树脂3·P80十、羧酸1.乙酸与乙醇发生酯化反应2·P68CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O2.乙酸与碳酸钠反应2·P67 2CH3COOH+Na2CO3==2CH3COONa+H2O+CO2↑4.两分子乳酸脱去两分子水3·P862CH3CHOHCOOH7.甲酸与银氨溶液反应3·P84HCOOH+2AgNH32OH NH42 CO 3+ 2Ag↓ + 3NH3 + H2O8.甲酸与新制氢氧化铜反应3·P84HCOOH+2CuOH2 +2NaOH Na2 CO3+ Cu2O↓ + 3H2O9.甲酸与碳酸钠反应3·P842HCOOH+Na2CO32HCOONa+H2O+CO2↑十一、糖类1.葡萄糖燃烧2·P45 C6H12O6 + 6O26CO2 + 6H2O2.葡萄糖与乙酸完全酯化3·P91CH2OHCHOH4CHO+5CH3COOH CH3COOCH2CHOOCCH3CHO+5H2O3.葡萄糖与银氨溶液反应3·P91CH2OHCHOH4CHO + 2AgNH32OH CH2OHCHOH4COONH4+ 2Ag↓ + 3NH3↑ + H2O4.葡萄糖与新制氢氧化铜反应2·P71CH2OHCHOH4CHO + 2CuOH2 +NaOH CH2OHCHOH4COONa + Cu2O↓ + 3H2O5.葡萄糖被还原为直链己六醇3·P91CH2OHCHOH4 CHO + H2CH2OHCHOH4CH2OH6.葡萄糖在酒化酶作用下获得乙醇2·P72C6H12O62CH3CH2OH + 2CO2↑7.蔗糖水解3·P93 C12H22O11蔗糖+ H2O C6H12O6葡萄糖+ C6H12O6果糖8.麦芽糖水解2·P71 C12H22O11麦芽糖+ H2O 2C6H12O6葡萄糖9.淀粉水解2·P47 C6H10O5n淀粉+ nH2O n C6H12O6葡萄糖10.纤维素水解2·P45C6H10O5n纤维素+ nH2O n C6H12O6葡萄糖11.纤维素燃烧2·P46 C6H10O5n纤维素+ 6nO26nCO2 + 6nH2O十二、酯类1.乙酸乙酯与H218O混合加入稀硫酸水解3·P13CH3COOCH2CH3 + H218O CH3CO18OH + CH3CH2OH2.油脂的氢化以油酸甘油酯加氢为例3·P993.油脂的皂化反应以硬脂酸甘油酯为例3·P99。
高中有机化学反应方程式总结(较全)

高中有机化学反应方程式总结(较全)
简介
这份文档总结了高中有机化学中常见的反应方程式,旨在帮助学生更好地理解和记忆有机化学反应。
以下是一些常见的有机化学反应类型及其方程式。
1. 烷烃类反应
1.1 烷烃燃烧反应
烷烃 + 氧气→ 二氧化碳 + 水
例如:甲烷 + 氧气→ 二氧化碳 + 水
1.2 烷烃与卤素反应
烷烃 + 卤素→ 卤代烷 + 氢卤酸
例如:甲烷 + 溴→ 溴代甲烷 + 氢溴酸2. 烯烃类反应
2.1 烯烃与卤素反应
烯烃 + 卤素→ 二卤代烷
例如:乙烯 + 光→ 过氧化氢 + 氯乙烷3. 醇类反应
3.1 醇脱水反应
醇→ 烯烃 + 水
例如:乙醇→ 乙烯 + 水
3.2 醇氧化反应
醇 + 氧气→ 酮/醛 + 水
例如:乙醇 + 氧气→ 乙酸 + 水
4. 酮类反应
4.1 酮的高温还原反应
酮 + 还原剂→ 伯胺
例如:丙酮+ NaBH4 → 正丙胺
5. 羧酸类反应
5.1 羧酸与醇酸酐化反应
羧酸 + 醇酸酐→ 酯 + 水
例如:乙酸 + 乙酸酐→ 乙酸乙酯 + 水
5.2 羧酸与碱反应
羧酸 + 碱→ 盐 + 水
例如:乙酸 + 氢氧化钠→ 乙酸钠 + 水
6. 醛类反应
6.1 醛还原反应
醛 + 还原剂→ 一级醇
例如:乙醛+ NaBH4 → 乙醇
以上是高中有机化学反应方程式的一些简单总结。
更详细的反应方程式及反应条件请参考有机化学教材或咨询化学老师。
注意:文档中的所有反应方程式仅供参考,请在实验操作时遵循正确的操作规程和安全注意事项。
有机化学方程式总结

高中有机化学方程式总结一、烃 1、甲烷烷烃通式:C n H 2n +2稳定性:通常状况下,烷烃很稳定,与强酸、强碱和强氧化剂都不反应。
(1)氧化反应①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O②甲烷不可使酸性高锰酸钾溶液及溴水褪色。
2222231C H O CO (1)H O 2n n n n n +++−−−→++点燃(2)取代反应:在光照条件下能与卤素单质发生取代反应。
一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl(3)裂解反应(分解反应):烷烃在高温下可分解生成碳原子数较少的烷烃和烯烃(CH 4在高温下可分解成C 和H 2)。
1634818816C H C H C H −−−→+高温2、乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O烯烃通式:C n H 2n点燃光光光光浓硫酸170℃图1 乙烯的制取(1)氧化反应①乙烯的燃烧:火焰明亮且伴有黑烟,生成二氧化碳和水,同时放出大量热。
24222C H 3O 2CO +2H O +−−−→点燃②乙烯可使酸性高锰酸钾溶液褪色,可以利用这个反应鉴别甲烷和乙烯。
但是乙烯会被酸性KMnO 4溶液氧化成CO 2和H 2O ,所以不能用酸性KMnO 4来除去乙烷中的乙烯。
(2)加成反应①与溴水加成:②与氢气加成:③与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl④与水加成:(3)聚合反应①乙烯加聚,生成聚乙烯:②CH=CH 2n CHCH 2催化剂聚丙烯nCH 3CH 3丙烯3、乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH↑+Ca(OH )2(1)氧化反应①乙炔的燃烧:222222C H 5O 4CO 2H O +−−−→+点燃催化剂 △②乙炔可使酸性高锰酸钾溶液褪色,发生氧化反应。
有机化学方程式(70个)

有机化学基础反应方程式汇总 1.甲烷(烷烃通式:C n H 2n +2) 甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 点燃2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+ClCH 3CH 2Cl 2CHCl 3(32.乙烯((1(2(3CH 3CH CH 3CH n CH 2=3.乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br =CHBr CHBr =CHBr+Br 2—CHBr 2与氢气加成:HC ≡CH+H 2催化剂H 2C =CH2图3乙炔的制取与氯化氢加成:HC≡CH+HCl催化剂CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH2=CHCl催化剂[CH2—]n乙炔加聚,得到聚乙炔:n HC≡CH催化剂[CH=CH]n4.1,3-丁二烯与溴完全加成:CH2=CH-CH=CH2+2Br2Br-CHBr-CHBr-CH2Br与溴1,2-加成:CH2=CH-CH=CH2+Br2Br-CHBr-CH=CH2与溴5.苯(1(2(制溴苯)+HO—苯硝化反应生成硝基苯,它是一种带有苦杏仁味、无色油状液体,有毒。
+HO—(3)加成反应(环己烷)6.甲苯(1(2)取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、开矿等。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。
CH3CH3BrCH3Br+Br2Fe(或 )+HBr(本反应用纯溴,催化剂时苯环上取代)CH3|+3HNO 浓硫酸O2N—CH3|—NO2|NO2+3H2O3。
有机物化学方程式

+HO—SO3H +H2O
(苯磺酸)
(3)加成反应
(环己烷)
苯还可以和氯气在紫外光照射下发生加成反应,生成C6H6Cl6(剧毒农药)。
5.甲苯
(1)氧化反应
甲苯的燃烧:C7H8+9O27CO2+4H2O
甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
(2)取代反应
甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),
烷烃通式:CnH2n+2
(1)氧化反应
甲烷的燃烧:CH4+2O2CO2+2H2O
甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应
一氯甲烷:CH4+Cl2CH3Cl+HCl
二氯甲烷:CH3Cl+Cl2CH2Cl2+HCl
三氯甲烷:CH2Cl2+Cl2CHCl3+HCl(CHCl3又叫氯仿)
四氯化碳:CHCl3+Cl2CCl4+HCl
是一种淡黄色晶体,不溶于水。它是一种烈性炸药,广泛用于国防、开矿等。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。
(3)加成反应
(甲基环己烷)
6.溴乙烷
纯净的溴乙烷是无色液体,沸点38.4℃,密度比水大。
(1)取代反应
溴乙烷的水解:C2H5—Br+NaOHC2H5—OH+NaBr
苯酚是无色晶体,露置在空气中会因氧化显粉红色。苯酚具有特殊的气味,熔点
43℃,水中溶解度不大,易溶于有机溶剂。苯酚有毒,是一种重要的化工原料。
(1)苯酚的酸性
(苯酚钠)
2
高中有机化学方程式汇总

高中有机化学方程式汇总一、取代反应1、CH 4 + Cl 2 HCl + CH 3Cl ( 气态) 一氯甲烷CH 3Cl + Cl 2HCl + CH 2Cl2 ( 液态 ) 二氯甲烷CH 2Cl + Cl 2HCl + CHCl 3 ( 液态 ) 三氯甲烷或氯仿 CHCl 3+ Cl 2HCl +CCl 4 ( 液态 )四氯甲烷或四氯化碳 2、C 2H 6 + Cl 2 HCl + CH 3CH 2Cl3 + Br 2Br + HBr (真正催化剂是FeBr3)3 + Cl 22Cl + HCl3 + 3Cl 2 + 3HCl4 + HONO 2 2 + H 2O+ HOSO 3H 3H + H 2O5 + 3Br 2 + 3HBr+ 3HONO 2 + H 2O6、C 2H 5OH + HBr C 2H 5Br + H 2O C 2H 5Br C 2H 5OH + HBrC 2H 5Br CH 2 CH 2 + HBr7、CH 3COOC 2H 5 + H 2O CH 3COOH + C 2H 5 OH光照光照光照 光照光照Fe 光照无水AlCl 3Cl LNaOHH 2O NaOHC 2H 5OHBr L3H 2SO 4浓50-60℃2NO NO 2 LH 2SO 4浓50-60℃ H 2SO 4浓70-80℃ 无机酸或碱8、 + 3 NaOH + 3C 17H 35 COONa二、加成反应1、CH 2 CH 2 + H 2CH 3 CH 32、CH 2 CH 2 + HCl CH 3 CH 2Cl3、CH 3CH CH 2+ HClCH 3 CHClCH3(马氏加成)CH 3 CHCH 2 + HCl CH 3 CH 2 CH 2Cl (反马氏加成)4、CH CH + H 2 CH 2 CH 2 CH CH + 2 H 2 CH 3 CH 35、CH CH + 2HCl CH 3 CHCl 26、CH 3 CHO + 2 H 2 CH 3 CH 2OH 7+ 3 H 2 + H 2 CH 3 CH 2 CH 3+ H 2 CH 3 CH 2 CH 2 CH 3 ㊣ Pt 比Ni 催化效率高 8+ 3Cl 2 C 6H 6 Cl 69、 CH 2 CH 2 + H 2O CH 3 CH 2OHCH CH + H 2O 2CH 2 CH 2 + O 22 1、CH3 CH 2OH CH 2 2 + H 2O2、2CH 3 CH 2OH+ H 2O (分子间脱水) 3、C 2H 5 Cl CH 2 CH 2 + H ClOOOCH 2 O C C 17H 35 CH O C C 17H 35 CH 2 O C 17H 35CH 2CH OH CH 2 无水AlCl 3/HgCl 2/ZnCl 2150-160℃ 无过氧酸有过氧酸如CH 3COOOH 催化剂加热 HHC CH Cl +--+ H Cl无水AlCl 3 H 2SO 4 或 H 3PO 4 加热 加压HgSO 4(H +)OCH 3 C H高温、高压PdCl 2 或CuCl 2OCH 3 C H三、消去反应H 2SO 4浓170℃ H 2SO 4浓 140℃CH 3 CH 2 O CH 2 CH 3 NaOH C 2H 5OH四、酯化反应 (酯化反应也是取代反应)1、CH 3 COOH + CH 3 CH 2OH CH 3 COOCH 2 CH 3 + H 2O2、 + 3HONO 2+ H 2O3、[C 6H 7 O 2(OH) 3 ]n + 3n HONO 2 [C 6H 7 O 2(NO 2) 3 ]n + 3nH 2O 五、水解反应(卤代烃、酯、油脂的水解见上,也是取代反应)1、CH 3 COONa + H 2O 3 COOH + NaOH2、C 17H 35 COONa + H 2 C 17H 35 COOH + NaOH3、(C 6H 10O 5)n + nH 2O n C 6H 12O 64、C 12H 22O11 + H 2OC 6H 12O 6 + C 6H 12O 6C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖5、CH 3 COOCH 2 CH 3 + H 2O CH 3 COOH + CH 3 CH 2OH六、氧化反应①被强氧化剂氧化 1、2 CH 3 CH 2OH + O 2 2 + H 2O 2、2 + O 2 2 CH 3 COOH 3、2 CH 2 CH 2 + O 2 2 ②被弱氧化剂缓慢氧化1、CH 3 CHO + 2[Ag(NH 3)2] OH CH 3 COOH + 4 NH 3 + 2Ag + H 2O2、CH 3 CHO + 2 Cu(OH)2 CH 3 COOH + 2 Cu 2O + H 2O3、CH 2 OH(CHOH)4 CHO + 2[Ag(NH 3)2] OH CH 2 OH(CHOH)4 COOH + 4 NH 3 + 2Ag + H 2O4、CH 2 OH(CHOH)4 CHO +2 Cu(OH)2 OH(CHOH)4 COOH + 2 Cu 2O + H 2O5、HCOOH + 2[Ag(NH 3)2] OH CO 2 + 4 NH 3 + 2Ag + H 2OH 2SO 4浓 加热CH 2 OH CH OHCH 2 OHCH 2 O NO 2 CH O NO 2 CH 2 O NO 2 H 2SO 4浓 H 2SO 4浓H 2SO 4稀加热淀粉/纤维素 葡萄糖H 2SO 4稀加热蔗糖 葡萄糖 果糖H 2SO 4稀加热无机酸 或碱Cu 或Ag OCH3 C H OCH 3 C H Mn(AC)2 Mn(AC)2 OCH 3 C H 水浴加热 水浴加热 水浴加热6、HCOOH + 2 Cu(OH)2CO 2 + 2 Cu 2O + 2H 2O③有化合机物的燃烧 C x H y + (x+y /4) O 2xCO 2 + y /4 H 2O七、还原反应1、+ H 22、 + H 2 CH 3 CH 2OH3、 八、加聚反应1、n CH 2 CH 22、n CH CH3、 九、缩聚反应1、n+ nH 2O2、+ nH 2O 1、CH 4 C + 2H 2 C 16H 34 C 8H 16 + C 8H 18C 8H 18 C 4H 8 + C 4H 10 C 8H 16 CH 4 + C 7H 12十一、其它有机反应12 + H 2O 3 2、2CH 3 CH 2OH + 2Na 2CH 3 CH 2O Na + H 2 3、OH + 2Na 24、C 12H 22O 11 12C + 11 H 2O C + 2H 2SO 4(浓) CO 2 +2 SO 2 + 2H 2O5、氨基酸的两性点燃 O CH 3 C CH 3 CH 3 C CH 3 OCH 3 C H 2 CH 2 + H 2 2 CH 3nCH 2 CH CH 2 CH 2催化剂[ CH 2 CH CH 2 CH 2]nH N CH 2 C OH H O [N CH 2 C ]n H O催化剂COOH + nHO CH 2 CH 2 OH 催化剂O O CH 2 CH 2 O C C]n [ O 十、裂化反应高温 高温 高温 高温 H 2SO 4浓 + HClCH 2 COOH NH 2 CH 2 COOHNH 3Cl+ NaOHCH 2 COOH NH 2CH 2 COONa + NH 2H 2O。
有机化学方程式
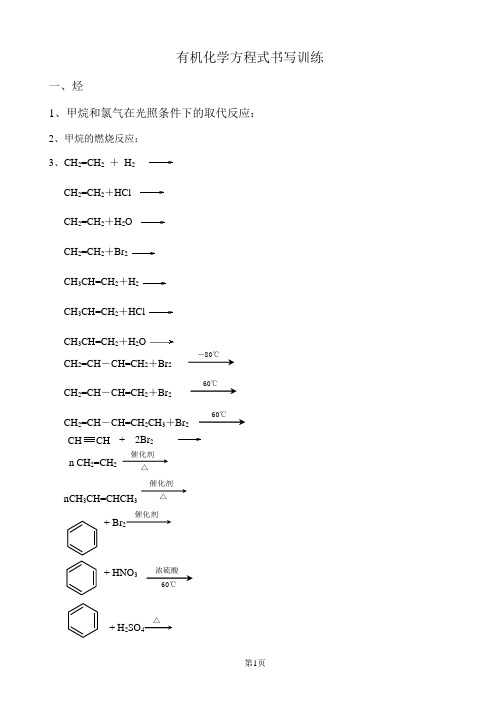
有机化学方程式书写训练一、烃1、甲烷和氯气在光照条件下的取代反应:2、甲烷的燃烧反应:3、CH 2=CH 2 + H 2CH 2=CH 2+HCl CH 2=CH 2+H 2OCH 2=CH 2+Br 2 CH 3CH=CH 2+H 2 CH 3CH=CH 2+HCl CH 3CH=CH 2+H 2OCH 2=CH -CH=CH 2+Br 2CH 2=CH -CH=CH 2+Br 2CH 2=CH -CH=CH 2CH 3+Br 2 + 2Br 2n CH 2=CH 2催化剂 △nCH 3CH=CHCH 3催化剂△+ Br 2催化剂+ HNO 3+ H 2SO 4△CH CH ―80℃60℃ 60℃浓硫酸 60℃+ CH 2=CH 2催化剂+ CH 3CH=CH 2催化剂+ 3HNO 3(写出主要有机产物)(写出主要有机产物)nCH 2=CHCl催化剂 △二、卤代烃1、溴乙烷与氢氧化钠水溶液共热: CH 3CH 2Br +2、溴丙烷与氢氧化钠水溶液共热:CH 3CH 2CH 2Br +NaOH3、2—溴丙烷与氢氧化钠水溶液共热: (CH 3)2CHBr +NaOH4、1,2—二溴乙烷与氢氧化钠水溶液共热: BrCH 2CH 2Br +2NaOH5、溴乙烷与氢氧化钠的乙醇溶液共热: CH 3CH 2Br +NaOH6、1—溴丙烷与氢氧化钠的乙醇溶液共热:CH 3CH 2CH 2Br +NaOH7、2—溴丁烷与氢氧化钠的乙醇溶液共热:加热乙醇 加热乙醇加热加热加热 浓硫酸100℃CH CH 3 CH3 KMNO4 H +2 CH 3KMNO4 H +CH 3CHBrCH 2CH 3+NaOH8、2,3—二溴丁烷与氢氧化钠的乙醇溶液共热: CH 3CHBrCHBrCH 3+2NaOH 二、乙醇与醇类1、乙醇与钠的反应:2CH 3CH 2OH +2Na2、乙二醇与钠的反应:HOCH 2CH 2OH +2Na3、乙醇与钙的反应:2CH 3CH 2OH +Ca4、乙醇与氢溴酸共热:CH 3CH 2OH +HBr5、2—丙醇与氢溴酸共热:(CH 3)2CHOH +HBr6、乙醇分子间脱水:2CH 3CH 2OH7、甲醇分子间脱水:2CH 3OH8、甲醇与乙醇分子间脱水:CH 3CH 2OH +CH 3OH9、乙醇使酸性高锰酸钾溶液褪色: 5CH 3CH 2OH +4KMnO 4+6H 2SO 45CH 3COOH +2K 2SO 4+4MnSO 4+11H 2O10、 乙醇的催化氧化:2CH 3CH 2OH +O 211、甲醇的催化氧化:2CH 3OH +O 212、乙二醇的催化氧化:HOCH 2CH 2OH +O 2 13、乙醇与浓硫酸共热170℃:CH 3CH 2OH14、丙醇与浓硫酸共热:CH 3CH 2CH 2OH15、 乙醇与乙酸和浓硫酸共热:CH 3COOH +CH 3CH 2OH16、甲醇与乙酸和浓硫酸共热:CH 3COOH +CH 3OH加热浓硫酸 加热浓硫酸170℃浓硫酸 170℃浓硫酸 加热 催化剂加热催化剂 加热催化剂140℃浓硫酸140℃浓硫酸 140℃浓硫酸加热加热加热乙醇加热乙醇17、甲酸、乙醇与浓硫酸共热:HCOOH +CH 3CH 2OH18、乙酸、2—丙醇与浓硫酸共热: CH 3COOH +(CH 3)2CHOH19 2021、乙二酸与乙二醇和浓硫酸共热: 22、3—羟基丙酸与浓硫酸共热:HOCH 2CH 2COOH+H 2O23324、1,4—丁二酸与乙二醇和浓硫酸共热:三、苯酚与酚类1、苯酚燃烧:C 6H 6O +7O 26CO 2+3H 2O2、苯酚与氢氧化钠溶液反应:C 6H 5OH +NaOH3、苯酚钠溶液中通入二氧化碳气体: C 6H 5O -+CO 2+H 2O ===C 6H 5OH +HCO 3-4、苯酚钠溶液与氯化铝溶液混合:3C 6H 5O -+Al 3++3H 2O ===3C 6H 5OH +Al(OH)3↓5、苯酚溶液中加入浓溴水: OH +3Br 2 7、苯酚在一定条件下与氢气反应:点燃 浓硫酸 加热浓硫酸 加热浓硫酸COOH COOH +2CH 3CH 2OH浓H 2SO 4加热 +2H 2O CH 2OH CH 2OH +2CH 3COOH 浓H 2SO 4加热+2H 2O CH 2OH CH 2OH COOH COOH 浓H 2SO 4加热+2H 2O nHOCH 2CH 2COOH H [ OCH 2CH 2CO ]n OH +(n -1)H 2O浓H 2SO 4加热 nHOOCCH 2CH 2COOH +nHOCH 2CH 2OH HO [OCCH 2CH 2COOH +nHOCH 2CH 2O] n H +(2n -1)H 2O 浓H 2SO 4加热—OH +3H 2 —OH8、酚醛树脂的制备:9、苯酚与乙醛的缩聚:四、乙醛与醛类1、乙醛的燃烧:2C 2H 4O +5O 24CO 2+4H 2O3、乙醛与溴水反应:CH 3CHO +Br 2+H 2O CH 3COOH +2HBr4、乙醛与银氨溶液反应: CH 3CHO +2[Ag(NH 3)2]OH5、甲醛与少量的银氨溶液反应: HCHO +2[Ag(NH 3)2]OH6、甲醛与过量的银氨溶液反应: HCHO +4[Ag(NH 3)2]OH7、乙二醛与银氨溶液反应: OHCCHO +2[Ag(NH 3)2]OHH 4NOOC —COONH 4+2H 2O +4Ag +6NH 3↑8、乙醛与新制的氢氧化铜反应:CH 3CHO +2Cu(OH)2 CH 3COOH +Cu 2O↓+2H 2O9、甲醛与少量的新制的氢氧化铜反应:HCHO +2Cu(OH)2HCOOH +Cu 2O↓+2H 2O10、甲醛与过量的新制的氢氧化铜反应:HCHO +4Cu(OH)2 CO 2↑+2Cu 2O↓+5H 2O11、乙醛与新制的氢氧化铜反应:CH 3CH 2CHO +2Cu(OH)2CH 3CH 2COOH +Cu 2O↓+2H 2O12、乙醛的催化氧化: 2CH 3CHO +O 2催化剂加热加热加热加热 加热加热 加热加热点燃 加热催化剂 OH+nHCHO 催化剂nOHCH 2+nH 2OCH 3OH+nCH 3CHO 催化剂n OHCH+nH 2O13、乙二醛的催化氧化:OHCCHO +O 214、乙醛与氢气反应:CH 3CHO +H 215、乙二醛与氢气反应:OHC —CHO +2H 2HOCH 2CH 2OH五、丙酮与酮类1、丙酮燃烧:C 3H 6O +4O 23CO 2+3H 2O2、丙酮与氢气反应:CH 3COCH 3+H 2六、乙酸与羧酸类1、乙酸与钠反应:2CH 3COOH +2Na3、乙酸与氢氧化钠反应:CH 3COOH +NaOH4、乙酸与碳酸钙反应:CH 3COOH +CaCO 35、乙酸与碳酸氢钠反应:CH 3COOH +NaHCO 36、乙酸与乙醇和浓硫酸共热: CH 3COOH +CH 3CH 2OH7、乙酸和甲醇与浓硫酸共热: CH 3COOH +CH 3OH8、乙酸与2—丙醇和浓硫酸共热: CH 3COOH +(CH 3)2CHOH9、对苯二甲酸与乙二醇的缩聚:10、1,6—己二酸与1,6—己二胺的缩聚:七、乙酸乙酯与酯类 加热浓硫酸加热浓硫酸 加热浓硫酸点燃加热催化剂 加热催化剂加热催化剂催化剂 催化剂 nHOOC — —COOH + nHOCH 2CH 2OH +(2n -1)H 2O HO —OC — —CO O CH 2CH 2O — [ ]n H nHOOC(CH 2)6COOH +nH 2N(CH 2)6NH 2 催化剂—OC(CH 2)6CONH(CH 2)6NH — +(2n -1)H 2O HO [ ]n H1、乙酸乙酯的燃烧:C 4H 8O 2+5O 24CO 2+4H 2O4、乙酸乙酯在酸性条件下的水解反应: CH 3COOCH 2CH 3+H 2O5、甲酸甲酯在酸性条件下的水解反应: HCOOCH 2CH 3+H 2O6、乙酸甲酯在酸性条件下的水解反应: CH 3COOCH 3+H 2O7、丙酸乙酯在酸性条件下的水解反应: CH 3CH 2COOCH 2CH 3+H 2O8、乙酸乙酯与氢氧化钠溶液共热: CH 3COOCH 2CH 3+NaOH9、甲酸乙酯与氢氧化钠溶液共热: HCOOCH 2CH 3+NaOH10、乙酸甲酯与氢氧化钠溶液共热:CH 3COOCH 3+NaOH11、丙酸乙酯与氢氧化钠溶液共热:CH 3CH 2COOCH 2CH 3+NaOH12、浓硫酸 △13、+ 3NaOH加热加热加热加热 加热稀硫酸加热稀硫酸 加热稀硫酸 加热稀硫酸点燃 2 CH 2 COOH CH 2CH 2OH 2 Br 水 △。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:CnH2n+2)甲烷的制取:CaO △(1)氧化反应甲烷的燃烧:点燃甲烷不成使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应 光照一氯甲烷)+HCl 光照二氯甲烷)+HCl 光照三氯甲烷)+HCl (CHCl3又叫氯仿) 光照四氯化碳)+HCl(3)分解反应甲烷分解:高温2. 乙烯(烯烃通式:CnH2n)乙烯的制取:浓硫酸170℃=CH2↑+H2O(消去反应) (1)氧化反应乙烯的燃烧:CH2=点燃乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH2=—CH2Br与氢气加成:CH2=CH2+H2催化剂CH3CH3 与氯化氢加成:CH2=CH2+HCl 催化剂CH3CH2Cl 与水加成:CH2=CH2+H2O催化剂CH3CH2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH2=CH2催化剂 [CH2—CH2 ] n 适当拓展:CH3CH =׀ Cl CH -׀ ClCH2 CH3CH =CH2+H2催化剂CH3CH2CH3 CH3CH =CH2+HCl 催化剂CH3CH2CH2Cl 或CH3׀ ClCHCH3 CH3CH =CH2+H2O 催化剂CH3CH2CH2OH 或CH3׀ OHCHCH3 nCH2=CH -CH3催化剂 [CH2—׀ CH3CH ] n(聚丙烯) 3. 乙炔(炔烃通式:CnH2n-2)乙炔的制取: CH↑+Ca(OH)2(1)氧化反应乙炔的燃烧:点燃乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CHBr =CHBr CHBr =—CHBr2 与氢气加成:HC≡CH+H2催化剂H2C =CH2与氯化氢加成:HC≡CH+HCl催化剂CH2=CHCl (3)聚合反应图2 乙烯的制取图1 甲烷的制取图3 乙炔的制取氯乙烯加聚,得到聚氯乙烯:nCH2=CHCl催化剂[CH2—׀ Cl CH ] n 乙炔加聚,得到聚乙炔:n HC≡CH催化剂 [CH =CH ] n 4. 1,3-丁二烯 与溴完全加成:CH2=CH -CH =CH2Br -CHBr -CHBr -CH2Br 与溴1,2-加成:CH2=CH -CH =CH2Br -CHBr -CH =CH2 与溴1,4-加成:CH2=CH -CH =CH2Br -CH =CH -CH2Br 5. 苯苯的同系物通式:CnH2n-6(1)氧化反应苯的燃烧:2+15O2点燃苯不克不及使溴水和酸性高锰酸钾溶液褪色。
有机化学方程式
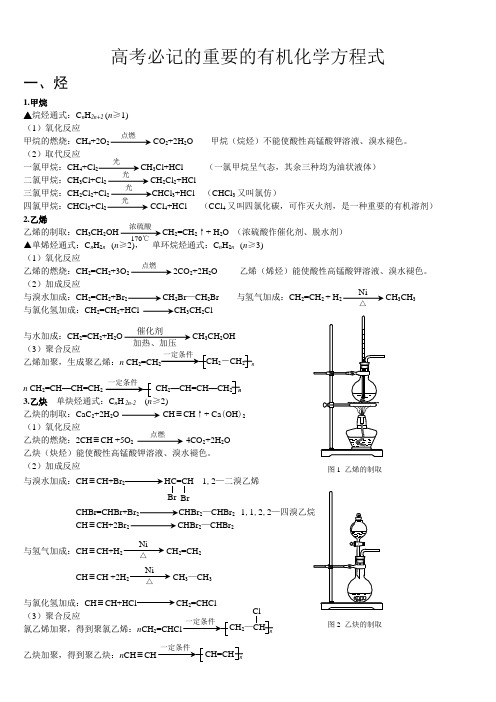
高考必记的重要的有机化学方程式一、烃1.甲烷▲烷烃通式:C n H 2n+2 (n ≥1) (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷(烷烃)不能使酸性高锰酸钾溶液、溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl (一氯甲烷呈气态,其余三种均为油状液体)二氯甲烷:CH3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯甲烷:CHCl 3+Cl 2CCl 4+HCl (CCl 4又叫四氯化碳,可作灭火剂,是一种重要的有机溶剂)2.乙烯乙烯的制取:CH3CH 2OH CH 2=CH 2↑+ H 2O (浓硫酸作催化剂、脱水剂)▲单烯烃通式:C n H 2n (n ≥2), 单环烷烃通式:C n H 2n (n ≥3) (1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 2 2CO 2+2H 2O 乙烯(烯烃)能使酸性高锰酸钾溶液、溴水褪色。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:CH 2=CH 2 + H 2 CH 3CH 3与氯化氢加成:CH 2=CH 2+HCl CH 3CH 2Cl与水加成:CH 2=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n CH 2=CH nn CH 2=CH —CH=CH CH 2—CH=CH —CH 2 n3.乙炔 n 2n-2 2)乙炔的制取:CaC 2+2H 2O CH ≡CH ↑+ Ca (OH )2(1)氧化反应乙炔的燃烧:2CH ≡CH +5O 2 4CO 2+2H 2O乙炔(炔烃)能使酸性高锰酸钾溶液、溴水褪色。
(2)加成反应 与溴水加成:CH ≡CH+Br 2 HC=CH 1,2—二溴乙烯BrCHBr=CHBr+Br 2 CHBr 2—CHBr 2 1,1,2,2CH ≡CH+2Br 2 CHBr 2—CHBr 2与氢气加成:CH ≡CH+H 2 CH 2=CH 2CH ≡CH +2H 2 CH 3—CH 3与氯化氢加成:CH ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n CH ≡ n点燃光光光光浓硫酸170℃点燃Ni△催化剂加热、加压2-CH 2点燃Br 2—CHClCH=CHNi△Ni△ 图1 乙烯的制取图2 乙炔的制取4.苯▲苯及其苯的同系物通式:C n H2n-6 (n≥6)(1)氧化反应苯的燃烧:2C6H6+15O212CO2+6H2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(完整版)有机化学反应方程式汇总

浓硫酸△ 有机物类别官能团 主要化学性质 烷烃——取代反应:CH 4+Cl 2CH 3Cl +HCl烯烃碳碳双键加成反应: CH 2=CH 2+HBr催化剂 △CH 3-CH 2Br ,(还可与Br 2、H 2O 、H 2在一定条件下发生加成反应)加聚反应:nCH 2=CH 2催化剂-[CH 2-CH 2氧化反应:使酸性KMnO 4溶液褪色(同时生成CO 2)炔烃碳碳三键同烯烃 芳香烃苯——取代反应: FeBr 3加成反应:苯的 同系物——取代反应:氧化反应:使酸性KMnO 4溶液褪色(与苯环相连的C 上有H 时统一被氧化为苯甲酸)卤代烃 —X取代反应:CH 3CH 2Br+NaOHH 2OCH 3CH 2OH+NaBr消去反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 醇—OH与活泼金属反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑取代反应:CH 3CH 2OH+HBr△CH 3CH 2Br+H 2O 消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2O氧化反应:2CH 3CH 2OH+O 2催化剂 △2CH 3CHO+2H 2O醛—CHO还原反应(加成反应):CH 3CHO+H 2催化剂 △CH 3CH 2OH氧化反应:2CH 3CHO+O 2催化剂 △2CH 3COOHCH 3CHO+2Ag(NH 3)2OH△CH 3COONH 4+2A g ↓+3NH 3+H 2OCH 3CHO+2C u (O H )2 +NaOH△CH 3COONa+Cu 2O ↓+3H 2O羧酸 —COOH 酸的通性:如CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑酯化反应:CH 3COOH+ CH 3CH 2OH 浓H 2SO 4CH 3COOCH 2CH 3+H 2O 酯—COO —水解反应:CH 3COOCH 2CH 3+H 2OCH 3COOH+ CH 3CH 2OH酚弱酸性:取代反应: 光照+HNO 3—NO 2 +H 2O浓硫酸 △OHOH + NaOH ONa + H 2O OH+3Br 2OHBrBrBr+3HBr↓ 乙醇+HBr+Br 2 Br —CH 3 +3HNO 3 CH 3NO 2O 2N NO 2+3H 2O +3H 2Ni反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr催化剂△H3C-CH2Br醇取代反应CH3CH2OH+HBr△CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O催化剂△H3C-CH2OH酯水解反应CH3COOCH3+H2O催化剂△CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应2CH3CH2OH+ 2Na 2CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH△CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2催化剂△H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2催化剂△CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O2催化剂△2CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略乙醇OH+3Br2OHBrBrBr+3HBr↓光照取代反应烷烃、苯环+3H2Ni。
有机化学反应方程式汇总

c.酯化反应时醇和酸两种原料,那种便宜那种过量
d.导管不能插入液面以下,防止倒吸
③HCOOH有醛基可以发生银镜反应
CH3COOH+NaOH CH3COONa+H2O
CH3COOH+NaHCO3 CH3COONa+H2O+CO2
2CH3COOH+Na2CO3 2CH3COONa+H2O+CO2
③油脂酸性水解或碱性水解产物都有甘油(丙三醇)CH2OH
④可以利用NaOH区分地沟油和石油
地沟油在NaOH作用下发生碱性水解生成甘油(极易溶于水)和羧酸钠(是钠盐易溶于水),所以加入NaOH后地沟油不分层,石油(以烯烃和烷烃为主不溶于水)分层
C17H35COOCH2CH2OH
C17H35COOCH+3H2O CHOH +3C17H35COOH
(-CHO)
CH3CHO+H2 CH3CH2OH
还原
有机反应中,加H或者去O叫还原,加O或者去H叫还原
2CH3CHO+5O2 4CO2+4H2O
氧化
①做银镜反应的时候,银氨溶液必须随时用随时配制,不能提前配制。②银镜反应需要用水浴加热。
③1mol—CHO生成2molAg,可以通过生成Ag的量计算—CHO数目。
H2O/H+
CH2=CH2+Br2 CH2BrCH2Br
CH2=CH2+HBr CH3CH2Br
CH2=CH2 2HCHO 2H2CO3 2CO2
氧化
使KMnO4/H+褪色
不能用KMnO4/H+除去CH2=CH2中的CH4,应该用溴水
2CH2=CH2+O2 2CH3CHO
有机化学反应方程式总结

有机化学反应方程式总结一. 取代反应1.CH4 + Cl2—1:1光照C2H6 + Cl2-1:1光照2. C6H6 + Br2—铁屑3. C2H5OH + HBr--加热4. C6H6+ HNO3--H2SO4 水浴加热7. C2H5Cl + H2O—NaOH8. CH3COOC2H5 + H2O--无机酸8. CH3COOC2H5 + H2O—碱9. (C17H35COO)3C3H5 + 3NaOH →皂化反应二. 加成反应10. CH2=CH2 + H2→Ni加热13. CH2=CH2 + HCl--催化剂,加热14. C2H2 + HCl 1:1--催化剂,加热C2H2 + 2H2-- Ni,加热16. CH2=CH-CH=CH2 + Br2 1,2加成17. CH2=CH-CH=CH2 + Br2 1,4加成18. CH2=CH-CH=CH2 + 2Br2 1,2,3,4加成19. CH3CHO + H2 –Ni20. CH2OH-(CHOH)4-CHO(葡萄糖) + H2 --Ni21. C6H6 + 3H2—Ni23. CH2=CH2 + H2O三. 消去反应24. CH3CH2OH-- 浓H2SO4 ,170℃25. CH3CH2Br + NaOH--醇,加热四. 酯化反应(亦是取代反应)26. CH3COOH + CH3CH2OH-- 浓H2SO4,加热27. C3H5(OH)3 + 3HNO3 --浓H2SO4五. 水解(卤代烃、酯、油脂的水解见上,亦是取代反应)32. CH3CH2ONa + H2O33. C6H5ONa + H2O36. 2(C6H10O5)n(淀粉) + nH2O --H2SO4,加热38. C12H22O11 (蔗糖) + H2O --H2SO439. C12H22O11(麦芽糖)+ H2O -六. 氧化反应41. 2C2H5OH + O2 --Cu或Ag43. 2CH3CHO + O2 →2CH3COOH47. CH3CHO + 2[Ag(NH3)2]OH→48. CH3CHO + 2Cu(OH)2 加热→49.CH2OH(CHOH)4CHO(葡萄糖)+2[Ag(NH3)2]OH→50.CH2OH(CHOH)4CHO+2Cu(OH)2--加热→57. HCHO + 4[Ag(NH3)2]OH →58. HCHO + 4Cu(OH)2 加热→七. 还原反应59. CH3COCH3 + H2 --Ni →60. HCHO + H2 --Ni →61. C6H5CH=CH2 + 4H2 --Ni →八. 加聚反应62. nCH2=CH2 →63. nCH3-CH=CH2 →64. nCH2=CHX →69. nCH2=CH-CH=CH2 →72. nCH2=CH2 + nCH3-CH=CH2 →九. 缩聚反应73. C6H5OH + HCHO---浓HCl,加热→74. HOOC- -COOH + HO-CH2CH2-OH →十. 其他(一)有机物跟钠的反应75. CH3CH2OH + Na76. C6H5OH + Na77. CH3COOH + Na(二)炭化78. C12H22O11 --浓H2SO4 →12C + 11H2O(三)分子间脱水79. 2C2H5OH-- 浓H2SO4,140℃(四)氨基酸的两性。
有机化学方程式总结

有机化学方程式总结-CAL-FENGHAI.-(YICAI)-Company One1高中有机化学方程式总结一、烃 1、甲烷烷烃通式:C n H 2n +2稳定性:通常状况下,烷烃很稳定,与强酸、强碱和强氧化剂都不反应。
(1)氧化反应①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O②甲烷不可使酸性高锰酸钾溶液及溴水褪色。
2222231C H O CO (1)H O 2n n n n n +++−−−→++点燃(2)取代反应:在光照条件下能与卤素单质发生取代反应。
一氯甲烷:CH 4+Cl23Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl(3)裂解反应(分解反应):烷烃在高温下可分解生成碳原子数较少的烷烃和烯烃(CH 4在高温下可分解成C 和H 2)。
1634818816C H C H C H −−−→+高温点燃光光光光2、乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O烯烃通式:C n H 2n (1)氧化反应①乙烯的燃烧:火焰明亮且伴有黑烟,生成二氧化碳和水,同时放出大量热。
24222C H 3O 2CO +2H O +−−−→点燃②乙烯可使酸性高锰酸钾溶液褪色,可以利用这个反应鉴别甲烷和乙烯。
但是乙烯会被酸性KMnO 4溶液氧化成CO 2和H 2O ,所以不能用酸性KMnO 4来除去乙烷中的乙烯。
(2)加成反应①与溴水加成:②与氢气加成:③与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl ④与水加成:(3)聚合反应①乙烯加聚,生成聚乙烯:②CH=CH 2n CH 2催化剂聚丙烯nCH 3CH 3丙烯浓硫酸170℃催化剂△3、乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH↑+Ca(OH)2(1)氧化反应①乙炔的燃烧:222222C H 5O 4CO 2H O +−−−→+点燃②乙炔可使酸性高锰酸钾溶液褪色,发生氧化反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学方程式书写
一、取代反应
1、
+ Br 2(单质)
2、 + Cl 2(单质)
3、 + HO-NO 2
4、 + Br 2(单质)
5、 +NaOH
6、+HBr
7、 + Br 2(水溶液)
8、 CH 3-OH+H-O-C 2H 二、加成反应
9、CH 2=CH 2+H-OH
10、+ Br 2(水溶液或CCl 4溶液)
11、+ Br 2(二者1:1反应)
12、+HBr (写出主要产物)
13、+HCl
14、+3H 2
OH OH CH CH
CH
Br
CH 3CH 3CH 3
CH 3
15、 +H 2(足量)
16、+ CH 2=CH 2
17、+H 2(足量)
小结:(1
)能与H 2发生加成反应官能团有:
(2)能与Br 2发生加成反应的官能团有:
三、消去反应
18、+NaOH
19、+2NaOH
20、CH
2Br-CH 2
21、
小结:消去反应能发生,在结构上的关键是:
四、氧化反应
22、+O 2
23、+O 2
24、CH 3OH+O 2
25、+O
2
小结:醇催化氧化反应能发生,在结构上的关键是:
CHO
O Br Cl Cl OH H 2C CH H 2C OH
CH 2H 3C
H 3C H 3C
OH
H 3C H 3H 3C
26、
27、 + Ag(NH 3)2OH
28、
+ Cu(OH)2 + NaOH
五、酯化反应
29、+H-O-C 2H 5 30、 (1mol ) 31、2 六元环状化合物
32、 +3 HO-NO 2
六、水解反应
33、CH 2Br-CH 2
34、+H 2O
35、
+ NaOH 36、
+ NaOH
37
、+ NaOH
C
H CHO CHO CHO H 3C C O
18OH
C C H 2
OH O O H H 3C CH H 2C HC H 2C O O H 3C O
OC 2H 5C
C H 2O
O
H 2C O C O
38、 + 3 NaOH
39
、n
40、n
41、n CH 2=CH 2
-CN + n +n
42、n
43、n HO-CH2-CH2-OH+n HOOC-COOH 44、n 45、
n + n HCHO
小结:加聚与缩聚反应在生成物上的差别是:
八、几个特殊反应
46
、+Cu(OH)2
47、+Cu(OH)2 48、6C 6H 5OH+Fe 3+
49、C 20H 42
CH H 3C CH OH
OH H 2C OH H 2C OH H 2C OH HC OH
H 2C OH O C H 2CH C H 2
C O C 17H 35O C O C 17H 35O C O
C 17H 35
九、有机物衍变的一般规律(通常以卤代烃为桥
烃 卤代烃 醇
醛
酸
CH 3-CH 3CH 3-CH CH 3CH CH 3CHO CH 3COOH 酯
CH 2=CH
酯
22CH 2Cl CH 3CH 2OH COOH
CH 3Br CH 3Br CH 3OH CH 3
O。
