酶活性及酪氨酸酶..
酪氨酸酶

酪氨酸酶概念:酪氨酸酶(EC 1.14.18.1)是一种含铜的氧化还原酶,它与生物体合成色素直接相关.(长的黑有很大的一部分原因在自己)在人体中,它与色素障碍性疾病及恶性黑色素肿瘤的发生与治疗有关(酪氨酸酶的分布与动物的生理功能息息相关,不同动物的酪氨酸酶在体内分布的部位不同.多数昆虫在正常生理状态下,酪氨酸酶以酶原的形式存在,不同类型的酪氨酸酶存在于昆虫的特定部位,以完成特定的生理功能.美洲蜚蠊存在于血红细胞内,而麻蝇则仅存在于血浆中,并且在表皮中主要以活化形式的酪氨酸酶存在.昆虫酪氨酸酶除参与黑色素的形成外还是唯一参与角质硬化的酶.昆虫高度硬化的角质能阻断微生物和异物的入侵,并为柔软的元脊椎动物身体提供了保护.在节肢动物中,酪氨酸酶还参与其他两种重要的生理过程——防御反应和伤口愈合.哺乳动物酪氨酸酶催化产生的黑色素被分泌进入到表皮和毛发的角质细胞中,使体表着色,从而起保护皮肤和眼睛、抵御紫外线的辐射和防止内部组织过热等作用.哺乳动物酪氨酸酶常见于黑素细胞中,黑素细胞是存在于皮肤,发囊和眼睛中并产生色素的高度特异性的细胞[1“].酪氨酸酶功能减退或缺失时,即会影响黑色素代谢,从而发生疾病如白癫疯和白化病.动物与人的常染色体隐性疾病也与酪氨酸酶的缺失或活性下降有关.)作用机制:酪氨酸酶主要参与两个反应过程:催化L.酪氨酸羟基化转变为L-多巴和氧化L-多巴形成多巴醌,多巴醌经一系列反应后,形成黑色素,与人体雀斑、褐斑等黑色素过度沉积等疾病的发生有关,并与昆虫的蜕皮(蝉蜕可以入药)和(苹果)果蔬的褐化有很大关系(黑色素生物合成过程可大体分为两个阶段,第一阶段是由酪氨酸酶催化酪氨酸被羟化反应形成L_3,4一二羟基丙氨酸(L_多巴)(单酚酶活性),并进步将L_多巴氧化生成多巴醌(二酚酶活性)。
这两步反应都是由酪氨酸酶催化的,酪氨酸酶在这里显示了独特的双重催化功能.第二阶段从多巴醌(DOPAqui—non)为原料从两个不同途径分别生成真黑素和褪黑素的过程.真黑素生成,多巴醌经多聚化反应等一系列反应生成无色多巴色素,极不稳定的无色多巴色素被另一分子多巴醌氧化为多巴色素,多巴色素经异构、脱羧生成5,6一二羟基吲哚(DHI),5,6一二羟基吲哚(DHI)由酪氨酸酶催化氧化为真黑色素的前体吲哚一5,6一醌(IndQu);褪黑素生成,多巴醌(DOPAquinon)与半胱氨酸(Cys)反应生成产生5-Cys一多巴及5-Cys一多巴醌,然后成环、脱羧变成苯肼噻嗪的衍生物,最后形成褪黑素.在第二阶段,只有少数几步反应由酪氨酸酶、异构酶或金属离子催化,大部分反应都是自发的,因此酪氨酸酶是整个黑色素生成反应的限速酶,第一阶段的两步反应是限速步骤.)活性中心:酪氨酸酶的活性中心是由两个含铜离子位点构成.在催化过程中,双核铜离子位点以3种形态存在,分别是氧化态、还原态和脱氧态.研究表明与酪氨酸酶结合的双核铜离子活性中心与在血蓝蛋白中发现的活性中心非常相似、白化病概念:白化病是由黑色素合成相关基因突变导致黑色素沉着减少或缺失引起的一类遗传性疾病的总称。
蛋白酪氨酸激酶 酪氨酸酶

蛋白酪氨酸激酶酪氨酸酶蛋白酪氨酸激酶和酪氨酸酶是两类重要的蛋白质调节因子,它们在细胞的信号转导过程中扮演着重要的角色。
本文将对这两类蛋白质的结构、功能以及其在生理和病理过程中的作用进行探讨。
一、蛋白酪氨酸激酶蛋白酪氨酸激酶(protein tyrosine kinase,PTK)是一类主要负责磷酸化酪氨酸残基的酶。
它们是一种膜相关或可逆性质的酵素,在多个细胞信号转导通路中发挥着重要的调节作用。
1. 结构特征蛋白酪氨酸激酶有多种结构,基本上都是由膜结合域、负载域、催化域以及调控结构域组成。
其中催化域是最重要的结构,它由300个氨基酸缀合而成,具有保守的核心酶活性结构。
2. 功能特征蛋白酪氨酸激酶的功能主要是磷酸化酪氨酸残基,并发挥调节作用,从而影响多个细胞信号转导通路。
如PTK 参与调节细胞增殖、分化、凋亡、分泌等生理调节过程。
3. 生理和病理作用蛋白酪氨酸激酶在细胞增殖、分化等生理过程中具有积极的作用,但当PTK在恶性肿瘤等病理过程中异常激活时,就会诱导癌细胞生长、分化,从而促进肿瘤的发展。
此外,一些致病性细菌和病毒也能通过干扰PTK活性来引起脱落的细胞增殖、炎症反应的激活等。
二、酪氨酸酶酪氨酸酶(Tyrosine phosphatase,PTP)是一类可以选择性地去磷酸化酪氨酸残基的酶类,主要通过神经系统的信号转导链路来调控细胞内的生物过程。
1. 结构特征酪氨酸酶结构由几个反应中具有活性的序列域组成,包括催化域(Cys-X(5)-Arg或Cys-X(3)-Cys)和配体结合域。
其中催化域的含硫的半胱氨酸(Cys)残基与底物酪氨酸残基反应,从而实现去除底物酪氨酸残基上的磷酸基团。
2. 功能特征酪氨酸酶的主要功能是去除酪氨酸残基上的磷酸基团,并对多个细胞信号转导通路的调节发挥重要作用。
3. 生理和病理作用酪氨酸酶可以对与不同类型的细胞信号转导相关的酪氨酸激酶降解。
在有些肿瘤细胞中,酪氨酸酶的表达水平降低,从而不能去除酪氨酸酶相关的活性激酶上的磷酸基团,导致磷酸化的酪氨酸激酶异常激活,从而引起了癌症的发生、发展。
酪氨酸酶活性的抑制研究及皮肤美白化妆品的研制

究 制
o n H
肿
Hale Waihona Puke ∞Do pa Do pa qu non i e
— 一 —— ’
l
、l
l
[
收 稿 f期 :0 2—0 j 20 4—1 0
作 者简介 : 自强 ( 9 5一) 男 , 建惠 安人 , 王 16 , 福 工程 师 , 长期 从事 香料 、 香精 、 化妆 品 的研制工 作 。
酶 茔 每 芭 大
摘 要 :研 究探 讨 了皮 肤 黑 色素 的 成 因 和 皮 肤 美 白机 理 。 通 过 测 定 常 用 的 6种 生 物 美 白剂 对 酪 氨 酸 酶 活 性 的抑 制 率 ,初 步 建 立 美 白剂 效 果 的评 价 体 系 , 实验 还 表 明 自制 中草 药 萃 取 物 美 白 效 果 明 显 ,抑 制 率 可 达 9 % 。 同时 , 开 发 了 3种 美 白、 祛 斑 、 防 晒 等 功 能 的 化 妆 品 , 市场 潜 力 5
的 妆^ IJ-, I | c t = =
此 ,近 些 年 皮 肤 美 白类 化 妆 品 市 场 的 开 发 日趋 重 视 ,无 论 是 日常 家 庭 用 还 是 专 业 美 容 店 用 ,美
白化 妆 品 已 成 为 护 肤 类 化 妆 品 的 主 流 品 种 之 一 ,尽 管 其 价 格 不 菲 ,但 所 占 的 市 场 份 额 越 来 越
维普资讯
・
2・
福
建
轻 纺
・ 0 2・ 20
皮 肤 黑 色 素 细 胞 组 织 将 黑 色 素 转 移 到 表 皮 基 底 层 细 胞 中 ,随 着 细 胞 的 新 陈 代 谢 而 被 带 到 角
酶的种类,活性及影响因素

【摘要】:酶广泛存在与生物体中,对生命的生化反应至关重要
,本实验主要探究不同浓度下催化活性的不同,以及温度,pH值,抑 制剂对于酶活性的影响。
【关键词】:酪氨酸酶,唾液淀粉酶,活性,pH,温度
,抑制剂
【酶的特性综述】
酶是一种具有生物活性的蛋白质,有单纯酶和结合酶 两种。单纯酶只含蛋白质,不含其它物质,其催化活性 仅由蛋白质的结构决定。结合酶则由单纯蛋白质和辅基 组成,辅基是结合酶催化活性中不可缺少的部分。 (1)酶的催化效力远远超过化学催化剂(高108~109倍)。 (2)酶催化剂具有高效化学选择性,能从混合物中选择特 定异构体进行催化反应。 (3)酶催化剂对反应条件要求苛刻,如pH值、温度都各有 特定的界限,超出界限即可引起酶蛋白的变性与分解。
根据实验数据所画图及求出的活度来看,分别加入0.1ml、0.2ml、0.3ml、 0.4ml的活性是不一样,按照实验推测,应该是逐渐上升的,但是从实验结果 反应的情况上来看,并不是如此,而是上升之后下降,原因在于酶提取液提 取之后保存方法不得当,并没有冰浴,所以导致酶失活,从而导致活性下降 的情况
酶活性影响因素的研究
结论
(1)酶是一种活性蛋白质,因此,一切对蛋白质有影响的因 素都影响酶的活性。酶与底物作用的活性,受温度、pH值、 酶液浓度、底物浓度、酶的激活剂或抑制剂等许多因素的影 响。 (2)提取物在放置过程中变黑,是由于他们的组织中都含酪 氨酸和酪氨酸酶,酶存在于组织内部,当内部物质暴露于空 气中,在氧的参与下将发生反应,生成黑色素。 (3)酶的催化作用,只有在一定温度下才能体现出来。酶在 低温下活性暂时被抑制,高温时会永久失活。
酪氨酸酶简介
酪氨酸酶的催化作用

酪氨酸酶的催化作用[原理]酪氨酸酶是一种以铜为辅基的结合蛋白酶,这种氧化酶可直接作用于底物多巴生成多巴醌,然后经过一系列的反应,最终生成黑色素。
在多巴转变为多巴醌的反应中,酪氨酸酶使多巴中的氢原子的两个电子传递给分子氧,使后者转变为氧离子,游离在溶液中的两个质子与氧离子化合生成水。
其催化的主要反应及电子传递过程如下:酪氨酸是甲状腺素、肾上腺素和黑色素的前体。
人类皮肤、毛发和眼睛虹膜的黑色素是酪氨酸在酪氨酸羟化酶催化作用下生成了3,4-二羟苯丙氨酸(简称多巴,DOPA ),后者在酪氨酸酶的作用下生成多巴醌,而后经过一系列中间反应,最后聚合成黑色素。
白化病(albunism )是一种表现为皮肤、毛发和虹膜变白,因为缺乏酪氨酸酶而不能合成黑色素的先天性代谢缺陷性疾病。
酪氨酸酶也广泛分布于植物界,例如新鲜蘑菇、马铃薯(外层含量尤多)和谷物等。
[试剂]1.酪氨酸溶液 0.1g 酪氨酸溶于100ml 0.1%碳酸钠溶液中。
2.马铃薯抽提液 切碎马铃薯约6g 置于研钵中,加少量净砂,研成匀浆,再加蒸馏水l0ml 充分研磨;最后通过棉花过滤,即可获得含有酪氨酸酶的马铃薯抽提液。
3.煮沸过的马铃薯滤液 取2ml 试剂2于试管内,在酒精灯上加热至沸以破坏酶的活性。
4.液体石蜡[主要器材]研钵、恒温水浴箱CHCOOH NH 2 酪氨酸 2[操作步骤]取试管3支按表10进行操作表10试剂(滴) 1 2 3煮沸过的马铃薯液20 ——马铃薯抽提液—20 20酪氨酸液20 20 20充分混匀各管液体石蜡—— 5置35℃~40℃水浴约30分钟,观察并记录各管颜色,试解释所得的结果。
[注意事项]1.煮沸马铃薯液时,小心勿使液体溅出。
2.加液体石蜡时宜斜执试管,沿管壁缓缓加入,不要产生气泡;加入的液体石蜡必需完全覆盖液面,以隔绝空气。
酪氨酸酶的作用与功效

酪氨酸酶的作用与功效
酪氨酸酶是一种在生物体内具有重要作用的酶类。
它主要参与酪氨酸的代谢过程,具有以下的作用和功效:
1. 酪氨酸降解:酪氨酸酶能够将酪氨酸分解为苯丙氨酸和酪胺。
这个过程是在肠道中发生的,酪氨酸酶的活性对于保持正常的消化系统功能至关重要。
2. 蛋白质合成:酪氨酸酶在蛋白质的合成过程中扮演重要角色。
它能够促进氨基酸的连接,使得多肽链能够正确地形成。
3. 神经递质合成:酪氨酸酶还参与神经递质的合成过程。
例如,它是产生多巴胺和肾上腺素的关键酶之一。
这些神经递质在中枢神经系统中起着重要的调节作用。
4. 免疫系统调节:酪氨酸酶也被发现与免疫系统的调节有关。
它可以影响免疫细胞的活性和功能,从而影响机体的免疫反应。
5. 治疗酪氨酸相关疾病:一些酪氨酸相关疾病,如苯丙酮尿症,是由于体内酪氨酸酶的缺乏或功能异常导致的。
因此,通过补充酪氨酸酶或调节其活性,可以治疗或改善这些疾病的症状。
总结起来,酪氨酸酶在酪氨酸的代谢、蛋白质合成、神经递质合成和免疫系统调节等方面发挥重要作用。
进一步研究酪氨酸酶的功能与机制,有助于了解其在生物体内的生理调节过程,并为相关疾病的治疗提供新的思路和方法。
酪氨酸酶的粗提取,分离纯化、纯度鉴定及活性测定

课程:实验日期:2012年月日专业班级:组别交报告日期:2102年月日姓名:学号报告退发:(订正、重做)同组者:教师审批签字:实验名称:酪氨酸酶的粗提取、分离纯化、纯度鉴定及活性测定实验目的:1.自行查阅资料,选取原材料,设计合理的酪氨酸酶提取、分离、纯化鉴定以及活性测定的方案;2.按照实验方案,自主进行实验并对实验方案进行评价和改进;3.通过酪氨酸酶的分离过程,了解并熟悉生物工程下游分离工程的一些常规操作;4.对实验结果进行总结,分析和汇总展示,培养分析问题和自我展示的能力。
实验原理:酪氨酸酶是一种含铜的氧化还原酶,广泛存在于动植物和微生物体内。
与生物体黑色素的合成直接相关。
近年来,有学者已经从各种植物中提取得到酪氨酸酶,如马铃薯,蘑菇,香蕉,苹果,桑叶以及香樟等。
相关资料显示,L-多巴和邻苯二酚测定体系都说明香蕉,马铃薯及蘑菇中酪氨酸酶的活性较高。
因此,本实验选取香蕉为实验原材料,通过简单的提取分离以及纯化,初步得到了酪氨酸酶的样品(溶液),并用邻苯二酚为底物对其活性做了定性鉴定。
酪氨酸酶的粗提取包括研磨(匀浆),过滤,离心,盐析和透析等过程。
盐析蛋白质在高离子强度的溶液中溶解度降低、发生沉淀的现象。
随着溶液中离子强度的增大,蛋白质表面的双电层厚度降低,静电排斥作用减弱。
同时由于盐的水化作用使蛋白质表面的疏水区附近的水化层脱离蛋白质,暴露出来,增大了蛋白质表面的疏水相互作用,容易发生凝集,进而沉淀。
盐析的方法有K s盐析法和β盐析法,前者是改变体系的离子强度,而后者的则通过改变温度和pH实现。
由于蛋白质对离子强度的变化十分敏感,所以常采用K s盐析法。
常用的盐有硫酸铵等。
通过查阅资料,本实验中采用饱和度为55%的硫酸铵进行酪氨酸酶的盐析沉淀。
透析是一种膜分离的方法,利用的是浓度引起的自由扩散,在透析袋内盛放盐析后酪氨酸酶的溶解液,放入缓冲液内透析,目的是除去盐析过程带入的离子。
透析袋在使用前一般需要进行预处理。
酪氨酸酶

酪氨酸酶(EC 1.14.18.1,Tyrosinase)是一种含铜的金属酶,广泛分布于微生物、动植物及人体中[1]. 在植物中,酪氨酸酶一般称为多酚氧化酶;在昆虫中,则称为酚氧化酶;在微生物和人体中,才称为酪氨酸酶.酪氨酸酶主要参与两个反应过程:催化L-酪氨酸羟基化转变为L-多巴和氧化L-多巴形成多巴醌,多巴醌经一系列反应后,形成黑色素.酪氨酸酶在生物体中具有重要的生理功能.同时,它也与人体雀斑、褐斑等黑色素过度沉积等疾病的发生有关,并与昆虫的蜕皮和果蔬的褐化有很大关系[2].自从发现了人黑色素细胞可以以L-3,4-二羟基丙氨酸(L-多巴)为底物合成黑色素,这个反应成为酪氨酸酶活性和定位检测的基础.在之后的研究中,酪氨酸酶成为第一个用亲和色谱纯化的酶,酪氨酸酶也是最早发现能将酶分子内部氧原子参入到有机物中的酶;并为酶自杀性失活提供了早期实例.现今,人们已经从微生物、植物及多种动物中提取并纯化了酪氨酸酶.目前,对酪氨酸酶的研究主要集中在酶的分离纯化、催化机制、活性调控以及酪氨酸酶基因及其在生物体内的生理作用等方面,在结构方面,其三维结构仍未得到.鉴于此,对编码酪氨酸酶基因的结构、表达及其调控,酪氨酸酶的合成和运输的研究也在不断发展.酪氨酸酶的理化性质高等脊椎动物、低等脊椎动物和原核生物的酪氨酸酶的理化性质不同.由表1可以看到,从Strepto- myces antibioticus的272个氨基酸到Homo sapiens的529个氨基酸,不同生物中的酪氨酸酶氨基酸数目差异很大.虽然它们在生物体内具有相似的生理功能,但它们的理化性质却有不同程度的差异性.酪氨酸酶在同工酶的研究也占有非常重要的地位,是生物体内具有同工酶的一大类酶.据研究,哺乳动物、原核动物、真菌的酪氨酸酶一般为单聚体或二聚体;而昆虫、两栖类的酪氨酸酶一般为二聚体、四聚体或五聚体等多聚体.3 酪氨酸酶的活性中心结构酪氨酸酶的活性中心是由两个含铜离子位点构成.在催化过程中,双核铜离子位点以3种形态存在,分别是氧化态(Eoxy)、还原态(Emet)和脱氧态(Edeoxy). 研究表明与酪氨酸酶结合的双核铜离子活性中心与在血蓝蛋白中发现的活性中心非常相似[16,17].由X射线吸收光谱(XANES, X-Ray Absorption Near Edge Structure)分析,酪氨酸酶和血蓝蛋白含铜活性中心主要的构象变化基本相同,铜离子位点的几何构型是可变的.血蓝蛋白氧化态结晶学和延伸X射线吸收结构光谱(EXAFS, Edge X-ray Absorption Fine Struc-ture)的研究结果表明[18],Cu-Cu键长约为0.35 nm,每个二价铜离子构型为正四棱锥状,受到两个强的赤道面配位原子的调控和一个相对较弱的轴向NHis配基的调控,形成5个配位键(结构可见图1).其电子构象为3d9.即与蛋白上的组氨酸残基上的氮原子形成3个配位键,外源氧分子作为过氧化物与铜离子形成两个配位键占据了铜离子的两个赤道面位置,并可作为两个铜离子之间的桥联配体.所以Eoxy活性中心可以写成Cu(I) -O2-Cu(I),但通常更适合用过氧化态Cu(II) -O2-Cu(II)表示[16].过氧化物的电子结构对于Eoxy的生物功能很重要.由于受强的R*受体作用,过氧化物带有较少的负电荷,而P电子受体与过氧化物的R*轨道上的电子作用,大大的削弱了氧氧键,使图1 酪氨酸酶活性中心的双核铜中心结构Fig.1 The structure of the active center containing Cu of ty- rosinase之容易断裂.酪氨酸酶被认为是血蓝蛋白的祖先蛋白,因为酪氨酸酶在非常原始的生物体中也有发现.Eoxy的结构比血蓝蛋白的结构更紊乱,因此酪氨酸酶相对于血蓝蛋白存在更多构象不同的底物与其活性中心结合.还原态酪氨酸酶与氧-铜离子态的酶相似,都含有两个四角形的反磁铜离子,不同的是,桥联配体是氢氧化物而不是过氧化物.每个亚铜离子电子构象为3d10,分别与两个吲哚上的氮原子形成两个键长为0.19 nm的配位键,与第三个吲哚上的氮原子形成键长为0.27nm的配位键,环绕Cu-Cu轴形成近似C3V的对称结构.当加入过氧化物,酶从Emet变为Eoxy;当缺少过氧化物时,酶由Eoxy变为Emet.纯化后得到的酶是由\85%的Emet和[15%的Eoxy组成的混合物.半亚铜离子态酪氨酸酶含有一个2价铜离子和一个1价铜离子.2价铜离子含有未配对的电子,由电子顺磁共振分析,未配对的电子占据一个dx2 -y2轨道.根#732#厦门大学学报(自然科学版) 2006年据两个铜离子之间电子离域的电子顺磁共振和可见光谱特征,证明在两个铜离子之间同样有桥连配体的存在.通过对铜离子态血蓝蛋白的研究表明:Edeoxy的活性中心由两个一价铜离子组成.1938年Kubowitz证明了这种酶形态的存在.图2 酪氨酸酶催化生成黑色素过程Fig.2 The process of the melanin biosynthesis catalyzed by tyrosinase。
酪氨酸酶高考知识点

酪氨酸酶高考知识点高考是每个学生进入大学的关键时刻,对于理科生而言,化学是其中一个必考科目。
在化学中,酪氨酸酶是高考中的一个重要知识点。
在本文中,我们将深入探讨酪氨酸酶的相关概念、作用和应用。
一、酪氨酸酶的概念和结构酪氨酸酶是一种氧化酶,它的作用是催化酚类化合物的氧化反应。
酪氨酸酶的结构主要由两个亚基组成:α亚基和β亚基。
其中,α亚基是酶的催化部位,而β亚基则负责酶的稳定性和催化效率。
二、酪氨酸酶的作用机制酪氨酸酶的催化作用主要通过四个步骤来完成。
首先,酪氨酸通过与酶的α亚基形成氢键作用,进而定位于酶的活性中心。
接下来,在酶的活性中心中,氧分子结合到酪氨酸的羟基上,形成酚的过渡态。
然后,酚的过渡态通过质子转移反应形成氧化酚。
最后,在酶的反应活性中心中,氧化酚与β亚基形成氢键作用,从而释放产物。
三、酪氨酸酶的应用酪氨酸酶在生物医学领域有着广泛的应用。
首先,酪氨酸酶可以用于检测乳制品中的酪氨酸含量。
通过测量酪氨酸酶催化反应的速率,可以推测出乳制品的质量和纯度。
其次,酪氨酸酶在生化研究中被广泛用于分析和测定蛋白质的含量。
通过测量蛋白质样品与酪氨酸酶的反应速率,可以获得蛋白质的相对含量。
此外,酪氨酸酶还可以用于生物防治和酶工程等领域。
四、酪氨酸酶与健康酪氨酸酶在人体中也起着重要的作用。
例如,酪氨酸酶可以催化酪氨酸的氧化反应,从而产生酚类物质。
这些酚类物质对人体具有抗菌、抗炎和抗氧化等多种保健作用。
此外,酪氨酸酶还参与体内代谢过程,维持身体健康平衡。
综上所述,酪氨酸酶是高考化学中的一个重要知识点。
通过了解酪氨酸酶的概念、结构、作用和应用,可以帮助学生更好地掌握相关知识,为高考化学科目的备考打下坚实的基础。
同时,了解酪氨酸酶在生物医学领域的应用和与健康的关系,也有助于学生对这一知识点的兴趣和理解。
因此,在复习化学知识的过程中,学生们应该重点关注酪氨酸酶这一重要的高考知识点。
酪氨酸酶提取及活性研究

荧光光谱法
总结词
荧光光谱法是一种利用荧光物质与酪氨酸酶相互作用产生的荧光信号变化来研究酶活性 的方法。
详细描述
荧光光谱法通过测量荧光信号的强度和波长变化,可以分析荧光物质与酪氨酸酶的结合 情况以及酶的催化过程。该方法具有高灵敏度和选择性,适用于生物体系中的酪氨酸酶
活性研究。
紫外可见光谱法
总结词
紫外可见光谱法是通过测定酪氨酸酶在紫外可见光区的吸收光谱来研究酶活性的方法。
有机溶剂萃取法
• 有机溶剂萃取法:利用有机溶剂将目标物质从水相中萃取 出来。常用乙醚、氯仿等。
离子交换法
• 离子交换法:利用离子交换剂将目标物质与溶液中的其他离子进行交换,从而实现分离。常用DEAE-纤维素 、CM-纤维素等。
$item2_c{单击此处添加正文,文字是您思想的提炼,为了最终呈现发布的良好效果单击此处添加正文单击此处 添加正文,文字是您思想的提炼,为了最终呈现发布的良好效果单击此处添加正文单击此处添加正文,文字是 一二三四五六七八九十一二三四五六七八九十一二三四五六七八九十一二三四五六七八九十一二三四五六七八 九十单击此处添加正文单击此处添加正文,文字是您思想的提炼,为了最终呈现发布的良好效果单击此处添加 正文单击此处添加正文,文字是您思想的提炼,为了最终呈现发布的良好效果单击此处添加正文单击5*48}
药物研发
基于酪氨酸酶的催化机制,开发具有治疗作 用的新型药物或药物前体。
生物工程
利用酪氨酸酶在酶工程领域进行蛋白质改造 和优化,提高酶的催化效率和稳定性。
感谢您的观看
THAபைடு நூலகம்KS
在食品工业领域的应用
• 酪氨酸酶在食品工业中主要用于生产 食品添加剂和调味品。例如,它可以 催化产生茶多酚和咖啡色素等天然色 素,为食品提供丰富的色泽。此外, 酪氨酸酶还可用于生产香精和调味剂, 提高食品的口感和风味。
酪氨酸酶的提取及其催化活性研究

酪氨酸特性及其影响因素摘要:酶是由生物细胞合成的、对特定底物起高效催化作用的蛋白质,是生物催化剂。
生物体内所有的化学反应几乎都是在酶的催化作用下进行的。
只要有生命活动的地方就有酶的作用,生命不能离开酶的存在。
在酶的催化下,机体内物质的新陈代谢有条不紊地进行着;同时又在许多因素的影响下,酶对代谢发挥着巧妙的调节作用。
生物体的许多疾病与酶的异常密切相关;许多药物也可通过对酶的作用来达到治疗的目的。
随着酶学研究的深入,必将对人类社会产生深远影响和做出巨大贡献。
Summary: The enzyme is high efficiency catalyst on a specific substrate protein synthesis by biological cells is the biological catalyst. Chemical reactions in all organisms is almost in the under the catalysis of enzyme. As long as there is life there is the function of enzyme the enzyme in the presence of life can not leave. In the enzyme catalytic machine body material the new supersedes the old. With everything in good order and well arranged; and at the same time, the influence of many factors under the regulation of enzyme plays cleverly on metabolism. Many diseases and enzyme of organisms are closely related; many drugs can also be based on the role of the enzyme to achieve the purpose of treatment. With the in-depth study of bound enzyme have a far-reaching impact on human society and make great contributions to. 关键词:酶催化活性影响因素正文引言:酶是具有催化作用的蛋白质。
酪氨酸酶的种类及分布
当加入过氧化物,酶 从Emet 变为Eoxy ; 当缺少过氧 化物时,酶由Eoxy 变 为Emet . 纯化后得 到的酶是由≥ 85 %的Emet 和≤15 %的Eoxy组成的混 合物.
5
酪氨酸酶是黑色素合成的关键酶
6
酪氨酸酶在生物色素形成中的作用 THIS IS AN EXAMPLE TEXT
2
酪氨酸酶的分布与动物的生理功能息息相关,不同动物的酪氨酸酶在体内分布的部位 不同. 昆虫 在正常生理状态下,酪氨酸酶以酶原的形式存在,不同 类型的酪氨酸酶存在于昆虫的特定部位,以完成特定 的生理功能
哺乳动物 哺乳动物酪氨酸酶催化产生的黑色素被分泌进入 到表皮和毛发的角质细胞中,使体表着色,从而起保护 皮肤和眼睛、抵御紫外线的辐射和防止内部组织过热 等作用.
二、肉类 少吃牛肉、羊肉、猪肉、 内脏、鸡肉、火鸡肉、鸭肉。 因 为这些食物含有丰富的两种氨基酸: 酪胺酸及苯丙胺酸,这两种氨基酸, 是形成黑色素的主要营养素,不要吃 过量,否则黑色素的制造原料一多, 就容易使皮肤变黑,所以海鲜类是比 较安全的食物。
三、柠檬、芹菜、胡萝卜、九层塔、橙类水果等等 这些食材含有光敏感的物质,如果没有清洗干净残 留在手上,照射到阳光时会导致皮肤发红过敏,还 会留下色素沉淀呢。临床上常遇到挤柠檬汁,结果 弄得满手黑黑的人,就是因为挤了柠檬,事后没有 把手洗干净又照射到阳光造成的。
酪氨酸酶 ——浅谈皮肤变黑、美白、护肤
安阳 化二
一、酪氨酸酶的种类及 分布
二、酪氨酸酶的活性中心 结构
三、 酪氨酸酶在生物色 素形成中的作用
酪氨酸酶的种类及分布
酪氨酸酶( Tyrosinase) 是一种含 铜的金属酶,广泛分布于微生物、动植物及人体 中,但酪氨酸酶蛋白的立体结构尚不清楚。在植 物中,酪氨酸酶一般称为多酚氧化酶;在昆虫中, 则称为酚氧化酶;在微生物和人体中,才称为酪氨 酸酶.
酪氨酸酶溶液的制备

酪氨酸酶溶液的制备
酪氨酸酶是一种能够水解酪氨酸及其衍生物的酶类物质,广泛应用于食品、医药、化学等领域。
本文将介绍酪氨酸酶溶液的制备方法。
一、实验仪器和材料
1.分散酪蛋白
2.75mmol/L的Tris-HCl缓冲液(PH7.0)
3.酪氨酸酶
4.活化剂
5.浓盐酸
6.氨水
7.异丙醇
8.离心管
9.定量管
二、实验步骤
1.酶活性的检测
首先,要对酪氨酸酶的活性进行检测,以保证制备出的酶溶液具有一定的水解能力。
方法如下:
(1)取适量的分散酪蛋白放入离心管中,加入适量的75mmol/L的Tris-HCl缓冲液,振荡均匀后,将其加温至37℃。
(2)向管内加入一定量的酪氨酸酶和一定量的活化剂,混匀后再次放置于37℃下反应。
(3)反应一定时间后取出样品,加入50%的异丙醇,离心沉淀。
离心上清取出,并进行紫外吸收光度计检测。
(2)缓慢加入浓盐酸或氨水,调节溶液的PH值至适宜范围。
(3)反复冷水浴加温,使反应液温度达到37℃,继续搅拌,使酶能够快速发挥作用。
(4)反应一定时间后,离心样品,并留取上清液即为酶溶液。
三、实验注意事项
1.最好将酶制备在无菌条件下进行。
2.Tris-HCl缓冲液的浓度和PH值应先进行调节,确保溶液稳定性。
3.调节PH值时应缓慢加入酸碱,注意避免过度调节。
4.反应温度过高或时间过久会影响酶的活性。
5.制备好的酶溶液需要在低温下保存,避免酶的降解。
酶活性及酪氨酸酶

酶催化活性及其影响因素的研究学院:化学与分子工程学院班级:应用化学108班姓名:王文移05 宁家彬06****:***酶催化活性及影响其活性因素的研究作者:王文移 宁家彬[摘要]:酶广泛存在与生物体中,对生命的生化反应至关重要,本实验主要探究不同浓度下催化活性的不同,以及温度,pH 值,抑制剂对于酶活性的影响。
[关键词]:酪氨酸酶,唾液淀粉酶,活性,pH ,温度,抑制剂Enzyme is widespread and in living organisms, biochemical reactions vital to life, this experiment mainly explore different catalytic activity of differentconcentrations, as well as temperature, pH value, effect of inhibitor for the enzyme activity.[引言]认识生物体中酶的存在和催化作用,了解生物体系中在酶存在下的合成或分解与普通的有机合成的不同和相同之处,认识一些生物化学过程的特殊性,是当今对酶的研究不可或缺的话题。
通过本次实验能够掌握生物活性物质的提取和保存方法,学会使用仪器分析手段研究催化反应特别是生物化学体系中催化过程的基本思想和方法。
酪氨酸酶是一种氧化还原酶,它广泛存在于动植物和微生物中。
土豆的提取液中含有酪氨酸酶。
人唾液中的淀粉酶为a-淀粉酶,在唾液腺细胞内合成。
酶的活性会受到很多因素的影响,如温度、PH 值、底物浓度以及激活剂抑制剂的影响。
本实验目的在于测定各个因素对于酶活性的影响。
1.实验原理本实验采用唾液淀粉酶及酪氨酸酶来进行反应,主要观察淀粉与试剂的反应颜色,多巴的吸光度。
本实验从土豆中提取酪氨酸酶,并测定其催化活性。
当土豆、苹果、香焦等的受损面接触空气后会产生深棕色的现象是人们都见过的,这是这类物质含有酪氨酸和酪氨酸酶,酶存在于物质内部,当暴露在空气中后,在氧气的参与下,会发生一系列反应。
酪氨酸酶活性抑制实验方法
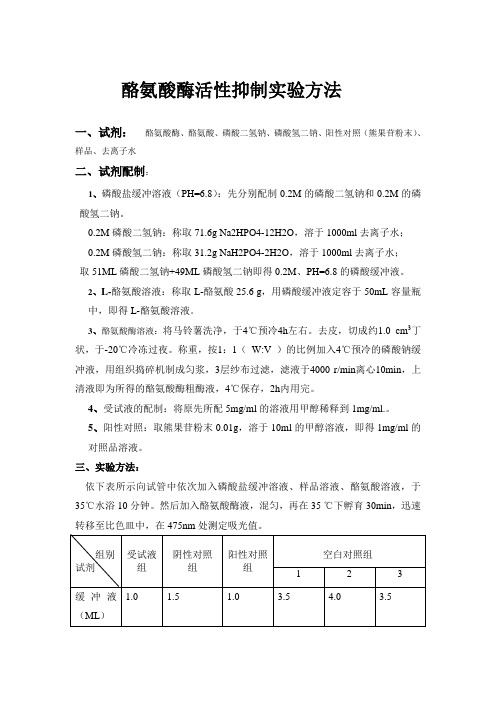
酪氨酸酶活性抑制实验方法一、试剂:酪氨酸酶、酪氨酸、磷酸二氢钠、磷酸氢二钠、阳性对照(熊果苷粉末)、样品、去离子水二、试剂配制:1、磷酸盐缓冲溶液(PH=6.8):先分别配制0.2M的磷酸二氢钠和0.2M的磷酸氢二钠。
0.2M磷酸二氢钠:称取 71.6g Na2HPO4-12H2O,溶于 1000ml 去离子水;0.2M磷酸氢二钠:称取 31.2g NaH2PO4-2H2O,溶于1000ml 去离子水;取51ML磷酸二氢钠+49ML磷酸氢二钠即得0.2M、PH=6.8的磷酸缓冲液。
2、L-酪氨酸溶液:称取L-酪氨酸25.6 g,用磷酸缓冲液定容于50mL容量瓶中,即得L-酪氨酸溶液。
3、酪氨酸酶溶液:将马铃薯洗净,于4℃预冷4h左右。
去皮,切成约1.0 cm3丁状,于-20℃冷冻过夜。
称重,按1:1(W:V )的比例加入4℃预冷的磷酸钠缓冲液,用组织捣碎机制成匀浆,3层纱布过滤,滤液于4000 r/min离心10min,上清液即为所得的酪氨酸酶粗酶液,4℃保存,2h内用完。
4、受试液的配制:将原先所配5mg/ml的溶液用甲醇稀释到1mg/ml.。
5、阳性对照:取熊果苷粉末0.01g,溶于10ml的甲醇溶液,即得1mg/ml的对照品溶液。
三、实验方法:依下表所示向试管中依次加入磷酸盐缓冲溶液、样品溶液、酪氨酸溶液,于35℃水浴10分钟。
然后加入酪氨酸酶液,混匀,再在35 ℃下孵育30min,迅速转移至比色皿中,在475nm处测定吸光值。
受试组用空白对照组1调零,阴性对照组用空白对照组2调零,阳性对照组用空白对照组3调零。
受试组吸光值为A1,阴性对照组吸光值为A2,阳性对照组吸光值为A3。
抑制率=1-[(A1-A2)/(A3-A2)]×100%=(A3-A1)/(A3-A2)×100% 注:受试液组共四种样品。
酪氨酸酶活性检测试剂盒说明书 微量法

酪氨酸酶活性检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4055规格:100T/96S产品内容:提取液:液体125mL×1瓶,4℃保存。
试剂一:粉剂×3瓶,4℃保存。
临用前每瓶加入7mL提取液充分溶解待用。
现配现用。
产品说明:酪氨酸酶(tyrosinase:EC1.14.18.1)是一种单酚单加氧酶,是具有双功能的含铜糖蛋白,广泛存在于植物、酵母和动物组织中。
酪氨酸酶是生物体合成黑色素的关键酶,也是引起果蔬酶促褐变的主要因素,同时也对昆虫的免疫及生长有重要影响酪氨酸酶催化L-多巴生成多巴色素,其在475nm下有特征吸收峰,进而测定出酪氨酸酶的活性。
自备实验用品及仪器:可见分光光度计/酶标仪、低温离心机、水浴锅、可调式移液器、微量玻璃比色皿/96孔板、研钵/匀浆器、冰、蒸馏水。
操作步骤:一、样本处理:(1)组织:称取约0.1g组织,加入1mL提取液进行冰浴匀浆。
12000g,4℃离心20min,取上清,置冰上待测。
(2)细胞或微生物样品的制备:先收集细胞或微生物样品到离心管内,弃上清,按照每500万细胞或微生物加入1mL提取液,超声波破碎细菌或细胞(功率20%,超声3s,间隔10s,重复30次)。
12000g,4℃离心20min,取上清,置冰上待测。
(3)血清(浆):直接检测。
二、测定步骤:(1)分光光度计/酶标仪预热30min,波长调至475nm。
蒸馏水调零。
(2)加样表:在微量玻璃比色皿/96孔板中分别加入试剂名称(μL)测定管试剂一180样品20充分混匀后立即测定10s时在475nm下的吸光度,记为A1,之后迅速将其放入37℃(哺乳动物)或25℃(其他物种)水浴或培养箱中3min(若酶标仪自带控温功能,将温度调至37℃或25℃)。
然后迅速拿出擦净后测定190s时的吸光度,记为A2。
计算ΔA=A2-A1。
三、酪氨酸酶活力计算:1、按微量玻璃比色皿计算:(1)按蛋白浓度计算:单位的定义:每mg组织蛋白每分钟催化生成1nmol多巴色素的酶量定义为一个酶活性单位。
酪氨酸酶的提取及其催化活性研究

酪氨酸酶的提取及其催化活性研究路环 08生化制药技术2班指导教师张业实验目的人是生物体中酶的存在和作用催化,使学生了解生物体系中在酶存在下的合成或分解与普通的有机合成的不同和相同之处认识一些生物化学过程的特殊性。
掌握生物活性物质的提取和保存方法,学会使用仪器分析手段研究催化反应特别是生物化学体系中催化过程的基本思想和方法。
实验原理在实验室里,复杂的有机合成与分解往往要求在高温、强酸、强碱、减压等剧烈条件下才能进行。
而在生物体内,虽然条件温和(常温、常压和接近中性的溶液等),许多复杂的化学反应却进行的十分顺利和迅速,而且基本没有副产物,其根本原因就是由于生物催化剂-酶的存在。
酶是具有催化作用的蛋白质。
按照酶的组成,可将其分为两种:(1)简单蛋白质其活性仅决定于它的蛋白质结构。
如脲酶、淀粉酶;(2)结合蛋白这种酶需要加入非蛋白质组分(称之为辅助因子)后,才能表现出酶的活性。
酶蛋白质与辅酶因子结合形成的复合物称为全酶。
例如酪氨酸酶就是以Cu+或Cu2+为辅助因子的全酶。
辅助因子谁然本身无催化作用,但参与氧化还原或其运载酰基载体的作用。
若将全酶中的辅助因子除去,则酶的活性就失去了。
通常把被酶作用的物质称为该酶的底物。
一种酶催化特定的一个或一类底物的反应,具有很高的选着性和灵敏性,因而引起了广大分析工作者的兴趣。
目前,酶已经作为一种分析试剂得到广泛应用。
特别在生化、医学方面。
例如一些生命物质和液体中的特殊有机成分,用其他方法测定有困难,用酶法分析却有其独到之处。
本实验拟通过从土豆中提取酪氨酸酶并测定其活性,使同学们对酶有个初步的了解。
我们都见过,当土豆、香蕉、苹果、蘑菇受损伤时限棕色的现象,这是由于土豆、苹果等含有酪氨酸酶。
酶存在于物质内部,当内部物质暴露出来后,在空气中的氧参与下,发生了如图31-1所示的一系列反应,生成黑色素。
HONH 2COOHHNN HHO HOCOOHNH 2HOHONHOOOO酪氨酸多巴多巴醌多巴红二羟基吲哚吲哚醌黑色素O 2图31-1 酶参与的多巴转换反应酪氨酸酶可用比色法测定。
一种用于检测酪氨酸酶活性的SERS基底及利用该基底检测酪氨酸酶活

专利名称:一种用于检测酪氨酸酶活性的SERS基底及利用该基底检测酪氨酸酶活性的方法
专利类型:发明专利
发明人:陆德婵,陈彩柔,卢玉栋,黄祖芳,刘显鹏,沈慧英
申请号:CN202010096667.1
申请日:20200217
公开号:CN111157512A
公开日:
20200515
专利内容由知识产权出版社提供
摘要:本发明提供一种用于检测酪氨酸酶活性的SERS基底及利用该基底检测酪氨酸酶活性的方法,利用三价铁离子与NTA形成螯合物Fe(NTA),当体系中出现TYR时,催化氧化多巴胺变成多巴醌,多巴胺含量降低,抑制了Fe(NTA)DA络合物的形成,拉曼信号降低。
利用Au@Au NPs做为拉曼增强基底,普鲁士蓝(PB)做为核壳结构中的内标信号分子,该分子只在生物静默区有强的谱峰,无背景信号干扰,可以用于校准检测过程中的信号波动,Fe(NTA)DA的拉曼特征峰1480cm信号与普鲁士蓝2121cm信号强度的比值(I/)与酪氨酸酶活性之间存在着良好的线性关系,检测限较低,可达0.0003U/mL。
申请人:福建师范大学
地址:350300 福建省福州市福清市龙江街道校园新村一号福建师范大学研发中心
国籍:CN
代理机构:福州科扬专利事务所
代理人:李晓芬
更多信息请下载全文后查看。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酶催化活性及其影响因素的研究学院:化学与分子工程学院班级:应用化学108班姓名:王文移05 宁家彬06指导老师:詹天荣酶催化活性及影响其活性因素的研究作者:王文移 宁家彬[摘要]:酶广泛存在与生物体中,对生命的生化反应至关重要,本实验主要探究不同浓度下催化活性的不同,以及温度,pH 值,抑制剂对于酶活性的影响。
[关键词]:酪氨酸酶,唾液淀粉酶,活性,pH ,温度,抑制剂Enzyme is widespread and in living organisms, biochemical reactions vital to life, this experiment mainly explore different catalytic activity of differentconcentrations, as well as temperature, pH value, effect of inhibitor for the enzyme activity.[引言]认识生物体中酶的存在和催化作用,了解生物体系中在酶存在下的合成或分解与普通的有机合成的不同和相同之处,认识一些生物化学过程的特殊性,是当今对酶的研究不可或缺的话题。
通过本次实验能够掌握生物活性物质的提取和保存方法,学会使用仪器分析手段研究催化反应特别是生物化学体系中催化过程的基本思想和方法。
酪氨酸酶是一种氧化还原酶,它广泛存在于动植物和微生物中。
土豆的提取液中含有酪氨酸酶。
人唾液中的淀粉酶为a-淀粉酶,在唾液腺细胞内合成。
酶的活性会受到很多因素的影响,如温度、PH 值、底物浓度以及激活剂抑制剂的影响。
本实验目的在于测定各个因素对于酶活性的影响。
1.实验原理本实验采用唾液淀粉酶及酪氨酸酶来进行反应,主要观察淀粉与试剂的反应颜色,多巴的吸光度。
本实验从土豆中提取酪氨酸酶,并测定其催化活性。
当土豆、苹果、香焦等的受损面接触空气后会产生深棕色的现象是人们都见过的,这是这类物质含有酪氨酸和酪氨酸酶,酶存在于物质内部,当暴露在空气中后,在氧气的参与下,会发生一系列反应。
以下是主要的反应过程。
由于多巴转变成多巴红的反应速率较快,再转到下一步产物速率则慢得多,故可选择多巴转变为多巴红的反应速率的测定来判断催化反应的活性。
因多巴红具有特殊的颜色,故可用分光光度法测定,在不同的时刻测定某特定波长下的吸光度,用吸光度对时间作图,从所得的直线斜率求酶的活性。
酶的活性计算方法:一般定义在优化的条件下(包括pH 值、离子强度、温度等),25℃时在1min 内转化1mol 底物所需要催化剂的量为活性单位。
通过下式可计算酶的活性:610⨯∆=ktVAa ,式中,a 为所用溶液的酶的活性,A ∆为最大吸收波长吸光度的变化,t 为时间(min ),k 为多巴红的摩尔吸收系数,V 为加入酶的体积,进而计算出原料(土豆)中酶的活性:m aV o /A 。
式中A 为原料中酶的活性(注意此处A 不是吸光度A ),V 0为原料所得的酶溶液的总体积,m 为原料总质量。
淀粉在淀粉酶作用下发生分解,其变化为:淀粉——紫色糊精——红色糊精——麦芽糖,葡萄糖。
淀粉与糊精无还原性,对班氏试剂呈阴性;麦芽糖与葡萄糖则是还原性的糖,与班氏试剂共热生成红棕色氧化亚铜的沉淀。
反应最适温度为37-40o C ,最适pH 为6.8,Cl -离子是激活剂,Cu 2+离子是抑制剂。
下图为多巴在酪氨酸酶的催化作用的下的反应历程2.实验仪器与试剂1、仪器:分光光度计、离心机、研钵、水浴、秒表2、试剂:二羟基苯丙胺酸(多巴)、磷酸二氢钠、氢氧化钠、盐酸、土豆、淀粉溶液,碘液、班氏试剂、盐酸、乳酸、碳酸钠、氯化钠、硫酸铜3.实验步骤3.1 酪氨酸酶的活性研究3.1.1.溶液配制0.10mol/L磷酸缓冲溶液(pH=7.2):50ml 0.20mol/L磷酸二氢钠+8ml0.1mol/L盐酸,定容至200ml;0.10mol/L磷酸缓冲溶液(pH=6.0):50ml 0.20mol/L磷酸二氢钠+22ml0.1mol/L盐酸,定容至200ml;0.10mol/L多巴溶液:0.195g多巴,用pH=6.0的磷酸缓冲溶液定容至100ml (现用现配)。
3.1.2酶的提取取新鲜土豆,清洁后切碎,称取10.0g置于研钵中,加入7.5mL pH=7.2的磷酸缓冲溶液,用力挤压,两层纱布滤出提取液,立即离心分离(3000rpm,5min),倾出上层清液保存于冰浴中,提取液为棕色,在放置过程中不断变黑。
3.1.3酶的活性测量取2.5ml上述提取液用pH=7.2的缓冲溶液稀释到10ml比色管中,摇匀分别取0.1mL稀释过的提取液于10mL比色管中,加入2.5mL pH=6.0的缓冲溶液,再加入2ml多巴溶液,同时开始计时,用分光光度计在480nm处测定吸光度。
开始6min内每分钟读一个数,以后隔2min读一个数,直至吸光度变化不大为止。
取0.2ml,0.3ml。
0.4ml已稀释过提取液重复上述实验(总体积为5ml)。
以吸光度对时间作图,从直线斜率求出酶的活性。
3.2淀粉酶的活性研究3.2.1.淀粉酶活性的检测:取一只试管加入5ml淀粉溶液和0.2-2ml唾液,混匀后水浴(37o C)在白瓷板上用碘液观察颜色,至微黄色为止,向上述试管中加入2ml班氏试剂,放入沸水中加热十分钟观察实验现象3.2.2.pH对酶活性的影响:取四只试管分别加入盐酸,乳酸,蒸馏水,碳酸钠各2ml再加入2ml淀粉溶液和2ml酶溶液,37度水浴,5分钟后加入2ml班氏试剂,沸水浴,观察沉淀生成情况3.2.3.温度对酶的影响:三只试管分别加入3ml淀粉,另外三只加1ml淀粉酶,分别成组在0,37,70度下水浴,5分钟后混合,5分钟后加碘液,观察颜色3.2.4.抑制剂与激活剂的作用3.3影响酶活性的因素的研究(1)取0.40ml稀释过了的提取液在沸水浴中加热5min,冷却后配成测定溶液,观察现象。
(2)取0.40ml稀释过的提取液,加入少量的固体Na2S2O3配成测定溶液,观察现象。
(3)取0.40ml稀释过的提取液,加少量EDTA振动混合,反应一段时间后配成测定溶液,观察现象。
4.实验数据记录及讨论(一)酪氨酸酶催化活性研究加入不同量的酶在不同时间反应的吸光度如下表(表1)所示,由于反应在8分钟以后已经趋于平缓,故在12分钟以后的两组(14、16)实验数据未列出。
表1:不同酶加入量不同时间反应的吸光度测定换动力学过程,再由直线部分得出转换速率,即为酶的活性。
为使作图更为准确,现只取前六分钟内数据作图如下:图1:0.10mol 提取液关系曲线 图2:0.20mol 提取液关系曲线图3:0.30mol 提取液关系曲线 图4:0.40mol 提取液关系曲线依次得出不同提取液的活性,比较不同体积的提取液加入后相同量的多巴转换速率。
由于放置时间较长,第四组实验已经失去可靠性。
(酪氨酸酶的吸光系数为lg k=3.7。
)表2:酶的活性计算(二)淀粉酶实验现象进行的用沸水浴,EDTA及Na2S2O3处理过的酪氨酸酶溶液进行实验发现沸水浴与Na2S2O3的吸光度几乎不变,而EDTA则是变小。
可得出如下结论:(1)在沸水浴中加热5分钟冷却后测得的溶液吸光度基本保持不变,其酶的活性在高温下失活。
(2)加入少量固体Na2S2O3配成的测定溶液,其测得的吸光度也基本保持不变且比(1)条件下的吸光度还小,其原因是硫代硫酸钠是还原剂,使蛋白质变性。
(3)稀释的提取液加入少量EDTA振动混合,其测得的吸光度在缓慢减小。
其原因是EDTA与辅助因子络合,使酶活性失活。
5.实验结果讨论根据酪氨酸酶的活性实验得出结果,可知活性本应当随着酶浓度的增大而增大,但在实际实验中却出现活性随酶浓度的增大而先增大后减小的情况出现,可能是因为在酶提取之后未保存在冰浴中导致没失活,从而导致酶活性的变化出现异常情况。
关于酶的活性影响因素的实验可得出以下结论(1)pH对活性影响:1.pH过小(过酸)、过大(过碱)都能使酶蛋白变性而失活.2.pH的改变能影响酶活性中心上必须基团的解离程度,同时也可以影响底物和辅酶的解离程度,从而影响酶分子对底物分子的结合和催化,只有在特定的pH 下,酶、底物和辅酶的解离状态,最适宜它们相互结合,并发生催化作用,从而使酶反应速度达到最大值。
这个pH称为酶的最适pH。
唾液淀粉酶的最适PH 为中性,故在蒸馏水中沉淀最多,盐酸酸性过强,使酶的活性失活,乳酸是弱酸,颜色基本不变,碳酸钠是弱碱,产生较少的沉淀。
(2)温度对酶活性的影响:酶的催化作用受温度的影响很大,酶的化学本质是蛋白质,所以温度过高会引起蛋白质变性导致酶的失活,唾液淀粉酶在70°和0°时,酶活性失活,颜色呈蓝色。
在37°时,是唾液淀粉酶的最适温度,淀粉遇唾液淀粉酶水解,颜色呈浅黄色。
(3)抑制剂与激活剂对酶活性的影响:酶的活性受某些物质的影响,能使酶活性增加的称为激活剂,能使酶活性降低的称为抑制剂。
很多少量的激活剂和抑制剂就会影响酶的活性,而且常具有特异性。
本实验中氯离子为唾液淀粉酶的活化剂,铜离子为其抑制剂。
所以加入NaCl后,溶液颜色为浅黄色。
氯离子促进唾液淀粉酶的水解。
铜离子作为抑制剂,故加入硫酸铜后,溶液颜色为深蓝色。
水作为对照变量,加入后对溶液稀释,颜色为浅蓝色。
参考文献[l] KenllnerR,MermetJM,OttoMWindmerHM.AnalyticalChemistry.Chapter6.Weiheim:Wiley VCH,1998;北京大学、吉林大学合译.分析化学.北京:北京大学出版社,2000.第6章[2] 王希成编.生物化学(第3版).北京:清华大学出版社2010.第4章[3] StryerL编,唐有棋等译.生物化学.北京:北京大学出版社,1990[4] Frieclman M E,DaronHH.JchemEdu,1977,(54):256[5] 叶率官.化学试剂,1981,(2);6。
