极化曲线在电镀中的应用 PPT
极化曲线在电化学腐蚀中的应用

极化曲线在电化学腐蚀中的应用娄浩(班级:材料化学13-1 学号:9)关键词:电化学腐蚀;极化;极化曲线;极化腐蚀图据工业发达国家统计,每年由于腐蚀造成的损失约占国民生产总值的l~4%,世界钢铁年产量约有十分之一因腐蚀而报废,因此研究金属腐蚀对于国民经济发展和能源的合理利用具有重大意义。
其中电化学腐蚀是金属腐蚀的一种最普遍的形式。
论文分析了电化学腐蚀的机理以及极化曲线的理论基础。
利用测量极化曲线的方法,研究金属腐蚀过程,已经得到广泛的应用。
1.金属腐蚀的电化学原理金属腐蚀学是研究金属材料在其周围环境作用下发生破坏以及如何减缓或防止这种破坏的一门科学[1]。
通常把金属腐蚀定义为:金属与周围环境(介质)之间发生化学或电化学而引起的破坏或变质。
所以,可将腐蚀分为化学腐蚀和电化学腐蚀[2]。
化学腐蚀是指金属表面与非电解质直接发生纯化学作用而引起的破坏。
其反应的特点是金属表面的原子与非电解质中的氧化剂直接发生氧化还原反应,形成腐蚀产物[3]。
腐蚀过程中电子的传递是在金属与氧化剂之间直接进行的,因而没有电流产生。
电化学腐蚀是指金属表面与电子导电的介质(电解质)发生电化学反应而引起的破坏。
任何以电化学机理进行的腐蚀反应至少包含有一个阳极反应和一个阴极反应,并以流过金属部的电子流和介质中的离子流形成回路[4]。
阳极反应是氧化过程,即金属离子从金属转移到介质中并放出电子;阴极反应为还原过程,即介质中的氧化剂组分吸收来自阳极的电子的过程。
例如,碳钢[5]在酸中腐蚀,在阳极区Fe被氧化成Fe2+所放出的电子自阳极Fe流至钢表面的阴极区(如Fe3C)上,与H+作用而还原成氢气,即阳极反应:Fe - 2e →Fe2+阴极反应:2H+ + 2e →H2总反应:Fe + 2H+ →Fe2+ + H2与化学腐蚀不同,电化学腐蚀的特点在于,它的腐蚀历程可分为两个相对独立并可同时进行的过程。
由于在被腐蚀的金属表面上存在着在空间或时间上分开的阳极区和阴极区,腐蚀反应过程中电子的传递可通过金属从阳极区流向阴极区,其结果必有电流产生[6]。
稳态极化曲线测量在电镀中的应用
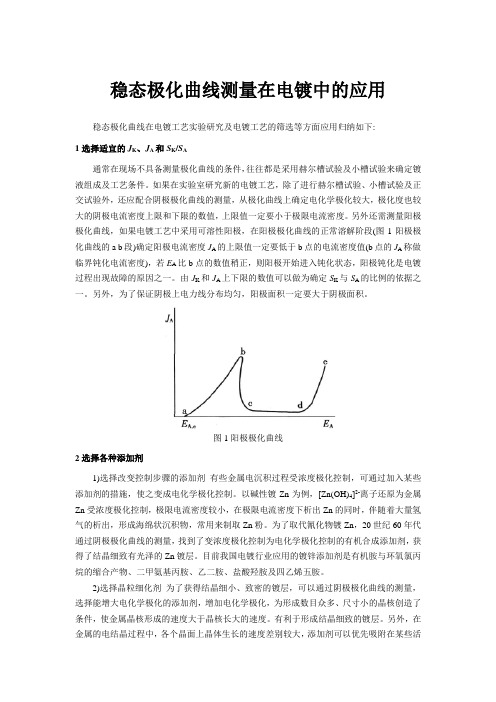
稳态极化曲线测量在电镀中的应用稳态极化曲线在电镀工艺实验研究及电镀工艺的筛选等方面应用归纳如下:1选择适宜的J K、J A和S K/S A通常在现场不具备测量极化曲线的条件,往往都是采用赫尔槽试验及小槽试验来确定镀液组成及工艺条件。
如果在实验室研究新的电镀工艺,除了进行赫尔槽试验、小槽试验及正交试验外,还应配合阴极极化曲线的测量,从极化曲线上确定电化学极化较大,极化度也较大的阴极电流密度上限和下限的数值,上限值一定要小于极限电流密度。
另外还需测量阳极极化曲线,如果电镀工艺中采用可溶性阳极,在阳极极化曲线的正常溶解阶段(图1阳极极化曲线的a b段)确定阳极电流密度J A的上限值一定要低于b点的电流密度值(b点的J A称做临界钝化电流密度),若E A比b点的数值稍正,则阳极开始进入钝化状态,阳极钝化是电镀过程出现故障的原因之一。
由J K和J A上下限的数值可以做为确定S K与S A的比例的依据之一。
另外,为了保证阴极上电力线分布均匀,阳极面积一定要大于阴极面积。
图1阳极极化曲线2选择各种添加剂1)选择改变控制步骤的添加剂有些金属电沉积过程受浓度极化控制,可通过加入某些添加剂的措施,使之变成电化学极化控制。
以碱性镀Zn为例,[Zn(OH)4]2-离子还原为金属Zn受浓度极化控制,极限电流密度较小,在极限电流密度下析出Zn的同时,伴随着大量氢气的析出,形成海绵状沉积物,常用来制取Zn粉。
为了取代氰化物镀Zn,20世纪60年代通过阴极极化曲线的测量,找到了变浓度极化控制为电化学极化控制的有机合成添加剂,获得了结晶细致有光泽的Zn镀层。
目前我国电镀行业应用的镀锌添加剂是有机胺与环氧氯丙烷的缩合产物、二甲氨基丙胺、乙二胺、盐酸羟胺及四乙烯五胺。
2)选择晶粒细化剂为了获得结晶细小、致密的镀层,可以通过阴极极化曲线的测量,选择能增大电化学极化的添加剂,增加电化学极化,为形成数目众多、尺寸小的晶核创造了条件,使金属晶核形成的速度大于晶核长大的速度。
应用电化学41金属电沉积和电镀原理ppt课件

2)络离子的还原
设 氰化物镀铜电解液基本组成
CuCN 35g/L(0.4 mol/L) NaCN 48g/L (1.0 mol/L) Cu+ 与CN-形成的络离子可能有[Cu(CN)2]-、 [Cu(CN)3]2-、 [Cu(CN)4]3-等不同形式,认为主要存在形式是[Cu(CN)3]2其在水中的电离平衡为:[Cu(CN)3]2-=Cu++3CN-
阴极性镀层 当镀层与基体金属形成腐蚀电池时,镀层因电位比基体更
正,基体金属首先受到腐蚀溶解,这时镀层为阴极性镀层。 阴极性镀层仅能对基体起到机械保护作用,不能起到电化
学保护作用,如:
铁上镀Sn: Sn2 /Sn -0.14V Fe2 /Fe -0.44V?
形成腐蚀电池时,Sn为阴极,Fe为阳极
(4) 电铸
提纯金属或湿法冶金
(5) 电加工 某些精密的零件,机械加工困难,可采用电加
工成型技术
(6) 表面处理 制备特殊用途材料如发泡镍、中空镍纤维等
(7) 高科技 如电沉积法制备一维纳米线
(8) 材料制备 制备催化材料、复合材料、金属膜材料等
常规电镀对电镀层的基本要求: 通常对电镀层要求:
镀层与基体结合牢固,一定的厚度及厚度均匀 镀层结构致密、孔隙率小等。 进一步要求:镀层内应力小、柔韧性好、有一定的硬度、
自行车轮镀铜镍铬; 吊灯等灯具电镀仿金镀层或仿银镀层; 仪器仪表盘装饰性电镀缎面镍;
功能性镀层 功能性镀层是具有特定功能和特定意义的镀层, 通常是只对 某一种零件和某一种特殊使用条件下所要求的特殊功能,因 此功能性镀层包括的项目较多,而且随着技术的发展和应用 的开发,今后还会越来越多,如: •耐磨镀层: 提高零件的表面硬度,增加抗磨损性能(如直 轴、曲轴、气缸, 纺织机械中的各种辊桶镀硬铬或喷涂陶磁 微粒); •减磨镀层: 多用于滑动接触面,需要电镀韧性好的金属, 如轴瓦,轴套等镀Sn、Pb-Sn、Pb-In等;
极化曲线的运用与分析 共21页PPT资料

稳态的定义
稳态是在指定的时间范围内,电化学系统的参量(如电位、电 流,电极表面的浓度分布,电极表面状态等)变化甚微,基本 上可认为不变,这种状态可称为电化学稳态。
利用三电极体系测定极化曲线
辅助电极的作用是与研究电极构成回路,通过电 流,实现研究电极的极化。它的表面一般比研究 电极大得多.
参比电极与研究电极组成电池 ,用来测量研究电 极的电极电位。参比电极具有已知的、稳定的电 极电位,而且不发生极化。参比电极的鲁金毛细 管尽量靠近研究电极表面,但也不能离电极太近, 否则会对电极表面产生屏蔽作用,影响电流的分 布。一般情况下,其外径为0.5~1mm,使其离研 究电极表面的距离不小于其外径。
P o te n tia l/V
1 .81 .6t11 .41 .2
1 .0
0 .8
0 .6
0 .4
0
10
20
30
t/m in
t
2
40
50
Back
暂态的定义
暂态法又称动态法,电极从开始极化到电极过程达到稳态的这一阶段称暂态过程。 在该过程中电极电位、电极界面上的吸附覆盖状态、双电层充电,电极附近液层 中分布等都处在变化之中,也就是体系的各变量随时间而变化。暂态法就是用指 定的小幅度的电流或电压讯号加到研究电极上,使处在平衡状态或其他状态的电 极体系发生扰动,同时测量电极参数的响应,来研究电极体系的各种性质。
PCB电镀中极化曲线的应用

PC B电镀中极化曲线的应用Application of Polarization Curves in PCB Plating罗 斌1, 安茂忠1, 王成勇2, 刘金峰2(1.哈尔滨工业大学应用化学系,黑龙江哈尔滨150001;2.深圳市深南电路有限公司,广东深圳518053)LUO Bin1, AN Mao zhong1, WANG Cheng yong2, LIU Jin feng2(1.Department of Applied Chemistry,H arbin Institute of T echno logy,H arbin150001,China;2.Shenzhen Shennan Circuits Co.,Ltd.,Shenzhen518053,China)摘要: 通过对PCB镀铜液的阴极极化曲线的测量,研究了添加剂的作用及其影响规律;分析了极化曲线与镀层质量的关系。
通过极化曲线,可以分析镀液是否受污染,若已被污染,则可以确认污染源;确定适宜的工作电流密度,从而保证镀层质量。
关键词: P CB;电镀;极化曲线;添加剂Abstract: T he ro le of the addit ive and its affecting law wer e inv est igated,and the r elation betw een po lar ization cur ves and co ating quality was analy zed thro ug h measuring the cathodic polar izatio n curv es of co pper bath fo r PCB plating.By using the po lar ization curves,w hether the bath is contaminated can be analy zed;and if contaminated,the contaminating source can be identif ied and fo r determining a suitable wo rking curr ent density,thus coating quality can be g uaranteed.Key words: PCB;electro plating;pola rizatio n curv e;addit ive中图分类号:T Q153 文献标识码:A 文章编号:1000 4742(2009)01 0013 040 前言随着现代通讯领域对高性能PCB产品品质要求的不断提高,PCB制造面临着诸多工艺技术方面的挑战,其中深孔电镀技术就是其关键技术之一。
电镀液性能PPT课件

镀铬电解液的覆盖能力最差,并且因基体 金属的不同而不同:铜>镍>黄铜>钢
改善覆盖能力的方法
➢冲击镀 ➢中间镀层
注意
• 析氢过电位低的基体金属,金属就不容易 析出,所以若基体金属组织不均匀或其表 面含有降低氢过电位的金属杂质.则此表 面就可能没有镀层。
• 基体金属表面不洁部位沉积困难 • 基体金属表面粗糙度大沉积困难
(1)初次电流分布(或一次电流分布)
• 初次电流分布:假设阴极极化不存在时 的电流分布,此时R 极化≈ 0。
I1 jK1 R电液2 I2 jK2 R电液1 I1 jK1 l2 K I2 jK2 l1
(2)二次电流分布(或实际电流分布)
• 二次电流分布:阴极极化存在时的电流分布
I1 R电液2 R极化2 I2 R电液1 R极化1
电解液的整平作用:电解液所具有的能使 镀层的微观轮廓比底层更平滑的能力。
微观轮廓—指粗糙度小于0.5毫米的表面 宏观轮廓—指复杂形状的零件表面
注意
• 镀液的分散能力是指在宏观轮廓表面上的 沉积分布情况,是宏观分散能力
• 镀液的整平能力是指在微观轮廓表面上的 沉积分布情况,是微观分散能力
例如
• 硫酸盐镀铜溶液宏观分散能力差,但整平 能力强,能填平基体表面的微观孔穴
K M1 T M 2 100%
K
实际电流分布与极化率、溶液电阻率、几何尺 寸等的关系
远阴极和近阴极与阳极之间的距离差
I1 I2
j1 j2
1
l1
l 1
j
近阴极和阳极之间的距离 电解液的电阻率
阴极极化度
j
j2
j1
j
阴极极化曲线
3、影响电流和金属在阴极表面分布的因素
第4章金属腐蚀极化曲线与测试方法课件

钝化电流 真实阳极曲线 致钝电流
表观阳极极 化曲线
特征:
•表观与真实曲线相似
•E<Ee,c后表观比真实 电流低,差值为 Ic
腐蚀电位
阴极电流
表观阳极极化曲线 钝化电流 Imax
I Ic I (EP) Ep时的真实阴极电流> Imax
特征:可自钝化 •EK处于钝化区——自 钝化,不用外加电流 •表观与真实差别极大: 表观曲线随E单调上升 •E>Ee,c后重合
活化钝化过渡区
•金属可钝化并进入第3种情况
-IC
阴极极化曲线 •阳阴极极化曲线交点在钝化区
活化溶解区
钝化区
腐蚀电位 EK
过钝化区
阳极平衡电位
Ee,c
钝化电位
活化电位 (Flade电位
)阴极平衡电位
过钝化电位
补充:实现自钝化的途径 (/link?url=mhrFetw_9kAuLVby_sAuh1hWlujaGj_DYaLiNvppr0WZ0Ms Nj_ChE6rkO89lxSKdE1bwRJFvxjVEsFKVtvIzvykMe3mC2VuJdWFAlwIgCnC)
4、扩散有影响甚至其控制下的金属腐蚀速度
腐蚀电位处的阳、阴极电流相等即 为腐蚀速度 = IL(阴极电流)
IK:自腐蚀电流 icorr
此后两线接近、相似 I:表观腐蚀电流
阴极平衡电位
相似
IL:阴极极限扩散电流
自腐蚀电位 阳极平衡电位
5、具有完整阳极钝化曲线金属的腐蚀速度
• 真实极化曲线上交点的电位就是腐蚀电位 • 此点对应的阳极真实电流即为腐蚀速度,也是此电位阴极电流的绝对值
问题:自钝化、化学钝化、阳极钝化、电化学钝化的区别?
致钝电流
极化度和过电位在电镀工艺中的应用
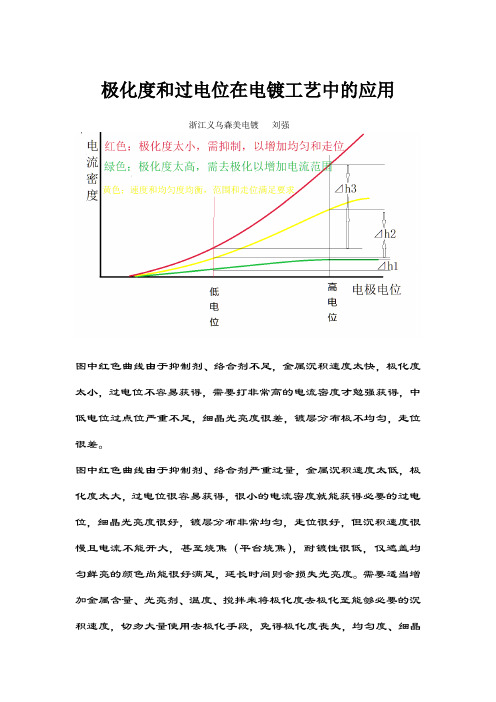
极化度和过电位在电镀工艺中的应用浙江义乌森美电镀刘强图中红色曲线由于抑制剂、络合剂不足,金属沉积速度太快,极化度太小,过电位不容易获得,需要打非常高的电流密度才勉强获得,中低电位过点位严重不足,细晶光亮度很差,镀层分布极不均匀,走位很差。
图中红色曲线由于抑制剂、络合剂严重过量,金属沉积速度太低,极化度太大,过电位很容易获得,很小的电流密度就能获得必要的过电位,细晶光亮度很好,镀层分布非常均匀,走位很好,但沉积速度很慢且电流不能开大,甚至烧焦(平台烧焦),耐镀性很低,仅遮盖均匀鲜亮的颜色尚能很好满足,延长时间则会损失光亮度。
需要适当增加金属含量、光亮剂、温度、搅拌来将极化度去极化至能够必要的沉积速度,切勿大量使用去极化手段,免得极化度丧失,均匀度、细晶光亮度、走位深度全面恶化。
轻度去极化也称“微调”,轻度去极化“微调”,能够在不明显损失极化度、过电位前提下明显改善慢沉积速度产生的“氢雾”死板,获得鲜亮度。
图中黄色曲线为正常曲线,具体应根据产品工艺要求的重点或、或低一些,若要求较快的沉积速度以获得足够的厚度,应去极化抬高曲线;s若均匀度、细晶光亮度、走位深度要求愈高,厚度是次要的,应提高络合剂、抑制性添加剂,甚至适当降低快金属的含量、温度、搅拌速度等以获得最佳均匀度、细晶光亮度、走位深度。
分散能力按照宏观分散能力公式Tp=1+∆LρΔE+LΔE/ΔD━极化度ρ━电导率ΔL━货差L━扩散时程(阴阳极距离乘以扩散时间)由于阴极电极电位E为负值ΔE/ΔD也为负值,所以+仅代表取ΔE/ΔD的绝对值。
应趋于0,货差要使宏观分散能力Tp最大为100%,∆LρΔE+LΔL一旦产品给定,只能通过稀下减小,贡献非常有限,切降低生产效率。
增大改善分母三项为电镀工艺操作重点考虑的三项,扩散时程L由于阴阳极距离一旦定型,只能改变扩散时间,一般开缸剂中的大分子抑制组分,络合剂络合配体都能减慢扩散速度,延长扩散时间,从而增大扩散时程L。
16--极化曲线的原理及应用PPT

电化学电极过程动力学复习、难点、习题传质过程(扩散极限电流)j d 影响传(电)荷过程传质过程(扩散极限电流)j d 影响传(电)荷过程电极过程动力学电极过程动力学控制电化学过程加快或减缓电化学反应速度(电流)控制电化学过程加快或减缓电化学反应速度(电流)超电势(电化学、浓差)极化现象三(二)电极体系j 0 ,η,α,B-V 方程,Tafel 公式极化曲线超电势--电流曲线jja =j= 10-3Acm-2’b =j= 10-6Acm-2’c =j= 10-9Acm-2’交换电流密度对i-η曲线的影响电荷传递系数对i-η曲线的影响Tafel曲线阳极超电势阴极超电势E=ϕa-ϕcI/A电解电池I-V曲线液相中的三种传质过程注意其所传输的物种及发生在溶液体相或在固/液界面电极界面溶液层的几部分反应物浓度体相电极溶液δ氢电极的极化曲线示意图H+ 离子的还原和析出氢气过程H3O+H3O+ H3O+adH adH2H2H3O+ + M + e M-H + H2O 迟缓放电机理Volmer反应氢超电势Hydrogen OverpotentialH 3O ++ M + e M-H + H 2O迟缓放电机理Volmer 反应(a) H 3O ++M-H+e M+H 2O+H 2Heyrovsky 反应(b) M-H + M-H 2M + H2Tafel反应4.(a) H 3O ++M-H+e M+H2O+H 2电化学脱附机理Heyrovsky 反应(b) M-H + M-H 2M + H 2Tafel 反应3. H 3O + + M + e M-H + H 2O 迟缓放电机理Volmer 反应3, 4(a), 4(b) 皆可能为速度控制步骤2H ++ 2e 2H ad (2M-H) M-H + M-H 2M + H (2][2irad Fk j Η=(忽略逆过程)][][ln '+ΗΗ−=r ad o r F RT ϕϕ][][ln '+ΗΗ−=ir ad o ir F RT ϕϕ][][ln '+ΗΗ−=ir ad o ir F RT ϕϕ⎭⎬⎫⎩⎨⎧−Η=ΗRT F c r ad ir ad ηexp ][][2][2irad Fk j Η=⎭⎬⎫⎩⎨⎧−Η=RT F Fk j c r ad η2exp ][22⎭⎬⎫⎩⎨⎧−=RT F j c η2exp 0jzF RT j zFRT c lg 303.2lg 303.20−=η注意: 没有α!21=α电化学方法的主要优点1. 通过方便调节电极电势显著地改变反应速度2. 较易控制电极反应方向3. 电极反应一般在常温常压下进行4. 反应所用氧化剂或还原剂为电子,环境污染少电化学学习重点物理化学固态电化学光电化学生物电化学量子化学统计热力学溶液电化学(电解质溶液)平衡态电化学热力学。
最新极化曲线的运用与分析

极化的定义
❖ 当电极上有净电流通过时,电极电位显著偏 离了平衡电位的现象叫做电极的极化。
❖ 极化的类型有: 1.电化学极化;2.浓差极化 ; 3.电阻极化 ❖ 极化的结果是:阳极的电极电位往正电位偏
移,而阴极的电极电位往更负的方向偏移。
❖ 发生电化学反应的推动力是过电位,也就是极化过程的发 生。对于同一条件下的电极体系,通过的电流密度越大, 电极电位偏离平衡电位的绝对值也越大,将电极与电流密 度的关系绘成的曲线,称为极化曲线。极化曲线就是利用 给研究电极施加一个过电位来研究 电极的电化学过程。
线性电位扫描
❖ 控制电极电位以恒定的速度变化,同时测量通过电极的电流。它也是暂 态法的一种,扫描速度对暂态极化曲线的形状和数值影响很大,只有当 扫描速度足够慢时才可得到稳态极化曲线。
❖ 线性扫描所得到的电流是双电层充电电流ic与电化学反应电流ir之和。如 果在某电位范围内基本上无电化学反应发生,即相当于理想极化电极, 主要反映双电层电容与电位的关系。当存在电化学反应时,扫描速度快, ic相对大;扫描速度慢,ic相对小。因此,只有当扫速足够慢时,ic相对于 ir可忽略不计,此时才是稳态极化曲线,才真正说明电极反应速度与电位 的关系,才可利用稳态法的公式计算动力学参数(没有浓差极化的情况 下)。
为什么要看-0.2V这个电位?
❖ 1. E=Φ+-Φ-=0.3V (Φ+=0.4V Φ-=0.1V) 2. 氧还原的过电位比较高,一般会
有300mv左右,但此时电流很小, 只有零点几 毫安的电流产生
3.在500mv的过电位下,氧还原反
应才有比较明显电流产生,具有 代表意义。
为什么要比较-0.2V时的电流?
❖ 同理阴极极化曲线也是类似的
极化曲线的测定及应用

极化曲线的测定及应用一、目的要求1.掌握恒电位法测定电极极化曲线的原理和实验技术。
通过测定金属铁在H2SO4 溶液中的阴极极化和阳极极化曲线求算铁的自腐蚀电位、自腐蚀电流和钝化电位范围、钝化电流等参数。
2.了解不同pH值、Cl-浓度、缓蚀剂等因素对铁电极极化的影响。
3.讨论极化曲线在金属腐蚀与防护中的应用。
二、原理Fe在H2SO 4 溶液中会不断溶解,同时产生H2。
Fe溶解:Fe -2e =Fe 2+。
H2析出:2H+ +2e =H2。
Fe电极和H2电极及溶液构成了腐蚀原电池。
其腐蚀反应为:Fe +2H+ = Fe 2+ + H2。
这是Fe在酸性溶液中腐蚀的原因。
当电极不与外电路接通时,阳极反应速率和阴极反应速率相等,Fe溶解的阳极电流I Fe与H2析出的阴极电流I H在数值上相等但方向相反,此时其净电流为零。
I=I Fe + I H=0。
I corr=I Fe=-I H≠0。
I corr值的大小反映净了Fe在H2SO 4 溶液中的腐蚀速率,所以称I corr为Fe在H2SO 4 溶液中的自腐蚀电流。
其对应的电位称为Fe在H2SO 4 溶液中的自腐蚀电位E corr,此电位不是平衡电位。
虽然,阳极反应放出的电子全部被阴极还原所消耗,在电极与溶液界面上无净电荷存在,电荷是平衡的。
但电极反应不断向一个方向进行,I corr≠0,电极处于极化状态,腐蚀产物不断生成,物质是不平衡的,这种状态称为稳态极化。
它是热力学的不稳定状态。
自腐蚀电流I corr和自腐蚀电位E corr可以通过测定极化曲线获得。
极化曲线是指电极上流过的电流与电位之间的关系曲线,即I=f(E)。
图27-1是用电化学工作站测定的Fe在1.0mol/L H2SO4 溶液中的阴极极化和阳极极化曲线图。
ar为阴极极化曲线,当对电极进行阴极极化时,阳极反应被抑制,阴极反应加速, 电化学过程以H2析出为主。
ab为阳极极化曲线,当对电极进行阳极极化时,阴极反应被抑制,阳极反应加速,电化学过程以Fe溶解为主。
极化曲线在电化学腐蚀中的应用

极化曲线在电化学腐蚀中的应用娄浩(班级:材料化学13-1 学号:120133202059) 关键词:电化学腐蚀;极化;极化曲线;极化腐蚀图据工业发达国家统计,每年由于腐蚀造成的损失约占国民生产总值的l~4%,世界钢铁年产量约有十分之一因腐蚀而报废,因此研究金属腐蚀对于国民经济发展和能源的合理利用具有重大意义。
其中电化学腐蚀是金属腐蚀的一种最普遍的形式。
论文分析了电化学腐蚀的机理以及极化曲线的理论基础。
利用测量极化曲线的方法,研究金属腐蚀过程,已经得到广泛的应用。
1.金属腐蚀的电化学原理金属腐蚀学是研究金属材料在其周围环境作用下发生破坏以及如何减缓或防止这种破坏的一门科学[1]。
通常把金属腐蚀定义为:金属与周围环境(介质)之间发生化学或电化学而引起的破坏或变质。
所以,可将腐蚀分为化学腐蚀和电化学腐蚀[2]。
化学腐蚀是指金属表面与非电解质直接发生纯化学作用而引起的破坏。
其反应的特点是金属表面的原子与非电解质中的氧化剂直接发生氧化还原反应,形成腐蚀产物[3]。
腐蚀过程中电子的传递是在金属与氧化剂之间直接进行的,因而没有电流产生。
电化学腐蚀是指金属表面与电子导电的介质(电解质)发生电化学反应而引起的破坏。
任何以电化学机理进行的腐蚀反应至少包含有一个阳极反应和一个阴极反应,并以流过金属内部的电子流和介质中的离子流形成回路[4]。
阳极反应是氧化过程,即金属离子从金属转移到介质中并放出电子;阴极反应为还原过程,即介质中的氧化剂组分吸收来自阳极的电子的过程。
例如,碳钢[5]在酸中腐蚀,在阳极区Fe被氧化成Fe2+所放出的电子自阳极Fe流至钢表面的阴极区(如Fe3C)上,与H+作用而还原成氢气,即阳极反应:Fe - 2e →Fe2+阴极反应:2H+ + 2e →H2总反应:Fe + 2H+ →Fe2+ + H2与化学腐蚀不同,电化学腐蚀的特点在于,它的腐蚀历程可分为两个相对独立并可同时进行的过程。
由于在被腐蚀的金属表面上存在着在空间或时间上分开的阳极区和阴极区,腐蚀反应过程中电子的传递可通过金属从阳极区流向阴极区,其结果必有电流产生[6]。
电极电位及极化曲线测定PPT课件

.
13
❖ 4)同样步骤分别测试扫描速度1 mV/s、2mV/s铜电极试样 的极化曲线。
❖ 5)采用碳钢作为研究电极进行同样的测试。 ❖ 6)同样的步骤,测定采用搅拌后的极化曲线。 ❖ 7)测试结束,依次关闭恒电位仪、推出测试系统。
.
14
实验结果与思考题
❖ 1、记录不同的介质/材料的自腐蚀电位,分析影响因素 有哪些?
相之间的电位差称为电极电位。
❖
单个电极上双电层电位差的绝对值,即当个金属的绝
对电位无法测定。但两个绝对电极电位之差(即相对电极
电位)是可以精确测量的。只要参比电极的电极电位(作
为比较基准的电极电位)是稳定不变的,那么就可以测定
所研究电极电位的相对值。
.
4
实验原理2 电极电位的测量技术
❖ 金属腐蚀研究中的电极电位测量一般有两类:1)测量腐 蚀体系无外加电流作用时的自然腐蚀电位及其随时间的 变化;2)测量金属在外加电流作用下的极化电位及其随 时间的变化。
1用去离子水配制35nacl溶液2用去离子水配制10naoh溶液按照附录1的方法制备铜电极和碳钢电极用游标卡尺测定电极暴露面积1cm分别采用直流数字电压表和恒电位仪附录2测定铜碳钢电极在氯化钠和氢氧化钠溶液中的自腐蚀电位
O
实验二十七、电极电位及 极化曲线测定(4学时)
.
1
目录
1
实验目的
2
实验原理
助电极、饱和甘汞电极为参比电极,分别将其与测试系 统对应的接线柱相连,此时系统恒电位仪上显示的即为 体系的开路电位(自腐蚀电位)。
❖ 3)按启动测试系统软件,设置电解池参数,选择动电位 扫描测试方法。取文件名,设定起始扫描电位为相对开 路电流-200mV,终止电位相对开路电位1.0V,扫描速度 为0.66mV/s(扫描周期1200s),实验结束条件选中 “实验结束”选项。按开始按钮,同时将恒电位仪面板 上的极化按钮打至极化,测试开始。测试结束后,可以 使用Origin软件对数据进行处理。
腐蚀电化学原理第3章极化与混合电位理论ppt课件

• 1、根据实验数据的计算绘出理想极化曲线 • 析氢腐蚀普通丈量氢气发生量 • 吸氧腐蚀普通丈量金属腐蚀量 • 2、实测极化曲线的外推法 • 外推法的优点是可以防止繁杂的实验操作,只需测出实测
极化曲线的数据,经过作图就可得到理想极化曲线。缺陷是在 小电流密度范围内用外推法作图时会产生较大误差,而且它只 适用于活化极化控制的体系。
Ic
orr
e,c
e,a
Pc PA R
3.5.2 伊文思腐蚀极化图的运用
〔1〕腐蚀速度与腐蚀初始电位差的关系
〔2〕极化性能对腐蚀速度的影响
PC PA
PA PC
R PA R PC
3.5.3 多电极腐蚀电池的图解计算
图解方法,是以以下规律为出发点:
〔1〕短路的多电极系统中各个电极 的电极电位都等于该系统的电极电位。
溶液为含有不同浓度双氧水的溶液为3%氯化钠溶液,电 极体系为锌、铝、镉、铅、铂组成的五电极腐蚀体系。
添加H2O2的浓度为什么会改动Al、Cd的极性?
溶液为含有0.15%过氧化氢的3%氯化钠溶液,电极体 系为锌、铝、镉、铂组成的四电极腐蚀体系,锌、铝、 镉的电极面积都为4cm2.
添加Pt片的面积为什么会改动Al、Cd的极性?
3.4.1 活化极化控制的腐蚀体系的极化行为
3.4.2 阴极过程由浓度极化控制时腐蚀金属 电极的极化
3.4.3 理想极化曲线与实测极化曲线
• 理想极化曲线:是指理想电极上得到的曲线。理想电 极是指电极上只发生一个电极反响,而且处于极化形 状时电极上依然只发生原来的那个电极反响的电极。
• 对于理想电极,开路电位就是它的平衡电位,当它作 为阳极时只发生原有的阳极反响,作为阴极时只发生 原有的阴极反响。这样当一个理想电极进展阳极极化 而另一个理想电极进展极化时,阳极极化曲线和阴极 极化曲线将从各自的理想电极的平衡电位出发,沿不 同的途径开展,它们的交点对应的电位就是它们的混 合电位,过了交点以后他们依然按各自的方向继续延 伸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•极化曲线与镀层质量的关系
区域Ⅲ:为高电流密度区域,电流密度超过了极限电流密度 。这时阴极开始析氢,镀层疏松,严重时出现烧焦现象。
•镀锌溶液的筛选
1一Zn0+NaOH
2一Zn0+NaOH+三乙醇胺+乙二 胺+六次甲基次胺+明胶 3一Zn0+KOH+三乙醇胺+KCl + 添加剂(环氧氯丙烷与六次甲基四胺 的反应物) 4一Zn0+NaCN +
•镀锌溶液的筛选
曲线3:使用复合添加剂 的镀液,在低电流密度
区,阴极极化便较大,
镀层获得细致结晶。 高电流密度,极化 作用减小,不存在极限 电流密度,工作电流范 围大大增加。
图2.几种碱性镀锌液的阴极极化曲线
•增加剂的影响
1-没有添加剂 2-添加硫脲
图3. 硫脲的影响
•增加剂的影响
0.25A/dm2以下时,添加硫脲极化度稍有增大; 0.25~2A/dm2,极化度反而减小; 2A/dm2以上,极化度又增大。 因而,欲在加硫脲的镀液内获得细致的镀层,必须
···
欢迎批评指正
2018/7/6
A
Cu2+浓度
+
镀 件
ee- Cu2+ e- Cu2+ e- Cu2+
0
Cu2+ Cu2+ Cu2+
Cu2+ Cu2+ Cu2+ Cu2+
距阴极的距离
Cu2+ Cu2+
A
Cu2+浓度
+
ee 镀e e Cu2+ 件 e- 2+ e- Cu
0
ห้องสมุดไป่ตู้
Cu2+ Cu2+ Cu2+
NaOH+Na2S
图2.几种碱性镀锌液的阴极极化曲线
•镀锌溶液的筛选
曲线1:在工作电流范 围内极化很小,镀层
呈疏松海绵状。
图2.几种碱性镀锌液的阴极极化曲线
•镀锌溶液的筛选
曲线2、4:阴极极化作 用在工作电流范围内已 比曲线1有明显增大, 但其后便是阴极大量析 氢。电流密度范围小。
图2.几种碱性镀锌液的阴极极化曲线
距阴极的距离
Cu2+ Cu2+
此时的 外加电流
A
Cu2+浓度
+
极 限 电 流 密 度
e e- e镀 - e 件e e e- e0
阴极附近Cu2+ 浓度等于0
Cu2+
Cu2+ Cu2+ Cu2+ Cu2+
距阴极的距离
Cu2+ Cu2+
采用大的电流密度。
pH值与温度的影响
pH=7
pH=9
pH=11
图5.pH值对焦盐镀铜液阴极极化 曲线的影响
图6.温度对某焦磷酸盐铜-锡合金 镀液阴极极化曲线的影响
pH值与温度的影响
pH=7
pH=9
pH=11
pH增大,低电流下, 极化增大。
但pH值不可过高,否
则在较低的电流密度下 便有一明显的极限电流 ,使镀层容易“烧焦” 。
· · ·
极化曲线在电镀中的应用
2018/7/6
•极化曲线在电镀中的应用
在电镀中,镀层质量与电极极化有极其密切的联系,
如镀层结晶的细致程度、光亮度、整平度与分散能力等评 定镀层质量的主要指标,都直接受电极极化行为的影响, 而对电极的极化行为评价,则依赖于极化曲线的分析。
•极化曲线与镀层质量的关系
Cu2+ Cu2+ Cu2+ Cu2+
距阴极的距离
Cu2+ Cu2+
A
Cu2+浓度
+
e e- e镀 - e 件e e e- e- Cu2+
0
Cu2+ Cu2+
Cu2+ Cu2+ Cu2+ Cu2+
距阴极的距离
Cu2+ Cu2+
A
Cu2+浓度
+
e e- e镀 - e 件e e e- e0
Cu2+
Cu2+ Cu2+ Cu2+ Cu2+
•极化曲线与镀层质量的关系
(a)阴极极化小时,活性点少 (b)极化大时,活性点多
•极化曲线与镀层质量的关系
区域I:低电流密度,极化小,镀层结晶比较粗糙,表
面颜色发乌。
•极化曲线与镀层质量的关系
区域Ⅱ:电流密度极化较高,电化学极化和浓差极化共同
控制。这时得到的镀层颜色均匀光亮,结晶细致,并且表
现出良好的延展性。
图5.pH值对焦盐镀铜液阴极极化 曲线的影响
pH值与温度的影响
温度升高,金属
离子的扩散速度加快
,降低了阴极浓差极 化,因而温度过高对 镀层质量有不利影响 。
图6.温度对某焦磷酸盐铜-锡合金 镀液阴极极化曲线的影响
总结
提高镀层的质量:增大阴极极化度。
通过极化曲线可从理论上直观地分析各种 工艺条件对镀层质量的影响,并进行选择,然 后再结合电镀生产实践确定最优的工艺参数。
