检测系统分析性能验证及确认
临床检验方法确认与性能验证

(三)方法的选择
足够特异、灵敏、精密度好 校准可溯源 有实验证据(杂志、自) 与其他检验项目相比有点何在
(四)常用物质
1.标准物质/参考物质( reference material ) 2.校准品( calibrator ) 3.质控物/控制品( control material )
3.基于生物学变异的规范。
用法
CVA<1/2CVI BA<1/4(CVI2+CVG2)1/2 CV仪器之间<1/3CVI TE<1.65CVA+BA(α<0.05) TE<2.33CVA+BA(α<0.01) 不精密度CV: 用于室内质控精密度分析 用于方法学性能验证:1.与客观比较 2.与厂家比较 偏差Bias:用于方法学比较,即考核真实度。 允许总误差Tea:用于EQA
方法验证
除应验证仪器的安装和检验程序的操作外 对于定量方法
应验证:测量精密度:包括重复性和再现性、患者结果与以前方法 或参考程序之间的一致性、在整个分析测量范围内被测量的回收、 高浓度的携带污染、干扰或非特异性(溶血、脂血、黄疸、容器 添加剂、药物)、参考区间。
对于定性方法
应验证阳性和阴性及临界值上和下标本的再现性和重复性、患者结 果的一致性、携带污染、干扰或非特异性。
5.已发表专业推荐
6.基于法规和EQA的质量规范
(七)具体操作
内容 常用的方案 具体方案
方法确认
内容: 总是包括可报告范围、精密度、准确度和参 考区间。某些研究还应包括检出限(或灵敏 度)、特异度、干扰和回收以及校准品确认。 CLIA规则规定对不同复杂程度分类的方法 需要确认不同的特征。对不太复杂的方法, 要求很少的研究。对于自建检测系统或实验 室修改的方法需要更多的实验。
临床检验方法确认与性能验证

5.已发表专业推荐
6.基于法规和EQA的质量规范
(七)具体操作
内容 常用的方案 具体方案
方法确认
内容: 总是包括可报告范围、精密度、准确度和参 考区间。某些研究还应包括检出限(或灵敏 度)、特异度、干扰和回收以及校准品确认。 CLIA规则规定对不同复杂程度分类的方法 需要确认不同的特征。对不太复杂的方法, 要求很少的研究。对于自建检测系统或实验 室修改的方法需要更多的实验。
1.标准物质
概念:又称参考物质( reference material ),是一类充分均匀,并具有一 个(或多个)确定的特性值的材料或物质,标准物质的定值结果一般表示为: 标准值 ± 总不确定度。 “ 标准物质证书“是介绍标准物质的技术文件,是 研制单位向用户提出的质量保证书和使用说明。附有证书的标准物质称为有证 标准物质( certified reference material, CRM ),其特性值由建立了溯 源性的程序确定,可溯源至准确复现该特性值的计量单位,且每个标准值都附 有给定置信水平的不确定度。 作用:校准仪器设备、评价测量方法,或给其它物质赋值 分类:一级标准物质( primary reference material ):稳定、均一,采 用高度准确、可靠的若干方法定值,可用于校准决定性方法及为二级标准物质 定值。在我国,一级标准物质是测量准确度达到国内最高水平的有证标准物质, 由国家技术监督局批准、颁布并授权生产。如: 人血清无机成分分析标准物 质( GBW09135 )和血清胆固醇标准物质( GBW 09138 )。二级标准物 质( secondary reference material ):用一级标准物质校准,参考方法 定值。如: 红细胞微粒标准物质 — GBW ( E ) 090001 、胆红素标准物 质 — GBW ( E ) 090002 、氰化高铁血红蛋白溶液标准物质 — GBW ( E ) 090004 和纯化血红蛋白标准物质 — GBW ( E ) 090011 。
2024年临床实验室检测系统方法确认与性能验证标准操作

2024/2/29
改进措施制定与实施
对发现的问题进行深入分析,找出根本原因 ,为制定有效的改进措施提供依据。
经验总结与分享
对实验室工作中遇到的问题和解决方法进行 总结和分享,促进实验室人员之间的交流和 学习,避免类似问题的再次发生。
24
06
临床实验室检测系统方法确认与性 能验证实践案例
2024/2/29
04
室内质量控制
通过设立质控品、重复实验等 方式,监控实验结果的稳定性 和准确性。
2024/2/29
22
质量保证体系建立与实施
建立质量管理体系
持续改进
依据国际或国家相关标准,建立实验 室质量管理体系,明确质量方针、目 标、职责和程序。
通过对实验室工作过程和结果的分析 ,识别存在的问题和不足,制定改进 措施并持续跟踪验证,实现实验室质 量的持续改进。
未来临床实验室将更加注重检测结果的准确性 和可靠性,对方法确认与性能验证标准的应用 将更加广泛。
随着大数据和人工智能技术的应用,临床实验 室将更加注重数据分析和挖掘,以提高检测结 果的预测性和精准性。
31
对临床实验室的建议和要求
临床实验室应加强对方法确认与性能验证标准的学习 和应用,确保检测结果的准确性和可靠性。
3
在操作过程中,注意个人防护和安全措施。
2024/2/29
18
操作步骤与注意事项
避免交叉污染和样品混淆,确保实验 结果的准确性。
如遇异常情况或故障,及时停止操作 并寻求专业支持。
2024/2/29
19
操作后处理与记录
结果解释与报告
根据实验需求和目的,对检测结 果进行合理的解释和评估,并编 写实验报告或记录。
临床实验室检测系统方法确认与性能验证标准操作规程

4.2检测系统的性能验证时机、周期及相关要求:
4.2.1验证的时机和周期。
4.2.1.1新的检测系统在投入使用时需按4.பைடு நூலகம்条款的要求对其各项性能进行全面的验 证
4.2.1.2其他情况:
.
谢谢
.
4.1 检测系统验证的内容:
4.1.1定量项目系统验证内容:正确度、精密度、分析测量范围(AMR)、临床可报 告范围(CCR)和生物参考区间
4.1.2定性、半定量项目检测系统验证的内容:符合率、检出限、精密度、cutoff值 评审(精密度、cutoff值评审适用于ELISA法试验),其中尿液干化学分析仪性能验证 内容至少应包括阴性和阳性符合率;
a) 如遇到重大投诉针对检测系统有质疑时,需要有针对性的进行验证;
.
b) 仪器维修后、重要零件更换后后等需要对系统的主要性能指标重新验证。 c) 仪器长距离搬动后(如运输至外地)需按4.1条款对该检测系统各项性能进行全面验证; 短距离搬动后(如在同一工作间内的位置发生变更)则只需对其精密度和正确度进行验证。 d)检测系统中任何组成部分发生改变(如试剂、仪器等),均需对检测系统进行重新验证 4.2.2检测系统性能的评审:每12个月,需要对检测系统的如下性能指标进行评审:用室内质控 的结果评审其精密度,用参加PT、EQA活动的结果评审其正确度或符合率等. 4.2.3其他要求 4.2.3.1要在项目执行之前进行验证,以确保系统符合制造商的声明 4.2.3.2实验室应用定值的控制品进行仪器的校准和质量控制。可以使用商业化的质控材料,如 果没有商业化的质控材料,也可使用已知阴阳性的材料 4.2.3.3验证过程中的每个批次都要运行质控品 4.2.3.4新检测系统的可接受性取决于对所有验证结果的比较和审核 4.2.3.5经过维修和预防性维护的仪器设备应该运行内外部质控品重新进行确认
实验室检测系统性能验证

实验室检测系统性能验证Hessen was revised in January 2021实验室检测系统性能验证检测系统是指完成一个检验项目所涉及的仪器、试剂、校准品、检验程序、保养计划等的组合。
随着检验医学的发展和对质量要求的提高,人们开始认识和关注检测系统的重要性。
新添置的检测系统,虽然仪器厂商已经提供了仪器性能的初步参数,但由于地区、实验室之间的差异,个实验室在仪器正式用来检测患者样品和发检验报告前,应重新进行性能评价。
这是保证检验质量的一个重要措施,也是实验室认可的要求。
实验室如使用的检测系统是公司的系列产品,即使用的是厂商提供的原检测系统,则只需做基本的性能验证。
具体方法如下:一.精密度验证1.批内精密度:根据CLSI EP15-A文件,取2个水平的标本,同一批次尽可能短时间内连续重复测定20次,CV值必须小于或等于厂家的要求。
标准差=方差的算术平方根=s=@sqrt(((x1-x)^2 +(x2-x)^2 +......(xn-x)^2)/(n-1));CV%=SD/mean(x1...xn)*100%.2.批间精密度:参照CLSIEP5-A文件,选取正常水平(Citrol-1)、异常水平(Citrol-2),分别分装成5份,冻存于-20℃冰箱内。
每天取出2个水平的质控,分别测定2批次,每批次测2遍,2次间隔大于2h,连续测定5天,计算SD和CV,CV值必须小于或等于厂家的要求。
二.准确度验证分别取2个水平的定值质控品(Citrol-1,Citrol-2)验证凝血四项的准确度,D-二聚体专用质控品验证其准确度,每个结果重复测定3次,结果应在质控品标识的可控范围内,偏倚应在厂家标识的±10%范围内;同时结合当年卫生部临检中心凝血室间质量评价结果进行评价。
三.检测限验证只验证以浓度为结果的项目,将FBG和D-Dimer的标准品分别使用配套的OVB 稀释液稀释到厂家标识的浓度检测底限值附近,重复检测10次,记录结果,计算CV,应在厂家标识的±20%范围内,该浓度即为该项目的检测下限。
临床检验方法确认与性能验证

概念: 分类:定值质控品
非定值质控品 检测系统配套的控制品 正确度控制品
质控品概念
具有与检测过程相适应的特性,其成份与检 测样本的基质相同或相似。应使用充分均 一 和稳定的质控物, 其瓶间变异 必须小于 监测系统预期的变异,其常规检测应有助于 确认报告范围。
定值质控品
d.总误差 总误差(total error,TE):能影响分析准确度的确定误差的组合【CLSI EP15-A2】,即偏倚和不精密度的和。 基于科学原理的理论或确定值 基于一些国家或组织的实验工作的指定值或认证值 基于科学或工程组织赞助下合作实验工作中的同意值或认证值。 以上三点不能获得时,则用可获得的期望,即规定测量总体的均值。
(二)检验方法分类
决定性方法( definitive method ): 经 详尽研究尚未发现 不准确度或不确定性原 因的方法;
参考方法( reference method ): 经详 尽研究证实其不准确度与不 精密度可以忽 略的方法;
常规方法( routine method ): 可满足 临床或其他目的需要的日常使用的方法。
(五)一些基本术语
准确度 正确度 精密度 溯源性
a.准确度与误差 准确度(accuracy)的完整表达应是检测准确度(accuracy of measurement):检测结果与被测量真值或约定真值
(可接受参照值)之间的一致程度(GB/T3358.1、GB/T6379). 可接受参照值:用来做比较的经协商同意的值,它可以是理论值(真值),赋值,公认值或由程序确定的值。准确度不
(三)方法的选择
足够特异、灵敏、精密度好 校准可溯源 有实验证据(杂志、自) 与其他检验项目相比有点何在
三大系统验证关于性能确认的部分解析
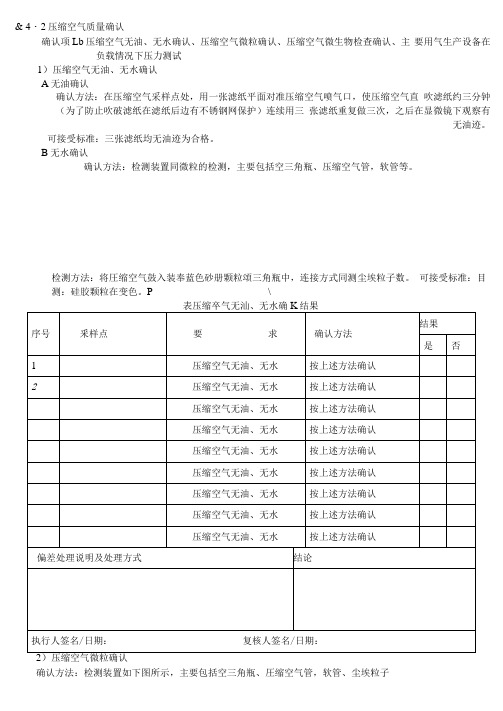
& 4・2压缩空气质量确认确认项Lb压缩空气无油、无水确认、压缩空气微粒确认、压缩空气微生物检查确认、主要用气生产设备在负载情况下压力测试1)压缩空气无油、无水确认A无油确认确认方法:在压缩空气采样点处,用一张滤纸平面对准压缩空气喷气口,使压缩空气直吹滤纸约三分钟(为了防止吹破滤纸在滤纸后边有不锈钢网保护)连续用三张滤纸重复做三次,之后在显微镜下观察有无油迹。
可接受标准:三张滤纸均无油迹为合格。
B无水确认确认方法:检测装置同微粒的检测,主要包括空三角瓶、压缩空气管,软管等。
检测方法:将圧缩空气鼓入装奉蓝色砂册颗粒頌三角瓶中,连接方式同测尘埃粒子数。
可接受标准:目测:硅胶颗粒在变色。
P \确认方法:检测装置如下图所示,主要包括空三角瓶、圧缩空气管,软管、尘埃粒子偏差处理说明及处理方式结论序号 采样点确认内容 要求 确认方法每次实测数(个/m3)结果 123是 否1微粒 $0. 5 u m 同上标准 按上述方2数 △5 P m同上标准 法确认3微粒 $0. 5 Mm 同上标准 按上述方4数$5 u m 同上标准 法确认5 微粒 $0. 5 Mm 同上标准 按上述方6数 △5 u m 同上标准 法确认7微粒 $0. 5 u m 同上标准 按上述方8数 △ 5 P m 同上标准 法确认9微粒 $0. 5 um 同上标准 按上述方10 数 $5 u m 同上标准 法确认11 微粒$0. 5 um 同上标准 按上述方12数 $5 P m同上标准 法确认13 微粒DO. 5 u m 同上标准 按上述方14数$5 P m 同上标准 法确认15 微粒$0. 5 M m 同上标准 按上述方16数$5 u m 同上标准 法确认警报限^0.5nm W1760000 个/m= ^5 Pm W14500 个/灵 纠偏限M0・5um ^2350000个/m‘,^5umW20000 个/m‘J 援受标范:法定限^0. 5 umW3520000 个/m= $5 Um W29000 个/長计数器等。
检测系统性能验证

主要用于确认和验证声明的性能,也可通 过该方案获得检测系统的分析性能特征
实验过程繁琐,统计过程也比较复杂,实 用性不强
.
35
EP5-A2
国内实验室往往未作评价前已开始使用 该仪器,对初步性能有一定了解
而且许多配套检测系统的分析性能已得 到大量文献证实
这种情况下完整而繁琐的评价显然没有 必要
.
12
线性范围
线性范围即定量检测项目的分析测量范围。 指患者标本未经任何处理(稀释、浓缩或其 他预处理),由检测系统直接测量得到的可 靠结果范围,在此范围内一系列不同样本分 析物的测量值和其实际的浓度(真值)呈线 性比例关系。
.
13
参考区间
对一个参考个体进行某项目测定得到的 的值为该个体的参考值,所有参考抽样 组的各个参考值合起来即为参考值范围。
一、样本准备 1、来源 新鲜患者标本 2、储存 最好是当天收集当天测定,否则按照待
测成分的稳定性来选择储存条件和时间。 3、样本数 每天5个,连续4天,共20个样本。 4、浓度 应分布整个线性范围,不易得到的浓度
可用混合血清。尽可能在线性范围内均匀分布, 覆盖临床医学决定水平。
.
27
.
28
EP15-A
依据所有参考值的分布特性以及临床使 用要求,选择合适的统计方法进行归纳 分析后,确定参考值范围中的一部分为 参考区间,区间的两端为参考区间的限 值,分为低参考限和高参考限。
.
14
参考区间
一般情况下,常选择95%分布范围的大 小表示参考值区间。例如:从2.5%位数 到97.5%位数所在的区间。
很多地方用“参考范围”表示“参考区
验证方案: CLSI C28-A2
.
50
生化检测系统性能验证

样本浓度的选择
1.精密度大小和样品浓度有关 样品浓度高时, 虽然标准差的绝对值
较大,但变异系数往往变小。 所以评估精密度时,建议评估高低二个
浓度的精密度。 当二个浓度的精密度有显著差异时,建
议增加为三个 浓度。
样本浓度的选择
2. 所选浓度应在测量范围内有医学意义的值,即 至少有一个浓度在医学决定水平(medical decision levels)左右。 不要为了得到较小的精密度,都选用较高 值的样品,甚至超出测量范围。
CLIA ’ 88允许误差范围不涉及 的项目:
EQA的允许误差 试剂说明书提供
二. 正确度验证实验
基本概念
准确度(accuracy)指检测结果与被测 量真值之间的一致程度。
正确度(truness)指大批检测结果得到 的平均值与真值的一致程度。通常用统 计量“偏倚”来表示。
偏倚(bias)指测量结果的预期值与可 接受值间的差异。以检测计量单位或百 分率表示,即平均值与参考值的差异。
基本概念
误差(error)指对于真值或对于可接受 的、预期真值或参考值的偏离,分为随 机误差和系统误差。
总误差(total error)指某实验室用某方 法在多次独立检验中分析某样品所得各 个结果值与靶值之差在一定置信区间内 的最大值。包括随机误差和系统误差, 是不准确度的估计值。
文件依据
CLSI 颁布的EP15-A文件《用户对精密度 和准确度性能的核实指南》
如果测定方法本身存在明显的携带污染,应根 据实际情况采取恰当措施尽量避免对测定结果 的影响。
线性范围结果分析
以预期值为横坐标,以实测值为纵坐标 进行线性回归,
得到直线回归方程Y=aX+ b , a在0.97~1.03范围内,r2 ≥ 0.95 。
浅谈医学实验室检测系统的性能验证

浙江省中医院徐淑贞陈明涛姚轶敏摘要为了提高医学实验室的质量和能力,规范实验室检测系统的性能验证过程,文章从制定计划,确定方案,执行方案三个方面详细的介绍了检测系统分析性能评价的程序。
医学实验室为保证检验结果的可靠有效,最大程度的得到质量和能力方面的认可,近年来各实验室着力推行检验过程的规范化和标准化,用审视的态度评价日常的操作行为,其中对检测系统的验证评价尤其重视。
检测系统的验证是指对实验室新购置的已被政府有关部门认可了其分析性能的检测系统,实验室在投入进行常规病人标本检测前,需对厂商提供的性能资料中的几个分析性能进行实验确认该检测系统是否具有预期的水平。
对检测系统性能验证的内容一般包括精密度,正确度,分析测量范围,临床可报告范围,生物参考区间。
本文就实验室如何开展验证工作做了以下几点探讨:1 制定验证计划1.1 实验室管理层应制定计划,用于定期监测并证实检测系统已适当校准处于正常功能状态。
同时还应有文件化的预防性维护计划并记录[1]。
1.2 实验室技术负责人和各专业组组长共同负责检测系统分析性能评价实验方法的设计,专业组组长负责组织检测系统的分析性能评价实验并成立工作小组。
2 制定验证方案2.1 确认检测系统:检查一个项目检测所涉及的仪器、试剂、校准品、操作程序、质量控制程序、保养计划等组组成的检测系统,若手工操作还包括具体操作人员都准备到位。
2.2 确认性能验证的内容:定量项目包含精密度,正确度,分析测量范围,临床可报告范围,生物参考区间;定性、半定量项目包含检测结果符合率,检出限。
2.3 确认验证时机和周期:实验室对新购置的检测系统在正式用于检测标本前,需要对检测系统的主要性能和指标进行验证;系统每运行12个月后,需要重新对检测系统的主要性能和指标进行验证;遇到重大投诉针对检测系统有质疑时,需要有针对性的进行验证;仪器维修后、重要零件更换后、试剂改变后等需要对系统的主要性能指标重新验证;仪器长距离搬动后,需要对检测系统的主要性能和指标进行验证,从而保证检验结果的可靠性,最大程度的满足临床要求。
5 临床分子检测:性能验证与性能确认

CLIA不要求,但CAP要求对定量进行LOD验证, 60个数据点(例如在预计的检测下限范围内5个样本,12次重复),研究时间5天, 使用在5天内收集的20个数据点 使用probit回归分析(或如果采用LOB研究,则使用SD加置信限) 定性检测:检测1个对照/天,共20天,或双份重 定性检测:最少3个浓度(LOD、LOD+20%、LOD-20%),获得40个数据点。 复/天,共10天。 定量检测:最少3个浓度(高、低和LOD),双管重复检测1~2次/天,检测20天, 定量检测:2个浓度的每1个检测2个样本(共4个 计算批内、批间、每天之间SD和/或CV,以及总的变异 样本),加1个对照,检测20天,或检测2个浓度, 3管重复,检测5天 CLIA不要求 未建议最小样本数量;检测样本相关的干扰物质(溶血、脂血、黄疸等)和遗传 上相似的微生物或具有相同临床表现同一样本位点可见到的微生物,加入低浓度 待测物质。采用t检测统计分析。 使用比较方法和拟评价方法至少5天进行双管重复检测,典型的40个以上的样本, 进行xy散点回归统计分析;采用Bland-Altman 差异描点,加偏倚测定; 使用kappa 统计学分析 % 符合率 如果在健康个体靶核酸不会存在,则属于定性检测,参考范围为“阴性”或“未 检测到”,则不需要进行参考区间研究。对于定量检测,参考区间可报告为低于 最低检测限(LOD或LLOD);对于某些待测物,参考区间可能是一个临床决策限 (a clinical decision limit);如果检测的预期用途限于已知被检测的待测物是阳性 的患者,则不适用参考区间。
性能验证与性能确认的实际操作区别
性能指标及所建议的 研究
可报告范围, 线性范围研 究(定量检测) 分析敏感性,测定下限 (LOD)研究 精密度, 重复实验
检测方法的验证及确认该怎么做

检测方法的验证及确认该怎么做检测方法的验证及确认当自己的实验室将标准方法引入到自身的检测工作时,则应对引入的标准方法进行验证,并正确有效地运用。
方法的确认应广泛全面,以满足预定用途或应用领域的需要。
标准方法确认准则是:所用的设备、环境条件、人员技术等。
以证明实验室能够正确使用该新标准实施检测过程。
标准方法的确认或是通过核查方式,并提供客观证据,以证实某一特定预期用途的特殊要求得到满足。
用于确定某方法性能的技术宜是下列情况之一,或是其组合:a.使用参考标准或标准物质(参考物质)进行校准;b.与其他方法所得的结果进行比较;c.实验室间比对;d.对影响结果的因素作系统评审;e.根据对方法的理论原理和实践经验的科学理解,对所得结果不确定度进行的评定。
实验室应按照制定的相关工作程序选择上述方法进行验证,确认将要使用的检测方法是否满足要求,在确认方法确实可行后,方可投入使用。
对于方法确认试验来说主要有:变更后的标准确认和新方法的确认。
在确认时应该做方法的标准曲线、添加标准回收率试验、最低检出限试验和精密度试验等,并考虑方法的特异性和耐用性,如果需要时还应进行不确定度评估。
应用实验数据真实地证明方法的适用性、准确性和灵敏性。
非标方法的确认在《实验室资质认定评审准则》条款中规定:实验室自行制订的非标方法,经确认后,可以作为资质认定项目,但仅限特定委托方的检测。
非标准方法是指未经相应标准化组织批准的检测/校准方法。
只有在尚无国家标准、行业标准、地方标准时,实验室方可自制非标检测方法,应经过确认:a、从理论到实际对方法的理解;b、使用标准物质或参考标准进行校准;c、与不同方法所得的结果进行比较;d、实验室间的比对试验;e、结果不确定度评定。
必要时对方法确认过程得到的测量值是否满足顾客的技术要求进行评审,这些值可包括:测量结果的不确定度、检出限、方法的选择性、线性、重复性限、复现性限、抵抗外来影响的稳健性和抵抗来自样品的基体干扰的交互灵敏度,可根据具体方法确定。
检测系统分析性能验证及确认

方法精密度分析方案-结果汇总
仪器名称:
浓度水平① 项目
精密度CV% 允许范围 判定结果 验证值 判定结果 精密度CV% 允许范 围
日立7600-210
浓度水平②
判定结果 验证值 判定结果
CA
CV批内 CV总
0.77% 1.41% 1.20% 1.38% 1.59% 2.56%
•
——(参考WS/T 406-2012《临床血液学检验常规项目分析质量要求》)
临床血液学
• • 日间精密度 试验方案
• 日间精密度以室内质控在控结果的变异系数为评价指标,使用Sysmex配套质
控品(低值、中值、高值)当前批号累积的变异系数,与允许的变异系数进 行比较,判断结果是否接受。 • ——(参考WS/T 406-2012《临床血液学检验常规项目分析质量要求》)
•检测限(detection limit):分析程序具有适当的确定检出的分析物的最小浓度或量。检 测限依赖于空白读数大小。
性能验证的实施过程
对检验程序的性能验证涉及到多方面工作,为了得到可靠结果,实验 室负责人或实验主持人应对此项工作有一个概括了解,先制定一个方案, 包括如下工作:
1、性能验证项目的选择、质量目标确定、性能验证方案制定及实施工 作计划; 2、实验前准备(人员培训、仪器维护及校准、样本留取及制备);
•
EP10 A2. Preliminary Evaluation of Quantitive Clinical of Laboratory Methods; Approved Guideline—Second Edition.
性能验证相关的基本概念
检测系统分析性能验证与确认

性能验证相关的基本概念
•线性(linearity):检测样本时,在一定范围内可以直接按比例关系得出分析物含量的 能力。
•总误差(total error):实验室用某方法在多次独立检测中分析某样品所得各个结果值与 靶值之差在一定置信区间内的最大允许范围。
•灵敏度(analytical sensitivity):校准曲线的斜率,即对于规定量的变化分析程序产生 信号的变化。
•批(Run):在检测系统真实性和精密度稳定的间隔期,一般不超过24小时或不少于2小 时。
•正确度(trueness):无穷多次重复测量所得量值的平均值与一个参考量值间的一致程度 。与系统测量误差有关,与随机测量误差无关,以偏倚(Bias)表示。
•准确度(accuracy):单次检测结果与参考值间的一致程度,以总误差(TE)表示。
•判断临床检验结果精密度、正确度和准确度水平高低的指标,或临床检 验结果应达到的精密度、正确度和准确度要求,通常用不精密度、偏倚和 总误差来表示。
设定质量目标的层次模式和方法
质量目标
精密度验证
•采用2个浓度的质控物,每天分析1个批次,每个浓度重复检测4次,连 续5天。数据经过离群值检验,收集2×20=40个有效数据,并通过统计 分析评价方法计算总精密度和批内精密度,与允许范围进行比较,判断 结果是否接受。
• EP5-A3 .Evaluation of precision of quantitative measurement procedures; approved guideline-third edition. 2014
• EP15-A3. User verification of precision and estimation of bias;approved guideline-third edition.2014
检测系统方法分析性能验证评估方案

线性范围验证
• 验证方法
1、样本要求:依照CLSI EP6-A文件的要求,样品必须与真 实标本尽可能相似,若难以收集到低值样品,可收集高值样 品,用低值样本稀释成系列不同浓度的评价样品。最好有5个 或以上的系列浓度的实验样品,数据点数不得低于4个,浓度 范围遍布整个预期可报告范围。
2、样本准备:将高值标本(H)与低值样本(L)分别按1L、 0.75L+0.25H、0.5L+0.5H、0.25L+0.75H、1H关系配置成系 列样本。
该项目的允许误差范围。 ● 判断标准
批内精密度CV%应小于1/4总允许误差(TEa)。 批间精密度CV%应小于1/3总允许误差(TEa)。 如果批内精密度、批间精密度小于允许范围的,验证通过。 如果批内精密度、批间精密度大于验证值,精密度验证未通过,重新 验证或与厂家联系并取得帮助。
2
正确度评价
正确度评价
3
线性范围验证
线性范围验证
• 线性范围是指系统最终的输出值(浓度或活性)与被分析 物的浓度成正比的范围。
分析测量范围:直接测量标本,而不需要任何的稀释、浓缩 或者其它预处理等过程下,测量结果总误关符合要求的分析 物浓度的范围
线性范围验证
• 文件依据 • CLSI颁布的EP6-A文件《定量测量方法的
1
精密度评价
精密度评价
• 精密度:在规定条件下获得的独立测量结果之间的接近程度。 重复性是指在相同条件(时间、校准、操作者、仪器等)下获
得的精密度,即所谓的批内精密度;
中间精密度是指在一种或几种条件因素发生变化,但在同一实 验室内获得的精密度。
精密度评价
● 实验方法 每天应进行正常的室内质量控制,在控后方可进行精密度的评价 重复性 选择具有医学决定水平的高低值标本,按规定的操作方法,在较
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.5血液分析仪的性能验证内容至少应包括正确度、精密 度、可报告范围等。
CNAS-CL43:2012《医学实验室质量和能力认可准则在临床血液学检验领域的应用说明》
• WS/T 403-2012《临床生物化学检验常规项目分析质量指标》 • WS/T 406-2012《临床血液学检验常规项目分析质量要求》 • WS/T 408-2012《临床化学设备线性评价指南》 • WS/T 492-2016《临床检验定量测定项目精密度与正确度性能验证》
• EP5-A3 .Evaluation of precision of quantitative measurement procedures; approved guideline-third edition. 2014
• EP15-A3. User verification of precision and estimation of bias;approved guideline-third edition.2014
• EP10 A2. Preliminary Evaluation of Quantitive Clinical of Laboratory Methods; Approved Guideline—Second Edition.
性能验证相关的基本概念
•精密度(precision):在规定的条件下,对同一或类似被测对象重复测量所得示指或测 得值间的一致程度。精密度的度量通常以不精密度(SD、方差或CV)表示。
• EP9-A2. Method Comparison and Bias Estimation Using Patient Samples;Approved Guideline—Second Edition
• EP6 A. Evaluation of the Linearity of Quantitative Measurement rocedures:A Statistical Approach; Approved Guideline
5.5检验方法和程序的分析性能验证内容至少应包括:检 出限,精密度(包括重复性和中间精密度)、符合率,并 应明确检验项目的预期用途,如筛查、诊断、确认。
CNAS-CL39:2012《医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明》
性能验证项目的选择(二)
5.5尿液干化学分析仪性能验证的内容至少应包括阴性和 阳性符合率
•批(Run):在检测系统真实性和精密度稳定的间隔期,一般不超过24小时或不少于2小 时。
•正确度(trueness):无穷多次重复测量所得量值的平均值与一个参考量值间的一致程度 。与系统测量误差有关,与随机测量误差无关,以偏倚(Bias)表示。
•准确度(accuracy):单次检测结果与参考值间的一致程度,以总误差(TE)表示。
LDH 乳酸脱氢酶性能特征(罗氏)-1
LDH 乳酸脱氢酶性能特征(罗氏)-2
ISO 15189认可准则的要求
性能验证与确认的区别
CNAS CL02:2012 5.5.1.3
性能验证项目的选择(一)
5.5检验方法和程序的分析性能验证内容至少应包括正确 度、精密度和可报告范围。
CNAS-CL38:2012《医学实验室质量和能力认可准则在临床化学检验领域的应用说明》
检测系统分析性能验证及确认
------
·
《 论 语
卫 目所涉及的仪器、试剂、校准品、操作程 序、质控品、样品、质量控制、保养计划、操作者等的组合。
• 检测系统的用途:为患者提供准确的检验结果。
• 要记住:单单一个试剂盒上的所谓分析性能,一定不就是 试剂盒的!因为只有试剂没有仪器的合作,就没有这些分 析性能!
• 同样,仪器厂商宣传的那些分析性能一定是在该仪器上使 用了某个厂商的试剂盒才具有的!
• 因此所有的分析性能一定是一个检测系统的!不是试剂盒 的、也不是某个仪器的!
常见检测系统
•配套检测系统-性能验证: A+A+A 封闭系统 A+B+B 配套开放系统
•自建检测系统-性能确认: A+B+C 非配套开放系统
2、实验前准备(人员培训、仪器维护及校准、样本留取及制备); 3、实验操作、数据收集、处理; 4、结论。
分析质量指标的确定
•分析质量指标(analytical quality specifications);又称质量目标 (quality goals)、质量规范(quality specification)、质量标准( quality standards)和分析性能目标(analytical performance goals )。
•判断临床检验结果精密度、正确度和准确度水平高低的指标,或临床检 验结果应达到的精密度、正确度和准确度要求,通常用不精密度、偏倚和 总误差来表示。
设定质量目标的层次模式和方法
质量目标
精密度验证
•采用2个浓度的质控物,每天分析1个批次,每个浓度重复检测4次,连 续5天。数据经过离群值检验,收集2×20=40个有效数据,并通过统计 分析评价方法计算总精密度和批内精密度,与允许范围进行比较,判断 结果是否接受。
•检测限(detection limit):分析程序具有适当的确定检出的分析物的最小浓度或量。检 测限依赖于空白读数大小。
性能验证的实施过程
对检验程序的性能验证涉及到多方面工作,为了得到可靠结果,实验 室负责人或实验主持人应对此项工作有一个概括了解,先制定一个方案, 包括如下工作:
1、性能验证项目的选择、质量目标确定、性能验证方案制定及实施工 作计划;
性能验证相关的基本概念
•线性(linearity):检测样本时,在一定范围内可以直接按比例关系得出分析物含量的 能力。
•总误差(total error):实验室用某方法在多次独立检测中分析某样品所得各个结果值与 靶值之差在一定置信区间内的最大允许范围。
•灵敏度(analytical sensitivity):校准曲线的斜率,即对于规定量的变化分析程序产生 信号的变化。
