四价流脑疫苗
一种四价流脑疫苗的制备方法与流程

一种四价流脑疫苗的制备方法与流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!揭秘四价流脑疫苗的创新制备过程与科学流程四价流脑疫苗,作为一种重要的预防医学工具,对于抵抗脑膜炎球菌引起的流行性脑脊髓膜炎(简称流脑)起到了关键作用。
四价流脑方案

绥中县2012年A、C、Y、W135群流脑疫苗接种方案为有效预防和控制A群、C群、Y群、W135群流行性脑脊髓膜炎的传播与流行,切实保障我县人民群众身体健康和生命安全,特制定本方案。
一、接种疫苗本次接种统一使用由重庆智飞公司提供的北京绿竹生物制药有限公司生产的A、C、Y、W135群脑膜炎球菌疫苗,规格为每安瓶200ug(1人份用量)。
二、接种对象接种对象为2岁以上人群,重点是儿童、中小学以及大中专院校学生。
三、接种方式本次接种采取以村为接种单位的定点接种。
四、接种方法接种时启开疫苗瓶,按标示量加入所附注射用水,摇匀后吸入注射器,立即与应接种对象上臂外侧三角肌附着处消毒后皮下注射,每人剂量为200ug(即1人份)。
五、接种禁忌及注意事项1、癫痫、抽风、脑部疾患、肾脏病、活动性肺结核、急性传染病、发热及有过敏史者均不得使用。
2、使用前要检查安瓶,如安瓶有裂纹,瓶塞松动或内有异物者,不得使用。
3、每一瓶(安瓶)制品溶解后,应按规定剂量一次完成。
4、严格执行一人一针一管,杜绝接种事故发生。
5、本疫苗使用后,偶有短暂低热、局部稍有压痛感,一般可自行缓解,如有严重反应应及时诊治。
6、本疫苗应与2-8避光保存和运输,在合签(或瓶签)标明的有效期内使用。
六、接种实施阶段全县A、C、Y、W135群流脑疫苗接种时间如有与其他疫苗间隔不足可先行统计后延期接种,具体安排如下:1、个乡镇要根据实际情况安排督导检查人员,负责全程巡回督导接种过程。
2、各村定点卫生所要根据本地实际情况安排分组分时段进行接种,对接种现场要做好充分的估计,确保接种工作的顺利进行。
3、接种现场必须将疫苗禁忌症张贴出来,同时应准备1:1000肾上腺素,防止严重过敏反应事件的发生。
七、强调注意问题1、做好询问、体检、告知事项、现场观察、急救准备、副反应处理工作。
2、与其他疫苗前后各间隔28天以上。
3、每人份疫苗对应一人份保单,妥善保管使用,丢失自负。
4、5月底前接种结束,接种后及时结算费用,同时保单存根按要求填写完整后一并返回,否则将不予理赔。
四价流脑疫苗接种通知及知情同意书

四价流脑(A、C、Y、W135群脑膜炎球菌多糖疫苗)接种通知及知情同意书_____________________(家长姓名):村(居)您好!根据《中华人民共和国传染病防治法》第十一条规定,国家实行有计划的预防接种制度。
国家免疫规划疫苗是适龄儿童必须接种的疫苗,其它疫苗家长可为自己的孩子选择性接种。
国家免疫规划疫苗种类请咨询当地疾病预防控制机构。
根据卫生部《儿童免疫规划程序》要求,请于_______年_____月_____日(上午/下午)带您的孩子___________(儿童姓名)到(单位)接种四价流脑疫苗1. 四价流脑疫苗2。
根据《疫苗流通和预防接种管理条例》,本产品属于第二类疫苗,由公民自费并且自愿受种;因接种第二类疫苗引起预防接种异常反应需要对受种者予以补偿的,补偿费用由相关的疫苗生产企业承担。
【疫苗作用与用途】本品仅用于预防A、C、Y、W135群脑膜炎球菌引起的流行性脑脊髓膜炎。
【不良反应】常见不良反应:1.接种后24小时内,在注射部位可出现疼痛和触痛,注射局部红肿浸润轻、中度反应,多数情况2-3天内自行消失。
2.接种疫苗后可出现一过性发热反应。
其中大多数为轻度发热反应,持续1-2天后可自行缓解,一般不需处理;对于中度发热反应或发热时间超过48小时者,可对症处理。
罕见不良反应:1.严重发热反应,应给予对症处理,以防高热惊厥。
2.注射局部重度红肿或其他并发症,可对症处理。
极罕见不良反应:1.过敏性皮疹:接种疫苗后72小时内可出现皮疹,应及时就诊,给予抗过敏治疗。
2.过敏性休克:一般在注射疫苗后1小时内发生,应及时抢救,注射肾上腺素进行治疗。
3.过敏性紫癜:出现过敏性紫癜反应时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。
4.血管神经性水肿、变态反应性神经炎。
【禁忌】1.已知对该疫苗的任何成分过敏者。
2.患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者。
4价流脑预防告知书
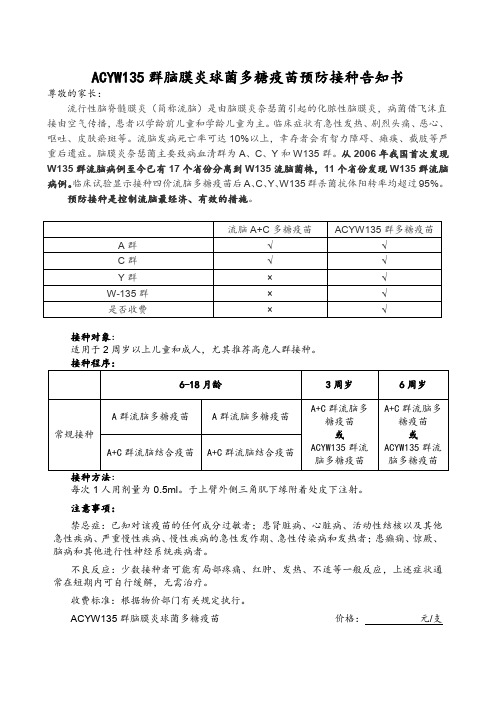
ACYW135群脑膜炎球菌多糖疫苗预防接种告知书
尊敬的家长:
流行性脑脊髓膜炎(简称流脑)是由脑膜炎奈瑟菌引起的化脓性脑膜炎,病菌借飞沫直接由空气传播,患者以学龄前儿童和学龄儿童为主。
临床症状有急性发热、剧烈头痛、恶心、呕吐、皮肤瘀斑等。
流脑发病死亡率可达10%以上,幸存者会有智力障碍、瘫痪、截肢等严重后遗症。
脑膜炎奈瑟菌主要致病血清群为A、C、Y和W135群。
从2006年我国首次发现W135群流脑病例至今已有17个省份分离到W135流脑菌株,11个省份发现W135群流脑病例。
临床试验显示接种四价流脑多糖疫苗后A、C、Y、W135群杀菌抗体阳转率均超过95%。
预防接种是控制流脑最经济、有效的措施。
接种对象:
适用于2周岁以上儿童和成人,尤其推荐高危人群接种。
每次1人用剂量为0.5ml。
于上臂外侧三角肌下缘附着处皮下注射。
注意事项:
禁忌症:已知对该疫苗的任何成分过敏者;患肾脏病、心脏病、活动性结核以及其他急性疾病、严重慢性疾病、慢性疾病的急性发作期、急性传染病和发热者;患癫痫、惊厥、脑病和其他进行性神经系统疾病者。
不良反应:少数接种者可能有局部疼痛、红肿、发热、不适等一般反应,上述症状通常在短期内可自行缓解,无需治疗。
收费标准:根据物价部门有关规定执行。
ACYW135群脑膜炎球菌多糖疫苗价格:元/支
接种时间:年月日,接种地址:接种单位(盖章)
我已了解上述事项,我的孩子身体健康,符合接种条件,已知有免费A+C群流脑疫苗的前提下,自费自愿接种ACYW135群流脑疫苗。
儿童姓名:家长(监护人)签名:时间:。
四价结合流脑疫苗接种程序

四价结合流脑疫苗接种程序1. 什么是四价结合流脑疫苗?大家好,今天咱们聊聊一个重要的话题,那就是四价结合流脑疫苗。
你问这是什么玩意儿?简单来说,它是一种保护我们免受流行性脑膜炎的疫苗。
听到“流脑”这个词,很多人可能心里就咯噔一下,觉得有点儿可怕。
其实,流脑虽然听起来吓人,但只要咱们好好预防,就能远离它的威胁。
这个疫苗就像是给你装上了一层无形的铠甲,保护你不受病毒侵扰。
四价这个名字,意思是它可以抵抗四种不同的脑膜炎菌,真的是个一举多得的好东西呢!2. 为什么要接种?2.1 预防流脑,保护生命首先,流脑可不是一个小打小闹的病。
它会引发很严重的后果,甚至危及生命。
想象一下,身边的朋友都活蹦乱跳,而你因为没打疫苗,突然就得了病,那感觉真是很心塞。
所以,打疫苗就是给自己和家人上了双保险,早早把隐患排除在外。
2.2 健康无忧,快乐生活其次,接种疫苗后,你就可以放心大胆地去各种聚会、旅行,尽情享受生活,而不用担心被流脑盯上。
就像在打游戏的时候,拿到了无敌道具,你的行动都变得更自信,做什么都特别带劲。
没打疫苗的话,心里总会有点儿忐忑,不如早早接种,活得开心自在!3. 接种程序是怎样的?3.1 接种时间安排那么,接种的程序到底是怎样的呢?一般来说,四价结合流脑疫苗的接种分为几个步骤。
首先,小朋友们在6个月大的时候就可以开始接种了。
接种的时间通常是在0、2、6个月这几个节点,听起来有点复杂,其实就是小朋友的成长阶段,家长们最好记好这几个时间点,别忘了哦!3.2 后续跟进接下来,到了大约15岁的时候,应该再进行一次加强针,这样才能确保疫苗的效果持久。
疫苗的接种不仅是一次性的事情,而是一个持续的过程。
记得每次接种后,观察一下孩子的反应,如果有啥不适,一定要及时和医生沟通,确保一切正常。
4. 注意事项与副作用当然,打疫苗也不是说完全没有风险的。
有些小朋友可能会在接种后感到轻微的不适,比如发热、红肿等等。
家长们不要慌,通常这都是正常的反应。
2 四价流脑疫苗

ACYW135群脑膜炎球菌多糖疫苗ACYW135 Qun Naomoyanqiujun Duotang YimiaoGroup ACYW135 Meningococcal Polysaccharide Vaccine 本品系分别用A群、C群、Y群、W135群脑膜炎球菌培养液,分别提取和纯化A群、C群、Y群、W135群脑膜炎球菌多糖抗原,混合后加入适宜稳定剂后冻干制成。
用于预防A群、C群、Y群、W135群脑膜炎球菌引起的流行性脑脊髓膜炎。
1 基本要求生产和检定用设施、原料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2 制造生产用菌种为A群脑膜炎球菌CMCC 29201(A4)菌株、C群脑膜炎球菌CMCC 29205(C11)菌株、Y群脑膜炎球菌CMCC 29028、W135群脑膜炎球菌CMCC 29037或其他经批准的菌种。
2.1混合前单价原液2.1.1A群、C群、Y群、W135群脑膜炎球菌多糖原液应分别符合“A群脑膜炎球菌多糖疫苗”中2.1~2.2项的规定。
原液制备过程中可采用经批准的方法去除内毒素。
2.1.2 原液检定按3.1项进行。
2.1.3 保存及有效期粗制多糖、精制多糖原液或原粉于-20℃以下保存。
自收获杀菌之日起至成品疫苗,总有效期应不超过60个月。
2.2 半成品2.2.1 配制用无菌、无热原乳糖溶液和灭菌注射用水稀释原液即为半成品。
每1次人用剂量含A群多糖50μg,C群多糖50μg,Y群多糖50μg,W135群多糖50μg,乳糖2.5~10mg。
2.2.2 半成品检定按3.2项进行。
2.3 成品2.3.1 分批应符合“生物制品分批规程”规定。
2.3.2 分装及冻干应符合“生物制品分装和冻干规程”规定。
冻干过程中制品温度不高于30℃,真空或充氮封口。
2.3.3 规格按标示量复溶后每瓶0.5ml。
每1次人用剂量0.5ml,含A群、C群、Y群、W135群多糖各50μg。
2.3.4 包装符合“生物制品包装规程”规定。
AC群流脑多糖结合疫苗和ACYW135接种注意事项

AC群流脑多糖结合疫苗和ACYW135
群流脑疫苗接种注意事项
一、接种对象
3月龄——24月龄儿童接种AC群流脑多糖结合疫苗;2周岁以上儿童及成人接种四价流脑疫苗,重点是托幼儿童、中小学校学生。
二、接种原则
实行“知情、同意、自愿、自费”的原则。
三、接种程序
AC群流脑多糖结合疫苗、四价流脑疫苗的接种程序根据疫苗使用说明接种,与国家免疫规划内的A群流脑多糖疫苗、AC群流脑多糖疫苗的接种间隔等联合使用严格按照市疾控中心《关于印发全市流行性脑脊髓膜炎球菌相关疫苗接种指导意见的通知》要求执行。
四、技术要求
1.接种方法:
(1)接种部位:上臂外侧三角肌附着处,皮肤用75%酒精消毒后皮下注射0.5ml,严禁静脉注射。
(2)接种剂量:每人次接种剂量均为0.5ml (即200ug/支)。
(3)疫苗供应:本次流脑疫苗由县疾控中心统一采购,统一供应。
2、禁忌症:
(1)癫痫、抽风、脑部疾患及有过敏史者;
(2)肾脏病、心脏病及活动性结核者;
(3)发热、急性传染病患者;
(4)体质衰弱、先天性免疫缺陷者。
3.不良反应监测:
常见不良反应:可出现短暂低热,局部稍有压疼感,一般可自行缓解,无需特殊处理。
极罕见不良反应:过敏性皮疹,一般接种后72小时出现,应及时就诊。
各预防接种点应备有肾上腺素等药物,以备偶有发生严重过敏反应时急救用。
接受注射者在注射后应在现场观察至少30分钟。
流脑结合疫苗

应用疫苗控制的理由
• 人群免疫水平低 山东省检测1731份健康人群血清标本 A群阳性率 81.98% GMT 17.52 C群阳性率 7.89% GMT 1.21 只有同时接种多价流脑疫苗才能有效预防流脑。
2007年健康人群流脑抗体水平监测结果 • 9个省上报结果流脑抗体保护率: • A群与C群差别明显,A群显著高于C群(χ2=1282.67,P< 0.0001)。 • 9省A群流脑抗体保护率均高于C群。
• 2001-2004年我国法定传染病报告系统流脑疫情资 料显示,报告发病人数分别为2250例、2551例、 2535例及2698例
流行性脑脊髓膜炎在中国的发病状况
• 2003年,安徽出现C群流脑病例,有5次爆发43例患者。 2004年仍然在安徽,有5次爆发,29个病例。2005年,各 地纷纷出现C群流脑病例,全国除福建、海南、西藏之外, 其他二十四省都有疫情传出,其中又以安徽最为严重,有 八人丧生。从2004年11月至2005年1月,全国累计出现546 个病例,仅1月就有258例病例,16人死亡,引起广泛关注。
2005年1月安徽省发生流脑流行
• 鉴于流脑疫情,卫生部于2005年1月31日紧急 通知,要求加强流脑预防控制工作。全国流 脑接种如火如荼,疫苗供应吃紧。
中国年流脑发病季节分布特征,1994~2006
各省流脑平均发病率,2002~2006
省 年平均发病率(/ 100 000)
青海、北京、西藏、云南、新疆、 宁夏、重庆、贵州、四川、甘肃、 安徽、辽宁、河北、天津、 陕西、黑龙江、山西、上海、吉林
省份 天津 山西 浙江 湖南 广东 广西 辽宁 江西 海南 合计 检测例数 797 840 902 620 485 778 465 798 676 6361 A 群流脑抗体 阳性例数 729 571 636 535 403 233 230 671 420 4428 保护率(%) 91.5 68.0 70.5 86.3 83.1 29.9 49.5 84.1 62.1 69.6 407 119 271 446 161 169 122 524 195 2414 C 群流脑抗体 阳性例数 保护率(%) 51.1 14.2 30.0 71.9 33.2 21.7 26.2 65.7 28.9 38.0
流行性脑脊髓膜炎疫苗:多糖疫苗与多糖结合疫苗

流行性脑脊髓膜炎疫苗:多糖疫苗与多糖结合疫苗WHO立场文件世界卫生组织(WHO)提供扩大免疫规划(EPI)疫苗的相关信息与建议。
根据其全球使命,WHO就预防具有全球公共卫生影响的疾病的疫苗及联合疫苗问题,发布一系列定期更新的立场文件。
这些文件着重关注疫苗在大规模免疫规划中的使用;主要在私立部门开展的数量有限的、以个体保护为目的的免疫接种对国家免疫规划来说是很有价值的补充,但不是这些政策文件强调的内容。
这些立场文件归纳了各相关疾病与疫苗的基本背景信息,并就如何在全球使用这些疫苗表明了WHO 目前的立场。
这些文件在发布前经过WHO内部和外部众多专家的审阅,主要供各国的公共卫生官员和免疫规划管理人员使用。
不过,对这些立场文件感兴趣的还可能包括一些国际资助机构、疫苗生产企业、医学界和科学媒体。
概要和结论流行性脑脊髓膜炎(流脑)和败血症是由多种血清群的脑膜炎奈瑟菌引起的,本病在全球呈地方性流行,主要由A群、B群或C群脑膜炎球菌引起,但Y群也变得越来越重要,至少在美国部分地区如此。
A群脑膜炎球菌是较大流行的主要致病血清群,特别是在所谓的非洲“流脑流行带”,每隔7-14年就会出现一次较大流行,引起儿童和年轻成人超额发病率与死亡率。
近年来,这些地区及沙特阿拉伯也出现过W135群导致的流脑爆发,一些西方国家则出现过C群引起的流脑爆发。
即使是在医疗条件比较完善的地方,流脑病死率仍然很高(5-15%)。
一般来说,仅靠药物预防措施来控制此病是不够的。
流脑感染后获得的免疫力具有群特异性。
目前国际市场的疫苗主要有群特异的荚膜多糖联合疫苗(A+C疫苗,或A、C、Y和W135疫苗)或C群荚膜多糖与蛋白载体结合的结合疫苗。
多糖疫苗安全并具有较高的免疫原性,但C群对2岁以下儿童效果不理想。
另一方面,最近上市的C群结合疫苗即使在很小的儿童也安全有效。
市场上单价多糖疫苗并不容易得到,迄今还没有A群结合疫苗上市。
B群流脑疫苗无论是对儿童还是成人均只产生中等程度的保护效力。
智飞绿竹四价流脑说明书

智飞绿竹四价流脑说明书
从北京智飞绿竹ac结合流脑疫苗说明书可以见到,它适合2-71月龄的婴幼儿、儿童接种,主要预防脑脊髓膜炎、会厌炎、败血症、肺炎等。
选择在上臂三角肌注射有更好效果,每次注射一针,一针量在0.5ml。
临床试验验证,接种该疫苗后身体会有不良反应,包括局部接种位置泛红、疼痛、起硬结、红肿,偶尔还会有局部皮肤瘙痒、起水泡;全身反应则有发热、拉肚子、影响食欲、全身乏力、起皮疹等。
这些反应会在接种后24小时里发生,不需要特别处理,之后它会慢慢缓解,严重可以与专业医生联系。
北京智飞绿竹ac结合流脑疫苗还有禁忌跟注意事项,比如对该疫苗药物成分过敏禁用、高血压、心脏病、肝脏疾病患者禁用,在说明书上都有详细列明,在这里不一一举例。
北京智飞绿竹ac结合流脑疫苗供应价格每支在120元,实际注射时价格会提高,约200元,具体价格要咨询防疫站。
四价流脑疫苗接种告知书

四价流脑疫苗接种告知书
流行性脑脊髓膜炎(以下简称“流脑”)是由脑膜炎双球菌引起的一种严重危害人类健康的急性呼吸道传染病,常在冬春季节发病和流行,具有发病急、流行广、病死率高及流行菌群易变异和易耐药等流行特点。
流脑有13个血清群,其中由A、C、Y、W135群引起的病例占90%以上。
好发于15岁以下儿童和青少年,主要症状为高热、头痛、呕吐、颈项强直等,严重者导致残疾甚至死亡,死亡率高达5%以上,30%的存活者留下痴呆、肢体障碍等神经系统后遗症。
我县自20世纪80年代开始使用A群脑膜炎球菌多糖疫苗以来,因A群引起的流脑发病率大幅度下降,但由于脑膜炎球菌血清群变迁和变异,以及菌株的耐药,引起流行的传统地域和分布群型已打破,特别是近年来由C群引起的病例局部暴发,严重危害着广大人民的身体健康。
我省已发生由C群引起的流脑病例,W135群最近在非洲、欧洲、亚洲许多国家和地区流行,我国广东、广西、安徽也出现病例。
预防流脑最经济有效的方法是接种流脑疫苗,四价脑膜炎疫苗,接种1针疫苗,可预防四种类型的脑膜炎,有效保护时间为3年,每针收费160.5元(含接种劳务费2.5元)。
各位家长,为了孩子的健康,请您做出明智的选择,于2015年—月—日至一日
将孩子带到接种门诊(点)接种四价流脑疫苗。
接种以“知
如家长仍有疑问,请咨询当地卫生院接种门诊或长阳县疾控中心。
由此裁下并由接种单位留存
长阳县四价流脑疫苗接种告知单
名。
ACYW135群四价流脑多糖疫苗接种告知书(20200707100233)

ACYW13群四价流脑多糖疫苗接种告知书
流行性脑脊髓膜炎(简称流脑)是由脑膜炎双球菌引起的化脓性脑膜炎,传染性较强,主要在冬春季流行,空气飞沫传播,主要侵犯对象为儿童及青壮年,15岁以下儿童发病占75%。
脑膜炎双球菌分13个血清群,常见的有A、B、C 群。
江苏省近年已出现W135群病例。
接种流脑疫苗是预防流脑的有效手段。
根据《中华人民共和国传染病防治法》和《疫苗流通和预防接种管理条例》,流脑
A+C群流脑多糖疫苗为第一类疫苗,如无禁忌,公民应当接种。
ACYW135群四价脑膜炎球菌多糖疫苗可替代免疫规划程序中的A+C群流脑多糖疫苗,并增加了丫和W135群流脑的成分。
ACYW135群四价流脑多糖疫苗属第二类疫苗,公民自愿自费
【注意事项】
1. 接种后应在接种单位留观区域留观30分钟。
2. 到目前为止,任何疫苗的保护效果都不能达到100%。
少数人接种后未产
生保护力,或仍然发病,与疫苗本身特性和受种者个人体质有关。
3. 如需了解更多信息,请查看产品说明书。
若本告知书的内容与产品说明书发生冲突的,以产品说明书为准。
【接种前受种者应告知/医生应询问下列健康状况】
1. 是否发热或其他不适症状?
2. 是否以往接种本疫苗后有不适?
3. 是否处于疾病的急性发作期?
4. 是否近期接受过输血或使用过免疫球蛋白?。
疫苗接种服务收费标准

疫苗接种服务收费标准收费依据:省物价局省财政厅省卫生厅关于疫苗接种价格问题的通知(苏价费[2006]366)号附件:省物价局省财政厅省卫生厅关于疫苗接种价格问题的通知苏价费[2006]366号各省辖市及常熟市物价局、财政局、卫生局:根据国务院《疫苗流通和预防接种管理条例》(以下简称《条例》)规定,结合我省实际,现就我省疫苗预防接种价格等问题通知如下:一、第一类疫苗是指政府免费向公民提供,公民应当依照政府的规定受种的疫苗。
其疫苗购置、运输、保管和接种费用均由政府承担,接种单位接种时不得向受种者收取任何费用。
根据财政部、原国家计委、卫生部《关于印发〈关于卫生事业补助政策的意见〉的通知》(财社[2000]17号)规定,疾病控制和妇幼保健等卫生机构向社会提供公共卫生服务(包括预防接种疫苗等)所需经费,均由同级财政预算和单位上缴的预算外资金统筹安排。
目前,我省纳入财政拨款支持、免费为受种者接种的第一类疫苗包括:乙型肝炎疫苗、卡介苗、脊髓灰质炎疫苗、百白破三联疫苗、麻莎疫苗、乙型脑炎疫苗、A群流脑疫苗等7种。
二、第二类疫苗(是指由公民自费并且自愿受种的非财政拨款购置的第一类疫苗和其它疫苗)的价格管理,暂按现行规定执行。
接种单位接种第二类疫苗可以收取服务费、接种耗材费,具体收费标准:疫苗接种服务费每人次1元;接种耗材费,使用普通一次性注射器的,每人次0.7元;使用自毁式注射器的,每人次0.8元。
接种单位收取上述费用,应使用省财政厅统一印制的收据,收费收入应全部缴入同级财政专户,按政府非税收入实行收支两条线管理。
三、应切实维护受种者享有免费接种第一类疫苗的知情权、选择权、受益权。
接种单位应当按照《条例》有关规定,通过发放预防接种证、接种通知等方式,提前告知所有需接种第一类疫苗的受种人或其监护人,接种单位保证提供免费接种第一类疫苗的服务。
同时可以根据受种者或其监护人的选择,提供自费接种的第二类疫苗及相应的服务。
还应当告知接种第二类疫苗费用承担、接种疫苗异常反应补偿方式,以及《条例》第二十五条规定的有关内容。
检测四价脑膜炎球菌多糖疫苗中A群多糖含量ELISA法的建立

p l s e h r e .M eh d T e p lc o a nie a a an tme i g c c a r u p l s c h rd swa u f d b a r oy a c a i s d to s h oy l n la t r g i s s n n o o c lgo p A oy a c ai e sp r e y c p i i i c
b d n i a a t o y w i a o t i d b dut gra t ec n io ,s c sc n e t t n o cpu ea t o y o y a ds n l ni d , hc w s pi z y aj s n e c v o dt n u h a o c nr i f a tr ni d g b h m e i i i ao b
( RsahDv i at il ac e B in in nBooi l rd c o ,t. B  ̄ g1 02 。hn } eec is no B c r ci , e gTa t i gc o ut C . Ld ,ei 0 0 4 C ia io f ea V n i f a l aP s i n A s a tObet e T ee padu l at oysn wc LS e r nt ncnet f ru e i oocl b t c: jc v odvl o be ni d ad i E IA i dt mi i otn o opA m nn cca r i o b h n e ao g g
ACYW135群四价流脑多糖疫苗接种告知书

ACYW135群四价流脑多糖疫苗接种告知书流行性脑脊髓炎(简称流脑)是由脑膜炎双球菌引起的化脓性脑膜炎症,是一种急性呼吸道传染病,主要通过空气飞沫传播,冬春季常见,主要临床表现为高热、头痛、呕吐、颈项强直、皮肤黏膜出现瘀点瘀斑等。
具有起病急、病情发展快和病后易留下后遗症及病死率高等特点,是严重危害群众,尤其是危害儿童、青少年身体健康的疾病,给家庭和社会带来沉重的负担。
近年来,流脑的流行菌群已由原来的A群向C群、Y群、W135群变迁,且这些菌群具有易传播、隐性感染比例高、起病急、病程进展快、病死率高等特点,包括山东、湖北、江西、安徽、四川、广东等多个省份已相继发生上述菌群所致疫情。
接种ACYW135流脑疫苗是预防流脑最经济、最简便、最有效的方法。
接种1针ACYW135流脑疫苗可同时预防由A群、C群、Y群、W135群引起的脑膜炎。
本疫苗属第二类疫苗,在群众知情自愿的前提下,自费选择接种,不强制您接种。
1、接种对象:2周岁以上的儿童及成人均可接种,重点对2周岁以上15岁以下,3年内未接种A+C群流脑疫苗的儿童补种1针次。
⑴ 2岁~5岁儿童:仅对未接种A+C群流脑疫苗者补种1针次ACYW135群四价流脑多糖疫苗。
⑵ 6岁~15岁儿童:对从未接种过A+C群流脑疫苗者应补种2针次(2针次间隔不少于3年),对已接种1针A+C群流脑疫苗者且已间隔达3年及以上者补种1针。
2、接种副反应:本疫苗使用后,少数接种者可有轻微红肿、硬结和疼痛,偶有短暂低热,一般不超过72小时可自行缓解。
3、禁忌症:1、患有癫痫、抽风、脑部疾患及有过敏史者;2、心脏病、肾脏病及活动性肺结核患者;3、急性传染病及发热者。
4、由于个体因素,疫苗对90%以上的受种者产生足够保护力而不发病,未产生足够保护力的受种者有可能会感染发病,但其症状轻病程短,严重并发症发生率低。
以上为接种疫苗相关的内容,请受种者或受种儿童的家长/监护人认真仔细阅读,如同意接种,请签名认可并在接种时交付疫苗费用。
ACYW群四价流脑多糖疫苗接种告知书
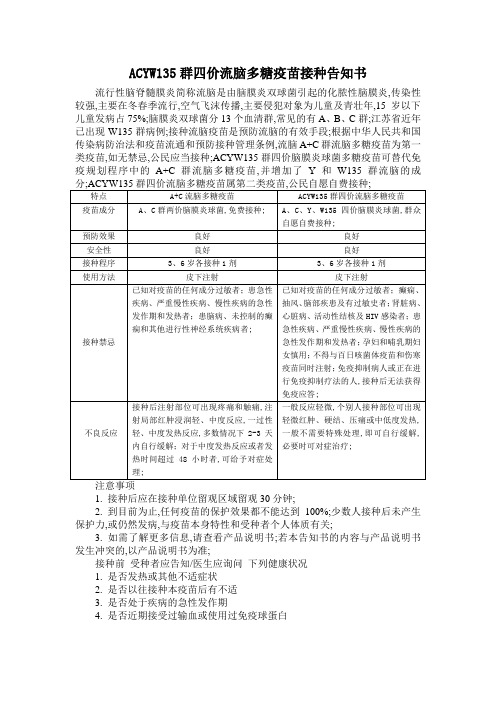
ACYW135群四价流脑多糖疫苗接种告知书
流行性脑脊髓膜炎简称流脑是由脑膜炎双球菌引起的化脓性脑膜炎,传染性较强,主要在冬春季流行,空气飞沫传播,主要侵犯对象为儿童及青壮年,15岁以下儿童发病占75%;脑膜炎双球菌分13个血清群,常见的有A、B、C群;江苏省近年已出现W135群病例;接种流脑疫苗是预防流脑的有效手段;根据中华人民共和国传染病防治法和疫苗流通和预防接种管理条例,流脑A+C群流脑多糖疫苗为第一类疫苗,如无禁忌,公民应当接种;ACYW135群四价脑膜炎球菌多糖疫苗可替代免疫规划程序中的A+C群流脑多糖疫苗,并增加了Y和W135群流脑的成
1. 接种后应在接种单位留观区域留观30分钟;
2. 到目前为止,任何疫苗的保护效果都不能达到100%;少数人接种后未产生保护力,或仍然发病,与疫苗本身特性和受种者个人体质有关;
3. 如需了解更多信息,请查看产品说明书;若本告知书的内容与产品说明书发生冲突的,以产品说明书为准;
接种前受种者应告知/医生应询问下列健康状况
1. 是否发热或其他不适症状
2. 是否以往接种本疫苗后有不适
3. 是否处于疾病的急性发作期
4. 是否近期接受过输血或使用过免疫球蛋白。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ACYW135群脑膜炎球菌多糖疫苗ACYW135 Qun Naomoyanqiujun Duotang YimiaoGroup ACYW135 Meningococcal Polysaccharide Vaccine 本品系分别用A群、C群、Y群、W135群脑膜炎球菌培养液,分别提取和纯化A群、C群、Y群、W135群脑膜炎球菌多糖抗原,混合后加入适宜稳定剂后冻干制成。
用于预防A群、C群、Y群、W135群脑膜炎球菌引起的流行性脑脊髓膜炎。
1 基本要求生产和检定用设施、原料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2 制造生产用菌种为A群脑膜炎球菌CMCC 29201(A4)菌株、C群脑膜炎球菌CMCC 29205(C11)菌株、Y群脑膜炎球菌CMCC 29028、W135群脑膜炎球菌CMCC 29037或其他经批准的菌种。
2.1混合前单价原液2.1.1A群、C群、Y群、W135群脑膜炎球菌多糖原液应分别符合“A群脑膜炎球菌多糖疫苗”中2.1~2.2项的规定。
原液制备过程中可采用经批准的方法去除内毒素。
2.1.2 原液检定按3.1项进行。
2.1.3 保存及有效期粗制多糖、精制多糖原液或原粉于-20℃以下保存。
自收获杀菌之日起至成品疫苗,总有效期应不超过60个月。
2.2 半成品2.2.1 配制用无菌、无热原乳糖溶液和灭菌注射用水稀释原液即为半成品。
每1次人用剂量含A群多糖50μg,C群多糖50μg,Y群多糖50μg,W135群多糖50μg,乳糖2.5~10mg。
2.2.2 半成品检定按3.2项进行。
2.3 成品2.3.1 分批应符合“生物制品分批规程”规定。
2.3.2 分装及冻干应符合“生物制品分装和冻干规程”规定。
冻干过程中制品温度不高于30℃,真空或充氮封口。
2.3.3 规格按标示量复溶后每瓶0.5ml。
每1次人用剂量0.5ml,含A群、C群、Y群、W135群多糖各50μg。
2.3.4 包装符合“生物制品包装规程”规定。
3 检定3.1原液检定3.1.1鉴别试验采用免疫双扩散法(附录ⅧC),本品与A群、C群、Y群及W135群脑膜炎球菌抗体应形成明显沉淀线。
3.1.2 化学检定3.1.2.1固体总量依法测定(附录ⅦM)。
(A群多糖于50℃干燥至恒重,C群、Y群、W135群多糖于50℃或105℃干燥至恒重。
)3.1.2.2 蛋白质含量A群多糖和C群多糖均应小于8mg/g ,Y群多糖和W135群多糖均应小于10mg/g(附录ⅥB第二法)。
3.1.2.3核酸含量A群多糖和C群多糖均应小于8mg/g,Y群多糖和W135群多糖均小于10mg/g。
核酸在260nm波长处的吸收系数(E1%1cm)为200(附录ⅡA)。
3.1.2.4 O-乙酰基含量A群多糖应不低于2.0mmol/g,C群多糖应不低于1.5mmol/g,Y群、W135群多糖均应不低于0.3mmol/g(附录ⅥF)。
3.1.2.5磷含量A群多糖应不低于80mg/g(附录ⅦA)。
3.1.2.6唾液酸含量以N-乙酰神经氨酸为对照,C群多糖应不低于800mg/g,Y群、W135群多糖均应不低于560mg/g(附录ⅥC)。
3.1.2.7多糖分子大小测定含A群、C群、Y群、W135群多糖分子的K D值均应不高于0.40,K D值小于0.5的洗脱液多糖回收率:A群多糖应大于76%,C群、Y群、W135群多糖应分别大于80%(附录ⅧG)。
3.1.2.8苯酚残留量A群、C群、Y群、W135群多糖均应不高于6.0mg/g(附录ⅥM)。
3.1.3 无菌检查依法检查(附录ⅫA),应符合规定。
3.1.4 细菌内毒素检查A群、C群、Y群、W135群多糖均应不高于12.5EU/μg(附录ⅫE)。
3.2 半成品检定无菌检查依法检查(附录ⅫA),应符合规定。
3.3成品检定3.3.1鉴别试验按3.1.1项方法进行。
3.3.2 物理检查3.3.2.1外观应为白色疏松体,按标示量加入所附稀释液后应迅速复溶为澄明液体,无异物。
3.3.2.2 装量差异依法检查(附录ⅠA),应符合规定。
3.3.3 化学检定3.3.3.1水分应不高于3.0%(附录ⅦD)。
3.3.3.2 pH依法检定,应符合标准(附录ⅤA)。
3.3.3.3渗透压摩尔浓度依法测定(附录V H),应符合批准的要求。
3.3.3.4 多糖含量称取1.0g琼脂糖,加0.05mol/L巴比妥缓冲液(pH8.6)100 ml中,加热溶解完全,待冷却至约56℃时分别加入适量的A群、C群、Y群和W135群脑膜炎球菌抗血清,混匀后迅速倾倒于水平放置的约5.5×12.5cm玻板上。
待琼脂凝固后打孔,孔径3mm,孔间距离4~5mm。
各孔中分别加入稀释好的脑膜炎球菌多糖参考品溶液(浓度分别为1μg/ml、2μg/ml、4μg/ml、6μg/ml、8μg/ml、10μg/ml、12μg/ml)和样品稀释液10 μl/孔。
在60V恒压条件下电泳适宜时间。
取出琼脂糖凝胶放入生理氯化钠溶液内浸泡适宜时间后,用考马斯亮蓝染色液染色至火箭峰出现,用甲醇-醋酸溶液脱色至背景清晰。
准确测量火箭峰高,将各群脑膜炎球菌多糖参考品含量及对应的峰高作直线回归分析,分别将待检样品电泳峰高度代入直线回归方程中,求出样品中各群脑膜炎球菌多糖的含量。
每1次人用剂量含A群、C群、Y群、W135群多糖应分别为35~65μg。
3.3.3.5分子大小测定K D值均应不高于0.40。
K D值小于0.5的洗脱液多糖回收率:A群多糖应大于76%,C群、Y群、W135群多糖应分别大于80%(附录ⅧG)。
3.3.4无菌检查依法检查(附录ⅫA),应符合规定。
3.3.5 异常毒性检查依法检查(附录ⅫF),应符合规定。
注射剂量为每只小鼠0.5ml,含1个人用剂量的制品;每只豚鼠5ml,含10个人用剂量的制品。
3.3.6 热原检查依法检查(附录ⅫD)。
注射剂量按家兔体重每1kg注射0.2μg多糖,应符合规定。
3.3.7细菌内毒素检查每1次人用剂量应不超过1500EU。
3.4 稀释剂检定疫苗稀释剂为灭菌注射用水或无菌、无热原PBS,稀释剂的生产应符合批准的要求。
灭菌注射用水应符合本版药典(二部)的相关规定。
无菌无热原PBS应符合以下要求。
3.4.1 外观检查应为无色澄清液体。
3.4.2 可见异物检查依法检查(附录V B),应符合规定。
3.4.3 pH值应为6.8~7.2(附录ⅤA)。
3.4.4 无菌检查依法检查(附录ⅫA),应符合规定。
3.4.5细菌内毒素检查应不高于0.25EU/ml。
(附录XII E 凝胶限度试验)4 保存、运输及有效期于2~8℃避光保存和运输。
自生产之日起,有效期为24个月。
5使用说明应符合“生物制品包装规程”规定和批准的内容。
ACYW135群脑膜炎球菌多糖疫苗使用说明【药品名称】通用名称:ACYW135群脑膜炎球菌多糖疫苗英文名称:Group ACYW135Meningococcal Polysaccharide Vaccine汉语拼音:ACYW135 Qun Naomoyanqiujun Duotang Yimiao【成分和性状】本品系分别用A群、C群、Y群、W135群脑膜炎球菌培养液,分别提取和纯化A群、C群、Y群、W135群脑膜炎球菌多糖抗原,混合后加入适宜稳定剂后冻干制成。
为白色疏松体,加入所附稀释液复溶后为无色澄明液体。
有效成分:A群、C群、Y群、W135群脑膜炎球菌荚膜多糖辅料:应列出全部批准的辅料成分疫苗稀释剂:无菌、无热原PBS或灭菌注射用水【接种对象】目前在国内仅推荐本品在以下范围内2周岁以上儿童及成人的高危人群使用:1. 旅游到或居住到高危地区者,如非洲撒哈拉地区(A、C、Y及W135群脑膜炎奈瑟氏球菌传染流行区)。
2. 从事实验室或疫苗生产工作可从空气中接触到A、C、Y及W135群脑膜炎奈瑟氏球菌者。
3. 根据流行病学调查,由国家卫生部和疾病控制中心预测有Y及W135群脑膜炎奈瑟氏球菌暴发地区的高危人群。
【作用与用途】本品用于预防A、C、Y及W135群脑膜炎奈瑟氏球菌引起的流行性脑脊髓膜炎。
【规格】复溶后每瓶0.5ml,每1次人用剂量0.5ml,含A、C、Y及W135群多糖各50μg。
【免疫程序和剂量】(1)按标示量加入所附稀释液溶解,摇匀后立即使用。
(2)将上臂外侧三角肌附着处皮下注射本品。
(3)接种1次,每次1人用剂量为0.5m1。
接种应于流行性脑脊髓膜炎流行季节前完成。
(4)再次接种(国外推荐):传染地区的高危个体,特别是第一次接种小于4岁的儿童,如果持续处于高危状态,应考虑初次免疫2~3年后再次接种;尽管还未确定大龄儿童和成人是否有再次接种的必要,但如果疫苗接种2~3年后抗体水平快速下降,则应考虑初次免疫3~5年内进行再次接种。
(绿竹、沃森、天元)本品尚无免疫持久性和加强免疫的研究资料。
【不良反应】本疫苗局部不良反应主要为接种部位疼痛、其次为红肿、肿胀、瘙痒,全身不良反应主要为发热,其次有头痛、乏力、嗜睡、恶心呕吐、腹泻、食欲不振、肌痛和皮疹,大多数可自行缓解,并在72小时内消失。
国内临床试验中900例受试者(包括幼儿、儿童和成人)接种本疫苗后的不良反应详见下表,此次观察时间是在接种后4周内。
临床试验中接种ACYW135群脑膜炎球菌多糖疫苗后的不良反应(%)(1)对本疫苗及其成分过敏者。
(2)癫痫、脑部患者及有过敏史者。
(3)肾脏病、心脏病、活动性结核患者、HIV感染者及其他急性疾病。
严重慢性疾病、慢性疾病的急性发作期。
(4)急性传染病及发热者。
(5)本疫苗未在妊娠妇女及试验动物中进行生殖毒性试验,是否对胎儿有影响未知,因此,妊娠妇女应禁用此疫苗,尤其是妊娠的前三个月。
(康华、沃森、绿竹)【注意事项】(1)以下情况者慎用:家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、孕妇、哺乳期妇女(2)为预防注射后发生罕见的不良反应,注射本品时需要必要的监护和治疗措施,如备有肾上腺素,以备偶有过敏反应发生时急救用。
接种后至少观察30分钟。
(3)使用前应检查本品,如有裂纹、瓶塞松动或疫苗稀释溶解后肉眼观察有异物和/或变色等任何一种现象,均不得使用。
(4)本疫苗溶解后,应按规定剂量一次用完,不得分多次使用。
如未立即使用,放置时间不得超过30分钟。
(5)应特别避免本品疫苗被注入皮内、肌肉内或静脉内,因上述三种注射途径临床还未被确定是安全的和有效的。
(6)由于内毒素量的叠加,本疫苗不得与百日咳菌体疫苗和伤寒菌体疫苗同时注射。
(7)如果本疫苗接种给免疫缺陷者或正在进行免疫抑制剂治疗的患者,则无法获得免疫应答。
(8)本疫苗不能用于已经感染脑膜炎奈瑟氏球菌者的治疗;不能保护其他感染包括B群脑膜炎奈瑟氏球菌在内导致的脑脊髓膜炎。
