大肠埃希氏菌计数 产气
大肠埃希氏菌生化鉴定结果

大肠埃希氏菌生化鉴定结果大肠埃希氏菌(Escherichia coli)是一种常见的细菌,可以引起多种感染性疾病,包括腹泻、尿路感染和食物中毒等。
鉴定大肠埃希氏菌的生化特征可以帮助确定病原菌的身份以及其潜在的耐药性和毒力因子。
本次实验目的是对一株致病性大肠埃希氏菌样本进行生化鉴定,以确认其菌株的性质和特征。
首先,我们进行了气体产生实验。
在Triple Sugar Iron Agar(TSI)培养基中,观察到菌落周围发生了气体产生,此结果表明该菌株具有产气性。
产气性通常意味着大肠杆菌等需要葡萄糖产生酸,进而分解产生气体的细菌。
其次,我们进行了甲烷发酵试验。
在Methyl Red(MR)试剂中,当菌液发酵产酸时,溶液颜色由黄色变成红色。
然而,该菌株在MR试剂中没有产生红色反应,这表明它无法通过甲烷发酵产酸。
这一结果与典型的大肠杆菌不同,因为大肠杆菌通常可以通过此途径产酸。
进一步,我们进行了亮氨酸脱氨酶试验。
使用亮氨酸脱氨酶(LDC)培养基,如果菌株具有亮氨酸脱氨酶活性,菌液会变色。
然而,我们观察到该菌株在培养基中没有出现任何颜色变化,这表明它不具备亮氨酸脱氨酶活性。
亮氨酸脱氨酶活性通常是大肠杆菌的典型特征之一。
此外,我们还进行了尿素酶试验。
使用尿素平板培养基,如果菌株具有尿素酶活性,培养基颜色将由黄色变为粉红色。
然而,我们观察到该菌株在培养基上未显示出任何颜色变化。
这暗示着该菌株可能缺乏尿素酶活性,与大肠杆菌的典型特征不同。
最后,我们进行了青霉素酶试验。
使用青霉素酶试纸进行反应检测,在试纸上出现蓝色点状斑点表示菌株具有青霉素酶活性。
而对于这个菌株,我们观察到在试纸上没有出现蓝色斑点。
这意味着该菌株可能对青霉素类药物敏感,这对于抗生素选择治疗提供了重要信息。
综上所述,通过对致病性大肠埃希氏菌样本进行生化鉴定,我们发现该菌株具有产气性,但与典型的大肠杆菌不同,它不表现出甲烷发酵、亮氨酸脱氨酶和尿素酶活性。
大肠埃希氏菌(内容详细)

医学精制
8
卫生学意义
大肠埃希氏菌的某些菌株对人有致病性。 相对于大肠菌群和粪大肠菌群,大肠埃希 氏菌与粪便污染的相关性最好,应用也最 悠久。自1892年被提议作为粪便污染的指 示菌以来,已被应用了100多年。
医学精制
9
3 设备和材料
除微生物实验室常规灭菌及培养设备外, 其他设备和材料如下:
摇试管或换用1支1 mL无菌吸管或吸头反
复吹打,使其混合均匀,制成1:100的样
品匀液。
医学精制
19
5.2.1 样品的稀释
5.2.1.5 根据对样品污染状况的估计,按 上述操作,依次制成10倍递增系列稀释样 品匀液。每递增稀释1次,换用1支1 mL 无菌吸管或吸头。从制备样品匀液至样品 接种完毕,全过程不得超过15 min。
医学精制
2
VRBA-MUG平板计数法
MUG对大肠埃希氏菌的生长繁殖没有抑制 作用也没有促进作用,对菌落形态也没有 影响。经实验发现,在MUG浓度从0 g/mL到200 g/mL的范围内,大肠 埃希氏菌生长繁殖率没有区别。
MUG方法有大约4%的假阴性,特别是倍 受关心的O157:H7菌株为阴性,令人感 到遗憾,但经典的常规方法也同样存在这 样的问题。
医学精制
4
VRBA-MUG平板计数法
研究还证实,大肠埃希氏菌荧光反应比产 气反应出现得更早,并且不受食品的影响, 仅发现对牡蛎直接进行的检验不适合用 MUG方法,因为牡蛎具有内源性葡萄糖苷 酸酶。
医学精制
5
VRBA-MUG平板计数法
本标准采用的VRBA-MUG平板计数方法, 正是以上述理论为依据,参照FDA方法而 确立的,检验时间为18 h~24 h,并能 准确测出样品中大肠埃希氏菌的CFU数值, 操作简便,但对于对染菌量低(如<10 CFU/g)的样品不如MPN法适用。
7-3第七章食品微生物检验-大肠菌群、粪大肠菌群、大肠埃希氏菌计数

(一)大肠菌群、粪大肠菌群、大肠杆菌
1、大肠菌群
在一定培养条件下(一般是37℃24小时)能发酵乳糖、产酸产气的需氧和兼性厌 氧革兰氏阴性无芽胞杆菌。(GB4789.3—2010)
大肠菌群不是细菌学上的分类命名,而是根据卫生学方面的要求,提出的与 粪便污染有关的细菌,即作为食品、水体等是否受过人畜粪便污染的指示菌, 这些细菌在生化及血清学方面并非完全一致。根据进一步的生化试验,可将这 群细菌再分为大肠艾希氏菌(俗称大肠杆菌)、枸橼酸杆菌、肺炎克雷伯氏菌 和阴沟肠杆菌等。
2、粪大肠菌群
• 根据生长温度的差异,将能在37C生长的称为总 大肠菌群,而在44.5C仍能生长的大肠菌群称为 耐热大肠菌群(thermo-tolerant coliform group) 或 粪大肠菌群(faecal coliform Fc),在人和动物 粪便中所占的比例较大,而且在自然界容易死亡。 因此,粪大肠菌群对粪便污染的指示作用更为直 接和贴切,主要就是大肠艾希氏菌,但也包括克 雷伯氏菌属,正是由于包括了克雷伯氏菌属,使 其与粪便污染的相关性受到了影响。
3)大肠艾希氏菌在外界存活时间与一些主要肠道致病菌接近,它的出现预示 着某些肠道病原菌的存在,因此该菌是国际上公认的卫生监测指示菌。近 年来,有些国家在执行HACCP管理中,将大肠艾希氏菌检测作为微生物污 染状况的监测指标和HACCP实施效果的评估指标。
4)大肠菌群、粪大肠菌群和大肠杆菌这三个指标在实际工作中都在应用,但 用途有所不同,一般认为大肠菌群是水源的卫生指标和食品加工卫生状况 的通用指标,粪大肠菌群主要用于贝类和贝类养殖用水的卫生指标,大肠 杆菌用于指示食品受到近期粪便污染或不卫生加工。作为粪便污染的指示 菌,大肠埃希菌检出的意义最大,其次是耐热大肠菌群,总大肠菌群的检 出意义略差一些。
《微生物与实验技术》食品中大肠埃希菌的检验实验

《微生物与实验技术》食品中大肠埃希菌的检验实验一、实验目的1.熟悉大肠埃希菌的检验原理2.熟悉大肠埃希菌检验的基本操作二、实验原理1.大肠杆菌,又叫大肠埃希氏菌是条件致病菌,在一定条件下可以引起人和多种动物发生胃肠道感染或尿道等多种局部组织器官感染。
因此,检查食品中是否存在治病大肠埃希氏菌具有实际意义。
2. 在TSI琼脂中,典型菌株为斜面与底层均呈黄色,产气或不产气,不产生硫化氢(H2S)。
置MUG-LST肉汤管于长波紫外灯下观察,MUG阳性的大肠埃希氏菌株应有荧光产生,MUG阴性的应无荧光产生,大肠埃希氏菌O157:H7/NM为MUG试验阴性,无荧光。
三、试剂及器材1 月桂基硫酸盐胰蛋白胨(LST)肉汤:2 EC肉汤(E.coli broth):3 蛋白胨水:4磷酸盐缓冲液:5伊红美蓝(EMB)琼脂:6 营养琼脂斜面:7结晶紫中性红胆盐琼脂(VRBA):8革兰氏染色液:9无菌1mol/LNaOH:10无菌1mol/LHCl:四、操作方法样品的稀释1. 固体和半固体样品:称取25g样品,放入盛有225mL磷酸盐缓冲液的无菌均质杯内,8000r/min~10000r/min均质1min~2min,制成1:10的样品匀液或放入盛有225mL磷酸盐缓冲液的无菌均质袋中,用拍击式均质器拍打1min~2min制成1:10的样品匀液。
2.液体样品:以无菌吸管吸取25mL样品置盛有225mL磷酸盐缓冲液的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1.10的样品匀液。
3. 样品匀液的pH值应在6.5~7.5之间,必要时分别用1mol/LNaOH或1mol/LHCl 调节。
4 .用1mL无菌吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓缓注入9mL 磷酸盐缓冲液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面)振摇试管或换用1支1mL无菌吸管或吸头反复吹打,使其混合均匀,制成1:100的样品匀液。
大肠埃希氏菌(内容详细)

医学精制
38
6.3平板菌落数的选择
数在10 CFU~100 CFU之间的 平板,暗室 360nm~ 366nm 波 长紫外灯照
射下,计数
平板上发浅
蓝色荧光的 菌落。
医学精制
39
6.2 操作步骤
检验时用已知MUG阳性菌株(如大肠埃希 氏菌ATCC25922)和产气肠杆菌(如
ATCC 13048)做阳性和阴性对照。
的样品匀液,每个稀释度接种2个无菌平皿, 每皿1 mL。同时取1 mL稀释液加入无菌 平皿做空白对照。
医学精制
37
6.2 操作步骤
6.2.2.2 将10 mL~15 mL冷至 45℃±0.5℃的结晶紫中性红胆盐琼脂 (VRBA)倾注于每个平皿中。小心旋转 平皿,将培养基与样品匀液充分混匀。
6.2.2.2 …待琼脂凝固后,再加3mL~4 mL VRBA-MUG覆盖平板表层。凝固后 翻转平板,36 ℃±1 ℃培养18 h~24 h。
医学精制
6
1 范围
本标准规定了食品中大肠埃希氏菌 (Escherichia coli)计数的方法。
本标准适用于食品中大肠埃希氏菌的计数, 其中大肠埃希氏菌平板计数法(第二法) 不适用于贝类产品。
医学精制
7
2 术语和定义
2.1 大肠埃希氏菌 Escherichia coli 大肠杆菌广泛存在于人和温血动物的肠道 中,能够在44.5℃发酵乳糖产酸产气, IMViC(靛基质、甲基红、VP试验、柠檬 酸盐)生化试验为++――或-+――的 革兰氏阴性杆菌。以此作为粪便污染指标 来评价食品的卫生状况,推断食品中肠道 致病菌污染的可能性。
摇试管或换用1支1 mL无菌吸管或吸头反
复吹打,使其混合均匀,制成1:100的样
大肠埃希氏菌

3 设备和材料
3.7 无菌吸管:1 mL(具0.01 mL刻 度)、10 mL(具0.1 mL刻度)或微量 移液器及吸头。 3.8 无菌锥形瓶:容量500 mL。 3.9 无菌培养皿:直径90mm。 3.10 pH计或pH比色管或精密pH试纸。 3.11 菌落计数器。 3.12 紫外灯:波长360nm~366nm, 功率≤6 W。
VRBA-MUG平板计数法
MUG对大肠埃希氏菌的生长繁殖没有抑制 作用也没有促进作用,对菌落形态也没有 影响。经实验发现,在MUG浓度从0 g/mL到200 g/mL的范围内,大肠 埃希氏菌生长繁殖率没有区别。 MUG方法有大约4%的假阴性,特别是倍 受关心的O157:H7菌株为阴性,令人感 到遗憾,但经典的常规方法也同样存在这 样的问题。
6.2 操作步骤
6.2.2.2 将10 mL~15 mL冷至 45℃±0.5℃的结晶紫中性红胆盐琼脂 (VRBA)倾注于每个平皿中。小心旋转 平皿,将培养基与样品匀液充分混匀。 6.2.2.2 …待琼脂凝固后,再加3mL~4 mL VRBA-MUG覆盖平板表层。凝固后 翻转平板,36 ℃±1 ℃培养18 h~24 h。
研究还证实,大肠埃希氏菌荧光反应比产 气反应出现得更早,并且不受食品的影响, 仅发现对牡蛎直接进行的检验不适合用 MUG方法,法
本标准采用的VRBA-MUG平板计数方法, 正是以上述理论为依据,参照FDA方法而 确立的,检验时间为18 h~24 h,并能 准确测出样品中大肠埃希氏菌的CFU数值, 操作简便,但对于对染菌量低(如<10 CFU/g)的样品不如MPN法适用。
5.2.1 样品的稀释
5.2.1.5 根据对样品污染状况的估计,按 上述操作,依次制成10倍递增系列稀释样 品匀液。每递增稀释1次,换用1支1 mL 无菌吸管或吸头。从制备样品匀液至样品 接种完毕,全过程不得超过15 min。
大肠埃希氏菌报告

EMB琼脂上大肠埃希氏菌 典型菌与可疑菌落
典型菌落:具黑色中心有光泽或无光泽的 菌落。 非典型的可疑菌落:粉红色,无黑心。
5.2.5 营养琼脂斜面或平板培养
从每个平板上挑5个典型菌落,如无典型菌 落则挑取可疑菌落。用接种针接触菌落中 心部位,移种到营养琼脂斜面或平板上36 ℃±1 ℃,培养18 h~24 h。取培养物 进行革兰氏染色和生化试验
3 设备和材料
3.7 无菌吸管:1 mL(具0.01 mL刻 度)、10 mL(具0.1 mL刻度)或微量 移液器及吸头。 3.8 无菌锥形瓶:容量500 mL。 3.9 无菌培养皿:直径90mm。 3.10 pH计或pH比色管或精密pH试纸。 3.11 菌落计数器。 3.12 紫外灯:波长360nm~366nm, 功率≤6 W。
EC肉汤
EC肉汤主要成分: 乳糖、胆盐、胰蛋 白胨。 大肠埃希氏菌因分 解乳糖而产气,使 小倒管中可见气泡。
5.2.4 伊红美蓝平板分离培养
轻轻振摇各产气管,用接种环取培养物分 别划线接种于EMB平板,36 ℃±1℃培养 18 h~24 h。观察平板上有无具黑色中 心有光泽或无光泽的典型菌落。
VRBA-MUG平板计数法
常规方法不能检出不产气菌株和乳糖迟缓 发酵菌株,而且由于O157:H7菌株不能 耐受44℃的培养温度而同样不能检出 O157:H7菌株,普通变形杆菌等某些杂 菌的存在对大肠埃希氏菌发酵乳糖的产气 能力具有抑制作用,但对分解MUG产生荧 光的能力没有抑制作用。
VRBA-MUG平板计数法
大肠埃希氏菌平板计数法程序
检样25g(mL)+225mL稀释液
大肠埃希氏菌报告

6.4 大肠埃希氏菌平板计数的报告
两个平板上发荧光菌落数的平均数乘以稀 释倍数,报告每g(mL)样品中大肠埃希 氏菌数,以CFU/g (mL)表示。若所有稀 释度(包括液体样品原液)平板均无菌落 生长,则以小于1乘以最低稀释倍数报告。
质量控制
人员培训 标准菌株:大肠埃希氏菌ATCC 25922, 产气肠杆菌ATCC 13048 消耗性材料技术性验收
EC肉汤
EC肉汤主要成分: 乳糖、胆盐、胰蛋 白胨。 大肠埃希氏菌因分 解乳糖而产气,使 小倒管中可见气泡。
5.2.4 伊红美蓝平板分离培养
轻轻振摇各产气管,用接种环取培养物分 别划线接种于EMB平板,36 ℃±1℃培养 18 h~24 h。观察平板上有无具黑色中 心有光泽或无光泽的典型菌落。
大肠埃希氏菌平板计数法 (第二法)
制订依据
美国食品药品管理局(FDA): Bacteriological Analytical Manual ,2002,Chapter 4: Enumeration of Escherichia coli and the Coliform Bacteria
基本原理
4-甲基伞形酮-β-D-葡萄糖苷,英文缩写 MUG。是一种不产生荧光的底物。由于 96%的大肠埃希氏菌都具有葡萄糖醛苷酸 酶,能分解β-D葡萄糖醛苷,而使4-甲基 伞形酮游离出来,在366 nm紫外光下产 生蓝色荧光。观察到蓝色荧光即可认为是 大肠埃希氏菌阳性。MUG对大肠埃希氏菌 的生长繁殖既没有抑制作用也没有促进作 用,对菌落形态也没有影响。
6.2 操作步骤
6.2.2.2 将10 mL~15 mL冷至 45℃±0.5℃的结晶紫中性红胆盐琼脂 (VRBA)倾注于每个平皿中。小心旋转 平皿,将培养基与样品匀液充分混匀。 6.2.2.2 …待琼脂凝固后,再加3mL~4 mL VRBA-MUG覆盖平板表层。凝固后 翻转平板,36 ℃±1 ℃培养18 h~24 h。
大肠埃希氏菌报告

靛基质 (I) + + -
+
-
+ +
+ +
典型产气肠杆菌 非典型产气肠杆菌
生化鉴定
注1:如出现表1以外的生化反应类型,表 明培养物可能不纯,应重新划线分离,必 要时做重复试验。 注2:生化试验也可以选用生化鉴定试剂盒 或全自动微生物生化鉴定系统等方法,按 照产品说明书进行操作
5.3大肠埃希氏菌MPN计数的报告
6.4 大肠埃希氏菌平板计数的报告
两个平板上发荧光菌落数的平均数乘以稀 释倍数,报告每g(mL)样品中大肠埃希 氏菌数,以CFU/g (mL)表示。若所有稀 释度(包括液体样品原液)平板均无菌落 生长,则以小于1乘以最低稀释倍数报告。
质量控制
人员培训 标准菌株:大肠埃希氏菌ATCC 25922, 产气肠杆菌ATCC 13048 消耗性材料技术性验收
6.3平板菌落数的选择
数在10 CFU~100 CFU之间的 平板,暗室 360nm~ 366nm 波 长紫外灯照 射下,计数 平板上发浅 蓝色荧光的 菌落。
6.2 操作步骤
检验时用已知MUG阳性菌株(如大肠埃希 氏菌ATCC25922)和产气肠杆菌(如 ATCC 13048)做阳性和阴性对照。
EMB琼脂上大肠埃希氏菌 典型菌与可疑菌落
典型菌落:具黑色中心有光泽或无光泽的 菌落。 非典型的可疑菌落:粉红色,无黑心。
5.2.5 营养琼脂斜面或平板培养
从每个平板上挑5个典型菌落,如无典型菌 落则挑取可疑菌落。用接种针接触菌落中 心部位,移种到营养琼脂斜面或平板上36 ℃±1 ℃,培养18 h~24 h。取培养物 进行革兰氏染色和生化试验
大肠埃希氏菌生化鉴定结果

大肠埃希氏菌生化鉴定结果
摘要:
1.大肠埃希氏菌的概述
2.大肠埃希氏菌的生化鉴定方法
3.大肠埃希氏菌在食品、药品、化妆品行业的应用
4.大肠埃希氏菌ATCC25922 菌株的特点和用途
正文:
大肠埃希氏菌(Escherichia coli,简称E.coli)是一种革兰氏阴性的短杆菌,大小约为0.51~3 微米,具有周生鞭毛,能运动,无芽孢。
大肠埃希氏菌在人和动物的肠道中广泛存在,可以发酵多种糖类产酸、产气。
大肠埃希氏菌的生化鉴定方法通常包括发酵乳糖产酸产气实验和IMViC 试验。
发酵乳糖产酸产气实验中,大肠埃希氏菌在乳糖发酵培养基中会产生酸和气体,使培养基颜色由紫色变为黄色,导管中有气体产生。
IMViC 试验则是通过检测大肠埃希氏菌在靛基质、甲基红、V-P 试验和柠檬酸盐中的反应,来初步鉴别革兰氏阴性杆菌。
大肠埃希氏菌在食品、药品、化妆品等行业中有着广泛的应用。
例如,在食品工业中,大肠埃希氏菌常被用作指示菌,以检测食品的卫生质量。
在药品和化妆品行业中,大肠埃希氏菌则可用于检测生产过程中的污染情况。
大肠埃希氏菌ATCC25922 是一种常用的实验菌株,主要用于阳性对照反应和培养基质量控制等实验。
该菌株的特点是采用真空冷冻干燥技术,菌株质量稳定,保存时间长。
同时,大肠埃希氏菌ATCC25922 菌株还配套有菌株复苏液和复活说明书,菌株复活简单、方便。
此外,该菌株还附带完整的菌株鉴
定报告,安全、放心。
大肠菌群、粪大肠、大肠埃希氏菌检验的相关知识总结

大肠菌群、粪大肠、大肠埃希氏菌检验的相关知识总结1、大肠菌群、粪大肠菌群和大肠埃希氏菌检验方法(1)大肠菌群(colifoms)在36°C培养48h可发酵乳糖产酸产气、需氧或兼性厌氧的革兰氏阴性无芽孢杆菌。
该菌主要来源自人畜粪便,作为粪便污染指标评价食品的卫生状况,推断食品中肠道致病菌污染的可能。
(2)粪大肠菌群(Fecal colifoms)也称耐热大肠菌群。
指大肠菌群中能在44.5℃生长、发酵乳糖产生气体的一群细菌。
与大肠菌群一样,并非细菌学分类命名,而是卫生细菌领域的用语,它不代表某-一个或某一属细菌,而指的是具有某些特性的-组与粪便污染有关的细菌,这些细菌在生化及血清学方面并非完全一致。
食品卫生学意义:作为粪便污染食品的指标菌,MPN值愈低则说明食品受粪便污染程度及对人体健康危害程度愈低。
作为肠道致病菌污染食品的指针,大肠菌群数量越多则肠道致病菌存在的可能性就越高,但两者之间并不总是呈平行关系。
(3)大肠埃希氏菌(Escherichia coli)分类学概念:肠杆菌科、埃希氏菌属。
是人和温血动物肠道内普遍存在的细菌,是粪便中的主要菌种。
一般生活在人大肠中并不致病,但它侵入人体一些部位时,可引起感染。
主要有:O抗原(菌体抗原,150个);K抗原(荚膜抗原,90个);H抗原( 鞭毛抗原,50个)(4)致泻性大肠埃希氏菌能侵入肠粘膜上皮细胞,引起食物中毒的大肠埃希氏菌。
产毒性大肠埃希氏菌(ETEC)-肠胃炎、旅行性腹泻。
致病性大肠埃希氏菌(EPEC)-婴儿腹泻;肠出血性大肠埃希氏菌(EHEC)--出血性结肠炎;(O157:H7;O104:H4;O111;O126等)侵袭性大肠埃希氏菌(EIEC)—杆菌性痢疾;粘附性大肠埃希氏菌(EAEC)—急慢性腹泻。
2、大肠菌群、粪大肠菌群、大肠埃希氏菌的关系3、相关检验方法标准GB4789.3-2016食品安全国家标准食品微生物学检验大肠菌群计数GB 4789.38-2012食品安全国家标准食品微生物学检验大肠埃希氏菌计数GB 4789.39- -2013食品安全国家标准食品微生物学检验粪大肠菌群计数GB4789.6- 2016 食品安全国家标准食品微生物学检验致泻大肠埃希氏菌检验GB4789.36-2016食品安全国家标准食品微生物学检验大肠埃希氏O157:H7/NM检验。
38食品中大肠埃希氏菌计数(MPN法)原始记录

食品中大肠埃希氏菌计数(MPN法)原始记录
编号: WJK/JL-W-
061
共页第页
样品名称批
号:样品编
号:
样品性
状数
量
收样日
期年月日检测日期年月日
检测项
目
检测地点:微生物洁净室检测环境(温、湿度等)
检测依据(方法): GB/T4789.38-
2012
检测仪器编
号:
检验记录与结果
自总大肠菌群LST肉汤试验中的阳性管(产气)中取1滴培养物转种于EC肉汤管中,置44.5℃水浴箱内,培养24±2h~48±2h,如有产气者分离EMB平板培养。
经36℃±1℃培养18~24h,有典型菌落生长,进行革兰氏染色和生化试验,根据鉴定LST肉汤阳性管数查MPN表,报告每克(或毫升)样品中大肠杆菌MPN 值。
大肠杆菌计数
EC培养基(产气管数)
EMB平板
革兰氏染色镜检
靛基质(阳性管数)
甲基红(阳性管数)
VP试验(阳性管数)
柠檬酸盐(阳性管数)
结果
检测人:复核人:
年月日年月日。
大肠埃希氏菌生化鉴定结果

大肠埃希氏菌生化鉴定结果
【原创实用版】
目录
1.大肠埃希氏菌的概述
2.大肠埃希氏菌的生化鉴定方法
3.大肠埃希氏菌在食品、药品、化妆品等行业的应用
4.大肠埃希氏菌菌株的保存与复活
正文
大肠埃希氏菌(Escherichia coli,简称 E.coli)是一种革兰氏阴性的短杆菌,周生鞭毛,能运动,无芽孢。
它能发酵多种糖类产酸、产气,是人和动物肠道中的正常菌群。
大肠埃希氏菌在生化鉴定时,通常采用发酵乳糖产酸产气、IMViC 试验等方法进行鉴定。
在食品、药品、化妆品等行业中,大肠埃希氏菌常被用作阳性对照反应和培养基质量控制等实验。
例如,在食品检测中,大肠埃希氏菌被用作粪便污染指标,以评估食品的卫生质量。
此外,大肠埃希氏菌还可用于生产酸奶、发酵食品等。
大肠埃希氏菌菌株的保存与复活也是实验室工作中的重要环节。
为了保持菌株的质量稳定,长时间保存,可以采用真空冷冻干燥技术。
在复苏菌株时,需要使用配套的菌株复苏液和复活说明书,以确保菌株的简单、方便地复活。
总之,大肠埃希氏菌在生化鉴定、食品检测、发酵生产等方面具有广泛的应用。
第1页共1页。
73大肠埃希氏菌分析记录
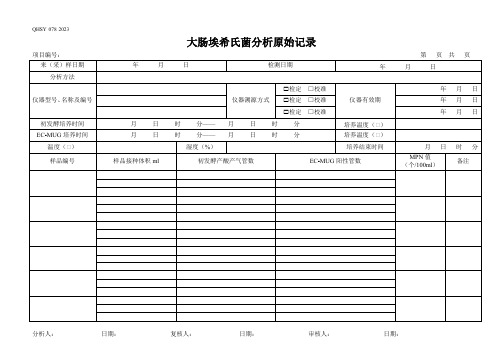
培养结束时间
月日时分
样品编号
样品接种体积ml初发酵产酸产气管数EC- NhomakorabeaUG阳性管数
MPN值
(个/100ml)
备注
大肠埃希氏菌分析原始记录(续表)
项目编号: 第 页 共 页
样品编号
样品接种体积ml
初发酵产酸产气管数
EC-MUG阳性管数
MPN值
(个/100ml)
备注
大肠埃希氏菌分析原始记录
项目编号: 第 页 共 页
来(采)样日期
年月日
检测日期
年月日
分析方法
仪器型号、名称及编号
仪器溯源方式
检定 □校准
仪器有效期
年月日
检定 □校准
年月日
检定 □校准
年月日
初发酵培养时间
月日时分——月日时分
培养温度(℃)
EC-MUG培养时间
月日时分——月日时分
培养温度(℃)
温度(℃)
大肠菌群计数实验报告

一、实验目的1. 了解大肠菌群在食品卫生检验中的意义。
2. 学习并掌握大肠菌群的检验原理和方法。
3. 通过实验,提高对食品卫生质量的判别能力。
二、实验原理大肠菌群是指一群能在37℃经24小时发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽孢杆菌。
该菌主要来源于人畜粪便,因此常被用作粪便污染指标,用于评价食品的卫生质量。
食品中大肠菌群数以每100g检样内大肠菌群最近似数表示。
本实验采用MPN(Most Probable Number)计数法,通过多次稀释样品,将稀释液接种于培养基中,观察菌落生长情况,结合MPN检索表,估算原样品中微生物的数量。
三、实验材料1. 样品:乳、肉、禽蛋制品、饮料、糕点、发酵调味品或其他食品。
2. 菌种:大肠埃希氏菌、产气肠杆菌。
3. 培养基及试剂:单料乳糖胆盐发酵管、双料乳糖胆盐发酵管、乳糖胆盐发酵管、伊红美蓝琼脂、革兰氏染色液、蛋白陈水、靛基质试剂、麦康凯(MA)。
4. 其他设备和材料:恒温培养箱、冰箱、恒温水浴箱、天平、无菌操作台、移液器、试管、吸管、镊子、酒精灯等。
四、实验步骤1. 样品处理:取适量样品,加入适量无菌生理盐水,进行10倍系列稀释。
2. 接种:取不同稀释度的样品稀释液,分别接种于单料乳糖胆盐发酵管中。
3. 培养:将接种后的发酵管置于37℃恒温培养箱中培养24小时。
4. 观察结果:观察发酵管中是否出现产酸产气现象,并记录结果。
5. 计算MPN值:根据发酵管中产酸产气的情况,结合MPN检索表,估算原样品中大肠菌群的MPN值。
五、实验结果与分析1. 实验过程中,各稀释度发酵管均出现产酸产气现象,说明样品中存在大肠菌群。
2. 根据MPN检索表,计算得到样品中大肠菌群的MPN值为10^2 CFU/g。
六、实验结论1. 本实验成功检测到样品中存在大肠菌群,说明样品可能存在粪便污染。
2. 根据大肠菌群的数量,可以初步判断样品的卫生质量。
3. 通过本实验,掌握了大肠菌群的检验原理和方法,提高了对食品卫生质量的判别能力。
大肠埃希氏菌计数 产气

肉汤结果判定 ℃ ± ℃培养
接种前的肉汤
不产气为阴性 产气为阳性
琼脂上大肠杆菌的典型菌落 与可疑菌落
典型菌落:具黑色中心有光泽或无光泽的 菌落。
非典型的可疑菌落:粉红色,无黑心
典型的大肠杆菌的菌落
非典型的大肠杆菌的菌落
试验原理
甲基红试验( )原理:本试验是用甲基红指 示剂测定细菌发酵葡萄糖时产生的氢离子 浓度的试验。大肠杆菌和大肠菌群能分解 葡萄糖产生大量酸性产物,使甲基红指示 剂变为红色。
中葡萄糖苷酶阳性的大肠杆菌数以两位整数大肠杆菌显色培养基大肠杆菌显色培养基杂菌大肠杆菌显色培养基同时检测大肠杆菌和大肠菌群大肠杆菌大肠菌群产气荚膜梭状芽孢杆菌检验内容标准的变更生物学特性菌体形态学特征培养特性和抵抗力培养基和试剂检验程序产气荚膜梭菌检验标准的变更步骤选择性分离生化鉴定标准亚硫酸盐多粘菌素磺胺嘧啶琼动力硝酸盐牛奶发酵卵磷脂分解新的检验方法胰月示亚硫酸盐环丝氨酸琼脂牛奶发酵乳糖明胶缓冲动力硝酸盐培养基牛奶发酵液体硫乙醇酸盐培养基英文名字由改为
菌落计数
在规定的培养结束后,选择总菌落(典型和 非典型菌落)数少于、典型菌落数少于的平 板,计算每一个平板上典型的β葡萄糖苷 酶阳性的大肠杆菌菌落数。
结果计算
至少有一个平板其蓝色菌落数不少于 时,按以下公
式计算:
N
a v(n10.1n2)d
∑:两个稀释度所有平板蓝色菌落数之和,其中两 个连续稀释度中至少有一个稀释度的蓝色菌落数不 少于。 :第一个稀释度平板个数。 :每个平板接种的体积()。 :第二个稀释度平板个数。 :稀释因子,相当于第一稀释度 。
注意:
在加入试剂时一定要加α萘酚,使其先与丁 二酮和胍基复合物结合,而后再加入氢氧化 钠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大肠杆菌计数的报告
大肠杆菌为革兰染色阴性无芽胞杆菌、发 酵乳糖、产酸、产气;试验为或。只要有 个菌落鉴定为大肠杆菌,其代表的肉汤管 即为大肠杆菌阳性。
依据肉汤阳性管数查表,报告每或每样品 中大肠杆菌值。
肉汤
肉汤主要成分:乳糖、胆盐、胰蛋白胨。 大肠杆菌因分解乳糖而产气,使小导管
中可见气泡。
样品匀液的值应在之间,必要时分别用氢氧 化钠或盐酸调节。
用无菌吸管或微量移液器吸取:样品匀液,沿 管壁徐徐注盛有磷酸盐缓冲液的无菌试管中 (注意吸管或吸头尖端不要触及稀释液面),振 摇试管或换用一支无菌吸管或吸头反复吹打, 使其混合均匀,制成:的样品匀液。
根据对样品污染状况的估计,按上述操作,依 次制成倍递增系列稀释样品匀液。每递增稀释 次,换用支无菌吸管或吸头。从制备样品匀液 至接种完毕,全过程不得超过。
注意:培养时间不得<;接种菌量浓度不 宜过大,否则细菌生长受抑制,因此,接 种量、试管大小应尽量标准化,否则影响 结果判定及重复性差
靛基质试验()原理:细菌(如大肠埃希菌、大 肠菌群等)含有色氨酸酶,将蛋白胨中的色氨 酸分解,生成靛基质。靛基质与对二甲基苯 甲醛作用,形成红色的玖瑰靛基质(红色的醇 层,为醌型结构的红色集约化化合物),呈红 色。
生化试验
靛基质试验:将培养物接种于蛋白胨水, ℃±℃培养 ±,加靛基质试剂,上层出现红 色为阳性。
试验:将培养物接种于培养基,℃±℃培养 ±,移取培养物至×小试管中,加α萘酚乙 醇溶液、氢氧化钾和少许肌酸结晶。振摇后 静置,如出现伊红色为试验阳性。
将试验剩余培养物再培养后,滴加滴甲基 红试剂,培养物变红为甲基红试验阳性; 变黄为阴性。
初发酵试验
选择适宜的三个连续稀释度的样品匀液(液 体样品可以选择原液)。每个稀释度接种管 肉汤,每管接种(如接种量需要超过 ,则 用双料肉汤),℃±℃培养±,观察小导管 内是否有气泡产生,如未产气继续培养至±。 记录在内产气的管数。如所有肉汤管均未产 气,即可报告大肠杆菌结果;如有产气者, 则进行复发酵试验。
肉汤结果判定 ℃ ± ℃培养
接种前的肉汤
不产气为阴性 产气为阳性
琼脂上大肠杆菌的典型菌落 与可疑菌落
典型菌落:具黑色中心有光泽或无光泽的 菌落。
非典型的可疑菌落:粉红色,无黑心
典型的大肠杆菌的菌落
非典型的大肠杆菌的菌落
试验原理
甲基红试验( )原理:本试验是用甲基红指 示剂测定细菌发酵葡萄糖时产生的氢离子 浓度的试验。大肠杆菌和大肠菌群能分解 葡萄糖产生大量酸性产物,使甲基红指示 剂变为红色。
柠檬酸盐利用试验:将培养物接种于氏柠 檬酸盐肉汤, ℃±℃培养±,记录有无细 菌生长,生长为阳性。
大肠杆菌与非大肠杆菌的生化鉴别
靛基质 甲基红 试验 () 枸橼酸盐()
()
()
+
+
-
-
-
+
-
-
+
+
-
+
-
+
-
+-ຫໍສະໝຸດ -+++
-
+
+
鉴定(型别)
典型大肠杆菌 非典型大肠杆菌
典型中间型 非典型中间型
非典型产气肠杆菌 非典型产气肠杆菌
大肠埃希氏菌计数
技术支持 田亮 广东微生物研究所 广东环凯微生物科技有限公司
大肠杆菌的定义
广泛存在于人和温血动物的肠道中,能够在 ℃发酵乳糖产酸产气、 生化试验 (靛基质、 甲基红、试验、柠檬酸盐)为 或 的革兰阴 性杆菌。
卫生学意义
大肠杆菌的某些菌株对人有致病性。
相对于大肠菌群和粪大肠菌群,大肠杆菌 与粪便污染的相关性最好,是指示粪便污 染最理想的指标,应用也最悠久。自年被 提议作为粪便污染的指示菌以来,已被应 用了多年 。
伊红美蓝平板分离培养
轻轻振摇各产气管,用接种环取培养物划 线分离于伊红美蓝()平板。℃±℃培养 ±后,检验平板上有无具黑色中心有光泽 或无光泽的典型菌落。
营养琼脂斜面或平板培养
从每个平板上挑选个典型菌落,如无典 型菌落则挑取可疑菌落。用接种针接触 菌落中心部位,移种到营养琼脂斜面或 平板上,℃ ± ℃培养,取培养物进行革 兰染色和生化试验。
注意:
蛋白胨的色氨酸含量与靛基质试验阳性反应 密切相关,若蛋白胨水中加入的色氨酸或选 用色氨酸高的胰蛋白胨做靛基质试验效果更 佳。
试验()原理:本试验是检查细菌利用葡萄后 所产生的代谢终产物乙酰甲基甲醇的实验。 细菌在葡萄糖代谢中生成丙酮酸,丙酮酸仅 是中间产物。随细菌种属不同而有多种分解 途径,使丙酮酸进一步分解为不同的终产物, 借此鉴定菌种。
复发酵试验
用接种环分别从所有±内发酵产气的管取培 养物环,移种到已提前预温至℃的肉汤管中, 放入带盖的℃±℃水浴箱内,水浴的水面应 高于肉汤培养基液面,培养±,检查小导管 内是否有气泡产生,如未产气继续培养至±。 记录在和内产气的肉汤管数。如所有肉汤管 均未产气,即可报告大肠杆菌结果。如有产 气者,则进行平板分离培养。
为什么后来又有了大肠菌群和粪大肠菌群 的应用?主要的原因是因为大肠杆菌的检 验过于复杂。
随着食品卫生标准的日益科学和细化,以 及对大肠杆菌检验方法的不断改进,对特 定食品的大肠杆菌的检验需求肯定会越来 越多。
可作为评价消毒效果的指示菌。
大肠杆菌的生化特性
形态与染色: 革兰染色朱阴性无芽胞的短小杆菌;多数菌株有
注意:
在加入试剂时一定要加α萘酚,使其先与丁 二酮和胍基复合物结合,而后再加入氢氧化 钠。
大肠杆菌计数法检验程序
检样()稀释液,均质 倍稀释
不产气
选择个连续稀释度样品匀液接种
℃±℃
±
产气
℃±℃
肉汤 ±
查表,报告
不产气
产气
℃±℃
琼脂平板 营养琼脂斜面培养
生化试验,革兰染色
样品的稀释
固体和半固体食品:称取样品,放入盛有 生 理盐水或磷酸盐缓冲液的无菌均质杯内,于 均质~,或放入盛有 生理盐水的无菌均质袋 中,用均质器拍打~,制成的样品匀液。
根鞭毛,能运动。少数菌有荚膜。 培养特性: 需氧或兼性厌氧。最适温度℃,但在℃也能生长。
最适。
大肠埃希氏菌计数
“大肠杆菌—平板计数”改为“大肠 埃希氏菌平板计数法” 删除大肠杆菌测试片计数法
大肠杆菌计数
第一法:法 第二法:大肠埃希氏菌平板计数法
第一法 大肠杆菌计数法
