药品零售企业《药品经营质量管理规范》现场检查细则
药品零售企业《药品经营质量管理规范》现场检查细则

药品零售企业《药品经营质量管理规范》现场检查细则
药品零售企业《药品经营质量管理规范》现场检查细则
第一章总则
第一条为了规范药品零售企业的经营行为,保护消费者的合法
权益,提高药品经营质量,特制定本《药品经营质量管理规范》现
场检查细则(以下简称“本细则”)。
第二条本细则适用于药品零售企业的现场检查,旨在检查企业
是否符合相关法律法规的要求,是否按照规范的标准进行经营管理。
第二章经营许可要求
第一节经营许可证件
第三条药品零售企业应当依法办理经营许可手续,并保持有效
的经营许可证件。
第四条经营许可证件应当在经营场所显著位置张贴,并定期更新。
第二节经营范围
第五条药品零售企业的经营范围应当与其经营许可证件所载明
的范围相符,并且不得超过许可证件载明的范围。
第六条药品零售企业应当按照国家药品目录经营相应的药品,并不得销售未经许可的药品。
:::
附件:
1、附件1:《药品经营许可证件样本》
2、附件2:《药品零售企业经营许可证件标准》
法律名词及注释:
1、经营许可证件:指药品零售企业依法办理的经营许可手续,并获得的许可证件。
2、经营范围:指药品零售企业所能涉及的药品类型和经营行为的范围。
3、国家药品目录:指国家药品监督管理部门发布的可供经营的药品目录。
广西壮族自治区食品药品监督管理局关于印发药品经营企业药品经营质量管理规范认证检查细则

附件1
广西壮族自治区药品批发企业药品经营
质量管理规范认证检查细则(试行)
说明
1、为规范《药品经营质量管理规范》(卫生部令第90号,以下简称《规范》)现场检查,确保检查工作质量,根据《规范》以及附录的条款设置要求,制定本细则。
2、食品药品监督管理部门应当根据《规范》和本细则,对企业实施《规范》情况进行全面检查。
3、药品批发企业检查项目共265 项,其中严重缺陷项目(**)5项,主要缺陷项目(*)56项,一般缺陷项目204项。
企业计算机系统,药品储存运输环境温湿度自动检测,药品收货与验收,冷藏、冷冻药品的储存与运输管理,验证管理等应符合《规范》附录中相关规定的要求。
4、药品批发企业分支机构抽查比例30%;一个分支机构不合格,视为一个主要缺陷。
5、本细则由广西壮族自治区食品药品监督管理局认证审评中心负责解释。
6、评定方法
(1)现场检查时,检查组应对所列条款检查内容进行全面检查,并逐条作出评定。
(2)每一条款检查内容中,凡有一条评定细则未达标的,
该条款即为缺陷项目。
其中,严重缺陷项目不合格为严重缺陷,主要缺陷项目不合格为主要缺陷,一般项目不合格为一般缺陷。
(3)合理缺陷项目认定原则:《药品经营许可证》中经营范围未核准的项目,即为合理缺陷项目。
合理缺陷项目不予评定,计算一般缺陷率时,从标准项目总数中,减去合理缺陷项目数,计算公式为:
一般缺陷率=
一般缺陷项目数
×100% 一般项目总数-一般合理缺陷项目数
(4)结果评定
2
— 3 —
4
— 5 —
6
— 7 —
8
— 9 —
10。
药品经营质量管理规范现场检查指导原则 药品零售企业

药品经营质量管理规范现场检查指导原则
说明
一、为规范《药品经营质量管理规范》检查工作,确保检查工作质量,根据《药品经营质量管理规范》,制定《药品经营质量管理规范现场检查指导原则》。
二、应当按照本指导原则中包含的检查项目和所对应的附录检查内容,对药品经营企业实施《药品经营质量管理规范》情况进行全面检查。
三、按照本指导原则进行检查过程中,有关检查项目应当同时对照所对应的附录检查内容进行检查。
如果附录检查内容检查中存在任何不符合要求的情形,所对应的检查项目应当判定为不符合要求。
四、本指导原则批发企业检查项目共258项,其中严重缺陷项目(**)6项,主要缺陷项目(*)107项,一般缺陷项目145项。
本指导原则零售企业检查项目共180项,其中严重缺陷项目(**) 4项,主要缺陷项(*)58 项,一般缺陷项118项。
五、药品零售连锁企业总部及配送中心按照药品批发企业检查项目检查,药品零售连锁企业门店按照药品零售企业检查项目检查。
六、结果判定:
注:缺陷项目比例数=对应的缺陷项目中不符合项目数/(对应缺陷项目总数-对应缺陷检查项目合理缺项数)×100%。
第二部分药品零售企业一、《药品经营质量管理规范》部分
二、附录部分
(一)药品经营企业计算机系统
(二)药品收货与验收。
广西壮族自治区药品零售企业药品经营质量管理规范认证检查细则(试行)新修订

广西壮族自治区药品零售企业药品经营质量管理规范认证检查细则(试行)新修订
广西壮族自治区药品零售企业药品经营质量管理规范认证检查细则(试行)
说明
1、为规范《药品经营质量管理规范》(卫生部令第90号,以下简称《规范》)现场检查,确保检查工作质量,根据《规范》以及附录的条款设置要求,制定本细则。
2、食品药品监督管理部门应当根据《规范》和本细则,对企业实施《规范》情况进行全面检查。
3、药品零售企业检查项目共176 项,其中严重缺陷项目(**)5项,主要缺陷项目(*)44项,一般缺陷项目127项。
企业计算机系统,药品储存运输环境温湿度自动检测,药品收货与验收,冷藏、冷冻药品的储存与运输管理,验证管理等应符合《规范》附录中相关规定的要求。
4、本细则由广西壮族自治区食品药品监督管理局认证审评中心负责解释。
5、评定方法
(1)现场检查时,检查组应对所列条款检查内容进行全面检查,并逐条作出评定。
(2)每一条款检查内容中,凡有一条评定细则未达标的,该条款即为缺陷项目。
其中,严重缺陷项目不合格为严重缺陷,主要缺陷项目不合格为主要缺陷,一般项目不合格为一般缺陷。
(3)合理缺陷项目认定原则:《药品经营许可证》中
经营范围未核准的项目,即为合理缺陷项目。
合理缺陷项目不予评定,计算一般缺陷率时,从标准项目总数中,减去合理缺陷项目数,计算公式为:
一般缺陷率=
一般缺陷项目数
×100% 一般项目总数-一般合理缺陷项目数
(4)结果评定。
《药品经营质量管理规范现场检查指导原则》(药品批发企业版附录一冷藏冷冻药品的储存与运输管理)

2.可实时采集、显示、记录、传送运输过程中的温度数据。
3.具有远程及就地实时报警功能。
4.可通过计算机读取和存储所记录的监测数据。
05201
储存、运输设施设备的定期检查、清洁和维护应当由专人负责,并建立记录和档案。
定期对冷库、冷藏车以及冷藏箱、保温箱进行检查、维护并记录。
*05601
企业应当根据验证确定的参数及条件,正确、合理使用相关设施设备。
企业应当依据验证确定的参数和条件,制定设施设备的操作、使用规程。
*07401
冷藏、冷冻药品到货时,应当对其运输方式及运输过程的温度记录、运输时间等质量控制状况进行重点检查并记录,不符合温度要求的应当拒收。
1.企业应当按照《规范》的要求,进行冷藏、冷冻药品的收货检查。
2.装箱前将冷藏箱、保温箱预热或预冷至符合药品包装标示的温度范围内。
3.按照验证确定的条件,在保温箱内合理配备与温度控制及运输时限相适应的蓄冷剂。
4.药品装箱后,冷藏箱启动动力电源和温度监测设备,保温箱启动温度监测设备,检查设备运行正常后,将箱体密闭。
09904
装车前应当检查冷藏车辆的启动、运行状态,达到规定温度后方可装车。
5.根据承运方的资质和条件,必要时对承运方的相关人员进行培训和考核。
10801
企业委托运输药品应当与承运方签订运输协议,明确药品质量责任、遵守运输操作规程和在途时限等内容。
1.与承运方签订委托运输协议。
2.内容包括承运方制定并执行符合要求的运输标准操作规程,对运输过程中温度控制和实时监测的要求,明确在途时限以及运输过程中的质量安全责任。
2.冷库内制冷机组出风口100厘米范围内,以及高于冷风机出风口的位置,不得码放药品。
(完整版)药品经营质量管理规范现场检查指导原则

药品经营质量管理规范现场检查指导原则
说明
一、为规范《药品经营质量管理规范》检查工作,确保检查工作质量,根据《药品经营质量管理规范》,制定《药品
经营质量管理规范现场检查指导原则》。
二、应当按照本指导原则中包含的检查项目和所对应的附录检查内容,对药品经营企业实施《药品经营质量管理规范》情况进行全面检查。
三、按照本指导原则进行检查过程中,有关检查项目应当同时对照所对应的附录检查内容进行检查。
如果附录检查内容检查中存在任何不符合要求的情形,所对应的检查项目应当判定为不符合要求.
四、本指导原则批发企业检查项目共258项,其中严重缺陷项目(**)6项,主要缺陷项目(*)107项,一般缺陷项目145项。
本指导原则零售企业检查项目共180项,其中严重缺陷项目(**) 4项,主要缺陷项(*)58 项,一般缺陷项118项。
五、药品零售连锁企业总部及配送中心按照药品批发企业检查项目检查,药品零售连锁企业门店按照药品零售企业检查项目检查.
六、结果判定:
注:缺陷项目比例数=对应的缺陷项目中不符合项目数/(对应缺陷项目总数—对应缺陷检查项目合理缺项数)×100%。
第一部分药品批发企业(略)
第二部分药品零售企业
一、《药品经营质量管理规范》部分
二、附录部分
(一)药品经营企业计算机系统
(二)药品收货与验收。
药品零售企业《药品经营质量管理规范》现场检查细则

药品零售企业《药品经营质量管理规范》现场检查细则《药品经营质量管理规范》现场检查细则一、企业基本信息1.1 企业名称:1.2 企业地质:1.3 法定代表人:1.4 经营许可证号:二、人员管理2.1 负责药品销售的人员是否持有相关资格证书?2.2 负责质量管理的人员是否具备相关药学或生物医药专业背景?2.3 人员培训记录是否完备,并包括药品销售知识和质量管理要求的培训?三、药品管理3.1 药品采购管理3.1.1 是否建立药品采购合同,并记录药品供应商的相关信息?3.1.2 是否对药品供应商进行评估,并记录评估结果?3.1.3 是否建立药品采购验收记录,包括药品的外观、包装、标签、有效期等要求?3.2 药品库存管理3.2.1 是否建立药品库存台账,并严格按照药品分类进行管理?3.2.2 是否定期进行库存盘点,并记录盘点结果?3.2.3 是否对过期、失效或破损的药品进行及时处理,并记录处理情况?3.3 药品销售管理3.3.1 是否建立购药登记制度,要求购药者提供相关身份信息?3.3.2 是否建立药品销售记录,包括药品名称、批号、销售数量等信息?3.3.3 是否对处方药品实施严格审查,并保留相关处方复印件?四、质量保证体系4.1 是否建立质量保证手册,并明确质量管理体系的组织结构和职责?4.2 是否建立流程文件,明确各个环节的操作规程和要求?4.3 是否进行质量风险评估,并采取相应的控制措施?附件:附件二:药品库存盘点记录表附件三:药品销售记录表法律名词及注释:1.药品销售许可证:药品经营企业必须持有的合法经营凭证。
2.质量管理体系:一种组织管理的工具,旨在确保产品或服务满足质量要求并持续改进。
《药品经营质量管理规范》现场检查细则XXXX年

2.质量治理体系文件内容应符合企业实际。
3.按照文件规定开展质量策划、质量操纵、质量保证、质量改进和质量风险治理等活动,并建立有关记录,记录应当真实完整。
1.检查企业是否制定了质量治理体系文件,是否覆盖企业经营治理各环节、各部门和各岗位。
2.审查企业质量治理体系文件是否符合法律法规和本规范的要求,是否符合企业实际,并及时修改和更新。
3.有与经营方式、经营范畴和经营规模相适应的质量治理制度、部门和岗位职责、操作规程、记录与凭证、档案等,及时更新。
4.企业人员、仓库、设施设备、运算机治理系统等应符合《药品经营质量治理规范》(以下简称《规范》)的有关要求,并与经营范畴、经营规模相适应。
1.查看资料:
(1)检查企业质量治理体系建立的差不多情形。
则药品经营质量管理规范现场检查细则xxxx年年湖南省药品批发企业药品经营质量治理规范现场检查细则试行湖南省食品药品监督治理局2013年12月湖南省药品批发企业药品经营质量治理规范现场检查细则试行序号条款号检查项目要求检查方法100401药品经营企业应当依法经营
《药品经营质量管理规范》现场检查细则XXXX年
2.检查是否按照经营范畴开展风险点动态排查(质量风险点列表),是否开展了动态风险评估。
2.企业必须按照核定的经营地址、仓库地址、经营范畴、经营方式依法开展经营活动。
3.企业不得有为他人以本企业的名义经营药品提供场所、资质证明文件、票据、账户等行为。
4.企业不得有其他严峻违反法律法规、规章等规定的行为。
1.企业《药品经营许可证》、《药品经营质量治理规范认证证书》和《营业执照》在有效期内(证书连续的,应当有原发证机关出具的证书连续证明材料)。
药品经营质量管理规范现场检查指导原则

药品经营质量管理规范现场检查指导原则说明一、为规范《药品经营质量管理规范》检查工作,确保检查工作质量,根据《药品经营质量管理规范》,制定《药品经营质量管理规范现场检查指导原则》。
二、应当按照本指导原则中包含的检查项目和所对应的附录检查内容,对药品经营企业实施《药品经营质量管理规范》情况进行全面检查。
三、按照本指导原则进行检查过程中,有关检查项目应当同时对照所对应的附录检查内容进行检查。
如果附录检查内容检查中存在任何不符合要求的情形,所对应的检查项目应当判定为不符合要求。
四、本指导原则批发企业检查项目共258项,其中严重缺陷项目(**)6项,主要缺陷项目(*)107项,一般缺陷项目145项。
本指导原则零售企业检查项目共180项,其中严重缺陷项目(**)4项,主要缺陷项(*)58项,一般缺陷项118项。
五、药品零售连锁企业总部及配送中心按照药品批发企业检查项目检查,药品零售连锁企业门店按照药品零售企业检查项目检查。
六、结果判定:检查项目严重缺陷项目≥1主要缺点项目<10%≥10%<10%普通缺点项目≤20%20%~30%<20%≥20%≥30%不通过检查结果判定通过检查限期整改后复核检查注:缺陷项目比例数=对应的缺陷项目中不符合项目数/(对应缺陷项目总数-对应缺陷检查项目合理缺项数)×100%。
第一局部药品批发企业(258项检查内容省略)第二部分药品零售企业一、《药品经营质量办理标准》局部序号1234条款号总则质量管理XXX经营企业应当依法经营。
**药品经营企业应当坚持诚实守信,制止任何虚假、欺骗行为。
**企业应当按照有关法律法规及本规范的要求制定质量管理文件,开展质量管理活动,确保药品质量。
企业应当具有与其经营范围和规模相适应的经营条件,包括组织机构、人员、设施设备、质量办理文件,并按照划定设置计算机系统。
企业负责人是药品质量的主要责任人,负责企业日常管理,负责提供必要的条件,保证**质量管理部门和质量管理人员有效履行职责,确保企业按照《规范》要求经营药品。
药品经营质量管理规范现场检查指导原则GSP使用解析零售企业

演讲人
目录
01. GSP概述 02. GSP现场检查 03. GSP在零售企业的应用
GSP概述
GSP的定义和意义
01
GSP:药品经营质量管理规范,是一
套针对药品经营企业的质量管理体系。
02
目的:确保药品质量和安全,保障公
众用药安全。
03
03
药品采购:采购渠道、采 购记录、供应商资质等
05
药品储存:储存条件、温 湿度记录等
07
售后服务:顾客投诉处理 记录等
02
质量管理体系:质量管理 文件、人员培训记录等
04
药品验收:验收记录、不 合格药品处理记录等
06
药品销售:销售记录、处 方药销售记录等
08
计算机系统:系统功能、 数据备份等
检查方法
内容:包括药品采购、验收、储存、
销售、运输等环节的质量管理要求。
04
意义:提高药品经营企业的质量管理
水平,促进行业健康发展。
GSP的适用范围
适用于药 品生产企
业
适用于药 品经营企
业
适用于药 品使用单
位
适用于药 品监督管
理部门
GSP的实施和监督
GSP的实施:药品 经营企业按照GSP 要求进行经营管理
药品不良反应报告:建立 完善的药品不良反应报告 和处理机制,确保药品安
全
零售企业GSP实施要点
建立完善的质量 管理体系,确保 药品质量安全
设立专门的质量 管理部门,负责 药品质量管理工 作
制定详细的药品 采购、验收、储 存、销售等环节 的操作规程
定期对员工进行 GSP培训,提高 员工的质量意识 和操作技能
药品批发企业《药品经营质量管理规范》

11
*00901
企业应当对内审的情况进行分析,依据分析结论制定相 应的质量管理体系改进措施,不断提高质量控制水平, 保证质量管理体系持续有效运行。
1应当汇总内审结论、分析缺陷原因、提出改进措施;
2•药品经营企业应当根据有关法律法规、《规范》以及质量管理体系内审的要求,及时对计算 机系统进行升级,完善系统功能;
3•审核并及时修订质量管理体系文件,保证文件符合法规要求和企业实际;
4•审核组织机构和人员,对不合格人员及时调整和培训,使人员资质和能力符合规范要求;
5•审核设备设施,及时对设备设施进行更新和改造。
12
01001
企业应当采用前瞻或者回顾的方式,对药品流通过程中 的质量风险进行评估、控制、沟通和审核。
2.企业应按照《国务院办公厅关于加快推进重要产品追溯体系建设的意见》(国办发〔2015〕95号)、《总局关于推动食品药品生产经营者完善追溯体系的意见》(食药监科〔2016〕122号) 和《规范》要求,建立药品追溯系统,实现药品可追溯。
2
**00401
药品经营企业应当依法经营。
1.《药品经营许可证》、《药品经营质量管理规范认证证书》、营业执照等,证件齐全且有效;
2•应当建立依据企业质量方针制定的质量目标文件,并分别制定各个部门和岗位质量目标,质 量目标应当具体、量化,可操作;
3•企业人员均应当熟悉企业质量方针和质量目标,并按规定贯彻实施质量方针和实现质量目 标;
4•应当建立质量目标的定期检查、考核、评价记录。
8
*00701
企业质量管理体系应当与其经营范围和规模相适应,包 括组织机构、人员、设施设备、质量管理体系文件及相 应的计算机系统等。
山西省药品零售企业《药品经营质量管理规范》认证现场检查评定标准(分栏)

山西省药品零售企业《药品经营质量管理规范》认证现场检查评定标准(分栏)山西省药品零售企业《药品经营质量管理规范》认证现场检查评定标准(分栏)1.质量管理体系建设1.1 质量管理体系组织1.1.1 设立质量管理部门1.1.2 指定质量管理部门负责人1.1.3 制定质量管理职责和权限1.1.4 建立质量管理制度1.1.5 开展质量培训和教育1.2 文件和记录管理1.2.1 建立文件管理制度1.2.2 确保文件的准确性和时效性1.2.3 建立记录管理制度1.2.4 确保记录的准确性和完整性1.3 药品质量管理1.3.1 质量管理岗位设置1.3.2 质量管理流程1.3.3 质量管理文件1.3.4 质量管理记录1.3.5 质量管理风险评估和控制2.药品经营管理2.1 药品采购管理2.1.1 供应商评价和选择2.1.2 采购合同管理2.1.3 药品验收管理2.1.4 药品采购记录2.2 药品库存管理2.2.1 药品存储条件和设施2.2.2 药品购进和发出记录2.2.3 药品库存盘点2.2.4 药品库存变动管理2.3 药品销售管理2.3.1 药品销售控制2.3.2 客户服务和投诉处理2.3.3 药品销售记录2.3.4 药品退换货管理3.药品跟踪追溯管理3.1 药品批次管理3.1.1 药品批次追溯制度3.1.2 药品批次信息记录3.2 药品溯源体系建设3.2.1 药品溯源体系规划3.2.2 药品溯源码的和应用3.2.3 药品流通环节的追溯管理4.制度执行和整改4.1 制度执行情况评估4.1.1 制度执行检查4.1.2 制度执行评估报告4.2 整改措施4.2.1 制度整改措施4.2.2 质量问题报告和处理附件:1.质量管理制度范本2.文件和记录管理流程图4.药品库存盘点表格5.药品销售记录样本法律名词及注释:1.药品经营质量管理规范:国家药品监督管理局制定的用于指导药品零售企业质量管理的规范文件。
2.质量管理体系:组织在制度、流程、培训等方面构建的用于管理和保证药品质量的体系。
《药品经营质量管理规范现场检查指导原则》(药品批发企业版附录一冷藏冷冻药品的储存与运输管理)

1附录部份 (一)冷藏冷冻药品的储存与运输管理从事冷藏、冷冻药品收货、验收、储存、养护、出库、运输等 岗位工作的人员,应当接受相关法律法规、专业知识、相关制 度和标准操作规程的培训,经考核合格后,方可上岗。
1.冷库设计应当符合国家相关标准要求。
2.应当合理划分冷库收货验收、储存、包装材料预冷、装箱发 货、待处理药品存放等区域,并有明显标示。
1.冷库具有自动调控温湿度的功能。
2.冷库配置温湿度自动监测系统。
3.可实时采集、显示、记录、传送储存过程中的温湿度数据。
4.具有远程及就地实时报警功能。
5.可通过计算机读取和存储所记录的监测数据。
1.冷藏车的配置符合国家相关标准要求。
2.冷藏车箱具有防水、密闭、耐腐蚀等性能。
3.冷藏车箱内部留有保证气流充分循环的空间。
1.冷藏箱、保温箱具有良好的保温性能。
2.冷藏箱具有自动调控温度的功能。
3.保温箱配备蓄冷剂以及与药品隔离的装置。
企业运输冷藏、冷冻药品,应当根据药品数量、运输距离、运输时间、温度要求、外部环境温度等情况,选择适宜的运输工具和温控方式,确保运输过程温度符合要求。
从事冷藏冷冻药品储存、运输等工作的人员, 应当接受相关法律法规和专业知识培训并经考 核合格后方可上岗。
经营冷藏、冷冻药品的,应当配备与其经营规 模和品种相适应的冷库。
冷库应当配备温度自动监测、显示、记录、调 控、报警的设备。
经营冷藏、冷冻药品的应当配备冷藏车。
经营冷藏、冷冻药品的应当配备车载冷藏箱或者 者保温箱等设备。
运输冷藏、冷冻药品的冷藏车及车载冷藏箱、 保温箱应当符合药品运输过程中对温度控制的*02802*04901*04903*04906*04907*0510121.冷藏车具有自动调控温度的功能。
2.冷藏车配置温湿度自动监测系统。
3.可实时采集、显示、记录、传送运输过程中的温度数据。
4.具有远程及就地实时报警功能。
5.可通过计算机读取和存储所记录的监测数据。
药品经营质量管理规范现场检查评定细则

说明
一、为规范《药品经营质量管理规范》检查工作,确保检查工作质量,根据《药品经营质量管理规范》、《药品经营质量管理规范现场检查指导原则》,制定本细则。
二、食品药品监督管理部门应当按照本细则中的检查项目,结合具体要求,对药品经营企业实施《药品经营质量管理规范》情况进行全面检查。
三、企业应对照《药品经营质量管理规范现场检查指导原则》附录,持续做好药品经营质量管理工作。
四、本细则批发企业检查项目共258项,其中严重缺陷项目(**)6项,主要缺陷项目(*)107项,一般缺陷项目145项。
本细则零售企业检查项目共180项,其中严重缺陷项目(**)4项,主要缺陷项(*)58项,一般缺陷项118项。
五、药品零售连锁企业总部及配送中心按照药品批发企业检查相关项目检查,药品零售连锁企业门店按照药品零售企业检查相关项目检查。
六、结果判定:
第一部分药品批发(连锁总部及配送中心)企业。
药品经营质量管理规范现场检查指导原则
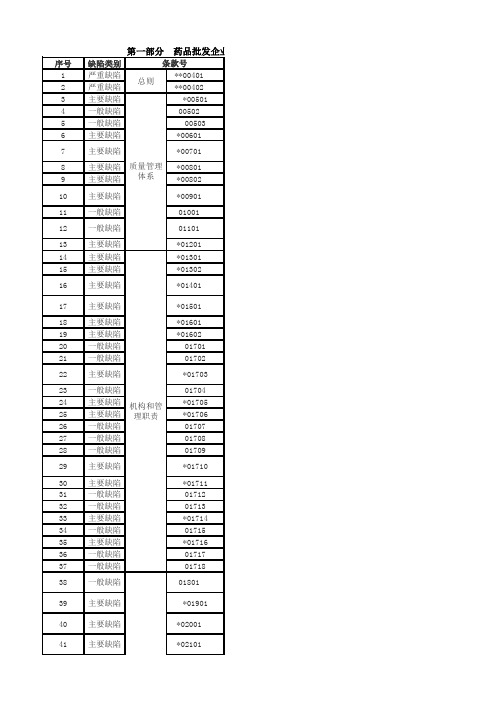
第一部分 药品批发企业序号缺陷类别1严重缺陷**00401 2严重缺陷**00402 3主要缺陷*005014一般缺陷00502 5一般缺陷005036主要缺陷*00601 7主要缺陷*00701 8主要缺陷*00801 9主要缺陷*00802 10主要缺陷*00901 11一般缺陷01001 12一般缺陷01101 13主要缺陷*01201 14主要缺陷*01301 15主要缺陷*01302 16主要缺陷*01401 17主要缺陷*01501 18主要缺陷*01601 19主要缺陷*01602 20一般缺陷0170121一般缺陷0170222主要缺陷*0170323一般缺陷0170424主要缺陷*0170525主要缺陷*0170626一般缺陷0170727一般缺陷0170828一般缺陷0170929主要缺陷*0171030主要缺陷*0171131一般缺陷0171232一般缺陷0171333主要缺陷*0171434一般缺陷0171535主要缺陷*0171636一般缺陷0171737一般缺陷0171838一般缺陷01801 39主要缺陷*0190140主要缺陷*02001 41主要缺陷*02101条款号总则质量管理体系机构和管理职责42一般缺陷0220143主要缺陷*02202 44主要缺陷*02203 45一般缺陷0220446主要缺陷*02205 47一般缺陷0220648一般缺陷02207 49主要缺陷*02208 50主要缺陷*02301 51一般缺陷02401 52一般缺陷02402 53主要缺陷*02501 54一般缺陷02601 55主要缺陷*02701 56一般缺陷02702 57主要缺陷*02801 58主要缺陷*0280259一般缺陷02901 60一般缺陷0290261一般缺陷03001 62一般缺陷03002 63一般缺陷0300364严重缺陷**03101 65主要缺陷*03201 66一般缺陷03301 67一般缺陷0330268一般缺陷0330369一般缺陷03401 70一般缺陷0340271一般缺陷03501 72人员与培训*03601质量管理体系文件主要缺陷74主要缺陷*03801 75主要缺陷*03901 76主要缺陷*0390277一般缺陷04001 78一般缺陷0400279一般缺陷0400380主要缺陷*04101 81一般缺陷0410282一般缺陷04201 84主要缺陷*04301 85一般缺陷04401 86一般缺陷04501 87主要缺陷*04601 88一般缺陷04602 89一般缺陷04603 90一般缺陷04604 91一般缺陷04605 92一般缺陷04701 93一般缺陷04702 94主要缺陷*04703 95主要缺陷*04704 96一般缺陷04705 97一般缺陷04706 98一般缺陷0470799一般缺陷04708 100主要缺陷*04709 101主要缺陷*04710 102主要缺陷*04801 103一般缺陷04802104主要缺陷*04901 105主要缺陷*04902106主要缺陷*04903 107一般缺陷04904 108一般缺陷04905 109主要缺陷*04906 110主要缺陷*04907111主要缺陷*05001 112主要缺陷*05101 113主要缺陷*0510273*0370183体系文件设施与设备主要缺陷一般缺陷04202114主要缺陷*05103 115一般缺陷05201 116主要缺陷*05301 117主要缺陷*05302 118主要缺陷*05303119主要缺陷*05304120主要缺陷*05401 121一般缺陷05501 122一般缺陷05502123一般缺陷05503124主要缺陷*05601 125主要缺陷*05701 126一般缺陷05801 127一般缺陷05802128一般缺陷05803129一般缺陷05804130严重缺陷**05805131主要缺陷*05901 132主要缺陷*06001 133主要缺陷*06101 134一般缺陷06102135一般缺陷06103137主要缺陷*06301 138一般缺陷06302141主要缺陷*06601 142一般缺陷06602143严重缺陷**06701136139140校准与验证主要缺陷主要缺陷一般缺陷计算机系统采购*06201*0640106501146主要缺陷*06901 147主要缺陷*07001 148一般缺陷07101 149一般缺陷07102150主要缺陷*07201 151主要缺陷*07301 152一般缺陷07302 154一般缺陷07501 155主要缺陷*07502 156一般缺陷07601 157一般缺陷07602158主要缺陷*07701 159一般缺陷07702160一般缺陷07703161一般缺陷07704162一般缺陷07705163一般缺陷07801 164一般缺陷07802165主要缺陷*07901 167一般缺陷08002 168一般缺陷08003169一般缺陷08004170一般缺陷08005171主要缺陷*08101 172一般缺陷08201 173一般缺陷08202174一般缺陷08301 177一般缺陷08403178一般缺陷08404179一般缺陷08501 180主要缺陷*08502175176145153166一般缺陷一般缺陷*0740108001 0840108402一般缺陷主要缺陷收货与验收一般缺陷06801182一般缺陷08504 183一般缺陷08505 184一般缺陷08506 185主要缺陷*08507186主要缺陷*08508187主要缺陷*08509188主要缺陷*08510189主要缺陷*08511190一般缺陷08512 191一般缺陷08513192一般缺陷08514 193一般缺陷08515194一般缺陷08516 195一般缺陷08601 196一般缺陷08602197一般缺陷08603198主要缺陷*08604199一般缺陷08605200一般缺陷08606 201主要缺陷*08607 202一般缺陷08608 203一般缺陷08609 204主要缺陷*08701 205一般缺陷08801 206主要缺陷*08901 207一般缺陷08902208一般缺陷08903209主要缺陷*08904210主要缺陷*08905211一般缺陷08906212一般缺陷09001 213主要缺陷*09101 214一般缺陷09201 215严重缺陷**09301 217一般缺陷09402 218一般缺陷09403219一般缺陷09404 220主要缺陷*09501 221主要缺陷*0960121609401 一般缺陷222*09602主要缺陷储存与养护销售224主要缺陷*09801 225主要缺陷*09901 226主要缺陷*10001 228一般缺陷10101 229一般缺陷10102230主要缺陷*10103231一般缺陷10104232一般缺陷10105233主要缺陷*10201 234一般缺陷10301 235一般缺陷10401 236主要缺陷*10501 237一般缺陷10502238一般缺陷10601 239主要缺陷*10701 240一般缺陷10702 241主要缺陷*10801 242主要缺陷*10901 243主要缺陷*11001 244一般缺陷11101 245一般缺陷11201246一般缺陷11202247一般缺陷11301 248一般缺陷11302249一般缺陷11401 250主要缺陷*11501 251主要缺陷*11601 252一般缺陷11701 253一般缺陷11801 254一般缺陷11802255一般缺陷11901 256主要缺陷*12001 257一般缺陷12101 258一般缺陷12201出库22309701 22710002一般缺陷一般缺陷运输与配送售后管理药品批发企业 《药品经营质量管理规范》部分检查项目药品经营企业应当依法经营。
药品经营质量管理规范现场检查指导原则(零售)

附件
药物经营质量管理规范现场检查指引原则
(修订稿)
说明
一、为规范药物经营公司监督检查工作,根据《药物经营质量管理规范》,制定《药物经营质量管理规范现场检查指引原则》。
二、本指引原则涉及《药物经营质量管理规范》旳检查项目和所相应旳附录检查内容。
检查有关检查项目时,应当同步相应附录检查内容。
如果附录检查内容存在任何不符合规定旳情形,所相应旳检查项目应当鉴定为不符合规定。
三、本指引原则检查项目分三部分。
批发公司检查项目共256项,其中严重缺陷项目(**)10项,重要缺陷项目(*)103项,一般缺陷项目143项;零售公司检查项目共176项,其中严重缺陷项目(**)8项,重要缺陷项(*)53项,一般缺陷项115项;体外诊断试剂(药物)经营公司检查项目共185项,其中严重缺陷项目(**)9项,重要缺陷项(*)70项,一般缺陷项106项。
四、药物零售连锁公司总部及配送中心按照药物批发公司检查项目检查,药物零售连锁公司门店按照药物零售公司检查项目检查。
五、药物生产公司销售药物,以及药物流通过程中其他波及药物储存、运送旳,参照本指引原则有关检查项目检查。
六、认证检查成果鉴定:
注:缺陷项目比例数=相应旳缺陷项目中不符合项目数/(相应缺陷项目总数-相应缺陷检查项目合理缺项数)×100%。
七、监督检查成果鉴定:
第二部分药物零售公司一、《药物经营质量管理规范》部分
二、附录部分
(一)药物经营公司计算机系统
(二)药物收货与验收。
药品经营质量管理规范现场检查细则(doc 47页)

药品经营质量管理规范现场检查细则(doc 47页)
2021年5月
说明
一、为规范«药品运营质量管理规范»反省任务,确保反省任务质量,依据«药品运营质量管理规范»,制定本细那么。
二、应当依照本细那么中的反省项目和所对应的附录反省内容,对药品批发企业实施«药品运营质量管理规范»状况停止片面反省。
三、依照本细那么停止反省进程中,有关反省项目应当同时对照所对应的附录反省内容停止反省。
假设附录反省内容反省中存在任何不契合要求的情形,所对应的反省项目应当判定为不契合要求。
四、该细那么反省项目共180〔现为176条)项,其中严重缺陷项目〔**〕 4项,主要缺陷项〔*〕58〔现为56条)项,普通缺陷项118〔现为116条)项。
五、新兴办企业央求发证现场反省适用准入条款;连锁门店、不设置仓库、无中药饮片、特殊管理药品运营范围允许有合理缺项。
六、结武判定:
注:缺陷项目比例数=对应的缺陷项目中不契合项目数/〔对应缺陷项目总数-对应缺陷反省项目合理缺项数〕×100%。
药品批发企业«药品运营质量管理规范»现场反省细那么〔试行〕。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品零售企业《药品经营质量管理规》现场检查细则(试行)
2016年5月
专业资料
说明
一、为规《药品经营质量管理规》检查工作,确保检查工作质量,根据《药品经营质量管理规》,制定本细则。
二、应当按照本细则中的检查项目和所对应的附录检查容,对药品零售企业实施《药品经营质量管理规》情况进行全面检查。
三、按照本细则进行检查过程中,有关检查项目应当同时对照所对应的附录检查容进行检查。
如果附录检查容检查中存在任不符合要求的情形,所对应的检查项目应当判定为不符合要求。
四、该细则检查项目共180(现为176条)项,其中重缺陷项目(**)4项,主要缺陷项(*)58(现为56条)项,一般缺陷项118(现为116条)项。
五、新开办企业申请发证现场检查适用准入条款;连锁门店、不设置仓库、无中药饮片、特殊管理药品经营围允有合理缺项。
注:缺陷项目比例数=对应的缺陷项目中不符合项目数/(对应缺陷项目总数-对应缺陷检查项目合理缺项数)×100%。
专业资料
药品零售企业《药品经营质量管理规》现场检查细则(试行)
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料
专业资料。
