2011年黄冈高考复习资料 打印版 必备
黄冈高考高中物理总复习资料(绝密)

黄冈高考高中物理总复习资料(绝密)★★★★★黄冈高考高中物理总复习资料(绝密)★★★★★黄冈高考高中物理综合复习材料(绝密)黄冈中学:郑帆主题一运动与力量【知识结构】三力平衡采用矢量三角形合力静态或匀速法为零直线运动状态多力平衡采用平方分解法匀速、直接匀速、恒力和直线运动在规则运动线上的初始速度,恒速和匀速变速力、移动力和移动状态变化解决两类问题f=ma体问题,力、恒力和初速度不均匀,速度变化曲线呈直线问题,整体分析和隔震分析交替使用VT?v0?1点?v0t?22伏?vs?及物动词?0tt22vt2?v0?2asvt?sVtt2已知争取运动已知运动力寻求特例平面投掷运动带电粒子沿力的方向总磁力提供匀速圆周运动和垂直向心力力力的大小不取决于天体的运动图像法周期加力的解周期方向和方向变化回答速度这类问题通常应用能量守恒定律,牛顿的第二固定轨迹是圆形合力曲线,轨迹不是圆形的。
这类问题通常应用动能定理或守恒方向。
振动的周期性变化,产生周期性的简谐振动。
在介质中,合力和位移振动的多重性与波解的多重性一致,运动方向与[典型示例]成正比动第1页共107页雨竹林高考网精心整理收集★★★★★ 黄冈高考高中物理综合复习材料(绝密)★★★★例1、如图1―1所示,质量为m=5kg的物体,置于一倾角为30°的粗糙斜面体上,用一平行于斜面的大小为30n的力f推物体,使物体沿斜面向上匀速运动,斜面体质量m=10kg,始终静止,取g=10m/s,求地面对斜面体的摩擦力及支持力.例2。
如图1-3所示,声源s和观察者a都沿x轴的正方向移动,相对于地面的速度分别为vs和VA。
声音在空气中的传播速度是VP,设置为vs?副总裁,弗吉尼亚州?VP,空气相对于地面不流动(1)若声源相继发出两个声信号,时间间隔为△t,请根据发出的这两个声信号从声源传播到观察者的过程,确定观察者接收到这两个声信号的时间间隔△t′.(2)利用(1)的结果,推导了观察者接收到的声源频率与声源发射的声波频率之间的关系例3、假设有两个天体,质量分别为m1和m2,它们相距r;其他天体离它们很远,可以认为这两个天体除相互吸引作用外,不受其他外力作用.这两个天体之所以能保持距离r不变,完全是由于它们绕着共...........................同“中心”(质心)做匀速圆周运动,它们之间的万有引力作为做圆周运动的向心力,“中心”o位于两个.....................................天体的连线上,与两个天体的距离分别为r1和r2.(1) R1和R2有多大?(2)两天体绕质心o转动的角速度、线速度、周期各多大?例4:两个小球a和B由一条L=6m长的软细线连接;以相同的初始速度V0=4.5m/s(先a后B)从同一点水平投掷球a和B,间隔为△ t=0.8s(1)a球抛出后经多少时间,细线刚好被拉直?(2)当细线刚拉直时,球a和B的水平位移(相对于投掷点)是多少?(g=10米/秒)2二fmm图1―1vsvasa图1-3x玉竹林107高考网第2页认真整理收集★★★★★黄冈高考高中物理总复习资料(绝密)★★★★★例5。
33765_2011年黄冈中学高考物理第二轮专题决战资料:专题2 动量与机械能

2011届黄冈高考物理第二轮专题决战资料专题二动量与机械能命题导向动量守恒与能量守恒是近几年高考理科综合物理命题的重点、热点和焦点,也是广大考生普遍感到棘手的难点之一.动量守恒与能量守恒贯穿于整个高中物理学习的始终,是联系各部分知识的主线.它不仅为解决力学问题开辟了两条重要途径,同时也为我们分析问题和解决问题提供了重要依据.守恒思想是物理学中极为重要的思想方法,是物理学研究的极高境界,是开启物理学大门的金钥匙,同样也是对考生进行方法教育和能力培养的重要方面.因此,两个守恒可谓高考物理的重中之重,常作为压轴题出现在物理试卷中,如2004年各地高考均有大题.纵观近几年高考理科综合试题,两个守恒考查的特点是:①灵活性强,难度较大,能力要求高,内容极丰富,多次出现在两个守恒定律网络交汇的综合计算中;②题型全,年年有,不回避重复考查,平均每年有3—6道题,是区别考生能力的重要内容;③两个守恒定律不论是从内容上看还是从方法上看都极易满足理科综合试题的要求,经常与牛顿运动定律、圆周运动、电磁学和近代物理知识综合运用,在高考中所占份量相当大.从考题逐渐趋于稳定的特点来看,我们认为:2005年对两个守恒定律的考查重点仍放在分析问题和解决问题的能力上.因此在第二轮复习中,还是应在熟练掌握基本概念和规律的同时,注重分析综合能力的培养,训练从能量、动量守恒的角度分析问题的思维方法.【典型例题】【例1】(2001年理科综合)下列是一些说法:①一质点受到两个力作用且处于平衡状态(静止或匀速),这两个力在同一段时间内的冲量一定相同;②一质点受两个力作用且处于平衡状态(静止或匀速),这两个力在同一时间内做的功或者都为零,或者大小相等符号相反;③在同样时间内,作用力力和反作用力的功大小不一定相等,但正负符号一定相反;④在同样的时间内,作用力和反作用力的功大小不一定相等,正负号也不一定相反.以上说法正确的是()A.①②B.①③C.②③D.②④【例2】(石家庄)为了缩短航空母舰上飞机起飞前行驶的距离,通常用弹簧弹出飞机,使飞机获得一定的初速度,进入跑道加速起飞.某飞机采用该方法获得的初速度为v0,之后,在水平跑道上以恒定功率P沿直线加速,经过时间t,离开航空母舰且恰好达到最大速度v m.设飞机的质量为m,飞机在跑道上加速时所受阻力大小恒定.求:(1)飞机在跑道上加速时所受阻力f的大小;(2)航空母舰上飞机跑道的最小长度s.【例3】如下图所示,质量为m=2kg的物体,在水平力F=8N的作用下,由静止开始沿水平面向右运动.已知物体与水平面间的动摩擦因数μ=0.2.若F作用t1=6s后撤去,撤去F后又经t2=2s物体与竖直墙壁相碰,若物体与墙壁作用时间t3=0.1s,碰墙后反向弹回的速度v'=6m/s,求墙壁对物体的平均作用力(g 取10m/s2).【例4】有一光滑水平板,板的中央有一小孔,孔内穿入一根光滑轻线,轻线的上端系一质量为M的小球,轻线的下端系着质量分别为m1和m2的两个物体,当小球在光滑水平板上沿半径为R的轨道做匀速圆周运动时,轻线下端的两个物体都处于静止状态(如下图).若将两物体之间的轻线剪断,则小球的线速度为多大时才能再次在水平板上做匀速圆周运动?【例5】如图所示,水平传送带AB 长l =8.3m ,质量为M =1kg 的木块随传送带一起以v 1=2m/s 的速度向左匀速运动(传送带的传送速度恒定),木块与传送带间的动摩擦因数μ=0.5.当木块运动至最左端A 点时,一颗质量为m =20g 的子弹以0v -=300m/s 水平向右的速度正对射入木块并穿出,穿出速度u =50m/s ,以后每隔1s 就有一颗子弹射向木块,设子弹射穿木块的时间极短,且每次射入点各不相同,g 取10m/s .求:(1)在被第二颗子弹击中前,木块向右运动离A 点的最大距离?(2)木块在传达带上最多能被多少颗子弹击中?(3)从第一颗子弹射中木块到木块最终离开传送带的过程中,子弹、木块和传送带这一系统产生的热能是多少?(g 取10m/s )【例6】质量为M 的小车静止在光滑的水平面上,小车的上表面是一光滑的曲面,末端是水平的,如下图所示,小车被挡板P 挡住,质量为m 的物体从距地面高H 处自由下落,然后沿光滑的曲面继续下滑,物体落地点与小车右端距离s 0,若撤去挡板P ,物体仍从原处自由落下,求物体落地时落地点与小车右端距离是多少?【例7】如下图所示,一辆质量是m =2kg 的平板车左端放有质量M =3kg 的小滑块,滑块与平板车之间的动摩擦因数μ=0.4,开始时平板车和滑块共同以v 0=2m/s 的速度在光滑水平面上向右运动,并与竖直墙壁发生碰撞,设碰撞时间极短且碰撞后平板车速度大小保持不变,但方向与原来相反.平板车足够长,以至滑块不会滑到平板车右端.(取g =10m/s 2)求:(1)平板车每一次与墙壁碰撞后向左运动的最大距离.(2)平板车第二次与墙壁碰撞前瞬间的速度v .(3)为使滑块始终不会滑到平板车右端,平板车至少多长?【例8】如图所示,光滑水平面上有一小车B和砂箱的总质量为M ,车上放有一物块A A 与左侧的车面的动摩擦因数为μm 的泥球自由下落,恰好落在砂箱中,求:(1)小车在前进中,弹簧弹性势能的最大值.(2)为使物体A 不从小车上滑下,车面粗糙部分应多长?【跟踪练习】 1.物体在恒定的合力F 作用下作直线运动,在时间△t 1内速度由0增大到v ,在时间△t 2内速度由v 增大到2v .设F 在△t 1内做的功是W 1,冲量是I 1;在△t 2内做的功是W 2,冲量是I 2,那么() A .1212,I I W W <=B .1212,I I W W <<C .1212,I I W W ==D .1212,I I W W =<2.矩形滑块由不同材料的上、下两层粘在一起组成,将其放在光滑的水平面上,如图所示.质量为m 的子弹以速度v 水平射向滑块.若射击上层,则子弹刚好不穿出;若射击下层,整个子弹刚好嵌入,则上述两种情况比较,说法正确的是()①两次子弹对滑块做功一样多②两次滑块所受冲量一样大③子弹嵌入下层过程中对滑块做功多④子弹击中上层过程中产生的热量多A .①④B .②④C .①②D .②③ v 0m A B M mH AB v 0 甲乙3.如图所示,半径为R ,内表面光滑的半球形容器放在光滑的水平面上,容器左侧靠在竖直墙壁.一个质量为m 的小物块,从容器顶端A 无初速释放,小物块能沿球面上升的最大高度距球面底部B 的距离为34R .求: (1)竖直墙作用于容器的最大冲量;(2)容器的质量M .4.离子发动机是一种新型空间发动机,它能给卫星轨道纠偏或调整姿态提供动力,其中有一种离子发动机是让电极发射的电子撞击氙原子,使之电离,产生的氙离子经加速电场加速后从尾喷管喷出,从而使卫星获得反冲力,这种发动机通过改变单位时间内喷出离子的数目和速率,能准确获得所需的纠偏动力.假设卫星(连同离子发动机)总质量为M ,每个氙离子的质量为m ,电量为q ,加速电压为U ,设卫星原处于静止状态,若要使卫星在离子发动机起动的初始阶段能获得大小为F 的动力,则发动机单位时间内应喷出多少个氙离子?此时发动机动发射离子的功率为多大?5.如图所示,AB 为斜轨道,与水平方向成45°角,BC 为水平轨道,两轨道在B 处通过一段小圆弧相连接,一质量为m 的小物块,自轨道AB 的A 处从静止开始沿轨道下滑,最后停在轨道上的C 点,已知A 点高h ,物块与轨道间的滑动摩擦系数为μ,求:(1)在整个滑动过程中摩擦力所做的功.(2)物块沿轨道AB 段滑动时间t 1与沿轨道BC 段滑动时间t 2之比值12t t . (3)使物块匀速地、缓慢地沿原路回到A 点所需做的功.6.如图所示,粗糙的斜面AB 下端与光滑的圆弧轨道BCD 相切于B ,整个装置竖直放置,C 是最低点,圆心角∠BOC =37°,D 与圆心O 等高,圆弧轨道半径R =0.5m ,斜面长L =2m ,现有一个质量m =0.1kg 的小物体P 从斜面AB 上端A 点无初速下滑,物体P 与斜面AB 之间的动摩擦因数为μ=0.25.求:(1)物体P 第一次通过C 点时的速度大小和对C 点处轨道的压力各为多大?(2)物体P 第一次离开D 点后在空中做竖直上抛运动,不计空气阻力,则最高点E 和D 点之间的高度差为多大?(3)物体P 从空中又返回到圆轨道和斜面,多次反复,在整个运动过程中,物体P 对C 点处轨道的最小压力为多大?7.如图所示,光滑水平面AB 与竖直面内的半圆形导轨在B 点衔接,导轨半径为R .一个质量为m 的静止物块在A 处压缩弹簧,在弹力的作用下获一向右的速度,当它经过B 点进入导轨瞬间对导轨的压力为其重力的7倍,之后向上运动恰能完成半圆周运动到达C 点.求:(1)弹簧对物块的弹力做的功.(2)物块从B 至C 克服阻力做的功.(3)物块离开C 点后落回水平面时其动能的大小.8.(’03全国高考,34)[理综·22分]一传送带装置示意如下图,其中传送带经过AB 区域时是水平的,经过BC 区域时变为圆弧形(圆弧由光滑模板形成,未画出),经过CD 区域时是倾斜的,AB 和CD 都与BC 相切.现将大量的质量均为m 的小货箱一个一个在A 处放到传送带上,放置时初速为零,经传送带运送到D 处,D 和A 的高度差为h .稳定工作时传送带速度不变,CD 段上各箱等距排列,相邻两箱的距离为L .每个箱子在A 处投放后,在到达B 之前已经相对于传送带静止,且以后也不再滑动(忽略经BC 段时的微小滑动).已知在一段相当长的时间T 内,共运送小货箱的数目为N .这装置由电动机带电,传送带与轮子间无相对滑动,不计轮轴处的摩擦.求电动机的平均输出功率P .9.如图所示,质量M =0.45kg 的带有小孔的塑料块沿斜面滑到最高点C 时速度恰为零,此时与从A 点水平射出的弹丸相碰,弹丸沿着斜面方向进入塑料块中,并立即与塑料块有相同的速度.已知A 点和C 点距地面的高度分别为:H =1.95m ,h =0.15m ,弹丸的质量m =0.050kg ,水平初速度v 0=8m/s ,取g =10m/s 2.求:(1)斜面与水平地面的夹角θ.(可用反三角函数表示)(2)若在斜面下端与地面交接处设一个垂直于斜面的弹性挡板,塑料块与它相碰后的速率等于碰前的速率,要使塑料块能够反弹回到C 点,斜面与塑料块间的动摩擦因数可为多少?10.(’04江苏,18)(16分)一个质量为M 的雪橇静止在水平雪地上,一条质量为m 的爱斯基摩狗站在雪橇上.狗向雪橇的正后方跳下,随后又追赶并向前跳上雪橇;其后狗又反复地跳下、追赶并跳上雪橇.狗与雪橇始终沿一条直线运动.若狗跳离雪橇时雪橇的速度为V ,则此时狗相对于地面的速度为V +u (其中u 为狗相对于雪橇的速度,V +u 为代数和,若以雪橇运动的方向为正方向,则V 为正值,u 为负值.)设狗总以速度v 追赶和跳上雪橇,雪橇与雪地间的摩擦忽略不计.已知v 的大小为5m/s ,u 的大小为4m/s ,M =30kg ,m =10kg .(1)求狗第一次跳上雪橇后两者的共同速度的大小.(2)求雪橇最终速度的大小和狗最多能跳动上雪橇的次数.(供使用但不一定用到的对数值:lg2=0.301,lg3=0.477)11.(汕头)如下图所示,光滑水平面上,质量为m 的小球B 连接着轻质弹簧,处于静止状态,质量为2m的小球A 以大小为v 0的初速度向右运动,接着逐渐压缩弹簧并使B 运动,过一段时间,A 与弹簧分离.(1)当弹簧被压缩到最短时,弹簧的弹性势能E p 多大?(2)若开始时在B 球的右侧某位置固定一块挡板,在A 球与弹簧未分离前使B 球与挡板发生碰撞,并在碰后立刻将挡板撤走.设B 球与挡板的碰撞时间极短,碰后B 球的速度大小不变但方向相反.欲使此后弹簧被压缩到最短时,弹簧势能达到第(1)问中E p 的2.5倍,必须使B 球在速度多大时与挡板发生碰撞?12.(’00全国高考,22)[天津江西·14分]在原子核物理中,研究核子与核子关联的最有效途径是“双电荷交换反应”.这类反应的前半部分过程和下述力学模型类似.两个小球A 和B 用轻质弹簧相连,在光滑的水平直轨道上处于静止状态.在它们左边有一垂直于轨道的固定挡板P ,右边有一个小球C 沿轨道以速度v 0射向B 球,如图所示.C 与B 发生碰撞并立即结成一个整体D .在它们继续向左运动的过程中,当弹簧长度变到最短时,长度突然被锁定,不再改变.然后,A 球与挡板P 发生碰撞,碰后A 、D 都静止不动,A 与P 接触而不粘连.这一段时间,突然解除锁定(锁定及解除锁定均无机械能损失).已知A 、B 、C 三球的质量为m .(1)求弹簧长度刚被锁定后A 球的速度;(2)求在A 球离开挡板P 之后的运动过程中,弹簧的最大弹性势能.13.(广州)用轻弹簧相连的质量均为2kg 的A 、B 两物块都以v =6m/s 的速度在光滑的水平地面上运动,弹簧处于原长,质量4kg 的物块C 静止在前方,如下图所示.B 与C 碰撞后二者粘在一起运动.求:在以后的运动中:(1)当弹簧的弹性势能最大时物体A 的速度多大?(2)弹性势能的最大值是多大?(3)A 的速度有可能向左吗?为什么?14.(’04广东,17)(16分)图中,轻弹簧的一端固定,另一端与滑块B 相连,B 静止在水平直导轨上,弹簧处在原长状态.另一质量与B 相同的滑块A ,从导轨上的P 点以某一初速度向B 滑行.当A 滑过距离l 1时,与B 相碰,碰撞时间极短,碰后A 、B 紧贴在一起运动,但互不粘连.已知最后A 恰好返回到出发点P 并停止.滑块A 和B 与导轨的滑动摩擦因数都为μ,运动过程中弹簧最大形变量为l 2,重力加速度为g .求A 从P 点出发时的初速度v 0.15.(’01春季招生,22)(14分)如下图所示,A 、B 是静止在水平地面上完全相同的两块长木板.A 的左端和B 的右面端相接触.两板的质量皆为M =2.0kg ,长度皆为l =1.0m .C 是一质量为m =1.0kg 的小物块.现给它一初速度v 0=2.0m/s ,使它从B 板的左端开始向右滑动,已知地面是光滑的,而C 与A 、B 之间的动摩擦因数为μ=0.10.求最后A 、B 、C 各以多大的速度做匀速运动.(取重力加速度g =10m/s 2)16.如图所示,一个长为L ,质量为M 的长方形木块,静止在光滑水平面上,一个质量为m 的物块(可视B Av 0C为质点),以水平初速度v0,从木块的左端滑向另一端,设物块与木块间的动摩擦因数为 ,当物块与木块达到相对静止时,物块仍在长木块上,求系统机械能转化成内能的量Q.。
2011年黄冈中学高考数学一轮复习(内部)系列
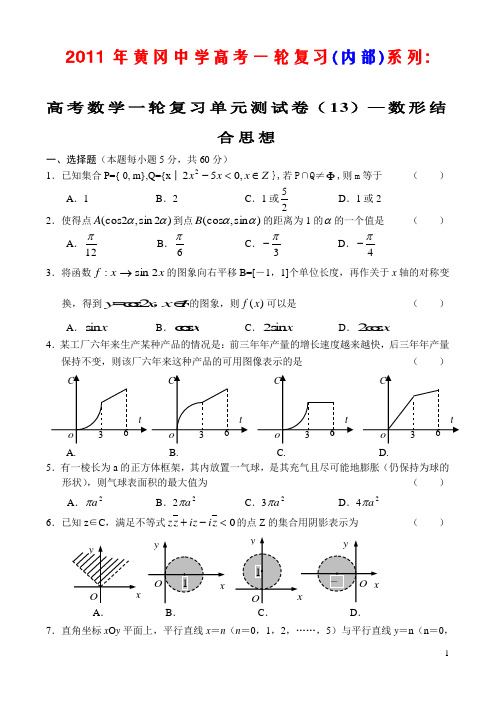
2011年黄冈中学高考一轮复习(内部)系列:高考数学一轮复习单元测试卷(13)—数形结合思想一、选择题(本题每小题5分,共60分)1.已知集合P={ 0, m},Q={x │Z x x x ∈<-,0522},若P∩Q≠Φ,则m 等于 ( )A .1B .2C .1或25D .1或22.使得点)2sin ,2(cos ααA 到点)sin ,(cos ααB 的距离为1的α的一个值是 ( )A .12π B .6π C .3π-D .4π-3.将函数x x f 2sin :→的图象向右平移B=[-1,1]个单位长度,再作关于x 轴的对称变换,得到y x x R =∈c o s 2,的图象,则f x ()可以是 ( )A .s in xB .c o s xC .2s i n xD .2c o s x4.某工厂六年来生产某种产品的情况是:前三年年产量的增长速度越来越快,后三年年产量保持不变,则该厂六年来这种产品的可用图像表示的是 ( )A .B .C .D .5.有一棱长为a 的正方体框架,其内放置一气球,是其充气且尽可能地膨胀(仍保持为球的形状),则气球表面积的最大值为 ( )A .2a πB .22a πC .32a πD .42a π6.已知z ∈C ,满足不等式0<-+z i iz z z 的点Z 的集合用阴影表示为 ( )A .B .C .D .36Cot36Cot 36Cot 36Cot x y O x y O1xy O 1 x y O -7.直角坐标x O y 平面上,平行直线x =n (n =0,1,2,……,5)与平行直线y =n (n =0, 1,2,……,5)组成的图形中,矩形共有 ( )A .25个B .36个C .100个D .225个8.方程11122=---x y y x 所对应的曲线图形是( )A .B .C .D .9.设0<x <π,则函数xxy sin cos 2-=的最小值是( )A .3B .2C .3D .2-310.四面体ABCD 的六条棱中,其中五条棱的长度都是2,则第六条棱长的取值范围是( )A .()2,0B .()32,0C .()32,2D .[)4,211.若直线1+=kx y 与曲线12+=y x 有两个不同的交点,则k 的取值范围是 ( )A .12-<<-kB .22<<-kC .21<<k D .2-<k 或2>k12.某企业购置了一批设备投入生产,据分析每台设备生产的总利润y (单位:万元)与年数x ()N x ∈满足如图的二次函数关系。
湖北黄冈2011年10月高考备考会报告.ppt

• 实验题有计算题化的趋势;
• 实验题经常涉及探究。 • 这些变化对今后高考实验命题的发展影响深远,要引起我们足够的重视。
特点五:注重理论联系实际 立意新颖
• 试题在考查基础知识的同时,重视考生理论联系实际能力的
考查,体现了将物理学知识和生活、生产及科技发展紧密联 系的理念。
特点三:注重考查基本概念和基本规律 突出过程方法
课标卷占分比例(全卷总分为110分)
年份 2007 2008 力学(必修1,2模块) 33分 42分 电学(3-1,3-2模块) 62分 53分 选考模块 15分 15分
2009
2010 2011 平均值
48分
42分 47分 42.4分
47分
53分 48分 52.6分
特点三:注重考查基本概念和基本规律 突出过程方法 • 从表中可以看出,试题所涉及知识的覆盖面较广。 选择题的计算量较小,但所有选择题都需要较为深 入的、定性的物理思维。试题突出考查了学生对基 本概念、基本规律的深刻理解及灵活运用,很好地 体现了高考物理以知识为载体,以过程和方法为依 托,以能力考核为目的的命题导向。
计算
匀变速直线运动规律,运动图像 匀变速直线运动规律
带电粒子在匀强磁场中的运动,牛顿第 二定律的应用
实验,数学 分析综合
理解,分析综合
10 13
19
中 中
较难
特点三:注重考查基本概念和基本规律 突出过程方法
• 2011年高考全国课标卷物理试卷测试的内容和能力 • 3、选考部分
题号 33(1) 33(2) 34(1) 34(2) 35(1) 35(2) 题型 5选 3 计算 5选 3 计算 5选 3 计算 考点 理想气体状态方程,内能,温度,热力 学第一定律 波意耳定律 简谐横波,振幅,波长波速周期的关系 光的折射定律。折射率 光电效应 动量守恒定律,机械能守恒定律 考查的主要能力 理解 理解,分析综合 理解 理解,分析综合 理解 理解,分析综合 分值 6 9 6 9 6 9 难易度 易 中 易 中 易 中
(2011年高考必备)湖北省黄冈中学高考数学压轴题精编精解100题(名师精选 131页).

黄冈中学高考数学压轴题精编精解精选100题,精心解答{完整版}1.设函数()1,121,23x f x x x ≤≤⎧=⎨-<≤⎩,()()[],1,3g x f x ax x =-∈,其中a R ∈,记函数()g x 的最大值与最小值的差为()h a 。
(I )求函数()h a 的解析式;(II )画出函数()y h x =的图象并指出()h x 的最小值。
2.已知函数()()ln 1f x x x =-+,数列{}n a 满足101a <<,()1n n a f a +=; 数列{}n b 满足1111,(1)22n n b b n b +=≥+, *n N ∈.求证:(Ⅰ)101;n n a a +<<<(Ⅱ)21;2n n a a +<(Ⅲ)若12,2a =则当n ≥2时,!n n b a n >⋅.个 个3.已知定义在R 上的函数f (x ) 同时满足:(1)21212122()()2()cos24sin f x x f x x f x x a x ++-=+(12,x x ∈R ,a 为常数);(2)(0)()14f f π==;(3)当0,4x π∈[]时,()f x ≤2 求:(Ⅰ)函数()f x 的解析式;(Ⅱ)常数a 的取值范围.4.设)0(1),(),,(22222211>>=+b a bx x y y x B y x A 是椭圆上的两点,满足0),(),(2211=⋅ay b x a y b x ,椭圆的离心率,23=e 短轴长为2,0为坐标原点. (1)求椭圆的方程;(2)若直线AB 过椭圆的焦点F (0,c ),(c 为半焦距),求直线AB 的斜率k 的值;(3)试问:△AOB 的面积是否为定值?如果是,请给予证明;如果不是,请说明理由. 5.已知数列{}n a 中各项为:12、1122、111222、 (111)⋅⋅⋅⋅⋅⋅14243222n ⋅⋅⋅⋅⋅⋅14243 ……(1)证明这个数列中的每一项都是两个相邻整数的积. (2)求这个数列前n 项之和S n .6、设1F 、2F 分别是椭圆22154x y +=的左、右焦点. (Ⅰ)若P 是该椭圆上的一个动点,求21PF ⋅的最大值和最小值;(Ⅱ)是否存在过点A (5,0)的直线l 与椭圆交于不同的两点C 、D ,使得|F 2C|=|F 2D|?若存在,求直线l 的方程;若不存在,请说明理由.7、已知动圆过定点P (1,0),且与定直线L:x=-1相切,点C 在l 上. (1)求动圆圆心的轨迹M 的方程;.B ,A M 3,P )2(两点相交于的直线与曲线且斜率为设过点-(i )问:△ABC 能否为正三角形?若能,求点C 的坐标;若不能,说明理由 (ii )当△ABC 为钝角三角形时,求这种点C 的纵坐标的取值范围.8、定义在R 上的函数y=f(x),f(0)≠0,当x>0时,f(x)>1,且对任意的a 、b ∈R ,有f(a+b)=f(a)f(b), (1)求证:f(0)=1;(2)求证:对任意的x ∈R ,恒有f(x)>0;(3)证明:f(x)是R 上的增函数;(4)若f(x)·f(2x-x 2)>1,求x 的取值范围。
黄冈中学2011届高考第三轮模拟试题及答案

英语试卷本试卷分第Ⅰ卷和第Ⅱ卷两部分,共150分,考试时间120分钟第Ⅰ卷(三部分,共115分)第一部分听力(共两节,满分30分)第一节(共5小题;每小题1.5分,满分7.5分)听下面5段对话。
每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。
听完每段对话后,你都有l0秒钟的时间来回答有关小题和阅读下一小题。
每段对话仅读一遍。
1.Where is the man?A.At home. B.In a shop. C.In a snack bar. 2.Where is the woman going?A.The 21st Road. B.The Park Apartments. C.The park. 3.What’s the number of the railway station?A.42611. B.24661. C.42661.4.What’s the relationship between them?A.Neighbors B.Workmates. C.Classmates.5.What do you think the man will do ?.A.He is happy to go with the woman.B.He will insist on staying at home.C.He doesn’t know what to do.第二节(共l5小题;每小题1.5分,满分22.5分)听下面5段对话或独白。
每段对话或独白后有几个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。
听每段对话或独白前,你将有时间阅读各个小题,每小题5秒钟;听完后,各小题将给出5秒钟的作答时间。
每段对话或独自读两遍。
听第6段材料,回答第6至7题。
6.What magazine does the man take besides Morning Post?A.Newsweek. B.New Yorkers. C.New Scientists. 7.What’s the price for Morning Post?A.One dollar. B.One and a half dollars. C.Three d011arS and fifty.听第7段材料,回答第8至9题。
黄冈中学高三2011年高考内部密卷语文试题

黄冈中学2010届高三年级第四次四校联考语文试题本试题分第Ⅰ卷(选择题)和第Ⅱ卷(主观题),满分150分,考试时间150分钟。
第Ⅰ卷(选择题,共30分)一、(12分,每小题3分)1.选出字音、字形全都正确的一项()A.渐.染(jiàn)前恭后倨.(jù)贻误至高无尚B.缟.素(gǎo)吹毛求疵.(cī)蝉联克敌致胜C.载.客(zài)踽.踽而行(yǔ)光牒优哉游哉D.肯綮.(qìng)靡.靡之音(mǐ)坐落电影脚本2.下列各句中,加点的成语使用恰当的一句是()A.叶健英最大的梦想就是把“新干线”打造成与“美国联合包裹快递”以及“美国联邦快递”等量齐观....的国际品牌,为在美国打拼的华人争光。
B.到了极端的地步,铜铁偷盗者可以说是见猎心喜....,无法无天,就连马来西亚槟城火车轨道也被鼠贼撬去了150个铁轨夹,盗贼难道不晓得火车是会出轨的吗?C.做人要正派,要品行端正,你这样到处刺探他人隐私是不道德的,古人不是也说过要目不窥园....吗?D.2010年上海世博会会徽图案形似汉字“世”,又与“2010”巧妙组合,两者交相..辉映..,表达了中国人民举办多元文化相融合的博览会的强烈愿望。
3.下列各句中,没有语病的一项是()A.最近,矿难事故频繁发生,人财两伤,损失巨大,其主要原因是工人缺乏安全意识和领导监督管理不力。
B.2010年上海世博会中国国家馆的展示以“寻觅”为主线,让参观者在“东方足迹”、“寻觅之旅”、“低碳行动”三个展区的“寻觅”中感悟并发现城市发展中的中华智慧。
C.足坛名帅戚务生的执教经验丰富,在短短5年内,把云南红塔队改造成一支甲A 强队,为西南足球赢得荣誉。
D.每年9月到10月的米亚罗,气候宜人,撩人情思的红叶、古尔沟的温泉、使人留恋的藏羌风情,是旅游的黄金季节。
4.填入下面横线处的句子,与上下文衔接最恰当的一组是( )“陆上丝绸之路”是中国古代通向西方的贸易通道,从西安出发,经新疆的南路和北路,到达中亚、西亚各国,再由这些国家转道至欧洲。
2011高考数学必看之-总复习资料[1]
![2011高考数学必看之-总复习资料[1]](https://img.taocdn.com/s3/m/896b9ae49b89680203d825f0.png)
高考数学总复习资料高三数学第三轮总复习分类讨论押题针对训练复习目标:1.掌握分类讨论必须遵循的原则 2.能够合理,正确地求解有关问题 命题分析:分类讨论是一种重要的逻辑方法,也是一种常用的数学方法,这可以培养学生思维的条理性和概括性,以及认识问题的全面性和深刻性,提高学生分析问题,解决问题的能力.因此分类讨论是历年数学高考的重点与热点.而且也是高考的一个难点.这次的一模考试中,尤其是西城与海淀都设置了解答题来考察学生对分类讨论问题的掌握情况.重点题型分析:例1.解关于x 的不等式:)()(232R a x a a a x ∈+<+ 解:原不等式可分解因式为:(x-a)(x-a 2)<0 (下面按两个根的大小关系分类)(1)当a>a 2⇒a 2-a<0即 0<a<1时,不等式的解为 x ∈(a 2, a). (2)当a<a 2⇒a 2-a>0即a<0或a>1时,不等式的解为:x ∈(a, a 2) (3)当a=a 2⇒a 2-a=0 即 a=0或 a=1时,不等式为x 2<0或(x-1)2<0 不等式的解为 x ∈∅.综上,当 0<a<1时,x ∈(a 2, a) 当a<0或a>1时,x ∈(a,a 2) 当a=0或a=1时,x ∈∅.评述:抓住分类的转折点,此题分解因式后,之所以不能马上写出解集,主要是不知两根谁大谁小,那么就按两个根之间的大小关系来分类.例2.解关于x 的不等式 ax 2+2ax+1>0(a ∈R) 解:此题应按a 是否为0来分类.(1)当a=0时,不等式为1>0, 解集为R. (2)a ≠0时分为a>0 与a<0两类①10)1(00440002>⇒⎩⎨⎧>->⇒⎪⎩⎪⎨⎧>->⇒⎩⎨⎧>>a a a a a a a a ∆时,方程ax 2+2ax+1=0有两根aa a a aa a a a a a x )1(12442222,1-±-=-±-=-±-=.则原不等式的解为),)1(1())1(1,(+∞-+-----∞aa a a a a . ②101000440002<<⇒⎩⎨⎧<<>⇒⎪⎩⎪⎨⎧<->⇒⎩⎨⎧<>a a a a a a a ∆时, 方程ax 2+2ax+1=0没有实根,此时为开口向上的抛物线,则不等式的解为(-∞,+∞).③ 11000440002=⇒⎩⎨⎧==>⇒⎪⎩⎪⎨⎧=->⇒⎩⎨⎧=>a a a a a a a a 或∆时,方程ax 2+2ax+1=0只有一根为x=-1,则原不等式的解为(-∞,-1)∪(-1,+∞).④01000440002<⇒⎩⎨⎧><<⇒⎪⎩⎪⎨⎧>-<⇒⎩⎨⎧><a a a a a a a a 或∆时,方程ax 2+2ax+1=0有两根,aa a a a a a x )1(12)1(22,1-±-=-±-=此时,抛物线的开口向下的抛物线,故原不等式的解为:))1(1,)1(1(aa a a a a ----+-. ⑤φ∈⇒⎩⎨⎧≤≤<⇒⎪⎩⎪⎨⎧≤-<⇒⎩⎨⎧≤<a a a a a a a 1000440002∆综上:当0≤a<1时,解集为(-∞,+∞).当a>1时,解集为),)1(1())1(1,(+∞-+-----∞aa a a a a . 当a=1时,解集为(-∞,-1)∪(-1,+∞).当a<0时,解集为))1(1,)1(1(a a a a a a ----+-. 例3.解关于x 的不等式ax 2-2≥2x-ax(a ∈R)(西城2003’一模 理科) 解:原不等式可化为⇔ ax 2+(a-2)x-2≥0, (1)a=0时,x ≤-1,即x ∈(-∞,-1]. (2)a ≠0时,不等式即为(ax-2)(x+1)≥0.① a>0时, 不等式化为0)1)(2(≥+-x ax ,当⎪⎩⎪⎨⎧->>120a a ,即a>0时,不等式解为),2[]1,(+∞--∞a .当⎪⎩⎪⎨⎧-≤>120aa ,此时a 不存在.② a<0时,不等式化为0)1)(2(≤+-x ax ,当⎪⎩⎪⎨⎧-<<120a a ,即-2<a<0时,不等式解为]1,2[-a当⎪⎩⎪⎨⎧-><120aa ,即a<-2时,不等式解为]2,1[a -.当⎪⎩⎪⎨⎧-=<120aa ,即a=-2时,不等式解为x=-1.综上:a=0时,x ∈(-∞,-1).a>0时,x ∈),2[]1,(+∞--∞a .-2<a<0时,x ∈]1,2[-a .a<-2时,x ∈]2,1[a-.a=-2时,x ∈{x|x=-1}.评述:通过上面三个例题的分析与解答,可以概括出分类讨论问题的基本原则为:10:能不分则不分;20:若不分则无法确定任何一个结果; 30:若分的话,则按谁碍事就分谁.例4.已知函数f(x)=cos 2x+asinx-a 2+2a+5.有最大值2,求实数a 的取值.解:f(x)=1-sin 2x+asinx-a 2+2a+5.6243)2(sin 22++---=a a a x令sinx=t, t ∈[-1,1].则6243)2()(22++---=a a a t t f (t ∈[-1,1]).(1)当12>a即a>2时,t=1,2533max =++-=a a y解方程得:22132213-=+=a a 或(舍). (2)当121≤≤-a 时,即-2≤a ≤2时,2a t =,262432max =++-=a a y ,解方程为:34-=a 或a=4(舍).(3)当12-<a即a<-2时, t=-1时,y max =-a 2+a+5=2即 a 2-a-3=0 ∴ 2131±=a , ∵ a<-2, ∴ 2131±-=a 全都舍去.综上,当342213-=+=a a 或时,能使函数f(x)的最大值为2. 例5.设{a n }是由正数组成的等比数列,S n 是其前n 项和,证明:15.025.05.0log 2log log ++>+n n n S S S . 证明:(1)当q=1时,S n =na 1从而0)1()2(2121211212<-=+-+⋅=-⋅++a a n a n na S S S n n n(2)当q ≠1时,qq a S n n --=1)1(1, 从而.0)1()1()1)(1(2122121221212<-=-----=-⋅++++nn n n n n n q a q q a q q a S S S由(1)(2)得:212++<⋅n n n S S S .∵ 函数xy 5.0log =为单调递减函数.∴ 15.025.05.0log 2log log ++>+n n n S S S . 例6.设一双曲线的两条渐近线方程为2x-y+1=0, 2x+y-5=0,求此双曲线的离心率.分析:由双曲线的渐近线方程,不能确定其焦点位置,所以应分两种情况求解.解:(1)当双曲线的焦点在直线y=3时,双曲线的方程可改为1)3()1(222=---b y a x ,一条渐近线的斜率为2=a b, ∴ b=2.∴ 555222==+==a a a b a c e .(2)当双曲线的焦点在直线x=1时,仿(1)知双曲线的一条渐近线的斜率为2=ba,此时25=e .综上(1)(2)可知,双曲线的离心率等于255或.评述:例5,例6,的分类讨论是由公式的限制条件与图形的不确定性所引起的,而例1-4是对于含有参数的问题而对参数的允许值进行的全面讨论.例7.解关于x 的不等式 1512)1(<+--x x a .解:原不等式 012)1(55<⇔+--x x a 0)]2()1)[(2(022)1(012)1(<----⇔<--+-⇔<+--⇔a x a x x a x a x x a⎪⎩⎪⎨⎧>----<-⎪⎩⎪⎨⎧<---->-⎩⎨⎧<--=-⇔0)12)(2(01)3(0)12)(2(01)2(0)21)(2(01)1(a ax x a a a x x a x a 或或 由(1) a=1时,x-2>0, 即 x ∈(2,+∞).由(2)a<1时,012>--aa,下面分为三种情况. ①⎩⎨⎧<<⇒⎪⎩⎪⎨⎧>--<012121a a aa a 即a<1时,解为)12,2(a a --.②0012121=⇒⎩⎨⎧=<⇒⎪⎩⎪⎨⎧=--<a a a a a a 时,解为∅.③ ⎪⎩⎪⎨⎧<--<2121aa a ⇒ ⎩⎨⎧><01a a 即0<a<1时,原不等式解为:)2,12(a a --.由(3)a>1时,aa--12的符号不确定,也分为3种情况.①⎩⎨⎧≤>⇒⎪⎩⎪⎨⎧≥-->012121a a aa a ⇒ a 不存在. ② ⇒⎩⎨⎧>>⇒⎪⎩⎪⎨⎧<-->012121a a a a a 当a>1时,原不等式的解为:),2()12,(+∞---∞ a a.综上:a=1时,x ∈(2,+∞).a<1时,x ∈)12,2(aa--a=0时,x ∈∅.0<a<1时,x ∈)2,12(a a--a>1时,x ∈),2()12,(+∞---∞ aa.评述:对于分类讨论的解题程序可大致分为以下几个步骤: 10:明确讨论的对象,确定对象的全体; 20:确定分类标准,正确分类,不重不漏; 30:逐步进行讨论,获得结段性结记; 40:归纳总结,综合结记. 课后练习:1.解不等式2)385(log 2>+-x x x2.解不等式1|)3(log ||log |3121≤-+x x3.已知关于x 的不等式052<--ax ax 的解集为M. (1)当a=4时,求集合M:(2)若3∈M ,求实数a 的取值范围.4.在x0y 平面上给定曲线y 2=2x, 设点A 坐标为(a,0), a ∈R ,求曲线上点到点A 距离的最小值d ,并写成d=f(a)的函数表达式.参考答案:1. ),(),(∞+235321 2.]4943[,3. (1) M 为),(),(2452 ∞- (2)),9()35,(+∞-∞∈ a4. ⎪⎩⎪⎨⎧<≥-==时当时当1||112)(a a a a a f d .2006年高三数学第三轮总复习函数押题针对训练复习重点:函数问题专题,主要帮助学生整理函数基本知识,解决函数问题的基本方法体系,函数问题中的易错点,并提高学生灵活解决综合函数问题的能力。
33764_2011年黄冈中学高考物理第二轮专题决战资料:专题1 运动和力参考答案

2011届黄冈高考物理第二轮专题决战资料专题一运动和力参考答案典型例题[例1]解析:对系统进行整体分析,受力分析如图1—2:由平衡条件有:cos30F f ︒=由此解得f =[例2]解析:(1)设t 1、t 2为声源S 发出两个信号的时刻,12、t t ''为观时间被观察者A 察者接收到两个信号的时刻.则第一个信号经过11()t t '-到,且接收到,第二个信号经过(22t t '-)时刻被观察者A 接收设声源发出第一个信号时,S 、A的运动的距离关系如图所示,可得11112221()()(P A P A S v t t L v t t v t t '''-=+--由以上各式解得P SP Av v t t v v -'∆=∆-(2)设声源发出声波的振动周期为T ,这样,由以上结论,观察者接收到的声波振动的周期T ′,P SP A v v T T v v -'=-.由此可得,观察者接收到的声波频率与声源发出声波频率间的关系为P AP Sv v f f v v -'=-.[例3]解答:根据题意作图1—4.对这两个天体而言,它们的运动方程分别为212112m m Gm r rω=①212222m m Gm r r ω=②以及12r r r +=③由以上三式解得21121212;m m r r r r m m m m ==++.将r 1和r 2的表达式分别代①和②式, 可得ω=[例4]解答:(1)A 、B 两球以相同的初速度v 0,从同一点水平抛出,可以肯定它们沿同一轨道运动. 作细线刚被拉直时刻A 、B 球位置示意图1—5. 根据题意可知:0 4.50.8 3.6(m) 4.8(m)x v t y ∆=∆=⨯=∆==设A 球运动时间为t ,则B 球运动时间为t -0.8,由于A 、B 球在竖直方f图1—2t 1v AS At 1 A ′Lt vm 图1—4xy图1—5向上均作自由落体运动,所以有2211(0.8)22y gt g t ∆=--. 由此解得t =1s . (2)细线刚被拉直时,A 、B 球的水平位移分别为004.5m (0.8)0.9m A B x v t x v t ===-=[例5]解答:(1)A 球通过最低点时,作用于环形圆管的压力竖直向下,根据牛顿第三定律,A 球受到竖直向上的支持力N 1,由牛顿第二定律,有:2111v N m g m g-=①由题意知,A 球通过最低点时,B 球恰好通过最高点,而且该时刻A 、B 两球作用于圆管的合力为零;可见B 球作用于圆管的压力肯定竖直向上,根据牛顿第三定律,圆管对B 球的反作用力N 2竖直向下;假设B 球通过最高点时的速度为v ,则B 球在该时刻的运动方程为2222v N m g m R+=②由题意N 1=N 2③∴2210212m v m v m g m g R R+=-④ 对B 球运用机械能守恒定律22202211222m v m v m gR =+⑤ 解得2204v v gR =-⑥⑥式代入④式可得:21212(5)()0v m m g m m R++-=.[例6]解答:火箭上升到最高点的运动分为两个阶段:匀加速上升阶段和竖直上抛阶段.地面上的摆钟对两个阶段的计时为140(s)t == 即总的读数(计时)为t =t 1+t 2=360(s ) 放在火箭中的摆钟也分两个阶段计时.第一阶段匀加速上升,a =8g ,钟摆周期112233T T '=== 其钟面指示时间113120s t t '== 第二阶段竖直上抛,为匀减速直线运动,加速度竖直向下,a =g ,完全失重,摆钟不“走”,计时20t '=.可见放在火箭中的摆钟总计时为12120s t t t '''=+=. 综上所述,火箭中的摆钟比地面上的摆钟读数少了240s t t t '∆=-=.[例7]解答:在情形(1)中,滑块相对于桌面以速度v 0=0.1m/s 向右做匀速运动,放手后,木板由静止开始向右做匀加速运动.20.02m/s mga Mμ==经时间t ,木板的速度增大到v 0=0.1m/s ,05s v t a==. 在5s 内滑块相对于桌面向右的位移大小为S 1=v 0t =0.5m . 而木板向右相对于桌面的位移为2210.25m 2S at ==. 可见,滑块在木板上向右只滑行了S 1-S 2=0.25m ,即达到相对静止状态,随后,它们一起以共同速度v 0向右做匀速直线运动.只要线足够长,桌上的柱子不阻挡它们运动,滑块就到不了木板的右端.在情形(2)中,滑块与木板组成一个系统,放手后滑块相树于木板的速度仍为v 0,滑块到达木板右端历时05s lt v '==. [例8]解答:以m 表示球的质量,F 表示两球相互作用的恒定斥力,l 表示两球间的原始距离.A 球作初速度为v 0的匀减速运动,B 球作初速度为零的匀加速运动.在两球间距由l 先减小,到又恢复到l 的过程中,A 球的运动路程为l 1,B 球运动路程为l 2,间距恢复到l 时,A 球速度为v 1,B 球速度为v 2.由动量守恒,有012mv mv mv =+ 由功能关系:A 球221011122Fl mv mv =-B 球:22212Fl mv = 根据题意可知l 1=l 2,由上三式可得22222220120220022()22v v v v v v v v v v =+=-+=-+得v 2=v 0、v 1=0即两球交换速度.当两球速度相同时,两球间距最小,设两球速度相等时的速度为v , 则00(),2v mv m m v v =+= B 球的速度由02v v =增加到v 0花时间t 0,即00002vv v at at =+=+ 得02v a t =. 解二:用牛顿第二定律和运动学公式.(略)跟踪练习1.C 提示:利用平衡条件.2.(1)重物先向下做加速运动,后做减速运动,当重物速度为零时,下降的距离最大,设下降的最大距离为h ,由机械能守恒定律得2sin )Mgh mg R θ=解得h .(2)系统处于平衡状态时,两小环的可能位置为 a .两小环同时位于大圆环的底端 b .两小环同时位于大圆环的顶端c .两小环一个位于大圆环的顶端,另一个位于大圆环的底端d .除上述三种情况外,根据对称性可知,系统如能平衡,则小圆环的位置一定关于大圆环竖直对称轴对称.设平衡时,两小圆环在大圆环竖直对称轴两侧α角的位置上(如图).对于重物m ,受绳的拉力T 与重力mg 作用,有T =mg .对于小圆环,受到三个力的作用,水平绳的拉力T ,竖直绳的拉力T ,大圆环的支持力N .两绳的拉力沿大圆环切向的分力大小相等,方向相反sin sin T T αα'=.得,90,45ααααα''=+=︒=︒而∴.3.设测速仪扫描速度为v ′,因P 1、P 2在标尺上对应间隔为30小格,所以3030v t'==∆格/s . 测速仪发出超声波信号P 1到接收P 1的反射信号n 1.从图B 上可以看出,测速仪扫描12小格,所以测Tm 1m T速仪从发出信号P 1到接收其反射信号n 1所经历时间120.4s t v'=='. 汽车接收到P 1信号时与测速仪相距1168m 2t S v ==声. 同理,测速仪从发出信号P 2到接收到其反射信号n 2,测速仪扫描9小格,故所经历时间290.3s t v =='.汽车在接收到P 2信号时与测速仪相距2251m 2t S v ==声. 所以,汽车在接收到P 1、P 2两个信号的时间内前进的距离△S =S 1-S 2=17m .从图B 可以看出,n 1与P 2之间有18小格,所以,测速仪从接收反射信号n 1到超声信号P 2的时间间隔3180.6s t v =='. 所以汽车接收P 1、P 2两个信号之间的时间间隔为1230.95s 22t tt t ∆=++=. ∴汽车速度17.9Sv t∆==∆m/s . 4.从B 发出第一个超声波开始计时,经2T 被C 车接收.故C 车第一次接收超声波时与B 距离102T S v =. 第二个超声波从发出至接收,经T +△T 时间,C 车第二车接收超声波时距B 为202T TS v +∆=,C 车从接收第一个超声波到接收第二个超声波内前进S 2-S 1,接收第一个超声波时刻12Tt =,接收第二个超声波时刻为202T Tt T +∆=+. 所以接收第一和第二个超声波的时间间距为2102Tt t t T ∆∆=-=+. 故车速0021002222C v TTv S S v T T tT T ∆∆-===+∆∆+∆.车向右运动. 5.ACD6.(1)根据动能定理,可求出卫星由近地点到远地点运动过程中,地球引力对卫星的功为22211122W mv mv =-. (2)由牛顿第二定律知1222112()()GM GM a a R h R h ==++∴21212()R h a a R h +=+ 7.(1)建立如图所示坐标系,将v 0与g 进行正交分解. 在x 方向,小球以0x v 为初速度作匀加速运动. 在y 方向,小球以0y v 为初速度,作类竖直上抛运动. 当y方向的速度为零时,小球离斜面最远,由运动学公式2220sin |2|2cos y y v v H g g θθ==.小球经时间t 上升到最大高度,由0y y v g t =得000sin tan cos g yv v v t g g gθθθ===.(2)02220000221sin 1sin 2(2)2cos sin 42cos 2cos ABx x v v Sv t g t v v g g θθθθθθ=+=+ 8.(1)设滑雪者质量为m ,斜面与水平面夹角为θ,滑雪者滑行过程中克服摩擦力做功cos (cos )W mg S mg L S mgL μθμθμ=+-=①由动能定理21()2mg H h mgL mv μ--=② 离开B点时的速度v(2)设滑雪者离开B 点后落在台阶上2111122h gt S vt ==<可解得1S=④此时必须满足2H L h μ-<⑤当2H L h μ->时,滑雪者直接落到地面上,222221,2h gt S v t ==, 可解得2S = 9.AC10.摆球先后以正方形的顶点为圆心,半径分别为R 1=4a ,R 2=3a ,R 3=2a ,R 4=a 为半径各作四分之一圆周的圆运动.当摆球从P 点开始,沿半径R 1=4a 运动到最低点时的速度v 1, 根据动量定理221011422mv mv mga -=① 当摆球开始以v 1绕B 点以半径R 2=3a 作圆周运动时,摆线拉力最大,为T max =7mg ,这时摆球的运动方程为21max3mv T mg a-=② 由此求得v 0的最大许可值为0v当摆球绕C 点以半径R 3=2a 运动到最高点时,为确保沿圆周运动, 到达最高点时的速度3v由动能定理223001122mv mv mga v -=-=得0v 11.B12.由题意知,周期为42s 63T ==.波速40320m/s 23v T λ===.P 、Q 两点距离相差9(6)4-次全振动所需时间即9235(6)4s.4322t ∆=-⨯=-= ∴50m PQ v t =∆=.13.ABC 开始时小车上的物体受弹簧水平向右的拉力为6N ,水平向左的静摩擦力也为6N ,合力为零.沿水平向右方向对小车施加以作用力,小车向右做加速运动时,车上的物体沿水平向右方向上的合力(F =ma )逐渐增大到8N 后恒定.在此过程中向左的静摩擦力先减小,改变方向后逐渐增大到(向右的)2N 而保持恒定;弹簧的拉力(大小、方向)始终没有变,物体与小车保持相对静止,小车上的物体不受摩擦力作用时,向右的加速度由弹簧的拉力提供:260.75m/s 8T a m ===. 14.(1)设物体与板的位移分别为S 物、S 板,则由题意有2L S S -=物板① 212S S vt a t =物板板∶∶②解得:,2LS L S ==物板.(2)由22112,,mgMv v a S a M mgLμμ===板板板得.得222()Mv M m gL μ=+,故板与桌面之间的动摩擦因数222()Mv M m gLμ+≥.15.在0~10s 内,物体的加速度210.8m/s va t∆==∆(正向) 在10~14s 内,物体的加速度222m/s va t∆==∆(反向) 由牛顿第二定律1F mg ma μ-=①23Fmg ma μ-=-② 由此解得F =8.4N μ=0.3416.(1)依题意得1B v =0,设小滑块在水平面上运动的加速度大小为a ,由牛顿第二定律,f mg ma μ==,由运动学公式202v gS μ=,解得0.09μ=.(2)滑块在水平面上运动时间为t 1,由01110, 3.3s 23v S t t ===得.在斜面上运动的时间2120.8s 4.1s t t t t ==+=∴(3)若滑块在A 点速度为v 1=5m/s ,则运动到B点的速度4m/s B v .即运动到B 点后,小滑块将做平抛运动.假设小滑块不会落到斜面上,则经过30.4s t =落到水平面上, 则水平位移3 1.67m tan30B hx v t ==>︒.所以假设正确,即小滑块从A 点运动到地面所需时间为312 1.5s BSt t v v '=+=+.。
湖北省部分重点中学2011届高三联考_理科综合(11月试卷)

黄冈中学 黄石二中命题人:邢新山 付 军 吴向晖本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至12页,考试结束后,将本试题卷和答题卡一并交回。
第Ⅰ卷(选择题,共21小题,126分)注意事项:1.答题前,考生在答题卡上务必用直径0.5毫米黑色墨水签字笔将自己的姓名、准考 证号填写清楚,并贴好条形码。
请认真核准条形码上的准考证号、姓名和科目。
2.每小题选出答案后,用2B 铅笔把答题卡上对应题的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号,在试题卷上作答无效.........。
可能用到的相对原子质量:H :1 C :12 N :14 O :16 Na :23 S :32 Cl :35.5一.选择题(本题共13小题。
在每小题给出的四个选项中,只有一项是符合题目要求的。
)1. 右图为细胞亚显微结构示意图,下列有关说法不正确的是( )A.此图可用来表示低等植物细胞的亚显微结构B .若此图表示洋葱根尖分生区细胞,则不包括的结构为5、2,图中的其余的细胞器都应该具有。
C .图中能利用尿嘧啶核糖核苷酸的结构有3、5、6D .此图若表示动物的性腺细胞,则不应有的结构为1、2、52. 下列关于细胞结构和功能的叙述,正确的是( )A .各种生物的细胞壁都可以用纤维素酶和果胶酶进行分解B .植物细胞中能够产生A TP 的场所只有线粒体和叶绿体C .植物根尖细胞中无叶绿体,故用根尖细胞不能培养出含叶绿体的植物体D .促甲状腺激素只能作用于甲状腺细胞, 是因为甲状腺细胞具有特定的膜蛋白,而促甲状腺激素的运输不是定向运输到甲状腺细胞的3. 对下列四幅图的描述正确的是( )A . 图1中含两个染色体组,1与2、3与4为同源染色体B .在适宜的温度、水肥等条件下,适当增加光照强度,图2中a 点右移,b 点右移C .图3中bc 段和de 段光合作用速率都下降,此时造成光合作用速率下降的原因是一样的D .图4中造成cd 段的原因对于有丝分裂和减数分裂是一样的 · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · 1 2 3 4 5 6 7 8 9 图22011届高三联考·理科综合图1 湖北省4. 动物的生命活动是在一系列调节机制的调节下实现的,下列对生命活动调节和动物行为的相关判断不符合生物学原理的是( )A .破坏小白鼠的下丘脑,动物便不再具有维持体温恒定的能力B .对于较轻的糖尿病患者,通过调节和控制饮食,配合口服降血糖药物就可以达到治疗的目的C .神经递质只能由突触前膜通过主动运输释放到突触间隙,作用于突触后膜,使后一个神经元兴奋或抑制D .人类学习和动物学习的一个重要区别是只有人类有语言中枢5. 垂体被称为―乐队的指挥‖,因为它不仅产生生长素和催乳素,也能调节和控制其他内分泌腺的活动。
2011湖北黄冈高考模拟试题

湖北省黄冈中学2011届高三五月模拟考试(语文)本试卷分第Ⅰ卷、第Ⅱ卷两部分。
共150分。
考试用时150分钟。
第Ⅰ卷(选择题共36分)一、(15分,每小题3分)1.下列各组词语中加点字的读音全都相同的一组是A.垂髫紫貂韶山冲年高德劭B.吩咐附带女驸马涸辙之鲋C.悲怆寒伧头等舱沧海桑田D.裨益稗史臭脾气纵横捭阖2.下列各组词语中,有错别字的一组是A.文饰/纹身辅弼/复辟变本加利/辩才无碍B.牵扯/牵掣侥幸/矫形管中窥豹/管窥蠡测C.熔铸/融会菲薄/诽谤鬼迷心窍/诡计多端D.辖制/挟制屹立/昳丽烜赫一时/煊赫一时3.依次填入下列横线处的词语,恰当的一项是香溪河上的宝坪村,是王昭君的故乡,这个看着并不起眼的,却孕育了一代绝色佳人。
是清澈如玉的香溪河水的,才使得昭君有了倾国倾城之貌和的心灵。
没有香溪河水,中国历史上会不会少去胡汉和亲这一页呢?A.村庄滋养秀色可餐即使B.乡村润泽兰质蕙心然而C.村落滋润冰清玉洁假如D.乡井滋补秀外慧中尽管4.下列各项中,没有语病的一项是A.抗美援朝是新中国突然遭遇的一次大考,有无数理由可以让这个新生的国家被这场战争压垮,但以毛泽东为核心的共和国第一代领袖们围绕以究竟出不出兵为主题反复商讨,最终决定出兵朝鲜,保家卫国。
B.百年以来,我校始终坚持以人为本的办学理念,为莘莘学子插上了理想的翅膀,让他们从这里出发,去扬帆远航。
C.8月份以来,楼市趋于活跃,投资投机性需求卷土重来,限购、停贷等措施短期内将对不合理的购房需求产生明显的抑制作用,并对市场的“恐慌性心理”有积极作用。
D.中国功夫能否勇立世界搏击术的潮头,打遍天下无敌手?多年来,人们一直渴盼得到肯定的答案。
在无数影视作品和武林传说提供了足够多的佐证之后,中国功夫无形之中也逐渐走上了神坛。
但近年来中泰拳手的较量却提醒着我们中国功夫正逐渐走下神坛。
5.下列各句中,标点符号使用规范的一项是A. 对于怎么看待人口零增长,陆杰华认为,“过去认为零增长是好事,那时是考虑到人口是人‘口’,要占有资源,但人口也是人‘手’,是劳动力和家庭供养,零增长不完全是个好事,要看结构的变化。
黄冈 状元 实战 笔记---2011历史高考试题分章节汇总(必修二)

第一单元:第1课精耕细作农业生产模式的形成一、选择题1.(2011·福建文综·14)图4 所示坎儿井(井渠)是我国古代具有地方特色的水利灌溉工程,至今还流行于新疆的吐鲁番、哈密地区。
联系历史地理知识,对坎儿井解读正确的是()①在汉代就已出现②我国古代最早的灌溉工程③利用了天山、昆仑山的冰雪融水④井深随地势坡降而改变图4A.①②③ B.①②④ C.①③④ D.②③④【解析】C 根据所学知识,坎儿井起源于西汉时期,①正确;根据材料“至今还流行于新疆的吐鲁番、哈密地区”得之坎儿井正是利用新疆天山、昆仑山的冰雪融水而兴建的具有地方特色的水利灌溉工程,③正确;从图中明显可以看到坎儿井井深随地势坡降而改变,④正确;材料无法反映出坎儿井是我国古代最早的灌溉工程,另外根据所学知识在坎儿井之前还有著名的水利工程如都江堰等。
故选C项。
2.(2011·山东文综·10)图4描绘了汉代农民使用四齿钉耙耕作的场景。
它反映出当时()A.开始使用铁器B.注重精耕细作C.尚未推广牛耕D.雇佣关系盛行【解析】B 从关键词“汉代”,可以排除A项,春秋时期就开始使用铁器;汉代随着犁壁的发明,已经开始推广牛耕,排除C;雇佣关系盛行是在明清时期,排除D.故选B。
二、主观题1.(2011·安徽文综·35)(30分)马克思说:“各种经济时代的区别,不在于生产什么,而在于怎样生产,用什么劳动资料生产。
”阅读材料,结合所学知识回答下列问题。
材料一(王景)迁庐江太守。
先是,百姓不知牛耕,致地力有余而食常不足。
郡界有楚相孙叔敖所起芍陂稻田。
景乃驱率吏民,修起芜废,教用犁耕,由是垦辟倍多,境内丰给。
是岁,年疫。
京师及三州大旱,诏勿收兖、豫、徐州田租、刍稿(汉代的一种税收),其以见谷赈给贫人。
——摘自《后汉书》卷七十六、卷三(1)依据材料一概括中国农业经济的特征。
(8分)解析:本题以历史热点――三农问题切入,考查学生的分析理解综合应用能力。
湖北省黄冈市黄州区综合基础知识历年真题汇总【2011年-2021年整理版】(二)

湖北省黄冈市黄州区综合基础知识历年真题汇总【2011 年-2021 年整理版】 (二)1、单选题当降水的 pH 值低于多少时,降水即成为酸雨?_____A : 5.3B : 5.6C : 7.0D : 4.8参考答案: B本题解释:【答案】B。
解析:pH 值小于 5.6 的降水,包括雨、雪在内,称为酸雨。
酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体,经过复杂的大气化学反应,被雨水吸收溶解而成。
故本题答案选 B。
第 1 题所属考点-题库原题2、多选题下列关于“云南之最”的说法中,正确的是_____。
A : 云南最深的湖泊是迪庆的泸沽湖B : 云南面积最大的淡水湖泊是位于昆明的滇池C : 国家级景区景点最多的地区是西双版纳傣族自治州D : 云南省海拔最低点在红河州河口县红河与南溪河交汇处E : 云南最高峰是位于迪庆藏族自治州的梅里雪山卡瓦格博峰参考答案: BCDE本题解释:【答案】BCDE。
解析:云南最深的湖泊是抚仙湖,A 项排除。
故本题答案选 BCDE。
第 2 题所属考点-题库原题3、单选题管理的核心问题是_____。
A : 处理好人际关系B : 明确目标C : 正确决策D : 完善组织结构参考答案: A本题解释:【答案】A 【解析】管理的基本特征之一就是管理的核心是处理好人际关系。
在组织中的各种要素和资源中,人是最重要最活跃的要素和资源,他直接或间接地影响组织的效果,因此调动认的积极性,发挥人的创造潜力,处理好人与人之间的关系,成为管理的核心问题,也是领导工作所要完成的任务。
第 3 题所属考点-题库原题4、单选题辽宁南瀕浩瀚的黄、渤二海,辽东半岛斜插于两海之间,隔渤海海峡,与_____半岛遥相呼应。
A : 江苏B : 朝鲜C : 东南D : 山东参考答案: D本题解释:D。
解析:辽宁省南濒浩瀚的黄、渤二海,辽东半岛斜插于两海之间,隔渤海海峡,与山东半岛遥相呼应;西南与河北省接壤;西北与内蒙古自治区毗连;东北与吉林省为邻;东南以鸭绿江为界与朝鲜民主主义人民共和国隔江相望。
2011黄冈市高三期末试题文综卷
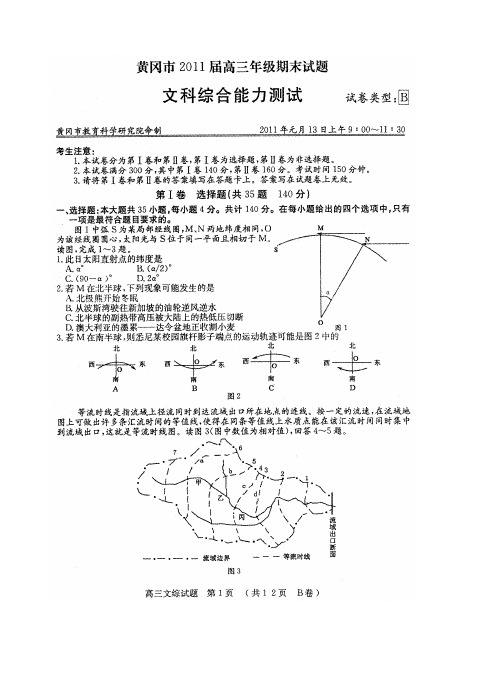
2011年秋高三政治参考答案A/B卷12.C.2010年此商品的价值量为90/5=18,2011年社会劳动生产率提高20%,则此商品的价值量为18/(1+20%)=15。
商品的价值总量与社会劳动生产率无关,只与个别劳动生产率有关,2011年此商品的价值总量是90×(1+10%)=99。
13.B. 14.C 15.B 16.C 17.B 18.C 19.D 20.C 21.D 22.D 23.C38.(1)①现象:GDP在2009年上半年至2010年上半年的一年里快速增长,但到了2011年上半年,有所下滑。
CPI一直在不断攀升,并超过国际警戒线。
2009年以来,农村居民现金收入比率上升较快,而城镇居民人均可支配收入却有所下降。
(6分)②原因:货币超发,人为恶意炒作,劳动力生产成本增加,天气等自然灾害造成农产品供不应求,经济全球化影响,国外经济波动殃及我国。
(5分)(2)①我国政府是人民的政府,要切实履行经济、政治、社会公共服务职能,平抑物价。
(4分)②政府要坚持对人民负责的原则,提高政府为经济社会发展服务、为人民服务的能力和水平;坚持为人民服务的工作态度,树立求真务实的工作作风,坚持从群众中来到群众中去的工作方法。
(4分)(3)①人民群众是实践的主体,是历史的创造者。
物价关系到人民群众的切身利益,政府必须采取果断措施平抑物价。
(4分)②坚持正确的价值观,自觉维护人民群众的根本利益。
政府必须采取果断措施平抑物价。
(4分)39.(1)①在多元文化并存的世界中,要尊重世界文化的多样性,相互借鉴,求同存异。
(4分)②在文化发展上,必须遵循各国文化一律平等的原则,共同促进世界文化的繁荣和发展。
(4分)(2)①中西两国在平等的基础上开展文化间交流与合作,有利于两国文化相互尊重,有利于保护世界文化的多样性。
(4分)②两国文化的交流,有利于各自吸收对方的优秀文化成果,有利于促进世界文化的繁荣。
(4分)(3)①坚持联系的观点,促进中西文化的交流与借鉴。
2011年普通高等学校招生全国统...

2011年普通高等学校招生全国统一考试(江苏卷)2011届高考必备物理学史总结(按物理学分类)一.力学中的物理学史1、前384年—前322年,古希腊杰出思想家亚里士多德:在对待“力与运动的关系”问题上,错误的认为“维持物体运动需要力”。
2、1638年意大利物理学家伽利略:最早研究“匀加速直线运动”;论证“重物体不会比轻物体下落得快”的物理学家;利用著名的“斜面理想实验”得出“在水平面上运动的物体若没有摩擦,将保持这个速度一直运动下去即维持物体运动不需要力”的结论;发明了空气温度计;理论上验证了落体运动、抛体运动的规律;还制成了第一架观察天体的望远镜;第一次把“实验”引入对物理的研究,开阔了人们的眼界,打开了人们的新思路;发现了“摆的等时性”等。
3、1683年,英国科学家牛顿:总结三大运动定律、发现万有引力定律。
另外牛顿还发现了光的色散原理;创立了微积分、发明了二项式定理;研究光的本性并发明了反射式望远镜。
其最有影响的著作是《自然哲学的数学原理》。
4、1798年英国物理学家卡文迪许:利用扭秤装置比较准确地测出了万有引力常量G=6.67³11-11N²m2/kg2(微小形变放大思想)。
5、1905年爱因斯坦:提出狭义相对论,经典力学不适用于微观粒子和高速运动物体。
即“宏观”、“低速”是牛顿运动定律的适用范围。
二.电、磁学中的物理学史1、1785年法国物理学家库仑:借助卡文迪许扭秤装置并类比万有引力定律,通过实验发现了电荷之间的相互作用规律——库仑定律。
2、1826年德国物理学家欧姆:通过实验得出导体中的电流跟它两端的电压成正比,跟它的电阻成反比即欧姆定律。
3、1820年,丹麦物理学家奥斯特:电流可以使周围的磁针发生偏转,称为电流的磁效应。
4、1831年英国物理学家法拉第:发现了由磁场产生电流的条件和规律——电磁感应现象。
5、1834年,俄国物理学家楞次:确定感应电流方向的定律——楞次定律。
2011届高考语文备战资料合集

2010届备战中考语文资料合集拼音几条规律:1.多音字:记少不记多如:辟bì复辟辟邪其余念pì处chù机关、地方其余念chǔ2.形声字:多数情况仍读声母,少数已经变音未变:粗犷guǎng 舐犊情深shì变音:矩形jǔ轮廓kuî3.前后鼻音:一般与声旁的前后鼻音是一致的,少数例外艮gen:垠yín 恳kěn 跟gēn 坙jing:经jīng 径jìng 刭jǐng亘gân:垣yuán 桓huán 恒hãng 令lìng:岭lǐng 伶líng 邻lín 拎līn 4.平翘舌音:也基本与声旁一致,少数例外仓cāng:沧cāng 疮chuāng 怆chuàng寺sì:侍shì峙zhì恃shì真zhēn:镇zhân 缜zhěn 臻zhēn多音字:(空的为用法多的一项)1.语体色彩:(上面为口语,下面为书面语)壳kã(口)贝壳脑壳翘qiào 翘尾巴qiào(书)躯壳金蝉脱壳地壳qiáo 翘楚翘首连翘露lîu 露头出头露面露脸露马脚露丑剥bāo 剥皮lù bō嚼jiáo 咬文嚼字味同嚼蜡勒lēijuã咀嚼lâ勒令勒索悬崖勒马2.词性:粘nián(形)粘性粘土处chǔ(动)处方……zhān(动)粘贴……chù(名)处所处长处处泊pō(名)水泊血泊湖泊畜chù(名)牲畜家畜bï(动)停泊泊位xù(动)畜养畜牧囤tún(动)囤积dùn(名)粮囤3.语意:哄hōng(许多人同时发出声音)哄堂大笑哄抢强qiánghǒng(骗)哄骗qiǎng(勉强)强颜欢笑强词夺理hîng(吵闹)起哄一哄而散jiàng 倔强强嘴着zhāo(同“招”)着数花着累lãi 累赘硕果累累zháo(感受;受到)着凉着急着慌lěi 拖累累积牵累连累zhuï着手着陆着落着笔lâi(疲劳)劳累称chēng 差chā(书)差别差价差强人意qiáng châng(同“秤”)尺量称称chà(口)差劲差不多chân(适合;相当)称职称心称体裁衣chāi 差遣差事差使信差cī参差臭xiù(气味)乳臭铜臭挨āi 挨近挨家挨户挨个chîu ái(遭受;拖延)挨打挨时间禁jīn(禁受;忍住)弱不禁风忍俊不禁结jiē(长出)树结果结实jìn 禁止禁令禁忌禁闭jiã尽jǐn 尽管尽快尽量横hãngjìn 尽力尽情尽心尽职hâng蛮横横财横祸横暴供gōng 场cháng 场院一场大战gîng(迷信;办案)供认供奉供职chǎng弹dàn(与军事有关)丧sāng(与死了人有关)丧钟丧乱tán sàng角jiǎo 口角(嘴边)渐jiān 渐染西风东渐juã角斗角逐角色口角(争吵)角力jiàn创chuāng 创伤重创创巨痛深创痍予yú(我)予取予求chuàng yǔ纤xiān(细)纤弱纤细纤维靡mí(浪费)奢靡靡费qiàn(拉船的绳)纤夫拉纤mǐ中zhōng中看中听擂lãi 擂鼓zhîng(正对上;受到)中肯中意中伤lâi 打擂擂台应yīng(答应;应该)应当应许应允应届载zǎi(记载;年)登载一年半载yìng zài 载体载歌载舞承载鲜xiān(新鲜)屡见不鲜时鲜xiǎn(少)鲜为人知寡廉鲜耻4.特殊读音:熨yù熨帖症zhēng 症结槛kǎn 门槛藉jí狼藉yùn zhèng jiàn jiè轴zhïu 辟bì复辟辟邪脯pú胸脯倔juã倔强zhîu 压轴子pìfǔjuâ佣yōng 埋mái 遂suí半身不遂作zuō作坊yîng 佣金mán 埋怨suìzuî单音字:(只念这个音)萎靡wěi 呆板dāi 摇曳yâ粗犷guǎng 粳米jīng 叱咤zhà愆伏qiān 感喟kuì倨傲jù城垣yuán 氛围fēn 痉挛jìng 卓越zhuï脂肪zhī剽窃piāo 档次dàng 祛除qū褒贬bāo挑衅xìn 暂时zàn 绯闻fēi 扉页fēi 根茎jīng 装帧zhēn 潜力qián 包庇bì栖身qī嫉妒jí发酵jiào 掣肘châ船舷xián 荫蔽yìn 狙击jū追溯sù朔风shuî即使jí既然jì倾倒qīng 顷刻qǐng徇私枉法xùn 高屋建瓴líng 惩前毖后chãng 怏怏不乐yàng 汗流浃背jiā韦编三绝wãi 返璞归真pú锲而不舍qiâ针砭时弊biān 弦外之音xián 形声字:匡正kuāng 箩筐kuāng 诓骗kuāng 框架kuàng 眼眶kuàng通缉jī缉边qī逻辑jí戢怒jí舟楫jí教诲huì晦涩huì侮辱wǔ悔悟huǐ草莓mãi嗔怪chēn 缜密zhěn 谨慎shân 镇定zhân 颠倒diān刽子手guì脍炙人口kuài 荟萃huì市侩kuài 狡狯kuài泥淖nào 悼念dào 飞棹zhào 绰绰有余chuî卓越zhuï错别字几种方法:1.注意形近字的区别,把偏旁与字意联系起来记忆。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学复习习题化学计量在实验中的应用一、选择题(本题包括16个小题,每小题3分,共48分)1.(2010·安庆模拟)设N A为阿伏加德罗常数的值,下列叙述中正确的是()A.常温常压下,3.2 g O3所含电子数为1.2 N AB.标准状况下,2.24 L CCl4中含有的C—Cl键的数目为0.4 N AC.标准状况下,11.2 L NO与11.2 L O2混合所含原子数为2N AD.将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 N A Fe3+解析:3.2 g O3含0.2 N A个氧原子,所含电子数为1.6 N A,A不正确;标准状况下,CCl4是液体,B不正确;NO、O2都是双原子分子,二者物质的量和为1 mol,故所含原子数为2N A,C正确;因Fe3+水解,Fe3+的数目应小于0.1 N A,D不正确.答案:C2.(2009·浙江高考)用N A表示阿伏加德罗常数的值,下列说法正确的是()A.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5N AB.1 mol乙烷分子含有8N A个共价键C.58.5 g的氯化钠固体中含有N A个氯化钠分子D.在1 L 0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1N A解析:A项,0.25 mol NO与0.25 mol O2将反应生成0.25 mol NO2,剩余O2 0.125 mol,不考虑NO2转化N2O4,分子总数应为0.375N A;B项,乙烷的结构式为,1 mol分子中含7N A个共价键;C项,NaCl为离子晶体,无分子;D项正确,因CO2-3水解使得阴离子数增加.答案:D3.(2010·汕头二模)只给出下列甲和乙中对应的量,不.能求出物质的量的是()D解析:根据n=NN A 、n=VV m、n B=c B V可知,A、B、D中都能求出物质的量.答案:C4.某氯化镁溶液的密度为1.18 g/cm3,其中镁离子的质量分数为5.1%,300 mL该溶液中氯离子的物质的量约等于()A.0.37 molB.0.63 molC.0.74 molD.1.5 mol解析:n(Mg2+)=300 mL×1.18 g/cm3×5.1%24 g/mol=0.75 mol,在MgCl2溶液中,Mg2+与Cl-的物质的量之比为1∶2,则n(Cl-)=2n(Mg2+)=2×0.75 mol=1.5 mol.答案:D5.等质量的CuO和MgO粉末分别溶于相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol/L和b mol/L.则a与b的关系为()A.a=bB.a=2bC.2a=bD.a=5b解析:n(CuO)∶n(MgO)=mM(CuO)∶mM(MgO)=m80∶m40=1∶2,体积相同时,物质的量的比等于物质的量浓度的比,所以ab=n(CuO)n(MgO)=122a=b,故选C.答案:C6.某溶液中大量存在以下五种离子:NO-3、SO2-4、Fe3+、H+、M,其物质的量之比为n(NO-3)∶n(SO2-4)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则M可能为()A.Fe2+B.Mg2+C.CO2-3D.Ba2+解析:根据电荷守恒可知M为+2价的阳离子,排除CO2-3,由于原溶液中存在SO2-4,根据离子共存知,其中不可能含有Ba2+,又因原溶液中含有NO-3和H+,使溶液具有强氧化性,所以原溶液中不可能存在Fe2+. 答案:B7.有一真空瓶的质量为W1g,向该瓶充入氧气后的质量为W2g,在相同条件下充入某一单质气体,其质量为W3g,则此单质气体的摩尔质量为()A.W3-W1W2-W132 B.W2-W1W3-W1×32C.W3-W1W2-W132 g/mol D.W2-W1W3-W1×32 g/mol解析:根据题意,该气体物质的量与氧气相同,有如下关系:2132 g/mol =31M ,即可确定答案.答案:C8.在标准状况下,若V L 甲烷中含有的氢原子个数为n ,则阿伏加德罗常数的数值可表示为 ( )A.Vn /22.4B.22.4n /VC.Vn /5.6D.5.6n /V解析:设阿伏加德罗常数为N A ,则依题意,可得V L 22.4 L/mol ×4N A =n ,即N A =5.6nVmol -1. 答案:D9.若以w 1和w 2分别表示浓度为a mol/L 和b mol/L 氨水的质量分数,且知2a =b ,则下列判断正确的是(氨水的密度比纯水的小) ( )A.2w 1=w 2B.2w 2=w 1C.w 2>2w 1D.w 1<w 2<2w 1解析:设溶液的体积为V L ,密度为ρ g/mL ,溶质的摩尔质量为M g/mol ,物质的量浓度为c mol/L ,由c =1000ρ·wM得:a =1000ρ1w 1/17,b =1000ρ2w 2/17,因为2a =b ,所以有2ρ1w 1=ρ2w 2,又氨水的密度比纯水小,且浓度越大,密度越小,所以ρ1>ρ2,代入上式得:2w 1<w 2. 答案:C10.300 mL Al 2(SO 4)3溶液中,含Al 3+为1.62 g ,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL ,反应后溶液中SO 2-4的物质的量浓度为 ( )A.0.4 mol/LB.0.3 mol/LC.0.2 mol/LD.0.1 mol/L 解析:n (Al 3+)=1.62 g 27 g/mol=0.06 mol ,则n (SO 2-4)=0.09 mol.加入的Ba(OH)2溶液中含Ba 2+ 0.03 mol ,反应后剩余SO 2-40.06 mol ,此时溶液的体积为600 mL ,因此c (SO 2-4)=0.1 mol/L.答案:D11.在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9 g/cm 3,这种氨水的物质的量浓度和质量分数分别为( )A.18.4 mol/L 34.7%B.20.4 mol/L 38.5%C.18.4 mol/L 38.5%D.20.4 mol/L 34.7%解析:NH 3溶于水后虽然大部分生成NH 3·H 2O ,但在计算时,仍以NH 3作为氨水中的溶质;气体溶于水后,溶液的体积、密度均发生了改变,计算时应该用溶液质量除以密度求出其体积.设水的体积为1 L ,则有: w =700 L÷22.4 L/mol×17 g/mol 1000 g +700 L÷22.4 L/mol×17 g/mol ×100%=34.7% 氨水的体积为:V=0.9 g/cm3×1000 cm3/L=1.7 L故c=700 L÷22.4 L/mol1.7 L=18.4 mol/L.答案:A12.以下仪器,用蒸馏水洗净后便可立即使用而不.会对实验结果造成误差的是()①中和滴定用的锥形瓶②中和滴定用的滴定管③容量瓶④配制一定体积、一定物质的量浓度的NaOH溶液,用于称量的小烧杯⑤量筒(量取浓H2SO4用)A.①②⑤B.①③C.②④⑤D.①⑤解析:中和滴定时锥形瓶中有蒸馏水不会对实验结果产生误差,容量瓶定容时仍会加水至刻度线.答案:B13.某学生配制了100 mL 1 mol/L的硫酸溶液.然后,对溶液浓度做精确测定,且测定过程中一切操作都正确.结果测得溶液的物质的量浓度低于 1 mol/L.那么,在配制过程中,下列操作可能导致溶液浓度偏低的是()①量筒用蒸馏水洗净后立即用来量取浓硫酸②将浓硫酸在烧杯中稀释,转移到容积为100 mL的容量瓶中后,没有洗涤烧杯③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切A.②③④B.③④C.①②③D.①②③④解析:①量筒用蒸馏水洗净后量取,浓H2SO4被稀释,所取溶质H2SO4偏少,会导致浓度降低.②未洗涤烧杯,溶质H2SO4损失,会导致浓度偏低.③少量溶液流到容量瓶外面,溶质H2SO4损失,会导致浓度偏低.④加水超过了刻度线,马上用胶头滴管吸去多余的水,会损失H2SO4,导致溶液浓度偏低.答案:D14.下列叙述正确的是()A.与28 g CO具有相同分子数的CO2的质量一定是44 gB.与V L CO具有相同分子数的CO2的体积一定是V LC.所含原子数相等的CO与CO2的密度之比为7∶11D.所含原子数相等的CO与CO2的密度之比为21∶22解析:A项:根据公式NN A =n=mM,可列式:m(CO)M(CO)=m(CO2)M(CO2),可判断A项正确.B、C、D都未指明两种气体所处的温度和压强是否相同,所以说法都不正确. 答案:A性,其还原产物为SO 2,B 错误.C 项设硫酸与水的体积分别为 1mL ,混合后浓度为(1.84 g/cm 3×1 mL×98%÷98 g/mol)÷0.002 L =9.2 mol/L ,但实际混合后溶液密度有变化,其浓度不等于9.2 mol/L ,C 错误.D 中随反应进行,浓硫酸变为稀硫酸时反应停止,被还原的硫酸小于12×0.05 L×18.4 mol/L ,即小于0.46 mol.答案:D16.对于1 mol/L 的氨水,下列叙述正确的是(忽略溶液混合时的体积变化) ( ) A.将标准状况下22.4 L 氨气溶于1 L 水中配成溶液,即可得1 mol/L 的氨水 B.1 mol/L 的氨水的质量分数小于1.7%C.将1 mol/L 的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5 mol/LD.将1 mol/L 的氨水与3 mol/L 的氨水等质量混合后,所得氨水的物质的量浓度为2 mol/L解析:A 项,因氨水以起始溶入的氨为溶质,故将1 mol 氨溶于水配成1 L 溶液,其物质的量浓度为1 mol/L ;B 项,由物质的量浓度与质量分数的关系,可有以下表达式:1000 cm 3/L×ρ×w17 g/mol =1 mol/L ,又由于氨水的密度ρ<1 g/cm 3,故w >1.7%;C 项,若将1 mol/L 的氨水与水等体积混合,所得氨水的浓度为0.5 mol/L ,由于氨水密度比水小,则相同质量的氨水的体积比水大,故等质量混合后所得氨水的物质的量浓度大于0.5 mol/L ;D 项,因氨水的浓度越大,其密度越小,则等质量混合时,3 mol/L 的氨水所占体积比1 mol/L 的氨水大,故所得氨水的物质的量浓度大于2 mol/L. 答案:C二、非选择题(本题包括6个小题,共52分)17.(7分)(1)将40 g NaOH 溶于水,配成250 mL 溶液甲,甲的浓度为 mol/L(将正确选项的标号填入空格,下同).将50 mL 甲加水稀释至100 mL 后,得溶液乙,乙的浓度为 mol/L.将10 mL 乙溶液与质量分数为9%、密度为1.11 g/cm 3的NaOH 溶液10 mL 混合,该混合溶液丙的浓度为 mol/L(忽略溶液体积变化).混合溶液丙能与 mL 0.5 mol/L 的盐酸恰好完全中和.(2)若12.4 g Na 2X 中含有0.4 mol 钠离子,Na 2X 的摩尔质量是 ,X 的相对原子质量是 . 解析:(1)n (NaOH)=40 g40 g/mol=1 mol ,c (甲)=1 mol0.25 L=4 mol/L ; c (乙)=4 mol/L×0.05 L0.1 L=2 mol/L ;c (丙)=2 mol/L×0.01 L +10 mL×1.11 g/cm 3×9%÷40 g/mol0.01 L +0.01 L=2.25mol/L ,丙中NaOH 的物质的量等于HCl 的物质的量,n (HCl)=2.25 mol/L×0.02 L =0.045 mol , V [HCl(aq)]=0.045 mol0.5 mol/L=0.09 L(即90 mL).(2)n (Na 2X)=12n (Na +)=120.4 mol =0.2 mol ,M (Na 2X)=12.4 g 0.2 mol =62 g/mol ,M (X)=62 g/mol -2×23 g/mol =16 g/mol ,因此,X 的相对原子质量为16.答案:(1)A C H D (2)62 g/mol 1618.(12分)实验室需要0.1 mol/L NaOH 溶液450 mL 和0.5 mol/L 硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称).(2)下列操作中,容量瓶所不具备的功能有 (填序号).A.配制一定体积准确浓度的标准溶液B.贮存溶液C.测量容量瓶规格以下的任意体积的液体D.准确稀释某一浓度的溶液E.量取一定体积的液体F.用来加热溶解固体溶质(3)根据计算用托盘天平称取NaOH 的质量为 g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1 mol/L(填“大于”“等于”或“小于”,下同).若NaOH 溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度 0.1 mol/L.(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm 3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有15 mL 、20 mL 、50 mL 量筒,应选用 mL 的量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 ___________________________.解析:(1)五种仪器分别为烧瓶、量筒、分液漏斗、胶头滴管、容量瓶,配制上述溶液肯定不需要烧瓶和分液漏斗,还需要烧杯、玻璃棒.(2)容量瓶不能用于贮存、加热溶液,它只有一个刻度线,也不能测量容量瓶规格以下的任意体积的液体.(3)因无450 mL 的容量瓶,配制NaOH 溶液只能用500 mL 的容量瓶,m (NaOH)=c ·V ·M =0.1 mol/L×0.5 L×40 g/mol =2.0 g ,定容仰视刻度线,造成加水较多,浓度偏低,洒落溶液会造成溶液浓度偏低.(4)由稀释前后物质的量相等,V (浓)=c (稀)·V (稀)c (浓)=000.50.51000 1.849897⨯⨯⨯L =0.2518.4 L =13.6 mL ,选用15 mL 的量筒最好,误差小.稀释时将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌. 答案:(1)A 、C 烧杯、玻璃棒 (2)B 、C 、E 、F (3)2.0 小于 小于(4)13.6 15 将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌19.(6分)常温下,将20.0 g 14%的NaCl 溶液跟30.0 g 24%的NaCl 溶液混合,得到密度为1.17 g/cm 3的混合溶液.(1)该混合溶液中NaCl 的质量分数为 . (2)该混合溶液中NaCl 的物质的量浓度 mol/L.(3)在1000 g 水中需加入 mol 氯化钠,才能使其浓度恰好与上述混合溶液浓度相等(保留1位小数).解析:(1)混合溶液的质量为:20.0 g +30.0 g =50.0 g ,混合溶液中溶质的质量为:20.0 g×14%+30.0 g×24%=10.0 g ,混合溶液中溶质的质量分数为:10.0 g50.0 g 100%=20%.(2)n (NaCl)=10.0 g58.5 g/molV (溶液)=50.0 g1.17 g/cm ×1000 mL/L c (NaCl)=n (NaCl)V (溶液)=10.0 g 58.5 g/mol ×1.17 g/cm 3×1000 mL/L 50.0 g =4.0 mol/L.(3)n (NaCl)×58.5 g/mol 1000 g +n (NaCl)×58.5 g/mol ×100%=20% n (NaCl)=4.3 mol.答案:(1)20% (2)4.0 (3)4.320.(10分)配制一定物质的量浓度的溶液是一个重要的定量实验.请回答以下问题:(1)配制浓度为 2 mol/L 的NaOH 溶液100 mL ,用托盘天平称取NaOH 固体时,天平读数将 (填写代号,下同) A.等于8.0 g B.等于8.00 g C.大于8.0 g D.等于0.2 g(2)要配制浓度约为2 mol/L 的NaOH 溶液100 mL ,下面的操作正确的是 .A.称取8 g NaOH 固体,放入250 mL 烧杯中,用量筒量取100 mL 蒸馏水,加入烧杯中,同时不断搅拌至固体溶解B.称取8 g NaOH 固体,放入100 mL 量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mLC.称取8 g NaOH 固体,放入100 mL 容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线,盖好瓶塞,反复摇匀D.用100 mL 量筒量取40 m L 5 mol/L NaOH 溶液,倒入250 mL 烧杯中,再用另一量筒量取60 mL 蒸馏水,边搅拌边慢慢倒入烧杯中(3)下列操作会使配制的BaCl2溶液浓度偏低的是.A.配制1 L 0.1 mol/L的BaCl2溶液时,将砝码放在左盘上,BaCl2放在右盘上进行称量B.选用的容量瓶内有少量蒸馏水C.定容摇匀后,液面下降,又加水至刻度线D.整个配制过程中,容量瓶不振荡(4)某实验中需 2 mol/L的Na2CO3溶液950 mL,配制时应选用的容量瓶的规格为,称取Na2CO3的质量为.解析:(1)称量NaOH固体时需用小烧杯盛放,故天平读数等于(8.0 g +烧杯质量).(2)注意NaOH溶液的浓度约为2 mol/L,并不是精确配制浓度为2 mol/L的溶液.(3)配制一定物质的量浓度溶液的误差分析要紧扣c=nV,分析错误操作对n、V的影响.(4)根据容量瓶的常用规格可知,应配制 2 mol/L的Na2CO3溶液1000 mL,所需Na2CO3的质量为:1 L×2 mol/L×106 g/mol=212 g.答案:(1)C(2)AD(3)AC(4)1000 mL212 g21.(9分)某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:Ⅰ.①配制浓度均为0.5 mol/L的H2SO4和H2C2O4溶液.②用量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.③分别称取除去表面氧化膜的镁带并系于铜丝末端.④检查装置的气密性,在广口瓶中装满水,按图连接好装置.⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录.⑥反应结束后,读取量筒内水的体积为y mL.Ⅱ.请将上述步骤补充完整并回答下列问题:(1)用密度为 1.84 g/cm398%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有、、烧杯、玻璃棒、酸式滴定管.(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是.(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是.(4)简述速率不等的原因,铜丝不与酸接触的原因是.解析:Ⅰ.②根据量取溶液体积的精确度要求可知使用酸式滴定管;⑤比较H2SO4、H2C2O4反应速率可通过观察气泡或完全反应所用时间长短.Ⅱ.(1)配制溶液需要使用特定的仪器(250 mL的容量瓶),定容时需用到胶头滴管.(2)为保证测量数据的准确,应该先将气体冷却到室温,所以应该先进行操作②,然后调整液面使气体压强等于外界大气压,最后正确读数.(3)如丙(量筒)中的液面高于乙的液面,应将丙向下移动.(4)因为H 2SO 4是强酸、H 2C 2O 4是弱酸,故同浓度的两溶液H 2SO 4中含氢离子浓度大,反应速率快.若铜丝接触溶液,则构成原电池,使反应速率加快,影响实验结果. 答案:Ⅰ.酸式滴定管 反应所需时间 Ⅱ.(1)250 mL 的容量瓶 胶头滴管 (2)②①③ (3)下移丙(4)氢离子浓度不同 易形成原电池加快反应速率,干扰实验的测定22.(8分)(2010·南京模拟)将10 g 复盐CuSO 4·x (NH 4)2SO 4·y H 2O 加到过量的NaOH 溶液中,加热;生成的氨用100 mL 0.5 mol/L硫酸全部吸收,多余的硫酸用2 mol/L NaOH 溶液中和,用去NaOH 溶液25 mL.已知复盐中SO 2-4的质量分数为48%,则x = ,y = .解析:解答时可根据题意首先求得铵根离子的物质的量,根据10 g 复盐中SO 2-4的质量分数为48%,可求SO 2-4的物质的量.根据复盐中阴阳离子所带正、负电荷数相等,可求出Cu 2+的物质的量,再根据总质量和已知各部分的物质的量,求出水的物质的量,进而求得各部分物质的量之比.10 g 复盐中n (NH +4)=2×(0.5 mol/L×0.1 L -2 mol/L×0.025 L×12)=0.05 moln (SO 2-4)=10 g×48%96 g/mol=0.05 moln (Cu 2+)=0.05 mol -0.05 mol×12=0.025 moln (H 2O)=10 g -0.025 mol×160 g/mol -0.025 mol×132 g/mol18 g/mol=0.15 moln (CuSO 4)∶n [(NH 4)2SO 4]∶n (H 2O) =0.025∶0.025∶0.15=1∶x ∶y 得x =1,y =6 答案:1 6第八章 第三节 盐类的水解一、选择题(本题包括10小题,每小题5分,共50分)1.(2009·天津高考)25℃时,浓度均为0.2 mol/L 的NaHCO 3和Na 2CO 3溶液中,下列 判断不.正确的是 ( )A.均存在电离平衡和水解平衡B.存在的粒子种类相同C.c(OH-)前者大于后者D.分别加入NaOH固体,恢复到原温度,c(CO2-3)均增大解析:A项,两种溶液中均存在着水的电离平衡,NaHCO3溶液中还存在:HCO-3H++CO2-3及HCO-3+H2OHCO-3+OH-,故A正确.B项,两种溶液中均存在 H2CO3+OH-,Na2CO3溶液中还存在有CO2-3+H2ONa+、CO2-3、HCO-3、H2CO3、OH-、H+、H2O,B正确.C项,浓度相同时,CO2-3水解程度大于HCO-3,故Na2CO3溶液中c(OH-)要大,故C错.D项,NaHCO3溶液中加入NaOH固体:HCO-3+OH-===H2O+CO2-3,c(CO2-3)增大,Na2CO3溶液中加入NaOH,导致CO2-3的水解平衡向左移动,c(CO2-3)增大,故D正确.答案:C2.下列有关问题,与盐的水解有关的是()①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AlCl3溶液得到Al(OH)3固体A.①②③B.②③④C.①④⑤D.①②③④⑤解析:①中NH4Cl与ZnCl2溶液水解均显酸性,可除去金属表面的锈;②HCO-3与Al3+水解相互促进,产生二氧化碳,可作灭火剂;③草木灰的主要成分碳酸钾水解显碱性,而铵态氮肥水解显酸性,因而不能混合施用;④碳酸钠溶液水解显碱性,而磨口玻璃塞中的二氧化硅会与碱反应生成硅酸钠将瓶塞与瓶口黏结,因此盛放碳酸钠的试剂瓶应用橡胶塞;⑤AlCl3溶液中存在水解平衡:AlCl3+3H2OAl(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,最终得到Al(OH)3固体.答案:D3.用一价离子组成的四种盐溶液:AC、BD、AD、BC,其物质的量浓度分别为1 mol/L,在室温下前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液pH<7,则正确的是()A B C D碱性AOH>BOH AOH<BOH AOH>BOH AOH<BOH酸性HC>HD HC>HD HC<HD HC<HD 解析:强酸强碱盐不水解,溶液呈中性;强酸弱碱盐,溶液呈酸性;强碱弱酸盐,溶液呈碱性;弱酸弱碱盐,溶液可能呈中性、酸性,也可能呈碱性.根据题意,AOH为强碱,BOH为弱碱;HC为强酸,HD为弱酸.答案:A4.向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为()A.减小、增大、减小B.增大、减小、减小C.减小、增大、增大D.增大、减小、增大解析:在CH3COONa溶液中存在平衡:CH3COO-+H2OCH3COOH+OH-.加入NH4NO3固体促进了CH3COO-水解,平衡右移,CH3COO-浓度减小;加入Na2SO3抑制了CH3COO-水解,平衡左移,CH3COO-浓度增大;加入FeCl3促进了CH3COO-的水解,平衡右移,CH3COO-浓度减小.答案:A5.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,下列排序正确的是()A.c(OH-)>c(HA)>c(HB)>c(H+)B.c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+)D.c(OH-)>c(HB)>c(HA)>c(H+)解析:酸越弱,对应的盐的水解程度越大,同浓度的NaA和NaB的溶液中,前者水解程度更大,因此HA的浓度更大一些,D项错误;盐的水解程度很弱,故c(OH-)不可能大于c(A-)和c(B-),故B、C错误.答案:A6.关于氯化铁水解的说法错误的是()A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸解析:增大FeCl3的浓度,平衡正向移动,但水解程度减小,加水稀释,平衡正向移动,水解程度增大,A、B均正确;水解是吸热反应,温度升高,水解程度增大,C错误;Fe3+水解显酸性,增大H+浓度可抑制Fe3+的水解,D正确.答案:C7.(2009·广东高考)下列浓度关系正确的是()A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)D.Na2CO3溶液中:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+)解析:A项,氯水中只有部分Cl2与水作用,生成HCl和HClO,Cl2的浓度与其他粒子浓度的关系无法确定,A错误.B 项应为:c(H+)>c(Cl-)>c(ClO-)>c(OH-).C项,氢氧化钠与醋酸恰好完全中和,生成的醋酸钠水解呈碱性,c(OH-)>c(H+),根据电荷守恒,c(Na+)>c(CH3COO-).答案:D8.下列溶液中有关物质的量浓度关系正确的是()A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=c(H+)+c(CH3COOH) D.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)解析:选项A中根据电荷守恒,此关系式正确;选项B中pH相等,溶液中的c(OH-)相等,根据酸性越弱,水解越强,所以溶液中c(Na2CO3)<c(CH3COONa);选项C中根据电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)①,由于c(CH3COOH)=c(CH3COONa),且它们等体积混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)②,将①×2-②得:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH);选项D中NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同时也可以判断HA-以电离为主,所以离子浓度的大小顺序是:c(HA-)>c(H+)>c(A2-)>c(H2A).答案:A9.(2009·绍兴质检)能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是()①将水加热煮沸②向水中投入一小块金属钠③向水中通CO2④向水中加入明矾晶体⑤向水中加NaHCO3固体⑥向水中加NaHSO4固体A.①②④⑤B.①④⑤C.③④⑤D.④解析:将水加热可以促进水的电离,但c(H+)=c(OH-);钠与水反应,溶液中c(OH-)增大,抑制水的电离;向水中通入二氧化碳、加入硫酸氢钠,溶液中的c(H+)增大,抑制水的电离;向水中加入碳酸氢钠,HCO-3与水电离出的氢离子结合,促进水的电离,但c(H+)<c(OH-);加入明矾晶体,铝离子与水电离出的氢氧根离子结合生成氢氧化铝,促进了水的电离,且c(H+)>c(OH-).答案:D10.室温下,在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是()A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)B.在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)C.在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)D.在D点:c(CH3COO-)+c(CH3COOH)=0.1 mol/L解析:根据电荷守恒,可知A正确;CH3COOH是弱酸,若使两者反应后的溶液pH=7,则应该使CH3COOH稍过量,B正确;在C点c(H+)>c(OH-),再根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),可得c(CH3COO-)>c(Na+),C 错误;在D点共加入CH3COOH的物质的量为0.025 L×0.2 mol/L,反应后一部分变为CH3COO-,另一部分依然为CH3COOH分子,溶液体积为0.05 L,故根据物料守恒,可以确定c(CH3COO-)+c(CH3COOH)=0.1 mol/L.答案:C二、非选择题(本题包括4小题,共50分)11.(11分)25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH(已知25℃时,CH3COONH4溶液呈中性).A.固体CH3COOK B.固体CH3COONH4C.气体NH3D.固体NaHCO3(2)若________的解释正确(填“甲”或“乙”),溶液的pH应________(填“增大”“减小”或“不变”).(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液.判断:①溶液中共有________种粒子;②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________;③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.解析:由题意知,要判断甲、乙两种解释正确与否,可加入一种含有CH3COO-而不显碱性的盐,如CH3COONH4,其溶液呈中性,从水解的角度看对醋酸溶液的pH变化无影响;但CH3COONH4电离产生的CH3COO-可使醋酸的电离平衡CH3COOHCH3COO-+H+向左移动,c(H+)减小,pH增大.从而说明甲不正确,乙正确.因发生反应CH3COONa +HCl===CH3COOH+NaCl得到0.006 mol CH3COONa,0.004 mol CH3COOH和0.004 mol NaCl的混合溶液,其中含有CH3COO-、Na+、H+、Cl-、OH-、CH3COOH和H2O,共7种粒子.由物料守恒知n(CH3COO-)+n(CH3COOH)=0.01 mol,由电荷守恒可得n(Na+)+n(H+)=n(CH3COO-)+n(Cl-)+n(OH-),n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.01 mol-0.004 mol=0.006 mol.答案:(1)B(2)乙增大(3)①7②CH3COOH CH3COO-③0.00612.(12分)现有①0.2 mol/L NaOH溶液②0.2 mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-).则:(1)①中由水电离出的c(OH-)________②中由水电离出的c(H+)(填“>”、“=”或“<”).(2)上述混合液中共存在________种粒子.且:c(HX)________c(X-)(填“>”、“=”或“<”,下同).c(HX)+c(X-)________0.1 mol/L(忽略体积变化)请根据电荷守恒写出一个用离子浓度表示的等式:____________________________________________________________________.(3)上述混合液显________性(填“酸”、“碱”或“中”),其原因用离子方程式表示________________________________________________________________________.解析:NaOH溶液与HX溶液等浓度、等体积混合,二者恰好完全中和,所得溶液中c(Na+)>c(X-),说明X-水解,即HX 为弱酸.(1)HX溶液中c(H+)对水电离的影响程度小于NaOH溶液中c(OH-)对水电离的影响程度.[来源:](2)混合溶液中应存在Na+、X-、H+、OH-、H2O、HX六种粒子.由于水解程度较小,故c(HX)<c(X-),由物料守恒知c(HX)+c(X-)=0.1 mol/L.答案:(1)<(2)6<=c(Na+)+c(H+)=c(OH-)+c(X-)(3)碱X-+H2OX+OH-13.(14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:请回答:(1)从①组实验分析,HA是强酸还是弱酸________.(2)②组实验表明,c__________0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是__________________.(3)从③组实验结果分析,说明HA的电离程度______________NaA的水解程度(填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是__________________.(4)①组实验所得混合溶液中由水电离出的c(OH-)=________mol/L.写出该混合溶液中下列算式的精确结果(不能作近似计算).c(Na+)-c(A-)=________ mol/L;c(OH-)-c(HA)=________mol/L.解析:(1)从①组情况分析,等体积等物质的量浓度的HA和NaOH溶液混合后,溶液显碱性,说明生成强碱弱酸盐,即HA 是弱酸.(2)②组中NaOH溶液的浓度为0.2 mol/L,混合后溶液显中性,说明HA稍过量,HA的物质的量浓度应大于0.2 mol/L.根据电荷守恒可得c(Na+)+c(H+)=c(A-)+c(OH-),溶液pH=7,呈中性c(H+)=c(OH-),则c(A-)=c(Na+).(3)第③组实验相当于等体积等物质的量浓度的HA和NaA混合,pH<7说明HA的电离程度大于NaA的水解程度,溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).(4)①组实验所得混合溶液中的pH=9,则c(OH-)=10-5 mol/L,水电离出的c(H+)=c(OH-)=10-5 mol/L.由电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可得c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9) mol/L,由A-―→HA,OH-H2O―→H3O+可得质子守恒关系式c(OH-)=c(HA)+c(H+),所以c(OH-)-c(HA)=c(H+)=10-9 mol/L.答案:(1)弱酸(2)大于c(A-)=c(Na+)(3)大于c(A-)>c(Na+)>c(H+)>c(OH-)(4)10-510-5-10-910-914.(13分)Ⅰ.已知盐酸和氨水混合后,其溶液中只存在OH-、H+、NH+4、Cl-四种带电离子,某同学推测其离子浓度大小顺序有以下几种:①c(Cl-)>c(NH+4)>c(H+)>c(OH-)。
