中考化学专题测试卷溶解度及溶解度曲线的应用含答案
中考化学专题练习溶解度(含解析)

溶解度一、选择题1.如图是甲、乙两种固体物质的溶解度曲线.以下说法错误的选项是()A.T℃时,甲、乙两物质的溶解度相等B.乙的饱和溶液降温时,溶质质量分数保持不变C.甲中混有少许乙,可采纳降温结晶的方法提纯甲D.T℃时,甲的饱和溶液溶质质量分数为20%2.t ℃时,向一支盛有熟石灰的烧杯中加入50g 水,充足振荡后静置,烧杯底部仍有未溶解的白色固体.以下有关表达正确的选项是()A.高升温度上层清液变为不饱和溶液B.t ℃时,熟石灰的溶解度为C.烧杯中溶液的质量小于D.上层清液中溶质质量分数大于0.3%3.以下说法不合理的是()A.“卤面”制作时,加入氯化钠当调味剂B.大脖子病是人体缺少铁元素惹起的C.大多数物质的溶解度随温度的高升而增大D.水受热膨胀是因为水分子间的距离变大4.T℃时,将少许生石灰放入必定质量的饱和石灰水中,搅拌并冷却至原温度,获得的溶液与原溶液对比,以下物理量前后不变的是()①溶质的质量②溶剂的质量③溶液的质量④溶质的质量分数⑤溶解度.A.①③⑤B.②④⑤C.②④D.④⑤5.以下四个图象能正确反响对应实验操作的是()A.向必定量的饱和石灰水中不停加入生石灰B.向等质量的锌、铁中滴加等质量分数的稀盐酸C.向必定的氧化铁中通入一氧化碳气体并连续高温D.向必定量的氢氧化钠和氯化钡的混淆溶液中滴加稀硫酸6.下表是 KCl 固体在不一样温度时的溶解度.以下说法错误的选项是()温度/ ℃0 20 40 60 80 溶解度 /gA. KCl 固体的溶解度随温度的高升而增大B.80℃时, KCl 固体的溶解度是C.60℃的 KCl 饱和溶液降温后会有晶体析出D.20℃时, KCl 饱和溶液的溶质质量分数为34.0%7.以下说法不正确的选项是()A.物质的溶解度必定随温度的高升而增大B.蔗糖水属于溶液C.在必定条件下,饱和溶液与不饱和溶液之间能够互相变换D.翻开汽水瓶盖,汽水会自动喷出来,证明气体的溶解度和压强有关8.小张同学用某固体物质进行以下图的实验,依据实验判断以下说法不正确的选项是()A.该固体物质的溶解度随温度的高升而增大B.溶液 b 必定是不饱和溶液C.溶液 d 中溶质质量必定大于溶液 e 中的溶质质量D.溶液 d 和溶液 e 的溶质质量分数可能同样9.下表列出了硝酸钾在不一样温度时的溶解度.温度/ ℃10 20 30 40溶解度 /g某兴趣小组做了如图实验:以下说法中正确的选项是()A.①②③中溶液都为不饱和溶液B.②③中都含有末溶解的固体C.①②③中溶液的质量相等D.③中溶质质量分数最大10.在化学知识中有很多规律,以下详细物质的性质切合对应规律的是()A.某些非金属氧化物能和碱反响生成盐和水;比如:二氧化碳和三氧化硫B.一般固体物质的溶解度随温度的高升而增大;比如:氢氧化钙和氯化钠C.常温下金属一般为固态;比如:汞和金D.某些非金属单质能够将金属从其氧化物中复原出来;比如:氢气和一氧化碳11.如表是NaCl、 KNO3在不一样温度时的溶解度温度/ ℃10 20 30 40 50 60溶解度 /g NaClKNO3 110据此数据,以下有关说法中错误的选项是()A.在 40℃时, 100g 水中最多可溶解KNO3B. KNO3和 NaCl 的溶解度曲线在20℃~ 40℃温度范围内订交C.在 60℃时, KNO饱和溶液210g 加入 10g 水后,溶质质量分数为50%3D.在 20℃时 KNO和 NaCl 的混淆溶液100g ,恒温蒸发,先析出的晶体必定是NaCl312. KCl 与 KNO在不一样温度的溶解度数据如表.则以下说法正确的选项是()3温度/ ℃10 20 30 40 50KCl 30g 33g 35g 38g 41g KNO 21g 31g 45g 65g 88g 3A. KNO3比 KCl 的溶解度大B.两物质的溶解度相等的温度在20 ~ 30℃之间C.在20℃时,10g 水中加入5g KCl 可获得33.3%的KCl 溶液D.在50℃时,两物质各5g 分别加入10g 水中,充足溶解,均有固体节余13. Ca( OH)2在不一样温度时的溶解度以下表:温度/ ℃0 2040 6080溶解度/g依据表中信息,判断以下说法正确的选项是()A. Ca( OH)2的溶解度随温度的高升而增大B.20℃时, Ca( OH)2的溶解度为C.40℃时,降低 Ca( OH)2饱和溶液温度会析出溶质D. 60℃时,向 100g 水中加入 0.20g Ca ( OH)2充足搅拌,固体完整溶解14.物质 M在不一样温度下的溶解度数据以下表所示,以下说法正确的选项是()温度(℃)0 20 40 60 80 溶解度( g)A.0℃时, 15.9gM 溶于 150g 水中形成饱和溶液B.20℃时, M形成饱和溶液的溶质质量分数是15.3%C.若要配制 200.0g20.0% 的 M的饱和溶液,对应温度一定是60℃D.80℃时, M的饱和溶液138.2g 降温至 40℃,析出晶体的质量大于15.硝酸钾在不一样的溶解度数据如表,以下说法错误的选项是()温度/ ℃0 20 40 60 80 100 溶解度 /g 110 169 246 A.硝酸钾的溶解度受温度影响变化较大B.60℃时,饱和硝酸钾溶液中溶质与溶液质量之比为11: 21C.20℃时, 10g 水中加入5g 硝酸钾充足溶解后再加入5g 水,前后溶质的质量分数不变D.将溶质质量分数为28%的硝酸钾溶液从60℃降温至20℃,没有晶体析出16.以下有关量的变化图象与其对应表达符合的是()A.常温下,向必定量的饱和石灰水中加入氧化钙B.t ℃时,向等质量的甲、乙、丙三种物质中分别加水配成饱和溶液,所得溶液质量最小的是丙C.向必定质量的过氧化氢的水溶液中加入二氧化锰D.向等质量的铁和镁中分别加入足量的稀盐酸17.科学研究中常用图象来表示两个量(x, y)之间的关系,以使研究的间压变得直观了然.在某温度下.将少许氧化钙加入到必定量的饱和氢氧化钙溶液中.图甲表示整个过程中温度的变化,图乙表示氢氧化钙的溶解度与温度的关系.小阳同学要依照察看和思虑,作出了如图丙所示的图象,此图象反应了该过程中()A.溶质的质量与时间的关系B.溶剂的质量与时间的关系C.溶质的溶解度与时间的关系D.溶质的质量分数与时间的关系二、填空题18.下表是NaCl、 KNO3在不一样温度(℃)时溶解度(g)温度( t )0 10 20 30 40 50 60 70 80 90 100 溶解度NaCl( s )3KNO110 138 169 202 246 剖析上表,回答以下问题(1)60℃时, KNO3的溶解度为g(2)溶解度受温度变化影响较小的是.(3)20℃时, NaCl 饱和溶液溶质质量分数是(精准到).(4)温度为 t ℃时, NaCl 和 KNO的溶解度相等且为S 克,则 S 的取值范围是.319.如图 1 是 a、 b、 c 三种物质的溶解度曲线,回答以下问题:(1) P 点的含义是.(2) t ℃时,将 50g a 物质放入 50g 水中充足溶解获得溶液的质量为g.2(3)将 t 2℃时, a、 b、 c 三种物质的饱和溶液降温至t 1℃,所得溶液中溶质的质量分数由大到小的次序是.(4) t ℃时,将盛有 c 的饱和溶液的小试管放入盛水的烧杯中(如图2),向水中加入必定量的氢1氧化钠固体后,试管中的溶液变污浊,原由是.20.依据下表中的数据,回答以下问题:温度/ ℃20 40 60 80 100 溶解度 /g KClKNO3 110 169 246(1)20℃时 KCl 的溶解度是;(2)20℃时将20g KCl 与 50g 水混淆,充足溶解后,所得溶液为(填“饱和”或“不饱和”);(3)上表两种物质中,的溶解度受温度的影响大.21.下表是 KNO、 NaCl 在不一样温度下的溶解度(单位:g/100g 水)3温度0 10 20 30 40 50 60 70 80 90 100(℃)KNO 32 64 110 138 169 202 246 3NaCl 36 37 39①以上两种物质溶解度的变化受温度影响较小的是.②30℃时, KNO3的溶解度是g/100g 水.③KNO3溶液中含有少许 NaCl 时,可经过的方法提纯.④对③析出的晶体节余溶液描绘正确的选项是(填写编号).I 、节余溶液必定是KNO饱和溶液 II 、节余溶液必定是NaCl 不饱和溶液3III 、上述方法能够将二者完整分开IV 、析出的晶体中只含有KNO.322.下表是固体 A 和固体 B 在不一样温度时的溶解度.温度/ ℃0 20 40 60 80溶解度 /g 固体 A固体 B 110 169(1)从表中数据能够看出固体 A 和固体 B 的溶解度随温度高升而(填“增大”或“减小”).(2)20℃时,把50g 固体 A 放入 100g 水中,充足溶解后,所得溶液质量为g.(3)40℃时, A、 B 两种物质的饱和溶液中溶质的质量分数较大的是.(4)若 B 饱和溶液中有少许的A,可用以下法提纯B(填序号).①趁热过滤②蒸发结晶③冷却热饱和溶液.23.依据表中的数据,回答以下问题.温度/ ℃020*********溶解度 /NaClKNO3 110169246(1)40℃时, NaCl 的溶解度是.(2)20℃时,称取31.6g KNO 3固体加入盛有100g 水的烧杯中,充足溶解形成的溶液是(填“饱和”或“不饱和”)溶液;称取31.6g KNO 3固体时,发现托盘天平指针偏右,接下来的操作是.(3)当 KNO3中混有少许NaCl 时,提纯KNO3所采纳的方法为.(4)将等质量KNO3的饱和溶液和NaC1的饱和溶液从60℃降温到20℃,对所得溶液的表达正确的是(填序号).A、都是饱和溶液B、溶剂质量:KNO3> NaClC、溶液质量:KNO3< NaCl.24.下表是 NaCl, KCl , KNO三种物质在不一样温度下的溶解度.3温度/ ℃0 20 40 60 80 100溶解度 /gNaClKClKNO3 110 169 246(1)20℃时, NaCl 的溶解度是g;(2)若 NaCl 和 KCl 的溶解度相等,对应表中最小温度范围应在℃之间;(3)三种物质中,溶解度受温度影响变化最大的是,在必定温度下,要将该物质从其饱和溶液中结晶析出,最好的方法是.25.下表是 KNO、 NaCl 在不一样温度下的溶解度(单位:g/100g 水)3温度(℃)0 10 20 30 40 50 60 70 80 90 100 KNO 32 64 110 138 169 202 246 3NaCl 36 37 39(1)以上两种物质溶解度的变化受温度影响较小的是;(2)50℃时, KNO3的溶解度是g/100g 水;(3) KNO溶液中含有少许 NaCl 时,可经过的方法提纯;3(4)对( 3)析出的晶体和节余溶液描绘正确的选项是(填写编号)A.节余溶液必定是KNO饱和溶液 B .节余溶液必定不含有NaCl3C.节余的溶液必定是纯净物 D .析出的晶体中只含有KNO .326.下表是 KNO3的部分溶解度数据,请回答以下问题:(1)40℃时,将 70gKNO3固体加入100g 水中,充足搅拌,形成的溶液质量为g.(2)60℃时, KNO3的饱和溶液中获得晶体的一种方法是.(3)依照表中数据,请在如图坐标图中画出KNO3溶解度曲线的草图.温度/ ℃0 20 40 60 溶解度 /g 110三、解答题27.剖析办理图表中的信息是学习化学的一种重要方法.(1)如表是氯化钠和碳酸钠在不一样温度时的溶解度,依据此表回答:温度/ ℃10 20 30 40溶解度 /g 氯化钠碳酸钠①40℃时,氯化钠的溶解度为g.②碳酸钠的溶解度随温度的高升而(填“增大”或“减小”).在20℃时,将 100g 的水加入30g 碳酸钠中,充足搅拌后获得的是(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到 30℃,该溶液的溶质质量分数为(计算结果精准到0.1%).③10℃时,分别配制表中两种物质的饱和溶液,此中溶质质量分数较小的物质是.(2)将足量的稀盐酸加入必定量的铁、铜混淆物中,写出此中反响的化学方程式.如图是实验过程生成气体或节余固体的质量随反响时间的变化关系,此中表示正确的选项是(填标号).28.已知某碱溶液的溶解度随温度高升而增大;温度一准时,该碱溶液的浓度越大,其碱性越强.(1)要使该碱饱和溶液的pH 高升(溶质不变),可采纳的方法是.(2)要使该碱饱和溶液的pH 降低,在以下试剂中,哪些可选择加入?A. CO B . CaCO C . Fe( OH)3D .CuSO.2 3 4 29.下表是 KCl 在不一样温度时的溶解度.温度/ ℃0 10 20 30 40 50 60溶解度 /g x小明为测定x 的值,取 4 份 40℃的水各50g ,分别进行实验,并记录数据以下表.实验编号实验 1 实验 2 实验 3 实验 4 KCl 质量 /g 5 15 25 35 溶液质量 /g 55 65 70 70 请回答以下问题.(1)实验中需要用到的仪器有(只写一种).(2 )要使实验 2 的溶液达到饱和,可采纳的方法是.(3 )由实验可知, 40℃时KCl 的溶解度 x 为g .(4 )小明现要配制质量分数为30%的 KCl 溶液 100g,为达实验目的其主要操作是.30.下表是 NaCl 和 KNO在不一样温度时的溶解度:3温度/ ℃0 20 40 60 80 100溶解度 /g NaClKNO3 110 169 246(1)从表中数据能够看出 NaCl 和 KNO3的溶解度随温度高升而(2)若将 KNO3的不饱和溶液变为同样温度下饱和溶液,其方法为液中含有少许 NaCl 时,提纯的方法是(填一种).(3)以下有关说法正确的选项是.(填“增大”或“减小”).(填一种).若KNO3饱和溶℃时,KNO3溶液的溶质质量分数必定比NaCl 溶液的溶质质量分数大B. KNO3饱和溶液中必定不可以再溶解NaCl 固体C.从表中数据能够判断NaCl 和 KNO3的溶解度相等的温度在20﹣40℃之间.溶解度参照答案与试题分析一、选择题1.如图是甲、乙两种固体物质的溶解度曲线.以下说法错误的选项是()A.T℃时,甲、乙两物质的溶解度相等B.乙的饱和溶液降温时,溶质质量分数保持不变C.甲中混有少许乙,可采纳降温结晶的方法提纯甲D.T℃时,甲的饱和溶液溶质质量分数为20%【考点】固体溶解度曲线及其作用;结晶的原理、方法及其应用;溶质的质量分数、溶解性和溶解度的关系.【专题】溶液、浊液与溶解度.【剖析】依据已有的溶解度曲线的意义进行剖析解答,交点表示在该温度下二者的溶解度相等,根据物质的溶解度受温度的变化确立析出晶体的方法,依据溶质质量分数计算即可.【解答】解:A、据图能够看出,在T℃时,甲、乙两物质的溶解度相等,正确;B、乙物质的溶解度随温度的降低而增大,当乙的饱和溶液降温时,溶液的构成不变,故溶质质量分数保持不变,正确;C、甲的溶解度随温度的高升而增大显然,故甲中混有少许乙,可采纳降温结晶的方法提纯甲,正确;D、T℃时,甲的饱和溶液溶质质量分数为,错误.应选 D.【评论】本题考察的是溶解度曲线的应用,达成本题,能够依照已有的溶解度曲线的意义进行.2.t ℃时,向一支盛有熟石灰的烧杯中加入50g 水,充足振荡后静置,烧杯底部仍有未溶解的白色固体.以下有关表达正确的选项是()A.高升温度上层清液变为不饱和溶液B.t ℃时,熟石灰的溶解度为C.烧杯中溶液的质量小于D.上层清液中溶质质量分数大于0.3%【考点】固体溶解度的影响要素;固体溶解度的观点.【专题】压轴实验题;溶液、浊液与溶解度.【剖析】解决本题时用到的知识点有:①氢氧化钙的溶解度随温度高升而减低;②溶液与溶质共存说明溶液是饱和状态;③溶质的质量是溶解在溶剂中的物质的质量;④计算溶质质量分数时溶质的量应当是溶解在水中的物质的质量.【解答】解:A、氢氧化钙的溶解度随温度高升而减低,升温会使溶解在水中的氢氧化钙析出,所剩溶液仍饱和,故 A 错误.B、t ℃时,向一支盛熟石灰的烧杯中加入50g 水,充足振荡后静置,烧杯底部仍有未溶解有100g 水中溶解熟石灰的质量小于0.3g ,所以t ℃时,熟石灰的溶解度小的白色固体,所以t ℃时于0.3 g ,故 B 错误.C、 0.15g 熟石灰的烧杯内加入50g 水,烧杯管底部仍有未溶解的白色固体,说明氢氧化钙未全溶,溶质的质量应当小于0.15g ,所以烧杯中溶液的质量小于50.15 g ,故 C 正确.D、溶质的量小0.15g ,故溶质的质量分数小于0.3%,故 D 错误.于应选 C.【评论】一般状况下,固体的溶解度随温度的高升而增大,但氢氧化钙特别,它的溶解度随温度的高升而降低.3.以下说法不合理的是()A.“卤面”制作时,加入氯化钠当调味剂B.大脖子病是人体缺少铁元素惹起的C.大多数物质的溶解度随温度的高升而增大D.水受热膨胀是因为水分子间的距离变大【考点】固体溶解度的影响要素;氯化钠与粗盐提纯;利用分子与原子的性质剖析和解决问题;人体的元素构成与元素对人体健康的重要作用.【专题】物质的微观构成与物质的宏观构成;溶液、浊液与溶解度;常有的盐化学肥料;化学与生活.【剖析】 A、依据食盐有咸味剖析;B、依据碘元素与人体健康之间的关系剖析;C、依据物质的溶解性规律剖析;D、依据分子间有间隔的特征剖析.【解答】解:A、因为食盐有咸味,“卤面”制作时,加入氯化钠当调味剂.故 A 说法合理;B、大脖子病是人体缺少碘元素惹起的.故 B 说法不合理;C、大多数物质的溶解度随温度的高升而增大.故 C 说法合理;D、分子间有间隔,水受热膨胀是因为水分子间的距离变大.故D说法合理.应选 B.【评论】本题所考察的知识属于课本的基础知识,增强基础知识的学习,是解答本类题的要点.4.T℃时,将少许生石灰放入必定质量的饱和石灰水中,搅拌并冷却至原温度,获得的溶液与原溶液对比,以下物理量前后不变的是()①溶质的质量②溶剂的质量③溶液的质量④溶质的质量分数⑤溶解度.A.①③⑤B.②④⑤C.②④ D.④⑤【考点】固体溶解度的影响要素;溶质的质量分数;生石灰的性质与用途.【专题】溶液、浊液与溶解度.【剖析】依据温度不变饱和石灰水不可以再连续溶解氢氧化钙的特色,判断关于此溶液的说法中正确的选项.【解答】解:因为氧化钙与饱和溶液中的水发生反响而使水减少,饱和溶液的溶剂减少会造成溶质析出,所以溶液的溶质、溶剂都在减少,溶液的质量也减小;固体物质的溶解度只受温度的影响,因为溶液的温度不变,所以,溶质的溶解度也不变.依据同样温度下的同种溶质的饱和溶液的溶质质量分数同样,饱和溶液的溶质质量分数不变,故④⑤正确.答案: D.【评论】生石灰遇水生成的氢氧化钙因溶液已为饱和溶液,所以不可以连续溶解,溶液中溶质质量不会增大.5.以下四个图象能正确反响对应实验操作的是()A.向必定量的饱和石灰水中不停加入生石灰B.向等质量的锌、铁中滴加等质量分数的稀盐酸C.向必定的氧化铁中通入一氧化碳气体并连续高温D.向必定量的氢氧化钠和氯化钡的混淆溶液中滴加稀硫酸【考点】固体溶解度的影响要素;金属的化学性质;一氧化碳复原氧化铁;生石灰的性质与用途;酸的化学性质.【专题】元素化合物知识型.【剖析】 A、依据氧化钙能够和水反响剖析;B、依据金属与酸反响产生气体的多少剖析;C、依据一氧化碳和氧化铁反响生成铁和二氧化碳剖析;D、依据硫酸和氯化钡反响立刻产生硫酸钡剖析.【解答】解:A、生石灰和饱和石灰水中的水反响,所以会使饱和溶液中的水减少,则会析出部分溶质,所以溶质的质量会减少,故坐标错误;B、横坐标代表稀盐酸,相等质量的酸供给的氢元素质量相等,则产生的氢气相等,所以是同一条斜率;向等质量的铁和锌中加入溶质质量分数同样的稀盐酸至过度,则铁和锌所有参加反响,Fe+2HCl═ FeCl 2 +H2↑56 2Zn+2HCl═ ZnCl 2 +H2↑65 2经过反响的化学方程式以及金属与酸反响生成氢气的质量关系能够看出,铁生成的氢气大于锌,故坐标正确;C、一氧化碳和氧化铁反响生成铁和二氧化碳,固体质量会减少但不会减少为0,故坐标错误;D、硫酸应当和氯化钡立刻产生硫酸钡积淀,所以起点应当是0,故坐标错误;应选: B.【评论】本题是过程与图象联合题,是对学生识图能力的考察,解题的要点是能正确的剖析各个反响的过程,并联合图象剖析问题,对培育学生剖析问题的能力有必定帮助.6.下表是 KCl 固体在不一样温度时的溶解度.以下说法错误的选项是()温度/ ℃0 20 40 60 80溶解度 /gA. KCl 固体的溶解度随温度的高升而增大B.80℃时, KCl 固体的溶解度是C.60℃的 KCl 饱和溶液降温后会有晶体析出D.20℃时, KCl 饱和溶液的溶质质量分数为34.0%【考点】固体溶解度的影响要素;晶体和结晶的观点与现象;溶质的质量分数、溶解性和溶解度的关系.【专题】溶液、浊液与溶解度.【剖析】 A、 KCl 溶解度随温度的高升而增大;B、由表格,可查出80℃时 KCl 的溶解度;C、依据氯化钾的溶解度随温度的变化特色确立能否析出固体;D、20℃时, 100g 水最多溶解KCl34.0g , 34.0 克为此温度下的溶解度.【解答】解: A、KCl 溶解度随温度的高升而增大,正确;B、80℃时, KCl 固体的溶解度是51.1g ,正确;C、 KCl 溶解度随温度的高升而增大,故60℃的 KCl 饱和溶液降温后会有晶体析出,正确;D、20℃时, KCl 饱和溶液的溶质质量分数为≈ 25.3%,错误;应选 D.【评论】掌握溶质的质量分数、溶解性和溶解度的关系,掌握饱和溶液与不饱和溶液的互相转变的方法.7.以下说法不正确的选项是()A.物质的溶解度必定随温度的高升而增大B.蔗糖水属于溶液C.在必定条件下,饱和溶液与不饱和溶液之间能够互相变换D.翻开汽水瓶盖,汽水会自动喷出来,证明气体的溶解度和压强有关【考点】固体溶解度的影响要素;溶液的观点、构成及其特色;饱和溶液和不饱和溶液互相转变的方法;气体溶解度的影响要素.【专题】溶液、浊液与溶解度.【剖析】依据已有的溶解度的影响要素以及饱和溶液和不饱和溶液之间的转变随和体溶解度的影响要素进行剖析解答即可.【解答】解:A、物质的溶解度不必定随温度的高升而增大,比方氢氧化钙的溶解度随温度的高升而减小,错误;B、蔗糖水属于溶液,正确;C、在必定条件下,饱和溶液与不饱和溶液之间能够互相变换,正确;D、翻开汽水瓶盖,汽水会自动喷出来,是因为压强变小,气体的溶解度变小,证明气体的溶解度和压强有关,正确;应选 A.【评论】本题考察的是溶液的知识,达成本题,能够依照已有的知识进行.8.小张同学用某固体物质进行以下图的实验,依据实验判断以下说法不正确的选项是()A.该固体物质的溶解度随温度的高升而增大B.溶液 b 必定是不饱和溶液C.溶液 d 中溶质质量必定大于溶液 e 中的溶质质量D.溶液 d 和溶液 e 的溶质质量分数可能同样【考点】固体溶解度的影响要素;饱和溶液和不饱和溶液;溶质的质量分数.【专题】溶液、浊液与溶解度.【剖析】依据溶液的转变以及溶液中溶质的质量变化对溶质质量分数的改变的影响进行剖析解答即可.【解答】解:A、从溶液 c 和溶液 d 能够看出,降低温度则溶液中会析出晶体,说明该物质的溶解度随温度的高升而增大,正确;B、溶液 b 中加入20g 固体获得的溶液 c 中没有未溶解的固体,说明加入的物质所有溶解,故溶液b必定是不饱和溶液,正确;C、溶液 d 变为溶液 e 的过程中没有发生化学变化,说明溶液 d 中的固体除掉,可能是高升温度使固体溶解,则溶液 d 中溶质质量可能大于溶液 e 中的溶质质量,错误;D、假如溶液 d 中的固体是经过过滤除掉,则溶液 d 和溶液 e 的溶质质量分数可能同样,正确;应选 C.【评论】本题考察的是溶解度的变化特色以及溶液的转变和溶质质量分数的知识,达成本题,能够依照已有的知识进行.9.下表列出了硝酸钾在不一样温度时的溶解度.温度/ ℃10 20 30 40溶解度 /g某兴趣小组做了如图实验:以下说法中正确的选项是()A.①②③中溶液都为不饱和溶液B.②③中都含有末溶解的固体C.①②③中溶液的质量相等D.③中溶质质量分数最大【考点】固体溶解度的影响要素;饱和溶液和不饱和溶液;溶质的质量分数.【专题】溶液、浊液与溶解度.【剖析】依据溶液中溶质溶剂的判断方法剖析,依据饱和溶液与不饱和溶液的特色判断.【解答】解: 20℃时硝酸钾的溶解度为31.6g ,将 30g 硝酸钾溶于100g 水中获得的溶液①为不饱和溶液,再加入5g 时获得的溶液②为饱和溶液且有硝酸钾节余30g+5g﹣ 31.6g=3.4g ,将②溶液升温到 30℃,因30℃时硝酸钾的溶解度为45.8g ,所以获得的溶液③为不饱和溶液.A、①、③中溶液为不饱和溶液,②为饱和溶液,故 A 错误;B、②中含有末溶解的固体,而③中不含有末溶解的固体,故 B 错误;C、①②③中溶质的质量不相等,所以溶液的质量也不相等,故C错误;D、③中溶质质量最大,所以溶质质量分数最大,故 D 正确.应选: D.【评论】本题考察溶剂的判断及饱和溶液不饱和溶液的转变,析出晶体及溶质质量分数的计算,需仔细剖析图示中溶剂溶质的质量与溶解度的关系.10.在化学知识中有很多规律,以下详细物质的性质切合对应规律的是()A.某些非金属氧化物能和碱反响生成盐和水;比如:二氧化碳和三氧化硫B.一般固体物质的溶解度随温度的高升而增大;比如:氢氧化钙和氯化钠C.常温下金属一般为固态;比如:汞和金D.某些非金属单质能够将金属从其氧化物中复原出来;比如:氢气和一氧化碳【考点】固体溶解度的影响要素;一氧化碳的化学性质;金属的物理性质及用途;氢气的化学性质与焚烧实验.【专题】溶液、浊液与溶解度;氧气、氢气的性质与用途;金属与金属资料;常有的碱碱的通性.【剖析】 A、依据碱的化学性质进行剖析判断;B、依据常有物质的溶解度受温度的影响的变化趋向进行剖析判断;C、依据金属的物理性质进行剖析判断;D、依据氢气和一氧化碳的化学性质进行剖析判断.【解答】解:A、某些非金属氧化物能和碱反响生成盐和水,如:二氧化碳和三氧化硫等,故 A 正确;B、一般固体物质的溶解度随温度的高升而增大,但氢氧化钙的溶解度随温度的高升而减小,氯化钠的溶解度受温度影响变化不大,故 B 错误;C、常温下金属一般为固态,如金等,汞在常温下为液态,故C错误;D、某些非金属单质能够将金属从其氧化物中复原出来,这些非金属单质拥有复原性,如:氢气,一氧化碳也拥有复原性,但属于化合物,故应选: A.D 错误.【评论】本题难度不大,掌握碱的化学性质、常有物质的溶解度受温度的影响的变化趋向、金属的物理性质等是正确解答本题的要点.11.如表是 NaCl、 KNO在不一样温度时的溶解度3温度/ ℃10 20 30 40 50 60溶解度 /g NaClKNO 1103据此数据,以下有关说法中错误的选项是()A.在 40℃时, 100g 水中最多可溶解 KNO3B. KNO3和 NaCl 的溶解度曲线在 20℃~ 40℃温度范围内订交C.在 60℃时, KNO3饱和溶液 210g 加入 10g 水后,溶质质量分数为50%D.在20℃时KNO3和NaCl 的混淆溶液100g ,恒温蒸发,先析出的晶体必定是NaCl。
2024年中考化学专题强化训练溶解度曲线
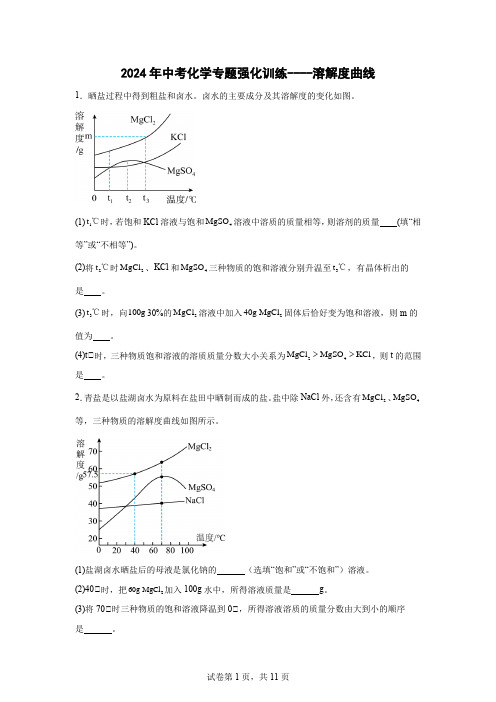
2024年中考化学专题强化训练----溶解度曲线1.晒盐过程中得到粗盐和卤水。
卤水的主要成分及其溶解度的变化如图。
(1)1t ℃时,若饱和KCl 溶液与饱和4MgSO 溶液中溶质的质量相等,则溶剂的质量 (填“相等”或“不相等”)。
(2)将2t ℃时2MgCl 、KCl 和4MgSO 三种物质的饱和溶液分别升温至3t ℃,有晶体析出的是 。
(3)3t ℃时,向100g 30%的2MgCl 溶液中加入240g MgCl 固体后恰好变为饱和溶液,则m 的值为 。
(4)t℃时,三种物质饱和溶液的溶质质量分数大小关系为24MgCl MgSO KCl >>,则t 的范围是 。
2.青盐是以盐湖卤水为原料在盐田中晒制而成的盐。
盐中除NaCl 外,还含有2MgCl 、4MgSO 等,三种物质的溶解度曲线如图所示。
(1)盐湖卤水晒盐后的母液是氯化钠的 (选填“饱和”或“不饱和”)溶液。
(2)40℃时,把260g MgCl 加入100g 水中,所得溶液质量是 g 。
(3)将70℃时三种物质的饱和溶液降温到0℃,所得溶液溶质的质量分数由大到小的顺序是 。
(4)氯化钠中含有少量硫酸镁,若要提纯氯化钠,可采用的方法是。
3.某同学进行了如图1所示实验,结合硝酸钾和氯化钠的溶解度曲线回答下列问题。
(1)20℃时,氯化钠的溶解度是g;(2)若氯化钠中混有少量硝酸钾,可采用的方法提纯氯化钠;(3)图1中烧杯℃为硝酸钾的(填“饱和”或“不饱和”)溶液;若通过升高温度使℃中固体继续溶解,则其溶液中溶质的质量分数(填“增大”“减小”或“不变”)。
4.如图是A、B、C三种固体物质的溶解度曲线,据图作答:(1)P点的意义是。
(2)A、B、C三种物质中,溶解度随着温度上升而减小的物质是。
(3)t2℃时,将30g A物质加入50g水中可形成g溶液。
5.如图是某苏打气泡水的标签。
(1)该气泡水中溶剂的化学式是。
C H O。
从赤藓糖醇的化学式中能获得与其有关的(2)赤藓糖醇是一种甜味剂,其化学式为4104信息是(任写一条)。
初三化学中考专题(5)溶解度曲线练习及答案

初三化学中考专题(5)溶解度曲线练习及答案1.a、b两种物质的溶解度曲线如图所示。
下列说法不正确的是A.将t1℃时b的饱和溶液加水可变为不饱和溶液B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变C.t2℃时,两种物质的饱和溶液中溶质质量分数a>bD.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等2.下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t1℃时,丙的饱和溶液中溶质的质量分数为40%3.下图是甲、乙、丙三种固体物质的溶解度曲线,将甲、乙、丙三种物质t2℃时的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系正确的是A.甲>乙>丙B.甲=乙=丙C.甲=乙>丙D.丙>甲=乙4.(多选)甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是A.t1℃时,甲物质的溶解度为20gB.t1℃时,30g甲加入到50g水中最多可得70g溶液C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液D.t2℃时,甲乙两物质的饱和溶液分别降温到t1℃时,所得溶液溶质质量分数的大小关系是:甲<乙5.(多选)甲、乙两种固体物质的溶解度曲线如图所示。
20℃时,进行了如下图所示的实验,下列叙述正确的是A.甲的溶解度大于乙的溶解度B.实验过程中,属于不饱和溶液的是A溶液和C溶液C.实验过程中,只有B溶液和D溶液属于饱和溶液D.实验过程中,B溶液与E溶液中溶质的质量分数相同6.(多选)甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少C.分别将t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数的大小关系是乙>甲>丙D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多丙溶液中无晶体析出7.甲、乙、丙三种物质的溶解度曲线如下图所示。
2020中考化学 溶液溶解度和溶解度曲线 培优专题练习(含答案)

2020中考化学溶液溶解度及溶解度曲线培优专题练习(含答案)专题训练一一、选择题(本题包括6小题,每小题2分,共12分)1.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是()A. 碘B. 汽油C. 白糖D. 碳酸钙2.溶液在生活、生产中有广泛的应用。
下列有关溶液的叙述正确的是()A. 均一稳定的液体一定是溶液B. 洗涤剂去油污是乳化现象C. 豆浆、牛奶都是溶液D. 溶液都是无色的3.化学实验常需要配制溶液。
下列说法正确的是()A. 配制溶液时,只能用水作溶剂B. 配制硝酸铵溶液的过程中,溶液的温度会下降C. 用浓硫酸配制稀硫酸时,应将水缓缓注入浓硫酸中D. 将10 g 氯化钠溶于100 g水中,得到质量分数为10%的氯化钠溶液第4题图4.如图是甲、乙的溶解度曲线。
下列说法不正确...的是()A. t1℃时,乙的溶解度大于甲的溶解度B. t2℃时,甲、乙饱和溶液中溶质的质量分数相等C. 降低温度能使接近饱和的甲溶液变为饱和溶液D. t3℃时,75 g甲的饱和溶液中加入50 g水,可以得到质量分数为25%的溶液5.高氯酸钾(KClO()温度/℃20406080溶解度/g 1.68 3.737.313.4A.B. 20 ℃时,将2 g高氯酸钾溶于98 g水可配制2%的溶液C. 60 ℃时,高氯酸钾饱和溶液中溶质的质量分数是7.3%D. 80 ℃的高氯酸钾饱和溶液冷却至40 ℃有结晶现象6.如图为三种物质的溶解度曲线。
下列说法错误..的是()第6题图A. 约在64 ℃时KCl和Na2SO4的溶解度相等B. 在室温至100 ℃区间,随温度升高Na2SO4的溶解度先增大后减小,醋酸钙则相反C. 分离含少量KCl的Na2SO4溶液,采用先蒸发浓缩,再降温结晶的方法D. 在40 ℃时40 g KCl固体溶于60 g水得到40%KCl溶液二、填空及简答题(本题包括4小题,共21分)7.(2分)为了研究物质的溶解现象,设计并进行了如下实验。
中考化学《溶解度及溶解度曲线》专项练习题(附答案解析)

中考化学《溶解度及溶解度曲线》专项练习题(附答案解析)1. 甲、乙、丙三种固体物质的溶解度曲线如右图所示。
下列说法不正确的是()A. T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙B. T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲D. T2℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液2. 下图是甲、乙两种固体物质的溶解度曲线。
下列说法中错误的是( )A. 20℃时,甲、乙饱和溶液中溶质质量分数相等B. 40℃时,甲的溶解度大于乙的溶解度C. 40℃时,乙的饱和溶液中溶质的质量分数为40%D. 将40℃甲的饱和溶液降温到20℃,会有晶体析出3. KNO3与KCl的溶解度曲线如右图所示。
下列说法正确的是( )A. KNO3的溶解度比KCl的溶解度大B. t1温度下的KCl的饱和溶液升温至t2,有晶体析出C. A点所表示的KCl饱和溶液溶质的质量分数为29%D. 冷却热的KNO3饱和溶液可获得KNO3晶体4. ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。
下列说法正确的是( )A. N点对应的ZnSO4溶液升温或降温均都可能析出晶体B. M点对应的ZnSO4溶液是不饱和溶液C. ZnSO4饱和溶液的溶质质量分数随温度升高而增大D. 40℃时,ZnSO4的溶解度为41g5. 下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )A. 甲的溶解度大于乙的溶解度B. 降温可使接近饱和的丙溶液变为饱和溶液C. 将t2°C甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数℃乙>甲=丙D. P点表示t1℃时甲、丙两种物质的溶解度都是25g6. 下图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )A. 乙中含有少量甲,可用冷却热饱和溶液的方法提纯甲B. t3℃时,甲的溶液溶质质量分数一定大于乙的溶液溶质质量分数C. t3℃时,将等质量的甲、乙两种物质的饱和溶液分别降温至t2℃,析出晶体的质量甲一定大于乙D. t1℃时,乙的不饱和溶液只有通过蒸发溶剂的方法才能转变成饱和溶液7.甲、乙、丙三种固体物质的溶解度曲线如图所示。
中考化学经典题型专题练习之溶解性、溶解度和溶解度曲线
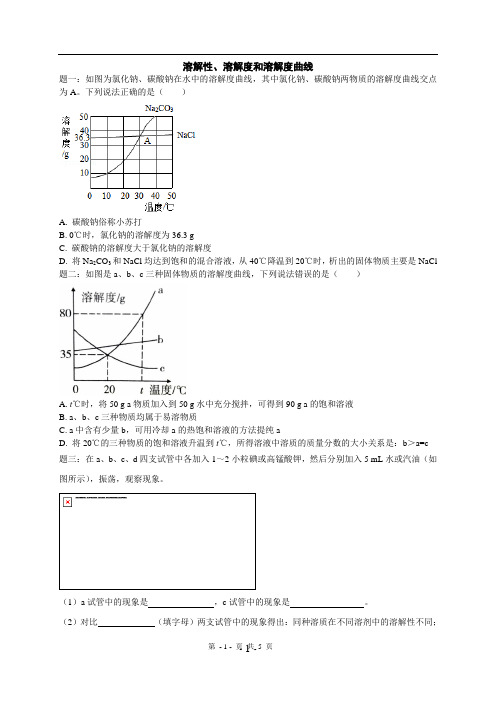
溶解性、溶解度和溶解度曲线题一:如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A。
下列说法正确的是()A. 碳酸钠俗称小苏打B. 0℃时,氯化钠的溶解度为36.3 gC. 碳酸钠的溶解度大于氯化钠的溶解度D. 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl 题二:如图是a、b、c三种固体物质的溶解度曲线,下列说法错误的是()A. t℃时,将50 g a物质加入到50 g水中充分搅拌,可得到90 g a的饱和溶液B. a、b、c三种物质均属于易溶物质C. a中含有少量b,可用冷却a的热饱和溶液的方法提纯aD. 将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a=c题三:在a、b、c、d四支试管中各加入1~2小粒碘或高锰酸钾,然后分别加入5 mL水或汽油(如图所示),振荡,观察现象。
(1)a试管中的现象是,c试管中的现象是。
(2)对比(填字母)两支试管中的现象得出:同种溶质在不同溶剂中的溶解性不同;对比a、c试管中的现象得出的结论是;(3)【提出问题】物质的溶解性除与溶质、溶剂的性质有关外,还与什么有关?【作出猜想】。
【设计方案】。
【观察现象】。
【得出结论】。
题四:小明陪妈妈到医院输液,不小心将护士手中的盘子打翻,其中的棉球落在了小明的白色衬衣上,白色衬衣上立即出现了一大片紫黑色痕迹。
为找到去掉白衬衣上的痕迹的最好方法,几位同学进行了讨论,提出了以下几个方案并进行实验:①用水洗;②用无水酒精洗;③用汽油洗;④用四氯化碳洗;⑤用肥皂水洗;⑥用淀粉溶液洗。
(1)你认为留在白色衬衣上的紫黑色物质是什么?(2)如果用白色布条进行实验,为使实验结果更加准确,你认为该实验中需要控制哪些实验条件?(3)一位同学按如图所示方法进行实验:结果是⑤、⑥几乎完全褪色;②略带颜色;③、④略微变浅;①几乎不变。
中考化学总复习《物质的溶解度》专项测试卷(带有答案)

中考化学总复习《物质的溶解度》专项测试卷(带有答案)学校:___________班级:___________姓名:___________考号:___________一、选择题1.如图为甲、乙两固体(不含结晶水)的溶解度曲线,下列说法正确的是A.甲的溶解度一定大于乙B.T1℃时的甲乙饱和溶液的溶质质量分数相等C.T2℃时,将60g甲放入100g水中,可以得到160g甲溶液D.降低温度可以使不饱和的乙溶液变成饱和2.小明在家中用蔗糖和其他常见物品进行了以下家庭小实验,下列叙述正确的是温度/℃01020406080100蔗糖的溶解度/g181191204238287362497A.甲中得到的是蔗糖饱和溶液B.0℃时,可配得70%的蔗糖溶液C.蔗糖在水中无法解离出离子D.丙中的蔗糖溶液下层比上层甜3.将5g固体M分别投入到盛有不同温度下10g水的烧杯中,充分溶解后,均有固体剩余,数据如表。
下列说法正确的是A.M的溶解度随着温度的升高而增大B.20℃时,M的溶解度为20gC.烧杯I中,溶质的质量分数为20%D.将I、℃两个烧杯中的溶液,分别升温至40℃,此过程中,析出的固体质量相等4.提纯含少量NaC1杂质的KNO3部分实验过程如下。
相关物质的溶解度曲线如图所示。
下列说法正确的是A.℃→℃,KNO3的溶解度不变B.℃→℃,溶液中KNO3的质量分数不变C.℃→℃,溶液中NaCl的质量分数不变D.℃→℃,溶液中KNO3的质量减小5.常温下,向一定量的饱和石灰水中加入少量生石灰粉末,如图是溶液中溶质质量随时间变化的曲线,下列分析正确的是A.ab段溶液始终处于饱和状态B.生石灰溶解导致bc段溶质增加C.c点时未溶解固体为加入的生石灰D.d点溶质质量分数小于a点溶质质量分数6.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是A.t1℃时,可以制得溶质质量分数为12%的甲溶液B.将丙的饱和溶液变为不饱和溶液,可采用降温的方法C.t2℃时,甲、乙两种物质的饱和溶液降温至t1℃,析出甲的质量比析出乙的质量大D.0℃时,甲、乙、丙三种物质的饱和溶液升高到t1℃时,溶质质量分数为乙>甲=丙KNO的溶解度曲线,下列说法正确的是7.如图,是3A.饱和硝酸钾溶液从b点降温到a点,有晶体析出B.60C时,b、c点对应的都是饱和溶液C.将a点的饱和溶液从20C升温到60C时,仍是饱和溶液60gKNO,得到不饱和溶液D.60C时,向50g水中加入38.室温下将一铜块悬挂在盛有含少量硝酸钾固体的饱和溶液的烧杯中(如图所示),另一端与弹簧秤相连(铜块不参与反应),向烧杯中加入少量氢氧化钠固体,恢复室温后,下列说法不正确的是A.弹簧秤的示数减小B.烧杯内溶液中溶质的质量增大C.烧杯内硝酸钾固体的质量不变D.烧杯内溶液中硝酸钾的质量分数不变9.如图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是A.甲中含有少量乙,可通过蒸发溶剂的方法提纯甲B.t2℃时,甲、乙两物质的饱和溶液降到0℃,所得溶液的溶质质量分数甲大于乙C.t1℃时,甲、乙两物质的饱和溶液升到t2℃,所得溶液中溶质的质量相等D.t2℃时,甲的饱和溶液的溶质质量分数一定大于乙溶液的溶质质量分数10.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。
中考化学考点专训:溶解度及溶解度曲线

1. X 、Y 、Z三种物质的溶解度曲线如图所示。
将t2℃时三种物质的饱和溶液降温至t1℃,溶液中溶质质量分数大小关系正确的是 ( )A.X>Y>ZB.Y>Z>XC.Z>Y>XD.X=Y>Z【答案】B2.我国古代劳动人民常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白丝帛。
清液的主要成分及溶解度如图所示。
(1)t1℃时3种物质的饱和溶液中溶质质量分数由小到大的顺序是。
(2)20 ℃时,向4个盛有50 g水的烧杯中,分别加入一定质量的氢氧化钾并充分溶解。
4组实验数据如下:由上述实验数据可知:①所得溶液是不饱和溶液的是(填序号);②20℃时,将C继续恒温蒸发25 g水,过滤,得到质量为 g的固体。
【答案】(1)Ca(OH)2 KOH K2CO3 (2) ①AB ② 283.下表是Ca(OH)2 和NaOH的溶解度数据。
请回答下列问题:温度/℃0 20 40 60 80 100溶解度/gCa(OH)2 0.19 0.17 0.14 0.12 0.09 0.08NaOH 31 91 111 129 313 336(1)依据上表数据,绘制Ca(OH)2 和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是(填“A”或“B”)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可采取措施有(填序号)。
①蒸发水②升高温度③降低温度④加入水⑤加入氢氧化钙实验序号 A B C D加入氢氧化钾的质量/g7 14 56 70溶液质量/g 57 64 106 106(3)现有60 ℃时含有Ca(OH)2 和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是。
(4)现有20 ℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后恢复20 ℃,得到乙溶液,溶液中溶质的质量分数的关系为甲乙(填“>”、“<”或“=”)。
2023中考化学专题训练:溶解度曲线及其应用

甲 > (选填“>”“=”或“<”)丙。
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
(3)t2 ℃时分别把15 g甲、乙、丙固体加入50 g水中,能形成饱和溶液的
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
2.(2022•四川内江)我国航天员王亚平在太空演示“冰雪”实验时用到 了过饱和醋酸钠溶液。下图是醋酸钠的溶解度曲线图,下列说法正确的 是( B ) A.常温下,醋酸钠属于微溶物质 B.图中P点所表示的醋酸钠溶液是 不饱和的 C.40 ℃时,饱和醋酸钠溶液的溶质 质量分数是65.6% D.将A点的饱和溶液降温至20 ℃, 溶质质量分数增大
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
12.(2022•四川达州)t1 ℃时,将相同质量的KNO3和KCl分别加入盛有100 g
水的甲、乙烧杯中,充分搅拌后现象如图Ⅰ所示,图Ⅱ为两物质的溶解度曲D 线。以下说法正确的是D ( ) A.甲烧杯中的溶质为KNO3 B.将温度升高到t2 ℃时,乙烧杯中 仍然有固体剩余
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
4.(2022•江苏宿迁)“侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是 NaCl+NH4HCO3 NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线图,下列
初三化学中考专题溶解度曲线练习及答案

专题五溶解度曲线1.a、b两种物质的溶解度曲线如图所示。
下列说法不正确的是A.将t1℃时b的饱和溶液加水可变为不饱和溶液B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变C.t2℃时,两种物质的饱和溶液中溶质质量分数a>bD.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等2.下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t1℃时,丙的饱和溶液中溶质的质量分数为40%3.下图是甲、乙、丙三种固体物质的溶解度曲线,将甲、乙、丙三种物质t2℃时的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系正确的是A.甲>乙>丙B.甲=乙=丙C.甲=乙>丙D.丙>甲=乙4.(多选)甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是A.t1℃时,甲物质的溶解度为20gB.t1℃时,30g甲加入到50g水中最多可得70g溶液C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液D.t2℃时,甲乙两物质的饱和溶液分别降温到t1℃时,所得溶液溶质质量分数的大小关系是:甲<乙5.(多选)甲、乙两种固体物质的溶解度曲线如图所示。
20℃时,进行了如下图所示的实验,下列叙述正确的是A.甲的溶解度大于乙的溶解度B.实验过程中,属于不饱和溶液的是A溶液和C溶液C.实验过程中,只有B溶液和D溶液属于饱和溶液D.实验过程中,B溶液与E溶液中溶质的质量分数相同6.(多选)甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少C.分别将t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数的大小关系是乙>甲>丙D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多丙溶液中无晶体析出7.甲、乙、丙三种物质的溶解度曲线如下图所示。
2020中考化学真题分类汇编 专题分类 溶解度与溶解度曲线(含解析)

专题分类:溶解度与溶解度曲线1.(2019深圳)甲、乙两种物质(不含结晶水)的溶解度曲线如下图所示,下列叙述正确的是()A.甲和乙的溶解度相等且均为30gB.甲物质的溶解度随温度的升高而减小C.t1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7D.将t2℃150g甲的饱和溶液降温到t1℃,有20g固体析出答案:D解析:固体物质溶解度一定要注意其四要素,A没有指定温度,故错误;甲的曲线随温度的升高而增大,故B错;t1℃时,乙的溶解度为30g,即100g水中最多可溶解30g乙物质即达到饱和状态,此时溶液中溶质与溶剂的质量比为30:130 = 3:13,故C错;t2℃时,甲的溶解度为50g,故150g甲的饱和溶液中含有50g溶质甲,其降温到t1℃,此时甲的溶解度降到30g,故有20g固体甲析出,故D正确。
2.(2019恩施)A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是()A.t1℃时,三种物质的溶解度由大到小的顺序是A>B>CB.t2℃时,A和C的溶解度相等C.将B的饱和溶液变为不饱和溶液可采用升高温度的方法D.A、B、C三种物质的溶解度都随温度的升高而增大解析:A、t1℃时,三种物质的溶解度由大到小的顺序是B>C>A,A>B>C错误;故选项错误;B、t2℃时,A和C的溶解度相等正确,因为该温度下它们有交点;故选项正确;C、将B的饱和溶液变为不饱和溶液可采用升高温度的方法错误,因为B的溶解度随温度的升高而减少;故选项错误;D、A、B、C三种物质的溶解度都随温度的升高而增大错误,因为B的溶解度随温度的升高而减少;故选项错误;故选:B。
3.(2019宜昌)甲乙丙三种物质均不含结晶水,溶解度曲线如下图所示,下列分析错误的是A. 甲中含有杂质乙,可采用加水溶解、蒸发浓缩、冷却结晶、过滤的方法提纯甲B. 将A点降温到t1℃甲、乙、丙均变为不饱和溶液C. t2℃时,甲、乙、丙饱和溶液中,丙质量分数最大D. 将甲中A点变成B点可采用恒温蒸发溶剂的方法【答案】B【解析】A. 对于溶解度受温度影响较大的物质,从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂,因为甲的溶解度受温度影响较大,可用降温结晶法,所以甲中含有杂质乙,可采用加水溶解、蒸发浓缩、冷却结晶、过滤的方法提纯甲,正确;B. 将A点降温到t1℃时,甲、乙的溶解度变小,有晶体析出,丙溶解度增大,变为不饱和溶液,错误;C. t2℃时,甲、乙、丙的溶解度大小关系是:丙>甲=乙,所以饱和溶液中,丙质量分数最大,正确;D. A点是不饱和溶液,B 点是饱和溶液,将甲的不饱和溶液变成饱和溶液,可采用恒温蒸发溶剂的方法,正确。
中考九年级化学复习专题5 溶解度及溶解度曲线

温度/℃
20 30 50 60 80
溶解度/g K2CO3 110 114 121 126 139 KNO3 31.6 45.8 85.5 110 169
考查点2 溶解度随温度的变化趋势与结晶现象的判断(2019.10AC,2016.10AD) (3)KNO3的溶解度随温度的升高而_增__大__(填“增大”或“减小”)。 (4)将60 ℃的K2CO3饱和溶液降温至30 ℃,__有__(填“有”或“无”)晶体 析出。
C. 将t3 ℃时甲、乙、丙的混合溶液降温至t1 ℃,析 出的固体中可能只有乙
D. 将t1 ℃时乙、丙的饱和溶液升温至t2 ℃,两种溶 液中溶质的质量分数可能相等
7. (2021郴州改编)T ℃时,等质量的甲、乙、丙三种固体分别加入等质 量的水中,加入固体的质量与溶液溶质质量分数的关系如图所示,请回 答下列问题:
(3)t3℃时甲、乙、丙三种物质的溶解度由大到小的顺序是_甲__=__乙__>_丙__。 【易错警示】比较固体物质的溶解度大小时,必须指明温度。 (4)甲、乙物质的溶解度均随温度的升高而_增__大__(填“增大”或“减小”), 其中_甲___物质的溶解度受温度的影响变化较大。
考查点2 饱和溶液与不饱和溶液的判断及转化(2020.11B,2012.10D) (5)P点表示t2℃丙的_不__饱__和__(填“饱和”或“不饱和”,下同)溶液,C点 表示t2℃丙的___饱__和溶液。 (6)将t2 ℃时甲、丙的饱和溶液分别降温至t1 ℃,甲变为_饱__和_溶液,丙变 为_不__饱__和_溶液。
水的质量/g
100 100 100 100
溶液
①②③④
固体种类
KNO3 KNO3 NH4Cl NH4Cl
加入固体的质量/g 30 50 30 50
中考化学专项练习溶解度(含解析)

中考化学专项练习溶解度(含解析)【一】单项选择题1.在t℃时,A%的硝酸钾饱和溶液,冷却使其析出晶体,过滤后,将剩下的溶液再回升到t℃时〔假定水量不变〕,剩下的溶液是〔〕A.不饱和溶液,浓度小于A%B.饱和溶液,浓度小于A%C.不饱和溶液,浓度等于A%D.饱和溶液,浓度大于A%2.60℃时,100g水溶解20.94g氢氧化钡恰好饱和,那么氢氧化钡属于〔〕A.易溶物质 B.可溶物质 C.微溶物质 D.无法确定3.如图是a、b两种固体物质的溶解度曲线,以下说法中正确的选项是〔〕A.a、b两种物质都属于微溶性物质 B.分别降温t 2℃时a、b的饱和溶液到t1℃时,析出的a比b多C.t2℃时,恒温蒸发a、b饱和溶液中等质量的水,析出a比b多 D.当a中含有少量b时,可以用降温结晶法提纯b4.如图是甲、乙两种物质的溶解度曲线,以下说法错误的选项是〔〕A.t1℃时,甲、乙两种物质的溶解度相等B.甲物质的溶解度随温度的升高而增大C.将t2℃时甲、乙两种物质的饱和溶液降温到t1℃,溶液仍然饱和D.t1℃时,将50g甲物质加入100g水中,充分搅拌,能得到甲物质的饱和溶液5.以下变化中,溶液中原溶质的溶解度和溶质分量分数都发生变化的是〔〕A.常温下密闭容器中硝酸钾稀溶液升温10°C B.氯化铁溶液中加入少量生石灰C.硫酸锌溶液中加入少量铜粉D.稀释硫酸钠溶液6.甲、乙两种物质的溶解度曲线如下图。
以下表达正确的选项是〔〕A.t1℃时,甲和乙饱和溶液中溶质的质量分数相同 B.依据溶解度曲线可判断,甲的溶解度比乙的大C.将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大 D.将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法7.以下措施中:①加热,②振荡,③搅拌,④将溶质的大颗粒粉碎.可以加快固体在水中的溶解速率的是〔〕A.①②B.②③C.①②③D.②③④【二】多项选择题8.如下图为硝酸钾和氯化钠两种物质的饱和溶液的质量分数随温度变化的曲线,M、N分别是50℃时硝酸钾和氯化钠质量分数随温度变化曲线上的点.分析曲线得到的以下结论中,正确的选项是〔〕A.50℃时,其他条件不变,降温至40℃,N点向左平移,氯化钠的溶解度降低B.50℃时,向两饱和溶液添加溶质,M和N点竖直向上移动,硝酸钾和氯化钠的溶解度不变C.50℃时,M、N之间任一点表示的溶液一定是硝酸钾和氯化钠的饱和溶液D.50℃时,其他条件不变,升温至60℃,M点向右平移,硝酸钾的溶解度增大9.在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象图1所示,甲、丙还有剩余固体,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化.以下说法正确的选项是〔〕A.室温时,乙溶液可能是不饱和溶液B.图2中能表示甲物质的溶解度曲线的是cC.t1℃时,甲、乙、丙三种物质的等质量的饱和溶液中水的质量由大到小的顺序是a=b>cD.t2℃时,a的饱和溶液中含有少量b,要得到较纯净的a晶体,可采用降温结晶、过滤等操作【三】填空题10.目前市场上销售的汽水饮料大多数是碳酸饮料,其中溶有二氧化碳气体.打开汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与________有关.喝了汽水后,常常会打嗝,这说明气体的溶解度还与_ _______有关.由此可见,有利于气体溶解的条件是________温________压.11.以下图是A、B、C三种物质的溶解度曲线,回答以下问题:〔1〕________℃时,A、C的溶解度相等.〔2〕如果A物质中混有少量B物质,可用________ 的方法得到较纯的A 物质。
中考化学溶解度曲线习题汇总含答案
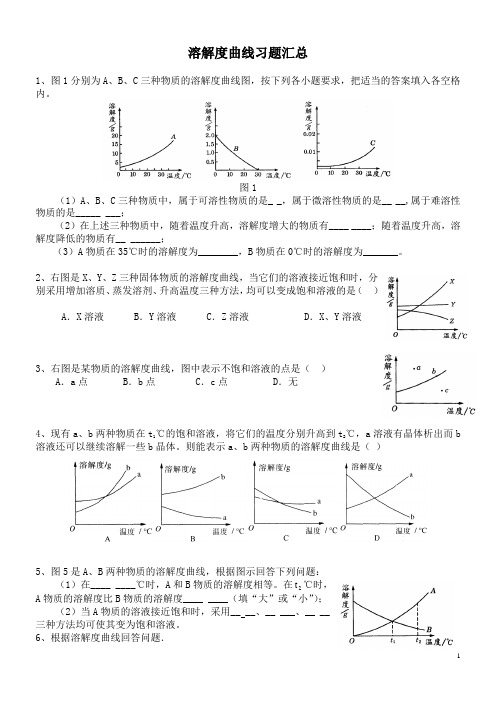
溶解度曲线习题汇总1、图1分别为A、B、C三种物质的溶解度曲线图,按下列各小题要求,把适当的答案填入各空格内。
图1(1)A、B、C三种物质中,属于可溶性物质的是_ _,属于微溶性物质的是__ __,属于难溶性物质的是_____ ___;(2)在上述三种物质中,随着温度升高,溶解度增大的物质有____ ____;随着温度升高,溶解度降低的物质有__ ______;(3)A物质在35℃时的溶解度为________,B物质在0℃时的溶解度为_______。
2、右图是X、Y、Z三种固体物质的溶解度曲线,当它们的溶液接近饱和时,分别采用增加溶质、蒸发溶剂、升高温度三种方法,均可以变成饱和溶液的是()A.X溶液B.Y溶液C.Z溶液 D.X、Y溶液3、右图是某物质的溶解度曲线,图中表示不饱和溶液的点是()A.a点 B.b点C.c点 D.无4、现有a、b两种物质在t1℃的饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体。
则能表示a、b两种物质的溶解度曲线是()5、图5是A、B两种物质的溶解度曲线,根据图示回答下列问题:(1)在____ ____℃时,A和B物质的溶解度相等。
在2t℃时,A物质的溶解度比B物质的溶解度____ ____(填“大”或“小”);(2)当A物质的溶液接近饱和时,采用__ __、__ ___、__ __三种方法均可使其变为饱和溶液。
6、根据溶解度曲线回答问题.(1)溶解度随温度升高而增大的物质是____ ____.(2)t2℃时,溶解度相等的是__ _____.(3)t2℃时,100 g水中加入20 g a物质,溶液不饱和,为使其饱和,可再加入a物质________g,或使其温度降到__ _____℃.7、右图是 a、b、c三种物质的溶解度曲线,据图回答:(1)当温度是℃,a、b两种物质的溶解度相等;℃时三种物质的溶解度由大到小的顺序是(2)t38、甲乙两种固体的溶解度曲线如右图所示。
微专题09 溶解度及溶解度曲线-备战2023年中考化学热点微专题专项突破训练(全国通用)(解析版)

微专题09溶解度及溶解度曲线1.(2022·贵州黔西·中考真题)如图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。
(1)t 3℃时,甲、乙、丙三物质溶解度由小到大的顺序是_____。
(2)t 2℃时,甲和丙两饱和溶液的溶质质量分数关系是_____。
(3)P 点对应混合物,甲、乙、丙中处于不饱和状态的是_____。
【答案】(1)丙<甲<乙(2)甲=丙(3)乙【解析】(1)如图所示,t 3℃时,甲、乙、丙三物质溶解度点在上的是乙表示乙的溶解度最大,其次是甲,最下面的是丙,表示丙的溶解度最小,因此三者溶解度小到大的顺序是:丙<甲<乙;(2)如图所示,t 2℃时,甲和丙的溶解度曲线交于一点,说明此温度下甲和丙的溶解度相等,则根据t 2℃时,甲和丙两饱和溶液的溶质质量分数可以用公式100%100g⨯+溶解度溶解度:计算,因此t 2℃时,甲和丙两饱和溶液的溶质质量分数关系是:甲=丙;(3)如图所示,P 点对应的甲和丙溶解度点都在P 点以下,说明此时甲和丙都处于饱和状态,而P 点在所对应的乙的溶解度点以下,说明此温度下乙是不饱和状态,故填:乙。
2.(2022·湖北襄阳·统考中考真题)如图为甲、乙、丙三种固体物质的溶解度曲线,据图回答问题。
突破一、溶解度曲线(1)t 1℃时,甲、丙两种物质的溶解度大小关系是甲______丙(填“>”“<”或“=”)。
(2)溶解度随温度的升高而减小的物质是______。
(3)t 2℃时,将甲、乙两种物质的饱和溶液降温至t 1℃,对所得溶液的叙述正确的是(填序号)。
A.甲溶液仍是饱和溶液,乙溶液变为不饱和溶液B.溶液中溶剂的质量甲<乙C.溶液中溶质的质量分数甲<乙【答案】(1)=(2)丙(3)C【解析】(1)由溶解度曲线可知,1t ℃时甲、丙两条曲线相交于一点,即1t ℃时,甲、丙两种物质的溶解度大小关系是甲=丙。
2021年中考化学真题分类:溶解度及溶解度曲线

操作
溶质质量
溶液质量
溶质的质量分数
硝酸钾的溶解度
A
从60℃升温至80℃
变大
变大
不变
变大
B
从60℃降温至40℃
变小
变小
不变
变小
C
恒温蒸发部分水
变小
变小
不变
不变
D
保持温度不变,再加入20g硝酸钾固体
不变
变大
变大
变大
【答案】C
13.(2021·潍坊)如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是()
C.将b点的硼酸溶液降温至t1℃时,有晶体析出
D. t2℃时,向50g水中加入20g硼酸后充分搅拌,可得70g溶液
【答案】C
16.(2021·河南)右图是KNO3和NaCl的溶解度曲线。下列说法正确的是( )
A.KNO3溶解度大于NaCl的溶解度
B.t℃时,两种物质的饱和溶液中溶质的质量分数相等
C.30 ℃时,30g NaCl加入100g水中可得到饱和溶液
A.甲、乙、丙三种物质的溶解度关系为S甲>S乙>S丙
B.乙物质的溶解度随温度变化最大
C.27℃时,往26g丙里加100g水,形成不饱和溶液
D.33℃时,甲、乙两种物质溶解度相等
【答案】D
15.(2021·广东)如图是硼酸的溶解度曲线,下列说法正确的是()
A. a点的硼酸溶液中溶质的质量分数为10%
B.将a点的硼酸溶液升温至t2℃时,仍是饱和溶液
B.图中p点表示10 ℃时丙的饱和溶液
C. 20 ℃时,向130 g乙的饱和溶液中加入20 g水,乙的质量分数变为20%
D. 50 ℃时,同质量的甲、乙、丙饱和溶液降温至10℃,丙溶液中析出固体最多
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶解度及溶解度曲线的应用一、单选题1.溶解度曲线可表示物质在不同温度时的溶解情况,如图所示。
下列说法错误的是A.KNO3的溶解度随温度的升高而增大B.加入KNO3可以使接近饱和的硝酸钾溶液变饱和C.30℃时30gNaCl与100g水充分混合可以形成饱和溶液D.KNO3中含有少量NaCl可采用降温结晶的方法提纯KNO3【答案】C2.测定某温度下某物质的溶解度时所用溶液必须是( )A.浓溶液 B.稀溶液 C.饱和溶液 D.不饱和溶液【答案】C3.X、Y两种固体物质的溶解度曲线如图所示。
下列说法正确的是( )A.溶剂不变时,t1℃ X的饱和溶液升温至t2℃仍是饱和溶液B.溶剂不变时,分别将t1℃ X、Y的饱和溶液升温至t2℃,所得溶液中溶质的质量分数相等C.相同温度时,X的溶解度一定大于Y的溶解度D.Y的溶解度随温度的升高而增大【答案】B4.X、Y两种固体溶解度曲线如图所示,下列说法正确的是( )A.X的溶解度比Y的溶解度大B.t2℃时,X溶液的浓度比Y溶液的浓度大C.在交点M处,X、Y两种溶液均为饱和溶液D.将t1℃时X的饱和溶液升温至t2℃,溶质的质量分数增大【答案】C5.M、N两种物质的溶解度曲线如图所示。
t2℃时,分别将50 g的M、N固体加入到100 g水中,搅拌。
下列说法不正确...的是A.t2℃时,N固体不能完全溶解B.t2℃时,M的饱和溶液中溶质的质量分数为50%C.M的溶解度受温度变化的影响大于ND.分别将上述t2℃时 M、N的溶液降温到t1℃,得到M、N溶液的质量一定相等【答案】B6.甲、乙两种固体的溶解度曲线如图所示。
下列说法中正确的是( )A.20 ℃时,甲溶液中溶质的质量分数一定大于乙溶液B.将40 ℃时甲的饱和溶液降温至20 ℃,溶液质量不变C.40 ℃时,分别在100 g水中加入50 g甲、乙,所得溶液溶质的质量分数相等D.40 ℃时,分别在100 g水中加入30 g甲、乙,同时降温至20 ℃,甲、乙溶液均为饱和溶液【答案】D7.已知t℃时,盐M(不含结晶水,式量═126)的溶解度为S g.在一定量的M的水溶液中加入ag M后,恰好为t℃时的饱和溶液.若用M•7H2O代替M,欲使原溶液在t℃时恰好饱和,则需加入M•7H2O的质量(g)为()A.2a B.(2+)a C. D.(2+)a【答案】C8.甲、乙的溶解度曲线如图所示。
下列说法正确的是A.t1℃时,甲、乙两种饱和溶液中溶质的质量相等B.t2℃时,甲的饱和溶液中溶质与溶液的质量比为2:5C.将t1℃时乙的饱和溶液升温到t2℃,溶质质量增加D.甲、乙的饱和溶液分别从t1℃升温到t2℃,两溶液中溶质质量分数相等【答案】D9. t1℃时,将等质量的硝酸钾和氯化钾分别放入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
则下列说法正确的是()A.烧杯①的溶液是硝酸钾溶液B.烧杯①的溶液一定是不饱和溶液C.若将烧杯①和烧杯②的溶液升温到t2℃时,溶质的质量分数相等D.若烧杯②的溶液升温到t2时,烧杯底部还有部分物质不溶解【答案】C10.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液B.t1℃时将接近饱和的丙溶液升温可转化为饱和溶液C.乙中混有少量的甲,要提纯乙通常可采用冷却热饱和溶液的方法D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多【答案】B11.下列说法正确的是( )A.20 ℃时20 g某物质溶解在100 g水里形成溶液,则20 ℃时某物质的溶解度是20 gB.20 ℃时20 g某物质溶于水制成饱和溶液,则20 ℃时该物质的溶解度是20 gC.20 g某物质在100 g水里恰好制成饱和溶液,所以该物质的溶解度为20 gD.20 ℃时100 g水里最多只能溶解20 g某物质,则20 ℃时该物质的溶解度为20 g【答案】D12.如图是a、b、c三种物质的溶解度曲线,下列有关说法不正确的是( )A.P点表示t1℃时a和c的溶解度均为20 gB.t2℃时,溶质质量分数为30%的a溶液是饱和溶液C.从a和c的混合溶液中提纯a,可采用降温结晶的方法D.将t1℃时,a、b、c的饱和溶液分别升温到t2℃,所得溶液中溶质的质量分数大小顺序为:b>a>c 【答案】B13.含有碳酸钠的湖泊在冬季结冰时,湖底常有碳酸钠晶体析出,这是因为( )A.碳酸钠难溶于水B.碳酸钠的溶解度随温度升高而增大C.碳酸钠的溶解度随温度升高而减少D.温度变化对碳酸钠的溶解度影响不大【答案】B14.下列四个图像中,能正确反映对应变化关系的是()【答案】B15.某温度时,将20g KNO3固体解在100g水中恰好饱和,该饱和溶液的叙述正确的是()A.m(溶质)∶m(溶剂)=20∶120 B.降温后,有固体析出C.升高后,溶质的质量分数增大 D.溶质的质量分数为20%【答案】B16.影响固体在水中溶解度大小的外界条件是( )A.加入水的多少 B.加入溶质的多少C.是否进行震荡和搅拌 D.温度的变化【答案】D17.如图abc是三种物质的溶解度曲线,下列说法正确的是( )A.溶液的溶质质量分数随温度的升高而减小 B.t1℃时,50g水中溶解20gA就可以达到饱和状态C.t1℃时,等质量的A、B、C三中物质饱和溶液中,A溶液中含溶剂量最少D.A、B两种物质的饱和溶液分别从t2℃降到t1℃时,析出的溶质质量A大于B【答案】B18.如图是X、Y两种固体物质的溶解度曲线,下列说法不正确的是A.将20℃的饱和溶液X降温到10℃,溶液X仍然是饱和溶液B.a点表示30℃时,X的溶解度为60gC.b点表示20℃时X、Y的溶解度相等D.同质量的X、Y饱和溶液从30℃降到10℃时,析出的Y大于X【答案】D19.在室温下,向一定量的NaCl溶液中加入10g固体,充分搅拌后,还有部分固体未溶解;加入10g水后,固体全部溶解.下列判断正确的是( )A.加水前,溶液可能是饱和溶液 B.加水前,溶液一定是饱和溶液C.加水后,溶液一定是饱和溶液 D.加水后,溶液一定是不饱和溶液【答案】B20.人们喝了汽水后常常会打嗝,这是因为汽水中的CO2进入人体后()A.发生了分解 B.与胃液反应生成了气体C.温度升高,CO2溶解度减小 D.压强增大,CO2溶解度减小【答案】C二、填空题21.水和溶液对人类的生产、生活具有重要意义.(1)水_________(填“属于”或“不属于”)人类所需的六大基本营养素之一。
(2)天然水多为硬水,日常生活中可用___________的方法降低水的硬度。
(3)发生火灾时,消防员利用高压水枪灭火的原理是_____________。
(4)右图为A、B、C三种不含结晶水的固体物质的溶解度曲线图,根据曲线图回答下列问题:t1℃时,溶解度最大的物质是____________ 。
若将C的不饱和溶液变成饱和溶液,可以选择的方法是_______(填序号)A、降低温度B、增加溶质C、蒸发溶剂t2℃时,将等质量的A、B、C的饱和溶液都升温至t3℃,溶液中溶剂质量的大小关系是__________(忽略水的挥发)。
【答案】属于煮沸降低可燃物的温度到着火点以下 C BC A=C<B22.一些物质的溶解度同线如图,回答下列问题:(1)70℃时,在100g水中加入110g硝酸钾固体,所形成的溶液是__________溶液(填“饱和”或“不饱和”)。
(2)将上述溶液降温到10℃时,析出的晶体质量是__________g。
(3)工业上将硝酸钾和氯化钠的热混合溶液(两者均已达饱和)冷却至室温,析出晶体。
①析出的晶体含有的物质是____________________(填化学式)。
②关于剩余溶液,下列说法正确的是__________。
A.只含有氯化钠,不含硝酸钾,且氯化钠达到饱和B.含有氯化钠,又含有硝酸钾,且只有氯化钠达到饱和C.含有氯化钠,又含有硝酸钾,且两者都达到饱和【答案】不饱和; 90; KNO3; C。
23.海洋中蕴藏着丰富的化学资源,如NaCl、MgCl2、CaCl2等物质。
从海水中提取金属镁的主要流程如下:(1)电解熔融的无水MgCl2可以得到金属镁。
该反应属于基本反应类型中的反应。
(2)将海水中的镁提取出来,首先要让海水中的镁离子形成沉淀而富集起来。
结合表中数据分析,为了使氯化镁转化为沉淀,应加入溶液A可能是。
室温下几种物质的溶解度(3)结合MgCl2的溶解度曲线分析,操作I:蒸发浓缩、、过滤。
【答案】(1)分解(2)Ca(OH)2溶液或NaOH溶液(3)降温结晶24.小红家喜欢养金鱼,但金鱼存活的时间总是不长,她上网查阅资料得知:鱼缸中每升水的溶氧量低于0.003g 时,鱼就会死亡。
过氧化钙(CaO2)是一种化学增氧剂,其反应原理是2CaO2+2H2O==2Ca(OH) 2+O2↑请回答:(1)氧气在水中的溶解度随温度的升高而_____。
(2)小红将2.88g过氧化钙放入盛有200L水的鱼缸中,请你通过计算分析,当过氧化钙完全反应后,鱼缸中水的溶氧量是否符合最低要求?(假设产生的氧气完全溶入水,其他因素忽略不计)【答案】(1)减小(2)符合最低要求25.粗盐中除NaCl外还含有泥沙等杂质。
初步提纯粗盐的实验流程如下:(1)“滤渣”是粗盐中含有的______________________________。
(2)实验过程中多次用到玻璃棒,分别是:第一次:____________________________________________________________;第二次:____________________________________________________________;第三次:蒸发结晶时不断搅拌,防止液体和固体小颗粒飞溅;第四次:将粗盐从蒸发皿转移出来。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参照所给溶解度曲线图分析其原因是:__________________________________________________。
(4)看图可知,20℃时NaCl的溶解度为__________g,本实验溶解5.4g的粗盐,蒸馏水的最佳使用量约为__________ml(水的密度为1g/mL)。
【答案】泥沙;溶解时搅拌;过滤时引流;氯化钠的溶解度受温度影响不大; 36; 15。
