慢性移植物抗宿主病共42页
慢性移植物抗宿主病诊断与治疗中国专家共识护理课件

根据临床表现和病理特征,cGVHD可 分为局限性和广泛性两类。
病因与发病机制
病因
cGVHD的发生与多种因素相关, 包括免疫因素、遗传因素、环境 因素等。
发病机制
cGVHD的发病机制涉及多个免疫 细胞的相互作用和多种细胞因子 的分泌,导致宿主组织损伤和疾 病进展。
临床表现与诊断标准
临床表现
cGVHD的临床表现多样,可累及皮肤、黏膜、关节、消化道 、肝脏等多个器官,常见症状包括皮疹、口腔溃疡、关节疼 痛、消化道症状等。
建立健全慢性移植物抗宿主病患者社会支持体系,提供心理疏导、康复指导等服务,帮助患者重返社 会。
THANKS
感谢观看
行调整和优化。
病情变化应对
在随访或复诊过程中,如发现病 情变化或出现新症状,应及时调 整治疗方案或采取紧急处理措施
。
05
CATALOGUE
慢性移植物抗宿主病的预防与控制
预防措施与健康教育
预防措施
加强慢性移植物抗宿主病的预防意识,提高公众对慢性移植物抗宿主病的认识和重视程 度。
健康教育
开展慢性移植物抗宿主病相关知识的宣传和教育活动,提高公众的健康素养和自我保护 能力。
劳等诱发因素。
心理支持
关注患者的心理状态,提供必 要的心理疏导和支持,帮助患
者树立战胜疾病的信心。
患者自我管理与监测
症状观察与记录
定期复查与检测
指导患者及家属观察病情变化,记录体温 、体重、皮肤状况等指标,及时发现异常 情况。
根据医生建议定期进行相关检查,如血常 规、肝功能等,以便及时调整治疗方案。
其他治疗手段
造血干细胞移植
对于严重的慢性移植物抗宿主病患者 ,可以考虑进行造血干细胞移植,重 建患者的免疫系统。
移植物抗宿主病硬皮病样改变并双侧、复发性带状疱疹1例

r . i 安德鲁斯 临床皮肤病学 . 版 . G 9 徐
皮 内胶原纤维显著 增生 ”确诊 为慢 性移 植 物抗宿 主病 硬皮 ,
病样改 变 , 以甲泼尼龙 、 予 环孢 素 、 青霉胺 、 普乐可 复胶 囊等
药物治疗 , 情缓 解。20 年 7月 中旬 , 者右 侧腰 部 出现 病 07 患 簇集水疱 , 伴针 刺样 疼 痛 , 渐 波及 双侧 腰 腹部 , 逐 呈带 状 分 布 , 断为带状疱 疹 , 我 院给予 注射用 阿昔 洛韦 抗病 毒及 诊 在 其他 对症治疗 , 后病情痊 愈 , 部遗 留色素沉着 斑 , 1d 5 局 未遗
留局部神经痛 。20 07年 1 月初 无 明显诱 因 , O 右侧 颈部 、 右上 肢出现簇集水疱 , 呈带状分布 , 伴针 刺样疼 痛 , 诊断为带 状疱
疹, 给予相同治疗, 半个月后病情痊愈, 无明显后遗症 。患者
为我 部战士 , 白血病 后一 直在 我院休 养 , 患 目前 长期 服普 乐
食管切除有一定 困难H 。食 管憩 室、 滑肌瘤 可进行 , ee j 平 H lr l 手术 、 晚期 食管癌切除操作不便 。积极开展小 切 口的合理应 用 , 术上可以满足 大部 分胸 外科手 术 的需要 , 技 与传统 切 口 相比, 能够减少手术创伤 , 口美观 , 切 有利 于减少并 发症 和术
热 , 宜昌市 中心 医院 就诊 , 在 确诊 为 急性 粒 细胞 白血 病 ( M1 型 )经治疗后病情好 转。于 20 , 02年 2 2 月 0日在华 中科技大 学 同济 医学 院附属协 和医院住院 , 同胞相合 外周血 干细胞 行
移植术 。供者 为其弟 , L H A配型完全相合 。移植后 给予环孢
移植物抗宿主反应查房

心理压力:移 植物抗宿主反 应带来的心理 压力和负担
护理措施
01
评估疼痛程度:使用疼 痛评分量表进行评估
04
健康教育:向患者及家 属讲解疼痛原因、治疗 方法及注意事项
疼痛管理
02
药物治疗:使用镇痛药 物,如阿片类药物、非 甾体抗炎药等
03
非药物治疗:使用物理 治疗、心理治疗等方法 缓解疼痛
05
监测不良反应:观察药 物治疗效果及不良反应, 及时调整治疗方案
添加标题
提供心理疏导,帮助患者缓解焦虑 和恐惧
提供心理干预,帮助患者建立积极 的心理状态
健康宣教
疾病预防与控制
0
保持良好的生活习惯,如合理饮
1
食、规律作息、适量运动等
避免接触传染源,如勤洗手、戴
0
口罩、保持社交距离等
2
0
定期进行健康体检,及时发现并
3
治疗疾病
接种疫苗,提高机体免疫力,预
0
防疾病发生
_
移植物抗宿主反应查房
汇报人:刀客特万ຫໍສະໝຸດ 目录CONTENTS
01 疾病相关知识
03 护理诊断
05 健康宣教
02 病例汇报 04 护理措施
疾病相关知识
定义和分类
01
02
移植物抗宿主反应(GVHD):移植物 对宿主的免疫反应,导致宿主组织损伤
03
分类:急性GVHD和慢性GVHD
04
急性GVHD:移植后100天内发生,主要 表现为皮肤、胃肠道和肝脏损伤
原因:移植物抗宿主反应引起的炎症反应 症状:疼痛、肿胀、发热、乏力等 护理措施:止痛药、冷敷、休息等 预防措施:保持良好的生活习惯,避免感染等
发热
慢性移植物抗宿主病的诊断和防治

2.1 发 生 的时间 c—GVHD通 常 出现在 干细胞移植后 100~500 d,对 mA 相合及 不完全相合 的同胞 SCT及 无 关供 体 而 言 ,平 均 发 生 的 时 间 分 别 是 201 d,159 d及 133 d。 2.2 症状和体 征 c—GVHD的临床表 现 变化 较 大、因人 而异 。可 以 累及 身体 的任 何 器官 ,与 Sjogren’s综合征 、类风 湿 性 关节炎 、SLE、硬 皮病 等 自身免疫疾病 的症状 体征 类似 。最常见 的 累及部 位是 皮肤 、口腔、肝 、眼、食 管 、上 呼 吸道 .也 可累及 小肠 、肺 、肌 肉、浆膜 一具体表 现 为皮肤 出现 苔癣样 红 色斑丘疹 、皮肤 变厚 变 紧变脆 (硬 皮病 )、汗腺 破 坏 导致体 温 升 高 ;指 甲垂 直 隆 起 、变脆 ;头发 和 体 毛 变细 、变脆 ,亦可 部 分 或 全 面 脱 落 ;眼 干 燥 、畏 光 、灼 痛 ,角 膜 进 行 性 损 坏 :口腔 干燥 、黏 膜硬 化 ,对薄荷 、辛辣食 物、西红柿敏 感 ,颊部 黏膜 白色花 边状 斑块 ,舌上 出现 苔藓样斑 块、红斑 及痛 性 溃疡 ,对 温度敏 感性 降低 ;细 支气管 炎引起 的 阻塞 可表现 为 呼吸 困难 、喘呜 、咳嗽 ,但 CT正 常 ,肺 功 能检 查时 可有 气道 阻塞 改 变 ;胃肠道动 力学异常 、狭 窄 ,摄入 减 少可致体重减轻 ;肝 功能检 查异 常 ,胆 汁 淤积 (胆 红 素增加 ,碱性磷 酸 酶增 高);筋
论 文 30余 篇。
慢性 移植物抗 宿主病(chronic graft versus host disease,C—GVHD)是 异基 因干 细胞 移植 (Allo—SCT)术后 最 常见 的一 个后 期并发 症 。其发 生率并未随 着急性 移植物 抗宿主病 (acute gm versus host disease,a—GVHD)的 防治水 平 的迅 速提 高而相应减 低 。相反 ,还 有上 升的趋 势。 由于 C—GVHD不仅 是 导致 患者发 生机 会 性 感染和 致残 的重要 原 因,而且 其 病 死率 亦可高达 20% ~4JD%。 因此 ,C—GVHD 已成为 Allo—SCT后 的一个亟待 解决 的主要 问题 ,必须予 以高度 重视 。
移植物抗宿主病概述

第18章移植物抗宿主病移植物抗宿主病(graft versus host disease, GVHD)是异基因造血干细胞移植后的一个常见而又重要的并发症。
尽管使用免疫抑制剂预防GVHD,甚至供体是HLA“完全”相合的同胞,GVHD仍可能发生。
GVHD是受体抗原递呈细胞(Ag-presenting cells, APC)和供体成熟T细胞相互作用的结果。
1955年,Barnes 和Loutit首先报道了发生在动物体内的GVHD,当时认为是一种移植继发性疾病或runt病。
直到20世纪50年代后期,人们才认识到移植继发性疾病引起的皮肤异常、腹泻等症状是由于具有免疫活性的细胞进入无免疫活性的宿主体内所致,GVHD这一术语被用于描述这一免疫损伤的过程。
GVHD是异基因造血干细胞移植、供体淋巴细胞输注(DLI)的常见并发症,大部分接受异基因造血干细胞移植的受者都会经历不同程度的GVHD,因而GVHD依然是目前困扰异基因造血干细胞移植成功的主要障碍。
根据GVHD发生的时间,可分为急性GVHD (aGVHD)和慢性GVHD (cGVHD)。
一般100天以内发生的为aGVHD,100天以后发生的为cGVHD,但cGVHD也可在100天以内发生,随着减低剂量预处理和供体淋巴细胞输注的广泛开展,aGVHD也可迟至移植后4~6月发生。
aGVHD可直接演变为cGVHD,没有明确的间隔期,亦可在aGVHD完全缓解一段时间后出现cGVHD;没有aGVHD,也可单独出现cGVHD。
第一节急性移植物抗宿主病根据美国NIH的GVHD共识工作组意见,aGVHD分为移植后100天内发生的经典aGVHD和持续、复发及晚发性aGVHD(移植后100天以后)两种类型,兼有aGVHD和cGVHD临床表现者为“重叠综合征(overlap syndrome)”。
【发病机制】1966年Billingham将发生GVHD的条件定义为:①移植物中需含有免疫活性细胞成分;②宿主必须具备供者移植物不存在的异体移植抗原,这些异体移植抗原被移植物中的免疫活性细胞视为异体抗原而发生反应;③宿主必须对移植物缺乏有效的免疫反应能力,致使移植物有足够的时间组织其免疫反应,并放大、扩展此反应。
移植物抗宿主病

移植物抗宿主病移植物抗宿主病疾病别名GVHD疾病分类消化内科疾病描述移植物抗宿主病(graft-versus-host disease,GVHD)是骨髓移植(BMT)后出现的多系统损害(皮肤、食管、胃肠、肝脏等)的全身性疾病,是造成死亡的重要原因之一。
有急性(aGVHD)和慢性(cGVHD)之分,前者发生在BMT 后3 个月内,后者发生在BMT 3 个月以后。
免疫功能低下者输入HLA 不同的血液也会发生GVHD,并可能是致死性的。
症状体征GVHD 是一种免疫反应性异常的全身性疾病,临床表现较为复杂,主要受累器官是皮肤、消化道和肝脏。
aGVHD 皮肤损害最早出现的症状有红斑、丘疹、水疱,甚至皮肤剥脱,严重者皮损可在数天内扩展至全身。
cGVHD 皮损的突出表现是色素沉着、脱屑增厚或角化不良、苔藓样皮疹等,晚期出现皮肤硬化或关节挛缩。
肝脏亦是GVHD 的靶器官,aGVHD 较多见,轻者无临床症状,重者肝区不适、脾大、黄疸等。
肝功能异常是GVHD 的重要表现,ALT、AKP、胆红素等均有不同程度增高。
口腔黏膜可发生溃疡或片状剥脱,晚期可发生口腔干燥,当BMT 后外周血象恢复时出现与大剂量射线照射和CTX 预处理无关的恶心、呕吐、腹泻等症状时是GVHD 胃肠黏膜损害的表现。
aGVHD 小肠黏膜损害突出,无论aGVHD或cGVHD 均可出现食管损伤。
食管GVHD 发生率高于胃,低于小肠,通常上中段病变较下段多见和严重。
正常人食管上皮是由复层扁平上皮构成,故aGVHD 病变与皮肤相近似,有变性坏死乃至溃疡。
溃疡多是局灶性,少数严重者是大片状甚至累及全食管。
BMT后不论食管GVHD 发生与否,其黏膜表面均常见细菌、真菌(尤其是念珠菌、酵母菌,也可有毛霉菌)和病毒感染,需要指出的是cGVHD 发生时食管常被广泛累及并引起严重症状,尤其是真菌感染性假膜更多见。
疾病病因移植物抗宿主反应是一种特异的免疫现象,是由于移植物组织中的免疫活性细胞与免疫受抑制的、组织不相融性抗原受者的组织之间的反应。
移植物抗宿主病

移植物抗宿主病移植术是现代医学中常见的治疗方法,可以拯救许多患有器官损伤或疾病的患者的生命。
然而,在移植过程中,患者的免疫系统会将移植物识别为外来物体,并发动攻击,导致移植物抗宿主病(Graft-versus-host disease,简称GVHD)的发生。
本文将介绍移植物抗宿主病的原因、症状和治疗方法。
什么是移植物抗宿主病?移植物抗宿主病是一种由移植物免疫细胞攻击宿主组织而引起的疾病。
通常在进行造血干细胞移植或器官移植后发生。
在这些移植过程中,移植物的免疫细胞(如T细胞)会攻击宿主组织,从而引起炎症和损伤。
移植物抗宿主病可以发生在移植物和宿主之间的多个器官和组织中,如皮肤、肝脏、肺和肠道等。
移植物抗宿主病的原因移植物抗宿主病的发生原因是复杂的,主要包括以下几个方面:1.移植物与宿主之间的主要组织相差很大,免疫细胞会将移植物识别为外来物体并攻击。
2.移植物与宿主之间的匹配程度不足,导致移植物免疫细胞对宿主组织产生攻击性反应。
3.移植术后的抗排斥免疫抑制治疗可能导致免疫系统的不平衡,从而引发移植物抗宿主病的发生。
移植物抗宿主病的症状移植物抗宿主病的症状因患者个体差异和病情严重程度而有所不同。
一般来说,症状可以分为急性和慢性两种类型。
急性GVHD的症状包括:•皮肤炎症:常见症状是皮疹、瘙痒和红肿等。
•肝脏炎症:可能导致黄疸、肝功能异常和肝脏疼痛等。
•肠道炎症:引起腹泻、腹痛、恶心和呕吐等。
慢性GVHD的症状包括:•皮肤病变:干燥、搔痒、溃疡和色素沉着等。
•眼部病变:可能导致干眼症和结膜炎等眼部炎症。
•口腔病变:口腔干燥、溃疡和牙龈疾病等。
移植物抗宿主病的治疗方法治疗移植物抗宿主病的方法主要包括免疫抑制治疗和支持性治疗。
免疫抑制治疗包括以下方面:•全身免疫抑制药物:如环孢素、他克莫司及皮质类固醇等,用于抑制免疫系统的活性,减少攻击宿主组织的反应。
•靶向治疗药物:如抗TNF药物和抗B细胞疗法等,可针对特定免疫细胞或分子进行干预,从而减轻症状和改善疾病进程。
移植物抗宿主病病人的护理

移植物抗宿主病病人的护理家庭护士2007年9月第5卷第9期下旬版(总第84期)?23?病时间,早晨睡醒后先静卧10min,感觉舒适后再起床.最好选择在太阳升起后进行锻炼,有雾的天气,因空气混浊最好别进行运动.2结果(见表1)表1病人出院指导前后对疾病的认知及生活方式的改变比较例(%)项目出院指导前未达标达标出院指导后未达标达标生活方式饮食运动要求药物用法及注意事项复诊项目,时间64(75.3)21(24.7)19(224)66(77.6)58(68.2)27(31.8)22(259)63(74.1)56(65.9)29(34.1)2(2.4)83(97.6)60(706)25(29.4)o(o)85(100)3讨论冠心病是一种心身疾病,遗传因素,生物学因素,心理社会因素的综合作用,促使其发生发展.其中,生活压力太大,工作紧张,抑郁等心理因素是冠心病发生的主要诱因,且对疾病的转归和治疗有重要影响,单纯的药物治疗虽然能治疗心脏疾患,却不移植物抗宿主病病人的护理周喜月,林婷,朱志英中图分类号:R473.5文献标识码:C文章编号:1672—1888(2007)9C一0023—03移植物抗宿主病(GvHI])是异基因造血干细胞移植的主要并发症和造成死亡的一个重要原因,是异基因造血干细胞移植后一种免疫反应性异常影响到多器官全身并发症.它是植活的供者造血干细胞中的T细胞损伤受者(宿主)组织而引起.分急性和慢性,一般100d或3个月以内发生的为急性GVHD,100d或3个月以后发生的为慢性GVHD, 而在10d内发生的GVHD又称为超急性GVHD. GVHD的预防和治疗,主要应用免疫抑制剂和糖皮质激素等药物,极易合并感染,而GVHD的护理是影响移植成败的关键之一.现对我院1995年3月一2006年3月21例人类白细胞抗原(}{IA)匹配的异基因亲缘造血干细胞移植病例进行护理总结.1临床资料本组病人21例,男12例,女9例;年龄14岁~50岁,平均28岁;急性非淋巴细胞白血病9例,急性淋巴细胞白血病2例,慢性粒细胞白血病7例,非霍奇金淋巴瘤3例.供者为亲缘供者,HIA配型与受者匹配,其中18例为全相合,3例有2个次要位点相合.21例受者中,17例发生GVHD(其中发生能教会病人避开诱发因素.若辅以心理干预,则既能增加病人对疾病相关知识的了解,明确情绪对冠心病的影响,学会自我调节与放松的方法,又能增加病人的心理社会支持,消除顾虑,树立战胜疾病的信心.从而有效的缓解了病人的紧张焦虑,抑郁情绪对疾病的发展起到很好的控制作用.因此,对冠心病病人采用心身兼顾,标本兼治的治疗方法是值得推广的.参考文献:[1]叶任高.内科学[M].第6版.北京:人民卫生出版社, 2004:280—312.[2]李梅,石贞仙.疾病治疗护理常规一临床非手术科室护理分册[M].太原:山西人民出版社,2004:50—53.作者简介:张志芳(1973一),女,山西省长治人,护士长,主管护师,工作单位:047600,山西省黎城县人民医院. (收稿日期:2007—07—19)(本文编辑郭海瑞)急性GVHD5例,慢性GVHD3例,急性和慢性并存9例).17例GVHD病人的临床表现为I度~Ⅱ度15例,Ⅲ度1例,Ⅳ度1例.17例病人中13例有不同程度的皮肤损害,4例发生肠道反应.17例发生GVHD的病人,经治疗13例达到完全缓解,13例完全缓解的病人无病生存10例,而未缓解4例,病人则死亡,1例死于急性GVHD,3例死于严重的肺部感染.2GvHI]的临床表现急性GVHD主要侵犯的组织是皮肤,胃肠道和肝脏.皮肤表现为丘疹,脱屑,水疱,胃肠道表现为腹泻,腹痛,严重可引起肠黏膜大片脱落,肠梗阻,肝脏损害轻者为ALT升高,重者有严重黄疸.上述三种损害常同时发生.慢性GVHD表现为皮肤色素沉着,硬皮病样改变,口腔黏膜炎,溃疡.急慢性GVHD均易发生感染.因此,临床护理十分重要.3护理3.1一般护理病人外周血中性粒细胞低于0.5×10/L时,居住于空气层流病室,实行全环境保护性隔离.当外周血中性粒细胞大于0.5×109/L 时,可逐渐过渡到无污染,阳光充足,空气流通的普通单人房间,每天通风2次,空气紫外线消毒30min 或空气消毒机消毒.根据病人的具体情况,实行保护性隔离措施,严格无菌操作.严密观察生命体征,24?FAMILYNURSESeptember,2007V o1.5No.9C注意皮肤,口腔,肝脏和胃肠道受损及变化情况.病人以卧床休息为主,可根据体力情况适当活动.根据病人发生GVHD的程度不同,给予相应清淡,易消化,营养丰富的饮食.I度给予低菌普食,Ⅱ度给予低菌半流质饮食,Ⅲ度以上给予无菌流质饮食.3.2皮肤的护理严密观察全身皮肤及黏膜变化. GVHD最常见最初表现在皮肤,表现为皮疹.首先是手掌和脚掌发红,发痒,疼痛,继而头面部,颈部, 前胸,后背,会阴部,上下肢及全身皮肤出现红色斑或红疹,轻者皮肤干燥,色素沉着,脱屑,重者皮疹发展为水泡,破溃,剥脱,渗血,渗液,所以在进行异基因造血干细胞移植前,护理人员与病人及家属交谈时要说明可能出现GVHD.而急性GVHD往往在移植后血象开始恢复时出现皮疹不明显,当病人皮肤有发痒,疼痛等异常感觉时,及时告知医护人员, 以便早发现及时处理,这样病人即使在出现GVHD 时有心理准备及不至j太紧张,又能主动配合医护人员早期发现GVHD.医生可根据GVHD具体情况进行抗排斥的处理.护理人员除要仔细观察外, 准确记录皮肤变化的程度和范围及伴随症状,协助病人每日用洗必泰消毒水清洗全身,及时洗掉坏死的皮屑,保持清洁,减少或避免感染机会.更换灭菌的床单,被套,枕套和衣服.皮肤干裂可涂无菌石蜡油,瘙痒涂抹考的松类软膏,经常叮嘱病人勿用手抓挠皮肤,剥脱时不要撕拉皮肤,用无菌剪刀剪去脱起的皮肤,保护好新生的皮肤.破溃严重渗出液较多时,用外科无菌方法清创.如出现大的水泡要在无菌操作下抽出液体.手掌,足掌由于神经丰富,表现为疼痛明显,特别是出现大面积皮疹时,有时用止痒药物效果不佳,可用冷敷减轻疼痛,必要时使用止痛剂.本院13例(包括1例IV度)皮肤损害者均未发生严重感染.3.3肠道的护理发生肠道GVHD时,病人出现腹泻,腹痛时,要注意观察大便的形状,颜色,性质, 数量,适当给予止泻药物,腹痛时可给予解痉药止痛.了解肠道GVHD的程度.病人此时应进半流质或流质无菌饮食,必要时应禁食.由于病人反复腹污,易致肛周感染,因此要密切观察肛周皮肤黏膜有无糜烂,发红,疼痛,感染,应用洗必泰水或1:5000高锰酸钾溶液每次便后肛周清洗或坐浴, 清洗后用无菌小毛巾轻抹,避免使用粗糙毛巾及动作粗暴,局部用百多邦软膏外涂,有痔疮时给予痔疮软膏外涂或栓剂.我院有4例肠道反应均未发现肛周感染.3.4肝脏的护理肝脏GVHD时,我们主要观察有无皮肤,眼球结膜黄染,有无恶心呕吐等消化道症状,及时抽血化验肝功能,注意肝功能检查报告,特别是胆红素的变化.胆红素异常增高,则病人病情危重,除遵医嘱给予抗GVHD保肝药物外,需要密切观察病情变化.本院17例病人中都有不同程度的恶心呕吐等消化道症状,其中还有2例伴随皮肤巩膜黄染.3.5口腔黏膜的护理GVHD病人最常见出现口唇干燥,脱屑,疼痛,口腔黏膜发红,溃疡,渗血等,所以每日口腔需要护理3次,给予生理盐水十vitBI2十庆大霉素配成漱口液及生理盐水交替漱口.根据局部情况给予碳酸氢钠液及硼酸液漱口,口唇涂以无菌石蜡油,保持湿润,以免干裂.口腔溃疡处给予安尔碘Ⅲ型外涂或抗菌液喷溃疡处.进食不能过快,不可食过热,生,硬,有刺激性的食物,避免口腔黏膜损伤和感染.本组17例病人中都有不同程度的口腔黏膜溃疡,经过上述处理后均愈合,未发生感染.3.6免疫抑制剂应用后药物的观察与护理环孢素A(CSA)是预防和治疗GVHD的首选药物,可选择性地抑制细胞毒素T淋巴细胞的活化而发挥作用,其既与抗原识别有关,又影响免疫调节,这种调节作用与CsA结合蛋白的相对浓度有关.所以要求在给CSA药物治疗时,剂量,时间,浓度,用法要准确,按时按量用药,定时抽血检测CSA浓度,告诉病人不能自行停药,自行停药可诱发GVHD的发生.环孢素A的主要副反应为肾毒性,胃肠道反应,血压增高,多毛症等.本院17例病人中无发生明显的肾毒性,有15例出现恶心厌食等症状,3例出现血压增高.发生急性GVHD时,要用大剂量的甲基强的松龙冲击治疗,甲基强的松龙为强有力的免疫抑制剂,起效快,其副作用为严重感染,水钠储留及精神兴奋引发应激性溃疡并出血.在用药过程中要注意观察药物的疗效及副作用,如密切观察高血压变化,有无消化道出血,体温及精神异常.发现异常时及时报告医生.本院17例病人中有3例合并间质性肺炎,2例出现精神兴奋,10例出现满月脸,并伴有不同程度的痤疮.发生急性GVHD时,除用大剂量的甲基强的松龙冲击治疗外,同时应用人血丙种球蛋白治疗,人血丙种球蛋白可发生发热,寒战等过敏症状,需要密切观察.本院17例病人中无发生过敏反应.4体会由于造血干细胞移植破坏了人体免疫机制,病人细胞免疫和体液免疫未完全恢复,又运用免疫抑制剂,病人的机体抵抗力极其低下,护理人员细致的家庭护士2007年9月第5卷第9期下旬版(总第84期)?25? 观察,正确评估发生GVHD的严重程度,以及密切配合治疗的有效护理措施是十分重要的.参考文献:[1]刘玲,欧英贤.造血干细胞移植护理学[M].北京:人民卫生出版社,2002:1.[2]张志灵,赵淑兰.造血干细胞移植的护理[J].天津:天津科学技术出版社,2002:1.[3]陈爱凤.急性移植物抗宿主病患者的护理观察[J].中华护理杂志,1997,32(4):80.留置导尿漏尿原因分析及对策贾改香中图分类号:R472.1文献标识码:C文章编号:1672—1888(2007)9C一0025—02留置导尿是临床解决尿潴留和观察记录尿量,保持昏迷尿失禁病人局部干燥,清洁,促进膀胱功能恢复的基本治疗方法和手段.采用双腔气囊导尿管留置导尿,具有操作简便,固定稳妥,刺激性小,引流通畅等优点,但在使用过程中经常发生尿道口漏尿现象.我科从2004年一2()(】6年236例病人采用气囊导尿管留置导尿,其中出现漏尿现象的共有25 例,占总数的10.6%,对其进行原因分析并提出护理措施.1临床资料本组病人25例,其中男10例,女15例,年龄25岁~76岁;均选用相同厂家的一次性硅胶双腔气囊导尿管导尿,插入深度为见尿后再插入4CITt~5 CITt,气囊内注入生理盐水10rnL~15mL后将导尿管向外牵拉至轻微阻力.2漏尿原因分析及对策2.1尿管质量问题本组病例中有2例病人因使用了有缺陷的导尿管,导致尿管侧孑L被堵引起漏尿, 因此留置尿管前一定要仔细检查尿管质量,并向气囊内注入气或水,观察有无漏水或漏气,还要试气囊大小,形状,囊壁厚薄,有无畸形,否则很有可能引起漏尿.2.2尿道松弛而致漏尿颅内病变或截瘫病人,由于支配神经障碍,尿道括约肌及盆底肌肉松弛,使导尿管与尿道内口不能紧贴,造成尿管周围漏尿E1J.护理对策:对于此类病人可选择较粗导尿管且给于轻度牵拉尿管.在临床男病人可以用纱布牵拉[4]骆秋芳,高芳.异体骨髓移植合并移植物抗宿主病的护理[J].护理杂志,2000,15(12):26.[5]张志灵.25例异基因造血干细胞移植合并急性移植物抗宿主病病人的护理[J]天津护理,2001,9(3):22作者简介:周喜月工作单位:510080,中山大学附属第一医院;林婷工作单位:510630,中山大学附属第三医院;朱志英工作单位:510080,中山大学附属第一医院.(收稿日期:2007—07—12)(本文编辑郭海瑞)法,导尿成功后,牵拉尿管使气囊与尿道内口紧贴,然后用无菌纱布条沿尿道口在尿管上扣一死结.女病人可用空瓶悬挂法E,取250mL空盐水瓶一只,长约2Ill的包装绳一根,将绳子一头紧系在空盐水瓶的颈口上备用,另一头系在导尿管末端较硬处,借重力垂直向下形成90度角牵引尿管,一般每次1h~2 h,一次牵引后放松观察,若无漏尿说明效果好,若仍有漏尿者应保持牵引.2.3气囊注水量过多气囊注水量不足可引起漏尿,建议气囊注水量15mL~30mL,很少有气囊注水量过多引起的报道E3J,在本组25例漏尿病人的观察中发现增加气囊的注水量效果不理想;相反有10例病人回抽气囊注水量至气囊内剩余液体5mL~8mL时漏尿停止,气囊注水量与漏尿的关系可能与气囊的位置有关E引.气囊注水量小于15mL时由于气囊易漂浮与尿道口上,因而产生漏尿;气囊注水量过多引起漏尿的原因可能是气囊内压力过大,压迫尿管至引流不畅及气囊内压力对膀胱颈,尿道口压力过大,易致膀胱痉挛,病人有想排尿的感觉,不时的用力排尿.在使用气囊导尿管时,气囊内注入液体的量应严格按照其说明书规定使用,在不使导尿管脱出又有最佳导尿效果的前提下,可减少气囊内液体或使用气囊容积较小的导尿管.2.4导尿管阻塞而致漏尿由于急性细菌性感染,尿液浑浊,尿沉淀产生,或者出血,血凝块堵塞以及长期留置导尿管未定期更换冲洗引起的钙盐沉积而导致尿管堵塞,尿液引流不畅.当膀胱容量达到一定量时,出现尿液从周围溢出并伴有尿潴留.护理对策:对于长期留置尿管者每天定期用0.02%呋喃西林或生理盐水加庆大霉素16×10U冲洗膀胱,同时遵医嘱口服碳酸氢钠片碱化尿液以减少黏液的分泌E,保持尿管引流通畅.同时根据。
扁平苔藓样慢性移植物抗宿主病一例

扁平苔藓样慢性移植物抗宿主病一例徐俊涛;周慧;刘菡【摘要】患者,男,40岁。
躯干泛发苔藓样皮损伴瘙痒1个月。
患者1年前因“急性粒细胞白血病”行异体造血干细胞移植术。
皮损组织病理示基底细胞液化变性,有嗜酸性变的角质形成细胞似胶样小体,周围淋巴细胞卫星状分布,真皮浅层淋巴细胞等呈带状浸润。
诊断:扁平苔藓型慢性移植物抗宿主病。
%A 40-year-old male presented with lichenoid lesions over the trunk, with itching for 1 month. The patient had a history of acute myeloid leukemia and was treated with allogeneic hematopoietic stem cell transplantation 1 year ago. Histopathology of skin lesions revealed liquefaction degeneration of basal cell, civatte bodies-like keratinocyte which surrounded by lymphocytes in satellite-like distribution and banded infiltration of lymphocytes in dermis. The diagnosis of lichen planus-type chronic graft-versus-host disease was made.【期刊名称】《中国麻风皮肤病杂志》【年(卷),期】2016(032)004【总页数】3页(P226-228)【关键词】慢性移植物抗宿主病;扁平苔藓样【作者】徐俊涛;周慧;刘菡【作者单位】湖北医药学院附属东风医院皮肤科,湖北十堰,442008;湖北医药学院附属东风医院输液室,湖北十堰,442008;湖北医药学院附属东风医院皮肤科,湖北十堰,442008【正文语种】中文移植物抗宿主病(graft-versus-host disease,GVHD)是常见于异基因造血干细胞移植术后的一种累及多器官、多系统的免疫性疾病,以皮肤、胃肠道及肝胆系统为主。
慢性移植物抗宿主病诊断与治疗中国专家共识(2021年版)

②cGVHD早期征象不典型,应定期随访和密切观察。一旦出现晨僵、皮肤感 觉异常、肌肉酸痛、不明原因低热、乏力或活动后喘息、不明原因消瘦、眼 涩、口干、味觉异常、肝肾功能异常、感觉或运动轻度障碍、大便性状改变 及生殖系统异常变化等征象均需高度重视,同时进行无创性筛查;
③活检可以在难以明确诊断和安全的前提下安排; ④诊断指标并不等同于评价严重性和治疗反应的指标。
➢ 区分性征象指只见于cGVHD而不见于急性移植物抗宿主病(aGVHD)的临床表现,包括皮肤
色素脱失/丘疹鳞状变、指甲萎缩/甲床分离/对称性脱落、新出现的斑秃/脱发、口腔干燥/黏液腺 囊肿/黏膜萎缩/溃疡/假膜、眼结膜新发干燥/沙砾感/疼痛感/瘢痕性结膜炎/干眼症/点状角膜病、 生殖道糜烂/龟裂/溃疡、经影像学诊断的空气潴留/支气管扩张、肌炎/多发性肌炎。
免疫抑制药物
3.移植后环磷酰胺(PT/CY):
✓ 对于HLA全相合移植患者,单独应用PT/CY预防方案(+3d、+4d静脉输注环磷酰胺 50mg/kg)而不使用MTX/CNI常规预防方案,cGVHD发生率仅为7%。
✓ 对于外周血造血干细胞移植患者,PT/CY预防cGVHD的效果也十分显著,发生率控制在20 %以下。
✓如果一线治疗有效,cGVHD症状得到有效控制,糖皮质激素应逐渐减量。糖皮质 激素如何减量至今无统一方案,但需把握一个原则:缓慢减量、足够疗程,尽量使 用足以控制GVHD症状的剂量。
肝移植术后移植物抗宿主病的诊治进展

㊀㊀DOI:10.3877/cma.j.issn.1674 ̄3903.2019.01.018㊀㊀基金项目: 十三五 国家科技重大专项(2017X10203201)㊀㊀作者单位:310058杭州ꎬ浙江大学医学院1ꎻ310003杭州ꎬ浙江大学医学院附属第一医院肝胆胰外科2㊀㊀通信作者:郑树森ꎬEmail:shusenzheng@zju.edu.cn 综述肝移植术后移植物抗宿主病的诊治进展朱晓璐1㊀郑树森2㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀ʌ摘要ɔ㊀肝移植术后移植物抗宿主病(GVHD)发生率低ꎬ但病死率极高ꎬ典型症状包括不明原因发热㊁皮疹㊁腹泻和骨髓抑制ꎮ其发病机制目前尚未完全阐明ꎬ诊断缺乏统一标准ꎬ治疗缺乏特异性手段ꎮ近年来ꎬ针对GVHD免疫反应进程中的病理生理学研究ꎬ为开辟新的诊断方法和治疗手段提供可能ꎮ目前ꎬ大剂量糖皮质激素联合静脉注射免疫球蛋白冲击㊁免疫抑制剂减少或停用可能是较为有效的治疗方案ꎮ而对于糖皮质激素难治性GVHDꎬ应用多种不同的分子靶向药物可能对改善受者预后起到积极作用ꎮ㊀㊀ʌ关键词ɔ㊀肝移植ꎻ移植物抗宿主病ꎻ发病机制ꎻ药物治疗Progressofthegiagnosisandtreatmentofpostoperativelivertransplant ̄associatedgraftversushostdisease㊀ZhuXiaolu1ꎬZhengShusen2.1ZhejiangUniversitySchoolofMedicineꎬHangzhou310058ꎬChinaꎻ2DepartmentofHepatopancreatobiliarySurgeryꎬtheFirstAffiliatedHospitalꎬSchoolofMedicineꎬZhejiangUniversityꎬHangzhou310003ꎬChinaCorrespondingauthor:ZhengShusenꎬEmail:shusenzheng@zju.edu.cnʌAbstractɔ㊀Theincidenceofgraftversushostdisease(GVHD)afterlivertransplantationislowꎬbutthemortalityrateisextremelyhigh.Thetypicalsymptomsare:unidentifiedhighfeverꎬtetterꎬdiarrheaandmyelosuppression.ThestandardizedtreatmentofGVHDafterlivertransplantationremainsunclear.Itisprobablymoreeffectivetousehigh ̄doseofmethylprednisolonecombinedwithintravenousimmunoglobulinꎬwithdrawingordeclinethedosageofimmunosuppressanttotreatGVHDafterlivertransplantation.Forthehormone ̄refractoryGVHDꎬtheapplicationofavarietyoftargeteddrugsofcytokineorchemokinemayplayapositiveroleinimprovingtheprognosisofpatients.ʌKeywordsɔ㊀LivertransplantationꎻGraftversushostdiseaseꎻPathogenesisꎻMedicinaltreatment㊀㊀移植物抗宿主病(graftversushostdiseaseꎬGVHD)是由于供者来源的免疫活性细胞将受者抗原识别为外来抗原并产生免疫应答ꎬ对受者靶组织㊁器官进行攻击而出现相应临床表现的一种全身性疾病ꎮGVHD在富含淋巴细胞的器官(如骨髓㊁小肠)移植术后高发ꎬ肝移植术后GVHD的发生率仅为0.1%~2.0%ꎬ但病情进展极其凶险ꎬ死亡率高达75%[1 ̄4]ꎮ本文着重对近年来肝移植术后GVHD的发生机制㊁高危因素㊁诊断和治疗方面的进展作一综述ꎮ1㊀发生机制肝移植术后GVHD的发生发展机制复杂且尚未完全阐明ꎮ肝移植术后排斥反应的发生率虽然较心脏和肾移植低ꎬ但GVHD的发生率更高ꎬ主要归因于肝脏及肝周淋巴结组织中含有更多 过客白细胞 ꎬ易在受者体内形成嵌合体ꎬ诱导免疫耐受[5]ꎬ但同时也为肝移植术后诱发GVHD提供可能ꎮYu等[6]在研究中发现ꎬ应用抗T细胞抗原受体α/β单抗离体灌注大鼠GVHD模型肝脏ꎬ尽可能去除 过客T细胞 ꎬ在不影响受体移植物功能的情况下几乎完全抑制了GVHDꎬ提示在肝移植前后消耗或控制供者 过客白细胞 可以降低移植肝免疫攻击的强度ꎬ从而预防GVHDꎮTaylor等[7]提出GVHD的发生有3个环节: (1)传入期:感染或其他致组织损伤因素诱发炎症反应时ꎬ受者巨噬细胞反应性释放IL ̄1㊁IL ̄6和TNF ̄α等细胞因子ꎬ增强受者抗原呈递细胞(antigen ̄presentingcellsꎬAPC)活性[8]ꎻ(2)传出期:供者T细胞识别APC呈递的受者MHC抗原后增殖活化[9]ꎬ释放IL ̄2和INF ̄γ等细胞因子ꎬ激活供者单核吞噬细胞系统并使其分泌TNF ̄α和IL ̄1等炎性因子ꎻ(3)效应期:通过穿孔素/颗粒酶B途径㊁Fas/FasL途径及细胞因子介导发挥对受者的免疫攻击ꎬ靶器官受到损伤后将产生更多的炎性介质和细胞因子ꎬ进而形成瀑布式效应ꎬ最终作用于受者皮肤㊁黏膜和骨髓等靶器官ꎬ导致全身多脏器损伤和严重病变ꎮ对肝移植术后GVHD发生发展机制的认识ꎬ许多都是基于造血干细胞移植(hematopoieticstemcelltransplantationꎬHSCT)的研究经验ꎮ近期研究发现肠上皮细胞和肠道微生态在GVHD发病机制中具有重要作用[10]ꎮ肠道中含有通过分泌抗菌肽从而调节肠道微生物群的潘氏细胞ꎬ当肠上皮细胞受到外来病原体及其他因素损伤时ꎬ释放TNF ̄α㊁IL ̄6和IL ̄1等细胞因子导致潘氏细胞功能受损ꎬ继而引起肠道微生物组的改变ꎬ该过程被认为是GVHD中免疫反应的起始传播事件[11]ꎮ有研究提出ꎬ新生血管发生[12]和肠道内中性粒细胞㊁单核细胞浸润[13]是GVHD最早发生的病理生理改变ꎬ广泛的中性粒细胞浸润与不良后果相关[14]ꎮMartin等[15]在回肠中使用光照标记中性粒细胞ꎬ其迁移随后被追踪到肠系膜淋巴结ꎬ在淋巴结中活化的中性粒细胞向供者T细胞呈递受者HLA抗原ꎬ这有助于促进GVHD的发生ꎮHülsdünker等[16]在HSCT中研究Janus激酶(JanuskinaseꎬJAK)1/2抑制剂Ruxolitinib对中性粒细胞抗原呈递作用的影响ꎬ发现其通过减少中性粒细胞诱导的MHCⅡ类分子表达ꎬ并阻止它们从回肠迁移到肠系膜淋巴结ꎬ从而发挥减弱GVHD反应的作用[17]ꎮ调节性T细胞(regulatoryTcellꎬTreg细胞)可通过干扰T细胞活化和增殖㊁抑制效应CD4+与CD8+T细胞功能等发挥自身免疫抑制作用ꎬ同时具有维持免疫耐受的功能ꎮChen等[18]研究证明ꎬ在骨髓移植小鼠模型发生GVHD期间存在Treg细胞的进行性减少ꎬ并且这导致自身反应性的供体小鼠促炎性T细胞的出现ꎻ相反ꎬ已证实扩增供体小鼠来源的自然调节性T细胞(naturalregulatoryTcellꎬnTreg)能够有效缓解GVHD[19]ꎮ雷帕霉素与IL ̄2抗体复合物的联合应用能够促进nTreg细胞增殖ꎬ从而降低GVHD的严重性[20]ꎮ2㊀危险因素2.1㊀HLA配型GVHD的始动因素是供㊁受者间MHC抗原不符ꎬ而在HLA相合的情况下ꎬ次要组织相容性复合物抗原的差异成为触发GVHD的重要因素ꎮ供㊁受者HLA位点的匹配率越高ꎬ受者对供者产生的免疫应答越低ꎬ肝移植术后GVHD的发生率及病情凶险程度随之增高[21 ̄22]ꎻ由于HLA的家族相容性ꎬ活体肝移植(livingdonorlivertransplantationꎬLDLT)中GVHD的发生率高于原位肝移植[23]ꎮ使用HLA纯合子的供者与HLA杂合子的受者匹配(即单向供㊁受者HLA匹配)ꎬ供者因此与受者共享单倍型ꎬ此时受者不能识别并清除供者细胞ꎬ相反供者细胞可将另一未共享的单倍型识别为 异己 而对其进行免疫攻击ꎬ因此在LDLT中发生GVHD的风险极高[24]ꎮShimata等[25]研究发现ꎬ如果在HLA ̄A㊁B和C位点上存在供者显性单向匹配ꎬ即便HLA ̄DR不匹配ꎬ仍可发生急性GVHDꎮ2.2㊀供㊁受者匹配因素受者年龄>50岁㊁供受者年龄差>20岁以及女性供者-男性受者或多产女性供者ꎬ这些匹配类型将增加肝移植术后GVHD的发生风险[3ꎬ10ꎬ26]ꎻ其中供㊁受者年龄差是肝移植受者发生GVHD后死亡的独立危险因素[27]ꎮ2.3㊀受者免疫状态肝移植受者免疫状态低下㊁移植前输血或进行免疫治疗㊁血型不合肝移植㊁再次移植及多器官联合移植等是导致GVHD发生的高危因素[1ꎬ28]ꎻ受者原发疾病类型如各种自身免疫性疾病及肝炎㊁酒精性肝病和糖尿病等均增加GVHD发生风险[29]ꎮMurali等[3]在研究中发现ꎬ肝细胞肝癌(hepatocellularcarcinomaꎬHCC)患者肝移植后GVHD的发生率较非HCC患者高ꎮMeenakshi等[30]强调了HCC患者体内可能存在免疫系统功能障碍ꎬ通过引起CD4+T细胞功能下降ꎬ对肿瘤抗原产生耐受并促进HCC的发展ꎬHCC本身又可能引起免疫功能失调ꎬ最终导致HCC患者在肝移植术后更易发生GVHDꎮ也有报道认为ꎬHCC肝移植术后并发GVHD且治愈的受者可能从中获益ꎬ即获得免疫源性的抗肿瘤作用而长期无瘤生存[31]ꎮ3㊀临床表现GVHD常发生在肝移植术后2~6周ꎬ也有学者认为GVHD主要是由特定的临床表现和组织学结果协助诊断ꎬ而不论发病时间[32]ꎮ症状及发生率分别为:皮疹(92%)㊁发热(66%)㊁腹泻(65%)和全血细胞减少(78%)[3ꎬ26]ꎮ受者可先后出现全部或部分上述临床特征ꎬ但这些表现均为非特异性ꎬ早期与药物过敏㊁感染性疾病常难以鉴别[29ꎬ33]ꎮ因此ꎬ当肝移植受者术后出现不明原因发热㊁皮疹而无明显肝功能损害时ꎬ应警惕GVHD的可能ꎮ肝移植术后GVHD进展至终末期ꎬ最常见的死亡原因是严重感染(60%)和多器官功能衰竭[3]ꎮ3.1㊀皮疹起初为红斑㊁斑丘疹ꎬ可先见于颈前㊁胸部ꎬ并逐渐向四肢㊁腹部及背部蔓延ꎬ严重时可融合成片或形成大疱ꎬ常累及广泛的体表区域ꎬ并可能演变为红皮病ꎬ可伴有瘙痒和全身表皮脱屑[34]ꎮ3.2㊀发热不明原因高热是肝移植术后GVHD常见的首发症状ꎬ体温常在38.5~41.0ħ波动ꎬ反复多次行细菌学㊁病毒学及影像学检查ꎬ无病原学及支持感染证据ꎮ3.3㊀消化道症状主要表现为腹泻和消化道溃疡ꎮ腹泻继发于肠黏膜破坏引起的吸收功能障碍ꎬ轻者仅出现腹胀和轻度腹泻ꎻ重者往往呈水样腹泻ꎬ每日可达10余次或更甚ꎮ黏膜溃疡可累及消化道全程ꎬ引起纳差㊁恶心㊁呕吐和腹痛等不适ꎮ肠道黏膜糜烂㊁脱落时出现便血㊁腹痛等症状ꎮ口腔黏膜损伤的特征是红斑和溃疡ꎬ与单纯疱疹病毒引起的口腔黏膜炎症状相似ꎬ常导致受者吞咽疼痛和困难ꎮ3.4㊀骨髓抑制当受者造血干细胞遭到免疫攻击和破坏时ꎬ外周血逐渐出现以白细胞水平下降为主的全血细胞减少征象ꎮ粒细胞集落刺激因子和促血小板生成素具有一定作用ꎬ但难以逆转病情ꎬ晚期时中性粒细胞计数可下降至0.1ˑ109/Lꎬ血小板计数可降至10ˑ109/L以下ꎮ因受者多数存在皮肤和黏膜组织受损ꎬ对外界致病微生物的抵御能力被削弱ꎬ在伴随严重骨髓抑制的同时ꎬ极易发生致命的重症感染ꎬ常见病原菌为肠杆菌㊁侵袭性曲霉和播散性假丝酵母菌[3ꎬ33]ꎮ3.5㊀其他肝移植术后GVHD是供者淋巴细胞对受者进行免疫攻击ꎬ此时移植肝自身被视为 非异己 ꎬ因此发病早期通常无明显肝功能受损ꎬ晚期因继发疾病可导致肝功能异常[35]ꎮGVHD攻击呼吸系统㊁神经系统等组织器官时将产生相应症状ꎬ如呼吸衰竭及癫痫等ꎮKnox等[36]曾报道过以呼吸困难为主要症状的病例ꎻPadovan等[37]在GVHD小鼠模型的脑组织中观察到淋巴细胞浸润ꎬ这提示GVHD可能引起神经系统病变ꎮ4 诊断与标准Triulzi等[38]将肝移植术后GVHD诊断标准归纳为以下3点:(1)出现靶器官受累的特征性症状和体征ꎬ包括皮疹㊁腹泻和骨髓抑制等ꎻ(2)受累靶器官的组织学证据ꎻ(3)外周血或受累靶器官中存在受者免疫细胞与供者来源淋巴细胞嵌合的现象ꎮ4.1㊀组织病理学检查皮肤活检镜下见表皮松解和角化不良㊁基底层空泡样改变及淋巴细胞浸润[34]ꎮ上述组织学表现有助于早期诊断ꎬ但并非特异性表现ꎬ需与药疹和中毒性表皮坏死等鉴别[39]ꎮ当出现严重腹泻及便血时应行胃肠道组织活检ꎬ敏感性最高的部位是直肠和乙状结肠ꎬ内镜下可见黏膜红斑㊁浅表溃疡及周围渗出液ꎻ组织病理学示隐窝上皮细胞凋亡ꎬ隐窝结构广泛破坏伴黏膜脱落ꎬ淋巴细胞浸润增加ꎻ骨髓活检常提示以粒系增生低下为特征的骨髓抑制征象ꎬ后期骨髓象呈现出发育不良及再生障碍性贫血的表现[40]ꎮ4.2㊀嵌合体检测聚合酶链式反应-序列特异性引物法通过检测受者组织内有无供者HLA等位基因的淋巴细胞嵌合体ꎬ以帮助确诊GVHD[41]ꎮ聚合酶链式反应扩增短串联重复序列检测技术被称为 微卫星DNA指纹技术 ꎬ能够快速检测受者组织中供者DNA的存在并判断嵌合情况ꎬ灵敏度高且结果不受供㊁受者间HLA匹配的影响ꎬ是临床上广泛应用的检测方法[7]ꎮ当供㊁受者为异性时ꎬ可利用荧光原位杂交法检测Y染色体ꎬ以判断女性受者体内是否存在男性供者的嵌合体[39]ꎮ4.3㊀生物学标志物检测检测并使用生物学标志物辅助诊断肝移植术后GVHD仍然是目前较为活跃的研究领域ꎮ多种炎性细胞因子在GVHD的发生发展中起到重要作用ꎬ通过密切监测肝移植术后受者外周血中生物学标志物的水平和变化ꎬ可能有助于早期筛选GVHD高危受者[42]ꎮ有研究显示ꎬ肝移植术后GVHD受者IL ̄2㊁IL ̄18水平显著升高ꎬ标准抗GVHD治疗后ꎬIL ̄2㊁IL ̄18和IFN ̄1水平下降[32]ꎮ此外ꎬ可溶性生长刺激表达基因2蛋白的血清水平㊁TNF受体 ̄1和IL ̄2受体α链(CD25)[10ꎬ43]以及多种微小RNA(miR ̄155和miR146a74)对预测肝移植术后GVHD的发生和转归具有重要价值[44 ̄45]ꎮ5 治疗肝移植术后GVHD的治疗目标是恢复受者有效的免疫调节[20]ꎬ治疗措施主要包括:大剂量糖皮质激素联合静脉注射免疫球蛋白(intravenousimmunoglobulinꎬIVIG)冲击㊁免疫抑制剂减量或停用㊁应用分子靶向药物㊁预防性抗感染㊁提高受者免疫力及有效的支持治疗等[46]ꎮ然而ꎬ约有50%~60%的受者糖皮质激素治疗无效[47]ꎬ应用抗TNF ̄α抗体(如依那西普和英夫利昔单抗)㊁抗胸腺细胞球蛋白(anti ̄humanT ̄lymphocyteglobulinꎬATG)㊁阿巴西普[48]㊁CD4+CD25+Foxp3+Treg细胞和人类间充质干细胞等新型治疗方法ꎬ可能通过抑制炎症反应㊁协助清除供者来源T细胞以及调节受者免疫状态等多种不同机制对难治性肝移植术后GVHD起到一定积极作用ꎮ5.1㊀糖皮质激素联合IVIG冲击糖皮质激素通过抑制炎性介质的释放及其瀑布式效应㊁减少淋巴细胞的生成并抑制其功能ꎬ从而控制全身免疫炎症反应ꎬ减少靶器官的损伤ꎬ对改善受者全身症状有一定疗效ꎬ是治疗肝移植术后GVHD的一线药物ꎮ大剂量IVIG(0.4g/kg)能够直接增强受者自身被动免疫力ꎬ降低大剂量糖皮质激素治疗带来的感染风险ꎬ还能通过抑制淋巴细胞功能㊁降低网状吞噬细胞活性㊁抑制补体激活和炎症因子释放等途径稳定㊁协助恢复受者免疫状态[21ꎬ28]ꎮ不仅如此ꎬIVIG对血液系统造血功能的保护及恢复ꎬ在肝移植术后GVHD骨髓抑制的治疗中也起到重要作用ꎮ当疑似或确诊肝移植术后GVHD时ꎬ即刻应用大剂量糖皮质激素联合IVIG冲击ꎬ既可降低体温㊁缓解皮疹及骨髓抑制等症状ꎬ又能抑制强烈的免疫反应ꎬ同时促进机体免疫功能重建ꎬ是较为合理的方案ꎮ5.2㊀减少或停用免疫抑制剂早期研究认为ꎬ增加免疫抑制剂的应用能阻断T细胞激活ꎬ抑制供者T细胞活性ꎬ从而达到减轻免疫反应并改善全身症状的治疗效果ꎻ而现在更多研究表明减少或停用免疫抑制剂有助于减轻肝移植术后GVHD的病情并使救治率提高[1]ꎮ其理论依据为GVHD的发生反映受者处于免疫功能过度抑制状态ꎬ应在骨髓抑制出现前果断减少或停用免疫抑制剂ꎬ使受者恢复并提高自身免疫力ꎬ以有效清除供者来源T细胞ꎬ对抗可能存在的机会性感染ꎮ需要注意的是ꎬ免疫抑制剂减量可能会增加发生排斥反应的风险[49]ꎮ当肝移植受者GVHD病情得到有效控制时ꎬ应逐渐㊁缓慢增加免疫抑制剂剂量ꎬ同时辅以CD25单抗ꎬ可降低移植肝发生排斥反应的风险[50]ꎮ5.3㊀分子靶向药物肝移植术后GVHD发展过程中T细胞的激活与克隆性扩增依赖IL ̄2的介导ꎬ抗IL ̄2受体单克隆抗体(如达利珠单抗和巴利昔单抗)可通过与IL ̄2受体α链上的CD25抗原特异性结合从而抑制IL ̄2ꎬ进而阻断CD4+T细胞引发的免疫反应[48]ꎮ既往有肝移植术后GVHD受者使用巴利昔单抗治疗成功的案例ꎬ提示IL ̄2受体拮抗剂可能是有效的治疗药物[51 ̄52]ꎮTNF ̄α是GVHD发展中关键的促炎因子ꎬ具有增强靶组织细胞的抗原呈递㊁促进B/T细胞增殖和分化以及刺激炎性介质和细胞因子大量分泌的作用ꎬ因此成为治疗GVHD的靶点[53]ꎮ抗TNF ̄α抗体(如依那西普和英夫利昔单抗)在治疗胃肠道受累的糖皮质激素难治性GVHD中疗效较好[54]ꎮATG和阿仑单抗都能通过作用于T细胞表面抗原和消耗CD4+淋巴细胞来达到免疫抑制的目的[47ꎬ55]ꎮATG已被证明有助于预防GVHDꎬ但对受者总体生存率的影响有限[56]ꎮ阿仑单抗是CD52特异性单克隆抗体ꎬ在预防和治疗GVHD方面均有益处[57]ꎬ但由于免疫抑制更为严重ꎬ因此要进行预防性抗病毒治疗ꎬ尤其是针对CMV和EB病毒ꎮ利妥昔单抗可通过抑制B细胞生成㊁减弱B细胞抗原呈递作用及与T细胞相互作用等ꎬ达到减轻免疫反应的目的ꎮ有研究表明ꎬGVHD高危患者应用利妥昔单抗可使GVHD发生率显著降低ꎬ且预后明显改善[58]ꎮ5.4㊀抗感染和支持治疗肝移植术后并发GVHD的受者应转移至ICU或层流病房进行隔离和保护ꎬ早期应预防性加用小剂量广谱抗生素和抗真菌药物ꎬ预防和治疗CMV感染尤为重要[59]ꎮ有研究认为肝移植术后GVHD与CMV感染之间存在显著相关性ꎬ可能与供者淋巴细胞攻击骨髓导致全血细胞减少有关[60]ꎮ口服或静脉给予万古霉素有助于减少肠道菌群移位和内毒素的吸收ꎬ有研究通过粪菌移植将微生物群直接注入患者肠道内ꎬ发挥保护肠道的作用ꎬ对难治性肝移植术后GVHD受者有一定疗效[61]ꎮ早期行血浆置换以清除循环中免疫活性细胞和炎性介质可能有利于缓解GVHD病情ꎮ当出现骨髓抑制征象时ꎬ应立即停用骨髓毒性的药物ꎬ同时予粒细胞集落刺激因子㊁促血小板生成素及成分输血对症支持治疗ꎮ应用质子泵抑制剂抑制胃酸㊁保护胃黏膜ꎻ保证充分的肠内营养对维持和保护消化道功能十分必要ꎬ若患者正常进食受影响ꎬ则辅以部分或完全胃肠外营养支持ꎮ此外ꎬ应对出现的其他并发症采取及时㊁积极的对症支持治疗ꎮ6 小结GVHD是肝移植术后罕见且预后极差的并发症ꎮ随着肝移植术的广泛开展ꎬGVHD的有效预防㊁早期诊断和及时治疗对受者的预后具有十分重要的意义ꎮ应鼓励所有移植中心分享病例及经验ꎬ有助于推动对GVHD的病理生理机制的探索与研究ꎬ由此提出新型㊁特异性的治疗手段ꎬ将为改善肝移植术后GVHD受者的预后带来新希望ꎮ参㊀考㊀文㊀献1㊀SmithDMꎬAguraEꎬNettoGꎬetal.Livertransplant ̄associatedgraft ̄versus ̄hostdisease[J].Transplantationꎬ2003ꎬ75(1):118 ̄126.2㊀ElsiesyHꎬIbrahimAꎬSelimKꎬetal.Graft ̄versus ̄hostdiseaseafterlivertransplantation:Asingle ̄centercaseseries[J].AnnTransplantꎬ2015ꎬ20:397 ̄401.3㊀MuraliARꎬChandraSꎬStewartZꎬetal.Graftversushostdiseaseafterlivertransplantationinadults:Acaseseriesꎬreviewofliteratureꎬandanapproachtomanagement[J].Transplantationꎬ2016ꎬ100(12):2661 ̄2670.4㊀KangWHꎬHwangSꎬSongGWꎬetal.Acutegraft ̄vs ̄hostdiseaseafterlivertransplantation:Experienceatahigh ̄volumelivertransplantationcenterinKorea[J].TransplantProcꎬ2016ꎬ48(10):3368 ̄3372.5㊀MorosoVꎬMetselaarHJꎬManchamSꎬetal.Livergraftscontainauniquesubsetofnaturalkillercellsthataretransferredintotherecipientafterlivertransplantation[J].LiverTransplꎬ2010ꎬ16(7):895 ̄908.6㊀YuEꎬUetaHꎬKimuraHꎬetal.Graft ̄versus ̄hostdiseasefollowinglivertransplantation:Developmentofahigh ̄incidenceratmodelandaselectivepreventionmethod[J].AmJTransplantꎬ2017ꎬ17(4):979 ̄991.7㊀TaylorALꎬGibbsPꎬSudhindranSꎬetal.Monitoringsystemicdonorlymphocytemacrochimerismtoaidthediagnosisofgraft ̄versus ̄hostdiseaseafterlivertransplantation[J].Transplantationꎬ2004ꎬ77(3):441 ̄446.8㊀OnoRꎬWatanabeTꎬKawakamiEꎬetal.Co ̄activationofmacrophagesandTcellscontributetochronicGVHDinhumanIL ̄6transgenichumanisedmousemodel[J].EBioMedicineꎬ2019. [Epubaheadofprint]9㊀BlazarBRꎬMurphyWJꎬAbediM.Advancesingraft ̄versus ̄hostdiseasebiologyandtherapy[J].NatRevImmunolꎬ2012ꎬ12(6):443 ̄458.10NassereddineSꎬRafeiHꎬElbaheshEꎬetal.Acutegraftversushostdisease:Acomprehensivereview[J].AnticancerResꎬ2017ꎬ37(4):1547 ̄1555.11RiesnerKꎬShiYꎬJacobiAꎬetal.Initiationofacutegraft ̄versus ̄hostdiseasebyangiogenesis[J].Bloodꎬ2017ꎬ129(14):2021 ̄2032.12SchwabLꎬGoroncyLꎬPalaniyandiSꎬetal.Neutrophilgranulocytesrecruitedupontranslocationofintestinalbacteriaenhancegraft ̄versus ̄hostdiseaseviatissuedamage[J].NatMedꎬ2014ꎬ20(6):648 ̄654.13KlämbtVꎬWohlfeilSAꎬSchwabLꎬetal.AnovelfunctionforP2Y2inmyeloidrecipient ̄derivedcellsduringgraft ̄versus ̄hostdisease[J].JImmunolꎬ2015ꎬ195(12):5795 ̄5804.14SociéGꎬMaryJYꎬLemannMꎬetal.Prognosticvalueofapoptoticcellsandinfiltratingneutrophilsingraft ̄versus ̄hostdiseaseofthegastrointestinaltractinhumans:TNFandFasexpression[J].Bloodꎬ2004ꎬ103(1):50 ̄57.15MartinPJ.PathogenicneutrophilsinacuteGVHD[J].Bloodꎬ2018ꎬ131(16):1774 ̄1775.16HülsdünkerJꎬOttmüllerKJꎬNeeffHPꎬetal.Neutrophilsprovidecellularcommunicationbetweenileumandmesentericlymphnodesatgraft ̄versus ̄hostdiseaseonset[J].Bloodꎬ2018ꎬ131(16):1858 ̄1869.17StickelNꎬHankeKꎬMarschnerDꎬetal.MicroRNA ̄146areducesMHC ̄ⅡexpressionviatargetingJAK/STAT ̄signalingindendriticcellsafterstemcelltransplantation[J].Leukemiaꎬ2017ꎬ31(12):2732 ̄2741.18ChenXꎬVodanovic ̄JankovicSꎬJohnsonBꎬetal.AbsenceofregulatoryT ̄cellcontrolofTH1andTH17cellsisresponsiblefortheautoimmune ̄mediatedpathologyinchronicgraft ̄versus ̄hostdisease[J].Bloodꎬ2007ꎬ110(10):3804 ̄3813.19BeresAJꎬDrobyskiWR.TheroleofregulatoryTcellsinthebiologyofgraftversushostdisease[J].FrontImmunolꎬ2013ꎬ4:163.20RobbRJꎬLineburgKEꎬKunsRDꎬetal.IdentificationandexpansionofhighlysuppressiveCD8+FoxP3+regulatoryTcellsafterexperimentalallogeneicbonemarrowtransplantation[J].Bloodꎬ2015ꎬ119(24):5898 ̄5908.21ChanEYꎬLarsonAMꎬGernsheimerTBꎬetal.Recipientanddonorfactorsinfluencetheincidenceofgraft ̄vs. ̄hostdiseaseinlivertransplantpatients[J].LiverTransplꎬ2010ꎬ13(4):516 ̄522.22UchiyamaHꎬKayashimaHꎬMatonoRꎬetal.RelevanceofHLAcompatibilityinlivingdonorlivertransplantation:thedouble ̄edgedswordassociatedwiththepatientoutcome[J].ClinTransplantꎬ2012ꎬ26(5):E522 ̄E529.23KameiHꎬOikeFꎬFujimotoYꎬetal.Fatalgraft ̄versus ̄hostdiseaseafterlivingdonorlivertransplantation:differentialimpactofdonor ̄dominantone ̄wayHLAmatching[J].LiverTransplꎬ2006ꎬ12(1):140 ̄145.24SoejimaYꎬShimadaMꎬSuehiroTꎬetal.Graft ̄versus ̄hostdiseasefollowinglivingdonorlivertransplantation[J].LiverTransplꎬ2004ꎬ10(3):460 ̄464.25ShimataKꎬSakamotoRꎬAnanTꎬetal.Fatalgraft ̄versus ̄hostdiseaseafterliving ̄donorlivertransplantationfromanHLA ̄DR ̄mismatcheddonor[J].PediatrTransplantꎬ2017ꎬ21(Suppl1):e13039.26ElfekiMAꎬPungpapongSꎬGencoPVꎬetal.Graft ̄versus ̄hostdiseaseafterorthotopiclivertransplantation:multivariateanalysisofriskfactors[J].ClinTransplantꎬ2016ꎬ29(12):1063 ̄1066.27AkbulutSꎬYilmazMꎬYilmazS.Graft ̄versus ̄hostdiseaseafterlivertransplantation:Acomprehensiveliteraturereview[J].WorldJGastroenterolꎬ2012ꎬ18(37):5240 ̄5248.28YuksekkayaHAꎬArikanCꎬTumgorGꎬetal.Late ̄onsetgraft ̄versus ̄hostdiseaseafterpediatricliving ̄relatedlivertransplantationforLangerhanscellhistiocytosis[J].PediatrTransplantꎬ2011ꎬ15(6):E105 ̄E109.29KohlerSꎬPascherAꎬJungeGꎬetal.Graftversushostdiseaseafterlivertransplantation–asinglecenterexperienceandreviewofliterature[J].TransplIntꎬ2008ꎬ21(5):441 ̄451.30MeenakshiSꎬChawlaYKꎬAroraSK.Immunologyofhepatocellularcarcinoma[J].WorldJHepatolꎬ2015ꎬ7(17):2080 ̄2090.31XieSꎬTangLGꎬCaiXꎬetal.MightlivertransplantationrecipientswithprimaryhepatocellularcarcinomabenefitfromGVTeffectofaGVHD?[J].Chinese ̄GermanJClinOncolꎬ2014ꎬ13(11):535 ̄538.32MengXQꎬChenXHꎬSaheballyZꎬetal.Cytokinesareearlydiagnosticbiomarkersofgraft ̄versus ̄hostdiseaseinliverrecipients[J].HepatobiliaryPancreatDisIntꎬ2017ꎬ16(1):45 ̄51.33KimGYꎬSchmelkinLAꎬDavisMDPꎬetal.Dermatologicmanifestationsofsolidorgantransplantation ̄associatedgraft ̄versus ̄hostdisease:Asystematicreview[J].JAmAcadDermatolꎬ2017ꎬ78(6):1097 ̄1101.34StrongRodriguesKꎬOliveira ̄RibeiroCꎬdeAbreuFiuzaGomesSꎬetal.Cutaneousgraft ̄versus ̄hostdisease:Diagnosisandtreatment[J].AmJClinDermatolꎬ2018ꎬ19(1):33 ̄50.35TaylorALꎬGibbsPꎬBradleyJA.Acutegraftversushostdiseasefollowinglivertransplantation:theenemywithin[J].AmJTransplantꎬ2015ꎬ4(4):466 ̄474.36KnoxKSꎬBehniaMꎬSmithLRꎬetal.Acutegraft ̄versus ̄hostdiseaseofthelungafterlivertransplantation[J].LiverTransplꎬ2002ꎬ8(10):968 ̄971.37PadovanCSꎬGerbitzAꎬSostakPꎬetal.Cerebralinvolvementingraft ̄versus ̄hostdiseaseaftermurinebonemarrowtransplantation[J].Neurologyꎬ2001ꎬ56(8):1106 ̄1108.38TriulziDJꎬNalesnikMA.MicrochimerismꎬGVHDꎬandtoleranceinsolidorgantransplantation[J].Transfusionꎬ2010ꎬ41(3):419 ̄426.39MevesAꎬel ̄AzharyRAꎬTalwalkarJAꎬetal.Acutegraft ̄versus ̄hostdiseaseafterlivertransplantationdiagnosedbyfluorescentinsituhybridizationtestingofskinbiopsyspecimens[J].JAmAcadDermatolꎬ2006ꎬ55(4):642 ̄646.40RoguljIMꎬDeegJꎬLeeSJ.Acutegraftversushostdiseaseafterorthotopiclivertransplantation[J].JHematolOncolꎬ2012ꎬ5(1):50 ̄50.41GrubicZꎬStinglKꎬCecukJelicicEꎬetal.RepetitiveDNApolymorphismsinfollowingchimerismafterallogeneicbonemarrowtransplantation[J].ClinTransplantꎬ2010ꎬ19(5):586 ̄590.42FerraraJLꎬLevineJEꎬReddyPꎬetal.Graft ̄versus ̄hostdisease[J].Lancetꎬ2009ꎬ373(9674):1550 ̄1561.43VanderLugtMTꎬBraunTMꎬHanashSꎬetal.ST2asamarkerforriskoftherapy ̄resistantgraft ̄versus ̄hostdiseaseanddeath[J].NEnglJMedꎬ2013ꎬ369(6):529 ̄539.44HartwellMJꎬÖzbekUꎬHollerEꎬetal.Anearly ̄biomarkeralgorithmpredictslethalgraft ̄versus ̄hostdiseaseandsurvival[J].JciInsightꎬ2017ꎬ2(3):e89798.45ZitzerNCꎬGarzonRꎬRanganathanP.Toll ̄likereceptorstimulationbymicroRNAsinacutegraft ̄vs. ̄hostdisease[J].FrontImmunolꎬ2018ꎬ9:256146PerriRꎬAssiMꎬTalwalkarJꎬetal.Graftvs.hostdiseaseafterlivertransplantation:anewapproachisneeded[J].LiverTransplꎬ2010ꎬ13(8):1092 ̄1099.47AliRꎬRamdialJꎬAlgazeSꎬetal.Theroleofanti ̄thymocyteglobulinoralemtuzumab ̄basedserotherapyintheprophylaxisandmanagementofgraft ̄versus ̄hostdisease[J].Biomedicinesꎬ2017ꎬ5(4):E67.48ElfekiMAꎬGencoPVꎬPungpapongSꎬetal.Abataceptuseingraft ̄versus ̄hostdiseaseafterorthotopiclivertransplantation:acasereport[J].TransplantProcꎬ2014ꎬ46(7):2422 ̄2425.49LehnerFꎬBeckerTꎬSybrechtLꎬetal.Successfuloutcomeofacutegraft ̄versus ̄hostdiseaseinaliverallograftrecipientbywithdrawalofimmunosuppression[J].Transplantationꎬ2002ꎬ73(2):307 ̄310.50YasharSꎬWuSSꎬBinderSWꎬetal.Acutegraft ̄versus ̄hostdiseaseafterpediatricsolidorgantransplant[J].JDrugsDermatoꎬ2008ꎬ7(5):467 ̄469.51SudhindranSꎬTaylorAꎬDelriviereLꎬetal.Treatmentofgraft ̄versus ̄hostdiseaseafterlivertransplantationwithbasiliximabfollowedbybowelresection[J].AmJTransplantꎬ2003ꎬ3(8):1024 ̄1029.52RaiVꎬDietzNEꎬAgrawalDK.Immunologicalbasisfortreatmentofgraftversushostdiseaseafterlivertransplant[J].ExpertRevClinImmunolꎬ2016ꎬ12(5):583 ̄593.53LevineJE.ImplicationsofTNF ̄αinthepathogenesisandmanagementofGVHD[J].IntJHematolꎬ2011ꎬ93(5):571 ̄577.54YangJꎬCheukDKꎬHaSYꎬetal.Infliximabforsteroidrefractoryordependentgastrointestinalacutegraft ̄versus ̄hostdiseaseinchildrenafterallogeneichematopoieticstemcelltransplantation[J].PediatrTransplantꎬ2012ꎬ16(7):771 ̄778.55ByrneJLꎬStainerCꎬCullGꎬetal.Theeffectoftheserotherapyregimenusedandthemarrowcelldosereceivedonrejectionꎬgraft ̄versus ̄hostdiseaseandoutcomefollowingunrelateddonorbonemarrowtransplantationforleukaemia[J].BoneMarrowTransplantꎬ2000ꎬ25(4):411 ̄417.56KumarAꎬReljicTꎬHamadaniMꎬetal.Antithymocyteglobulinforgraft ̄versus ̄hostdiseaseprophylaxis:anupdatedsystematicreviewandmeta ̄analysis[J].BoneMarrowTransplantꎬ2018.[Epubaheadofprint]57vanderZwanMꎬBaanCCꎬvanGelderTꎬetal.Reviewoftheclinicalpharmacokineticsandpharmacodynamicsofalemtuzumabanditsuseinkidneytransplantation[J].ClinPharmacokinetꎬ2018ꎬ57(2):191 ̄207.58SolomonSRꎬSizemoreCAꎬRidgewayMꎬetal.Safetyandefficacyofrituximab ̄basedfirstlinetreatmentofchronicGVHD[J].BoneMarrowTransplantꎬ2018.[Epubaheadofprint]59HeatonNDꎬReeceASꎬTanKC.Graft ̄versus ̄hostdiseasefollowinglivertransplantation[J].JRSocMedꎬ1992ꎬ85(6):313 ̄314.60NemotoTꎬKubotaKꎬKitaJꎬetal.Unusualonsetofchronicgraft ̄versus ̄hostdiseaseafteradultliving ̄relatedlivertransplantationfromahomozygousdonor[J].Transplantationꎬ2003ꎬ75(5):733 ̄736.61KakihanaKꎬFujiokaYꎬSudaWꎬetal.Fecalmicrobiotatransplantationforpatientswithsteroid ̄resistant/dependentacutegraft ̄versus ̄hostdiseaseofthegut[J].Bloodꎬ2016ꎬ128(16):2083 ̄2088.(收稿日期:2018 ̄12 ̄30)(本文编辑:杨扬)㊀㊀朱晓璐ꎬ郑树森.肝移植术后移植物抗宿主病的诊治进展[J/CD].中华移植杂志:电子版ꎬ2019ꎬ13(1):75 ̄80.。
移植物抗宿主病(GVHD)新药开发攻略
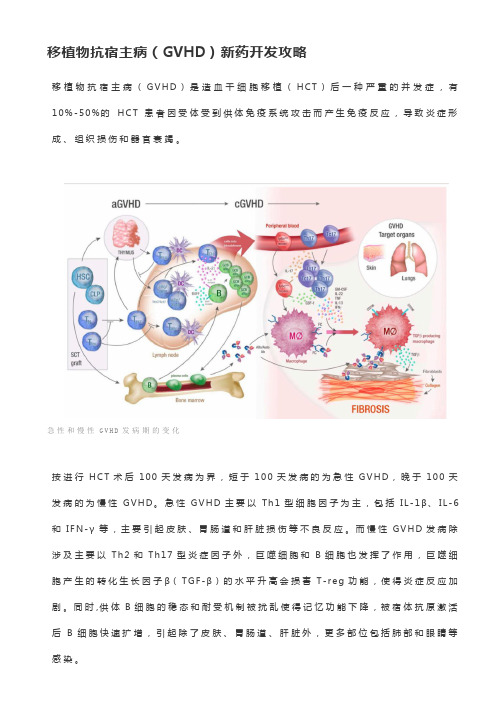
移植物抗宿主病(GVHD)新药开发攻略移植物抗宿主病(G V H D)是造血干细胞移植(H C T)后一种严重的并发症,有10%-50%的H C T患者因受体受到供体免疫系统攻击而产生免疫反应,导致炎症形成、组织损伤和器官衰竭。
急性和慢性G V H D发病期的变化按进行H C T术后100天发病为界,短于100天发病的为急性G V H D,晚于100天发病的为慢性G V H D。
急性G V H D主要以T h1型细胞因子为主,包括I L-1β、I L-6和I F N-γ等,主要引起皮肤、胃肠道和肝脏损伤等不良反应。
而慢性G V H D发病除涉及主要以T h2和Th17型炎症因子外,巨噬细胞和B细胞也发挥了作用,巨噬细胞产生的转化生长因子β(T G F-β)的水平升高会损害T-r e g功能,使得炎症反应加剧。
同时,供体B细胞的稳态和耐受机制被扰乱使得记忆功能下降,被宿体抗原激活后B细胞快速扩增,引起除了皮肤、胃肠道、肝脏外,更多部位包括肺部和眼睛等感染。
I n c y t e两款J A K抑制剂的两种结局J A K抑制剂在包括类风湿关节炎、斑秃、特应性皮炎等各类自身免疫疾病中都大放异彩,不过I n c y t e/诺华合作开发的J A K1/2抑制剂芦可替尼却走出了一条不一样的路。
继2011年和2014年被美国F D A批准用于骨髓纤维化、真性红细胞增多症后,又于2019年获批成为首个治疗类固醇难治的12岁及以上儿童及成人急性G V H D的J A K抑制剂。
从机制上看,J A K1/2对G V H D发病主要炎症因子I L-1β、I L-6和I F N-γ等信号传导起重要作用,因此J A K抑制剂也许可以是G V H D治疗的理想选择,芦可替尼的获批也印证了这一点。
在单臂R E A C H1试验中,49例可评价患者第28天的O R R达57%、C R达31%。
在R E A C H2研究中,与B A T治疗组相比,J a k a v i治疗组在第28天O R R显著提高(62% v s39%,p<0.001),达到了研究的主要终点。
移植物抗宿主病诊断与治疗PPT

移植物抗宿主病的 治疗效果及预后
治疗方法:免疫抑制剂、免疫调节剂、细胞因子等 治疗效果:改善移植物存活率、降低排斥反应发生率 预后:移植物存活率提高、排斥反应发生率降低 治疗过程中可能出现的并发症及处理方法
移植物抗宿主病的严重程度
患者的年龄、性别和健康状况
治疗方案的选择和实施
患者的心理状态和应对能力
早期诊断:及时发现移植物抗宿主病, 及时治疗
合理用药:选择合适的药物,避免过度 治疗
免疫抑制剂:合理使用免疫抑制剂,控 制病情
加强护理:加强患者护理,提高生活质 量
心理支持:给予患者心理支持,减轻心 理压力
定期复查:定期复查,监测病情变化, 及时调整治疗方案
定期复查:患者应定期到医院进行复查,以便及时发现病情变化 药物治疗:患者应按照医生的建议按时服药,不得擅自停药或更改剂量
免疫学检 测:进行 免疫学检 测,了解 患者免疫 状态和免 疫功能
移植物抗宿主病的 治疗
免疫抑制剂:如环孢素、他克莫司等,用于抑制免疫系统反应 生物制剂:如抗CD3抗体、抗IL-2受体抗体等,用于调节免疫系统功能 细胞因子:如IL-10、IL-15等,用于调节免疫系统反应 干细胞移植:如造血干细胞移植、间充质干细胞移植等,用于重建免疫系统
移植物抗宿主病的 预防
严格筛选供体:选择健康、无病史的供体 免疫抑制剂的使用:合理使用免疫抑制剂,避免过度抑制 预防感染:加强卫生管理,预防感染 监测和早期发现:定期监测,早期发现并治疗移植物抗宿主病
接种疫苗:预防接种是预防移植物 抗宿主病的重要手段
接种时机:在移植前或移植后进行 接种
疫苗种类:包括抗CD3抗体、抗 CD25抗体等
接种效果:可以有效降低移植物抗 宿主病的发生率
移植物抗宿主病的发生及其早期预测分析

移植物抗宿主病的发生及其早期预测分析张东华;游世伦;肖毅;黄伟;张路;李登举;冉丹;黄亮【期刊名称】《中国现代医学杂志》【年(卷),期】2005(15)9【摘要】目的为了探讨异基因造血干细胞移植(allo-HSCT)后移植物抗宿主病(GVHD)及不明原因水肿与GVHD的关系及其临床意义.方法对29例allo-HSCT 的白血病患者进行了随访观察;将发生急性GVHD(aGVHD)或慢性GVHD(cGVHD)前有无水肿的病例分为水肿组与非水肿组进行对比分析.结果29例病人均顺利植入,15例中17例次发生GVHD,其中8例aGVHD,7例为Ⅰ、Ⅱ度,1例为肠道Ⅳ度aGVHD;9例(其中2例为aGVHD转变)cGVHD中,5/9例为局限性皮肤或口腔黏膜cGVHD,4/9例为广泛性皮肤cGVHD.17例次GVHD中,4例aGVHD和1例cGVHD患者,发生GVHD前均有不明原因的水肿,其部位为颜面及双下肢,其中4例为轻度一过性水肿,1例为中等度持续性水肿,发生时间为+23~+150 d.水肿与GVHD发生时的间隔时间为7~12d.所有病例随访15个月(3~106个月),15例GVHD病人中,14例病情控制或稳定,仅1例Ⅳ度aGVHD死亡.结论水肿与GVHD 似乎有关联,特别是aGVHD.allo-PBSCT后不明原因的水肿可能为GVHD预测指征,防治GVHD有积极意义.【总页数】4页(P1339-1342)【作者】张东华;游世伦;肖毅;黄伟;张路;李登举;冉丹;黄亮【作者单位】华中科技大学同济医学院附属同济医院,血液科,湖北,武汉,430030;深圳市布吉人民医院,内科,广东,深圳,518112;华中科技大学同济医学院附属同济医院,血液科,湖北,武汉,430030;华中科技大学同济医学院附属同济医院,血液科,湖北,武汉,430030;华中科技大学同济医学院附属同济医院,血液科,湖北,武汉,430030;华中科技大学同济医学院附属同济医院,血液科,湖北,武汉,430030;华中科技大学同济医学院附属同济医院,血液科,湖北,武汉,430030;华中科技大学同济医学院附属同济医院,血液科,湖北,武汉,430030【正文语种】中文【中图分类】R733.7【相关文献】1.异基因造血干细胞移植后发生移植物抗宿主病患者血清外泌体miRNAs敏感生物标志物的表达分析 [J], 刘娇;周义文;郑磊;王大明;安泰学;胡雪松;李南凯;汪洪富;马雯;聂赫中容;肖利佳2.异基因造血干细胞移植后急性移植物抗宿主病的发生及其危险因素的探讨 [J], 王仕军3.异基因造血干细胞移植后急性移植物抗宿主病的发生及其危险因素的探讨 [J], 王仕军4.异基因骨髓移植小鼠肠道菌群和NLRP3炎症小体改变与急性移植物抗宿主病发生发展的关系 [J], 赵燕娜;汪丽佩;李天一;何志兴;张婷;温成平5.RH-PBSCT治疗后细胞免疫功能表达及与急性移植物抗宿主病发生关系研究 [J], 徐建丽;袁海龙;王洪波;陈刚;杨蕊雪;古力巴旦木·艾则孜;玛丽娅·木哈什;曲建华;庞楠楠;江明因版权原因,仅展示原文概要,查看原文内容请购买。
以肾病综合征为表现慢性移植物抗宿主病一例

・病例报告・作者单位:650032昆明,云南省第一人民医院肾内科(罗惠民、陈飞、张金黎);北京大学病理学系(邹万忠);昆明医学院电镜室(宋金玲)通信作者:罗惠民,Email:lhm_1962@sina .com以肾病综合征为表现慢性移植物抗宿主病一例罗惠民 陈飞 张金黎 邹万忠 宋金玲 患者男,31岁。
因尿中泡沫增多20d,颜面、双下肢水肿1周,于2004年9月5日入院。
既往于2003年6月体检发现急性非淋巴细胞性白血病(M 2b 型),经化疗后病情缓解。
患者于2004年2月26日行异基因骨髓移植(供体为其哥哥),术后服环孢素A (Cs A )治疗,Cs A 25mg/d 。
入院体检:T 3712℃,BP 90/55mm Hg (1mm Hg =01133kPa )。
皮肤、黏膜无皮疹、黄疸、出血点,浅表淋巴结无肿大。
颜面、双眼睑水肿,心、肺(-)。
肝脾未触及,腹水征(+),腰骶部、双下肢凹陷性水肿。
实验室检查:血象WBC 7184×109/L,中性01647,淋巴01213,RBC 3178×1012/L,Hb 116g/L,P LT 154×109/L 。
尿常规:糖(-),蛋白(+++),红细胞8~9/HP,白细胞3~6/HP,透明管型4~6/LP;尿蛋白定量815g/d;血AST 18U /L,ALT 15U /L ,白蛋白1410g/L,球蛋白2710g/L,总胆固醇611mmol/L,甘油三酯2158mmol/L,尿素氮(BUN )1218mmol/L,肌酐(Scr )31819μmol/L,I gG 5184g/L,I g A 1104g/L ,I g M 1181g/L,C 31104g/L;内生肌酐清除率(Ccr )2212m l/m in;抗核抗体、抗基底膜抗体、抗中性粒细胞胞浆抗体及HB s Ag 、HBe Ag 、抗HB s 、抗HBe 、抗HBc 、HCV 均为(-)。
移植物抗宿主病的临床分析

移植物抗宿主病的临床分析伏瑞祥;孙爱宁;仇惠英;唐晓文;傅铮铮;苗喵;马骁;刘跃均;吴德沛【期刊名称】《苏州大学学报(医学版)》【年(卷),期】2003(023)003【摘要】目的分析异基因干细胞移植后移植物抗宿主病(GVHD)与预处理方式、干细胞来源和GVHD预防的关系及其对预后的影响.方法对56例异基因造血干细胞移植患者进行2~25个月的临床随访.结果(1)Ⅱ°~Ⅳ°急性GVHD的激素疗效明显不如Ⅰ°急性GVHD ,激素耐药的急性GVHD患者预后较差(P<0.05);(2)非亲缘性骨髓移植患者的急、慢性GVHD发病率高于亲缘性骨髓移植(R-BMT)患者,但均无显著差异(P>0.05);(3)非清髓性外周血干细胞移植(NST)患者的急、慢性GVHD 发病率与R-BMT患者相比无显著差异(P>0.05),但激素耐药的急性 GVHD比例明显高于R-BMT患者(P<0.05).结论 GVHD是影响NST患者预后的主要因素,该类患者GVHD的预防和激素耐药的急性GVHD的治疗有待研究.【总页数】4页(P327-329,343)【作者】伏瑞祥;孙爱宁;仇惠英;唐晓文;傅铮铮;苗喵;马骁;刘跃均;吴德沛【作者单位】苏州大学附属第一医院,江苏省血液研究所,苏州,215006;苏州大学附属第一医院,江苏省血液研究所,苏州,215006;苏州大学附属第一医院,江苏省血液研究所,苏州,215006;苏州大学附属第一医院,江苏省血液研究所,苏州,215006;苏州大学附属第一医院,江苏省血液研究所,苏州,215006;苏州大学附属第一医院,江苏省血液研究所,苏州,215006;苏州大学附属第一医院,江苏省血液研究所,苏州,215006;苏州大学附属第一医院,江苏省血液研究所,苏州,215006;苏州大学附属第一医院,江苏省血液研究所,苏州,215006【正文语种】中文【中图分类】R733.05;R55.05【相关文献】1.异基因造血干细胞移植后肠道急性移植物抗宿主病24例临床分析 [J], 文钦;张诚;陈幸华;高力;高蕾;孔佩艳;张曦2.肝移植术后移植物抗宿主病六例临床分析 [J], 王跃;彭伟;张洪涛;李琳;陶开山;窦科峰;杨诏旭3.紫外线治疗仪在肠道移植物抗宿主病所致的肛周皮肤损伤中的应用及临床分析[J], 刘欣4.表现为特应性皮炎的移植物抗宿主病11例临床分析 [J], 魏瑾;张宇;徐宏俊;杜娟;陈周;蔡林;李文海;张建中5.异基因造血干细胞移植患者术后皮肤移植物抗宿主病的临床分析及护理对策 [J], 张婷;韩爱芝;龙章飚;葛健;杨明珍因版权原因,仅展示原文概要,查看原文内容请购买。
