化学键和分子结构(习题及答案)
化学键及分子化合物测试题(附详细答案)

化学键及分子化合物测试题(附详细答案)1. 下列分子中哪一个有离子键:- 氯气 (Cl<sub>2</sub>)- 氧气 (O<sub>2</sub>)- 硝酸 (HNO<sub>3</sub>)- 甲烷 (CH<sub>4</sub>)答案:硝酸 (HNO<sub>3</sub>)2. 下列化合物中哪一个是离子化合物:- 二氧化碳 (CO<sub>2</sub>)- 氯化钠 (NaCl)- 丙烷 (C<sub>3</sub>H<sub>8</sub>)- 甲醇 (CH<sub>3</sub>OH)答案:氯化钠 (NaCl)3. 分子式为C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>的化合物是以下哪一个:- 葡萄糖- 甲烷- 乙炔- 苯答案:葡萄糖4. 哪一种键是由电子共享形成的:- 离子键- 共价键- 隧道键- 金属键答案:共价键5. 下列化合物中,键的极性最小的是:- H<sub>2</sub>O- CO<sub>2</sub>- HCl- NH<sub>3</sub>答案:CO<sub>2</sub>6. 下列哪一种键是由金属原子形成的:- 离子键- 共价键- 隧道键- 金属键答案:金属键7. 分子式为H<sub>2</sub>SO<sub>4</sub>的化合物是以下哪一个:- 硫酸- 硝酸- 氯酸- 醋酸答案:硫酸8. 下列化合物中,含有三个氧原子的是:- 二氧化碳 (CO<sub>2</sub>)- 氯酸 (HClO<sub>3</sub>)- 亚硝酸 (HNO<sub>2</sub>)- 偏磷酸 (H<sub>3</sub>PO<sub>4</sub>)答案:亚硝酸 (HNO<sub>2</sub>)9. 化学键是原子间的相互作用力,下列哪一种化学键是最强的:- 离子键- 隧道键- 金属键- 氢键答案:离子键10. 下列化合物中,键的极性最大的是:- CO<sub>2</sub>- HCl- H<sub>2</sub>O- NH<sub>3</sub> 答案:HCl。
基础化学第二版李保山10 化学键与分子结构习题解答-学生
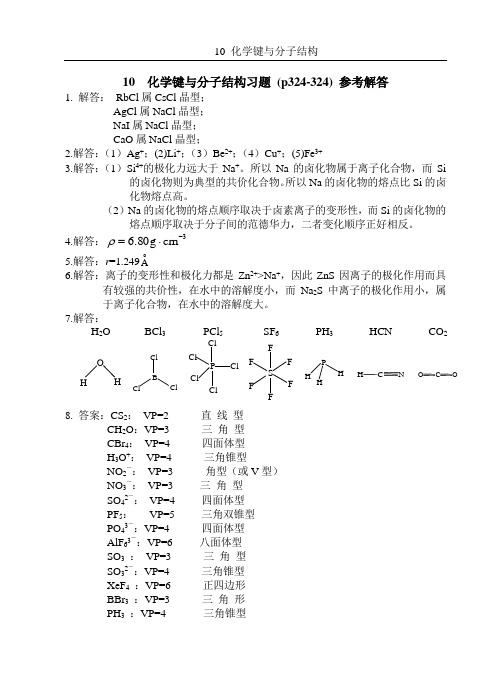
10 化学键与分子结构习题 (p324-324) 参考解答1. 解答: RbCl 属CsCl 晶型;AgCl 属NaCl 晶型;NaI 属NaCl 晶型;CaO 属NaCl 晶型;2.解答:(1)Ag +;(2)Li +;(3)Be 2+;(4)Cu +;(5)Fe 3+3.解答:(1)Si 4+的极化力远大于Na +。
所以Na 的卤化物属于离子化合物,而Si的卤化物则为典型的共价化合物。
所以Na 的卤化物的熔点比Si 的卤化物熔点高。
(2)Na 的卤化物的熔点顺序取决于卤素离子的变形性,而Si 的卤化物的熔点顺序取决于分子间的范德华力,二者变化顺序正好相反。
4.解答:3cm g 80.6-⋅=ρ5.解答:r =1.249o A6.解答:离子的变形性和极化力都是Zn 2+>Na +,因此ZnS 因离子的极化作用而具有较强的共价性,在水中的溶解度小,而Na 2S 中离子的极化作用小,属于离子化合物,在水中的溶解度大。
7.解答:H 2O BCl 3 PCl 5 SF 6 PH 3 HCN CO 2 OH B Cl Cl Cl PCl Cl Cl Cl ClS F F F F F F P H H C N H O C O8. 答案:CS 2: VP=2 直 线 型CH 2O :VP=3 三 角 型CBr 4: VP=4 四面体型H 3O +: VP=4 三角锥型NO 2-: VP=3 角型(或V 型)NO 3-: VP=3 三 角 型SO 42-: VP=4 四面体型PF 5: VP=5 三角双锥型PO 43-:VP=4 四面体型AlF 63-:VP=6 八面体型SO 3 : VP=3 三 角 型SO 32-:VP=4 三角锥型XeF 4 :VP=6 正四边形BBr 3 :VP=3 三 角 形PH 3 :VP=4 三角锥型H2S :VP=4 角型(或V型)CCl4:VP=4 四面体型NH4+:VP=4 四面体型9.答案:本题不适于8隅体规则。
高等有机化学各章习题及答案 (1)
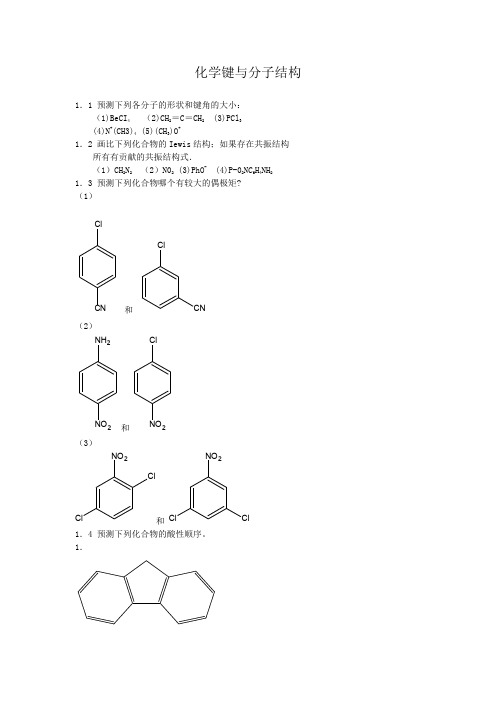
1.1 预测下列各分子的形状和键角的大小: (1)BeCI4 (2)CH2=C=CH2 (3)PCl3 (4)N+(CH3)4 (5)(CH3)O+
1.2 画比下列化合物的 Iewis 结构;如果存在共振结构 所有有贡献的共振结构式. (1)CH2N2 (2)N02 (3)PhO- (4)P-02NC6H4NH2
1.8 (2)和(7)不能形成分子间氢键 (1)HCN┈HCN (3)H2CO┈HOH
(6)H2NCH2CH2OH┈NH2CH2CH2OH
(4)Cl┈HOH
(5) (CH3)2CO┈HOOCC6H4OH
当第一个羧基上的 H+电离后,所形成的负离子是一个强的给电子基,它对第二个羧基所 发生的直接诱导,将使第二个羧基上好的电离趋于困难,这种影响也是顺式大于反式,所以 丁烯二酸的第二电离常数是顺式小于反式。这种诱导影响是通过空间或溶剂间的场效应传递 的。 1.6 (1)无芳香性
分子没有一个闭合的共轭体系,因而无芳香性,然后失去 H-以后生成的 A 为含有六个π 电子的离子,则具有芳香性。
1.8 下列各组化合物能否形成分子间氢键?若有的话,请画出分子间氢键。
(1)HCN 和 HCN (2)HCHO 和 HCHO
(3)HCHO 和 H2O
(4)Cl-和H
和丙酮
(6)HOCH2CH2NH2 和 HOCH2CH2NH2
答案: 1.1 (1)线性 (2)三个碳原子呈线型,氢位于相互垂直的平面上 (3)棱锥型,键角约
105~110°(4)正四面体 (5)棱锥型,键角约 105~110°。
1.2 (1) (2)
(3)
(4)
1.3 (1)Ⅰμ=2.5D Ⅱμ=3.4D (2)Ⅰμ=6.3D Ⅱμ=2.6D (3)Ⅰμ=3.48D Ⅱμ=2.68D
无机化学(上册):第9章 化学键与分子结构 习题答案
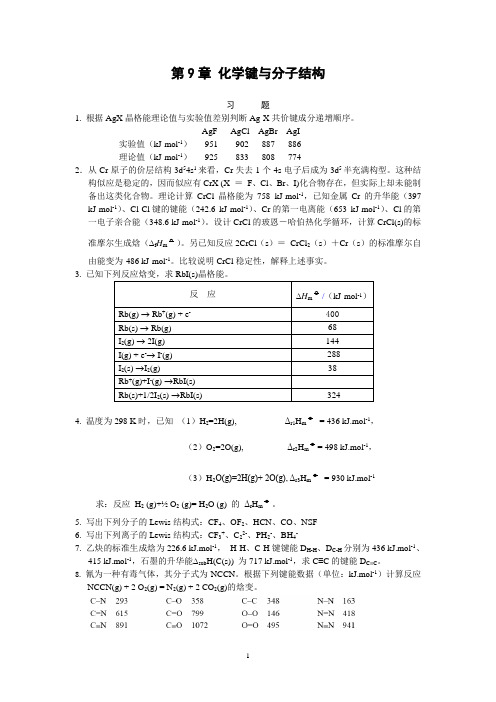
第9章化学键与分子结构习题1. 根据AgX晶格能理论值与实验值差别判断Ag-X共价键成分递增顺序。
AgF AgCl AgBr AgI实验值(kJ·mol-1)951 902 887 886理论值(kJ·mol-1)925 833 808 7742.从Cr原子的价层结构3d54s1来看,Cr失去1个4s电子后成为3d5半充满构型。
这种结构似应是稳定的,因而似应有CrX (X =F、Cl、Br、I)化合物存在,但实际上却未能制备出这类化合物。
理论计算CrCl晶格能为758 kJ·mol-1,已知金属Cr的升华能(397 kJ·mol-1)、Cl-Cl键的键能(242.6 kJ·mol-1)、Cr的第一电离能(653 kJ·mol-1)、Cl的第一电子亲合能(348.6 kJ·mol-1)。
设计CrCl的玻恩-哈伯热化学循环,计算CrCl(s)的标准摩尔生成焓(∆f H m o)。
另已知反应2CrCl(s)=CrCl2(s)+Cr(s)的标准摩尔自由能变为-486 kJ·mol-1。
比较说明CrCl稳定性,解释上述事实。
3.4. 温度为298 K时,已知(1)H2=2H(g), Δr1H m o= 436 kJ.mol-1,(2)O2=2O(g), Δr2H m o= 498 kJ.mol-1,(3)H2O(g)=2H(g)+ 2O(g), Δr3H m o= 930 kJ.mol-1 求:反应H2 (g)+½ O2 (g)= H2O (g) 的Δr H m o。
5. 写出下列分子的Lewis结构式:CF4、OF2、HCN、CO、NSF6. 写出下列离子的Lewis结构式:CF3+、C22-、PH2-、BH4-7. 乙炔的标准生成焓为226.6 kJ.mol-1,H-H、C-H键键能D H-H、D C-H分别为436 kJ.mol-1、415 kJ.mol-1,石墨的升华能∆sub H(C(s)) 为717 kJ.mol-1,求C≡C的键能D C≡C。
化学键和分子结构(习题及答案)

1
General Chemistry
Chapter 3 Homework
5.下列分子中含有极性键的非极性分子是( A ) A.BeCl2 A.O2B.H2S B.S2C.F2 C.FD.HBr 6.下列物种中,变形性最大的是( B )。 D.Cl7. 下列物质中只需克服色散力即沸腾的是( D ) A.HCl B.Cu C.CH2Cl2 D.CS2
9
8. 下列化合物中存在氢键的是( C )
A.HCl B.C2H5OC2H5 C.HNO3 D.CH3F
形成氢键要具备两个条件: ① 分子中必须有电负性较大而半径较小的元素(X=F、O、 N),并与H形成共价键; ② 分子中还必须有另外一个电负性大而半径小,有孤对电子的 原子(Y=F、O、N) 。
2
General Chemistry
2012-8-2
ionic bond theory
11
General Chemistry
Chapter 3 Molecular Structure
影响离子变形性的因素: ① 离子的半径。半径越大,变Байду номын сангаас性越大。 如:I->Br- >Cl- >F② 离子的电荷。负离子电荷越高,变形性越大,正离子电 荷越高,变形性越小。
如: O2- > F- >Na+ > Mg2+ > Al3+ >Si4+
③ 离子的电子构型。 18电子构型、 9~17电子构型>8电子构型 ④ 复杂离子的变形性通常不大,且复杂离子中心原子氧 化数越高,变形性越小。 如: I->Br- >OH- > NO3- >F- >ClO49
2012-8-2
化学键与分子结构练习题(附答案)

)
A
一般来说键键能小于键键能; 原子形成共价键的数目等于基态原子的未成对电子数; 相同原子间的双键键能是单键键能的两倍; 所有不同原子间的键至少具有弱极性.
提交
B
C
D
多选题
1分
下列说法中不正确的是(
)
A B C D E
键的一对成键电子的电子密度分布对键轴方向呈园柱型对称;
键电子云分布是对通过键轴的平面呈镜面对称; 键比键活泼性高,易参与化学反应;
提交
知识点
电子层构型 晶格能大小 共价键:单电子,自选相反,最大重叠 杂化轨道:中心原子杂化类型 几何构型
溶解度大小
熔点和硬度的高低 离子极化理论
直线型、平面正三角、正四面体、三角双锥、 正八面体 晶体类型 分子间作用力
单选题
1分
下列离子属于18电子构型的是 ( )
A
Na+ Ag+ Fe3+ Fe2+
提交
A
B
C
D
多选题
1分
下列说法正确的是(
)
A B C D E
原子形成的共价键数等于游离气态原子中不成对电子数; 同种原子双键的键能为单键键能的两倍; 键长是指成键原子的核间距离; 线性分子如A-B-C是非极性的; 共价键的极性是由成键元素的电负性差造成的.
提交
单选题
1分
关于共价键的说法,下述说法正确的是(
NaF>NaCl>NaBr>NaI NaCl<MgCl2<AlCl3<SiCl4 LiF>NaCl>KBr>CsI Al2O3>MgO>CaO>BaO
提交
B
专题训练(化学键与分子结构)
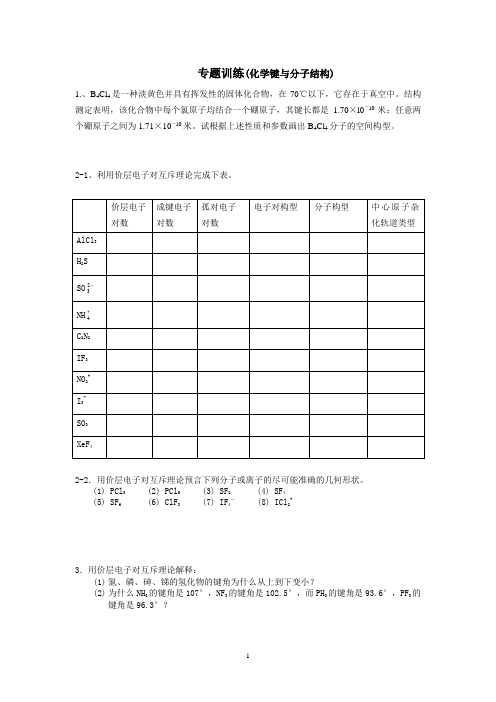
专题训练(化学键与分子结构)1.、B4Cl4是一种淡黄色并具有挥发性的固体化合物,在70℃以下,它存在于真空中。
结构测定表明,该化合物中每个氯原子均结合一个硼原子,其键长都是1.70×l0-10米;任意两个硼原子之间为1.71×10-10米。
试根据上述性质和参数画出B4Cl4分子的空间构型。
2-1、利用价层电子对互斥理论完成下表。
2-2.用价层电子对互斥理论预言下列分子或离子的尽可能准确的几何形状。
(1) PCl3 (2) PCl5 (3) SF2 (4) SF4(5) SF6 (6) ClF3 (7) IF4- (8) ICl2+3.用价层电子对互斥理论解释:(1)氮、磷、砷、锑的氢化物的键角为什么从上到下变小?(2)为什么NH3的键角是107°,NF3的键角是102.5°,而PH3的键角是93.6°,PF3的键角是96.3°?4、(1) 根据价层电子对互斥理论预测SCl3+和ICl4-的几何构型,给出每种情况下中心原子的氧化态和杂化类型。
(2) 给出Cl—S—Cl键角的合理的数值范围。
(3) 试比较S—Cl和I—Cl键中,哪一个键长?为什么?5、已知等电子体间具有相似的空间构型和成键形式,SO3、BF3、NO3-、CO32-互为等电子体。
(1)指出上述等电子体的空间构型和成键情况;(2)为什么上述等电子体不包括SiO32-?(3)列举与N2为等电子体的分子或离子4种(4)如果把BF3与乙醚放在一起,BF3键长从130pm增加到141pm,试问所成新化合物的成键情况及其极性如何?6、等电子原理通常是指原子数和价层电子数都相同的化合物,可能具有相似的结构。
例如:CO32-、SO3、NO3-都有24个价电子,都为平面三角形结构,都有3个σ键和1个∏46键。
讨论以下化合物或离子的结构。
(1)SCl3+和PCl3是等电子体, SCl3+空间构型是,S以杂化轨道与Cl形成共价键。
第2章化学键与分子结构

第2章化学键与分子结构第2章化学键与分子结构习题一、思考题1.什么叫共价键的饱和性和方向性?为什么共价键具有饱和性和方向性,而离子键无饱和性和方向性?2.举例说明什么是σ键,什么是π键?它们有哪些不同?3.价键理论和分子轨道理论的基本要点是什么?4.s、p原子轨道主要形成哪几种类型的杂化轨道?中心原子利用上述杂化轨道成键时,其分子构型如何?5.实验测定BF3为平面三角形,而[BF4]-为正四面体形。
试用杂化轨道的概念说明在BF3和[BF4]-中硼的杂化轨道类型有何不同?6.试用分子轨道表示式写出O2+的电子构型。
7.分子间力有几种?各种力产生的原因是什么?试举例说明极性分子之间、极性分子和非极性分子之间以及非极性分子之间的分子间力。
在大多数分子中以哪一种分子间力为主?8.何为极性分子和非极性分子?分子的极性与化学键的极性有何联系?9.分子间力的大小对物质的物理性质有何影响?10.什么叫做氢键?哪些分子间易形成氢键?形成氢键对物质的性质有哪些影响?11.氢键与化学键有何区别?与一般分子间力有何区别?12.下列各化合物中分子间有氢键的有哪几种?C2H6,NH3,C2H5OH,H3BO3,CH4。
13.写出下列物质的晶体类型:SO2,SiC,HF,KCl,MgO。
14.晶体有几种类型?确定晶体类型的主要因素是什么?各种类型晶体的性质有何不同?15.根据下列物质的性质,判断它们是属于何种类型的晶体。
(1)CaCO3晶体的硬度高,在1173K时尚未熔融就已分解。
(2)B的硬度极高,熔点为2573K,导电性很差。
(3)SnCl4熔点为240K,沸点为387K16.要使BaF2,F2,Ba,Si晶体熔融,需分别克服何种作用力?二、是非题(对的在括号内填“√”号,错的填“×”号)1.共价键的重叠类型有σ键π键两种。
()2.NH3和BF3都是4原子分子,所以二者空间构型相同。
()3.He2的分子轨道表示式为(σ1s)2(σ1s*)2。
(完整版)化学键练习题及答案

化学键练习题及答案一、选择题:1.下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是A.6和B.11和1C.11和1D.12和172.下列微粒中,既含有离子键又含有共价键的是A.CaB.H2OC.Na2O D.MgCl23.下列性质中,可以证明某化合物内一定存在离子键的是A.可溶于水 B.有较高的熔点 C.水溶液能导电 D.熔融状态能导电4.下列表示电子式的形成过程正确的是5.NaF、NaI、MgO均为离子化合物,现有下列数据,试判断这三种化合物的熔点6.下列过程中,共价键被破坏的是:A.碘晶体升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水二、选择题7.M元素的一个原子失去2个电子,该2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中,正确的是A.Z的熔点较低 B.Z可表示为M2YC.Z一定溶于水中 D.M形成+2价阳离子8.80年代,科学研制得一种新分子,它具有空心的类似足球状的结构,分子式为C60。
下列说法正确的是A.C60是一种新型的化合物 B.C60含有离子键C.C60和金刚石都是碳元素组成的单质 D.C60中的化学键只有共价键9.膦又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,它的分子呈三角锥形。
以下有关PH3的叙述正确的是A.PH3是非极性分子 B.PH3分子中有未成键的电子对C.PH3是一种强氧化剂D.PH3分子中P—H键是非极性键10.1999年曾报道合成和分离了含高能量正离子N的化合物 N5AsF,下列叙述错误的是A.N正离子共有34个核外电子 B.N中氮—氮原子间以共用电子对结合C.化合物N5AsF6中As化合价为+1 D.化合物N5AsF6中F化合价为-111.下列各组物质中,都是共价化合物的是A.H2S和Na2OB.H2O2和CaFC.NH3和ND.HNO3和HClO312.A+、B2+、C-、D2-四种离子具有相同的电子层结构。
(完整版)化学键习题及答案

化学键一、离子键1、下列说法正确的是( D )A.含有金属元素的化合物一定是离子化合物B.第IA族和第VIIA族原子化合时,一定生成离子键C.由非金属元素形成的化合物一定不是离子化合物D.活泼金属与非金属化合时,能形成离子键2、与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是( AD ) A. Na2S B. CCl4 C. KCl D. KF3、下列说法正确的是:( D )A.离子键就是使阴、阳离子结合成化合物的静电引力B.所有金属与所有非金属原子之间都能形成离子键C.在化合物CaCl2中,两个氯离子之间也存在离子键D.钠原子与氯原子结合成氯化钠后体系能量降低4、下列各数值表示有关元素的原子序数,能形成AB2型离子化合物的是: ( D )A.6与8B.11与13C. 11与16D.12与17二、电子式1.下列电子式有误的是( BC )A.氯原子• Cl∶ B.硫离子∶S∶ C.溴离子 [∶Br∶] D.钙离子Ca2+2.下列用电子式表示化合物的形成过程正确的是:( A )3. 用电子式表示下列离子化合物的形成过程:(1)Na2O (2)MgBr24.下列化合物电子式书写正确的是( BD )A.Ca2+[∶Cl∶]-2B.Na+[∶S∶]2-Na+C. [Mg2+][∶O∶]2-D. Na+[∶F∶]-三、共价键1.下列物质中含有共价键的离子化合物是( AB )A.Ba(OH)2B.CaCl2C.H2OD.H22、下列既含有离子键又含有共价键的化合物是( B )A.HI B.NaOH C.Br2 D.NaCl3.下列电子式书写正确的是( A )A.∶N ∶∶∶N ∶B.H ∶N ∶HC.H +[∶O ∶]2-H +D.Na +[∶Cl ∶]-4.下列说法中正确的是( AD )A.含有离子键的化合物必是离子化合物B.具有共价键的化合物就是共价化合物C.共价化合物可能含离子键D.离子化合物中可能含有共价键四、化学键1.下列物质中,不存在化学键的是( D )A.水B.食盐C.氯气D.氦气2.下列各分子中,化学键类型有差异的是( B )A.H2O 、CO2B.MgF2、H2O2C.NaOH 、Ba(OH)2D.NaCl 、KCl3、下列说法正确的是 ( D )A.含有金属元素的化合物一定是离子化合物B.第ⅠA 族和第ⅦA 族原子化合时,一定生成离子键C.由非金属元素形成的化合物一定不是离子化合物D.活泼金属与非金属化合时,能形成离子键其中A 项AlCl3是共价化合物;B 项HCl 是共价键;C 项如NH4Cl 是离子化合物。
原子结构-化学键-分子结构

原子结构-化学键-分子结构work Information Technology Company.2020YEAR原子结构、化学键、分子结构习题1.判断下列叙述是否正确(1)电子具有波粒二象性,故每个电子都既是粒子又是波。
(2)电子的波动性是大量电子运动表现出的统计性规律的结果。
(3)波函数,即电子波的振幅。
(4)波函数Ψ,即原子轨道,是描述电子空间运动状态的数学函数式。
(1)(2)(3)(4)2. 用原子轨道光谱学符号表示下列各套量子数:(1) n =2, l = 1, m = –1 (2) n =4, l = 0, m =0 (3) n =5, l = 2, m =02 (1)2p (2) 4s (3) 5d3. 假定有下列电子的各套量子数,指出哪几套不可能存在,并说明原因。
(1) 3,2,2,1/2 (2) 3,0,–1,1/2 (3) 2, 2, 2, 2(4) 1, 0, 0, 0, (5) 2,–1,0, –2/1 (6) 2,0,–2,1/23. (1)存在,为3d 的一条轨道;(2) 当l=0时,m只能为0,或当m=±1时,l可以为2或1。
(3) 当l=2时,n应为≥3正整数,m s=+1/2或-1/2;或n=2时l=0 m=0 m s=+1/2或-1/2;l=1 m=0或±1,m s=+1/2或-1/2;(4)m s=1/2或–1/2 ;(5)l不可能有负值;(6)当l=0时,m只能为04.指出下列各电子结构中,哪一种表示基态原子,哪一种表示激发态原子,哪一种表示是错误的?(1)1s22s2 (2) 1s22s12d1 (3) 1s22s12p2(4) 1s22s22p13s1 (5) 1s22s42p2 (6) 1s22s22p63s23p63d15.符合下列每一种情况的各是哪一族哪一元素?(1)最外层有6个p电子。
(2)3d轨道无电子,n =4,l = 0的轨道只有1个电子。
结构化学课后习题答案

结构化学课后习题答案结构化化学课后习题答案一、化学键与分子结构1. 选择题a) 正确答案:D解析:选择题中,选项D提到了共价键的形成是通过电子的共享,符合共价键的定义。
b) 正确答案:B解析:选择题中,选项B提到了离子键的形成是通过电子的转移,符合离子键的定义。
c) 正确答案:C解析:选择题中,选项C提到了金属键的形成是通过金属原子之间的电子云重叠,符合金属键的定义。
d) 正确答案:A解析:选择题中,选项A提到了氢键的形成是通过氢原子与高电负性原子之间的吸引力,符合氢键的定义。
2. 填空题a) 正确答案:共价键解析:填空题中,根据问题描述,两个非金属原子之间的键称为共价键。
b) 正确答案:离子键解析:填空题中,根据问题描述,一个金属原子将电子转移到一个非金属原子上形成的键称为离子键。
c) 正确答案:金属键解析:填空题中,根据问题描述,金属原子之间的电子云重叠形成的键称为金属键。
d) 正确答案:氢键解析:填空题中,根据问题描述,氢原子与高电负性原子之间的吸引力形成的键称为氢键。
二、有机化学1. 选择题a) 正确答案:C解析:选择题中,选项C提到了烷烃是由碳和氢组成的,符合烷烃的定义。
b) 正确答案:D解析:选择题中,选项D提到了烯烃是由含有一个或多个双键的碳原子组成的,符合烯烃的定义。
c) 正确答案:B解析:选择题中,选项B提到了炔烃是由含有一个或多个三键的碳原子组成的,符合炔烃的定义。
d) 正确答案:A解析:选择题中,选项A提到了芳香烃是由芳香环结构组成的,符合芳香烃的定义。
2. 填空题a) 正确答案:醇解析:填空题中,根据问题描述,含有羟基(-OH)的有机化合物称为醇。
b) 正确答案:醚解析:填空题中,根据问题描述,含有氧原子连接两个碳原子的有机化合物称为醚。
c) 正确答案:酮解析:填空题中,根据问题描述,含有羰基(C=O)的有机化合物称为酮。
d) 正确答案:酯解析:填空题中,根据问题描述,含有羧基(-COO)的有机化合物称为酯。
无机化学第四章化学键与分子结构补充习题

第四章化学键与分子构造增补习题【选择题】1.以下卤化物中,离子键成分大小次序正确的选项是()。
A.CsF>RbCl>KBr>NaI B.CsF>RbBr>KCl>NaFC.RbBr>CsI>NaF>KCl D.KCl>NaF>CsI>RbBr2.以下物质中沸点高低次序正确的选项是()。
A.H2Te>H2Se>H2S>H2O B.H2Se>H2S>H2O>H2Te;C.H2O>H2S>H2Se>H2Te D.H2O>H2Te>H2Se>H2S3.既能权衡元素金属性强弱,又能权衡其非金属性强弱的物理量是()。
A.电负性B.电离能C.电子亲和能D.偶极矩4.Pb2+、Bi3+离子均属何种电子构型()。
A.18B.18+2C.8D.9~175.以下离子型化合物熔点最低的是()。
A.NaF B.BaO C.SrO D.MgO 6.以下各化学键中极性最大的是()。
A.B-Cl B.Ba-Cl C.Be-Cl D.Br-Cl7.以下分子中属于非极性分子的是()。
A.CHCl3B.PCI3C.CO2D.HCl8.以下分子中,空间构型不是直线的是()。
A.CO B.H2O C.CO D.HgCI229.以下说法中错误的选项是()。
A.杂化轨道有益于形成σ键B.杂化轨道均参加成键C.采纳杂化轨道成键,更能知足轨道最大重迭原理D.采纳杂化轨道成键,能提升原子成键能力10.BF4-离子中,B原子采纳的杂化轨道是()。
A.spB.sp2C.sp3D.不等性sp3 11.以下分子中,构型是平面三角形的分子是(A.CO2 B.PCl3)。
C.BCl3D.NH312.以下分子中键角最大的是()。
A.PCl3 B.NH3C.SiCl4D.CO2 13.以下对于杂化轨道理论的说法中正确的选项是()。
第11章化学键和分子结构(精)

第11章化学键和分⼦结构(精)第11章化学键和分⼦结构思考题1. ⾦属阳离⼦有⼏种电⼦构型?阳离⼦的极化作⽤与电⼦构型的关系如何?解:⾦属阳离⼦有⼆种类型的电⼦构型:(1)形成稀有⽓体的电⼦构型(2电⼦型和8电⼦型)(2)形成⾮稀有⽓体的电⼦构型ⅰ)9~17电⼦型:n s2 n p6 n d1~9(离⼦最外层电⼦数为9~17个)ⅱ)18电⼦型:n s2 n p6 n d10ⅲ)18+2电⼦型:(n-l)s2 (n-l)p6 (n-l)d10 n s2极化⼒与电⼦构型有关,极化⼒⼤⼩次序如下:8电⼦型<9~17电⼦型<18及18+2 电⼦型。
2. 简要说明离⼦特征对离⼦极化⼒和变形性的影响。
解:(1)离⼦特征对离⼦极化⼒的影响:a、离⼦的电荷:在离⼦半径相近、外层电⼦构型相同的条件下,离⼦的正电荷越多,极化⼒越⼤;b、离⼦的半径:在离⼦的外层电⼦构型相同、电荷相同的条件下,离⼦的半径越⼩,极化⼒越⼤;c、离⼦的电⼦构型:在离⼦的半径相近、电荷相同的情况下,不同电⼦构型的阳离⼦,其极化作⽤⼤⼩如下:18、18+2电⼦型>9~17电⼦型>8电⼦型。
d、复杂离⼦的极化⼒相对较⼩。
(2)离⼦特征对离⼦变形性的影响a、离⼦的半径:在离⼦的外层电⼦构型相同、电荷相同的条件下,离⼦的半径越⼤,变形性越⼤;b、离⼦的电荷:在离⼦外层电⼦构型相同的条件下,离⼦的正电荷越少、负电荷越多,变形性越⼤;c、离⼦的电⼦构型:在离⼦的半径相近、电荷相同的情况下,18和18+2电⼦型及9-17电⼦型的离⼦⽐8电⼦型的离⼦变形性要⼤。
3. 以银的卤化物AgX为例说明离⼦的相互极化作⽤对物质颜⾊、⽔溶性、热稳定性的影响。
解: Ag+为18电⼦型阳离⼦,极化作⽤较强,卤素阴离⼦的变形性越⼤,相互极化作⽤越强。
故有相互极化作⽤的强弱顺序:AgF<AgCl<AgBr<AgI化合物颜⾊依次渐深;⽔溶性依次减弱;热稳性依次降低。
4. 原⼦轨道重叠形成共价键必须满⾜哪些原则?σ键和π键有何区别?解: 含有成单电⼦的原⼦轨道发⽣最⼤重叠才可以形成稳定的共价键。
分子结构习题及答案

分子结构习题及答案第四章分子结构习题1.是非判断题1-1化学键是相邻原子与原子(或离子与离子)之间的强烈相互作用。
1-2 50Sn2+是18+2电子构型,50Sn4+是18电子构型。
1-3 Al3+,Ba2+,Si(IV)的电子构型都属于8电子构型。
1-4具有未成对电子的两个原子相互接近时可以形成稳定的共价键。
1-5原子形成共价键的数目等于基态原子的未成对电子数。
1-6σ键的特点是原子轨道沿键轴方向重叠,重叠部分沿键轴呈圆柱形对称。
1-7一般来说,σ键的键能比π键键能小。
1-8 s电子与s电子配对形成的键一定是σ键,p电子与p电子配对形成的键一定为π键。
1-9两个σ键组成一个双键。
1-10键的强度与键长无关。
1-11所有非金属元素之间形成的化合物都不是离子化合物。
1-12μ=0的分子,其化学键一定是非极性键。
1-13共价键具有饱和性的原因在于每个原子提供一定数目的自旋方向相反的未成对电子。
1-14原子核外有几个未成对电子,就能形成几个共价键。
1-15共价键类型可以分为σ键和π键,π键的键能小于σ键的键能,因此π键的稳定性弱于σ键。
1-16烷烃分子中C-H键的键能为413 KJ·mol-1,因此提供413KJ·mol-1的能量能使甲烷和乙烷分子中C-H键断裂。
1-17沿键轴方向的s轨道和p轨道进行重叠可形成π键。
1-18原子轨道相互重叠应满足最大重叠原理,所以沿键轴以“头碰头”方式才能成键。
1-19原子轨道之所以要发生杂化是因为能增大成键能力。
1-20 sp3杂化是,s轨道的主量子数和p轨道的主量子数可以是不同的,也可以是相同的。
1-21 1个s轨道和3个p轨道,形成1个sp3杂化轨道。
1-22在sp,sp2,sp3杂化中,杂化轨道的成键能力随s轨道成分增多而增强。
1-23发生轨道杂化的原子轨道可以具有成对电子。
1-24原子轨道发生杂化,若轨道上有孤对电子存在,这类杂化是不等性的。
化学键与分子结构习题

化学键与分⼦结构习题第2章化学键与分⼦结构习题1.选择题2-1.下列关于化学键的描述正确的是……………………………………………………( )(A) 原⼦与原⼦之间的相互作⽤; (B) 分⼦之间的⼀种相互作⽤;(C) 相邻原⼦之间的强烈相互作⽤; (D) 相邻分⼦之间的强烈相互作⽤; 2-2.下列各组卤化物中,化学键的离⼦性依次增强的是………………………… ( )(A) KI ,KBr ,KCl ,KF (B) NaF ,NaCl ,NaBr ,NaI(C) RbBr ,RbI ,RbF ,KCl (D) KCl ,NaF ,C s I ,RbBr2-3.下列各组分⼦或离⼦中,中⼼原⼦都采⽤sp 3杂化轨道成键且构型⼜都为⾓形的是………………………………………………………………………………………… ( )(A) OF 2、ClO 2﹣、NH 2﹣ (B) NCl 3、PO 43﹣ (C) SO 2、NO 3﹣ (D) BeCl 2、CO 2 2-4.下列分⼦或离⼦中,键⾓最⼩的是…………………………………………………( )(A) HgCl 2 (B) H 2O (C) NH 3 (D) CH 42-5.下列化学键中,极性最弱的是………………………………………………………()(A) H —F (B)H —O (C) O —F (D) C —F2-6.下列氟化物分⼦中,分⼦的偶极矩不为0的是…………………………………()(A) PF 5 (B) BF 3 (C) IF 5 (D) XeF 42-7.下列分⼦或离⼦中,键⾓最⼤的是…………………………………………………()(A) XeF 2 (B) NCl 3 (C)-23CO (D)4PCl2-8.下列各体系中,溶质和溶剂分⼦之间,三种范德华⼒和氢键都存在的是…()(A) I 2的CCl 4溶液(B) I 2的酒精溶液 (C) 酒精的⽔溶液 (D) CH 3Cl 的CCl 4溶液2-9.下列分⼦中,磁矩不为0的是………………………………………………………()(A) PF 5 (B) ClF 3 (C) ClO 2 (D) XeF 42-10.为确定分⼦式为XY 2的共价分⼦是直线形还是⾓形的,最好要测定它的()(A)与另⼀个化合物的反应性能(B) 偶极矩 (C) 键能 (D) 离⼦性百分数2-11.下列分⼦中C 与O 之间键长最短的是……………………………………………()(A) CO (B) CO 2 (C) CH 3OH (D) CH 3COOH2-12.下列各组原⼦轨道中不能重叠成键的是……………………………………()(A) p x–p x (B) p x–p y(C) s–p x(D) s–p z2-13.下列说法中正确的是……………………………………………………………()(A) BCl3分⼦和B—Cl键都是⾮极性的(B) BCl3分⼦和B—Cl键都是极性的(C) BCl3分⼦是极性分⼦,⽽B—Cl键是⾮极性键(D) BCl3分⼦是⾮极性分⼦,⽽B—Cl键是极性键2-14.下列分⼦或离⼦中键级由⼤到⼩的是……………………………………( )(A) O2>N2>F2>O2+ (B) O2>O2+>F2>N2(C) O2>N2>O2+>F2 (D) N2>O2+>O2>F22-15.下列关于分⼦间⼒的说法正确的是……………………………………… ( )(A)分⼦量⼤的分⼦型物质的沸点⼀定⾼;(B)⼤多数含氢化合物中都存在氢键;(C)极性分⼦间仅存在取向⼒;(D)⾊散⼒存在于所有相邻分⼦间。
大学化学分子结构习题带答案

1.离子晶体中的化学键都是离子键。
()1.错2.CO 分子含有配位键。
()2.对3.所有分子的共价键都具有饱和性与方向性,而离子键没有饱和性与方向性。
()3.错4. 中心原子所形成的杂化轨道数等于参加杂化的原子轨道数。
()4.对5. 原子轨道发生杂化后可以增强成键能力。
()5.对6. 杂化轨道具有能量相等、空间伸展方向一定的特征。
()6.对7. 凡是中心原子采取sp3杂化轨道成键的分子,其空间构型都是正四面体。
()7.错8. 在任何情况下,每一个sp2杂化轨道所含的s、p成分均相同。
()8.错9. 由分子轨道理论可推知 O2-、O22-都比 O2稳定。
()9.错10. 按照分子轨道理论,N2+和 N2-的键级相等。
()10.对11. 色散力存在于一切分子之间。
()11.对12. 弱极性分子之间的分子间力均以色散力为主。
()12.对13. 氢键只存在于 NH3、H2O、HF 的分子之间,其它分子间不存在氢键。
()13.错14. 根据价层电子对互斥理论,分子或离子的空间构型取决于中心原子的价层电子对数。
()14.对15. 对 AB m型分子 ( 或离子 ) 来说,当中心原子 A 的价电子对数为 m 时,分子的空间构型与电子对在空间的构型一致。
()15.对16. AsF5是三角双锥形分子。
()16.错17. SO42-、ClO4-、PO43-的空间构型相同。
()17.对18. 下列化合物中既有离子键又有共价键和配位键的是()。
18.D(A) KF; (B) H2SO4; (C) CuCl2; (D) NH4NO3。
19. 关于离子键的本性,下列叙述中正确的是()。
19.D(A) 主要是由于原子轨道的重叠; (B) 由一个原子提供成对共用电子;(C) 两个离子之间瞬时偶极的相互作用; (D) 正、负离子之间的静电吸引为主的作用力。
20. 下列各组卤化物中,离子键成分大小顺序正确的是()。
20.A(A) CsF > RbCl > KBr > NaI;(B) CsF > RbBr > KCl > NaF;(C) RbBr > CsI > NaF > KCl;(D) KCl > NaF > CsI > RbBr。
高二化学分子结构练习题及答案

高二化学分子结构练习题及答案一、选择题1. 以下物质中具有离子键的是:A. 水B. 乙烷C. 氯化铜D. 甲烷答案:C2. 分子中存在单独的分子之间以氢键连接的是:A. 液氨B. 哌嗪C. 碳酸氢铵D. 乙烯答案:B3. 以下物质中属于共价键的是:A. 氮化锂B. 磷酸氢二铵C. 氧化钠D. 氢氧化钠答案:B4. 下列化学式中,哪一种有极性键?A. HClB. O₂C. COD. N₂答案:A5. 以下物质中,氧、氮、碳原子的电子结构分别是:A. 2,5,6B. 2,8,6C. 2,7,5D. 2,5,4答案:B二、填空题1. 具有分子式 C₃H₈O 的化合物有 ______ 种同分异构体。
答案:32. 分子式为 H₂O₂的化合物是 ______。
答案:过氧化氢3. 以下化学键属于离子键的是 ______。
答案:NaCl4. 以下物质中,属于分子式的是 ______。
答案:CO₂5. 共价键中,电子的共用是指 ______。
答案:原子间电子云的重叠三、解答题1. 说明离子键的形成原理及特点,并给出一个具体例子。
答案:离子键是由于两种或多种不同电负性原子之间电子的转移而形成的。
在化学键中,较强的电负性原子会从较弱的电负性原子那里接受一个或多个电子,形成带正电荷的离子和带负电荷的离子,互相吸引而形成化学键。
离子键通常在金属与非金属元素之间形成。
例如,氯化钠(NaCl)中钠原子会失去一个电子,形成正离子Na⁺,而氯原子会获得一个电子,形成负离子Cl⁻,它们通过电子的吸引力相互结合,形成离子键。
离子键的特点包括:离子键通常是由金属离子和非金属离子之间形成的,它们具有强的电荷吸引力;离子键的键能通常较高,所以离子化合物具有较高的熔点和沸点;离子键在溶液中能够导电,因为带电的离子能够自由移动。
2. 说明共价键的形成原理及特点,并给出一个具体例子。
答案:共价键是由于两个或多个非金属原子之间的原子间电子云的重叠而形成的。
化学键与分子结构练习题

化学键与分子结构练习题一.选择题1.以下化合物的熔点顺序为()。
(a)sicl4>kcl>sibr4>kbr(b)kcl>kbr>sibr4>sicl4(c)sibr4>sicl4>kbr>kcl(d)kcl>kbr>sicl4>sibr42、下列物质在水溶液中溶解度最小的是()。
(a)nacl(b)agcl(c)cas(d)ag2s3.当下列化合物(C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C,C)的熔点达到熔点时(c)sio2>hf>hcl(d)hf>sio2>hcl5.乙醇(78℃)的沸点远高于乙醚(35℃),主要原因是()。
(a)由于不同的相对分子量(b)由于不同的分子极性(c)由于乙醇分子之间的氢键(d)由于乙醇分子之间的强取向力。
6.以下粒子半径从大到小的顺序为()。
(a)cl-、k+、ca2+、na+(b)cl-、ca2+、k+、na+(c)na+、k+、ca2+、cl-(d)k+、ca2+、cl-、na+7、下列固态物质由独立小分子构成的是()。
(a)金刚石(b)铜(c)干冰(d)食盐8、在下列化合物中()不具有孤对电子。
(a)h2o(b)nh+3(c)nh4(d)h2s9、形成hcl分子时原子轨道重叠是()。
(a)s―s重叠(b)py―py(或py-py)重叠(c)s―px重叠(d)px―px重叠10.中心原子仅通过SP杂化轨道()键合。
(a) becl2和hgcl2(b)co2和cs2(c)h2s和h2o(d)bbr3和ccl411、bcl3分子几何构型是平面三角形,b与cl所成键是()。
化学键与分子结构练习题

化学键与分子结构练习题1.下列分子中偶极矩最大的是( )。
A、HCl;B、HI;C、HBr;D、HF。
2.决定共价键极性强弱的主要因素是( D )。
A、键角;B、键长;C、范德华(VanderWaals)力;D、成键原子间电负性差。
3.下列关于范德华(vanderWaals)力的叙述中,错误的是(D)。
A、非极性分子间没有取向力;B、色散力通常是主要的;C、分子的极性越大,取向力越大;D、极性分子间没有色散力。
4.已知CO2的偶极矩为零,对于CO2分子的下列叙述中错误的是( )。
A、CO2中存在极性共价键;B、CO2是结构对称的直线形分子;C、CO2中仅有非极性共价键;D、CO2是非极性分子。
5.下列叙述中错误的是( )。
A、同核双原子分子必定是非极性分子;B、异核双原子分子必定是极性分子;C、分子中键的极性越强,分子的极性也越强;D、通常分子中成键原子间电负性差决定了键的极性强弱。
6.下列化合物中,含有极性键的是( B )。
A、P4;B、BF3;C、I2;D、S8。
7.下列化合物中,含有非极性键的是( B )。
A、BF3;B、P4;C、CO2;D、H2S。
8.分子间取向力的产生取决于分子的()。
A、固有偶极;B、诱导偶极;C、瞬时偶极;D、以上三种都可以。
9.由诱导偶极产生的分子间力属于()。
A、范德华(vanderwaals)力;B、共价键;C、离子键;D、氢键。
10.分子间力的本质是()。
A、化学键;B、原子轨道重叠;C、磁性作用;D、电性作用。
11.在液态HCl中,分子间作用力主要是()。
A、取向力;B、诱导力;C、色散力;D、氢键。
12.下列物质中,沸点最高的是()。
A、He;B、Ne;C、Ar;D、Kr。
13.HCl、HBr、HI的熔、沸点依次升高,其主要原因是()。
A、键能依次减弱;B、键长依次增长;C、色散作用依次增强;D、Cl、Br、I的电负性依次减小。
14.对于一个反键分子轨道,下列叙述中正确的是( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5
General Chemistry
Chapter 3 Homework
2. 将下列化合物按熔点从高到低的顺序排列:
NaF SiF4 NaBr SiBr4 NaCl SiCl4 NaI SiI4 NaF >NaCl> NaBr> NaI> SiI4> SiBr4> SiCl4 >
kJ∙mol-1,碘的离解能为151 kJ∙mol-1,碘的电子亲合能为-310.5
kJ∙mol-1,求碘化钾的生成热(△fHm⊙)。 解: K(s) + 1/2I2(s) △fHm⊙
KI(s)
△subHm
△subHm
1/2I2(g)
△disHm
I(g)
EA
U
I-(g)
K(g)
I
+ K+(g)
△fHm⊙= △subHm(K)+I(K)+1/2 △subHm(I2)
能影响物质熔沸点)
(1) NH3和PH3 (3) Br2和ICl (5) SiO2和SO2
(2) PH3和SbH3 (4) MgO和Na2O (6) SnCl2和SnCl4
(1) NH3>PH3 (2) PH3<SbH3 (3) Br2<ICl (4) MgO>Na2O (5) SiO2>SO2 (6) SnCl2>SnCl4
D.F- > F
3.在BrCH=CHBr分子中,C-Br键采用的成键轨道是(C )
A.sp-p B.sp2-s C.sp2-p D.sp3-p
4.下列分子中具有平面三角形几何构型的是( B )
A.ClF3 B.BF3 C.NH3 D.PCl3
sp3d T字形 sp2 平面三角形
不等性sp3 三角锥形
1
General Chemistry
Chapter 3 Homework
5.下列分子中含有极性键的非极性分子是( A ) A.BeCl2 B.H2S C.F2 D.HBr
6.下列物种中,变形性最大的是( B )。
A.O2- B.S2- C.F- D.Cl-
7. 下列物质中只需克服色散力即沸腾的是( D ) A.HCl B.Cu C.CH2Cl2 D.CS2
5.H2Te比H2S的沸点高是因为 H2Te的分子量大,分子间 作用力大 ,而H2O比H2S的沸点高则因为 H2O间存在氢键 。
3
General Chemistry
三、计算题
Chapter 3 Homework
已知KI的晶格能(U)为-631.9kJ∙mol-1,钾的升华热为
90.0kJ∙mol-1,钾的电离能为418.9 kJ∙mol-1,碘的升华热为62.4
◆同主族元素,自上而下,具有相同电荷的离子半径依次增大
6
General Chemistry
Chapter 3 Homework
4. 下列化合物中哪些化合物能形成氢键?
C2H6 H2O2 C2H5OH CH3CHO H3BO3 H2SO4 (CH3)2O
H2O2 C2H5OH H3BO3 H2SO4
5. 比较下列各组中两种物质的熔点高低,并简单说明原因。 (提示:分子间作用力,氢键,晶体类型,极化作用都可
8. 下列化合物中存在氢键的是( C )
A.HCl B.C2H5OC2H5 C.HNO3 D.CH3F
形成氢键要具备两个条件:
① 分子中必须有电负性较大而半径较小的元素(X=F、O、
N),并与H形成大而半径小,有孤对电子的
原子(Y=F、O、N) 。
2
General Chemistry
SiF4 3. 指出下列各对分子之间存在的分子间作用力的类型(取 向力、诱导力、色散力、氢键):
(1) 苯和CCl4
(2) 甲醇和H2O
(3) CO2和H2O
(4) HBr和HI
(1) 色散力(非极性分子间) (2) 色散力、取向力、诱导力、氢键(极性分子间) (3) 色散力、诱导力、(极性和非极性分子间) (4) 色散力、取向力、诱导力、(极性分子间)
3.C2H4分子中包含有 5 个σ键, 1 个π键,两个C原子采用
了 sp杂2 化形式,π键在
C原子与
C原子间形成。
4.AgCl、AgBr、AgI在水中的溶解度依次 减小 ,颜色依
次 加深 ,这是因为 Ag+具较强的极化作用,而Cl-、Br-、I-
离子的半径依次增大,变形性增强,化合物共价性依次增强。。
+ 1/2△disHm(I2)+EA(I2)+U
= -326.8(kJ·mol-1)
4
General Chemistry
Chapter 3 Homework
四、简答题 1.试用杂化轨道理论说明BF3是平面三角形,而NF3却是
三角锥形。
BF3中的B采用等性sp2杂化,形成三条sp2杂化轨道, 分别与三个F的p轨道形成σ键。其分子构型Wie平面三角形。
前者分子间存在氢键 后者分子量大,分子间作用力强 后者为极性分子 前者阳离子电荷高,半径小,晶格能大 前者为原子晶体,后者为分子晶体 后者阳离子极化能力强,分子共价成分多
7
General Chemistry
离子半径的变化规律
Chapter 3 Molecular Structure
◆同一元素,r正<r原子<r负,正电荷数增大离子半径减小 如: r(Fe3+)< r(Fe2+) < r(Fe)。
General Chemistry
第三章 分子结构
一、选择题:
Chapter 3 Homework
1.下列离子中具有9~17电子组态的是( B )
A.Na+ B.Ni2+ C.Pb2+ D.Zn2+
2.下列各组中离子原子半径大小关系不正确的是( B )
A.Na+ < Cs+
B.Cu2+ > Cu+
C.S2- > Cl-
Chapter 3 Homework
二、填空题
1.Fe原子的价层电子组态 3d64s2 ,Fe2+的价层组态为 3d6 ,
Fe3+的价层组态为 3d5 ,二者的半径大小为 r(Fe2+) >r(Fe3+) 。
2.Li—F,Li—H,Li—Li,Li—S按键极性由大到小应排为
___________L_i—__F__>_L_i_—__S_>__L_i_—__H_>__L_i—__L__i______________。
