第八章 醛和酮2
醛、酮的其它反应

(b)用还原剂(金属氢化物)还原 LiAlH4还原:
CH3CH=CHCH2CHO ① LiAlH 4 干乙醚 ② H2O CH3CH=CHCH2CH2OH ( 只还原 C=O )
LiAlH4是强还原剂,但①选择性差,除不还原C=C、C≡C外,其它不 饱和键都可被其还原;②不稳定,遇水剧烈反应,通常只能在无水醚或THF 中使用 。
a) 羰基加成
O N OH
N OH
H2N OH
+ NH2 OH
O
羟氨
O
对苯醌单肟
N OH
对苯醌双肟
b) 双键加成
O O O
+ Cl 2
O O
Cl H Cl H
Cl2
Cl H Cl H
O
Cl H Cl H
二氯苯醌
四氯苯醌
O + HCl O
O
[
OH
Cl H
OH
]
重排
Cl OH
②
还原反应 O
[H]
[O]
C6H5CHO + CH 3CHO
C6H5CHO + CH 3CH 2CHO
OH
OH
C6H5CH=CHCHO
C6H5CH=CCHO CH 3 68%
含有α -H的酮在碱催化下,也可发生类似反应,称为羟 酮缩合,但反应比醛难以进行。
十、 醌的性质
醌是一类特殊环状不饱和二元酮,醌分子中两个碳-碳 双键与两个羰基共轭,形成交错共轭体系,而不是闭合共 轭体系,故醌不具芳香性。 ① 加成反应:(具有典型烯、羰基化合物性质)
第八章 醛、酮、醌
8.3醛、酮的其它反应
八、氧化和还原反应
1.氧化反应 醛易被氧化,弱的氧化剂即可将醛氧化为羧酸。 酮难被氧化,使用强氧化剂(如重铬酸钾和浓硫酸) 氧化酮,则发生碳链的断裂而生成复杂的氧化产物。 (1)与多伦(B.Tollen)试剂反应
醛、酮的亲核加成反应

H
加成
OH H
-H2O
C O+ HN Y
C NY
C NY
上式也可以直接写成:
CO +H 2NY
CNY+H 2 O
反应的结果是在醛和酮与氨的衍生物分子间脱去一 分子水,生成含有C=N双键的化合物。这一反应又叫 做醛和酮与氨的衍生物的缩合反应。
H2 N OH
O+
H2 N NH2 H2 N NH
NH2 NH O2N
2-戊醇 2-戊酮 苯甲醚
卢卡斯试剂
出现混浊 X X
2,4-二 硝基苯肼
生成晶体 X
Backmann重排 酮与羟胺作用生成的酮肟在强酸作用下发生重排,生成取代的 酰胺。这种由肟变为酰胺的重排,叫贝克曼(Backmann)重排。
反应历程:
特点:(1) 在不对称的酮肟中,处于羟基反位的基 团重排到氮上;
1.与氢氰酸加成
C O + HCN
OH C
CN
α 羟基睛
在少量碱催化下,醛和脂肪族甲基酮与氢氰酸加成生成氰醇(或叫
羟基醇)。
应用范围:醛、甲基脂肪酮、C8以下环酮
H2O
(C3H)2CCN H2O/H
OH
H
练习:
CH 3 CH 3OH
C H 3
CH 2=C-CN H CH 2=C-CO3OCH
(C3H)2C C O O H
C H 3 C H O +2 C 2 H 5 O H
利用这一性质在有机合成中常用来保护羰基。
例题: HO 2 CH CHO O HOOC CHO
必须要先把醛基保护起来后再氧化。
HOC 2 H HOOC
CHOCHH 3O CH l HOC 2 H
第八章 醛和酮(一)醛和酮的命名(二)醛和酮的结构(三)醛和

N
六亚甲基四胺(乌咯托品)
(己)与Wittig试剂加成
Ph3P + CH3CH2Br C6H6
PhLi
Ph3PCH2CH3 Br
Ph3P=CHCH3 + C6H6+LiBr
Ph3P CHCH3
O CH3 C CH3 + Ph3P=CHCH3
O PPh3 CH3 C CHCH3
CH3
O PPh3 CH3 C CHCH3 0oC CH3 C CHCH3 + Ph3P O
C
O
92%
(4)羧酸衍生物的还原
COCl
LiAl(OBu-t)3H OCH3 乙醚,-78 oC
CH3
H+/H2O
CHO
OCH3 CH3
60%
CH3(CH2)10
COOC2H5
Al(Bu-n)2H 己烷,-78 oC
H+/H2O CH3(CH2)10 CHO 88%
(5)芳烃的氧化
V2O5 CH3 + O2(air) 350-360oC
CH CCOOH CH3
(丙)Mannich反应
O CCH3 HCHO
HN(CH3)2 HCl
O CCH2CH2N(CH3)2
H3C
CO +HCl AlCl3_ CuCl, 20oC
H3C
CHO
(四)醛和酮的物理性质
沸点:介于烃、醚与醇、酚之间。
CH3CH2CH2CH3 CH3OCH2CH3 CH3CH2CHO CH3COCH3 CH3CH2CH2OH
沸点/ oC -0.5
8
49
56
97
CH2CH3
CHO
第八章 醛和酮

NO2
②消除
乙醛-2,4乙醛-2,4-二硝基苯腙 黄色结晶) (黄色结晶)
O C H
正丁醛
O CH3 C CH2CH3
异戊醛
苯甲醛
C O
二苯甲酮
甲基乙基(甲 酮 甲基乙基 甲)酮 甲乙酮
系统命名法:是选择含有羰基在内的最长碳链为主链, 系统命名法:是选择含有羰基在内的最长碳链为主链,称 为某醛或某酮。主链从离羰基较近的一端开始编号。 为某醛或某酮。主链从离羰基较近的一端开始编号。醛基 总是在碳链的一端。有取代基时,应标出其位置。例: 总是在碳链的一端。有取代基时,应标出其位置 CH3CHCH2CHO C2H5 3-甲基戊醛 甲基戊醛) (β-甲基戊醛) CH3-C=CH-CHO = - CH3 3-甲基-2-丁烯醛 甲基O - CH3-CH-C- CH2CH3 CH3 2-甲基-3-戊酮 甲基甲基- 戊酮) (α-甲基-3-戊酮)
水合三氯乙醛可用作安眠药和麻醉剂;水合茚三酮则用 水合三氯乙醛可用作安眠药和麻醉剂;水合茚三酮则用 可用作安眠药和麻醉剂 检验α 氨基酸色层分析指示剂。 于检验α-氨基酸色层分析指示剂。
(6)与氨的衍生物的加成反应 与氨的衍生物的加成反应 氨的衍生物(羰基试剂): 氨的衍生物(羰基试剂): NH2OH 羟胺 NH2-NH NH2-NH2 肼 NO2 NO2 NH2-NH 苯肼 O NH2-NH-C-NH2 氨基脲
② 反应历程
实验发现碱对上例加成反应有极显著的影响。例如: 实验发现碱对上例加成反应有极显著的影响。例如: 丙酮 + HCN 丙酮 + HCN 丙酮 + HCN HCN C=O OC CN + H+ + CN→ 在3-4小时内只有一半原料起反应 反应在2 反应在2分钟内完成 放置几星期也不反应 放置几星期也不反应 OC CN OH C CN
有机化学-第八章-醛酮的命名、化性及制备

醛酮的命名和化学性质及制备本章要点一、分类命名和结构二、主要化性(一)醛酮1、亲核加成(水/氢氰酸/亚硫酸氢钠/醇/羰基试剂/格式试剂/烷基锂/金属炔化物)2、α-H的反应(卤代/卤仿反应,羟醛缩合)3、氧化还原(不同还原体系产物不同)4、α、β-不饱和醛酮的特征反应(了解)(二)醌1、C=C亲电加成2、C=O亲核加成3、共轭体系1,4-加成一、醛酮的命名1、含CO、较多取代的最长碳链→⨯醛、⨯酮2、CHO总是1位,不饱和醛酮的C=O位号﹤重键3、酮离羰基最近端起编,羰基位次要标明(有些可省)4、有环基取代→环基作取代基5、环酮命名与酮类似,加前缀→环⨯酮例题:1、CHO2、HO CHO3、PhCH=CHCHO4、OHC CHO5、COCH36、CO7、COCH2CH39、H3CO COCH39、(CH3)3CCOCHCH3CH310、CH3CHCHCOCH3CH311、CH3COCH2COCH312、OBr13、CH3O14、CH3O15、COHOOH16、CH3COCH2NH2解:1、苯甲醛2、对羟基苯甲醛3、3-苯基-2-丙稀醛4、乙二醛5、苯乙酮6、二苯甲酮7、苯丙酮8、对甲氧基苯乙酮9、2,2,4-三甲基-3-戊酮10、3-甲基-4-苯基-2-戊酮11、2,4-戊二酮(乙酰丙酮,acac.) 12、2-溴环戊酮13、4-甲基-2-环己烯酮14、4-甲基-2,4-环己二烯酮14、3,4’-二羟基二苯甲酮16、对氨基苯-2-丙酮二、醛酮的结构特点COδδ+1、醛酮中的羰基是极性双键,由于氧的电负性强,因此碳上带有δ+,氧上带有δ-;2、δ+的碳与δ-的氧比较而言,前者更易受到试剂(亲核试剂)的进攻,因此羰基的加成属 于亲核加成;3、受羰基影响,α-H 具有一定的酸性,可发生卤代等反应;4、羰基的氧化度处于中间状态,可继续氧化亦可被还原。
三、醛酮的主要化学性质H Cα-H的反应氧化还原醛的反应(一)羰基的亲核加成反应通式:CNuO C O δδ++ Nu -E+NuC OE注:(1)羰基加成反应属于亲核加成,有别于C=C 的亲电加成,因此,易与C=C 加成的试剂如卤素、卤化氢等,就不易与C=O 进行亲核加成;反之同理。
第八章 醛、酮

>H
R
C=O
>(
)
>
CH3 C=O R
由于HCN是一种极易挥发的剧毒液体,一般采用 NaCN 或 KCN 水溶液与醛酮混合,再慢慢滴加硫酸。 这样可使反应产生的HCN随即与醛酮反应。即使这样 操作也必须在通风厨中进行。
18
2. 加亚硫酸氢钠
R H C=O + NaHSO3
O-Na+ S O R H C OH SO3Na R H
O O O O O O H C H R C H Ar C H CH3CCH3 R CCH3 R-C-R
烃基的斥电子效应和空间位阻增大
O Ar-C-Ar
课堂练习2.下列各化合物发生加成反应活性顺序?
O CH3 (CH 2 )2 CHO
O
C6H5CHO
(A)
(B)
(C)
CH3
(D)
C CH2C6H5
A >C > B > D
H(R)
碳与氧相连 氢易被氧化
α碳有吸电子基 α-H有弱酸性
羰基碳有亲电性 可与亲核试剂结合
12
不同结构醛酮的反应活性
亲核加成反应的活性与羰基碳原子亲电性强弱、 羰基所连R基大小,即诱导效应、空间效应等因 素有关。
诱导效应
羰基碳原子连有吸电子基团将使羰基碳原子的正电 性↑,从而有利于亲核试剂的进攻;反之,连有斥 电子基团将使羰基碳原子的正电性↓,不利于亲核 试剂的进攻。
(—)
白色结晶
3. 加醇——形成缩醛(或缩酮)
在干燥HCl存在的条件下,醇与醛加成生成半缩 醛;然后,半缩醛又与另一分子醇反应,生成缩醛。
OR' OH O HOR' 干HCl R C H + H2O R C H R C H + HOR' 干HCl OR' OR'
第八章 醛、酮和羧酸

1
学习重点 ❖ 醛、酮和羧酸的概念、结构和命 名 ❖ 常见的醛、酮和羧酸在医学上的 用途
2
第一节 醛 和 酮
3
一、醛、酮的结构和命名
在醛和酮分子中,都含有一个共同的官能 团——羰基,故统称为羰基化合物。
羰基:碳原子以双键与氧原子相连形成的原子团。
(
)
R CO
H
( RCHO )
CH2—COOH
苯乙酸
19
二、乙酸的性质
(一)乙酸的物理性质 物态:C1~C3 有刺激性酸味的液体,溶于水。
C4~C9 有酸腐臭味的油状液体(丁酸为脚臭味),难溶于水。 > C9 腊状固体,无气味。
●乙酸是无色、具有强烈刺激性酸味的液体,溶于水。 ●沸点118摄氏度,熔点16.5摄氏度。 ★ 当温度低于16.5摄氏度时,纯净的乙酸很容易凝结成
布洛芬
阿司匹林
15
分类
1.按烃基的种类可分为: a.脂肪族羧酸:饱和羧酸、不饱和羧酸 b、脂环族羧酸
c、芳香酸 2.按羧基数目可分为:一元羧酸、二元羧酸、多元羧酸
饱和酸 不饱和酸
芳香酸
一元酸 乙酸
丙烯酸
苯甲酸
二元酸 乙二酸 顺丁烯二酸 邻二苯甲酸
16
(二)羧酸的命名
1、俗名 HOOCCH-CHCOOH
7
醛酮的命名
1、普通命名法
根据碳原子的个数称为“某醛”“某 酮”。
O H—C—H
甲醛
O CH3—C—H
乙醛
O CH3—C—CH3
丙酮
8
2、系统命名法 Ⅰ 选择含羰基碳原子在内的最长碳链为主链,支链作取代基,
根据主链碳原子数目称为“某醛”或“某酮” Ⅱ 从靠近羰基的一端开始给主链碳原子编号。 Ⅲ 取代基的位次、数目和名称写在醛或酮名称的前面。 Ⅳ 醛基因位于碳链首端,其位次不必标示;
醛和酮 (2)优秀课件

一. 醛酮的性质(II)
复习:醛酮与负离子型亲核试剂的加成
OH
R C CCR
OH RC R
H(R)
(R)H
1. M C C R
OH
1. RMgX 2. H2O
R
2. H2O
RC H
1. LiAlH4
H(R)
O
or NaBH4
C
2. H2O
H (R )
ONa R C SO3H
NuH
可逆
O C NuH
较易离去
•结论:
分子型亲核 试剂难直接 与羰基加成
•预测: H+存在下与羰基加成
H+ O C
羰基亲电 性增强
O H 易加成 C
HNu
结论:酸性条件有助分子型亲
核试剂向羰基的加成
O H C NuH
- H H
O H C Nu
O H C N u
O H C O H 偕二醇
O H C O R 半缩醛(酮)
O H C N H R a羟基胺
不稳定,可进一步转变
1.1 醛酮与 H2O 加成
O C
+ H 2O
H +
例
O
HCH
O H3C C H
O
H3C C CH3
•给电子基 •位阻
H2O H2O H2O
O H C O H
偕二醇
H2C(OH)2
100%
CH3CH(OH)2
~ 58%
(CH3)2C(OH)2
0%
CH3
(2) H2O
OO
C
R
(CH2)2
H2O H+
O
大学有机化学教程第八章醛和酮详解演示文稿

第25页,共68页。
a、反应机理
δ-O
δ+C R
H(CH3)+ SO3H
R C
CH3(H)
O SO3H
互变重排
R
OH
C
CH3(H) SO3
R
OH
Na
C
CH3(H) SO3Na (白)
羰基的碳原子是和硫原子结合的,HSO3-的亲核性
与CN-相近,二者反应机理也相似。
第26页,共68页。
b、反应范围
醛,脂肪族甲基酮以及C8以下的环酮均可与饱和NaHSO3溶液 反应。非甲基酮和芳香酮难发生此反应。
不 同 的 羰 基 化 合 物 与 1molNaHSO3 反 应 1hr 后 生成加成产物的百分数为:
CH3CHO (89%)
CH3COCH3 CH3CH2COCH3
(56%)
(36%)
O CH3CH2COCH2CH3 PhCOCH3
O CH3CCH2CH3
O CH3CCH3
二甲酮(丙酮)
甲基乙基甲酮
(甲乙酮)(丁酮)
O CH3CCH(CH3)2
甲异丙酮(异戊酮)
第6页,共68页。
(2)系统命名法
(a)选主链。选取包含羰基在内的最长碳链为主链,
并根据主链碳原子数命名为“某醛”或“某酮”。
(b)编号。从离羰基最近的一端开始编号。醛的羰
第4页,共68页。
2、醛酮的命名
(1) 普通命名法
醛与醇的习惯命名相似,相应的碳原子数的烃 基后面加一个“醛”字即可。
CH3CH2CHO
丙醛
CH2=CHCHO
丙烯醛
O CH3CH2CH2C H
第八章醛酮和羧酸总结

(四)乙二酸HOOC-COOH 俗称草酸,常以盐的形式广泛存在于草本植物及藻类的 细胞中。为无色晶体,通常含有2个结晶水,加热至 100℃,失去结晶水称为无水草酸,草酸易溶于水和乙醇。 草酸容易与钙质反应生成难溶的草酸钙,在体内可影响 人体对钙质的吸收。在体内累积可形成结石。
酮体
β-丁酮酸、β-羟基丁酸、丙酮三者合称为酮体。 检查酮体的方法是向尿液中加入几滴5%的亚硝酰铁 氰化钠及氢氧化钠溶液,若尿液呈现红色,表明有 酮体存在。
(二)乙醛CH3CHO
为无色、具有刺激性气味、易挥发的液体,能溶于水、乙醇 和乙醚。 乙醛中通入氯气可得三氯乙醛,三氯乙醛与水作用生成水合 三氯乙醛,简称水合氯醛。是比较安全的催眠药和镇静药。
(三)丙酮CH3COCH3
无色、易挥发、易燃、有特殊香味的液体,易溶于 水,能溶解多种有机物质,是常用的有机溶剂。 糖尿病患者中,丙酮可过量排出,可向尿液中滴加 亚硝酰铁氰化钠溶液和氢氧化钠溶液,如有丙酮存 在,尿液即呈鲜红色。
2.酯化反应 在强酸的催化下,羧酸与醇作用生成酯和水的反应称为 酯化反应。
浓硫酸
CH3-COOH + HO-CH2-CH3
CH3-COO-CH2-CH3 +H2O
O ‖ 羧酸分子中去掉羧基上的羟基,剩下的部分称为酰基 R- C – , O ‖ 如乙酸分子中去掉羟基剩下的部分称为乙酰基 CH3- C –
Thanks for listening!
(二)醛和酮的命名
简单的脂肪醛、酮的命名是根据碳原子的个数称为某 醛或某酮。
O ‖ H - C –H 甲醛
O ‖ CH3 - C –H 乙醛
O ‖ CH3 - C –CH3 丙酮
复杂的脂肪醛、酮的命名则采用系统命名法。 命名时,选择含羰基碳原子在内的最长碳链作为主 链,支链作为取代基,根据主链碳原子数称为某醛或某酮。 从靠近羰基较近的一端开始给主链碳原子编号,取代基的 位次、数目和名称写在醛或酮名称的前面。醛基因位于碳 链的首端,其位次不必标示;酮基的位次标在某酮前面, 中间用短线隔开。 O H3 C O ‖ ︱ ‖ CH3 - C –CH2-CH2-CH3 CH3-CH - C –H 2-戊酮 2-甲基丙醛
第八章醛和酮
CN C OH
还原
CH3 CH3—C—CH2—NH2 OH
β-羟基胺
CH3 CH3OH CH2=C—COOCH3 H2SO4
α-甲基丙烯酸甲酯
例如:
O C H3C HCN CH3 NaOH OH H3C C CN CH3
水解
脱水 H2C C COOH H3C C COOH CH3 CH3
OH
适应范围:
溶解度:与醇相似。低级醛、酮可溶于水;高级醛、酮 不溶于水。 因为醇、醛、酮都可与水形成氢键:
H R-O H H-O R H C=O H H-O R R' C=O H H-O
第三节 醛、酮的化学性质 一、羰基的结构
羰基中C和O均采取Sp2杂化成键。O上有两对孤 电子未参与成键。
甲醛的结构
键 H C H p轨道 甲醛的结构与羰基的极性 O H 键 孤对电子 O C
二、亲核加成反应
δ -O δ C
+
Nu 慢 + Nu A C (1) O A (2)快
Nu C OA
负氧离子中间体
注意与烯烃的 C=C 的亲电加成反应区别。
影响亲核加成的因素:
一般来说,醛比酮活泼些。这是因为一方面酮的羰基碳连有 两个烷基,而烷基具有给电子的诱导效应,这样使羰基碳所 带正电荷比只连有一个烷基的醛少;另一方面,两个烷基的 空间位阻也比一个烷基大。例如:脂肪族醛酮的活性顺序为:
H C O > H H R C O > H3C R C O > R' R C O
对于芳香醛、酮而言,苯环上有吸电子基团使羰基碳的正电 性增强,有利于亲核加成;反之,活性降低:
O O2N C H O O
>
羰基化合物:含有羰基(

第八章 醛、酮、醌第一节 醛、酮一、结构、命名1. 结构:羰基化合物:含有羰基( C=O )的化合物为羰基化合物。
R 1、R 2均为烷基时,分子称为酮;R 1、R 2有一个或二个为氢分子称为醛。
芳香醛酮:羰基与芳环直接相连的化合物。
醛、酮 脂肪醛酮:羰基与脂肪烃基相连的化合物。
不饱和醛酮:羰基与不饱和烃基相连的化合物。
羰基C 为sp 2杂化,杂化轨道分别与其他的原子形成三个σ键,余下的一个p 轨道与氧的p 轨道形成一个π键。
π键电子云偏向O 、C 上带部分正电荷利于亲核试剂的进攻。
2.命名:⑴ 普通命名法:① 简单醛 烷基+“醛”异丁醛 正十二醛 (月桂醛)② 简单酮:按羰基所连的两个烃基的名称来命名,按顺序规则,简单在前,名称为“甲酮”。
甲(基)乙(基)酮 二乙(基)酮 2-羟基丙醛(α-羟基丙醛) ⑵ 系统命名法:① 基本规则同前面讲过的其他化合物相似。
注意:选主链时,要选含羰基的最长链为主链,编号时从离羰基最近的一端开始编号,名称为“醛”或“酮”。
4-甲基-2-戊酮 3-甲基丁醛 ② 分子中含苯环的,常以苯环作为取代基。
1-苯基-1-丙酮 苯乙酮O R 1CR 2OR 1CR 2¨¨C HOC H CH 3C H 3C HOCH 3(CH 2)10CH 31C H 23C H 34OC2CH 31C H 22C H 24C H 35C3OC H1C H 2CH 33O H OC H1C H 22C H 3CH 34C H 3OC H 31C H 23C H 4CH 35C H 3C2OC1C H 22C H 33O C1C H 32O③ 复杂:2-丁烯醛 4-庚烯-2-酮 二、物理性质:常温下,除甲醛是气体外,,十二个碳原子以下的醛酮是液体,高级的醛酮和芳香酮多为固体。
分子一般具有较大的极性,因此沸点比分子量相近的烃和醚要高,但比相应的醇要低。
醛酮的分子可以与水形成氢键,低级的醛酮(四碳以下的脂肪醛酮)易溶于水,五碳以上的醛酮,微溶或不溶于水中,而易溶于有机溶剂中。
有机化学 第八章 醛、酮、醌

O
H+
δ
Csp
+
C O
2
δ-
Nu C OH
Csp3
+ Nu
-
C
O-
1.与HCN的加成 (1)反应范围: 醛、脂肪族甲基酮和八个碳原子以下的脂环 酮,在室温下可与氢氰酸反应。
OH R (CH3)H C O + HCN R C CN (CH3)H α—羟基氰
H+ H2O
OH R C COOH (CH3)H α—羟基酸
O 环己酮
O O 1,2-环己二酮
O CCH3 苯乙酮
O CCH2CH3 1-苯基-1-丙酮
二、醛、酮的物理性质 三、醛、酮的化学性质
C sp
3
σ
O
δ
+
δ
δ
C
+
C
O
O
δ
键角接近120°
α-H 的反应 H R C C H O H(R) 醛基的氧化反应 羰基的亲核加成反应
(一)亲核加成反应
+ C
Nu
NH3 氨 RNH2 胺 NH2OH 羟氨 NO2 NH2NH 苯肼 NH2 NH NO2 NH2NH2 肼 O NH2 NH C NH2 氨基脲
2,4—二硝基苯肼
通式:
C O + H2-N-Y
Y= -OH, -NH2,
NH , NH NO2
C NY
NO2 , -NHCONH2 等
NH2OH NH2NH2 C O NH2NH NO2 NH2 NH NO2
第八章
本章重点:
醛、酮、醌
1. 醛、酮的结构和命名。 2. 醛、酮的化学性质、反应范围及其应用。 3. 影响羰基活性的因素及羰基活性顺序。 本章难点: 具有不同结构特点醛、酮化合物的反应范围及应用;利用
第八章醛酮和醌

一些常见醛和酮的物理性质
(续表) O
O
O
H3C C C2 H C CH3
酮式(24%)
H
O
O
H3C
CH3
烯醇式(76%)
2.卤代反应 卤仿反应:含有a-H的醛或酮与卤素的氢氧化钠 溶液作用,首先生成a-三卤代物,后者在碱性溶 液中立即分解成三卤甲烷(俗称卤仿)和羧酸盐
+ O
X 2 , H O -
O
H O -
H 3 CCR(H) C3XCR(H)
放在前面,较复杂放在后面,最后加 “酮”;
含芳烃基酮命名时把芳烃基放在名称前面。
O H3C C C2H5
CO2C CH 3 H
甲基乙基酮
苯基乙基酮
(二)系统命名法
脂肪族一元醛酮命名时,选含羰基碳原 子最长碳链为主链,从靠近羰基一端给主链 编号,取代基的位次与名称放在母体前,醛 基与只有一种可能位次的酮基不必标明位次
一、醌的结构与命名 1.醌的结构
醌是一类环状共轭α,β-不饱和二酮
O
O
O
O
2.醌的命名 在醌字加上相应芳烃的名称,同时注明
两个羰基的相对位置。环上有取代基时,还 要在醌字前注明取代基的位次、数目和名称
O
O
O
O
O
O
O
1,4-苯醌 1,2-苯醌
1,2-萘醌
O
1,4-萘醌
醛酮的结构——精选推荐
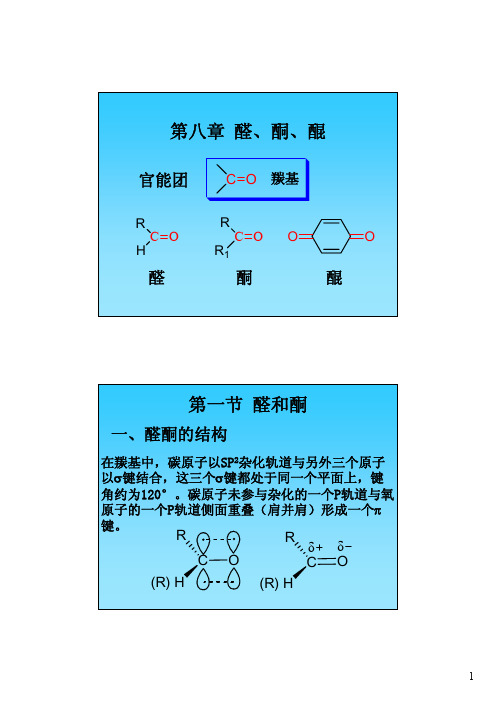
第八章醛、酮、醌官能团醛酮C O RR 1C O RH OO 醌C O 羰基第一节醛和酮一、醛酮的结构在羰基中,碳原子以SP 2杂化轨道与另外三个原子以σ键结合,这三个σ键都处于同一个平面上,键角约为120°。
碳原子未参与杂化的一个P轨道与氧原子的一个P轨道侧面重叠(肩并肩)形成一个π键。
δδC O R (R) H C OR(R) H二、醛酮的命名对苯二甲醛顺-丁烯二醛环己基甲醛3-甲基-2-乙基戊醛H CHOH CHOOHC CHOCHO CH 3CH 2CCH 2CHO O 3-氧代戊醛CH 3CH 2CH CHCHOCH 2CH 3H 3C1-苯基-1-丙酮3-乙基己醛3-甲基-5-庚烯-2-酮CCH 2CH 3OO HO CH 33-甲基环戊酮2,7-壬二酮OOOO O螺[2.5]辛-6-酮1,7,7-三甲基二环[2.2.1]庚-2-酮1-苯基-2-丙酮二苯甲酮OO3,3'-二甲基-4-甲氧基二苯甲酮C OH 3C CH 3OCH 3第二节物理性质由于羰基的偶极矩,增加了分子间的吸引力,因此醛酮的沸点比相应分子质量的烷烃高得多,但比相应分子质量的醇低。
醛酮的氧原子可以与水形成氢键,因此低级醛酮可以与水混溶,随着相对分子质量的增加,在水中溶解度大大降低。
第三节化学性质一、羰基的加成由于羰基碳原子带部分正电荷,容易与一系列的亲核试剂发生加成反应,称羰基的亲核加成反应,或称1,2-亲核加成。
常见的亲核试剂:CN RNH2RSOHROH H2ONH3RMgX(一)与氢氰酸的加成醛及多种活泼的酮(脂肪族甲基酮及少于8个碳原子的脂环酮)与氰基负离子的碳原子发生加成反应,生成α-羟基腈。
O +H CN C CNOHOHCH 3CHO HCN +OH CH 3CHCN OH H CH 3CHCO 2HOHCH 3C CH 3O +HCN NaOHCH 3C CH 3OHCNCH 3OHH 2SO 4CH2C CH 3C OOCH 390%(二)与亚硫酸氢钠的反应醛或活泼的酮(脂肪族甲基酮及少于8个碳原子的脂环酮)在室温下与过量的饱和亚硫酸氢钠(40%水溶液)溶液一起振荡,不需加任何催化剂反应即可发生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NO2
乙醛-2,4-二硝基苯腙 (黄色结晶)
CHO + NH2-NH2
①加成
②消除
CH=N-NH2 苯甲醛腙
这些产物肟、腙、苯腙等都是很好的结晶,易于提纯, 具有一定的熔点,因此常用于醛酮的鉴别。且这些产物在 稀酸的作用下可分解成为原来的醛酮,故又可用作醛酮的 分离提纯。例: 鉴别: 丙酸 丙醛
2,4-二硝基苯肼
氧化反应
H
1.羰基上的加成反应
δ δ- C=O + : Nu+
Nu C OH+
Nu C OH
羰基的活性:
羰基上电子云密度越低,活性越高。因而,羰基碳连 接的基团给电效应使羰基电子云密度升高,降低反应活 性;吸电效应活化羰基,提高反应活性。 如: Cl3C-CHO ﹥ HCHO ﹥ RCHO ﹥ RCOR′ 羰基碳连接的基团体积增大,空间位阻增大,活性降低。 如: HCHO ﹥ RCHO ﹥ RCOCH3 ﹥ RCOR′
CH3CHCH2CHO C2H5 3-甲基戊醛 (β -甲基戊醛) CH3-C=CH-CHO CH3 3-甲基-2-丁烯醛 O CH3-CH-C- CH2CH3 CH3 2-甲基-3-戊酮 (α -甲基-3-戊酮)
CH2 CHCH CHCHO
OH CH3
2-甲基-3-羟基-4-戊烯醛
芳香族醛酮命名时,常把芳环作为取代基。 O -C- CH2CH3 1- 苯基-1-丙酮 CH3O O -C-CH3
R
C H (CH3)
OH CN
增一碳 反应
(α -羟基腈)
制得的羟基腈是较活泼的化合物,在酸性条件下水解 可得到α -羟基酸。例: OH OH + H3O CH3CHCOOH CH3CHO + HCN → CH3CHCN α -羟基丙酸 α -羟基丙腈 ①反应范围 (乳酸) 醛、脂肪族甲基酮、八个碳以下的环酮。
2
C
C
R1 R
2
+ (Ph)3P =O
此反应即为魏悌希反应,是合成烯烃和共轭烯烃的好方法。 其反应特点是: 1°可用与合成特定结构的烯烃(因卤代烃和醛酮的结构可以多种多样)。 2°醛酮分子中的 C=C、C≡C对反应无影响,分子中的COOH对反应也无 影响。
3°魏悌希反应不发生分子重排,产率高。
4°能合成指定位置的双键化合物。 魏悌希(Wittig)发现的此反应对有机合成作出了巨大的贡献,特别
O H+ + R C CH2
CH3-CO-CH2-H H-CH2CHO 20 17
⑴ α-H 卤代反应
O
O
乙醚 0℃
C-CH3 + Br2
C-CH2Br + HBr α -溴苯乙酮
醛与卤素作用往往生成多卤代物。例: Cl
Cl2 CH3CH2CHO H O 2 Cl2 CH3CHCHO H2O
CH2CCHO Cl
对甲氧基苯乙酮
脂环族醛和酮的命名:羰基在环内的——“环某 酮”;羰基在环外的——环作为取代基。
O
O
H3C
CH3
4–甲基环己酮
CHO
O
1,4–环己二酮 3–甲基环己基甲醛
二、醛酮的化学性质
羰基的结构: 羰基的碳、氧原子是sp2杂化
H
121.7°
116.5° C
O
H
121.7°
图8.1 甲醛分子的结构
② 反应历程
实验发现碱对上例加成反应有极显著的影响。例如:
丙酮 + HCN
丙酮 + HCN 丙酮 + HCN HCN
→
在3-4小时内只有一半原料起反应
反应在2分钟内完成 放置几星期也不反应 OC CN OH C CN
1滴氢氧化钾 加大量的酸
H+ + CN慢
C=O + CNOC CN + H+
快
(2)与格氏试剂加成
是在维生素类化合物的合成中具有重要的意义,为此他获得了1979年的诺
贝尔化学奖(1945年43岁发现,1953年系统的研究了魏悌希反应,82岁获 奖)。
2.α -H的反应
H H-C→C H O
由于羰基的-I效应和吸电子超共轭效应,使醛酮的 α -H比较活泼,酸性增强。如:
O R C CH3
CH3CH2-H pKa 42
I2 + NaOH
R-C-CH3 ( H)
R-C-ONa + CHI3↓(黄色) ( H)
碘仿是不溶于水的黄色结晶,有特殊的气味,易于识别 O 所以可用于鉴别具有(H)R-C-CH3 结构的醛酮。 OH ∣ 具有 CH3-CH-R ( H) 结构的α-甲基仲醇能被(I2+NaOH) O 氧化成具有 CH3-C-R 结构的羰基化合物,所以也能发 ( H) 生碘仿反应。 可发生碘仿反应的物质 乙醛 甲基酮 乙醇 α-甲基仲醇
典型的增碳反应
H3O+
醛酮能与格氏试剂加成,产物经水解得到醇。例:
R Mg X +
C O
R C O Mg X
R C OH
H H R H R R' '
C O
C O
'MgX ①R
② H3
R'CH2OH (伯醇) R R' CHOH (仲醇)
O+
C O
R R' COH (叔醇) R''
例:由丙醇制3-己醇
C O+H N Y H CH3
C N Y HO H
-H2O
C N Y + H 2O
CH3 OH H C=O + H2NOH → C-NOH CH3 CH3 CH3 NO2 C=O + NH2-NH CH3 C= N-NH H NO2
-H 2 O
CH3 CH3
C=N-OH 丙酮肟
①加成
NO2
H
②消除
Cl
乙醛和甲基酮在碱催化下与卤素作用,甲基上的三个α 氢均被卤素取代,所生成的三卤代乙醛或三卤代甲基酮在碱 作用下,碳碳键断裂,生成卤仿和相应的羧酸盐。如: 卤仿反应: O O
NaOH
H C (R)
CH3 + X2
H-C-CX3 (R)
O NaOH H-C-ONa + CHX3 (R)
当卤素是碘时又称碘仿反应。 O O
(P h) 3P + (P h) 3P -CH R1 R
2
CHXቤተ መጻሕፍቲ ባይዱX 强碱 Li - C4H9
(P h) 3P -CH
R1 R
2
X R1 R
2
R1 R
2
(P h) 3P = C
+ LiX + C4H9
(P h) 3P - C 内鎓盐
R1 R2
磷叶立德(魏悌希试剂)
C O +
(Ph)3P = C
R1 R
亲核试剂: CN− , HSO-3,R3C− , ROH,H2O, NH3(H2N—Y) (1)加氢氰酸(HCN)
(2)与格氏试剂加成 (3)加亚硫酸氢钠 (4)与醇加成 (5)与水加成 (6)与氨的衍生物的加成反应 (7)与品红试剂(Schiff试剂)反应
(1)加氢氰酸(HCN) 醛酮与氢氰酸加成生成α -羟基腈。 R H (CH3) C=O + HCN
A B
C=NR 参与反应
稀酸
A' B'
C=O
思考题
(7)与品红试剂(Schiff试剂)反应 H2O 品红 + SO2 品红试剂 (红色) (无色) 鉴别: 醛 酮 甲醛 其他醛
①品红试剂 ②稀硫酸 品红试剂
紫红色 无色 紫红色不褪
紫红色褪去
(8)与魏悌希(Wittig)试剂的加成反应 魏悌希(Wittig)试剂为磷的内鎓盐,又音译为叶立 德(Ylide),是德国化学家魏悌希在1945年发现的。 磷 叶立德(魏悌希试剂)通常由三苯基磷与1级或2级卤代物 反应得磷盐,再与强碱作用而生成。
H
CH3 OCH3
OCH3
(二甲醇缩乙醛或1,1二甲氧基乙烷)
C
H OCH3
环状的半缩醛比较稳定:
O HOCH2CH2CH2C H H2C CH2 O H C H2 C O H
乙二醇、丙二醇或其结构类似物易与醛反应生成 五元环或六元环状缩醛。
O +
HO CH2
HO CH2
干HCl
O O
CH2 CH2
+O H3
×
KMnO4 OH-
O
HOOC
干HCl HOCH2CH2OH
HOCH2
O CH O
HOOC
O CH O
思考题
1、
2、
(5)与水加成 醛、酮与水发生可逆的加成反应,形成极不稳定的水 合物(同碳二元醇)。 OH R R-C-OH (醛水合物) C=O + H2O H H 水是极弱的亲核试剂,所以平衡大大偏向于反应物的 一方。只有个别醛如甲醛的羰基活性较大,在水溶液中几 乎全部以水合物形式存在。 OH H H-C-OH (99.99%) C=O + H2O H 水合甲醛 H 乙醛的水溶液只有58%的水合物;而丙酮在水溶液中 的水合物含量可忽略不计。
按官能团数目分类
2.命名
普通命名法 醛:“烃基” + 醛 酮:以甲酮作母体,“甲”字可省略
O CH3CH2CH2 C H
CH3CHCH2CHO CH3
O C H
正丁醛
O CH3 C CH2CH3
异戊醛
苯甲醛
C O
二苯甲酮
甲基乙基(甲)酮 甲乙酮
系统命名法:是选择含有羰基在内的最长碳链为主链,称 为某醛或某酮。主链从离羰基较近的一端开始编号。醛基 总是在碳链的一端。有取代基时,应标出其位置。例:
