第 8 章 醛、酮、醌
第八章醛、酮、醌第一节醛和酮一、醛酮的结构和命名羰基碳原子SP2杂化
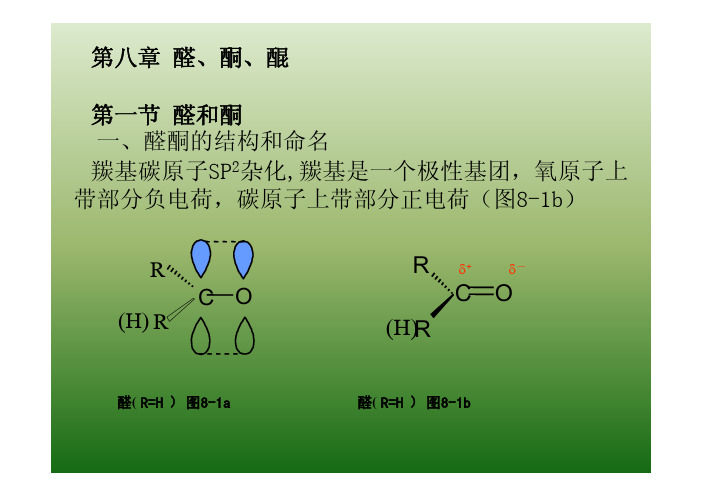
二、醛酮的物理性质羰基是极性基团,羰基中的氧原子可以与水形成氢键,醛酮的沸点比相应分子质量的烷烃高得多,而比相应分子质量的醇低得多。
三、醛酮的化学性质(一)羰基的加成羰基碳原子带部分正电荷,显正电性,易发生羰基的亲核加成反应醛、酮亲核加成反应的活泼性z空间效应考虑:醛羰基中有一个小的氢原子,酮羰基中有两个烃基,加成产物的中心碳原子周围较拥挤,反应平衡中产率较低z电子效应考虑:烃基是推电子的基团,醛只连有一个推电子的基团,而酮则连有两个推电子基团z直接连有吸电子基可使羰基碳原子正电性增高,更易于发生加成反应CCl3CHO>HCHO>RCHO>CH3COCH3>RCOCH3>ArCOCH3>ArCOAr常见醛酮的相对活泼性顺序为:(二)与氨的衍生物的加成—消除反应氨的衍生物通式H 2N-X 。
氨的衍生物氮原子上仍保留一对孤电子,容易与醛酮发生反应最常见的有:羟胺H 2N-OH 肼H 2N-NH 2;苯肼、H 2N-NHC 6H 52,4-二硝基苯肼H 2N-NHC 6H 5(NO 2)2 -2,4氨基脲H 2N-NHCONH 2醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用Wolff-Kishner-黄鸣龙反应还原。
反应机理本反应的反应机理较复杂,目前尚不很清楚。
参考文献[1]E. Clemensen, Ber.,1913, 46, 1837.[2]S. Yamamura, S. Ueda, Y. Hirata, Chem. Commun., 1967, 1049.[3]S. Yamamura, Y. Hirata, J.Chem. Soc.,C,1968, 2887.[4]S. Yamamura, Chem. Commun., 1968, 1494.[5]S. Yamamura,Tetrahedron Lett., 1967, 3361.[6]M. Toda, Y. Hirata, S.Yamamura,Chem. Commun., 1969, 919.。
醛、酮的亲核加成反应

缩醛(酮 ),双醚结构。 对碱、氧化剂、还原剂稳定, 可分离出来。 酸性条件下易水解
醛较易形成缩醛,酮在一般条件下形成缩酮较困难,用 1,2-二醇或1,3-二醇则易生成缩酮。
上述反应可以看成是1mol醛与2mol醇分子间脱去1mol水,生 成缩醛。
比如:
H3C C
H
H OC2H5 O+
H OC2H5
2.与饱和亚硫酸氢钠(40%)的加成
R C O + H SO3Na
(CH 3)H
R C
(CH 3)H
OH SO3Na
α -羟基磺酸盐
产物α -羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠 溶液中,容易分离出来;与酸或碱共热,又可得原来的醛、 酮。故此反应可用以提纯醛、酮。
α- 羟基磺酸钠如果在酸或碱存在下,加水稀释,产物又可 分解成原来的醛或酮。
例题: 2-己酮中含有少量3-己酮,试将其分离除去。
CH3CCH2CH2CH2CH3 O
2-己 酮
CH3CH2CCH2CH2CH3 O
3-己 酮
(1)加 NaHSO3饱 和 溶 液
(2)分 离
沉淀
滤液
SO3Na
CH3CCH2CH2CH2CH3
OH
(1)加 HCl溶 液
CH3CH2CCH2CH2CH3 , H2O, NaHSO3 O
CH3CHCH2 CH3
CH2OH
(3)写出合成路线。
HCHO + CH3CHCH2MgBr 干 醚 CH3
CH3CHCH2CH2OMgBr CH3
H2O CH3CHCH2CH2OH CH3
若合成仲醇 OH 因连有羟基的碳原子上R和Rˊ两个烃基故
RCHR'
大学有机化学第九章醛、酮、醌

第八章 醛、酮、醌用IUPAC 及普通命名法(如果可能的话)命名或写出结构式a.(CH 3)2CHCHOb.CH 2CHOc.H 3C CHOd.(CH 3)2CHCOCH 3e.(CH 3)2CHCOCH(CH 3)2f.CHOOH 3Cg.h.(CH 3)2C=CHCHOCH 2=CHCHOj.CH 3CH 2CH=CHCH 2COCH 3i.CH 3COCH 2CH 2COCH 2CH 3k.(S)-3-甲基-2-戊酮l. β-溴丙醛 m. 1,1,1—三氯代—3—戊酮 n. 三甲基乙醛 o. 3—戊酮醛 p. 肉桂醛q. 苯乙酮 r. 1,3-环己二酮答案:a. 异丁醛 2-甲基丙醛 b. 苯乙醛 c. 对甲基苯甲醛d. 3-甲基-2-丁酮e. 2,4-二甲基-3-戊酮f. 间甲氧基苯甲醛g.3-甲基-2-丁烯醛 h. 2-丙烯醛 i. 2,5-庚二酮 j. 4-庚烯-2-酮OOCCl 3CH 2COCH 2CH 3k.(CH 3)3CCHOl.CH 3CH 2COCH 2CHOm.CH=CHCHOn.C CH 3Oo.p.C 2H 5COCH 3HCH 3 BrCH 2CH 2CHOq.r.写出任意一个属于下列各类化合物的结构式。
a .α,β-不饱和酮 b. α-卤代酮 c. β-羟基酮 d. β-酮醛答案:CH 2=CHCOCH 3CH 2CH 2COCH 3XCH 2CHO a. b. c.OHd.CH 3COCH 2CHO写出下列反应的主要产物a.CH 3COCH 2CH 3+H 2N -OHb.Cl 3CCHO +H 2Oc.H 3C CHO +KMnO 4+d.CH 3CH 2CHO 稀NaOHe.C 6H 5COCH 3+C 6H 5MgBr H+2f.O+H 2NNHC 6H 5g.(CH 3)3CCHO浓NaOHh.O +(CH 3)2C(CH 2OH)2无水HClOi.+K 2Cr 2O 7+j.CHO4k.C OCl 2,H 2O -CH 3l.C O CH 3+Cl 2H+m.CH 2=CHCH 2CH 2COCH 3+HCln.CH 2=CHCOCH 3+HBr o.CH 2=CHCHO +HCN p.C 6H 5CHO+CH 3COCH 3稀答案:a.CH 3COCH 2CH 3+H 2N -OHCH 3CCH 2CH 3NOHb.Cl 3CCHO +H 2O Cl 3OHc.H 3CCHOHOOC COOH+KMnO 4+d.CH 3CH 2CHO稀NaOHCH 3CH 2CH-CHCHOOHCH 3e.C 6H 5COCH 3+C 6H 5MgBrC 6H 5CC 6H 5CH 3OMgBrH+2C 6H 5CC 6H 5CH 3OHf.O+H 2NNHC 6H 5NNHC 6H 5g.(CH 3)3CCHO浓NaOH(CH 3)3CCH 2OH(CH 3)3CCOOH+h.O +(CH 3)2C(CH 2OH)2无水HClOO Oi.+K 2Cr 2O 7+HOOC(CH 2)3COOHj.CHO 4COOHk.C OCl 2,H 2O -CO CH 2Cl CH 3COOH +CHCl 3l.C OCH 3+Cl 2H+m.CH 2=CHCH 2CH 2COCH 3+HCl CH 3-CHCH 2CH 2COCH 3Cl+Cl OH CH 3n.CH 2=CHCOCH 3+HBr BrCH 2CH 2COCH 3o.CH 2=CHCHO +HCNNCCH 2CH 2CHO +CH 2=CHCHCNOHp.C 6H 5CHO+CH 3COCH 3稀C 6H 5CHCH 2C-CH 3OOH用简单化学方法鉴别下列各组化合物a. 丙醛、丙酮、丙醇和异丙醇b. 戊醛、2-戊酮和环戊酮 答案:a.A丙醛B丙酮C丙醇D异丙醇AC试剂I2 / NaOHABCDb.A戊醛B2-戊酮C环戊酮ABCB完成下列转化a.C2H5OH CH3CHCOOHOHb.COCl COc.O OHd.HC CH CH3CH2CH2CH2OHe.CH3CH2CCH3OHCH3f.CH3CH=CHCHOCH3CH-CHCHOOH OHg.CH3CH2CH2OH CH3CH2CH2CH2OHh. 3-己烯→ 3-己酮i. 苯→间溴代苯答案:a.C2H5OH CrO3.(Py)2CH3CHO CH3CHOHCNH+CH3CHCOOHOHb.COCl无水AlCl3COc.O4OHH2O2d.HC CHH ++2CH 3CHOOH -H 2 / NiCH 3CH 2CH 2CH 2OHe.CH 3Cl 2光CH 2ClMg Et 2OCH 2MgCl H CH COCH CH 23OHCH 3f.OHOH 无水CH 3CH=CHCHOO稀冷KMnO 4OCH 3CH-CHCHOH OH3+CH 3CH-CHCHOOH OH g.CH 3CH 2CH 2OH3CH 2CH 2Br23CH 2CH 2MgBrHCHO CH 3CH 2CH 2CH 2OH1)CH 3CH=CHCHO CH 3CH=CHCHOh.CH 3CH 2C CCH 2CH 32HgSO 4,H 2SO 4CH 3CH 2COCH 2CH 2CH 3i.CH 3COCl无水AlCl 3C CH 3OBr 2FeBr 3C CH 3OBr写出由相应的羰基化合物及格氏试剂合成2-丁醇的两条路线. 答案:B CH 3CH 2MgBr32H 2O/H A CH 3MgBrCH 3CHOHCH 2CH 3CH 3CHO H 2O/H CH 3CHOHCH 2CH 3分别由苯及甲苯合成2-苯基乙醇 答案:CH 3Cl 2CH 2Cl Mg 2CH 2HCHO+CH 2CH 2OH1)2)Br MgBrO22H 2O下列化合物中,哪个是半缩醛(或半缩酮),哪个是缩醛(或缩酮)并写出由相应的醇及醛或酮制备它们的反应式。
醛、酮的其它反应

(b)用还原剂(金属氢化物)还原 LiAlH4还原:
CH3CH=CHCH2CHO ① LiAlH 4 干乙醚 ② H2O CH3CH=CHCH2CH2OH ( 只还原 C=O )
LiAlH4是强还原剂,但①选择性差,除不还原C=C、C≡C外,其它不 饱和键都可被其还原;②不稳定,遇水剧烈反应,通常只能在无水醚或THF 中使用 。
a) 羰基加成
O N OH
N OH
H2N OH
+ NH2 OH
O
羟氨
O
对苯醌单肟
N OH
对苯醌双肟
b) 双键加成
O O O
+ Cl 2
O O
Cl H Cl H
Cl2
Cl H Cl H
O
Cl H Cl H
二氯苯醌
四氯苯醌
O + HCl O
O
[
OH
Cl H
OH
]
重排
Cl OH
②
还原反应 O
[H]
[O]
C6H5CHO + CH 3CHO
C6H5CHO + CH 3CH 2CHO
OH
OH
C6H5CH=CHCHO
C6H5CH=CCHO CH 3 68%
含有α -H的酮在碱催化下,也可发生类似反应,称为羟 酮缩合,但反应比醛难以进行。
十、 醌的性质
醌是一类特殊环状不饱和二元酮,醌分子中两个碳-碳 双键与两个羰基共轭,形成交错共轭体系,而不是闭合共 轭体系,故醌不具芳香性。 ① 加成反应:(具有典型烯、羰基化合物性质)
第八章 醛、酮、醌
8.3醛、酮的其它反应
八、氧化和还原反应
1.氧化反应 醛易被氧化,弱的氧化剂即可将醛氧化为羧酸。 酮难被氧化,使用强氧化剂(如重铬酸钾和浓硫酸) 氧化酮,则发生碳链的断裂而生成复杂的氧化产物。 (1)与多伦(B.Tollen)试剂反应
8 醛、酮、醌

醛羰基中的氢原子直接连在羰基碳上,它表现出 与其它碳氢键上氢原子不同的性质。在化学性质 上最大的区别是醛基氢原子非常容易被氧化,而 其它碳氢键上的氢原子较难被氧化。 醛酮C=O双键的化学反应,主要有: (1) 羰基上 的反应; (2) 羰基α-H的反应; (3) 醛基氢的 反应。
3.1 羰基上的加成反应
脂肪族亚胺不稳定,易分解为原料,而芳香族亚胺稳定 H+对反应有两种作用,①活化作用:与醛酮形成 RR’C=O+H,增大羰基碳的正电性,有利于含氮亲核试剂 进攻,且H+催化脱水。②钝化作用:H+与NH2-G形成 +NH -G,降低含氮亲核试剂的亲核性,不利于反应。因 3 此,反应体系需要有一个最适宜pH值。不同醛酮化合物 与不同含氮化合物的反应,所需的pH值不同。例如,由 丙酮制丙酮肟,pH=4.5最合适。 醛酮与氨衍生物的加成反应在有机分析中很有用,肟、苯 腙及缩氨脲绝大多数都是白色固体(与2,4-二硝基苯肼 生成的2,4-二硝基苯腙为金黄色固体),具有固定的结 晶形状和熔点,通过测定熔点就可确定原来的醛、酮;另 外,肟、腙、苯腙及缩氨脲在稀酸作用下,又能够水解为 原来的醛、酮,因而又可利用这种性质来分离和提纯醛酮。
CH 3CHO + 2C2H5OH 无水CaCl 2 CH 3CH(OC 2H5)2 + H2O
乙醛缩二乙醇
分子量大的醛与醇反应需要加苯蒸馏,把生成的 水带出,使平衡向右移动,提高缩醛产率。
酮与醇难形成类似的半缩酮或缩酮,但用乙二醇,丙三 醇或原甲酸三乙酯代替醇,可以形成缩酮。
C6H5CH2COCH 3 + HC(OC 2H5)3
缩醛和缩酮较稳定,不与碱反应,也不与RMgX 和金属氢化物反应,但在稀酸中加热,变为原来 的醛酮,缩醛 ( 酮 ) 这一性质在有机合成上很有 用。通过生成缩醛和缩酮,可使羰基在化学反应 中不被破坏而被保护起来。对于多官能团分子进 行某些反应,如果不需羰基发生反应,但羰基又 干扰反应进行,可先使之变为缩醛或缩酮,在反 应结束后,再酸性水解,恢复原来的羰基。
第八章 醛和酮

NO2
②消除
乙醛-2,4乙醛-2,4-二硝基苯腙 黄色结晶) (黄色结晶)
O C H
正丁醛
O CH3 C CH2CH3
异戊醛
苯甲醛
C O
二苯甲酮
甲基乙基(甲 酮 甲基乙基 甲)酮 甲乙酮
系统命名法:是选择含有羰基在内的最长碳链为主链, 系统命名法:是选择含有羰基在内的最长碳链为主链,称 为某醛或某酮。主链从离羰基较近的一端开始编号。 为某醛或某酮。主链从离羰基较近的一端开始编号。醛基 总是在碳链的一端。有取代基时,应标出其位置。例: 总是在碳链的一端。有取代基时,应标出其位置 CH3CHCH2CHO C2H5 3-甲基戊醛 甲基戊醛) (β-甲基戊醛) CH3-C=CH-CHO = - CH3 3-甲基-2-丁烯醛 甲基O - CH3-CH-C- CH2CH3 CH3 2-甲基-3-戊酮 甲基甲基- 戊酮) (α-甲基-3-戊酮)
水合三氯乙醛可用作安眠药和麻醉剂;水合茚三酮则用 水合三氯乙醛可用作安眠药和麻醉剂;水合茚三酮则用 可用作安眠药和麻醉剂 检验α 氨基酸色层分析指示剂。 于检验α-氨基酸色层分析指示剂。
(6)与氨的衍生物的加成反应 与氨的衍生物的加成反应 氨的衍生物(羰基试剂): 氨的衍生物(羰基试剂): NH2OH 羟胺 NH2-NH NH2-NH2 肼 NO2 NO2 NH2-NH 苯肼 O NH2-NH-C-NH2 氨基脲
② 反应历程
实验发现碱对上例加成反应有极显著的影响。例如: 实验发现碱对上例加成反应有极显著的影响。例如: 丙酮 + HCN 丙酮 + HCN 丙酮 + HCN HCN C=O OC CN + H+ + CN→ 在3-4小时内只有一半原料起反应 反应在2 反应在2分钟内完成 放置几星期也不反应 放置几星期也不反应 OC CN OH C CN
醛酮醌知识点总结思维导图

醛酮醌知识点总结思维导图一、醛酮醌的概念及分类1.1 醛酮醌的定义醛酮醌是一类具有羰基和酮基的有机化合物,其结构中含有羰基(一定是一个氧原子与一个碳原子形成的双键),也有酮基。
1.2 醛酮醌的分类醛酮醌根据其结构和特性可以分为醛、酮、醌三种类型。
其中醛和酮分别是通过氧原子与碳原子形成的双键连接,在结构上醛中羰基与氢原子相连,而酮中羰基与两个碳原子相连。
而醌则是通过两个羰基连接在一起。
二、醛酮醌的物理性质2.1 醛酮醌的溶解性醛酮醌在水中的溶解度一般较低,而在有机溶剂中的溶解度则较高。
2.2 醛酮醌的气味醛酮醌具有多种不同的气味,其中包括芳香、刺激性气味等。
2.3 醛酮醌的熔沸点醛酮醌的熔沸点一般在较高温度范围内,不同种类的醛酮醌具有不同的熔沸点。
三、醛酮醌的合成和制备3.1 醛酮醌的合成方法醛酮醌的合成方法有直接合成、氧化还原合成、亲核加成反应合成等多种方法。
3.2 醛酮醌的制备工艺醛酮醌的制备工艺中通常包括原料准备、反应操作、产物分离和提纯等多个步骤。
四、醛酮醌的化学性质4.1 醛酮醌的还原性醛酮醌在还原反应中常常失去氧原子,生成相应的羟基和醇类化合物。
4.2 醛酮醌的亲核加成反应醛酮醌在亲核加成反应中,酮中羰基上的氧原子可以成为亲核试剂攻击的位置,产生相应的产物。
4.3 醛酮醌的氧化反应醛酮醌在氧化反应中会通过氧化剂的作用产生相应的氧化产物。
五、醛酮醌的应用领域5.1 化工领域醛酮醌在化工领域中广泛应用,包括有机合成、催化剂和溶剂等方面。
5.2 医药领域醛酮醌在医药领域中用作药物合成中间体和抗氧化剂等。
5.3 日用品领域醛酮醌在日用品领域中用于生产香水、口红等化妆品,以及染料的生产。
六、醛酮醌的安全性及环境影响6.1 醛酮醌的安全性醛酮醌在使用和储存过程中需要注意防火、防爆、防毒等措施,以保证人员和设备的安全。
6.2 醛酮醌的环境影响醛酮醌可能对环境造成一定影响,需要在使用和废弃处理过程中注意环保措施。
有机化学ppt-醛酮醌

a.α-C上含有三个活泼氢的醛,酮与碘的氢氧化钠溶液作用, 生成碘仿(黄色沉淀,有特殊气味)和羧酸钠,称碘仿反应。
b.常用此反应鉴别乙醛和甲基酮以及有( 醇。
)结构的
(2)羟醛缩合反应
O
H
OH
稀OH-
CH3 C H + CH2 CHO
CH3 CH CH2 CHO
乙醛
乙醛
β- 羟基丁醛
是增长碳链的一种方法。
O
O
O
O
O
O
1,4-苯醌 (对苯醌)
1,2-苯醌 (邻苯醌)
O
1,4-萘醌 (α-萘醌)
1,2-萘醌 (β-萘醌)
二、重要的醌及性质 (一) α-萘醌和维生素K
许多天然的植物色素含有α-萘醌的结 构,如维生素K类,它们存在于绿叶蔬菜 中,具有促进凝血作用,故在医学上常用 作止血剂,亦可用于预防长期口服广谱抗 生素药物引起的K族维生素缺乏症。
3-甲基丁醛 β -甲基丁醛
O CH3CHCCH2CH3
CH3 2-甲基-3-戊酮
CH3CH=CHCHO
2-丁烯醛
(CH3)2CHCH2COCH3 4-甲基-2-戊酮
CH3COCH2COCH2CH3 2,4-己二酮
O
CH3CH=CHCCH2CH3
4-己烯-3-酮
OHCCH2CHO 丙二醛
三、醛酮的物理性质
目录
Contents
第一节 醛和酮 第二节 醌
第二节 醌
一、醌的结构和命名 醌是一类具有环状共轭体系的环己二烯二酮类化合物
O
O
O
O 对位
邻位
一、醌的结构和命名
命名:以相应的芳烃衍生物来命名,苯醌、萘醌、蒽醌等,两
有机化学——醛、酮、醌

? OH
OH CH3CHCHCHO CH3 OH CH3CH2CHCHCHO CH3 OH CH3CH2CHCH2CHO
(4)交叉醇醛缩合反应 (Claisen-Schmidt reaction)
OH CHO + CH3CHO CH-CH2CH=O
延长碳链!
CH=CH-CH=O
肉桂醛
(5). 分子内的醇醛反应
1) Et2O 2) H+
OH CH2CH3
O HC NH3 C Na
ONa C CH
H2O
OH C CH
(二)α-H 的反应
1、烯醇 化 H C H
H
C O C C H OH
+ C H 酮式 C O H
+
C
..
C
O (1)
碳 负离 子 H + C C O (2) 烯醇 阴 离 子
(α- H)
O Na2CO3,H2O OH -H2O O O
O
1,6-环葵二酮
(三)、歧化反应(Cannizaro’s reaction)
NaOH HCOONa + CH3OH 2 HCHO △
CHO + HCHO
(氧化剂)
(还原剂)
Na OH △
CH2OH + HCOONa
1、歧化化反应机理
CHO CHO COOH CH2OH
H
+ R
OCH3 C H OH2 +
-H2O R
OCH3 C + + O H H
OCH3 R-CH
+ H OCH
3
R
缩醛
OCH3 CH3OH + C OCH3 R-C H H
第八章醛和酮
CN C OH
还原
CH3 CH3—C—CH2—NH2 OH
β-羟基胺
CH3 CH3OH CH2=C—COOCH3 H2SO4
α-甲基丙烯酸甲酯
例如:
O C H3C HCN CH3 NaOH OH H3C C CN CH3
水解
脱水 H2C C COOH H3C C COOH CH3 CH3
OH
适应范围:
溶解度:与醇相似。低级醛、酮可溶于水;高级醛、酮 不溶于水。 因为醇、醛、酮都可与水形成氢键:
H R-O H H-O R H C=O H H-O R R' C=O H H-O
第三节 醛、酮的化学性质 一、羰基的结构
羰基中C和O均采取Sp2杂化成键。O上有两对孤 电子未参与成键。
甲醛的结构
键 H C H p轨道 甲醛的结构与羰基的极性 O H 键 孤对电子 O C
二、亲核加成反应
δ -O δ C
+
Nu 慢 + Nu A C (1) O A (2)快
Nu C OA
负氧离子中间体
注意与烯烃的 C=C 的亲电加成反应区别。
影响亲核加成的因素:
一般来说,醛比酮活泼些。这是因为一方面酮的羰基碳连有 两个烷基,而烷基具有给电子的诱导效应,这样使羰基碳所 带正电荷比只连有一个烷基的醛少;另一方面,两个烷基的 空间位阻也比一个烷基大。例如:脂肪族醛酮的活性顺序为:
H C O > H H R C O > H3C R C O > R' R C O
对于芳香醛、酮而言,苯环上有吸电子基团使羰基碳的正电 性增强,有利于亲核加成;反之,活性降低:
O O2N C H O O
>
羰基化合物:含有羰基(

第八章 醛、酮、醌第一节 醛、酮一、结构、命名1. 结构:羰基化合物:含有羰基( C=O )的化合物为羰基化合物。
R 1、R 2均为烷基时,分子称为酮;R 1、R 2有一个或二个为氢分子称为醛。
芳香醛酮:羰基与芳环直接相连的化合物。
醛、酮 脂肪醛酮:羰基与脂肪烃基相连的化合物。
不饱和醛酮:羰基与不饱和烃基相连的化合物。
羰基C 为sp 2杂化,杂化轨道分别与其他的原子形成三个σ键,余下的一个p 轨道与氧的p 轨道形成一个π键。
π键电子云偏向O 、C 上带部分正电荷利于亲核试剂的进攻。
2.命名:⑴ 普通命名法:① 简单醛 烷基+“醛”异丁醛 正十二醛 (月桂醛)② 简单酮:按羰基所连的两个烃基的名称来命名,按顺序规则,简单在前,名称为“甲酮”。
甲(基)乙(基)酮 二乙(基)酮 2-羟基丙醛(α-羟基丙醛) ⑵ 系统命名法:① 基本规则同前面讲过的其他化合物相似。
注意:选主链时,要选含羰基的最长链为主链,编号时从离羰基最近的一端开始编号,名称为“醛”或“酮”。
4-甲基-2-戊酮 3-甲基丁醛 ② 分子中含苯环的,常以苯环作为取代基。
1-苯基-1-丙酮 苯乙酮O R 1CR 2OR 1CR 2¨¨C HOC H CH 3C H 3C HOCH 3(CH 2)10CH 31C H 23C H 34OC2CH 31C H 22C H 24C H 35C3OC H1C H 2CH 33O H OC H1C H 22C H 3CH 34C H 3OC H 31C H 23C H 4CH 35C H 3C2OC1C H 22C H 33O C1C H 32O③ 复杂:2-丁烯醛 4-庚烯-2-酮 二、物理性质:常温下,除甲醛是气体外,,十二个碳原子以下的醛酮是液体,高级的醛酮和芳香酮多为固体。
分子一般具有较大的极性,因此沸点比分子量相近的烃和醚要高,但比相应的醇要低。
醛酮的分子可以与水形成氢键,低级的醛酮(四碳以下的脂肪醛酮)易溶于水,五碳以上的醛酮,微溶或不溶于水中,而易溶于有机溶剂中。
有机化学第八章醛酮醌

•能发生碘仿反应的结构:
O CH3 C 、CH3 OH CH
• 乙醛 • 甲基酮 • 含CH3CHOH—的醇 NaOX为强的氧化剂,可将此类结 构氧化成:CH3-CO-
•下列化合物哪些能发生碘仿反应?
(1)CH3CH2OH (2)CH3CHO (3)异丙醇 (4)-苯乙醇 (5)CH3-CO-CH2-CH2-COOH 答:都可以。 注意:乙酸不可以(Why?)
(1)碳碳双键加成
2,3,5,6-四溴环己二酮
(2)1,4-加成 — 苯醌可与氢卤酸 , 氢氰酸和胺发生 1,4-加成,生成1,4-苯二酚的衍生物.
(3) 羰基加成 ——对苯醌能与一分子羟胺和二分子羟 胺生成单肟或双肟。
•与羟胺反应
•苯醌单肟( wo) 与对 亚硝基苯酚的互变
互变异构体
(4)还原反应 •对苯醌与对苯二酚可通过还原与氧化反应互变。
2,4-二硝基苯肼
腙 (zong)
(E)醛酮与氨基脲的反应:
氨基脲
脲(niao)
• 醛酮与氨衍生物的反应历程: 第一步:羰基的亲核加成,生成不稳定的加成产物; 第二步:失去一分子水.
• 醛酮与氨衍生物的反应是——加成-脱水反应.
• 氨衍生物对羰基的加成一般可在弱酸催化下进行, 其历程和醇对羰基的加成相类似。
注意:两种方法的适用范围
• 克莱门森还原——适用对酸不敏感的化合物;
如:NH2-CH2-CH2-CO-CH3,就不能用此方法, 含有-NO2也被同时还原。
• 沃尔夫 - 凯惜钠 - 黄鸣龙反应 —— 适用对碱不
敏感的化合物; 如:含有羧基等就不行。
补充:
-CO,-NO2均 还原!
用HCl,可使 之变为酚!
•1,4-萘醌的制备1 •工业上用氧气氧化。
醛、酮、醌

醛拼音:quán醛([Chemistry] aldehyde):有机化合物的一类,是醛基(-CHO)和烃基(或氢原子)连接而成的化合物。
醛-结构醛的通式为R-CHO,-CHO为醛基。
醛基是羰基(-CO-)和一个氢连接而成的基团。
醛-分类按照烃基的不同,醛可分为脂肪醛和芳香醛。
芳香醛的羰基直接连在芳香环上。
按照醛基的数目,醛可以分为一元醛(二元醛和多元醛。
按烃基是否饱和可以分为,饱和醛,不饱和醛。
醛-命名简单的醛常用普通命名法。
芳香醛中芳基可作为取代基来命名。
多元醛命名时,应选取含醛基尽可能多的碳链作主链,并标明醛基的位置和醛基[1]的数目。
不饱和醛的命名除醛基的编号应尽可能小以外,还要表示出不饱和键所在的位置。
许多天然醛都有俗名,例如,肉桂醛(cinnamaldehyde),茴香醛(anisaldehyde),视黄醛等(retinal)。
(注:饱和一元脂肪醛的通式为Cn H2n O,分子式相同的醛、酮、烯醇互为异构体)醛-重要反应银镜反应:R-CHO + 2Ag(NH3)2OH —(条件:水浴60℃加热)→ R-COONH4 + 2 Ag↓ + 3NH3↑ + H2O与新制氢氧化铜(斐林试剂、班氏试剂)反应:R-CHO + 2Cu(OH)2 —(条件:加热)→R-COOH + Cu2O↓ + 2H2O与溴水反应:R-CHO + Br2 + H2O —→ R-COOH + 2HBr加成反应:R-CHO + H2 —(条件:镍做催化剂,加热)→ R-CH2-OH2R-CHO+O2—(条件:铜或者银做催化剂,加热)→ 2R-COOH注:醛类也可通过和高锰酸钾反应(条件:加热)得到羧酸,方程式高中不需掌握甲醛与苯酚反应生成酚醛树脂反应规律在氧化还原反应中,醛类被氧化则生成酸,被还原则生成醇。
酮定义:酮是羰基与两个烃基相连的化合物(正式学名为“某基·某基甲酮”)。
根据分子中烃基的不同,酮可分为脂肪酮、脂环酮、芳香酮、饱和酮和不饱和酮。
醛-酮-醌

规律
1、与甲醛反应,生成增加一个碳的一级醇 2、与其它醛反应,生成二级醇(仲醇) 3、与酮反应,生成三级醇(叔醇)
写出由相应的羰基化合物及格氏试剂合成2-丁醇的两 条路线.
A CH3CH2CHO + CH3MgBr
B CH3CHO + CH3CH2MgBr
分别由苯及甲苯合成2-苯基乙醇
CH3 Cl2 光照 Br
CO
Nu C O -
进一步反应 产物
氧亲核试剂——RO-,OH硫亲核试剂——SO3H-,RS氮亲核试剂——RNH2,HONH2,RNHNH2 碳亲核试剂——CN-,RMgX
(1) 加氢氰酸: 醛、脂肪族甲基酮、8个碳以下的环酮可以和HCN加成, 生成α-羟基腈。 α-羟基腈水解得α-羟基酸。
CH3CH2CH O + HCN
R CO
R
Zn-Hg HCl
R CH2
R
此法适用于还原芳香酮,是间接在芳环上引入直链烃基的方法。
+ CH3CH2CH2C
O H
AlCl3
O C CH2CH2CH3
Zn-Hg/HCl
CH2CH2CH2CH3
80%
此法对芳酮较好,对酸敏感的醛或酮不能使用。
吉尔聂尔-沃尔夫-黄鸣龙还原法 此反应是吉尔聂尔和沃尔夫分别于1911、1912年发现的, 1946年-黄鸣龙改进了这个方法。故此而得名。
CH3CH=CHCH2CHO
① LiAlH 4 干乙醚
② H2O
CH3CH=CHCH2CH2OH (只还原 C=O )
LiAlH4是强还原剂,但其 ①选择性差,除不还原C=C、C≡C外,其它不饱和键都可被 其还原。 ②不稳定,遇水剧烈反应,通常只能在无水醚或THF 中使用
第八章醛酮和醌

一些常见醛和酮的物理性质
(续表) O
O
O
H3C C C2 H C CH3
酮式(24%)
H
O
O
H3C
CH3
烯醇式(76%)
2.卤代反应 卤仿反应:含有a-H的醛或酮与卤素的氢氧化钠 溶液作用,首先生成a-三卤代物,后者在碱性溶 液中立即分解成三卤甲烷(俗称卤仿)和羧酸盐
+ O
X 2 , H O -
O
H O -
H 3 CCR(H) C3XCR(H)
放在前面,较复杂放在后面,最后加 “酮”;
含芳烃基酮命名时把芳烃基放在名称前面。
O H3C C C2H5
CO2C CH 3 H
甲基乙基酮
苯基乙基酮
(二)系统命名法
脂肪族一元醛酮命名时,选含羰基碳原 子最长碳链为主链,从靠近羰基一端给主链 编号,取代基的位次与名称放在母体前,醛 基与只有一种可能位次的酮基不必标明位次
一、醌的结构与命名 1.醌的结构
醌是一类环状共轭α,β-不饱和二酮
O
O
O
O
2.醌的命名 在醌字加上相应芳烃的名称,同时注明
两个羰基的相对位置。环上有取代基时,还 要在醌字前注明取代基的位次、数目和名称
O
O
O
O
O
O
O
1,4-苯醌 1,2-苯醌
1,2-萘醌
O
1,4-萘醌
醛酮的结构——精选推荐
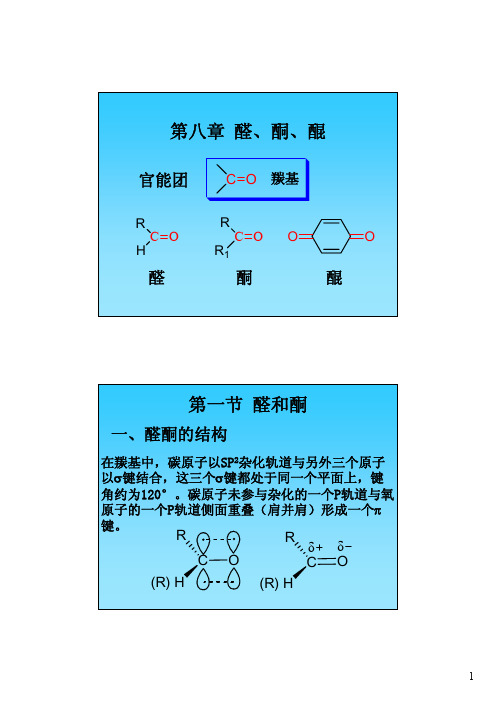
第八章醛、酮、醌官能团醛酮C O RR 1C O RH OO 醌C O 羰基第一节醛和酮一、醛酮的结构在羰基中,碳原子以SP 2杂化轨道与另外三个原子以σ键结合,这三个σ键都处于同一个平面上,键角约为120°。
碳原子未参与杂化的一个P轨道与氧原子的一个P轨道侧面重叠(肩并肩)形成一个π键。
δδC O R (R) H C OR(R) H二、醛酮的命名对苯二甲醛顺-丁烯二醛环己基甲醛3-甲基-2-乙基戊醛H CHOH CHOOHC CHOCHO CH 3CH 2CCH 2CHO O 3-氧代戊醛CH 3CH 2CH CHCHOCH 2CH 3H 3C1-苯基-1-丙酮3-乙基己醛3-甲基-5-庚烯-2-酮CCH 2CH 3OO HO CH 33-甲基环戊酮2,7-壬二酮OOOO O螺[2.5]辛-6-酮1,7,7-三甲基二环[2.2.1]庚-2-酮1-苯基-2-丙酮二苯甲酮OO3,3'-二甲基-4-甲氧基二苯甲酮C OH 3C CH 3OCH 3第二节物理性质由于羰基的偶极矩,增加了分子间的吸引力,因此醛酮的沸点比相应分子质量的烷烃高得多,但比相应分子质量的醇低。
醛酮的氧原子可以与水形成氢键,因此低级醛酮可以与水混溶,随着相对分子质量的增加,在水中溶解度大大降低。
第三节化学性质一、羰基的加成由于羰基碳原子带部分正电荷,容易与一系列的亲核试剂发生加成反应,称羰基的亲核加成反应,或称1,2-亲核加成。
常见的亲核试剂:CN RNH2RSOHROH H2ONH3RMgX(一)与氢氰酸的加成醛及多种活泼的酮(脂肪族甲基酮及少于8个碳原子的脂环酮)与氰基负离子的碳原子发生加成反应,生成α-羟基腈。
O +H CN C CNOHOHCH 3CHO HCN +OH CH 3CHCN OH H CH 3CHCO 2HOHCH 3C CH 3O +HCN NaOHCH 3C CH 3OHCNCH 3OHH 2SO 4CH2C CH 3C OOCH 390%(二)与亚硫酸氢钠的反应醛或活泼的酮(脂肪族甲基酮及少于8个碳原子的脂环酮)在室温下与过量的饱和亚硫酸氢钠(40%水溶液)溶液一起振荡,不需加任何催化剂反应即可发生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
N - Y
( 4 )
+ R`MgX
Y =
H
R C OMgX H2O R R` O H
R C OH + MgOHX R N H R` N H - C
(5)
2
6
H 5
试剂名: 氨 羟胺 产物名: 亚胺 肟
肼 腙
苯肼 苯腙
12
醛,酮的典型加成反应如下: 1.1 加HCN (醛,脂肪族甲基酮和8个碳以下的环酮)
α -H 的反应
7
1,.羰基的加成反应 2,氧化和还原反应 3,α-H的反应 4,歧化反应
8
1,羰基的加成反应
很容易想到,羰基含有C=O双键,具有 不饱和性,应该和碳碳双键,碳碳三键一样 ,可以进行加成反应.实际上,加成反应正 是羰基的典型反应之一. 在碳碳双键的加成中,首先是亲电试剂 先进攻碳碳双键,是亲电加成;但在羰基的 加成反应中,首先是亲核试剂先发起进攻, 进攻的地方是碳原子,这叫亲核加成.
第八 章 醛,酮,醌
一,醛,酮的分类和命名
二,醛,酮的结构
三,化学性质
1
一,醛,酮的分类和命名
分子中含有羰基的化合物叫羰基化合物,可分 为三类: O
O R - C H C H
醛:
O O R - C R C R
羰基物:
酮:
O
O O
醌:
O
2
当羰基直接与芳基相连时,这种化合物叫芳香 醛或酮,如:
O
O
H
B r - - B r
- H
C
C H 2 B r
31
在碱性介质中反应,不能控制在单取代阶段,如: O O
C H 3 C C H 3 + I 2 d . O H C H 3 C C I 3 + H I
在浓碱性条件中,则:
O C H 3 C C H 3 + I 2 c . O H C H 3 C O O + C H I 3 + N a I
32
这就是有名的卤仿反应 卤仿反应,历程如下: 卤仿反应
O H C H 2 + O H - H 2 O C H 3 C H 3 C O O C C H 2 B r - - B r C H 3 C C H 2 B r
被溴取代的碳上的氢由于溴的吸电子作用更加活泼, 更易被取代:
O H C B r 2 C H B r + O H O C H 3 C C B r 3 - H 2 O C H 3 C C H 3 O C H B r B r - - B r C H 3 C O C H B r 2
CH3-C
OH
结构的醇.凡是这两类化合物都可 以发生碘仿反应,而其他的不行. 之所以可以发生碘仿反应是因为它容易被 I2+NaOH 首先氧化成甲基酮之故.醛只有乙醛 可以发生该反应.
35
(2)羟醛缩合
有α活泼氢的醛酮在稀碱(10% NaOH)的催化下 可以发生自身的加成作用:
O H C H + C H 3
NH-C6H5 苯肼 苯腙 返回
NHCONH2 氨基脲 缩氨脲
19
意义: 1. 鉴别.醛酮与2,4-二硝基苯肼生成黄色沉 淀,产物有一定的熔点,可用来鉴别醛酮. 2. 分离提纯.生成物在稀酸作用下,分解为 原来的醛酮.
20
1.5 加ROH
无水HCl R C=O + R`OH H
R OH C H OR`
实际上这是一个平衡反应,只不够是平 衡大大趋向右边罢了.在体系中烯醇式 含量很少,但确实存在.
28
从酚的性质,我们很容易理解烯醇的羟基的氢具 有酸性,即活泼,容易形成氢正离子,由于酮式 和烯醇式是相互变化的,所以我们说酮式中的αH也是活泼的:
O H C C H 2 O H C H 3 C C H 3 C H 3 C C H 3 O C H 2 + H
CH3(H) R
C-OH
CH3(H)
C=O + Na2SO3 + CO2 + H2O
CH3(H)
意义:分离,提纯醛,酮
18
1.4 与氨的衍生物作用
R R`(H)
..
C=O + HNH-Y
OH H
R
C
R`(H)
N-Y
-H2O
R
C= N-Y
R`(H)
Y= R 试剂名:胺 产物名:西佛碱
OH 羟胺 肟
NH2 肼 腙
丙酮
C O
甲丙酮
C O
二乙甲酮
C H 3
二苯甲酮
苯乙酮
4
二,醛,酮的结构
醛,酮的结构主要是羰基的结构问题,因为它 是醛酮的官能团,再者与之结合的烃基结构我们已 经讲过.所以我们只讲甲醛的结构. 羰基中的碳采取SP2 杂化形式,这三个SP2 杂化 轨道用来与氧和二个烃基或氢结合;碳上还剩下一 个未杂化的P轨道.羰基中的氧是没有杂化的,其 电子构型如下:
C
C R
但下面这 个化合物:
C H 2 C H 2 C H O
不是芳香醛,其他的就叫脂肪醛或酮.应该注 意的是醛基常写成-CHO,但不能写成-COH!
3
醛,酮的命名按系统命名法比较简单,同学们 可以自学,这里只介绍一下酮的习惯命名法:
O C H 3 - C - C H 3 O C H 3 - C - C H 2 C H 2 C H 3 O C H 3 C H 2 - C - C H 2 C H 3
酸或碱对这个反应有催化作用.
29
最典型的α-H反应有下列二个: (1)卤代反应及卤化 在中性或酸性催化下,醛酮的α-H容 易被卤素所取代,如:
C O
C H 3 +
B r 2 O
C
Байду номын сангаасC H 2 B r
注意:不发生苯环上的取代反应, 反应可以控制在单取代阶段.
30
其历程为:
C O C O H O H C H 2 B r C H 2 H C O H C H 2
33
O
在
C H 3
C
C B r 3
中,由于 作用:
C B r 3
的作用使羰基很
O H
活泼,易与
O C H 3 C C B r 3 + O H C H 3 C O H O O C O H + C B r 3 C H 3 C O + H C B r 3 C H 3 O C B r 3
34
常用的反应是碘仿反应 碘仿反应,因为CHI3 是一个 碘仿反应 具有特殊气味的淡黄色结晶,这个反应用 于鉴别甲基酮和具有
9
为什么同是双键,一个发生亲电加成而另一 个发生亲核加成呢?这当然是由于结构的不同所 引进的,下面我们来分析一下:
C C + + E - - N u S l o w C C + E + C O + E - - N u Q u i c k E + C O N u E Q u i c k C C N u E
半缩醛,不稳定
R OH 无水HCl C + R`OH H OR`
R OR` C H OR`
缩醛,稳定
21
缩醛在碱性溶液中比较稳定,但在酸的水溶液 中易水解为原来的醛:
酸溶液
R OR` C H OR`
H+
R C=O + R`OH H
意义:保护-CHO.-CHO 比较活泼,当含有-CHO 的 分子在进行分之中其它基团的氧化等反应时,-CHO 往往也参与反应.为了使-CHO 保留不变,可先将CHO 转化为缩醛,然后再进行分子中的其它基团的 反应,最后使缩醛水解而重新获得原来的醛基.
H C N
H
+
C N
在体系中加入酸,平衡向左移动,CN- 浓度下降,这 说明反应速度是由CN- 决定的,而不是H+,因为这时 H+ 浓度因加入酸而应该增加.而当加入碱时,上面的 平衡向右移动, CN- 浓度增加,反应速度加快,也就 是说碱能催化这个反应.这也同样说明上面的问题.
14
因此提出这个反应的历程是:
26
Ag Cu2O Cu2O
3.α-H的反应
官能团邻位碳原子上的氢叫α-H.如:
C H C H O H C C l H C C = C
一般α-H比较活泼,叫α活泼氢.
27
回顾以前我们遇到的烯醇式结构:
O H C
C H 2
C H 3
我们说它是很不稳定的,容易重排成羰 基化合物: O
O H C C H 2 C H 3 C H 3 C C H 3
15
判断一个反应步骤是快或是慢,一般可以这样来进 行:正负离子间的反应一般是快的,而产生带电荷 的反应一般是慢的.另外,在反应过程中,反应中 心C=O上的碳是从平面三角形变成四面体形,在三 角形中与中心碳相连的三个基团相距较远;而在四 面体形中,与中心碳相连的四个基团相距较近,因 此相互排挤,当这些基团越大时,拥挤越历害,也 就是越不容易形成,因所得的产物不稳定,这种现 象叫空间效应.如反应速度: O O
1° ROH
2° ROH
R1 2 C=O R
3° ROH
17
1.3 加 NaHSO3(醛,脂肪族甲基酮和7个碳以下的环酮)
R R SO3Na
C=O + NaHSO3
CH3(H)
C-OH
CH3(H)
R
α- 羟基磺酸钠
40%
R
SO3Na
+ HCl + Na2CO3
C=O + NaCl + SO2 + H2O
N u
S l o w C
O N u
