高通量药物筛选利器——HTRF 原理介绍
高通量药物筛选技术及其在药物研发中的应用

高通量药物筛选技术及其在药物研发中的应用随着生物医学领域的进展,越来越多的有机化合物被合成并用于药物研发。
而高通量药物筛选技术的引入,则大大提高了药物研发的效率。
本文将简述高通量药物筛选技术的概念和原理,以及其在药物研发中的应用。
一、高通量药物筛选技术高通量药物筛选技术(High-Throughput Screening,HTS)是一种通过快速、自动化的方法对大规模的化合物进行筛选的技术。
其主要的应用范围包括了代谢病、疼痛、肿瘤、心血管疾病等多种疾病的药物研发。
HTS技术的主要作用是,用最短的时间、最少的成本,筛选出能够绑定患者体内特定蛋白质的化合物,从而用于开发新的药物。
二、高通量药物筛选技术的原理HTS技术是基于“高速分析技术”、”高速自动化技术”和”高效率数据管理系统”的一种技术。
这三个方面的协作组成了当前大规模药物研发中的关键技术:高通量筛选。
具体来说,HTS需要依靠以下三个步骤实现:1.大规模药物化合物库:对于HTS技术而言,庞大的化合物库是基本的保障。
众所周知,化合物在自然界中的发现、分离和纯化都是一个相对困难的过程,而高通量化合物合成技术即使开展后效率都很低。
在这种情况下,就需要建立一个包含大量有效化合物的数据库。
2.适当的自动化技术:HTS技术不同于单个化合物的筛选,需要处理的样本容量在几千上万个,需要依赖自动化仪器和方法。
常常涉及移液、夹制、输液等操作。
这些自动化技术需要经过良好的条件和谐调和的,同时浓度的自动控制也是个问题。
3.高效的分析技术:高通量筛选分析需要具备极高的分辨率和灵敏度。
对于分子生物学和化学分析等领域的科学家而言,需要利用小巧精致的仪器,来对数千甚至数百万个样品进行检测。
高效性是HTS最重要的特点之一。
三、高通量药物筛选技术在药物研发中的应用HTS技术在药物研发中的应用非常广泛,涉及到药物发现、药物设计、药物活性优化等方方面面。
HTS技术能够提高药物研发的效率,并在很大程度上缩短了药物研发的周期。
HTRF技术

生药活性成分的高通量筛选技术高通量筛选(High throughput screening,HTS)技术是20世纪80年代后期发展起来的一种药物筛选新技术。
它集计算机控制、自动化操作、高灵敏度检测、数据结果自动采集和处理于一体,实现了药物筛选的快速、微量、灵敏和大规律,日筛选量达到数万甚至数十万样品次,是新药发现技术和方法的一大进步。
传统的药物筛选方法是采用药理学的实验方法,通过体内、体外的多种实验方法,评价药用样品的药理活性。
但是,由于传统的药理实验方法需要消耗大量样品,使用大量实验动物,参加实验的技术人员具有较熟练的操作技能,而且筛选样品量有限,劳动强度大,不能适应大量样品的同时筛选。
高通量药物筛选是在传统的筛选技术基础上,应用先进的分子生物学、细胞生物学、计算机、自动化控制等高新技术,建立的一套更适合于药物筛选的技术体系。
本文试对高通量筛选技术的基本原理及其在生药活性成分筛选中的应用做一简单论述。
1.基本原理高通量药物筛选技术是将多种技术方法有机结合而形成的新的技术体系,它以分子水平和细胞水平的实验方法为基础,以微板形式作为实验工具载体,以自动化操作系统执行实验过程,以灵敏快速的检测仪器采集实验数据,以计算机对实验获得的数据进行分析处理。
它的正常开展需要有一个高容量的化合物库、自动化的操作系统、高灵敏度的检测系统、高效率的数据处理系统以及高特异性的药物筛选模型。
1.1 化合物样品库高通量筛选是一种利用已有的化合物进行的体外随机筛选。
因此通过高通量药物筛选发现先导化合物(leading compounds)的有效性取决于化合物样品库中化合物的数量及其质量。
化合物样品的数量是指不同样品的数量。
化合物样品的质量主要由化合物结构的多样性决定的。
许多活性反应基团(reactive groups)使初筛的假阳性大量增加,剔除这些化合物可以提高化合物样品库的质量。
化合物样品主要有人工合成和从天然产物中分离纯化两个来源。
HTRF used in Kinase research

HTRF激酶检测解决方案激酶简介激酶是磷酸转移酶的一种,它在控制细胞生长,代谢,分化和凋亡的很多信号通路中起着核心作用。
激酶能催化一个磷酸基团从三磷酸腺苷(ATP)转移到特定的底物上。
这些底物可以是蛋白、多肽、脂质,糖,核苷,这些底物被磷酸化后会被激活从而发挥出一些特殊功能,例如在信号传导,调控细胞周期以及代谢等复杂的功能中发挥作用。
因此激酶跟人体的多种疾病如肿瘤,炎症,免疫失调,代谢疾病等有关。
激酶通常根据它们的底物命名。
激酶当中最大的一类是蛋白激酶,蛋白激酶作用于特定的蛋白或多肽,并改变其活性。
目前在人类基因组中已经发现了500多种蛋白激酶,占了人类所有基因的2%左右。
蛋白激酶可以分为:丝氨酸/苏氨酸蛋白激酶,酪氨酸蛋白激酶,组氨酸蛋白激酶,色氨酸蛋白激酶,天冬氨酰基/谷氨酰基蛋白激酶,目前研究的比较多得是前两类。
Cisbio公司利用其专利HTRF技术,开发出一系列的激酶平台,可以分为以下四类:HTRF KinEASE TM, HTRF Transcreener ADP, HTRF Kinase toolbox, Cellular Kinase assays。
目前这些产品被世界上几乎所有的大型药企广泛使用,本期我们将对这些产品逐一作介绍。
HTRF KinEASE TM试剂盒----测定丝氨酸/苏氨酸激酶,酪氨酸激酶活性最方便的平台丝氨酸/苏氨酸激酶和酪氨酸激酶是药筛的主要靶点。
Cisbio Bioassays和Millipore合作研发了基于HTRF技术的四个激酶试剂盒,已经有160多种激酶利用这个平台上得到了验证。
HTRF KinEASE TM四个试剂盒的实验方法都是一样的,每一个试剂盒都包含有一个通用的生物素化的多肽底物,一个标记了Eu的只针对特异性磷酸化位点的单抗,Sa-XL665以及实验缓冲液。
如图1所示,丝氨酸/苏氨酸激酶试剂盒有三种不同试剂盒,每一种有不同的底物;酪氨酸激酶试剂盒有一种底物,每一种底物都适用于一系列的激酶。
htrf法 -回复

htrf法-回复[HTRF法]:一种高灵敏、高准确性的生物分析技术引言:近年来,生物分析技术在生命科学和药物研发领域发挥着至关重要的作用。
其中,HTRF法(Homogeneous Time-Resolved Fluorescence Assay)以其高灵敏度、高准确性和简便操作而备受瞩目。
本文将一步一步回答关于HTRF法的基本原理、应用领域和未来发展方向。
一. HTRF法的基本原理HTRF法是一种光学测量技术,其基本原理是通过荧光共振能量传递来检测分子之间的相互作用或反应。
这个传递过程需要三个关键成分:Donor 标记物、受体标记物和荧光基质。
1. Donor标记物:Donor标记物是受体分子表面的产生能量的物质,通常是用稀土金属离子(如铕或镭)标记。
Donor标记物在受到激发光照射后会发射光子。
2. 受体标记物:受体标记物是Donor标记物能量传递的接收者,通常用荧光染料或荧光蛋白标记。
当Donor标记物的发射光与受体标记物的激发光在频率匹配时,能量会传递给受体标记物。
3. 荧光基质:荧光基质是一个短寿命的荧光化合物,例如有机化学家染料Terbium。
荧光基质在受到发射光照射后,会产生荧光信号,并在一段时间后减弱。
基于这个原理,HTRF法如下工作原理:首先,通过标记Donor和受体标记物,将其加入试验样品中。
当样品中发生特定的分子相互作用或反应时,Donor标记物的发光会与受体标记物的激发光匹配,从而传递能量,使受体标记物产生荧光。
荧光基质会吸收这些荧光,并在一段时间后发射出荧光信号,该荧光信号可以被检测并与样品中分子相互作用的程度相关联。
通过检测荧光信号的幅度与光谱特性,我们可以量化目标分子相互作用的强度和动力学参数。
二. HTRF法的应用领域1. 蛋白质相互作用研究:HTRF法被广泛应用于研究蛋白质相互作用,如配体-受体结合、酶底物结合等。
该技术不仅能够定量测量蛋白质相互作用的强度,还可以研究这些相互作用的动力学参数。
htrf法 -回复

htrf法-回复[htrf法]原理与应用领域[htrf法](High-throughput Fluorescence Resonance Energy Transfer)是一种高通量荧光共振能量转移技术,广泛应用于生物医学研究领域。
本文将逐步讨论[htrf法]的原理、实验步骤和应用领域。
一、[htrf法]原理[htrf法]利用荧光分子之间的共振能量转移现象,测量分子之间的相互作用。
当两种荧光染料分别存在于分子A和分子B上时,它们的光谱特性可以相互影响。
其中一种染料吸收光子的能量会以非辐射跃迁的方式传递给另一种染料,从而导致获能染料的发射峰增强,另一种染料的发射峰减弱。
这种共振能量转移现象可以通过检测发射光谱的变化来量化分子之间的相互作用。
二、[htrf法]实验步骤1. 实验准备:准备待测样本、荧光探针和仪器设备。
2. 样本标记:将待测的分子A和分子B各自用不同的荧光染料标记。
选择合适的染料对是非常重要的,需要考虑其发射和吸收波长的兼容性以及染料的光稳定性。
3. 混合反应:将标记的分子A和分子B混合,使它们相互作用。
也可以加入其他试剂以改变反应条件,以便研究分子间的互作用。
4. 测量反应结果:使用[htrf法]分析仪器测量样品的荧光发射谱。
该仪器可以同时测量两种不同波长的荧光发射。
5. 数据分析:根据[htrf法]原理中共振能量转移的特点,分析测量到的发射谱数据,计算共振能量转移的效率。
这可以通过计算荧光峰的比例来完成,即获能染料峰的强度与失能染料峰的强度之比。
三、[htrf法]应用领域[htrf法]在生物医学研究中具有广泛的应用。
以下是一些常见的应用领域:1. 蛋白质相互作用研究:[htrf法]可用于研究蛋白质之间的相互作用,如蛋白质与配体的结合和酶促反应。
通过标记不同的蛋白质和配体,可以研究它们之间的相互作用及其动力学特性。
2. 细胞信号转导:[htrf法]可以用于研究细胞中信号传递途径的动态过程。
htrf方法学

htrf方法学一、HTRF方法学简介高灵敏度时间分辨荧光(HTRF)方法学是一种生物分析技术,主要用于检测低浓度目标分子。
它结合了时间分辨荧光(TRF)技术和高效液相色谱(HPLC)技术,具有高灵敏度、高特异性和宽线性动态范围等特点。
二、HTRF技术原理HTRF技术通过将目标分子与荧光标记物结合,利用荧光信号的强度和时间特性进行分析。
在实验过程中,样品经过HPLC分离,随后通过荧光检测器检测,实现对目标分子的定量分析。
三、HTRF方法学的应用领域HTRF方法学广泛应用于生物科学研究、药物筛选、生物标志物检测等领域。
在生物科学研究中,HTRF技术可用于研究蛋白质相互作用、酶动力学、核酸杂交等;在药物筛选中,可用于筛选药物靶点、评估药物活性等;在生物标志物检测中,可用于疾病诊断、疗效监测等。
四、HTRF方法学的优势与局限性优势:1.高灵敏度:HTRF技术可检测低至ng/L级别的目标分子。
2.高特异性:可通过特异性抗体或核酸探针实现对目标分子的识别。
3.宽线性动态范围:适用于不同浓度范围的样品分析。
4.快速检测:实验流程简便,检测速度较快。
局限性:1.仪器设备较高:HTRF仪器设备相对昂贵,投入成本较高。
2.检测范围有限:对于高浓度样品,HTRF方法的检测效果较好,而对于高分子量或大分子复合物的分析能力较弱。
3.操作技巧要求较高:实验过程中需要严格控制条件,以避免非特异性信号干扰。
五、我国HTRF研究与发展现状近年来,我国HTRF技术研究取得了显著成果,不仅在基础研究方面取得了突破,还成功应用于临床医学、药物研发等领域。
此外,国内多家企业致力于HTRF仪器设备的研发与生产,逐步降低了国外产品的市场占有率。
六、未来发展趋势与展望随着科学技术的不断发展,HTRF方法学在以下几个方面有望取得突破:1.仪器设备的微型化和便携化:通过技术创新,降低设备成本,实现HTRF 仪器的便携化,以满足现场快速检测的需求。
高通量药物筛选技术的原理及其应用

高通量药物筛选技术的原理及其应用随着生物技术的发展,药物筛选技术也得到了长足的发展。
在药物研发过程中,化合物的筛选和评价是至关重要的环节,而高通量药物筛选技术就是一项能够同时检测数千种化合物的高效筛选方法。
本文将从原理和应用两个方面介绍高通量药物筛选技术。
一、高通量药物筛选技术的原理高通量药物筛选技术是利用机器自动化处理大量的生物数据,对候选药物进行初步筛选和评价的一种方法。
它可以快速识别候选药物的药效、毒性、代谢途径等因素,从而提高药物的开发与利用效率。
高通量药物筛选技术的原理主要包括以下几个方面:1. 酶反应酶反应一般用于寻找抗酶剂,这些抗酶剂能够调节酶活性,从而达到治疗疾病的效果。
这种技术主要通过测定样品与酶的反应来评价化合物的抑制效果。
2. 细胞培养细胞培养技术是一种常用的高通量药物筛选技术。
其中,细胞培养包括细胞系培养、原代细胞培养、三维细胞培养等多种方法。
利用这些细胞培养技术,可以评估化合物在细胞水平上的活性、基因诱导效应、细胞毒性等方面。
3. 生物分子分析生物分子分析技术主要用于鉴定化合物如何与生物分子相互作用,比如蛋白质和核酸。
这里,技术实验会介绍一些基于酶联免疫吸附试验、荧光免疫分析、光敏乳糖单聚体技术等,对候选化合物的活性进行评估。
4. 真核细胞含量在药物筛选过程中,真核细胞含量评估是必不可少的,该技术可以反映化合物的毒性和细胞的健康状态。
具体实验过程包括测量细胞凋亡、细胞分裂、细胞增生和代谢等生物学指标。
通过这些指标,可以评估化合物对细胞的影响。
二、高通量药物筛选技术的应用高通量药物筛选技术在药物研发领域广泛应用,涵盖了抗病毒、免疫调节、抗肿瘤、抗衰老等多个方面。
下面我们将从几个方面介绍高通量药物筛选技术的应用。
1. 腺苷酸磷酸化位点筛选腺苷酸磷酸化位点是生物学中的一个重要概念,包括蛋白质的反应性、转运、代谢等诸多因素。
通过高通量药物筛选技术,可以同时测试大量的腺苷酸磷酸化位点反应,并评价化合物对位点的影响。
均相时间分辨荧光

Bagnols-sur-Cèze法国-2009年11月5日-Cisbio Bioassays ()公司是IBA旗下的子公司,也是药物研究和药物筛选领域HTRF (均相时间分辨荧光)技术的发明者。
今天Cisbio公司宣布,其在中国和韩国已建立了自己的销售团队,以便进一步开发亚洲市场。
本土销售团队将能让Cisbio为这两个迅速增长的生物制药市场的客户提供GPCR和激酶研究的HTRF平台、生物标志物检测以及其他相关的服务。
Cisbio Bioassays公司所销售的基于HTRF技术的产品包括:IP1, cAMP, Cellul’erk 以及Tag-lite™细胞表面受体平台。
这些业务将会通过IBA集团旗下的IBA中国分公司()来操作。
为了在亚洲市场拓展应用于癌症诊断和治疗方面的放射药物产品、仪器和方法, IBA集团于2007年建立了IBA中国公司。
韩国的销售业务则由位于首尔的代理商JCBio公司(www.jcbio.co.kr)负责。
JCBio公司专注于为制药和生物技术实验室提供相关商品。
“在过去的10年里,我们一直致力于在欧洲、北美和亚洲建立本土化的团队,针对特定市场并拓展我们在当地的业务。
” Cisbio Bioassays 市场部主管François Degorce说道,“我们的目标是成为一个客户至上的服务性公司,并让业务遍及全球。
我们在中国和韩国的团队将帮助我们促进与该两个重要市场的客户的关系。
”作为2009年度 Frost & Sullivan北美技术创新奖项的获得者,Cisbio Bioassays凭借着其专利技术HTRF领先于均相荧光方法领域。
HTRF是一种很灵敏且稳定的技术,主要应用于药物研发的高通量筛选阶段。
除了基于HTRF的一些产品外,Cisbio还能提供一系列的定制服务,其包括:为客户特定的实验蛋白,抗体或化合物等进行标记,为客户设计和研发实验方法,以及为客户提供HTRF 技术培训。
均相时间分辨荧光技术

卡尔·古斯塔法·莫桑德尔 (Carl·Gustaf·Mosander)
背景简介——镧
镧的发现
镧于1839年1月,由在斯德哥尔摩的卡罗林斯卡研究所的卡尔·古斯 塔法·莫桑德尔(Carl·Gustaf·Mosander)发现。他从在1803已 经发现的铈中提取了它。莫桑德尔注意到他的大多数氧化铈样本不 可溶,而有些是可溶的,他推断这是一种新元素的氧化物。他从铈 中提取出了第二种元素,他称之为didymium(镨钕混合物)。然而 他没有意识到didymium也是混合物,在1885年它被分离成了镨和钕。
解决方法:
背景荧光主要来自于样品成分,包括缓冲液、蛋白质、化合物和细胞裂解液。检测到的 荧光强度必须对这些自发荧光进行校正,极大地影响了实验灵敏度,并使数据分析变得复杂。 背景荧 光非常短暂(寿命为纳秒级) ,可以利用时间分辨荧光方法将其去除。
三、HTRF 技术原理
HTRF技术原理
HTRF技术结合了FRET和TRF两种技术。该技术是利用了具有穴状结构的Eu元素的螯和标记物和 XL665作为一个供体,是基于Eu穴状化合物的供体与受体(第二荧光标记物)之间的FRET。在FRET中, 受体发射荧光的寿命等同与供体的发射荧光的寿命。因为Eu的荧光衰减周期较长,所以含Eu的供体 会诱导XL665受体长时间地发射荧光,受体激发后产生的荧光便能持续较长时间,这样通过TRF就可 以区分那些短寿命的自身散射的荧光,这样从短寿命荧光背景中就很容易区分出FRET信号。
从 HTRF 能应用到临床诊断就能看出它也适用于浓度高的血 清在读板前或者孵育时加入氟离子能增强实验对大量化合物的抗 干扰性,对实验没有干扰而给实验提供了很大的灵活性。
穴没有光漂白性,多次读数后信号没有损失,因此能按照需 要的次数去读,这就给许多动力学检测提供了可能。
htrf方法

htrf方法HTRF方法简介HTRF(Homogeneous Time-Resolved Fluorescence)是一种高灵敏度的荧光检测技术,广泛应用于生物和药物领域的研究。
该方法通过利用能够发射长寿命荧光的荧光标记物,结合时间分辨荧光检测技术,实现了高度灵敏的分析和定量测量。
HTRF方法的原理是基于荧光共振能量转移(FRET)的原理。
在HTRF实验中,通常使用两种不同的荧光染料标记待测物的两个不同位置。
其中一个标记物发射的荧光能量与另一个标记物的吸收光谱区域相重叠,使得能量可以通过非辐射转移的方式从一个标记物传递到另一个标记物,从而引起第二个标记物的荧光信号。
这种共振能量转移只在两个荧光染料之间的距离在几纳米范围内才能发生,因此具有高度的选择性和特异性。
HTRF方法相较于传统的荧光检测技术具有许多优势。
首先,HTRF 方法可以在混合溶液中进行测量,无需进行分离或洗涤步骤,大大简化了实验流程。
其次,HTRF方法对于样品的浓度范围非常宽广,可以进行从纳摩尔到毫摩尔的浓度测量。
此外,HTRF方法对样品的光学性质要求较低,可以在复杂的基质中进行测量,如血清、细胞培养基等。
最重要的是,HTRF方法具有极高的灵敏度,能够检测到非常微弱的信号。
HTRF方法在生物和药物研究中有着广泛的应用。
在药物发现和开发领域,HTRF方法可以用于高通量筛选(HTS)和药物分子相互作用研究。
例如,可以利用HTRF方法研究药物与靶蛋白之间的结合情况,评估药物的亲和力和抑制活性。
此外,HTRF方法还可以用于研究细胞信号转导、蛋白质交互作用、酶活性等生物学过程。
在免疫学和细胞生物学研究中,HTRF方法可以用于检测和定量细胞中的信号分子、蛋白质表达水平等。
总结起来,HTRF方法是一种高灵敏度的荧光检测技术,通过荧光共振能量转移实现对分子相互作用和生物过程的定量测量。
该方法在生物和药物研究中有着广泛的应用前景,为相关领域的研究者提供了一个强大的工具。
HTRF技术原理和应用介绍
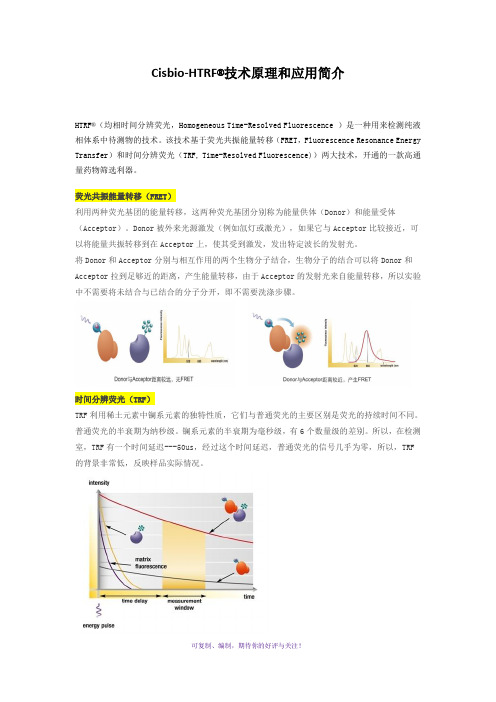
Cisbio-HTRF®技术原理和应用简介HTRF®(均相时间分辨荧光,Homogeneous Time-Resolved Fluorescence )是一种用来检测纯液相体系中待测物的技术。
该技术基于荧光共振能量转移(FRET,Fluorescence Resonance Energy Transfer)和时间分辨荧光(TRF, Time-Resolved Fluorescence))两大技术,开通的一款高通量药物筛选利器。
荧光共振能量转移(FRET)利用两种荧光基团的能量转移,这两种荧光基团分别称为能量供体(Donor)和能量受体(Acceptor)。
Donor被外来光源激发(例如氙灯或激光),如果它与Acceptor比较接近,可以将能量共振转移到在Acceptor上,使其受到激发,发出特定波长的发射光。
将Donor和Acceptor分别与相互作用的两个生物分子结合,生物分子的结合可以将Donor和Acceptor拉到足够近的距离,产生能量转移,由于Acceptor的发射光来自能量转移,所以实验中不需要将未结合与已结合的分子分开,即不需要洗涤步骤。
时间分辨荧光(TRF)TRF利用稀土元素中镧系元素的独特性质,它们与普通荧光的主要区别是荧光的持续时间不同。
普通荧光的半衰期为纳秒级。
镧系元素的半衰期为毫秒级,有6个数量级的差别。
所以,在检测室,TRF有一个时间延迟---50us,经过这个时间延迟,普通荧光的信号几乎为零,所以,TRF的背景非常低,反映样品实际情况。
HTRF®的能量受体(技术创新点)HTRF®的能量供体是铕(Eu)和钛(Tb)的穴状化合物。
在这个穴状化合物里,Eu和Tb被永久地嵌合在一个笼子里,结构非常稳定,这个结构由J.M.Lehn’s教授发明的,并由此在1987年获得了诺贝尔奖。
HTRF®的能量受体HTRF®的能量受体也有二种,XL665和d2.它们的光学性质相同,分子量不同,前者分子量为10KD,实际上就是别藻蓝蛋白(APC)。
药物筛选的新方法——高通量筛选技术

药物筛选的新方法——高通量筛选技术在医学领域,药物研发是一个十分复杂的过程。
其中,药物筛选是决定一种新药能否被研发成功的关键环节。
传统的药物筛选方法是通过单一或少量的生物学指标来测试药物的效果,但是这种方法效果不佳,筛选出的新药种类较少,筛选周期较长,费用较高。
为了克服这些弊端,科学家们提出了高通量筛选技术,这是一种用于快速筛选新药的新方法。
高通量筛选技术(HTS)是一项涉及多个领域的高科技技术,它将微量液体处理技术、光学成像技术、生物学、计算机和自动化技术等融合在一起,可以快速地对大量药物进行筛选。
HTS技术使得药物筛选的效率得到极大提升,同时也降低了研发成本。
高通量筛选技术的原理基于生物测定技术,可以对药物在大规模测试中的毒性、药理活性、代谢和药物相互作用进行评估。
HTS使用微型板和高通量分析仪器,可以同时检测成百上千种药物。
系统可以自动化测试过程,为化合物库中的药物快速、高效地获得耐受性和特定活性。
高通量筛选技术通常通过高速液体分配技术将药物样品分配到微孔板中。
目前,高通量筛选技术在药物研发领域极为广泛地应用。
例如,在发现潜在的抗癌化合物方面,HTS是非常成功的工具。
科学家可以使用此技术,对数百种化合物进行评估,找出那些对肿瘤细胞有显著影响的化合物。
通过HTS技术的应用,研究者可以发现许多具有潜力的抗癌化合物,这些化合物现在正在进一步的研究和开发中。
此外,在人类疾病治疗中,HTS越来越被认为是一种重要的筛选工具。
例如,HTS可用于开发抗生素、抗病毒药物和抗肿瘤药物。
它可以用于检测各种药物的药效,检测药物的性质以及检测药物的代谢。
HTS技术也可以用于了解大规模化合物库中化合物的相互作用。
高通量筛选技术相对传统的药物筛选方法,有许多优势。
首先,HTS技术是非常迅速的,可以处理大量样品和复合物。
其次,由于其自动化和微量药物评估程序,HTS还可以快速确定对生命的作用机制。
第三,HTS还可以自动识别具有生物活性的化合物,可以加快新药发现的速度。
高通量药物筛选利器——HTRF,在生物标志物(biomarker)中的应用

HTRF技术介绍快速、稳定、不需洗涤、操作简单、易于自动化和微型化。
上述优势使得Cisbio的HTRF技术一直是药物研发领域的领先技术之一,并广泛用于免疫检测。
该技术已经在知名医药公司、生物技术公司和学术研究机构应用了15年以上。
HTRF(均相时间分辨荧光,Homogeneous Time-Resolved Fluorescence )是用来检测纯液相体系中待测物的一种常用方法。
该技术结合了荧光共振能量转移(FRET,Fluorescence Resonance Energy Transfer)和时间分辨荧光(TRF,Time-Resolved Fluorescence))两种技术。
这种结合将TRF的低背景特点和FRET的均相实验方式融合在一起,使得HTRF技术拥有如下优势:实验方式Array灵活,具有很高的灵敏度和通量,实验数据稳定可靠,假阳性率较低。
虽然HTRF也是基于TR-FRET的化学技术,但它的许多特点把它与其它TR-FRET产品区分开来。
这些特点包括使用了镧系元素(铕和铽),从而具有非常长的半衰期,很大的Stroke's shift(如右图所示,Eu3+ Stroke’sshift > 300 nm);但是HTRF有其独特的地方,镧系元素与络合的穴相结合,这种结合的穴状物与其它所有TR-FRET产品使用的螯合物相比,显著增加了稳定性(可耐受低pH值、金属离子、DMSO、EDTA等);专利的比值测量能矫正淬灭和样品带来的干扰。
FRET技术简介FRET技术利用了两种荧光基团的能量转移,这两种荧光基团分别称为(能量)供体和(能量)受体。
供体被外来能源激发(例如闪光灯或激光),如果它与受体在足够近的距离之内,可以将能量共振转移到受体上。
受体受到激发,发出特定波长的发射光。
将供体和受体分别与相互作用的两个生物分子结合,生物分子的结合可以将受体和供体拉到足够近的距离,产生能量转移。
htrf技术原理

htrf技术原理一、引言htrf(high-throughput receptor functional assay)技术是一种高通量受体功能分析方法,用于研究受体与配体之间的相互作用和信号传导机制。
本文将介绍htrf技术的原理及其在生物医学研究中的应用。
二、htrf技术的原理htrf技术基于荧光共振能量转移(FRET)原理,通过测量荧光分子间的能量传递来研究受体与配体之间的相互作用。
其原理如下:1. 荧光共振能量转移(FRET)FRET是一种非辐射能量传递过程,发生在两个相互靠近的荧光分子之间。
该过程基于多种物理机制,其中最常见的是荧光蛋白或荧光染料的共振能量转移。
当一个荧光分子(受体)吸收光子能量并发射荧光时,如果有另一个荧光分子(配体)与之相互作用,能量将从受体传递给配体,导致受体的荧光减弱或熄灭。
2. 受体与配体相互作用的检测htrf技术利用了FRET原理来检测受体与配体的相互作用。
具体步骤如下:(1)在实验中,受体和配体分别与特定的荧光标记结合。
(2)当受体与配体结合时,荧光标记的受体与配体之间的距离缩短,从而促使FRET发生。
(3)通过激发受体特定的荧光标记,观察配体特定的荧光标记是否发生荧光减弱或熄灭,从而判断受体与配体的相互作用。
三、htrf技术在生物医学研究中的应用htrf技术在生物医学研究中具有广泛的应用,主要体现在以下几个方面:1. 受体配体筛选htrf技术可以用于大规模筛选化合物库,寻找与受体特异性结合的配体。
通过测量荧光信号的强度变化,可以筛选出具有高亲和力和特异性的配体,用于后续的药物研发。
2. 受体激活机制研究htrf技术可以用于研究受体的激活机制。
通过观察受体与不同配体结合后的荧光信号变化,可以揭示受体激活的动态过程和信号传导机制,进而深入理解相关疾病的发生机制。
3. 受体结构与功能关系研究htrf技术可以用于研究受体结构与功能之间的关系。
通过引入不同的突变体或受体片段,测量与配体结合相关的荧光信号变化,可以揭示受体结构的不同区域对功能的影响,从而进一步理解受体的生物学功能。
高通量药物筛选

高通量药物筛选1. 引言高通量药物筛选(High-throughput drug screening)是一种快速、自动化的方法,用于在大规模的化合物库中寻找潜在的药物候选物。
它通过对大量化合物进行快速筛选,以发现能够具有特定活性或功能的化合物,从而加速药物研发过程。
本文将介绍高通量药物筛选的原理、技术和应用。
2. 高通量药物筛选的原理高通量药物筛选的核心原理是通过快速并自动化的方法对大量化合物进行筛选,以寻找与特定疾病相关的药物候选物。
通常,高通量药物筛选的过程可以分为以下几个步骤:2.1. 样品准备在高通量药物筛选中,化合物库是筛选的关键。
化合物库可以包含数千到数百万个不同的化合物。
在筛选之前,这些化合物需要被存储在合适的格式中,使其能够被高通量筛选系统处理。
2.2. 筛选方法选择高通量药物筛选可以使用多种不同的筛选方法。
常见的筛选方法包括细胞筛选、蛋白质筛选和分子筛选等。
根据筛选的目标和所用的样本,选择适合的筛选方法非常重要。
2.3. 高通量筛选实验在高通量筛选实验中,化合物库中的化合物将被筛选系统自动投入到特定的样品板中,与目标物质进行反应。
筛选系统将对样品板中的化合物进行高速稀释、混合和处理等操作,以进行快速的筛选。
利用高通量筛选系统的自动化特点,可以同时测试多个化合物样品。
2.4. 数据分析和结果解读在筛选实验结束后,获得的数据将进行分析和解读。
通常使用计算机算法来处理和分析数据,提供筛选结果。
通过对结果进行解读和分析,研究人员可以确定具有潜在疗效的化合物,并进行后续的研究和验证。
3. 高通量药物筛选的技术高通量药物筛选利用了高速自动化系统和先进的生物技术手段。
以下是一些常见的高通量药物筛选技术:3.1. 机器人技术机器人技术在高通量药物筛选中起到关键作用。
通过使用机器人进行样品的处理、混合和分配等操作,可以实现高效的药物筛选。
机器人技术可以大大提高筛选的速度和准确性。
3.2. 细胞培养技术细胞培养技术是高通量药物筛选的重要组成部分。
均相时间分辨荧光技术 ppt课件

让-马里·莱恩 (Jean-Marie Lehn)
背景简介——穴状配合物
穴状化合物的形成是将一个阳离子纳入到一个立体笼中。笼 能收集光然后将能量转移到核心的镧系元素。大环的性质有利于 跟镧系元素紧密相连,这种不可破的连接会形成异常稳固的复合 体。穴结构能耐受一些特殊的实验条件如大量存在的阳离子 ( Mg2+和 Mn2+等)、螯合物( EDTA)、溶剂或者温度。
从 HTRF 能应用到临床诊断就能看出它也适用于浓度高的血 清在读板前或者孵育时加入氟离子能增强实验对大量化合物的抗 干扰性,对实验没有干扰而给实验提供了很大的灵活性。
穴没有光漂白性,多次读数后信号没有损失,因此能按照需 要的次数去读,这就给许多动力学检测提供了可能。
专利号: US Patent US 5,527,684 由于在该结构上的贡献,让-马 里·莱恩在 1987 年获得了诺贝尔 奖。
时间分辨荧光( TRF)利用稀土元素中镧系元素的独特 性质。在 TRF 中常用的镧系元素是钐( Sm)、铕( Eu)、 铽( Tb)和镝( Dy)。与传统荧光基团相比,它们具有大 的Stoke's shifts 和非常长的发射半衰期(从微秒到毫秒), 这使它们在生物学荧光应用领域中日益重要。
一、时间分辨荧光
镧系元素是57~71的15种化学元素的统称。包括镧、铈、镨、 钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱、镥,它们都是稀 土元素的成员。
背景简介——穴状配合物
Cisbio Bioassays最初在体外诊断方面的成就提供了丰富的免 疫化验的经验,通过与Jean-Marie Lehn 教授在稀土荧光特性方面 研究合作,造就了如今的HTRF技术。如今,全球各大制药企业、药 物研究所和新药筛选中心都将HTRF作为重要的化合物筛选方法进行 药物研发。
高通量药物筛选利器——HTRF,原理介绍

HTRF 技术介绍快速、稳定、不需洗涤、操作简单、易于自动化和微型化。
上述优势使得Cisbio 的HTRF 技术一直是药物研发领域的领先技术之一,并广泛用于信号转导研究和免疫检测。
该技术已经在知名医药公司、生物技术公司和学术研究机构应用了15年以上。
HTRF (均相时间分辨荧光,Homogeneous Time-Resolved Fluorescence )是用来检测纯液相体系中待测物的一种常用方法。
该技术结合了荧光共振能量转移(FRET ,Fluorescence Resonance Energy Transfer )和时间分辨荧光 (TRF, Time-ResolvedFluorescence))两种技术。
这种结合将FRET的均相实验方式和TRF 的低背景特点融合在一起,使得HTRF 技术拥有如下优势:操作简单、灵敏度高、通量大、实验数据稳定可靠、假阳性率较低。
HTRF 是基于TR-FRET 的化学技术,拥有与其它TR-FRET 技术相似的特征,包括使用镧系元素(铕和铽),具有非常长的半衰期,很大的Stroke's shift (如图1所示,Eu 3+ Stroke’s shift > 300 nm )等。
除此之外,它还有其独特的性质,从而与其它技术区分开来。
这主要表现在HTRF 的镧系元素与络合的穴相结合,而不是像其它所有TR-FRET 技术使用螯合物。
螯合物在溶液中是一种动态平衡,在特定条件下不稳定;而HTRF 中应用的穴与镧系元素是永久地嵌合,非常稳定,可耐受较宽的pH 范围、二价金属离子如Mn 2+等、螯合剂如EDTA 等。
HTRF 的独特之处还包括对数据的专利的比值处理方法,其能校正样品基质不同等带来的干扰。
FRET 技术简介FRET 技术利用了两种荧光基团的能量转移,这两种荧光基团分别称为(能量)供体和(能量)受体,前者的发射光谱与后者的激发光谱重叠。
供体被外来能源激发(例如闪光灯或激光),如果它与受体在足够近的距离之内,可以将能量共振转移到受体上。
一种新的便捷高效、高阳性率的单克隆抗体阳性克隆筛选方法——均相时间分辨荧光(HTRF)

⼀种新的便捷⾼效、⾼阳性率的单克隆抗体阳性克隆筛选⽅法——均相时间分辨荧光(HTRF)⼀种新的便捷⾼效、⾼阳性率的单克隆抗体阳性克隆筛选⽅法——均相时间分辨荧光(HTRF)引⾔在利⽤杂交瘤技术制备单克隆抗体的过程中,总共有两次筛选,第⼀次筛选出杂交瘤细胞(⽤HAT选择性培养基),第⼆次筛选出能产⽣特异性抗体的杂交瘤细胞(采⽤有限稀释克隆细胞法)。
两次筛选的原理和⽅法虽有所不同,但在具体操作时多是采⽤传统的酶联免疫检测⽅法(ELISA)。
该⽅法需要提前在微孔板上包被抗原,做实验时要预先封闭,实验中的每⼀步都需要洗板,整个实验步骤繁多,操作复杂,耗时耗⼒,极⼤地影响了阳性克隆的筛选效率。
本⽂介绍⼀种采⽤均相时间分辨荧光(Homogeneous Time-Resolved Fluorescence, HTRF)技术,快速、⾼效,且提⾼阳性率的阳性克隆筛选⽅法。
技术原理均相时间分辨荧光(HTRF, Homogeneous Time-Resolved Fluorescence)是⽤来检测纯液相体系中待测物的⼀种常⽤⽅法。
该技术结合了荧光共振能量转移(FRET, Fluorescence Resonance Energy Transfer)和时间分辨荧光(TRF, Time-Resolved Fluorescence))两种技术。
FRET技术利⽤了两种荧光基团的能量转移,这两种荧光基团分别称为能量供体(Donor)和能量受体(Acceptor),前者的发射光谱与后者的激发光谱重叠。
Donor被外来能源激发(例如闪光灯或激光),如果它与Acceptor在⾜够近的距离之内,可以将能量共振转移到Acceptor上。
Acceptor受到激发,发出特定波长的发射光(图1)。
图1. FRET技术的原理将Donor和Acceptor分别偶联在相互作⽤的两个⽣物分⼦上,⽣物分⼦的结合可以将Donor和Acceptor拉近距离,产⽣能量转移。
ht筛选的原理

HT筛选(High-Throughput Screening)是一种用于高通量药物筛选的技术,其原理主要涉及以下几个步骤:
1. 样本准备:在进行HT筛选之前,需要准备一系列待测试的化合物样本。
这些化合物通常存储在微孔板(microplate)中,每个孔中含有一个化合物。
2. 选择靶标:HT筛选的第一步是确定要测试的药物靶标,这是药物的作用目标,通常是某种疾病的关键蛋白质或生物分子。
3. 测试系统:建立适当的测试系统,这是一种模拟目标蛋白质在体内功能的体外实验系统。
测试系统可以是细胞培养物、酶反应体系、蛋白质结晶等,具体取决于靶标的性质。
4. 筛选过程:将待测试的化合物样本添加到测试系统中,让其与目标蛋白质或生物分子相互作用。
这些化合物会影响靶标的功能,可能抑制或促进其活性,从而对测试系统产生反应。
5. 检测方法:使用高通量检测技术,如荧光探针、酶活性分析、细胞增殖/毒性检测等,来检测化合物样本与靶标的相互作用和对测试系统的影响。
6. 数据分析:收集并记录所有筛选得到的数据。
通常,药物筛选实验会产生大量的数据,因此需要进行有效的数据分析和处理,以确定哪些化合物对靶标具有潜在的生物活性。
7. 确认与优化:在HT筛选结束后,通过进一步的实验验证和优化,确定最有潜力的化合物,使其具备更好的选择性、药物活性和药物性质。
HT筛选技术的优势在于其高效率和高通量性质,能够在相对短的时间内对大量化合物进行测试,从中筛选出有可能成为药物候选的化合物。
这对于新药物研发和药物发现领域具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HTRF 技术介绍快速、稳定、不需洗涤、操作简单、易于自动化和微型化。
上述优势使得Cisbio 的HTRF 技术一直是药物研发领域的领先技术之一,并广泛用于信号转导研究和免疫检测。
该技术已经在知名医药公司、生物技术公司和学术研究机构应用了15年以上。
HTRF (均相时间分辨荧光,Homogeneous Time-Resolved Fluorescence )是用来检测纯液相体系中待测物的一种常用方法。
该技术结合了荧光共振能量转移(FRET ,Fluorescence Resonance Energy Transfer )和时间分辨荧光 (TRF, Time-ResolvedFluorescence))两种技术。
这种结合将FRET的均相实验方式和TRF 的低背景特点融合在一起,使得HTRF 技术拥有如下优势:操作简单、灵敏度高、通量大、实验数据稳定可靠、假阳性率较低。
HTRF 是基于TR-FRET 的化学技术,拥有与其它TR-FRET 技术相似的特征,包括使用镧系元素(铕和铽),具有非常长的半衰期,很大的Stroke's shift (如图1所示,Eu 3+ Stroke’s shift > 300 nm )等。
除此之外,它还有其独特的性质,从而与其它技术区分开来。
这主要表现在HTRF 的镧系元素与络合的穴相结合,而不是像其它所有TR-FRET 技术使用螯合物。
螯合物在溶液中是一种动态平衡,在特定条件下不稳定;而HTRF 中应用的穴与镧系元素是永久地嵌合,非常稳定,可耐受较宽的pH 范围、二价金属离子如Mn 2+等、螯合剂如EDTA 等。
HTRF 的独特之处还包括对数据的专利的比值处理方法,其能校正样品基质不同等带来的干扰。
FRET 技术简介FRET 技术利用了两种荧光基团的能量转移,这两种荧光基团分别称为(能量)供体和(能量)受体,前者的发射光谱与后者的激发光谱重叠。
供体被外来能源激发(例如闪光灯或激光),如果它与受体在足够近的距离之内,可以将能量共振转移到受体上。
受体受到激发,发出特定波长的发射光。
将供体和受体分别与相互作用的两个生物分子结合,生物分子的结合可以将受体和供体拉到足够近的距离,产生能量转移。
这时,我们可以检测到两个发射光,分别为受体和供体的发射光。
由于受体分子的发射光来自于能量转移,所以在图1:铕穴状化合物的激发和发射光谱实验中不需要将未结合与已结合的分子分开,即不需要洗涤步骤。
这种均相的实验方式操作简单,而且减少了实验时间和花费。
如果与供体和受体结合的生物分子不存在相互作用,供体和受体距离较远,不能产生能量转移,则只能检测到来自于供体的发射光,如图2。
一般地,在FRET 实验中使用的供体和受体是快速荧光基团,半衰期非常短,背景荧光较强。
背景荧光主要来自于荧光染料本身的干扰,以及样品成分的荧光和自发荧光,后者包括缓冲液、化合物和样品中的蛋白质、脂质、糖类等等的荧光信号。
实验检测到的荧光信号必须对这些自发荧光进行校正,极大地影响了实验灵敏度,并使数据分析变得复杂。
HTRF 技术使用镧系元素作为供体,其属于长寿命荧光,可通过时间延迟的检测方式将背景荧光去除,提高了灵敏度,并使数据真实可靠。
TRF 技术简介如前所述,样品中的很多成分具有较强的荧光和自发荧光,利用传统的快速荧光基团进行检测极大地限制了实验灵敏度,并且不能反映样品的真实情况。
使用长寿命的荧光基团结合时间延迟的检测方式(在荧光激发和发射检测之间有一个时间延迟)可将快速荧光的干扰降到最低。
图2:FRET 技术的原理时间延迟的检测方式,是通过时间分辨荧光(TRF )技术实现的,其利用稀土元素中镧系元素的独特性质。
在TRF 中常用的镧系元素是钐(Sm )、铕(Eu )、铽(Tb )和镝(Dy )。
与传统荧光基团相比,它们具有大的Stoke's shifts 和非常长的发射半衰期(从微秒到毫秒)。
镧系元素的Stoke'sshifts 通常为300 nm ,检测的发射光中没有来自于激发波长的干扰。
HTRF 技术中镧系元素的半衰期大于1毫秒,与普通荧光纳秒级的半衰期相差6个数量级。
当延迟50微秒读数时,普通荧光的信号近似于零,镧系元素的信号改变很小。
所以,HTRF 技术的数据真实可靠,假阳性低。
为了能够成功应用于生物学检测中,稀土元素复合物应该具有特定的性质,包括较强的稳定性、较高的发射光产率,并且能够与生物分子连接。
除此之外,当直接在生物溶液中检测时,能够耐受荧光淬灭就显得尤为重要。
稀土元素螯合物在特定条件下稳定性较差,并且有的化合物与螯合物活性基团发生反应,产生竞争,增加了其不稳定因素。
HTRF 技术应用穴状化合物,整个体系非常稳定,没有光漂白现象,可在至少48小时内反复多次检测。
HTRF 技术的能量供体(Donor )和能量受体(Acceptor )HTRF 的供体是铕穴状化合物(Eu 3+ cryptate )或Lumi4™铽穴状化合物(Tb 2+ cryptate ),后者是近年与Lumiphore 公司合作的结果,激发效率更高。
两者的能量受体(Acceptor )均可为XL665和d2。
XL665和d2激发波长为620 nm ,发射波长为665 nm ,位于近红外光区,进一步降低了样品本身对实验的影响(生物学样品很少在近红外光区有自发荧光)。
对于铽穴状化合物来说,其受体也可以是Fluorescin 、GFP 等发绿色荧光的分子,所以可以进行双标记测量。
XL665是改良过的别藻蓝蛋白(APC ),其将APC 的亚基偶联,使其不能解离,增加了稳定性。
d2是第二代受体,光谱学特征与XL665相同,但是分子量较小,约为1KD ,可减少空间位阻对实验的可能影响。
当由于生物分子相互作用导致两个荧光基团接近时,在激发时被穴状化合物捕获的能量部分释放,发射波长为620 nm ;另一部分能量共振转移到XL665或d2,使其发光,发射波长为665 nm 。
665 nm 的发射光仅仅由穴状化合物作为能量供体的FRET 产生。
所以,当生物分子相互作用时,有两个激发光620 nm 和665 nm ;图3:TRF 技术的原理 图3:TRF 技术的原理图5:铕穴状化合物的结构 专利号:US Patent US 5,527,684由于在该结构上的贡献,Prof. J.M. Lehn’s 在1987年获得了诺贝尔奖。
当不存在相互作用时,只有620nm 一个激发光(见图2)。
HTRF 的数据分析HTRF 有来自于能量供体和能量受体的两个发射光,可采用Cisbio 专利的比值法来分析数据,从而去除由于溶液通透率、细胞大小、细胞数量等不同引起的误差。
如图4 所示,溶液通透率不同,分别为100%通透和50%通透,由此导致对同样样品信号值的不同,后者是前者的一半。
这种不同是由于溶液对光的吸收程度不同引起的,并不是样品的不同所致。
如果我们不用比值来处理数据,仅仅看信号值,很可能得出错误的结论。
穴状化合物简介穴状化合物的形成是将一个阳离子纳入到一个立体笼中。
笼能收集光然后将能量转移到核心的镧系元素。
大环的性质有利于跟镧系元素紧密相连,这种不可破的连接会形成异常稳固的复合体。
穴结构能耐受一些特殊的实验条件如二价阳离子(Mg 2+和Mn 2+等)、螯合物(EDTA )、极性较强的溶剂或者较高的温度。
从HTRF 能应用到临床诊断(TRACE®技术和Kryptor ®工作站技术)就能看出它也适用于浓度高的血清(50%)。
在读板前或者孵育时加入氟离子能增强该化合物的抗干扰性。
穴没有光漂白性,多次读数后信号没有损失,因此能按照需要的次数去读,所以可以进行动力学检测。
HTRF 技术的优势图4:HTRF 比值法数据分析可去除样品干扰∙操作非常简单实验过程不需要繁琐的洗板,只需要混匀孵育后检测∙体系非常稳定穴状化合物非常稳定,可耐受较宽的pH范围、二价金属离子、螯合物等,并且可以在至少48小时内反复多次检测∙数据真实可靠背景低,受到样品的干扰非常少,假阳性假阴性均低,尤其可去除由于天热产物自发荧光等引起的干扰∙应用灵活多样 HTRF可以看作是不需洗涤的ELISA,应用范围很宽∙易于实现微型化,通量高HTRF的应用HTRF技术从产生以来,已经被广泛应用于免疫检测和细胞信号转导的研究,在药物研发中被应用于不同的阶段,从实验方法的建立、高通量筛选(HTS),lead到hit,一直到临床前研究。
HTRF技术非常灵敏而且稳定,可以进行细胞实验和生化实验,并且可以使用384和1536孔板。
HTRF的很多应用是基于抗体的检测,包括GPCR(受体配体结合,受体二聚化,cAMP 和IP-1 的检测,以及磷酸化ERK和AKT的定量)、激酶、细胞因子和生物标志物、生物过程(治疗性抗体和蛋白药物的生产)等,以及蛋白和蛋白、蛋白和多肽、蛋白和DNA/RNA相互作用的研究。
HTRF具有与ELISA同等的检测范围和检测极限,但是它不需要洗板,可以极大地减少实验时间,所以HTRF技术可以取代大部分ELISA实验,为均相ELISA。
图6对HTRF的应用领域作了一个概括。
图6: HTRF的应用领域。
