功能蛋白质组学研究方法.ppt
蛋白互作研究方法PPT课件

2) MbSUS 体系
最新课件
18
mbSUS 原理
最新课件
19
最新课件
20
In vivo cloning into mbSUS vectors
GATEWAY cloning method
最新课件
21
最新课件
22
最新课件
23
最新课件
24
最新课件
25
最新课件
26
最新课件
P = Prey Protein, M = MagneG最S新T.课P件article.
33
5 免疫共沉淀Co-IP
最新课件
34
最新课件
35
最新课件
36
6 Far-western analysis
最新课件
37
7 双分子荧光互补技术 BiFC
双分子荧光互补(bimolecular fluorescence complementation,BiFC) 分析技术,利用绿色荧光 蛋白(green fluorescent protein,GFP) 及其突变体 (YFP,CFP,BFP)的特性作为报告基因,将荧光蛋白分割 成两个不具有荧光活性的分子片段,再分别与目标蛋 白连接. 如果两个目标蛋白因为有相互作用而靠近, 就使得荧光蛋白的两个分子片段在空间上相互靠近, 重新形成活性的荧光基团而发出荧光. 在荧光显微镜 下,就能直接观察到两目标蛋白是否具有相互作用, 并且在最接近活细胞生理状态的条件下观察到其相互 作用发生的时间、位置、强弱、所形成蛋白质复合体 的稳定性,以及细胞信号分子对其相互作用的影响等, 这些信息对研究蛋白质相最互新课作件 用有一定意义。 38
最新课件
7蛋白组学 功能

融合蛋白的应用
为了提高亲和纯化的强度和特异性,往往在靶蛋白上连接 一个标签(tag),在柱子上连接一个能够和标签有高强度 和特异结合的分子。这样可以把靶蛋白固定在柱子上。
常用的标签有:
GST (谷胱甘肽 S 转移酶 Glutathione S Transferase)
金黄色葡萄球菌的蛋白A (protein A)
主要研究内容
蛋白质复合物分析 细胞内蛋白质的定位 蛋白质与蛋白质之间的相互作用 蛋白质在代谢、调控、信号传导通路中的作
用
蛋白质与蛋白质之间的相互作用 (protein-protein interaction)
蛋白质与蛋白质之间的相互作用指的是蛋白质之间空间上相 互靠得很近,因此是一种物理上的相互作用(physical interaction)。
空间取向的变化将引起FRET 效率的改变
EGFR和Grb2的相互作用
EGF表皮生 长因子
分子生物学方法
酵母双杂交系统 (yeast two-hybrid system)
酵母双杂交系统于1989 年由Fields S 和 Song O 创立,是用来研究蛋白质与蛋白 质之间相互作用的简便而有效的方法,又 称为“相互作用陷阱”。
蛋白质组学
浙江大学 生命科学学院
江辉
第六章 功能蛋白质组学
蛋白质相互作用
功能蛋白质组学
功能蛋白质组学的研究对象是功能蛋白 质组,即在某一特定时期或者某一生理 现象相关的所有蛋白质的生理生化功能。
它是介于对个别蛋白质的传统蛋白质研 究和以全部蛋白质为研究对象的蛋白质 组研究之间的一个层次。
免疫共沉淀技术
与亲和层析不同的是,免疫共沉淀技术使用抗体来结合 靶蛋白,从而把靶蛋白固定在珠子上
生物化学 蛋白质的结构与功能(共112张PPT)

三、多肽链在二级结构基础上进一步折叠形 成三级结构
(一)三级结构是指整条肽链中全部氨基酸 残基的相对空间位置
定义:
整条肽链中全部氨基酸残基的相对空间位置。 即肽链中所有原子在三维空间的排布位置。
主要的化学键: 疏水键、离子键、氢键和 范德华力等。
• 肌红蛋白 (Mb)
各种蛋白质的含氮量很接近,平均为16%。
由于体内的含氮物质以蛋白质为主,因此, 只要测定生物样品中的含氮量,就可以根据以 下公式推算出蛋白质的大致含量:
100克样品中蛋白质的含量 (g %) = 每克样品含氮克数× 6.25×100
1/16%
一、组成人体蛋白质的20种L--氨基酸
存在自然界中的氨基酸有300余种,但 组 成 人 体 蛋 白 质 的 氨 基 酸 仅 有 20 种 , 且 均 属 L-α-氨基酸(甘氨酸除外)。
遍存在
-转角
无规卷曲是用来阐述没有确定规律性的那部分 肽链结构。
(五)二级结构可组成蛋白质分子中的模体
在许多蛋白质分子中,可发现二个或三个具有二 级结构的肽段,在空间上相互接近,形成一个有规则
的二级结构组合,被称为超二级结构。
二级结构组合形式有3种:αα,βαβ,ββ 。
二个或三个具有二级结构的肽段,在空间上 相互接近,形成一个特殊的空间构象,称为模体 (motif) 。
CHHR3
COO-
C
+NH3
H
L-氨基酸的丙甘通氨氨式酸酸
除了20种基本的氨基酸外,近年发现硒代半胱氨 酸在某些情况下也可用于合成蛋白质。硒代半胱氨 酸从结构上来看,硒原子替代了半胱氨酸分子中的 硫原子。硒代半胱氨酸存在于少数天然蛋白质中, 包括过氧化物酶和电子传递链中的还原酶等。硒代 半胱氨酸参与蛋白质合成时,并不是由目前已知的 密码子编码,具体机制尚不完全清楚。
蛋白质组学的研究方法

蛋白质组学的研究方法蛋白质组学是运用先进的分析技术,通过对细胞内的蛋白质分子进行检测、分离、同位素标记与定量等方法,研究不同细胞型、组织型、发育阶段以及病变状态等生物样本中蛋白质组成及其功能性调控的科学。
它是一门综合性学科,既涉及生物化学、蛋白质工程、分子生物学等学科,也涉及信息学及计算机科学等学科,运用了各种生物学技术和数学模型,将复杂的生物体蛋白质组织成一个有机的整体,从而更好地了解蛋白质的结构与功能关系。
蛋白质组学的研究方法主要包括:一、蛋白质分离与鉴定:蛋白质分离是蛋白质组学的基础步骤,其目的是从生物样本中提取蛋白质。
常用的技术包括凝胶电泳、膜分离、微萃取、液相色谱法以及离心分离等。
蛋白质分离之后,还需要进行鉴定,以获得蛋白质的名称及其细胞定位等信息,以便进行后续研究。
常用的方法包括凝集试验、蛋白质印迹、Western blotting、质谱分析以及二级结构分析等。
二、定量蛋白质组学:定量蛋白质组学是指利用有效的检测技术,对生物样本中的蛋白质进行定量分析,以便获得蛋白质组成及其功能性调控情况的精确信息。
定量蛋白质组学技术主要包括酶标记蛋白质定量、质谱定量以及流式细胞蛋白质定量等。
三、蛋白质组学的应用:蛋白质组学的研究结果可以用来研究基因调控、细胞信号转导、疾病机理等方面的问题。
它可以帮助研究人员更好地理解生物的复杂性,并为有效的治疗策略的制定提供重要的参考和指导。
它还可以用于研究新型药物的研究和开发,为疾病的治疗提供新的思路。
蛋白质组学的发展前景广阔,它不仅可以用于解决当前生物学上的实际问题,还可以为未来的研究提供重要的科学研究基础。
随着技术的进步和数据量的增加,蛋白质组学技术将会为生物学研究带来更多的惊喜和发现。
《蛋白质组研究技术》课件

酵母双杂交技术
利用酵母细胞表达的蛋白与待测蛋白 进行相互作用,筛选出与待测蛋白相 互作用的蛋白。
串联亲和纯化技术
将待测蛋白与其相互作用蛋白一起纯 化下来,再通过分离纯化得到相互作 用蛋白。
03 蛋白质组学在生物医学中 的应用
疾病标志物发现
疾病诊断
通过蛋白质组学技术,发现与疾病相关的特异性蛋白质标志物,有助于疾病的早 期诊断和预后评估。
电泳技术
利用蛋白质在电场中的迁移率不同,将蛋白质分 离成不同的条带。
蛋白质芯片技术
将蛋白质固定在芯片上,通过与待测蛋白质的相 互作用,实现对蛋白质的筛选和检测。
蛋白质鉴定技术
蛋白质鉴定技术
利用各种技术手段对分离得到的蛋白 质进行鉴定,确定其氨基酸序列和分 子量等信息。
氨基酸序列分析
通过测定蛋白质中氨基酸的排列顺序 ,确定蛋白质的种类和来源。
未来发展趋势与展望
技术创新
未来蛋白质组学技术将继续创新 ,如高通量、高灵敏度、高分辨 率的蛋白质检测技术。
跨学科融合
蛋白质组学将与生物信息学、计 算生物学等学科进一步融合,实 现多维度、多层次的数据分析。
临床应用拓展
随着技术的进步和应用研究的深 入,蛋白质组学将在临床诊断、 治疗和药物研发等方面发挥更大 的作用。
分子量测定
利用质谱等技术手段测定蛋白质的分 子量,以验证蛋白质鉴定的准确性。
免疫学检测
利用特异性抗体对蛋白质进行检测和 识别,具有高灵敏度和特异性。
蛋白质功能研究技术
蛋白质功能研究技术
通过各种手段研究蛋白质在生物体内的功能 和作用机制。
细胞生物学技术
通过观察蛋白质在细胞内的定位、分布和动 态变化,研究其功能和作用机制。
蛋白质结构与功能ppt

03
基于抗体与抗原的特异性结合原理,开发针对特定疾病的抗体
药物,如单克隆抗体、双特异性抗体等。
基因工程疫苗研究与开发
重组蛋白疫苗
利用基因工程技术将编码病原微生物保护性抗原的基因导入表达 系统,制备重组蛋白疫苗,从而诱导机体产生特异性免疫应答。
病毒样颗粒疫苗
利用病毒的结构蛋白自组装形成病毒样颗粒,模拟病毒的 自然感染过程,制备具有高免疫原性和安全性的疫苗。
05
蛋白质结构与功能的研究 方法
X射线晶体学
01
02
03
X射线衍射原理
利用X射线与晶体中的原 子相互作用产生衍射现象, 通过分析衍射图谱推断蛋 白质分子的三维结构。
晶体培养与优化
通过特定的条件和方法培 养和优化蛋白质的晶体, 以获得高质量的衍射数据。
结构解析与修正
利用计算机程序对衍射数 据进行处理、解析和修正, 最终得到蛋白质的三维结 构模型。
质的结构和动力学信息。
电镜技术
电子显微镜原理
利用高能电子束与样品相互作用产生散射、吸收等效应,通过检测 和处理这些效应产生的信号获得样品的形貌和结构信息。
样品制备与染色
制备适合电镜观察的蛋白质样品,通常需要对蛋白质进行负染或金 属投影等染色方法以增强对比度。
图像采集与处理
设置合适的实验参数,采集电子显微镜图像,并利用计算机程序对图 像进行处理和分析,得到蛋白质的结构和形貌信息。
蛋白质可以作为激素、 生长因子等,调节生物 体的生长、发育和代谢 等活动;同时,也可以 作为信号分子,参与细 胞间的通讯。
蛋白质的研究历史与现状
研究历史
自19世纪末开始,科学家们逐渐认识到蛋白质的重要性,并开展了大量的研究工作。 20世纪中叶以后,随着分子生物学和基因工程技术的发展,蛋白质研究进入了新的阶
蛋白组学定量蛋白质组学.ppt

2
常用研究方法
以质谱技术为基础的化学标记定量方法 荧 光 差 示 双 向 凝 胶 电 泳 技 术 ( F-2D-
质量变化依赖于氮原子数目,因此对未 知的蛋白质难以进行定量。
10
(二)稳定同位素标记的必需氨基酸体 内标记(SILAC法)
高等动物细胞的生长中需要一些必需氨基酸的摄入,如赖氨酸 (Lys)、亮氨酸(Leu)、苯丙氨酸(Phe)等,这些氨基酸细胞自身 无法合成,需要从外界摄入补充。
在培养细胞时,可以在培养介质中特异的加入用稳定同位素标 记的某一种必需氨基酸,在经过适当的培养时间后,细胞中合 成的含有这类氨基酸的蛋白质几乎都掺入了标记的氨基酸 。
31
MCAT策略流程:定性
Lys只在Trypsin酶切后的末端,所以产生的b离子都没有被修饰;所有的y 离子带Lys,因此被修饰。
在MS/MS图谱上,所有的b离子是单一条带出现,所有的y离子是成对出现, 丰度比例一样,且相差同样的m/z。
容易区分b离子和y离子,容易读出氨基酸序列。
32
MCAT策略流程:定量
36
–COOH羧基标记
通过对羧基酯化进行 标记
用H和D标记的甲醇酯 化标记,来定量研究 蛋白质表达量的差异
37
羧基酯化标记进行蛋白定量研究
比例=2 : 1
38
缺点:
特异性不是很好,在C末端和Asp和 Glu残基上都有标记,且效率不均
采用的标记条件容易引起天冬酰胺 (Asn)和谷氨酰胺(Gln)的去酰胺
蛋白质组学-PPT课件

iTRAQ 结构
iTRAQ包括三部分:报告部分、肽反应部分、平 衡部分。 1、报告部分:有八种,因此iTRAQ可同时标记8 组样品。 2、肽反应部分:能与肽N端及赖氨酸侧链发生共 价连接而标记上肽段,几乎可以标记所有蛋白质。 3、平衡部分:保证iTRAQ标记的同一肽段的质荷 比相同。
辉骏生物:fitgene/
辉骏生物:fitgene/
免费服务热线:400-699-1663
2:蛋白质组学研究内容
2.1:蛋白质的表达模式 (1)生理、病理或不同发育状态下蛋白质组表达差异蛋白质信息库。 (2)蛋白质及其组成质点的分离、分析、鉴定。 2.2:蛋白质的功能模式 (1)蛋白质结构分析。 (2)蛋白之间相互作用,翻译后修饰,细胞定位等。
3: 化学标记法—iTRAQ
简介:
iTRAQ试剂是可与氨基酸末端氨基及赖氨酸侧链氨基连接的胺标记同重元素。在质谱图 中,任何一种iTRAQ试剂标记不同样本中的同一蛋白质表现为相同的质荷比。 在串联质谱 中,信号离子表现为不同质荷比(113-119,121)的峰,因此根据波峰的高度及面积,可以 鉴定出蛋白质和分析出同一蛋白质不同处理的定量信息。
辉骏生物:fitgene/
免费服务热线:400-699-1663
1:双向电泳
基于2D-PAGE 的经典定量分 析方法。 1、样品准备 和定量:抽提 对照组和各种 不同实验组的 蛋白质。 2、蛋白质分 离:蛋白质经 过2D-PAGE分离 后染色(银染、 考染等)。 3、蛋白质的 定性与定量分 析:通过与对 照组相Image Master 7.0分 析出实验组中 差异点,质谱 鉴定差异点蛋 白质,同时应用 软件分析出其 表达量的变化。
辉骏生物:fitgene/
蛋白质组学及研究方法

蛋白质组学及研究方法质谱法是蛋白质组学中最重要的分析方法之一、常用的质谱法有两大类,一类是基于质谱仪直接测定蛋白质的质量和序列信息,如质谱仪联用液相色谱法(LC-MS)和二维凝胶电泳结合质谱法(2-DE-MS);另一类是基于质谱法间接测定蛋白质的表达水平和修饰信息,如蛋白质组学差异凝胶鉴定法(DIGE)和蛋白质组学激光解吸电离质谱法(MALDI-TOF)。
质谱法的基本原理是通过将蛋白质分子化为离子,在质谱仪中进行分离和检测。
质谱仪的常见类型有基于时间的质谱仪(TOF)、静电荧光质谱仪(ESI)、磁性质谱仪(FT-ICR)等。
质谱法可以通过测定蛋白质的质量和碎片信息来确定蛋白质的序列和修饰状态。
免疫检测是蛋白质组学中常用的方法之一,用于检测特定蛋白质在生物体中的表达水平和定位信息。
免疫检测可分为传统免疫学方法和现代免疫学方法两大类。
传统免疫学方法包括酶联免疫吸附测定法(ELISA)、免疫印迹和免疫组织化学等。
现代免疫学方法包括流式细胞术、免疫磁珠法和免疫表观遗传学等。
生物信息学分析是蛋白质组学中的重要环节。
通过生物信息学分析,可以从大量的蛋白质组学数据中提取有用的信息,如蛋白质相互作用网络、信号通路分析和功能注释等。
常用的生物信息学工具和数据库有NCBI、UniProt、STRING和Kegg等。
蛋白质组学的研究方法还包括蛋白质组分离和富集技术、蛋白质组学数据库和蛋白质组学分析软件等。
蛋白质组分离和富集技术可用于从复杂的蛋白质混合物中提取特定蛋白质或蛋白质家族,并进行进一步的分析。
蛋白质组学数据库和蛋白质组学分析软件可用于存储和分析大规模的蛋白质组学数据,并帮助研究者解释实验结果。
总之,蛋白质组学是一门综合性研究领域,涉及蛋白质的分析、鉴定、定位和功能等方面。
通过质谱法、免疫检测和生物信息学分析等方法,可以更好地理解蛋白质在生物体内的功能和调控机制,为生物医学研究和药物开发提供重要的技术支持。
蛋白质和蛋白质组学PPT

12
蛋白组研究的三个主要步骤:
Separation of individual proteins by 2-D polyacrylamide gel electrophoresis (2-D PAGE)
Identification by mass spectrometry or Nterminal sequencing of individual proteins recovered from the gel
Storage, manipulation, and comparison of the data using bioinformatics
13
蛋白组学研究过程
成像 Imaging
Sample
样品
Sample Prep
2-D GELS
SSWWIISSS-PPRROOTT/ / TTrrEMMBBLL
基因组
转录组
ቤተ መጻሕፍቲ ባይዱ
蛋白组
The study of proteins expressed by genomes Completion of the sequencing of the 1st draft of human genome
indicates there are approximately 250,000 proteins in the human genome Only 2-5% of proteins in human genome have been identified
MR et al 1997)
❖ 1994年Williams提出测定有机体的基因组所表达的全部蛋白 ❖ 1995年Wilkins正式提出Proteome一词由一个细胞或一个组织的基因
蛋白质组学中的从头测序方法PPT课件

VS
药物作用机制
通过从头测序方法,可以深入了解药物的 作用机制,有助于药物的优化和改进。
生物进化与物种分类的研究
物种进化
物种分类
从头测序方法可以用于研究物种的进化历程, 有助于理解生物多样性的形成和演化。
从头测序方法可以用于更精确地分类和鉴定 物种,有助于生物分类学的研究和发展。
05
从头测序的挑战与前景
蛋白质组学中的从头 测序方法ppt课件
目录
• 从头测序方法的概述 • 从头测序的基本原理 • 从头测序的最新进展 • 从头测序的应用实例 • 从头测序的挑战与前景
01
从头测序方法的概述
定义与重要性
定义
从头测序方法是一种基于质谱技术的蛋白质测序方法,通过将蛋白质切割成较小的肽段,然后对这些肽段进行测 序,最终确定蛋白质的氨基酸序列。
02
从头测序的基本原理
蛋白质的分离与纯化
蛋白质的分离
利用不同蛋白质在物理、化学性质上 的差异,将其从混合物中分离出来。 常见的方法包括离心、电泳、色谱等 。
蛋白质的纯化
在分离的基础上,进一步去除蛋白质 中的杂质,提高蛋白质的纯度。常用 的纯化方法包括凝胶过滤、离子交换 等。
蛋白质的酶切
选择合适的酶
03
从头测序的最新进展
高通量测序技术
最新一代测序技术
随着技术的不断进步,新一代测 序技术如纳米孔测序和单分子测 序等,具有更高的通量、更短的 测序时间以及更低的成本。
深度覆盖
高通量测序技术能够实现蛋白质 组的深度覆盖,从而更全面地揭 示蛋白质的表达和修饰情况。
交叉验证
通过与其他技术如质谱和抗体检 测的交叉验证,高通量测序技术 能够提高结果的准确性和可靠性。
化学蛋白质组学PPT课件演示文稿

• 在20世纪90年代中期,国际上萌发了一门研究细
胞内各种蛋白质的组成及其活动规律的新兴学科-蛋白质组学(proteomics)。
• 蛋白质组(proteome)这一概念是1995年由澳大利 亚学者最先提出来的,源于蛋白质(protein)与 基因组(genome)两个词的杂合,指的在一个 特定的时间和空间内,一个基因组、一种细胞组 织或一种生物体所表达的全部蛋白质。
• 对蛋白质组问题的研究称之为蛋白质组学
(proteomics),主要是在整体水平上研究细胞 内蛋白质的组成及其活动规律。
第四页,共48页。
• 而化学在这里再一次与生物学的最新发展融合,形成新的交叉研究
领域-化学蛋白质组学(chemical proteomics)。化学蛋白质组学
是一个目前仍在不断扩展中的全新领域,学术界至今对其尚未有确
根据分子量大小进行分离。
第九页,共48页。
第十页,共48页。
2,基质辅助激光解吸电离-飞行
时间质谱技术
• 基质辅助激光解吸电离-飞行时间质谱测量法以多 肽质量/电荷比为依据同数据库资料进行比较,进而
对蛋白质进行鉴定。此法通常被称为肽质量指纹法。
第十一页,共48页。
3,色谱与质谱联用技术
• 将色谱技术与新型质谱技术相结合,可有效地克服双向凝胶电 泳/质谱的不足,确保了分析的准确性。
• 首先对蛋白质混合物进行酶切得到混合肽段,然后通过强离子交换
反相色谱柱进行多次分离,并连用液相色谱-串联质谱分析肽段, 而且通过核素标记肽段的技术实现蛋白定量分析。分离 后的产品离子得到完好地扫描,连用分析肽段,可以区分待
测蛋白质和其他类似物。
第十二页,共48页。
第十三页,共48页。
蛋白质组学PPT课件
蛋白质组定义
1,基因组表达的全部蛋白质。 2,在一种细胞/组织内存在的全部蛋白 质。
Proteome
• 1994 M.Wilkins and K.W.Williams
•
Macquarie University in Sydney
• Total Proteins Complement of a Genome
环境
ቤተ መጻሕፍቲ ባይዱ
REAL COMPLEXITY…
IS IN CELLULAR ROTEOMES • BEYOND THE GENOME… • Tissue Specific Expression • Alternate Splicing, (1/3 of all genes) • Post-Translational Modifications
Functional
Proteomics
• During human development, cell express different proteins
• Normal and cancer cells express different proteins
• Cell treated with and without drug express different proteins
– Types and Level:
– Signal Sequence cleavage – Glycosylation
– Phosphorylation – Farnylation – Isoprenylation – Acetylation
• All combine > 100-1000 fold increase in complexity
相互作用蛋白质组学ppt课件

1
• 蛋白质是生命过程的真正执行者,蛋白质相互作 用与生命健康息息相关。因此,蛋白质互作研究 也是基础生命科学的一个重点研究领域.
• 生物体的生理功能主要由细胞中的蛋白质控制和 调节。其中,多数蛋白质是通过与配体结合或是 作为蛋白质复合物中的一部分参与细胞的代谢过 程。因此,研究蛋白质间的相互作用是理解生命 活动的基础。
1. 基本概述 2. 基本过程 3. 应用与优缺点
4
基本概述
• 酵母双杂交系统( Yeast two-hybrid system,Y2H)是1989年由Fields等提出并初步 建立的,主要用于研究真核生物的蛋白质。
• 该系统利用了酵母的转录激活因子GAL4,含有的两个结构域,DNA结合域 (DNA binding domain,BD)及转录激活域(activation domain,AD),将已知基因 (诱饵基因)和靶基因分别构建在含BD及AD质粒载体上,将两种质粒共同 转化酵母感受态细胞,若B此间结合时,则会导致位于侧翼的 BD与AD在空间上接近,呈现GAL4转录因子的完全活性,激活下游的报告基 因表达,从而在特定的选择性培养基上生长。
1. 基本概述 2. 基本过程 3. 优缺点
14
基本概述
• 免疫共沉淀(Co-Immunoprecipitation, Co-IP)是以抗体和抗原之间的专 一性作用为基础的、用于研究蛋白质相互作用的经典方法。
• 原理:当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白 质-蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫 沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。
存在于蛋白质之间的微弱的或暂时的相互作用;
12
缺点
1. 分析蛋白间的相互作用定位于细胞核内,而许多蛋白间的 相互作用依赖于翻译后加工,如糖基化、二硫键形成等, 这些反应在核内无法进行;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 蛋白质芯片反应结果的检测
荧光标记是芯片息采集中使用最多也是最 成功的报告标志。对杂交反后的芯片上各 个反应点的荧光位置、荧光强弱经过芯片 扫描仪和相关软件进行分析,将荧光信号 转成数据,即可获得有关生物信息。
蛋白质芯片分类
根据固定介质的不同,可以分为两大类: 化学型蛋白质芯片(SELDI-TOF-MS蛋白质芯片) 生物型蛋白质芯片(如抗体、受体、配体等);
如:抗体库的构建
表达载体噬菌粒pCANTAB 5E
噬菌体展示技术的应用
1. 蛋白质相互作用的研究
有研究利用T7噬菌体展示筛选系统,以丝裂原 活化蛋白激酶(MAPK)信号转导通路中p38作 为靶蛋白,筛选了与其有结合关系的多肽或蛋 白,得到了46个编码蛋白的序列,在这些蛋白 中有激酶、转录因子、细胞骨架相关蛋白和离 子通道相关蛋白等。
• 该系统中转录激活的条件是蛋白质作为一 个整体起作用。
• 分别经分子克隆技术在同一细胞中表达的BD和 AD多肽不会彼此间发生作用,BD和AD分别可以 同其他蛋白质X或Y结合形成融合蛋白,如果X,Y 之间可以形成蛋白-蛋白复合物,使GAL4两个结构 域重新构成AD和BD成为一体,就可以启动特异基 因序列的转录。
这一技术有效地实现了基因型和表型的体外转
换,即在二者之间架起了桥梁,使得研究者完 全可以在分子克隆的基础上,有效地实现蛋白 质构象的体外控制,从而可以在体外获得具有 良好生物学活性的表达产物。
• Navagen 蛋白基因中,插入片段基因长度可在300 bp ~3 000 bp之间,所表达的多肽或蛋白质以与噬菌体 外壳蛋白融合的形式展示在噬菌体表面。
酵母双杂交系统的局限性
1.并非对所有蛋白质都适用
双杂交系统分析蛋白间的相互作用定位于核内,而 许多蛋白间的相互作用依赖于翻译后加工,如糖基 化,二硫键形成等,这些反应在核内无法进行。另外, 有些蛋白的正确折叠和功能有赖于其它非酵母蛋 白的辅助,这限制了某些细胞核外蛋白和细胞膜受 体蛋白等的研究。
2.易发生假阳性
包括筛库过程中自发升高的BD-x融合蛋白自我激 活导致的假阳性,在BD-x融合蛋白不存在的情况 下AD-Y融合蛋白单独激活报告基因,导致的假阳 性,以及酵母中其他蛋白质作用引起的假阳性等。
因此,虽然双杂交系统可筛选出大量蛋白
质相互作用,但其中部分蛋白质在生理状态 下可能不发生相互作用,双杂交只是反映蛋 白质间能发生作用的可能性,这种可能性还 必须经过其他实验验证,尤其要与生理功能 研究相结合,否则可能会误入歧途。
酵母双杂交体系的新发展
• 传统酵母双杂交体系的改建
根据酵母的营养缺陷,发展了多重筛选机制 表达载体构建的改进 将蛋白的相互作用场所从核内移至细胞膜
• 哺乳动物细胞双杂交系统 • 三杂交系统的产生:用于研究蛋白和RNA
间的相互作用。
• DNA-BD能够识别GAL4效应基因的上游激 活序列 (Up stream activating sequence, UAS),并与之结合,而AD则通过与转录机 制中的其他成分之间的作用,启动UAS下游 的基因进行转录。DNA-BD和AD单独作用 均不能激活转录反应,只有当二者在空间上 充分接近并呈现完整的GAL4转录因子活性 时,方可激活UAS下游启动。
2. 在筛选和制备多肽药物方列的外源肽链,不同噬菌体粒子展示不同序 列的外源肽链。用一定功能的靶分子筛选,可以简 便快速地获得与靶分子具有强亲和力和特异性的小 肽或新型蛋白,这些肽段可以作为侯选药物进行开 发。
用的简便而有效的研究体系,酵母双杂交的 最大的优点是不需要分离、纯化蛋白质,整 个过程只是对核酸进行操作。
酵母双杂交系统应用
它主要应用在以下几个方面: 1.用于验证通过其他方法发现的蛋白质之间 是否有相互作用; 2.确定已知有生理作用选蛋白质。
液相蛋白质芯片
是一种新型的、高度灵活的多元蛋白质研究平台,可 以适用于蛋白质组研究、临床研究和药物研究中的各 种蛋白质分析。
• 液相芯片体系由许多不同的小球体为主要基质,每种 小球体上固定有不同的探针分子,将这些小球体悬浮 于一个液相体系中,就构成了一个液相蛋白质芯片系 统。在液相系统中,为了区分不同的探针,在球形基 质的制造过程当中,掺入了两种不同的红色分类荧光, 根据这两种红色分类荧光的比例不同(色彩编号),区 分不同的探针。
将待测样品滴到芯片表面(血清、尿液、分泌液、 细胞裂解液等),通过亲合作用样品中的某些蛋白 质被吸附到芯片的固相基质表面上,用缓冲液洗 去芯片上的杂质蛋白和其他污染物,然后在芯片 上 加 入 能 量 吸 收 分 子 ( energy absorbing molecular,EAM),芯片干燥后,在真空管中用激 光轰击,蛋白质在吸收能量后被解析发生离子化, 在电场力作用下脱离芯片表面, 被离子检测器所 检测。检测结果经过软件分析处理后, 可绘制出 质谱图,显示相关蛋白质的分子量、含量等信息。
GAL4重建后激活转录模式图
AD
BD UAS X
报告基因(LacZ)
Y
• 一般地,将BD-X的融合蛋白称作诱饵(bait), X往往是已知蛋白,AD-Y称作猎物(prey),能 显示诱饵和猎物相互作用的基因称报告基 因,通过对报告基因的检测,反过来可判断诱 饵和猎物之间是否存在相互作用。
作为一种分析蛋白质与蛋白质之间相互作
酵母双杂交系统
• 酵母双杂交技术由Fields等人于1989年提出。 • 该技术利用了酵母转录因子GAL4性质,GAL4包
括两个彼此分离但功能上必需的结构域,一个是 位于N端1-174位氨基酸残基区段的DNA结合 (DNA binding domain,DNA-BD),另一个是位于C 端768-881位氨基酸残基区段的转录激活域 (Activation domain, AD)。
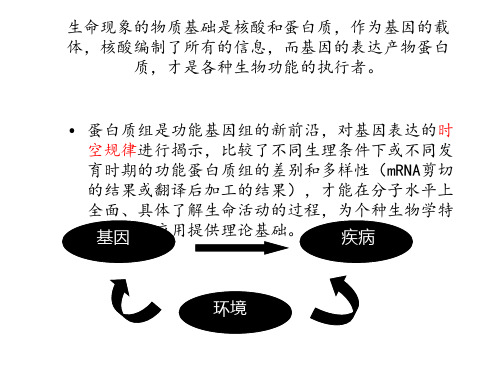
功能蛋白质组学
功能蛋白质组学是指对蛋白质间、蛋白质 与 DNA/RNA 间的相互作用的研究。以细 胞内与某个功能有关或某种条件下的一群 蛋白质为主要研究内容, 由此建立细胞内 外信号传递的复杂网络。
• 蛋白质芯片技术 • 噬菌体展示技术 • 酵母双杂交系统
蛋白质芯片
蛋白质芯片是将大量蛋白质分子按预先设置的排 列固定于一种载体表面,形成微阵列,根据蛋白 质分子间特异性结合的原理,构建微流体生物化 学分析系统,以实现对生物分子的准确、快速、 大信息量的检测。
flight-mass spectrometry,SELDI-TOF-MS )蛋白质 芯片由3部分组成:蛋白质芯片、阅读器和分析 软件。 蛋白质芯片是核心部分,芯片上固定的介质可以 是阴离子、阳离子、疏水性、亲水性、金属等, 根据蛋白质的化学特性而有选择性地捕获特异的 蛋白质。
SELDI技术的基本原理:
3 在疾病的治疗和致病机理方面的研究
有研究以HCV非结构蛋白NS4A作为固相靶分子,白NS4A结合 的是肝细胞蛋白丝裂原激活蛋白激酶(MAPK) 激活蛋白激酶5(MAPKAPK5),为进一步研究 HCV的致病机制奠定了基础。
假阳性分为两类:
一类是生物学上的假阳性
即蛋白质与蛋白质的相互作用在酵母细胞 中发生,但是在其生物体细胞内并不发生相 互作用,这主要是因为两种蛋白不同时表 达或者二者根本不在同一组织中,这种假 阳性,我们如果对所研究的蛋白质的生物学 特性没有深入了解的话,是很难排除的。
另一类是技术上的假阳性
即由于双杂交技术上的局限而鉴定出的蛋 白质与蛋白质间的相互作用。
抗体芯片
抗体芯片主要研究在不同生理或病理状态下蛋白质 水平的量变。微型化、集成化、高通量化是抗体芯片重 要特点。
芯片上排列了许多已知蛋白质的单克隆抗体,这些 单克隆抗体对应的蛋白质(抗原)都是细胞结构和功能 上十分重要的蛋白,涉及信号传导、肿瘤、细胞周期调 控、细胞结构、细胞凋亡等广泛的领域。
抗体芯片检测的结果不是蛋白质的绝对含量而是目 的蛋白质在两个样品之间的相对峰度。
• 可同时固定各种蛋白质、多肽、核酸等生物分子,可 以对同一个样品中的多个不同的分子同时进行检测。
噬菌体展示技术
自1985年Smith G P等创建噬菌体展示技术,其 原理是:以经过改建的噬菌体为载体,把外源基 因插入噬菌体外壳蛋白基因PⅢ区或PⅧ区,从而 使表达的外源肽或蛋白质展示在噬菌体的表面, 并使表达产物保持良好的空间构象。进而通过亲 和富集法筛选表达有特异肽或蛋白质的噬菌体, 最终获得具有特异结合性质的保持蛋白的一定构象。因此,该系 统最大程度地再现了细胞内的真实情况,所筛选 出的结合蛋白与自然状态较为接近。目前已被成 功应用于蛋白质-蛋白质、抗原-抗体以及DNA-蛋 白质之间作用的研究,为功能基因组学的研究提 供了一种新的方法。
• cDNA库是在噬菌体衣壳蛋白的基因中插入 从某些组织或细胞中抽提出来的mRNA的互 补DNA片段,从而表达该组织或细胞的各 种蛋白于噬菌体的表面。
根据片基材料的不同可以分为: 膜芯片、玻璃芯片和液相芯片等。
目前常用蛋白质芯片有: 1. SELDI-TOF-MS蛋白质芯片 2. 抗体芯片 3. 靶蛋白质芯片 4. 液相蛋白质芯片
SELDI-TOF-MS蛋白质Байду номын сангаас片
表面加 强激 光 解 吸电 离- 飞行 时间 质谱(surface
enhanced laser desorption /ionization time of
靶蛋白质芯片
主要用于蛋白质相互作用研究、蛋白表达 研究和小分子蛋白结合研究。
靶蛋白质的获得: 1.化学合成; 2.基因工程表达蛋白质并进行纯化点样制作芯片; 3.将活的生物体(如细菌、酵母等)在芯片上原位表
达蛋白质(living芯片) 。 4.将核酸固定在芯片介质中,然后利用不依赖细胞
的体外蛋白表达系统,在原位合成靶蛋白。
