多级萃取流程
合集下载
萃取课件专题知识课件

=K0 /(1 +10 pH - pK )
对于弱碱性电解质
K
K0
Kp
Kp H
=K0 /(1 +10 pK - pH )
K0-只与T、P有关; K-与T、P和pH有关 K可经过试验求出,而K0不能,可由公式求出。
有机溶剂旳选择
根据相同相溶旳原理,选择与目旳产物极性相近 旳有机溶剂为萃取剂,能够得到较大旳分配系数 (根据介电常数判断极性);
溶剂萃取概述
分液漏斗
有机相 水相
一般工业液液萃取过程
料液 (待分离物
质+杂质 萃 取
萃取液 (待分离物 质+少量杂质
洗 涤 剂
洗 涤
萃取剂 +稀释剂
杂质+少量 萃残液 待萃物质 (杂质)
反
萃 萃取剂+稀释剂
剂
(待返回使用)
待反 萃萃 物取 质
产物(待萃物质)
生物萃取与老式萃取相比旳特殊性
生物工程不同于化工生产,主要体现在生物 分离往往需要从浓度很稀旳水溶液中除去大 部分旳水,而且反应液中存在多种副产物和 杂质,使生物萃取具有特殊性。
青霉素旳分配平衡
弱电解质旳分配系数:
热力学分配系数K0 :萃取平衡时,单分子化 合物溶质在两相中浓度之比。
Kp=
弱酸性电解质K0= [AH]/[AH] 弱碱性电解质K0 = [B]/[B]
弱电解质旳表观分配系数K:
分配达平衡时,溶质在两相旳总浓度之比
对于弱酸性电解质
H K K0 K p H
亲水
亲油基团 亲油
亲水基团伸向水中,亲油基团伸向油中。
乳浊液类型
当将有机溶剂(通称为油)和水混在一起搅拌时,可
能产生两种形式的乳浊液。
萃取过程的计算

萃取过程的计算
2. 解析法
对于原溶剂B与萃取剂S不互溶的物系,若在操作范围内,以质
量比表示的分配系数K 为常数,则平衡关系可表示为
Y=KX
(8-16
式中 Y——萃取相E中溶质A的质量比分数;
X——萃余相R中溶质A的质量比分数;
K——相组成以质量比分数表示时的分配系数。
即分配曲线为通过原点的直线。在此情况下,当错流萃取的各
萃取过程的计算
图8-14 三级错流萃取三角形坐标图解
萃取过程的计算
(3)以R1为原料液,加入纯的萃取剂S,依杠杆规则找出 两者混合点M2,按与(2)类似的方法可以得到E2和R2,此即第二 个理论级分离的结果。
(4)以此类推,直至某级萃余相中溶质的组成等于或小于规 定的组成xR为止,重复作出的联结线数目即为所需的理论级数。
(1)由已知的相平衡数据在等腰直角三角形坐标图中绘出溶解度曲线 和辅助线,如图8-11所示。
(2)在三角形坐标的AB边上根据原料液的组成确定点F,根据萃取剂 的组成确定点S(若为纯溶剂,则为顶点S),联结点F、S,则原料液与 萃取剂的混合物系点M必落在FS连线上。
萃取过程的计算
(3)由已知的萃余相组成xR,在图上确定点R,再由点R利用辅助曲 线求出点E,作R与E的联结线,显然RE线与FS线的交点即为混合液的组 成点M。
(8-12)
联立求解式(8-6)和式(8-12) 得
萃取过程的计算
同理,可得萃取液和萃余液的量E′、R′,即 上述诸式中各股物流的组成可由三角形相图直接读出。
萃取过程的计算
二、 多级错流萃取的计算
单级萃取所得的萃余相中往往还含有较多的溶质,为进一步降低萃 余相中溶质的含量,可采用多级错流萃取。其流程如图8-13所示。
萃取过程的计算

二、单级萃取过程
部分互溶物系
图解法( 已知 xF、F、S 求 x’ )
A
①作溶解度曲线及辅助线 ②确定F、S点
③由杠杆定律确定M
④由M及辅助线试差法确定R、E ⑤由R、E及SE、SR定R’、E’ ⑥由△确定x’
E’
F M R’ R
B S
E
二、单级萃取过程
部分互溶物系
图解法( 已知 xF、F、 x’ 求 S及E相和R相的量、E 相组成 )
原溶剂B
yB kB xB
yA xA
E
R
k值愈大,萃取分离的效果愈好,其值随温度和组成而变
4
如第Ⅰ类物系,一般 k值随温度的升高或溶质组成的增 大而降低。一定温度下,仅当溶质组成范围变化不大时, k 值才可视为常数。 对于萃取剂S与原溶剂B互不相溶的物系,溶质在两液相 中的分配关系与吸收中的类似,即
' ' '
y E xR
'
R F E
二、单级萃取过程
B、S完全不互溶
适用于萃取剂与稀释剂互溶度很小,且在操作范围内溶质组 分对 B、S 的互溶度又无明显影响的体系。
Ⅰ 已知F ,xF 及 Y0,规定萃余液组成x,求S用量。 Ⅱ 已知F ,xF,Y0及 S 用量,求萃余液组成x’
二、单级萃取过程——完全不互溶物系
物料衡算:
BX F SY0 BX SY
S (Y Y0 ) B( X F X )
操作线方程
B Y X-X F Y0 S
二、单级萃取过程——完全不互溶物系
物料衡算:
BX F SY0 BX SY
S (Y Y0 ) B( X F X )
多级错流萃取的计算1萃取剂和稀释剂部分互溶的体系

....................................... .......................................
Yn Yo B S N ( X N X N 1 )
——错流萃取每一级的操作线方程
E E1 E2
Y1 Y2 Y0 O
-B/S2
第九章 液液萃取
第三节 萃取过程的计算
一、单级萃取的流程与计算
1、单级萃取的流程 2、单级萃取的计算
1)萃取剂与稀释剂部分互溶的体系
原料液F 萃余相R
xF
萃取剂Sห้องสมุดไป่ตู้
xR
萃取相E
ys
yE
E ' FR' E’ R' FE '
MF S F MS
R ME E MR
E ' R' F
FD F DS R’
2、多级错流萃取的计算
1)萃取剂和稀释剂部分互溶的体系
F M S0 M1 FS0
E1 R1 R2 R3 M1 M2 M3 E2 E3
2)萃取剂和稀释剂不互溶的体系
a)直角坐标图解法
对第一级 : Y1 Y0 B S1 ( X 1 X F )
第2到N级 : Y Y B S ( X X ) 2 0 2 2 1
-B/S3 X2 U X1
-B/S1
V XF
b)解析法 分配曲线: 设:
Y KX
——萃取因子
KS Am B
Ys XF 1 K) n ln( ln( 1 Am ) X YS n K
B B YE ( X F X R ) Y0 Y0 ( X R X F ) S S
4.3 萃取计算

原料 A+B 萃取剂 S 萃取相 E
萃余相 R
4.3.1 单级萃取
1、原溶剂和萃取剂部分互溶的体系(杠杆规则)
原料 A+B 萃取剂 S
萃取相 E
S用量的计算:
S = F(MF / MS)
R、E的计算:
萃余相 R
A E’m E’
R+E=F+S
R / E = ME / MR R’、E’组成计算:
F
B R’ R M
Y2 =
Y3 =
( B / S 1 )( X
( B / S 1 )( X
2
- X 1)
- X 2)
3
··· ··· ···
YN = ( B / S 1 )( X
N
- X
N
1
)
(4-8c)
12.3.2 多级错流萃取
(1)图解法
Y 1 = - ( B / S 1 )( X 1 - X F )
Y1
E1 E2 E3
(2)解析法
平衡线 Y=mX
1
Y 1 = mX
Y 1 = - ( B / S 1 )( X 1 - X F )
Y1
Y2 Y
E2 E3 E4
E1
E
mS X1 = X
F
/( B
1
+ 1)
萃取因数
令 b1=mS1/B ,则X1=XF/( b1 +1)
Y1 = mX
F
Y3 Y4
0
/( b1 + 1 )
/( b 1 + 1 )
例4-4 含丙酮20%(质量百分率,下同)的水溶液,流量 F=800kg/h,按错流萃取流程,以1,1,2-三氯乙烷萃取其中的丙酮, 每一级的三氯乙烷流量S1=320kg/h。要求萃余液中的丙酮含量降到 5%以下,求所需的理论级数和萃取相、萃余相的流量。操作温度为 25℃,此温度下的平衡数据示于下表。
萃余相 R
4.3.1 单级萃取
1、原溶剂和萃取剂部分互溶的体系(杠杆规则)
原料 A+B 萃取剂 S
萃取相 E
S用量的计算:
S = F(MF / MS)
R、E的计算:
萃余相 R
A E’m E’
R+E=F+S
R / E = ME / MR R’、E’组成计算:
F
B R’ R M
Y2 =
Y3 =
( B / S 1 )( X
( B / S 1 )( X
2
- X 1)
- X 2)
3
··· ··· ···
YN = ( B / S 1 )( X
N
- X
N
1
)
(4-8c)
12.3.2 多级错流萃取
(1)图解法
Y 1 = - ( B / S 1 )( X 1 - X F )
Y1
E1 E2 E3
(2)解析法
平衡线 Y=mX
1
Y 1 = mX
Y 1 = - ( B / S 1 )( X 1 - X F )
Y1
Y2 Y
E2 E3 E4
E1
E
mS X1 = X
F
/( B
1
+ 1)
萃取因数
令 b1=mS1/B ,则X1=XF/( b1 +1)
Y1 = mX
F
Y3 Y4
0
/( b1 + 1 )
/( b 1 + 1 )
例4-4 含丙酮20%(质量百分率,下同)的水溶液,流量 F=800kg/h,按错流萃取流程,以1,1,2-三氯乙烷萃取其中的丙酮, 每一级的三氯乙烷流量S1=320kg/h。要求萃余液中的丙酮含量降到 5%以下,求所需的理论级数和萃取相、萃余相的流量。操作温度为 25℃,此温度下的平衡数据示于下表。
8-3-2萃取计算
42.14 47.21
2.18
1.02 0.44
55.97
71.80 99.56
41.85
27.18 0
附表2
xA 5.96 yA 8.75
联结线数据
10.0 15.0 14.0 21.0 19.1 27.7 21.0 32.0 27.0 40.5 35.0 48.0
解: (1)由题中数据作溶解度曲线和辅助曲线; (2)由题丙酮含量40%,确定F点位置; (3)连结FS,有杠杆规则确定M1点位置; (4)试差法求R1与E1位置:以M1点为轴,转动 联结线R1与E1,当点T恰好落在辅助曲线上时, 停止转动,此时该直线与溶解度曲线的交点就是 所求的R1与E1; (5)杠杆规则求R1的质量: 以E1为支点:
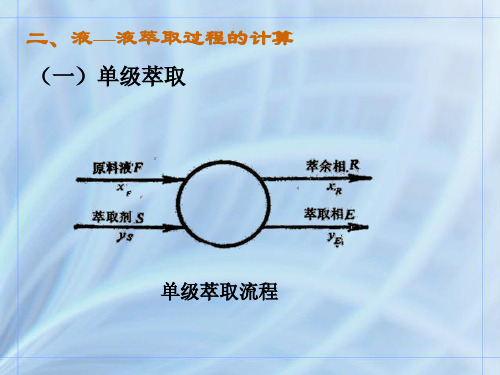
二、液—液萃取过程的计算 (一)单级萃取
单级萃取流程
实际上,对于某一个萃取分离任务,通 常已知料液量F及其组成xF,且规定了 萃余相的浓度xR ,求萃取剂用量S,萃 取相的量E和组成yE,及萃余相的量R。
也就是,已知: (1)料液量F;
P
(2பைடு நூலகம் F点相图位置;
(3)萃余相R点的位置。 (1)萃取剂用量S; 求: (2)萃余相的量R;
(3)萃取相的量E;
(4)萃取相E的相图位置。
F+S
物料衡算: 杠杆规则求 各流股的量:
M
E R
E’ R’
F+S=M=E+R
S×MS = F×MF E×ER = M×MR
(以M点为支点)
(以R点为支点)
E’×E’R’ = F×FR’ (以R’点为支点)
溶质A物料衡算:
FxF = MxM = EyE + RxR= E’yE’ + R’xR’
2.18
1.02 0.44
55.97
71.80 99.56
41.85
27.18 0
附表2
xA 5.96 yA 8.75
联结线数据
10.0 15.0 14.0 21.0 19.1 27.7 21.0 32.0 27.0 40.5 35.0 48.0
解: (1)由题中数据作溶解度曲线和辅助曲线; (2)由题丙酮含量40%,确定F点位置; (3)连结FS,有杠杆规则确定M1点位置; (4)试差法求R1与E1位置:以M1点为轴,转动 联结线R1与E1,当点T恰好落在辅助曲线上时, 停止转动,此时该直线与溶解度曲线的交点就是 所求的R1与E1; (5)杠杆规则求R1的质量: 以E1为支点:
二、液—液萃取过程的计算 (一)单级萃取
单级萃取流程
实际上,对于某一个萃取分离任务,通 常已知料液量F及其组成xF,且规定了 萃余相的浓度xR ,求萃取剂用量S,萃 取相的量E和组成yE,及萃余相的量R。
也就是,已知: (1)料液量F;
P
(2பைடு நூலகம் F点相图位置;
(3)萃余相R点的位置。 (1)萃取剂用量S; 求: (2)萃余相的量R;
(3)萃取相的量E;
(4)萃取相E的相图位置。
F+S
物料衡算: 杠杆规则求 各流股的量:
M
E R
E’ R’
F+S=M=E+R
S×MS = F×MF E×ER = M×MR
(以M点为支点)
(以R点为支点)
E’×E’R’ = F×FR’ (以R’点为支点)
溶质A物料衡算:
FxF = MxM = EyE + RxR= E’yE’ + R’xR’
食品分离技术(3)萃取技术1

疏水性 共价键化合物 弱极性或非极性
35
萃取百分率
E
溶质溶 在质 有的 机总 相量 中的量
mo mo mw
coVo coVo cwVw
co
co cw cw Vw
Vo
D DR
其中
R
Vw Vo
称为相比
当 R = 1 时,
E
D D 1
D
1 10 100 1000
E % 50 91 99 99.9
在实际工作中,人们所关注的是被萃物分配在两 相中的实际总浓度各为多少,而不是它们的具体存 在的型体。
分配比
D CA(有机 ) C(A 水)
即,在一定条件下,当达到萃取平衡时,被萃物 质在有机相和在水相的总浓度之比。
9
分配系数和分配比的比较
●概念不同,关注的对象有差别 ●两者有一定的联系
KD表示在特定的平衡条件下,被萃物在两相中的 有效浓度(即分子形式一样)的比值;而D表示实际 平衡条件下被萃物在两相中总浓度(即不管分子以 什么形式存在)的比值。分配比随着萃取条件变化 而改变。
丁酯逆流萃取
萃取液
乳酸沉淀
分解转碱
红霉素乳酸盐 调 pH9.8, 溶于丙酮 红霉素碱
加水
红霉素碱成品
结晶
18
2. 温度T
◆ T↑,分子扩散速度↑,故萃取速度↑ ◆ T影响分配系数
例:pen ― T↑ 水中的溶解度↑ ∴ 萃取时 T↓使K↑;反萃时 T↑使K反↑ 红霉素、螺旋霉素― T↑ 水中的溶解度↓ ∴ 萃取时 T ↑使K ↑ ;反萃时 T ↓使K反↓
16
举例:
青霉素 ( pK2.75 ) 工业钾盐 :
预处理及过滤
发酵液
滤洗液
35
萃取百分率
E
溶质溶 在质 有的 机总 相量 中的量
mo mo mw
coVo coVo cwVw
co
co cw cw Vw
Vo
D DR
其中
R
Vw Vo
称为相比
当 R = 1 时,
E
D D 1
D
1 10 100 1000
E % 50 91 99 99.9
在实际工作中,人们所关注的是被萃物分配在两 相中的实际总浓度各为多少,而不是它们的具体存 在的型体。
分配比
D CA(有机 ) C(A 水)
即,在一定条件下,当达到萃取平衡时,被萃物 质在有机相和在水相的总浓度之比。
9
分配系数和分配比的比较
●概念不同,关注的对象有差别 ●两者有一定的联系
KD表示在特定的平衡条件下,被萃物在两相中的 有效浓度(即分子形式一样)的比值;而D表示实际 平衡条件下被萃物在两相中总浓度(即不管分子以 什么形式存在)的比值。分配比随着萃取条件变化 而改变。
丁酯逆流萃取
萃取液
乳酸沉淀
分解转碱
红霉素乳酸盐 调 pH9.8, 溶于丙酮 红霉素碱
加水
红霉素碱成品
结晶
18
2. 温度T
◆ T↑,分子扩散速度↑,故萃取速度↑ ◆ T影响分配系数
例:pen ― T↑ 水中的溶解度↑ ∴ 萃取时 T↓使K↑;反萃时 T↑使K反↑ 红霉素、螺旋霉素― T↑ 水中的溶解度↓ ∴ 萃取时 T ↑使K ↑ ;反萃时 T ↓使K反↓
16
举例:
青霉素 ( pK2.75 ) 工业钾盐 :
预处理及过滤
发酵液
滤洗液
生物分离工程-第5章-萃取技术

多级错流 多级萃取 操作方式 多级逆流
单级萃取
假定:两相中的分配很快达到平衡; 两相完全不互溶,完全分离。
X S VS CS VS 1 ★ 萃取因素: E 萃取液溶质总量 = =K K 萃余液溶质总量 XF VF CF VF m
单级萃取
单级萃取:只包括一个混合器和一个分离器
分离因素(β)
分离因素表示有效成分A与杂质B的分离程度。
KA KB
β=1 KA = KB 分离效果不好;
β>1 KA > KB 分离效果好;
β越大,KA 越大于KB,分离效果越好。
弱电解质在有机溶剂-水相的分配平衡
分配系数中CO和CW 必须是同一种分子类型,即不发生缔合或离解。对 于弱电解质,在水中发生解离,则只有两相中的单分子化合物的浓度才 符合分配定律。 例如青霉素在水中部分离解成负离子(青COO-),而在有机溶剂相 中则仅以游离酸(青COOH)的形式存在,则只有两相中的游离酸分子 才符合分配定律。
多级逆流萃取
在多级逆流萃取中,在第一级中连续加入料液,并 逐渐向下一级移动,而在最后一级中连续加入萃取 剂,并逐渐向前一级移动。
料液移动的方向和萃取剂移动的方向相反,故称为 逆流萃取。 在逆流萃取中,只在最后一级中加入萃取剂,故和 错流萃取相比,萃取剂之消耗量较少,因而萃取液 平均浓度较高。
有机溶剂萃取的影响因素
pH的影响
pH对表观分配系数的影响(pH-K)
pH低有利于酸性物质分配在有机相,碱性物质分 配在水相。 对弱酸随pH↓,K↑, 当pH << pK时,K→K0
由萃取机理和K~pH的关系式可得出如下结论
酸性物质 萃取 反萃取 pH<pK pH>pK 碱性物质 pH>pK pH<pK
单级萃取
假定:两相中的分配很快达到平衡; 两相完全不互溶,完全分离。
X S VS CS VS 1 ★ 萃取因素: E 萃取液溶质总量 = =K K 萃余液溶质总量 XF VF CF VF m
单级萃取
单级萃取:只包括一个混合器和一个分离器
分离因素(β)
分离因素表示有效成分A与杂质B的分离程度。
KA KB
β=1 KA = KB 分离效果不好;
β>1 KA > KB 分离效果好;
β越大,KA 越大于KB,分离效果越好。
弱电解质在有机溶剂-水相的分配平衡
分配系数中CO和CW 必须是同一种分子类型,即不发生缔合或离解。对 于弱电解质,在水中发生解离,则只有两相中的单分子化合物的浓度才 符合分配定律。 例如青霉素在水中部分离解成负离子(青COO-),而在有机溶剂相 中则仅以游离酸(青COOH)的形式存在,则只有两相中的游离酸分子 才符合分配定律。
多级逆流萃取
在多级逆流萃取中,在第一级中连续加入料液,并 逐渐向下一级移动,而在最后一级中连续加入萃取 剂,并逐渐向前一级移动。
料液移动的方向和萃取剂移动的方向相反,故称为 逆流萃取。 在逆流萃取中,只在最后一级中加入萃取剂,故和 错流萃取相比,萃取剂之消耗量较少,因而萃取液 平均浓度较高。
有机溶剂萃取的影响因素
pH的影响
pH对表观分配系数的影响(pH-K)
pH低有利于酸性物质分配在有机相,碱性物质分 配在水相。 对弱酸随pH↓,K↑, 当pH << pK时,K→K0
由萃取机理和K~pH的关系式可得出如下结论
酸性物质 萃取 反萃取 pH<pK pH>pK 碱性物质 pH>pK pH<pK
萃取过程的计算

整理得
Y1
YS
B S
(X1
XF)
二、多级错流萃取的计算
第 n 级作溶质 A的质量衡算
Yn
YS
B S
(Xn
X n1)
操作线方程
斜率 过点
B S
( X n1,YS )
直角坐标图图解法
Y1
Y2 Y3
YS
N
M
斜率 –B/S
L
X3 X2
X1
XF
x x n计算 ≤ n规定
n=3
多级错流萃取直角坐标图图解计算
E
yE
xF
F
xR
R R
xR
E M
单级萃取图解
yE
纯溶剂
一、B 与 S 部分互溶物系
M FS RE
MF S Leabharlann F×MSR M E
E M RM RE
E F RF R E
Smin
F
FG GS
R F E
Smax
F
FH HS
Smin S Smax
多级错流萃取流程示意图
多级错流萃取的总溶剂用量为各级溶剂用量 之和,当各级溶剂用量相等时,达到一定的分离 程度所需的总溶剂用量最少。
二、多级错流萃取的计算
1. B与 S部分互溶物系 已知: 原料量 F
原料组成 xF
各级萃取剂用量 Si
规定:最终萃余相组成 xn
计算: 萃取级数 n
三角形相图图解法
F
F xF
1
E1 y1
R1 x1 E2 y2
x R x 2 2
Y1
YS
B S
(X1
XF)
二、多级错流萃取的计算
第 n 级作溶质 A的质量衡算
Yn
YS
B S
(Xn
X n1)
操作线方程
斜率 过点
B S
( X n1,YS )
直角坐标图图解法
Y1
Y2 Y3
YS
N
M
斜率 –B/S
L
X3 X2
X1
XF
x x n计算 ≤ n规定
n=3
多级错流萃取直角坐标图图解计算
E
yE
xF
F
xR
R R
xR
E M
单级萃取图解
yE
纯溶剂
一、B 与 S 部分互溶物系
M FS RE
MF S Leabharlann F×MSR M E
E M RM RE
E F RF R E
Smin
F
FG GS
R F E
Smax
F
FH HS
Smin S Smax
多级错流萃取流程示意图
多级错流萃取的总溶剂用量为各级溶剂用量 之和,当各级溶剂用量相等时,达到一定的分离 程度所需的总溶剂用量最少。
二、多级错流萃取的计算
1. B与 S部分互溶物系 已知: 原料量 F
原料组成 xF
各级萃取剂用量 Si
规定:最终萃余相组成 xn
计算: 萃取级数 n
三角形相图图解法
F
F xF
1
E1 y1
R1 x1 E2 y2
x R x 2 2
生物工程下游技术-第五章_萃取技术

1896年Beijerinck观察到当把明胶与琼脂 或把明胶和可溶性淀粉的水溶液混合时, 先得到一混浊不透明的溶液,随后分成 两相,上相含有大部分明胶,下相含有 大部分琼脂(或可溶性淀粉)。
2.2%的葡聚糖水溶液与等体积的0.72%甲基 纤维素钠的水溶液相混合并静置后,可得到两 个粘稠的液层。
多级逆流萃取图
L1
L2
S
L3
混 分混 分混 分 合 离合 离合 离 器 器器 器器 器
F
第一级
第二级
R3 第三级
青霉素的多级逆流萃
取 第一级
第二级
第三级
含青霉素乙酸戊酯
青霉素滤液
废液 乙酸戊脂
青(霉含素产发品酵青过霉在三滤素级液)逆进混流入合萃取第 萃装一取置级,中用萃然乙取后酸罐流戊,入酯从在第澄此一清与级的发从分酵第离液二器中级分分离分成青离上霉器下素来层的,萃取相
第一级的萃余液进入第二级作为料液,并加 入新鲜萃取剂进行萃取;第二级的萃余液再 作为第三级的料液,以此类推。
此法特点在于每级中都加溶剂,故溶剂消耗 量大,而得到的萃取剂平均浓度较稀,但萃 取较完全。
多级错流萃取示意
图 轻
料
相 入
液重相入Leabharlann 轻相入入口
轻相出
第一级
第二级
轻相出
第三级 萃余液出口
轻相出 重相出
图9-5 转筒式离心萃取器
5.2 双水相萃取
➢ 双水相萃取技术又称水溶液两相分配技术,是近 年来出现的引人注目的、极具前途的新型分离技 术。已被广泛的应用于生物化学、细胞生物学和 生物化工领域。
➢ 用此种方法已提取的酶已达数十种,其分离也达 到了相当的规模,如甲酸脱氢酶的分离已达到了 几十公斤的湿细胞规模,半乳糖苷酶的提取已进 行了中试规模实验,该法具有广阔的应用前景。
化工原理下萃取过程的流程与计算

20
1-甘氨酸 2-弗朗鼠李甙 3-大黄素 4-对羟基苯甲酸 5-1,8-二羟基蒽醌 6-水杨酸 7-苯甲酸
不同物质在二氧化碳中得溶解度
21
二、超临界萃取得基本原理
萃取剂
在超临界状 态下,压力 微小变化引 起密度变化 很大,使溶 解度增大
压缩到超 临界状态
液体(或固 升温、降压 体)混合物
萃取 组分
29
第4章 液-液萃取
4、4 其她萃取分离技术 4、5 液-液萃取设备 4、5、1 萃取设备得基本要求与分类
30
萃取因子
4
二、多级逆流萃取得计算
(3)适宜溶剂量得确定
处理量F 一定
S ~S/F ~n
根据工程经验
设备费 操作费
S = (1.1 ~ 2.0)Smin 适宜溶剂用量
5
Y1
Y1 Y1
max
YS
(B / S)
B/S
Xn
XF
最小溶剂用量
6
max B S min
Smin B max
max
T1 < T2 p1 = p2
超临界萃取等压变温流程
25
1-萃取器 2-吸附剂 3-分离槽 4-泵
T1 = T2 p1 = p2
超临界萃取等温等压吸附流程
26
四、超临界萃取得特点
超临界萃取得特点: ①超临界流体密度接近于液体,溶解能力与液体溶剂 基本相同; ②超临界流体具有气体得传递特性,具有更高得传质 速率; ③适合于热敏性、易氧化物质得分离或提纯; ④操作压力高,设备投资较大。
Y1* YS XF Xn
第4章 液-液萃取
4、3 萃取过程得计算 4、3、1 单级萃取得计算 4、3、2 多级错流萃取得流程和计算 4、3、3 多级逆流萃取得流程和计算 4、3、4 微分接触逆流萃取
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
辅助曲线和临界混熔点
(3)分配系数与分配曲线
分配系数:
组分A在E相中的组成 y A k A 组分A在R相中的组成 x A
yB kB xB
其中:yA—萃取相E中组分A的质量分数; xA—萃取相R中组分A的质量分数; kA愈大,萃取分离的效果愈好。
分配曲线
3.杠杆规则 M点:和点 R点、E点:差点
在湿法冶金中的应用
在食品化工中的应用
任务二 萃取操作知识准备
一、三元体系的液液相平衡
1.组成在三角形相图上的表示方法
三个顶点: A点:纯溶质 B点:纯稀释剂 S点:纯萃取剂 边上的点: 二元混合物 三角形内的点: 三元混合物
组成在三角形相图上的表示方法
例:M点的组成 过M作对边和平行线ED、HG、KF, 由点E、G、K读出组成。 xA=0.4 xB=0.3
S 在回收器内产 物与溶剂分离,溶 剂则可循环使用。
萃取器 F
分离器 R
回收器 P(产物)
2.多级萃取流程
(1)多级错流萃取
料液Leabharlann 萃余液萃余液混合分离器1
萃取液 溶剂 溶剂
混合分离器2
萃取液 溶剂
混合分离器n
萃取液
萃余液
多级错流萃取流程的特点:每级均加新鲜溶 剂,故溶剂消耗量大,得到的萃取液产物平均浓 度较稀,但萃取较完全。
(2)多级逆流萃取
料液
萃余液
萃余液
废液
混合分离器1
产物+溶剂
混合分离器2
混合分离器n
溶剂
多级逆流萃取流程的特点:料液走向和萃 取剂走向相反,只在最后一级中加入萃取剂, 萃取剂消耗少,萃取液产物平均浓度高,产物 收率较高。工业上多采用多级逆流萃取流程。
四、萃取在工业生产中的应用
在石油化工中的应用 在生物化工中和精细化工中的应用
喷洒萃取塔 1—重相;2—轻相
填料萃取塔
塔内装有适宜的填料, 轻相由底部进入,顶部排出, 重相由顶部进入,底 部排出。 优点:结构简单,操作方便 缺点:传质效率低,不适合 处理有固体悬浮物的 场合。
填料萃取塔
筛板萃取塔 两相依靠密度差,在重力的作用下,进行分散 和逆流流动,若以轻相为分散相,则其通过塔板上 的筛孔而被分散成细小的液滴,与塔板上的连续相 充分接触进行传质。穿过连续相的轻相液滴逐渐凝 聚,并聚集于上层筛板的下侧,待两相分层后,轻 相借助压力差的推动,再经筛孔分散,液滴表面得 到更新,直至塔顶分层后排出。而连续相则横向流 过塔板,在筛板上与分散相液滴接触传质后,有浆 液管流至下一层塔板。
E MR R ME
萃取操作示意图.swf
2.原理: 萃取是向液体混合物中加入适当溶剂利用 组分溶解度的差异使溶质A由原溶液转移到萃
取剂S中的过程。
萃取相-含萃取剂S多的一相,以E表示; 萃余项-含稀释剂B多的一相,以R表示。
二、萃取设备 (一)混合—澄清器 组成:混合器、澄清器
混合器中装有搅拌装置,使其中一相破碎成 液滴而分散于另一相中,以加大相际接触面积 并调高传质速率。两相在混合器内停留一定时 间后,流入澄清器。在澄清器中,轻、重两相 依靠密度差分离成萃取相和萃余相。 优点:处理量大,传质效率高;流量范围大; 结构简单,适用性强。 缺点:水平排列的设备占地面积大,萃取剂存 留量大,设备费和操作费都较高。
转盘塔
萃取操作时,转盘随 中心轴高速旋转,其在液 体中产生的剪应力将分散 相破碎成许多细小的液滴 ,在液相中产生强烈的涡 旋运动,从而增大了相际 接触面积和传质系数。
转盘萃取塔
结构简单,生产能力大,传质效率高,操作弹性大。
(三) 离心萃取器
操作时两相在压强作用下分别通过带机械密 封装置的套管式空心转轴的一端进入,轻相由外 圈引入,重相由中心引入,在离心力作用下,轻 相由外圈向中部流,重相由中心向外流,两相形 成逆向流动。最终,重相由螺旋最外层流出,轻 相从中部流出。
①当B、S完全不互溶时, 点C与D分别与三角形的 顶点B及S重合; ②两相区的混合液分为两 个液相共轭相,因此萃取 操作只能在两项区内进行。 ③一定温度下,同一物质 的联接线倾斜方向时一致 的,但各联接线互不平行。
溶解度曲线和联接线
(2)辅助曲线和临界混溶点(褶点) ①利用辅助线可方便的 从已知某相 R (或 E )的 组成确定与之平衡的另 一相 R (或 E )的组成; ② 辅助线与溶解度曲线 的交点P,表明通过改点 的联接线为无限短 ,相 当于这一系统的临界状 态。P点为临界混合点。
优点:结构紧凑,物料停留时间段,处理能力大 缺点:构造复杂、制造困难、造价维修费用高,能耗大。
三、萃取流程
单级萃取 萃取 多级萃取 多级逆流萃取 多级错流萃取
1.单级萃取流程
使用一个混合器和一个分离器的萃取操作: 料液F与萃取溶剂S一起加入混合器内搅拌混合 萃取,达到平衡后的溶液送到分离器内分离得到 萃取相L和萃余相R,萃取相送到回收器,萃余相R 为废液。
(二) 萃取塔
喷洒塔 以重液为连续相,分两 路由塔顶进入,向下流以轻 液液滴接触,至塔底后与轻 液分离后流出;轻液通过塔 底的喷洒器分散为液滴后进 入连续相,在连续相内浮升 与重液接触进行传质,直至 到达塔顶,并聚成轻液层后 流出。
优点:结构简单、投资少,易于维护 缺点:两相的接触面积和传质系数都不大,传质效率低
学习情境5 富集回收煤油中的苯甲酸
任务一 设备识别,萃取流程巡检 任务二 萃取操作知识准备 任务三 萃取操作及事故处理 任务四 萃取塔的日常维护和检修
任务一 设备识别,萃取流程巡检 一、萃取
1.概念:利用原料液中各组分在适当溶剂中溶解度 的差异而实现混合液中各组分分离的过程称为液- 液萃取又称溶剂萃取。 溶质-易溶组分以A表示; 稀释剂或原溶剂-部分溶解或完全不溶解即: 难溶组分以B表示; 萃取剂-所采用的溶剂,以S表示。
xS=0.3
2.相平衡关系在三角形相图中的表示方法 Ⅰ类物系: (1)溶质A完全溶于稀释剂B及萃取剂S中,但 B与S不互溶; (2)溶质A可完全溶解于稀释剂B及萃取剂S中, 但B与S为一对部分互溶组分; Ⅱ类物系: (1)组分A、B可完全互溶,但B、S及A、S为 两对部分互溶组分。
(1)溶解度曲线和联接线
(3)分配系数与分配曲线
分配系数:
组分A在E相中的组成 y A k A 组分A在R相中的组成 x A
yB kB xB
其中:yA—萃取相E中组分A的质量分数; xA—萃取相R中组分A的质量分数; kA愈大,萃取分离的效果愈好。
分配曲线
3.杠杆规则 M点:和点 R点、E点:差点
在湿法冶金中的应用
在食品化工中的应用
任务二 萃取操作知识准备
一、三元体系的液液相平衡
1.组成在三角形相图上的表示方法
三个顶点: A点:纯溶质 B点:纯稀释剂 S点:纯萃取剂 边上的点: 二元混合物 三角形内的点: 三元混合物
组成在三角形相图上的表示方法
例:M点的组成 过M作对边和平行线ED、HG、KF, 由点E、G、K读出组成。 xA=0.4 xB=0.3
S 在回收器内产 物与溶剂分离,溶 剂则可循环使用。
萃取器 F
分离器 R
回收器 P(产物)
2.多级萃取流程
(1)多级错流萃取
料液Leabharlann 萃余液萃余液混合分离器1
萃取液 溶剂 溶剂
混合分离器2
萃取液 溶剂
混合分离器n
萃取液
萃余液
多级错流萃取流程的特点:每级均加新鲜溶 剂,故溶剂消耗量大,得到的萃取液产物平均浓 度较稀,但萃取较完全。
(2)多级逆流萃取
料液
萃余液
萃余液
废液
混合分离器1
产物+溶剂
混合分离器2
混合分离器n
溶剂
多级逆流萃取流程的特点:料液走向和萃 取剂走向相反,只在最后一级中加入萃取剂, 萃取剂消耗少,萃取液产物平均浓度高,产物 收率较高。工业上多采用多级逆流萃取流程。
四、萃取在工业生产中的应用
在石油化工中的应用 在生物化工中和精细化工中的应用
喷洒萃取塔 1—重相;2—轻相
填料萃取塔
塔内装有适宜的填料, 轻相由底部进入,顶部排出, 重相由顶部进入,底 部排出。 优点:结构简单,操作方便 缺点:传质效率低,不适合 处理有固体悬浮物的 场合。
填料萃取塔
筛板萃取塔 两相依靠密度差,在重力的作用下,进行分散 和逆流流动,若以轻相为分散相,则其通过塔板上 的筛孔而被分散成细小的液滴,与塔板上的连续相 充分接触进行传质。穿过连续相的轻相液滴逐渐凝 聚,并聚集于上层筛板的下侧,待两相分层后,轻 相借助压力差的推动,再经筛孔分散,液滴表面得 到更新,直至塔顶分层后排出。而连续相则横向流 过塔板,在筛板上与分散相液滴接触传质后,有浆 液管流至下一层塔板。
E MR R ME
萃取操作示意图.swf
2.原理: 萃取是向液体混合物中加入适当溶剂利用 组分溶解度的差异使溶质A由原溶液转移到萃
取剂S中的过程。
萃取相-含萃取剂S多的一相,以E表示; 萃余项-含稀释剂B多的一相,以R表示。
二、萃取设备 (一)混合—澄清器 组成:混合器、澄清器
混合器中装有搅拌装置,使其中一相破碎成 液滴而分散于另一相中,以加大相际接触面积 并调高传质速率。两相在混合器内停留一定时 间后,流入澄清器。在澄清器中,轻、重两相 依靠密度差分离成萃取相和萃余相。 优点:处理量大,传质效率高;流量范围大; 结构简单,适用性强。 缺点:水平排列的设备占地面积大,萃取剂存 留量大,设备费和操作费都较高。
转盘塔
萃取操作时,转盘随 中心轴高速旋转,其在液 体中产生的剪应力将分散 相破碎成许多细小的液滴 ,在液相中产生强烈的涡 旋运动,从而增大了相际 接触面积和传质系数。
转盘萃取塔
结构简单,生产能力大,传质效率高,操作弹性大。
(三) 离心萃取器
操作时两相在压强作用下分别通过带机械密 封装置的套管式空心转轴的一端进入,轻相由外 圈引入,重相由中心引入,在离心力作用下,轻 相由外圈向中部流,重相由中心向外流,两相形 成逆向流动。最终,重相由螺旋最外层流出,轻 相从中部流出。
①当B、S完全不互溶时, 点C与D分别与三角形的 顶点B及S重合; ②两相区的混合液分为两 个液相共轭相,因此萃取 操作只能在两项区内进行。 ③一定温度下,同一物质 的联接线倾斜方向时一致 的,但各联接线互不平行。
溶解度曲线和联接线
(2)辅助曲线和临界混溶点(褶点) ①利用辅助线可方便的 从已知某相 R (或 E )的 组成确定与之平衡的另 一相 R (或 E )的组成; ② 辅助线与溶解度曲线 的交点P,表明通过改点 的联接线为无限短 ,相 当于这一系统的临界状 态。P点为临界混合点。
优点:结构紧凑,物料停留时间段,处理能力大 缺点:构造复杂、制造困难、造价维修费用高,能耗大。
三、萃取流程
单级萃取 萃取 多级萃取 多级逆流萃取 多级错流萃取
1.单级萃取流程
使用一个混合器和一个分离器的萃取操作: 料液F与萃取溶剂S一起加入混合器内搅拌混合 萃取,达到平衡后的溶液送到分离器内分离得到 萃取相L和萃余相R,萃取相送到回收器,萃余相R 为废液。
(二) 萃取塔
喷洒塔 以重液为连续相,分两 路由塔顶进入,向下流以轻 液液滴接触,至塔底后与轻 液分离后流出;轻液通过塔 底的喷洒器分散为液滴后进 入连续相,在连续相内浮升 与重液接触进行传质,直至 到达塔顶,并聚成轻液层后 流出。
优点:结构简单、投资少,易于维护 缺点:两相的接触面积和传质系数都不大,传质效率低
学习情境5 富集回收煤油中的苯甲酸
任务一 设备识别,萃取流程巡检 任务二 萃取操作知识准备 任务三 萃取操作及事故处理 任务四 萃取塔的日常维护和检修
任务一 设备识别,萃取流程巡检 一、萃取
1.概念:利用原料液中各组分在适当溶剂中溶解度 的差异而实现混合液中各组分分离的过程称为液- 液萃取又称溶剂萃取。 溶质-易溶组分以A表示; 稀释剂或原溶剂-部分溶解或完全不溶解即: 难溶组分以B表示; 萃取剂-所采用的溶剂,以S表示。
xS=0.3
2.相平衡关系在三角形相图中的表示方法 Ⅰ类物系: (1)溶质A完全溶于稀释剂B及萃取剂S中,但 B与S不互溶; (2)溶质A可完全溶解于稀释剂B及萃取剂S中, 但B与S为一对部分互溶组分; Ⅱ类物系: (1)组分A、B可完全互溶,但B、S及A、S为 两对部分互溶组分。
(1)溶解度曲线和联接线
