鼠神经生长因子生物学活性测定法
大鼠神经生长因子(NGF)说明书(1)
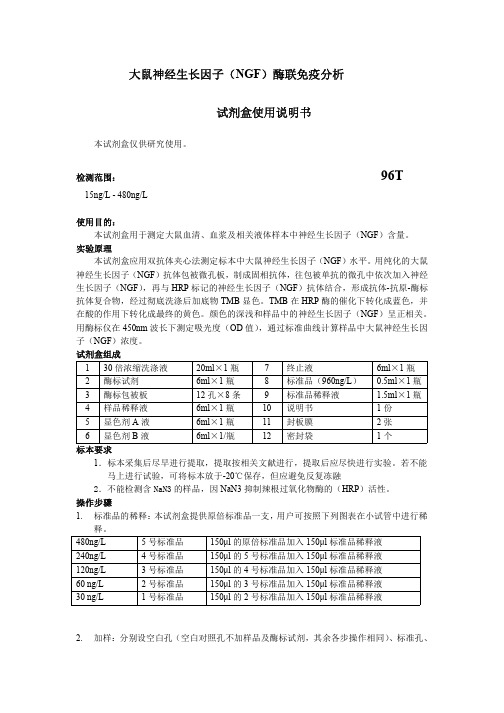
释。
480ng/L
5 号标准品
150µl 的原倍标准品加入 150µl 标准品稀释液
240ng/L
4 号标准品
150µl 的 5 号标准品加入 150µl 标准品稀释液
120ng/L
3 号标准品
150µl 的 4 号标准品加入 150µl 标准品稀释液
60 ng/L
2 号标准品
150µl 的 3 号标准品加入 150µl 标准品稀释液
11 封板膜
2张
6 显色剂 B 液
6ml×1/瓶
12 密封袋
1个
标本要求
1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。若不能
马上进行试验,可将标本放于-20℃保存,但应避免反复冻融
2.不能检测含 NaN3 的样品,因 NaN3 抑制辣根过氧化物酶的(HRP)活性。
操作步骤
1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀
生长因子(NGF),再与 HRP 标记的神经生长因子(NGF)抗体结合,形成抗体-抗原-酶标 抗体复合物,经过彻底洗涤后加底物 TMB 显色。TMB 在 HRP 酶的催化下转化成蓝色,并 在酸的作用下转化成最终的黄色。颜色的深浅和样品中的神经生长因子(NGF)呈正相 值),通过标准曲线计算样品中大鼠神经生长因
30 ng/L
1 号标准品
150µl 的 2 号标准品加入 150µl 标准品稀释液
2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、
待测样品孔。在酶标包被板上标准品准确加样 50µl,待测样品孔中先加样品稀释液 40µl, 然后再加待测样品 10µl(样品最终稀释度为 5 倍)。加样将样品加于酶标板孔底部,尽 量不触及孔壁,轻轻晃动混匀。 3. 温育:用封板膜封板后置 37℃温育 30 分钟。 4. 配液:将 30 倍浓缩洗涤液用蒸馏水 30 倍稀释后备用 5. 洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置 30 秒后弃去,如此 重复 5 次,拍干。 6. 加酶:每孔加入酶标试剂 50µl,空白孔除外。 7. 温育:操作同 3。 8. 洗涤:操作同 5。 9. 显色:每孔先加入显色剂 A50µl,再加入显色剂 B50µl,轻轻震荡混匀,37℃避光显色 10 分钟. 10. 终止:每孔加终止液 50µl,终止反应(此时蓝色立转黄色)。 11. 测定:以空白空调零,450nm 波长依序测量各孔的吸光度(OD 值)。 测定应在加终止 液后 15 分钟以内进行。 操作程序总结:
10 鼠神经生长因子

注射用鼠神经生长因子Zhusheyong Shu Shenjing ShengzhangyinziMouse Nerve Growth Factor for Injection本品系由健康小鼠颌下腺提取的生物活性蛋白质。
经分离、纯化后加入适宜稳定剂后冻干制成,不含防腐剂。
1 基本要求生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2 制造2.1 小鼠颌下腺来源及采集2.1.1 采用体重为20克以上60-90日龄健康雄性小鼠,小鼠应符合清洁级动物相关要求(附录XXX)。
2.1.2 采用适宜方法处死小鼠,经局部消毒处理后摘取颌下腺,剔除其他组织后备用。
如需存放应冻存于-20℃以下,并规定保存时间。
2.2 原液2.2.1 提取采用适宜的方法将小鼠颌下腺破碎匀浆,离心取上清。
2.2.2 纯化采用经批准的方法进行纯化、病毒去除或灭活后即为鼠神经生长因子原液。
2.2.3 原液检定按3.1项进行。
2.3 半成品2.3.1 配制按成品规格配制,并加入适宜稳定剂。
2.3.2 半成品检定按3.2项进行。
2.4 成品2.4.1 分批应符合“生物制品分批规程”规定。
2.4.2 分装及冻干应符合“生物制品分装和冻干规程”及附录I A有关规定。
2.4.3 规格应为经批准的规格。
30μg(≥15000AU) /支18μg(≥9000AU) /支20μg(≥9000AU)/支2.4.4 包装应符合“生物制品包装规程“及附录I A有关规定。
2.5 病毒去除和灭活生产过程中应采用经批准的方法去除和灭活病毒。
如用灭活剂(如有机溶剂、去污剂)灭活病毒,则应规定对人安全的灭活剂残留量限值。
3 检定3.1 原液检定3.1.1 生物学活性依法测定(附录Ⅹxx)。
3.1.2 蛋白质含量依法测定(附录ⅥB第二法),应不低于0.1mg/ml。
3.1.3 比活性为生物学活性与蛋白质含量之比。
每1mg蛋白质应不低于5.0×105AU。
鼠神经生长因子原理

鼠神经生长因子原理鼠神经生长因子(NGF,Nerve Growth Factor)是一种神经营养因子,被认为对神经系统发育和维持有重要作用。
它最早是由利昂尼·阿维奇纳(Levi-Montalcini)和斯坦利·科恩(Cohen)在1952年共同发现,并获得了1986年的诺贝尔生理学或医学奖。
鼠神经生长因子的研究奠定了神经发育生物学的基础,也为后续的研究提供了重要的理论依据。
它的发现和研究对于理解神经系统的发育、再生以及一些与神经系统相关的疾病的治疗具有重要意义。
NGF的研究首先从一个观察开始。
利昂尼·阿维奇纳和斯坦利·科恩发现当离体培养的鼠胚胎神经节细胞被种在培养基中时,细胞会发生异常的增殖和分化。
他们提取了这种细胞培养基,并命名为鼠神经母细胞浸润素(nerve-mother-cell-制液,即鼠神经生长因子)。
这个发现在当时被认为是革命性的,因为在之前的研究中,人们认为神经元的发育是无需外界因素的。
进一步的研究揭示了鼠神经生长因子通过结合特异性受体在神经系统中发挥作用。
这个受体被称为酪氨酸激酶类型A(tyrosinekinase A receptor,TrkA)。
通过与TrkA受体结合,NGF可以触发一系列的细胞信号传递,促进神经元的生长和分化。
这说明了NGF在神经系统中的重要作用。
接下来的研究逐渐揭示了鼠神经生长因子的更多作用和机制。
研究人员发现NGF还可以促进神经元突起的生长和分支,促进突触形成和稳定,并调控神经元的存活和死亡。
它也被证明在神经损伤和神经退行性疾病的治疗中具有潜力。
事实上,一些研究已经尝试使用NGF 的外源性补充来治疗神经退行性疾病如阿尔茨海默病等,取得了一定的进展。
此外,NGF不仅对神经元有影响,它还和其他细胞类型相互作用,如胶质细胞、免疫细胞等。
它在神经系统免疫调节、炎症反应和伤口愈合中也起到重要的作用。
总之,鼠神经生长因子的研究为我们揭示了神经系统发育和维持的重要机制。
9生长激素生物活性的测定方法中国药品检验标准操作规范

生长激素生物活性的测定方法一、去垂体大白鼠体重法1 实验材料及用具1.1 天平精度0.01mg 供试品称量用精度1mg 试剂称量用精度0.1g 大鼠称重用1.2 实验用具手术板、注射器(1ml,精度0.01ml)、吸管、移液管、带塞玻璃小瓶、烧杯、玻璃棒、量筒、脱脂棉。
1.3 手术器械手术剪、直镊、眼科剪、眼科直镊、眼科弯剪、牙科钻、钻头、抽滤瓶、真空泵、牙科刮勺、止血钳。
1.4 试剂氯化钠、牛血清白蛋白、乌拉坦。
2 溶液配制2.1 生理盐水称取氯化钠适量,加水配成0.9%的溶液。
2.2 牛血清白蛋白的生理盐水溶液,称取牛血清白蛋白适量,加生理盐水配成0.1%的牛血清白蛋白的生理盐水溶液,简称溶媒。
2.3 乌拉坦溶液称取乌拉坦适量,加生理盐水配成25%的乌拉坦溶液。
2.4 标准品溶液2.4.1 实验当日,取生长激素标准品,放置至室温。
2.4.2 割开安瓶(注意勿使内容物损失)立即按标示效价精确加以定量溶媒将全部内容物洗出,使成1.0IU/ml的标准品溶液;亦可精密加入适量溶媒使溶解,混合均匀,精密吸取适量,用溶媒配制成1.0IU/ml的标准品溶液。
2.5 标准品稀释液2.5.1 按《中国药典》附录生长激素生物检定法的要求,选择标准品高(d S2)、低(d S1)2组剂量及剂距。
2.5.2 计算2组剂量稀释液浓度及大鼠6天内皮下注射的总毫升数,一般高浓度稀释液可配成每1ml中含0.10~0.25IU(随季节、动物品系和来源不同),低浓度稀释液可配成每1ml中含0.025~0.06IU,高、低两浓度比值r=1:0.25,每鼠皮下注射每天0.5ml/次,连续6天,每组至少8只,例如:高浓度稀释液d S2=0.1IU/ml×0.5ml/(天.鼠)×6天×8鼠/组=2.4IU/组,即0.1IU/ml高浓度稀释液24ml低浓度稀释液d S1=0.025IU/ml×0.5ml/(天.鼠)×6天×8鼠/组=0.6IU/组,即0.025IU/ml低浓度稀释液24ml2.5.3 精密量取1.0IU/ml标准品溶液适量,置50ml烧杯中,加入溶媒适量成标准品d S2稀释液(如0.1IU/ml)。
鼠神经生长因子生物学活性测定法

附录Ⅹxx 鼠神经生长因子生物学活性测定法 第一法 鸡胚背根神经节培养法 试剂 (1)鼠尾胶 大鼠鼠尾用 75%酒精消毒后,分离出尾腱,剪碎,浸泡于 0.1%
100U(每步稀释不超过 10 倍)。在 96 孔细胞培养板中,做 3 倍系列稀释,共 8 个稀释度,每 个稀释度做 2 孔,每孔分别留 100μl 标准品溶液,弃去孔中多余溶液。以上操作在无菌条件 下进行。 测定法 TF-1 细胞株用完全培养液于 37℃、 5%二氧化碳条件下培养, 控制细胞浓度为 每 1ml 含 1.0× 105~5.0× 105 个细胞,传代后 24 小时用于生物学活性测定。将试验所用溶液预 温至 37℃。取足量 TF-1 细胞培养物,离心收集 TF-1 细胞,用基础培养液洗涤 3 次,然后 重悬于基础培养液配成每 1ml 含 6.0× 104 个细胞的细胞悬液,置于 37℃、5%二氧化碳条件 下备用。在加有标准品溶液和供试品溶液的 96 孔细胞培养板中每孔加入细胞悬液 100μl, 于 37℃、5%二氧化碳条件下培养 66~72 小时。每孔加入 MTS 溶液 20μl,于 37℃、5%二 氧化碳条件下培养 3 小时。以上操作在无菌条件下进行。放入酶标仪,以 550nm 为参比波 长,在波长 490nm 处测定吸光度,记录测定结果。 试验数据采用计算机程序或四参数回归计算法进行处理,并按下式计算结果: 供试品生物学活性(U/ml)=Pr×
Ds Es Dr Er
式中 Pr 为标准品生物学活性,U/ml; Ds 为供试品预稀释倍数; Dr 为标准品预稀释倍数; Es 为供试品相当于标准品半效量的稀释倍数; Er 为标准品半效量的稀释倍数。
《中国药典》2015年版生物制品质控要点

通用性技术要求—凡例General notices
(十章31条修订为十章34条)
章节
内容
2015版增修订
总 则:
6项(1-6),药典结构、内容、使用 标准体系中明确生物制品通则(原通则)和通则(原附录),并在生物制品通
原则的一般说明
则与各论之间增加总论的相关描述
正文(各论)
2项(7-8),各论内容、体例框架
生物制品生产检定用动物细胞基质制备及检定规程修订一对生产用细胞基质总的要求一细胞系株历史资料二细胞培养操作要求三细胞库四细胞检定五生产细胞培养二连续传代细胞系的特殊要求verochons0细胞等三人二倍体细胞株的特殊要求mrc52bskmb17等五原代细胞的要求一动物组织来源和其他材料二原代细胞培养物的检查phk六检定用细胞的要求一细胞资料二细胞检定附录1逆转录酶活性检查法附录2成瘤性检查法附录3致瘤性检查法17一供血浆者的选择一供血浆者体格检查二供血浆者血液检验三有下列情况者不能供血浆四有下列情况者暂不供血浆五供血浆者接受免疫接种后采集血浆的规定二血浆的采集一单采血浆站要求二采集血浆器材的要求三采集血浆的频度及限量三血浆检验一单人份血浆二合并血浆六特异性免疫血浆制备及其供血浆者免疫要求一血浆二供血浆者三供血浆者免疫18生物物免疫血浆 人血浆
未修订:
生物制品分批规程 生物制品包装规程
生物制品通则: 生物制品分批规程--无修订
1. 批号审定的组织管理
2. 批号(批、亚批)确定的原则:同一批号的制 品,应来源一致、质量均一,按规定要求抽样检验 后,能对整批制品作出评定。
3. 生物制品批号和亚批号编制的具体规则;
9203 药品微生物实验室质量管理指导原则
8005 指示剂与指示液
大鼠(Rat)神经生长因子(NGF)-NEWA

本试剂盒只能用于科学研究,不得用于医学诊断大鼠大鼠((Rat Rat))神经生长因子(神经生长因子(NGF NGF NGF))ELISA 检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被神经生长因子(NGF)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的神经生长因子(NGF)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),计算样品浓度。
样品收集、处理及保存方法1.血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
严格按照说明书中标明的时间、加液量及顺序进行温育操作。
4.所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL3mL无检测抗体-HRP10mL5mL无20×洗涤缓冲液25mL15mL按说明书进行稀释底物A6mL3mL无底物B6mL3mL无终止液6mL3mL无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、25、50、100、200、400pg/mL试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
大鼠神经营养因子3(NT3)说明书

大鼠神经营养因子3(NT3)说明书大鼠神经营养因子3(NT3)说明书一、产品简介大鼠神经营养因子3(NT3)是一种神经元特异性生长因子,具有促进神经细胞生长和发育的作用。
本说明书旨在提供有关大鼠神经营养因子3的详细信息,包括产品性质、适用范围、使用方法、储存条件和注意事项等。
二、产品性质1. 化学性质:大鼠神经营养因子3是一种多肽生物活性物质,由176个氨基酸残基组成。
2. 分子量:约为19.7kDa。
3. 纯度:大鼠神经营养因子3经过高效液相层析纯化,纯度高于95%。
4. 活性:经过酶活性测定,大鼠神经营养因子3活性为XXX U/mg (以某一标准试剂为参照)。
三、适用范围大鼠神经营养因子3可广泛应用于神经科学研究、组织工程学以及药物研发等领域。
主要功能包括但不限于:1. 促进神经元的生长和发育。
2. 改善神经元连接和突触传递效率。
3. 减轻神经退行性疾病患者的症状,并促进其神经再生。
四、使用方法1. 取适量的大鼠神经营养因子3溶液,按照具体实验要求进行稀释。
2. 使用前应先充分溶解,建议使用生理盐水、细胞培养基等缓冲液稀释。
3. 尽量避免反复冻融,以保持产品的活性。
五、储存条件1. 大鼠神经营养因子3应存放在-20℃以下避光、干燥的环境中。
2. 如需长期保存,建议将产品分装后置于-80℃的超低温冰箱中。
3. 避免反复冻融,每次使用后应立即回冻。
六、注意事项1. 本产品仅供科学研究使用,不用于临床诊断和治疗。
2. 使用本产品前请详细阅读相关文献,并参考相关实验方法及操作说明。
3. 避免将产品接触人体皮肤、摄入或吸入,如不慎接触,请立即用大量清水冲洗,并求医咨询。
4. 本产品为实验室专用品,严禁用于其他非法目的。
以上为大鼠神经营养因子3(NT3)的说明书内容,如有其他问题,请咨询相关生产商或供应商。
谢谢使用!。
鼠神经生长因子

适应症, 正己烷中毒性周围神经病。
用法用量
本品用2ml注射用水溶解,肌肉注射。一天1次,每次1支,4周为一疗程,根据病情轻重可遵医嘱多疗程连续给药。
不良反应
1.无严重不良反应。临床试验中未发现有肝、肾、心脏等功能损害。 2.用药后常见注射部位痛或注射侧下肢疼痛(发生率分别为85%和29%),一般不需处理。 个别症状较重者,口服镇痛剂即可缓解。 3.偶见其它症状(如头晕、失眠等),发生率与安慰剂组比较无明显差别。
儿童用药, 因目前尚没有儿童应用本品的资料,故儿童用药请遵医嘱。
性状
本品为白色冻干疏松体。按瓶标示量溶解后溶液为无色澄明液体,不应有异物,混浊和沉淀。
药理毒理
药理作用: 大鼠体内试验结果表明:本品可改善由己二酮和丙烯胺造成的大鼠中毒性周围神经病所致的肢体运动功能障碍,缩短神经-肌肉动作电位潜伏期,并提高神经-肌肉动作电位幅度。组织病理学检查结果表明,本品有减轻动物胫神经的髓鞘肿胀发生率和降低变性胫神经纤维数量等作用。以上结果提示本品可能有促进损伤神经恢复的作用。 毒理研究: 重复给药的毒性试验结果表明:1)Wistar大鼠肌注本品剂量分别为30μg/kg、60μg/kg和120μg/kg,连续给药12周,仅见120μg/kg剂量组的动物在给药28天后出现食欲减低,体重增长延缓,活动减少等。2)杂种犬肌注本品高剂量为17.8μg/kg,连续给药60天后,动物未见明显毒性反应。 上海种小鼠的一般生殖毒性、致畸敏感期和围产期毒性试验结果表明:剂量在高达200μg/kg时,对动物的生育力、胚胎器官形成及时F1代仔鼠的发育无明显的影响。
禁忌症, 对本品过敏者禁用。
注意事项
1.过敏体质者慎用。 2.本品加注射用水振荡后即可完全溶解,如有不溶的沉淀、混浊或絮状物时不可使用。 3.使用前应仔细检查药瓶,如有裂缝或破损等异常情况时不可使用。 4.用药过程中,如有任何不适症状及时与医生联系询问。
鼠神经生长因子临床应用研究

鼠神经生长因子临床应用研究神经损伤是临床上常见的一类疾病,包括外周神经损伤和中枢神经损伤等,给患者的生活质量带来了严重影响。
鼠神经生长因子(mouse nerve growth factor,mNGF)作为一种具有促进神经修复和再生作用的生物活性物质,在神经损伤的治疗中逐渐受到关注和应用。
本文将对鼠神经生长因子的临床应用进行详细探讨。
一、鼠神经生长因子的概述鼠神经生长因子是从小鼠颌下腺中提取的一种生物活性蛋白,其结构和功能与人体内的神经生长因子相似。
它能够特异性地与神经细胞表面的受体结合,激活细胞内的信号通路,从而发挥促进神经细胞存活、生长、分化和轴突再生等作用。
二、鼠神经生长因子的作用机制1、促进神经细胞存活在神经损伤后,神经细胞往往会受到缺血、缺氧、氧化应激等因素的影响,导致细胞凋亡。
鼠神经生长因子可以通过抑制凋亡信号通路,增强细胞的抗凋亡能力,从而提高神经细胞的存活率。
2、诱导神经细胞分化对于未成熟的神经前体细胞,鼠神经生长因子能够促进其向神经元或神经胶质细胞分化,增加神经细胞的数量和种类,为神经修复提供细胞基础。
3、促进轴突再生轴突是神经细胞传递信号的重要结构,在神经损伤后轴突的再生对于神经功能的恢复至关重要。
鼠神经生长因子可以刺激轴突的生长和延伸,引导轴突向正确的方向生长,并促进轴突与靶细胞建立有效的连接。
4、调节神经递质的释放神经递质在神经信号传递中起着关键作用。
鼠神经生长因子能够调节神经细胞内神经递质的合成、储存和释放,改善神经细胞之间的信息传递,从而促进神经功能的恢复。
三、鼠神经生长因子在临床中的应用1、外周神经损伤外周神经损伤常见于外伤、压迫、炎症等情况,如臂丛神经损伤、坐骨神经损伤、面神经麻痹等。
临床研究表明,在外周神经损伤后早期应用鼠神经生长因子可以促进神经再生和功能恢复,缩短恢复时间,提高恢复效果。
患者的感觉、运动功能以及神经电生理指标均有明显改善。
2、中枢神经损伤中枢神经损伤如脑梗死、脑出血、脑外伤、脊髓损伤等,往往会导致严重的神经功能障碍。
利用SEC-HPLC测定鼠神经生长因子的纯度

利用SEC-HPLC测定鼠神经生长因子的纯度张金龙;任军;付玲;宋晓红;陈俭勤;吕鹏;侯利华【期刊名称】《生物技术通讯》【年(卷),期】2013(000)005【摘要】目的::建立检测鼠神经生长因子(mNGF)纯度的分子排阻高效液相色谱法(SEC-HPLC)。
方法:利用TSK G3000 SWXL分析柱和Waters2695/2487高效液相色谱系统检测mNGF标准品纯度,并对方法的专属性、线性、重复性、中间精密度、检测限及耐用性等指标进行评估。
结果:空白溶剂在mNGF积分范围内无特异峰出现;样品浓度与吸收峰之间线性回归系数R2=0.9998;6次进样峰面积相对标准偏差(RSD)为1.18%;中间精密度分析RSD为0.45%;检测限为0.2μg;耐用性实验表明磷酸盐浓度在0.2~0.3 mol/L之间变动对检测结果无影响。
结论:各项指标符合规定,SEC-HPLC法可用于检测mNGF的纯度。
%Objective: To develop an assay for determining the purity of mouse nerve growth factor(mNGF) by SEC-HPLC. Methods: A SEC-HPLC method was used to determine the purity of the mNGF with TSK G3000 SWXL column and HPLC system(Waters 2695/2487). The validation for this assay was performed, including speci-ficity, linearity, repeatability, intermediate precision, limit of detection (LOD) and robustness. Results: The SEC-HPLC assay was established to determine the purity of mNGF. In this assay, the linear regression coefficient (R2) between concentration and absorption peak area was 0.9998 and the LOD of the method was 0.2 μg.Conclu-sion: The SEC-HPLC assay could be applied to determine the purity of mNGF.【总页数】4页(P691-694)【作者】张金龙;任军;付玲;宋晓红;陈俭勤;吕鹏;侯利华【作者单位】军事医学科学院生物工程研究所,北京,100071;军事医学科学院生物工程研究所,北京,100071;军事医学科学院生物工程研究所,北京,100071;军事医学科学院生物工程研究所,北京,100071;军事医学科学院生物工程研究所,北京,100071;军事医学科学院生物工程研究所,北京,100071;军事医学科学院生物工程研究所,北京,100071【正文语种】中文【中图分类】Q503【相关文献】1.鼠神经生长因子生物学活性测定方法的研究 [J], 赵淑媛;曾娟梅;扈会平2.配位返滴定法测定高纯度九水硝酸铁纯度 [J], 谢玉艳3.利用SEC-HPLC法测定重组人透明质酸酶的纯度 [J], 吕鹏;张金龙;宋小红;侯利华;陈薇4.SEC-HPLC 法测定重组人生长激素注射液中苯酚含量 [J], 陆春燕;李增礼;王荣海;宋礼华5.杂交油菜苗期纯度鉴定与大田种植纯度吻合率测定试验 [J], 史广富因版权原因,仅展示原文概要,查看原文内容请购买。
小鼠颌下腺神经生长因子的提取及活性鉴定的初步研究

小鼠颌下腺神经生长因子的提取及活性鉴定的初步研究
熊仁平;周元国
【期刊名称】《中国生化药物杂志》
【年(卷),期】1996(017)003
【摘要】对神经生长因子(Nerve Growth Factor,NGF)提取纯化、活性鉴定进行了研究。
将小鼠颌下腺组织匀浆、离心,取其上清,在不同pH和离子强度,依次通过两个离子交换纤维素层析柱,制得 2.5 S NGF纯品。
其分子量约43.5 kD,3种主要组分的等电点分别为8.85、9.10和9.20。
用鸡胚背根培养法证明其具有刺激神经生长的作用。
【总页数】3页(P111-113)
【作者】熊仁平;周元国
【作者单位】不详;不详
【正文语种】中文
【中图分类】R392-33
【相关文献】
1.小鼠Toll样受体9基因的克隆、表达及其活性的初步鉴定 [J], 彭丽娜;邱亚峰;繆剑华;李向东;王晓杜;袁经权;王寿昆;李力;马志永
2.db/db糖尿病小鼠颌下腺内皮细胞生长因子和神经生长因子表达的研究 [J], 杜金凯;王春艳;葛志华
3.胎脑中神经生长因子(NGF)的提取及生物活性鉴定的研究 [J], 张秋玲;王新成
4.小鼠颌下腺神经生长因子的制备和活性鉴定 [J], 王国华;杨浩
5.小鼠颌下腺2.5S神经生长因子生物活性评估标准的建立 [J], 刘少平;杨国成;孟祥平;夏腊菊;朱汉民
因版权原因,仅展示原文概要,查看原文内容请购买。
酶联免疫吸附法定量检测生物样品中的鼠神经生长因子

酶联免疫吸附法定量检测生物样品中的鼠神经生长因子王婉灵;邹佳;陈方;王清清;方云祥【期刊名称】《中南药学》【年(卷),期】2008(6)4【摘要】目的验证酶联免疫吸附(EUSA)法定量测定生物样品中的鼠神经生长因子(mNGF)。
方法利用双抗体夹心原理,建立mNGF测定方法学,考察方法学特异性、灵敏度、线性范围、精密度与准确度;并用此法研究比格犬肌注mNGF 后的药物动力学。
结果方法特异性良好,线性范围31.2~2000Pg·mL^-1,可靠定量下限(LLOQ)为31.2pg·mL^-1批内及批间精密度均〈16%,准确度为-9.3%~12.1%。
结论ELISA法灵敏度高、通量大、重复性、准确度及精密度好。
适用于生物样品中mNGF的定量检测。
【总页数】3页(P419-421)【关键词】鼠神经生长因子;定量;酶联免疫吸附法;药物动力学【作者】王婉灵;邹佳;陈方;王清清;方云祥【作者单位】中南大学药学院;军事医学科学院放射医学研究所生物技术药物代谢实验室【正文语种】中文【中图分类】R969.1;R917【相关文献】1.荧光定量PCR法与酶联免疫吸附法在乙型肝炎病毒检测中的应用价值体会 [J], 杨凤琴;王耀荣;吕如2.荧光定量PCR法与酶联免疫吸附法在乙型肝炎病毒检测及疗效评价中的应用价值探究 [J], 陈春妍3.荧光定量PCR法与酶联免疫吸附法在乙型肝炎病毒检测中的应用观察分析 [J], 徐诗卓4.荧光定量聚合酶链式反应法与酶联免疫吸附试验法在乙型肝炎病毒检测中的应用价值 [J], 谢玉娜5.检测牛乳样品生物素酶联免疫吸附法特异性高于间接酶联免疫吸附法 [J],因版权原因,仅展示原文概要,查看原文内容请购买。
冻干鼠2.5 S神经生长因子的稳定性考察

冻干鼠2.5 S神经生长因子的稳定性考察
周文丽;姚新芝;刘保山
【期刊名称】《中国生化药物杂志》
【年(卷),期】2000(021)006
【摘要】目的:研究冻干鼠2.5 S神经生长因子的稳定性.方法:于4℃和室温下留样观察,在1、3、6、12、18、24月取样检测活性、外观、溶解性、水分等,并与0月检测的相应指标比较.结果:在4℃时放置24月,各项质量指标无明显改变.结论:冻干鼠2.5 S神经生长因子有效期暂定为两年.
【总页数】2页(P299-300)
【作者】周文丽;姚新芝;刘保山
【作者单位】463000,驻马店,济南军区生物制品药物研究所;驻马店地区卫生学校;463000,驻马店,济南军区生物制品药物研究所
【正文语种】中文
【中图分类】R392-33
【相关文献】
1.马蔺子素冻干注射剂的制备及其稳定性考察 [J], 张学农;阎雪莹;唐丽华;张强
2.冻干小鼠神经生长因子的研制 [J], 颜真;王俊楼;王慧;韩苇;李波;赵宁;张英起
3.C·肉毒杀鼠素(冻干剂)应用研究 [J], 张晶仁;谷春广;王武芳;李华宇;周波;周庆文;张金生;胡文祥
4.注射用益气复脉(冻干)与果糖注射液的配伍稳定性考察 [J], 吕芳;叶正良;李德坤;刘君动;杨悦武;周大铮
5.鬼臼毒素冻干脂质体的制备及其稳定性考察 [J], 张晓云;倪京满;高菊萍;史彦斌;孟庆刚
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
样品终点稀释倍数 工作参考品终点稀释倍数
(5)TF-1 细胞 TF-1 细胞株用完全培养基于 37℃、5%二氧化碳培养箱中培养,控制细 胞浓度为每 1ml 含 1.0×105~5.0×105 个细胞,传代后 24 小时用于 NGF 生物学活性测定。 标准品溶液的制备 取鼠神经生长因子生物学活性测定的国家标准品, 按说明书复溶后, 用基础培养液稀释至每 1ml 含 100U(每步稀释不超过 10 倍)。在 96 孔细胞培养板中,做 3 倍系列稀释,共 8 个稀释度,每个稀释度做 2 孔,每孔分别留 100μl 标准品溶液,弃去孔中 多余溶液。以上操作在无菌条件下进行。 供试品溶液的制备 将供试品按标示量复溶后,用基础培养液稀释至每 1ml 约含
附录Ⅹxx 鼠神经生长因子生物学活性测定法 第一法 鸡胚背根神经节培养法 试剂 (1)鼠尾胶 大鼠鼠尾用 75%酒精消毒后,分离出尾腱,剪碎,浸泡于 0.1%
冰醋酸溶液中溶解 48 小时,4℃、4000 转/分钟离心 30 分钟,取上清液,经 121℃、15 分 钟灭菌,-20℃保存。 (2) DMEM 培养液 取市售 DMEM 培养液, 加入终浓度为 100Iu/m1 青霉素、 100Iu/m1 链霉素和 2mmol/L L-谷氨酰胺,混匀。 (3)基础培养液 量取胎牛血清(FBS)10ml,加 DMEM 培养液 90ml,4℃保存。 标准品溶液和供试品溶液的制备 取注射用鼠神经生长因子生物学活性测定的国家标 准品,用 DMEM 培养液做 3 倍系列稀释,共 5~6 个稀释度。取已过滤除菌的供试品做相同 稀释。 测定法 取 7~9 天的鸡胚,无菌条件下取出背根神经节,分置于涂有鼠尾胶的培养瓶 中,贴壁 1~2 小时后,加入不同稀释度的标准品溶液和供试品溶液,并设阴性对照瓶,于 37℃、含 5%CO2、饱和湿度的培养箱中培养 24 小时,用倒置显微镜观察神经节轴突生长情 况,以引起++++生长的最高稀释度为判定终点,用下式计算样品的生物学活性单位。 样品的活性单位(AU/ml)=工作参考品活性× 【附注】神经节轴突生长判定标准 “#” 神经节生长过量抑制; “++++”:神经节突起长满四周,又长又密,呈树杈状; “+++”:神经节突起长满 2/3 周,呈树杈状; “++”:神经节突起长满 1/2 周; “+”:神经节突起只有几根; “-”:无突起生长。 第二法 TF-1 细胞/MTS 比色法 本法系依据人红细胞白血病细胞 (简称 TF-1 细胞) 的生长状况因鼠神经生长因子 (NGF) 生物学活性的不同而不同,以此检测 NGF 的生物学活性。 试剂 (1)RPMI 1640 培养液 取市售 RPMI 1640 培养液,加入终浓度为 100Iu/m1 青霉素和 100Iu/m1 链霉素。 (2) 基础培养液 量取胎牛血清 (FBS) 100ml, 加入 RPMI 1640 培养液 900ml 中。 4℃ 保存。 (3)完全培养液 基础培养液添加鼠神经生长因子至终浓度为每 1ml 含 12U。 (4)MTS 溶液 取市售的 MTS 于 4℃融化,1.2ml/支分装到 EP 管中, ,并避光保存于 -20℃。
100U(每步稀释不超过 10 倍)。在 96 孔细胞培养板中,做 3 倍系列稀释,共 8 个稀释度,每 个稀释度做 2 孔,每孔分别留 100μl 标准品溶液,弃去孔中多余溶液。以上操作在无菌条件 下进行。 测定法 TF-1 细胞株用完全培养液于 37℃、 5%二氧化碳条件下培养, 控制细胞浓度为 每 1ml 含 1.0× 105~5.0× 105 个细胞,传代后 24 小时用于生物学活性测定。将试验所用溶液预 温至 37℃。取足量 TF-1 细胞培养物,离心收集 TF-1 细胞,用基础培养液洗涤 3 次,然后 重悬于基础培养液配成每 1ml 含 6.0× 104 个细胞的细胞悬液,置于 37℃、5%二氧化碳条件 下备用。在加有标准品溶液和供试品溶液的 96 孔细胞培养板中每孔加入细胞悬液 100μl, 于 37℃、5%二氧化碳条件下培养 66~72 小时。每孔加入 MTS 溶液 20μl,于 37℃、5%二 氧化碳条件下培养 3 小时。以上操作在无菌条件下进行。放入酶标仪,以 550nm 为参比波 长,在波长 490nm 处测定吸光度,记录测定结果。 试验数据采用计算机程序或四参数回归计算法进行处理,并按下式计算结果: 供试品生物学活性(U/ml)=Pr×
Ds Es Dr Er
式中 Pr 为标准品生物学活性,U/ml; Ds 为供试品预稀释倍数; Dr 为标准品预稀释倍数; Es 为供试品相当于标准品半效量的稀释倍数; Er 为标准品半效量的稀释倍数。
Hale Waihona Puke
