新版GMP口服固体制剂多品种共线生产风险评估报告
2021《[多品种共线生产质量风险评估报告]共线风险评估》
![2021《[多品种共线生产质量风险评估报告]共线风险评估》](https://img.taocdn.com/s3/m/392a184a51e79b896902262a.png)
《[多品种共线生产质量风险评估报告]共线风险评估》评价人:批准人:日期:xx-4-15日期:xx-4-15多品种共线生产风险评估报告目录1.前言2.风险评估目的3.风险评估范围4.风险评估小组5.评估流程6.风险等级评估方法(fmea)说明7.共线产品信息8.共线的可行性9.支持性文件10.风险评估实施11.风险评估结论1.前言我公司化妆品(一般液态单元、膏霜乳液单元和蜡基单元)生产车间,根据国家化妆品生产质量管理规范及可生产品种特性、工艺流程及相应法规要求,对厂房、生产设施和设备进行了合理设计造型和布局,设计多品种多规格共线生产,依据新版gmp第四十六条(为降低污染和交叉污染的风险,厂房、生产设施和设备应当根据所生产药品的特性、工艺流程及相应洁净度级别要求合理设计、布局和使用,并符合要求)规定,本着对生产安全和有效性进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险意见的控制措施,使生产质量及风险降低到可以接受的水平。
2.风险评估目的2.1.评估厂房、生产设施和设备多产品共用的可行性;2.2.提出降低预防污染与交叉污染措施实施过程中可能发生质量风险的措施;2.3.根据风险评估的结果确定的验证活动范围及深度。
3.风险评估范围本次评估仅限于对配料、乳化、静置、灌装、包装车间多品种多规格共线生产时可能存在的潜在风险的评估,其它与共线生产无关的质量风险不在此次评估范围内。
4.风险评估小组本次质量风险评估项目为“多品种共线生产”,因此选择的成员的资质应对该项目有相适应的科学知识及经验,为此特确定以下人员为本次质量风险评估小组成员:5.1.列出公司在共线生产采取的防止污染与交叉污染、防止混淆与差错的措施;5.2.对各项措施进行风险等级评估:本次进行风险评估所用的方法遵循fmea技术(失效模式与影响分析);5.3.提出预防质量风险发生的措施,以及根据风险评估的结果确定的验证活动范围及深度。
6.风险等级评估方法(fmea)说明进行风险评估所用的方法遵循fmea技术(失效模式与影响分析),它包括以下几点:6.1.风险确认:可能影响产品质量、产量、工艺操作或数据完整性的风险;6.2.风险判定:包括评估先前确认风险的后果,其建立在严重程度、可能性及可检测性上;6.3.严重程度(s):主要针对可能危害产品质量数据完整性的影响。
固体制剂车间多品种共线风险评估报告才

固体制剂车间多品种共线风险评估报告编号:1.概述固体制剂车间G1生产线和G2生产线于2013年10月建成,分别用于中药和西药的生产,其中G1生产线用于丸剂和中药片剂的生产,G2生产线用于胶囊剂和西药片剂的生产,目前只对三个剂型的6个品种进行共线风险评估(增加品种后再进行多品种共线生产的风险评估评估)。
厂房、设施、生产设备根据所生产药品特性、工艺流程及相应洁净度级别要求合理设计;配套了相应的GMP文件软件系统;具备了防止污染与交叉污染的措施。
对生产线的各个关键操作环节进行同步监控。
通过对拟认证的三黄片、氯芬黄敏片、通便灵胶囊、大山楂丸、舒肝健胃丸、麦味地黄丸6个品种的公用设施、设备生产产品的药理、毒理、适应症、处方成分的分析;厂房设施、设备清洁(清洁方法和残留水平)、防止混淆(物料、产品)人为差错(工艺不一同使用的模具、筛网不同等)等项目进行评估,以此确定多品种公用设备的可行性。
1.1 共线产品特性信息1.1.1 G1生产线共线生产品种信息1.2 共线产品的预定用途信息1.2.1 G1生产线共线产品的预定用途信息1.3共线产品工艺步骤信息1.3.1 G1生产线共线产品共用设备信息:★表示产品生产使用设备精选精选1.3.2G2 生产线共线产品工艺步骤信息精选精选精选精选2.风险评估小组及职责2.1风险评估小组2.2职责3.风险评估标准本次质量风险评估使用失败模式影响分析(FMEA)工具,识别潜在的失败模式,对风险的严重程度、发生几率和发现的可能性评分,采用5分制原则进行评估。
3.1失败发生的严重程度(S)3.2失败发生的几率(O)3.3损害发现的可能性(D)3.4风险评价准则:风险优先级( RPN=S×O×D )4.风险评估:识别、分析和评价潜在的风险本项工作计划开始时间 **年**月**日计划完成时间 **年**月**日确定可能的失败模式范围,列出每一个失败模式的潜在结果,对每一个失败模式给出严重性(S)分数。
【风险管理】多品种共线生产风险评估报告-固体
8
铝塑包装机
不锈钢
9
不锈钢
共线生产的全部品种规格均为普通药品,彼此间不存在相互反应或配伍禁忌;
共线车间具备了防止污染和交叉污染的措施,包括有完善的防止差错、防止污染和交叉污染的软件体系;
生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗。
二、风险评估标准
风险系数
分数
水平
定义
严重性
确定
基本确定,每次均会发生。
7
极高
必然的问题,几乎每次都发生。
5
高
反复出现的问题,通常会发生。
3
中
偶尔出现的问题,有时会发生。
1
低
不太可能出现的问题,或很少发生。
检测度
(D)
5
不可能
不可能检测到。
4
极低
问题总是检测不到,没有可行的检测手段,可认为是无法检测到的。
3
低
问题有时能被检测到,但是更倾向于检测不到。
高
不可接受,或需要整改
纯化水
经过验证符合生产要求
低
可接受风险
消毒剂
经过验证符合生产要求
低
可接受风险
丝光毛巾
经过验证符合生产要求
低
可接受风险
清洁用手套
经过验证符合生产要求
低
可接受风险
法
相应管理及操作文件
针对各岗位,已制定了相关岗位操作规程、设备使用操作文件、清洁操作文件、维护保养操作等文件,文件下发前对从事本岗位的人员都进行了培训。
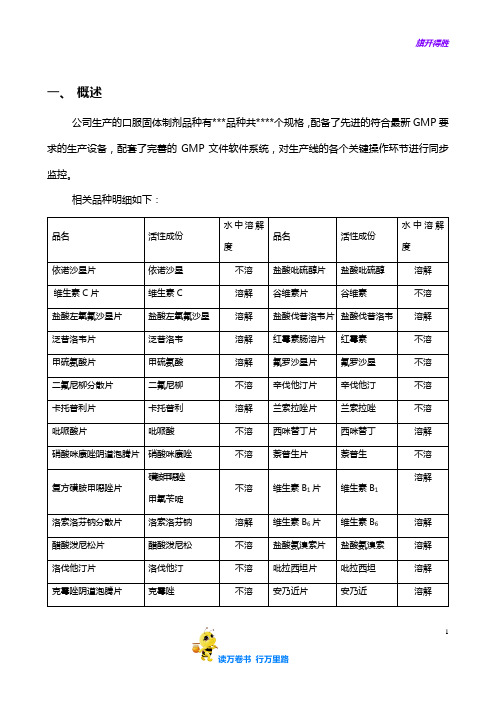
一、概述
公司生产的口服固体制剂品种有***品种共****个规格,配备了先进的符合最新GMP要求的生产设备,配套了完善的GMP文件软件系统,对生产线的各个关键操作环节进行同步监控。
固体制剂车间多品种共线生产风险评估报告

固体制剂车间多品种共线生产风险评估报告编号:FX-SC-2015-002固体制剂车间多品种共线生产风险评估报告起草部门及职务责任人签名起草日期审核部门及职务责任人签名审核日期批准人责任人签名批准日期吉林九鑫制药股份有限公司二零一五年五月固体制剂车间多品种共线生产风险评估报告目录1 概述1.1相关品种明细1.2具体的设备明细2 风险评估标准3 找出评估风险点4 对提出的风险点进行评估4.1原料性质风险评估4.2设备清洁风险评估5 结论1 概述公司生产的口服固体制剂品种有39个品种, 39个批准文号,其中片剂品种2个,胶囊剂品种3个,颗粒剂品种2个,水丸、水蜜丸、浓缩丸剂品种5个,大蜜丸剂品种27个。
常年生产的品种4个。
公司配备了先进的符合2010版GMP 要求的生产设备,配套了完善的GMP 文件软件系统,对生产线的各个关键操作环节进行同步监控。
1.1相关品种明细如下:剂型 品种名称丸剂大蜜丸偏瘫复原丸、补中益气丸、大山楂丸、二十七味定坤丸(定坤丸)、附子理中丸、舒肝丸、太极丸、天王补心丸、小活络丸、杞菊地黄丸、大活络丸、回天再造丸、琥珀安神丸、八珍益母丸、桂附地黄丸、参桂再造丸、通宣理肺丸、艾附暖宫丸、橘红丸、牛黄上清丸、利膈丸、紫蔻丸、朱砂安神丸、百合固金丸、十全大补丸、人参归脾丸、六味地黄丸、水丸、水蜜丸、浓缩丸清热暗疮丸、六味地黄丸、更年宁、人参再造丸、银翘解毒丸 胶囊剂 胃乐新胶囊、乙肝扶正胶囊、速感宁胶囊片剂咽炎片、消积健儿片 颗粒剂 益肾灵、通脉颗粒 1.2具体的设备明细如下:序号 设备名称 型号规格 设备编号 生产厂家 1 高效强力性竖式混合机SGTJ-046 黑龙江省迪尔制药机械有限公司 2 不锈钢粉碎机FS-320SGTJ-013 丹东市制药机械有限公司3 提升转料料斗混合机HZD-1000B SGTJ-024 永嘉迦南制药设备有限公司4 摇摆式颗粒机LYK160 SGTJ-018 丹东市制药机械有限公司5 全自动胶囊填充机NGP-1200 SGTJ-026 瑞安飞云机械厂6 旋转式压片机ZPY-129 SGTJ-039 上海天祥健台制药设备有限公司7 旋转式压片机ZPY-129 SGTJ-031 上海天祥健台制药设备有限公司共线生产的全部品种规格均为普通药品,彼此间不存在相互反应或配伍禁忌;共线车间具备了防止污染和交叉污染的措施,包括有完善的防止差错、防止污染和交叉污染的软件体系;生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗。
GMP制剂车间多品种共用风险评估报告

编号:GMPJL023版本:第2版×××制药有限公司综合制剂车间厂房、设施及设备多品种共用风险评估报告(二〇二〇年度)二〇二〇年十一月二十六日发布二〇二〇年十一月二十六日实施×××制药有限公司质量部组织起草实施×××制药有限公司质量受权人批准风险评估组织与实施该风险评估工作由技术质量部负责组织,生产部、动力设备部及QC检验室有关人员参与实施。
风险评估小组成员报告起草报告审核报告批准目录1主题内容与适用范围 (4)2相关文件 (4)3术语和定义 (4)3.1质量风险管理 (4)3.2风险评估 (4)3.3风险 (4)3.4可能性 (4)3.5可测定性 (4)3.6严重性 (4)3.7产品生命周期 (5)4目标和原则 (5)5概述 (5)6风险分析方法与评估内容 (6)6.1风险评估工具 (6)6.2风险评估 (9)7风险分析评估报告附件 (19)综合制剂车间厂房、设施及设备多品种共用风险评估报告1主题内容与适用范围本报告通过对公司综合制剂车间厂房、设施和设备多品种共线生产的安全性进行风险分析、沟通和控制,降低高风险点至可接受范围。
本报告适用于公司综合制剂车间厂房、设施和设备的风险控制管理。
有关激素类药品生产的风险评估见《关于激素类药品生产的风险评估报告》。
2相关文件《药品生产质量管理规范(2010版)》《质量风险管理程序》QM/BJH13-0023术语和定义3.1质量风险管理是对药品整个生命周期进行质量风险的识别、评估、控制、沟通、回顾的系统过程,运用时可采用前瞻或回顾的方式。
3.2风险评估使用定量或定性测量工具将估计的风险与给定的风险标准进行比较以确定风险的严重性。
3.3风险危害出现的可能性和严重性的组合(Risk。
R)。
3.4可能性有害事件发生的频率或可能性(Probability of Occurrence,P)。
【最新】片剂、胶囊剂、散剂车间多品种共线生产风险评估报告
文件编号:FX-20XX-XX片剂、胶囊剂、散剂车间多品种共线生产风险评估报告XXXXXXXX制药公司1、概述我公司的口服固体制剂主要在片剂、胶囊剂、散剂车间生产,共XX个品种。
片剂、胶囊剂、散剂车间配备了符合GMP要求的生产设备,配套了完善的GMP 文件如设备操作规程、清洁规程、生产管理制度等,车间管理人员能对生产线的各个关键操作环节进行同步监控。
我公司按规定的验证周期对所有片剂、胶囊剂、散剂产品进行了工艺验证、设备确认和关键设备的清洁验证,明确了关键的工艺参数、工艺步骤、清洁程序,确认关键工艺参数和工艺指标。
片剂、胶囊剂、散剂车间常规生产的产品均为中成药,大多数为0TC药品,工艺成熟,质量稳定,各药品品种间不存在相互反应及配伍禁忌;共线生产的设备经严格的设备清洁验证,有完善的防止差错、防止污染和交叉污染的措施:生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗,且每年按计划进行持续的再培训。
片剂、胶囊剂、散剂车间生产的相关品种明细如下:片剂、胶囊剂、散剂车间相关共线生产的设备明细如下:2、目的对片剂、胶囊剂、散剂车间多品种共线生产进行风险评估,通过风险识别、风险评估及风险控制,制定纠正和预防措施,以降低风险发生的可能性,提高可识别性,将风险控制在可接受水平,防止药品共线生产过程中出现污染和交叉污染,确保产品质量和公众用药安全有效。
3、范围片剂、胶囊剂、散剂车间多品种共线生产4、依据4.1《药品生产质量管理规范》(2010版)4.2《药品共线生产质量风险管理指南》(2023版)4.3《质量风险管理制度》(QW/S-SMP-004-01)5、风险管理小组成员及其职责6、质量风险管理流程执行我公司制定的《质量风险管理制度》。
7、风险因素标准的评定7. 1风险评估方法:使用FMEA技术(失效模式效果分析)。
7.2失败模式效果分析(FMEA)由三个因素组成:风险的严重性(S)、风险发生的可能性(P)、风险的可测性(D)。
新版GMP口服固体制剂多品种共线生产风险评估报告
编号:
固体制剂车间多品种共线生产
风险评估报告
******药业股份有限公司
一、概述
公司生产的口服固体制剂品种有***品种共****个规格,配备了先进的符合最新GMP 要求的生产设备,配套了完善的GMP文件软件系统,对生产线的各个关键操作环节进行同步监控。
共线生产的全部品种规格均为普通药品,彼此间不存在相互反应或配伍禁忌;
共线车间具备了防止污染和交叉污染的措施,包括有完善的防止差错、防止污染和交叉污染的软件体系;
生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗.
RPN:总风险=S×P×D
三、找出评估风险点
四、对提出的风险点进行评估
五、结论
通过人、机、料、法、环几方面的质量风险点排查,确定了固体制剂车间共线生产中存在的风险,对风险点进行评估并采取风险消减措施后,风险值均在可接受范围内,在验证时需对清洗工艺的清洗效果及设备的性能等项目进行验证,按照风险消减措施执行,确保风险被有效消减,验证结束后针对风险消减措施实施情况对各风险点进行再评估。
综上所述,我司口服固体制剂多品种共线生产不存在风险,或者说风险在可接受限度内。
共用生产线风险分析

我公司生产剂型为颗粒剂、硬胶囊剂,共有在线品种XXX 、XXX 、XXXX 等几个品种。
为完善公司生产质量管理体系,提高药品生产质量管理水平,预防和控制质量事故的发生,促进企业的健康发展,现结合 公司质量风险管理方案要求,对共用生产线进行风险评估。
为规范共用生产线的管理,提高药品生产管理水平,预防和控制质量事故的发生,结合GMP (2022 修订)版及公司质量风险管理,根据本公司本年度制订质量风险管理方案,对共用生产管理全过程进行质量 风险评估;并由此制定确实有效的且经过确认或者验证的风险控制措施,从而避免/降低公用生产线可能存 在的缺陷项给产品质量、生产环境、人员健康公共安全等带来的风险隐患。
我们根据各产品特性、工艺流程和预定用途,通过厂房设施设备、软件管理体系、员工技能等几个方面进行综合评估可能给产品质量带来潜在的风险,影响到产品质量,结合生产管理的经验以及管理制度, 对共用生产线进行分析。
共线品种情况:中 国 药 典常年生题 目:制 订 人: 审 核 人: 批 准 人:制定日期: 审核日期: 批准日期:分发部门:质量部、生产技术部文件编写/修订历史:本文件为首次制定页 码: 1文件编码: F-SJB-2022-004 版 本 号: 00颁发部门:质量部生效日期:页码: 2文件编码:F-SJB-2022-004版本号: 00题目:品种共线范围:1 制剂车间D 级洁净区制剂车间空调净化系统常年共用2 总混常年共用3 充填、泡罩常年共用4 制粒、粉碎过筛常年共用由共线品种特性可知:1. 我公司共线生产的 3 个品种均不是特殊性质的药品;如高致敏性药品(如青霉素类)或者生物制品(如卡介苗或者其他用活性微生物制备而成的药品)或者β-内酰胺结构类药品、性激素类避孕药品,或者某些激素类、细胞毒性类、高活性化学药品;无需独立厂房、空调或者设备的要求;2. 共线的 3 个品种均为中药品种,处方不涉及毒性中药饮片的使用,涉及到的所有中药饮品之间均不存在“十八反”、“十九畏”等配伍禁忌;3. 共线的 3 个品种不存在“注意事项”、“药物相互作用”方面的明确冲突。
04固体制剂车间产品共线生产风险评估报告

风险评估文件编号:RAP/R-FX00-004 版号:B/0 页码:第1页,共17页固体制剂车间产品共线生产风险评估报告目录起草人:年月日审核人:年月日年月日年月日年月日年月日批准人:年月日(质量副总)生效日期:年月日1 概述 (3)2 目的 (5)3 范围 (5)4 风险评估小组成员与职责 (5)5 风险识别 (6)6 风险分析 (12)7 风险评估 (13)8. 风险控制 (15)8.1. 风险降低 (15)8.2. 风险接受 (15)8.3. 风险再评估 (16)9. 风险沟通 (16)10. 风险回顾、总结、关闭 (16)11 风险管理报告及后续工作 (17)12 附件 (17)1 概述我公司新建固体制剂车间生产的口服固体制剂有6个品种,配备了先进的符合现行版GMP要求的生产设备,配套完善的GMP文件软件系统。
所有员工上岗前均经过岗位的技术培训及操作SOP培训,车间按照GMP要求进行生产全过程的质量控制。
固体制剂车间共线生产的全部品种规格均为普通药品,彼此间不存在相互反应或配伍禁忌。
具体的设备明细如下固体制剂车间为封闭式厂房,室内墙和吊顶采用表面光滑、易清洁的彩钢板防火材料。
车间工艺流程布局合理,人流、物流分开,生产工序按工艺要求划分为一般生产区、D级洁净区,有相应的卫生通道、缓冲区。
为了防止药品的交叉污染和混淆,车间每一操作间及生产用设备、容器均有能够指明正在生产的产品或物料的名称、批号及数量等的状态标志。
生产用的设备、容器具等用后均立即按规定进行清洁。
生产操作严格依照公司管理规程和岗位标准操作规程执行,有防止物料混淆、交叉污染的检查和控制措施。
车间生产采用的是阶段性生产,不同品种和同品种不同批次更替生产结束后,必须进行清场合格才能生产,避免了混淆的发生。
车间按生产区域环境、个人、设备工具、物料的卫生要求,建立有清洁卫生制度及清洁规程,定期检查并记录。
质量部派专职QA到车间代表质量部行使质量监督管理的职权,对药品生产的全过程实行质量监控,各工序配备质量管理员对进入工序的原辅料、进入下道工序的中间产品进行质量监督,管理监督层次清晰,能够保证生产产品质量。
新版GMP口服液体车间多品种共线生产风险评估

口服液体制剂车间多品种共线生产风险评估编号:FX-2016-001起草人:日期:审核人:日期:批准人:日期:口服液体制剂车间多品种共线生产风险评估1、简介本厂的口服液体制剂主要在口服液体制剂车间生产,包括合剂、糖浆剂、流浸膏剂三个剂型共6个品种。
车间配备了符合最新GMP要求的生产设备,配套了完善的GMP文件软件系统,对生产线的各个关键操作环节进行同步监控。
本厂2008年对所有口服液体制剂产品进行了工艺验证、设备确认和关键设备的清洁验证,明确了关键的工艺参数、工艺步骤、清洁程序,并于2012年、2013年对生产工艺及清洁验证进行了再验证,确认关键工艺参数和工艺指标未发生漂移。
本厂生产的口服液体制剂均为中成药,大多数为OTC药品,工艺成熟,质量稳定,不存在相互反应及配伍禁忌;共线生产的设备经严格的设备清洁验证,有完善的防止差错、防止污染和交叉污染的措施;生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗。
相关共线生产的设备明细如下:2、目的对口服液体制剂车间多品种共线生产进行风险评估,通过风险识别、风险评估及风险控制,制定纠正和预防措施,以降低风险发生的可能性,提高可识别性,将风险控制在可接受水平,确保产品质量。
3、范围口服液体制剂车间多品种共线生产4、引用资料4.1《药品生产质量管理规范》(2010版)4.2《质量风险管理规定》4.3《质量风险评估标准操作程序》5、风险管理小组成员及其职责分工6、质量风险管理流程执行厂部制定的《质量风险管理规定》。
7、风险因素标准的评定7.1风险评估方法:遵循FMEA技术(失效模式效果分析)。
7.2失败模式效果分析(FMEA)由三个因素组成:风险的严重性(S)、风险发生的可能性(P)、风险的可测性(D)。
7.2.2可能性(P):测定风险产生的可能性,为建立统一基线,建立以下等级:8.风险级别评判标准8.1风险优先系数(RPN)计算公式RPN=SPD=严重性(S)×可能性(P)×可测性(D)8.2风险评价标准9.找出评估风险点11、结论通过人、机、料、法、环几方面的质量风险点排查,确定了口服液体制剂车间共线生产中存在的风险,对风险点进行评估并采取风险消减措施后,风险值均在可接受范围内,在验证时需对清洗工艺的清洗效果及设备的性能等项目进行验证,按照风险消减措施执行,确保风险被有效消减,验证结束后针对风险消减措施实施情况对各风险点进行再评估。
固体制剂车间共线生产质量风险评估报告
XXXXX片共线生产质量风险评估报告审批表产品名称XXXXX片产品阶段放大生产起草起草部门XXXXX起草人年月日审核XXXX部年月日XXXX部年月日XXXX部年月日批准质量负责人年月日分发部门XXXX部、XXXX部、XXXX部、XXXX部生效日期年月日目录一、概述 (1)二、评估目的 (2)三、范围 (2)四、职责 (2)4.1XXXX部 (2)4.2XXXX部 (2)4.3XXXX部 (2)4.4XXXX部 (2)五、风险评估小组 (2)六、法规和指南 (3)七、参考文件 (3)八、处方工艺风险评估标准与准则 (4)8.1风险发生可能性判定准则 (4)8.2风险的严重性判定准则 (4)8.3检测概率判定准则 (4)8.4风险评价标准 (5)九、多产品共线可行性分析(风险分析) (5)9.1共线生产品种的特性分析 (5)9.2产品的工艺分析 (9)1)XXXXX片处方及组成 (9)2)处方变量对产品质量的风险如下表所示 (9)3)具体的风险评估依据如下表所示 (9)4)工艺过程 (10)5)工艺流程图 (10)十、原辅包管控在生产过程中风险评估 (11)十一、工艺及生产操作评估 (12)11.1工艺 (12)11.2工艺对产品质量的评估 (12)11.3工艺的生产过程风险评估 (14)十二、共线风险评估 (18)12.1评分标准 (18)1)清洁难易程度 (18)2)溶解度 (18)3)毒性/活性(MTDD) (18)12.2XXXXX片设备使用情况 (19)12.3各生产品种共用设备情况 (20)12.4与XXXXX片共线产品的清洁风险 (21)12.5XXXXX片的清洁限度 (21)十三、结论 (23)一、概述XXXXX片为处方药,原研药由XXXXX公司研发、生产,XXXXX片是治疗XXXXX应用历史最长的药物之一。
XXXXX片通过多种作用机制对XXXX,可抑制XXXXXX,以预防XXXXX;适用于治疗XXXXXXX。
药品共线生产风险评估报告

药品共线生产风险评估报告1. 引言药品共线生产是指在同一生产线上生产不同种类的药品。
在这种方式下,同一个生产线会加工多种原料和剂型,从而提高生产效率和降低成本。
然而,药品共线生产也面临着一定的风险,如交叉污染、混淆、误投药等。
本报告将对药品共线生产中的风险进行评估和分析,为相关企业提供决策依据。
2. 风险评估方法为了全面、客观地评估药品共线生产的风险,本次评估采用了以下方法:1. 文献研究:收集和分析过往相关研究和案例,了解共线生产可能面临的风险;2. 采访专家:邀请相关领域的专家进行访谈,获得他们的意见和建议;3. 现场调查:实地考察具体企业的生产线和生产环境,直接观察和记录相关风险点。
3. 风险评估内容3.1 交叉污染风险药品共线生产中最常见的风险之一是交叉污染。
由于生产线上加工多种原料和剂型,存在着不同药品之间相互污染的风险。
交叉污染可能导致产品质量不达标,甚至危及患者安全。
为了降低交叉污染的风险,企业应采取以下措施:- 严格执行GMP(Good Manufacturing Practice)标准,确保设备清洁和消毒;- 合理安排生产计划,避免不同药品的交叉生产;- 清晰标识和隔离不同的原料和产品,防止混淆。
3.2 混淆风险除了交叉污染,药品共线生产还存在混淆的风险。
由于生产线上可能同时存在多种不同的原料和产品,操作人员易混淆不同种类的药品,导致加工错误。
为了降低混淆的风险,企业应采取以下措施:- 严格执行SOP(Standard Operating Procedure),确保操作人员清楚和准确理解操作流程;- 提供明确的标识和包装,减少混淆可能性;- 进行员工培训,加强操作人员的技能和责任意识。
3.3 误投药风险在药品共线生产中,误投药也是一个较为严重的风险。
误投药指的是将某种药品错误地添加到另一种药品中,从而导致错误的成品。
为了降低误投药的风险,企业应采取以下措施:- 设立严格的质量控制体系,对原料、半成品和成品进行严格检验和验证;- 对每个工序进行仔细核对和确认;- 加强员工培训,提高员工的注意力和细致度。
口服固体制剂工艺过程风险评估报告

口服固体制剂工艺过程风险评估报告Newly compiled on November 23, 2020口服固体制剂生产工艺过程风险评估文件编码:STP/ZL/FX/002/00口服固体制剂生产工艺过程风险评估1 目的本风险评估的目的即为对口服固体制剂生产工艺过程可能影响到最终产品质量的风险因素进行确定、评估和控制,保证最终的产品质量,指导公司规避质量事故或药害事件的发生,科学规避风险,保护患者的切身利益,并通过风险评估确定验证活动的范围及深度。
本风险评估涉及到的剂型包括糖浆剂、合剂(口服液)、酊剂等。
2 范围本评估包括口服固体制剂生产工艺过程所涉及的工艺设备、控制系统及生产工艺等。
据此,验证总计划范围确定如下:口服固体制剂生产所需的工艺设备(包括其相关控制系统),主要包括:配料罐、洗瓶机、灭菌隧道烘箱、灌装机、轧盖机、灯检机以及包装设备等。
口服固体制剂所涉及的生产工艺,包括配制、灌装、轧盖、灯检、外包装等。
3 质量风险管理流程图4 风险评估小组的成立根据口服固体制剂生产工艺过程风险评估项目,我们成立了相应的风险评估小组,明确了各自责任与分工,具体分工如下表:5 风险评估采用方法本风险评估所用的方法遵循失效模式与影响分析(FMEA)技术,它包括以下几点:风险识别:识别可能影响产品质量、产量、工艺操作或数据完整性的风险。
风险鉴定:包括评估先前识别风险的后果,其基础建立在严重程度、可能性及可检测性上。
风险评价:风险评价是指根据预先确定的风险标准对已经识别并分析的风险进行评价,即通过评价风险的严重性、可能性和可检测性从而确认风险的等级。
5.3.1 严重程度(S):测定风险的潜在后果,主要对可能危害产品质量、患者健康及数据完整性的影响。
严重程度分为4个等级,如下:5.3.2 可能性程度(P):测定风险产生的可能性。
根据积累的经验、工艺/操作复杂性知识或小组提供的其他目标数据,可获得可能性的数值。
为建立统一基线,建立以下等级:5.3.3 可检测性(D):在潜在风险造成危害前,检测发现的可能性,定义如下:5.3.4.2 失效模式与影响分析矩阵6 风险评估及风险控制中药提取与浓缩风险评估及风险控制6.1.1 中药提取与浓缩等生产工艺流程图NOYES6.1.2 中药提取与浓缩工艺过程风险评估及风险控制应用失效模式与影响分析(FMEA)技术对中药提取与浓缩工艺过程进行风险评估,识别潜在的失效模式,对风险的严重程度、发生的可能性及可检测性进行评分,确定风险水平;在采取了相应的控制措施后,再次对其风险的严重程度、发生的可能性及可检测性进行重新评估后,改进后的RPN降低到了可接受水平,即通过全面的过程失效模式与影响分析后,对关键风险控制点进行了相应的控制,从而降低了整个过程的质量风险。
口服液体制剂多品种共线生产风险评估报告

口服液体制剂车间多品种共线生产风险评估报告1 概述:本公司的口服液体制剂包括糖浆剂、煎膏剂、酊剂三个剂型共12个品种。
根据生产任务的不同,每个生产工序配备了符合GMP要求的生产设备。
配料有2 套生产设施、设备,灌装机2台,内外包装线有2条生产线。
其中酊剂有独立的一套配料、灌装、灯检、内外包装线;煎膏剂与糖浆剂共用一套配料、灌装、内外包装线。
3个剂型产品共用厂房有称量间、洁净走道及中间站、洁具清洗存放间、人流、物流通道;生产设施有纯化水系统、压缩空气、空调净化系统等设施。
每台(套)设备产品批量生产计划完成以后,才转而生产另一种产品。
口服液体制剂车间常年生产3个品种,工艺成熟,质量稳定,不存在相互反应及配伍禁忌。
2 目的:对口服液体制剂车间多品种共线生产进行风险评估,通过风险识别、风险评估及风险控制,制定纠正和预防措施,从而降低或避免这些潜在风险在执行过程中可能造成的危害,并持续地改进风险降低措施,保证产品质量,避免交叉污染。
3 范围:口服液体制剂车间多品种共线生产。
4 引用资料4.1 《药品生产质量管理规范》(2010版)4.2 公司制定的《质量风险管理规程》。
5 成立风险评估管理小组:风险评估前,公司质量管理部、工程部及口服液体制剂车间管理人员及岗位主要人员共同组建成立“口服液体制剂车间多品种共线风险评估管理小组”。
由质量保证部担任组长、口服液体制剂车间主任担任副组长,正式启动风险管理程序。
风险评估小组成员6 风险分析活动流程:6.1活动流程图6.2 现状调查:收集口服液体制剂多品种共线的相关信息,包括生产品种简介、厂房及设备布局、设备基本信息、岗位关键工艺控制项目及监控参数,各岗位人员配备及资质情况等。
6.3 风险识别:根据口服液体制剂生产线多品种共线实际情况,从人、机、物、法、环五个方面分析,分析多品种共线程序可能出现的失效模式,同时对每一项进行分析编号。
6.4 风险分析:针对潜在的失效模式进行分析,通过失效的潜在后果、失效的潜在因素、现阶段减轻风险的措施进行分析,对严重程度、发生可能性、可检测性进行评分,计算其RPN 值。
制剂二楼多品种共线生产风险评估报告

质量风险评估报告风险项目:制剂二楼多品种共线生产风险评估编号:起草人: 年月日审核人: 年月日批准人: 年月日目录1.概述2.目的3.相关法规指南和参考文献4.质量风险管理小组人员与其职责分工5.风险识别6.风险分析与评价标准7.风险评估结果与控制8.风险管理评审结论9.风险评估报告审批1.概述制剂二楼现有大蜜丸、小蜜丸、水丸、浓缩丸、糊丸共线生产,布局于同一生产区域,现共线生产麻仁丸等15个品种。
多品种在同一生产线生产,部分设备共用,且在同一洁净区内,存在交叉污染、混淆等风险。
1.1共线产品情况1.2共线设备情况2.目的通过质量风险分析,发现风险点,评估风险,采取措施消除或降低风险,达到多品种共线生产时避免交叉污染、混淆等风险的发生。
3. 相关法规指南和参考文献3.1 《药品生产质量管理规范》(2010年修订)3.2 2010版GMP实施指南3.3 《质量风险管理规程》(MS 09-033)4.质量风险管理小组人员与其职责分工5.风险识别制剂二楼多品种共线生产相互影响因果分析图6. 风险分析与评价标准6.1风险分析根据公司的《质量风险管理规程》(MS 09-033)要求和规定的方法,对风险等级进行分类。
6.1.1按严重程度分类,测定风险的潜在后果,主要针对可能危害产品质量、患者健康与数据完整性的影响。
严重程度(S):分为四个等级,如下:6.1.2按风险发生的可能性程度划分:根据所评估风险项目的复杂性知识或其他目标数据,可获得可能性的数值。
可能性程度(P):分为四个等级,如下:6.1.3可检测性(D):在潜在风险造成危害前,检测发现的可能性,定义如下:6.2风险评价标准通过评价风险的严重性、可能性和可检测性,从而确认风险的等级。
采用RPN (风险优先系数)进行计算,将严重程度、可能性与可检测性三种因素的分值相乘获得风险优先系数(RPN=S×P×D)。
7.风险评估结果与控制:7.1风险评估结果7.2风险应对措施7.3风险应对措施执行情况8.风险管理评审结论质量风险管理小组组长/日期: 9.风险评估报告审批。
新版GMP口服液体车间多品种共线生产

新版GMP口服液体车间多品种共线生产风险评估口服液体制剂车间多品种共线生产风险评估编号:FX-2016-001起草人:日期:审核人:日期:批准人:日期:口服液体制剂车间多品种共线生产风险评估1、简介本厂的口服液体制剂主要在口服液体制剂车间生产,包括合剂、糖浆剂、流浸膏剂三个剂型共6个品种。
车间配备了符合最新GMP要求的生产设备,配套了完善的GMP文件软件系统,对生产线的各个关键操作环节进行同步监控。
本厂2008年对所有口服液体制剂产品进行了工艺验证、设备确认和关键设备的清洁验证,明确了关键的工艺参数、工艺步骤、清洁程序,并于2012年、2013年对生产工艺及清洁验证进行了再验证,确认关键工艺参数和工艺指标未发生漂移。
本厂生产的口服液体制剂均为中成药,大多数为OTC药品,工艺成熟,质量稳定,不存在相互反应及配伍禁忌;共线生产的设备经严格的设备清洁验证,有完善的防止差错、防止污染和交叉污染的措施;生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗。
相关共线生产的设备明细如下:序号设备名称型号规格材质设备编号生产厂家1 电加热浓配缸RLG 不锈钢01—019Ⅱ2001 温州半球轻工制药机械有限公司2 电加热稀配缸RLG 不锈钢01—017Ⅱ2002 温州半球轻工制药机械有限公司3 自动电磁感应铝箔封口机GLF-1300 不锈钢01—015Ⅱ2010 上海多源机械设备有限公司4 台式灌装机TG2 不锈钢01—015Ⅱ2011 中国中南制药机械厂5 口服液灌装轧盖机DGF16/24型不锈钢01—015Ⅱ2012 湖南千山制药机械股份有限公司2、目的对口服液体制剂车间多品种共线生产进行风险评估,通过风险识别、风险评估及风险控制,制定纠正和预防措施,以降低风险发生的可能性,提高可识别性,将风险控制在可接受水平,确保产品质量。
3、范围口服液体制剂车间多品种共线生产4、引用资料4.1《药品生产质量管理规范》(2010版)4.2《质量风险管理规定》4.3《质量风险评估标准操作程序》5、风险管理小组成员及其职责分工序号人员部门职务职责1 1) 提供风险管理所需的资源;2) 批准风险管理计划;3) 批准风险管理报告。
固体制剂车间多品种共线风险评估报告才

固体制剂车间多品种共线风险评估报告编号:1.概述固体制剂车间G1生产线和G2生产线于2013年10月建成,分别用于中药和西药的生产,其中G1生产线用于丸剂和中药片剂的生产,G2生产线用于胶囊剂和西药片剂的生产,目前只对三个剂型的6个品种进行共线风险评估(增加品种后再进行多品种共线生产的风险评估评估)。
厂房、设施、生产设备根据所生产药品特性、工艺流程及相应洁净度级别要求合理设计;配套了相应的GMP文件软件系统;具备了防止污染与交叉污染的措施。
对生产线的各个关键操作环节进行同步监控。
通过对拟认证的三黄片、氯芬黄敏片、通便灵胶囊、大山楂丸、舒肝健胃丸、麦味地黄丸6个品种的公用设施、设备生产产品的药理、毒理、适应症、处方成分的分析;厂房设施、设备清洁(清洁方法和残留水平)、防止混淆(物料、产品)人为差错(工艺不一同使用的模具、筛网不同等)等项目进行评估,以此确定多品种公用设备的可行性。
1.1 共线产品特性信息1.1.1 G1生产线共线生产品种信息1.2 共线产品的预定用途信息1.2.1 G1生产线共线产品的预定用途信息1.3共线产品工艺步骤信息1.3.1 G1生产线共线产品共用设备信息:★表示产品生产使用设备..1.3.2G2 生产线共线产品工艺步骤信息.....2.风险评估小组及职责2.1风险评估小组2.2职责3.风险评估标准本次质量风险评估使用失败模式影响分析(FMEA)工具,识别潜在的失败模式,对风险的严重程度、发生几率和发现的可能性评分,采用5分制原则进行评估。
3.1失败发生的严重程度(S)3.2失败发生的几率(O)3.3损害发现的可能性(D)3.4风险评价准则:风险优先级( RPN=S×O×D )4.风险评估:识别、分析和评价潜在的风险本项工作计划开始时间 **年**月**日计划完成时间 **年**月**日确定可能的失败模式范围,列出每一个失败模式的潜在结果,对每一个失败模式给出严重性(S)分数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编号:
固体制剂车间多品种共线生产
风险评估报告
******药业股份有限公司
一、概述
公司生产的口服固体制剂品种有***品种共****个规格,配备了先进的符合最新GMP要求的生产设备,配套了完善的GMP文件软件系统,对生产线的各个关键操作环节进行同步监控。
共线生产的全部品种规格均为普通药品,彼此间不存在相互反应或配伍禁忌;
共线车间具备了防止污染和交叉污染的措施,包括有完善的防止差错、防止污染和交叉污染的软件体系;
生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗。
RPN:总风险=S×P×D
三、找出评估风险点
四、对提出的风险点进行评估
五、结论
通过人、机、料、法、环几方面的质量风险点排查,确定了固体制剂车间共线生产中存在的风险,对风险点进行评估并采取风险消减措施后,风险值均在可接受范围内,在验证时需对清洗工艺的清洗效果及设备的性能等项目进行验证,按照风险消减措施执行,确保风险被有效消减,验证结束后针对风险消减措施实施情况对各风险点进行再评估。
综上所述,我司口服固体制剂多品种共线生产不存在风险,或者说风险在可接受限度内。
