锂离子电池理论比容量计算办法.doc
锂电池充放电理论及电量计算方法设计
锂电池充放电理论及电量计算方法设计1.锂离子电池介绍1.1荷电状态(State-Of-Charge;SOC)荷电状态可定义为电池中可用电能的状态,通常以百分比来表示。
因为可用电能会因充放电电流,温度及老化现象而有不同,所以荷电状态的定义也区分为两种:绝对荷电状态(AbsoluteState-Of-Charge;ASOC)及相对荷电状态(RelativeState-Of-Charge;RSOC)o通常相对荷电状态的范围是0%-100%,而电池完全充电时是100%,完全放电时是0%。
绝对荷电状态则是一个当电池制造完成时,根据所设计的固定容量值所计算出来的的参考值。
一个全新完全充电电池的绝对荷电状态是100%;而老化的电池即便完全充电,在不同充放电情况中也无法到100%。
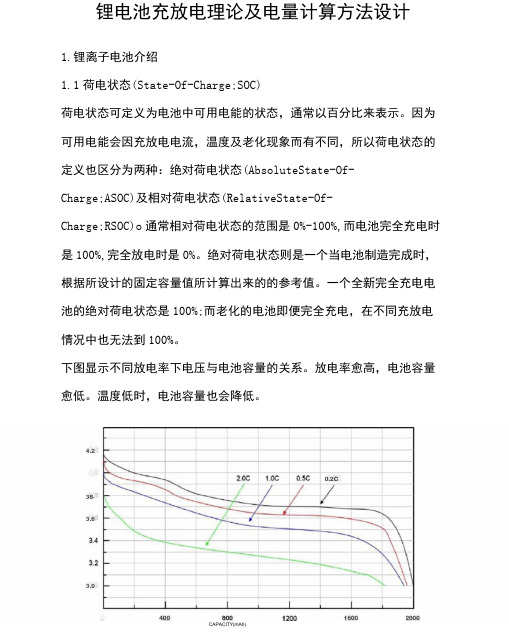
下图显示不同放电率下电压与电池容量的关系。
放电率愈高,电池容量愈低。
温度低时,电池容量也会降低。
4.20.2C383.63.0图一、不同放电率及温度下电压与容量之关系1.2最高充电电压(MaxChargingVoltage)最高充电电压和电池的化学成分与特性有关。
锂电池的充电电压通常是4.2V和4.35V,而若阴极、阳极材料不同电压值也会有所不同。
1.3完全充电(FullyCharged)当电池电压与最高充电电压差小于100mV,且充电电流降低至C/10,电池可视为完全充电。
电池特性不同,完全充电条件也有所不同。
下图所显示为一典型的锂电池充电特性曲线。
当电池电压等于最高充CURRENT3A) 3 CAPAC_TY3Ah)1400图二'锂电池充电特性曲线1.4最低放电电压(MiniDischargingVoltage)最低放电电压可用截止放电电压来定义,通常即是荷电状态为0%时的电压。
此电压值不是一固定值,而是随着负载、温度、老化程度或其他而改变。
1.5完全放电(FullyDischarge)当电池电压小于或等于最低放电电压时,可称为完全放电。
正极材料理论容量计算

锂离子电池正极材料理论电容量的计算常常看见文献上说该材料的理论电容量是多少mA h/g下面给出理论计算方法:1mol正极材料Li离子完全脱嵌时转移的电量为96500C(96500C/mol是法拉第常数)由单位知mAh/g指每克电极材料理论上放出的电量:1mA·h=1×(10^-3)安培×3600秒=3.6C 以磷酸锂铁电池LiFePO4为例:LiFePO4的分子量是157.756g/mol, 所以他的理论电容量是96500/157.756/3.6=170 mA h/g关于法拉第常数法拉第常数(F)是近代科学研究中重要的物理常数,代表每摩尔电子所携带的电荷,单位C/mol,它是阿伏伽德罗数NA=6.02214×1023mol-1与元电荷e=1.602176×10-19 C的积。
尤其在确定一个物质带有多少离子或者电子时这个常数非常重要。
法拉第常数以麦可·法拉第命名,法拉第的研究工作对这个常数的确定有决定性的意义。
一般认为此值是96485.3383±0.0083C/mol,此值是由美国国家标准局所依据的电解实验得到的,也被认为最具有权威性。
最早法拉第常数是在推导阿伏伽德罗数时通过测量电镀时的电流强度和电镀沉积下来的银的量计算出来的。
在物理学和化学,尤其在电化学中法拉第常数是一个重要的常数。
它是一个基本常数,其值只随其单位变化。
在电解、电镀、燃料电池和电池等涉及到物质与它们的电荷的工艺中法拉第常数都是一个非常重要的常数。
因此它也是一个非常重要的技术常数。
在计算每摩尔物质的能量变化时也需要法拉第常数,一个例子是计算一摩尔电子在电压变化时获得或者释放出的能量。
在实际应用中法拉第常数用来计算一般的反应系数,比如将电压演算为自由能。
如何计算电池材料的理论容量值C=26.8nm/M,n是电子数,m是活性物质质量,M是活性物质的分子量电池的化成,有的采用常温化成,有的采用高温化成,这两种化成的优缺点:主要区别应该是SEI膜的厚度和致密程度吧,高温化成形成的SEI较厚但不致密,消耗的锂比较多,常温或低温形成的较薄切致密。
锂电池的相关参数以及计算方法

(1)(1)电极材料的理论容量电极材料理论容量,即假定材料中锂离子全部参与电化学反应所能够提供的容量,其值通过下式计算:其中,法拉第常数(F)代表每摩尔电子所携带的电荷,单位C/mol,它是阿伏伽德罗数NA=6.02214 ×1023mol-1与元电荷e=1.602176 ×10-19 C的积,其值为96485.3383±0.0083 C/mol故而,主流的材料理论容量计算公式如下:LiFePO4摩尔质量157.756 g/mol,其理论容量为:同理可得:三元材料NCM(1:1:1)(LiNi1/3Co1/3Mn1/3O2 ) 摩尔质量为96.461g/mol,其理论容量为278 mAh/g,LiCoO2摩尔质量97.8698 g/mol,如果锂离子全部脱出,其理论克容量274 mAh/g.石墨负极中,锂嵌入量最大时,形成锂碳层间化合物,化学式LiC6,即6个碳原子结合一个Li。
6个C摩尔质量为72.066 g/mol,石墨的最大理论容量为:对于硅负极,由5Si+22Li++22e- ↔ Li22Si5 可知,5个硅的摩尔质量为140.430 g/mol,5个硅原子结合22个Li,则硅负极的理论容量为:这些计算值是理论的克容量,为保证材料结构可逆,实际锂离子脱嵌系数小于1,实际的材料的克容量为:材料实际克容量=锂离子脱嵌系数×理论容量(2)电池设计容量电池设计容量=涂层面密度×活物质比例×活物质克容量×极片涂层面积其中,面密度是一个关键的设计参数,主要在涂布和辊压工序控制。
压实密度不变时,涂层面密度增加意味着极片厚度增加,电子传输距离增大,电子电阻增加,但是增加程度有限。
厚极片中,锂离子在电解液中的迁移阻抗增加是影响倍率特性的主要原因,考虑到孔隙率和孔隙的曲折连同,离子在孔隙内的迁移距离比极片厚度多出很多倍。
(3)N/P比负极活性物质克容量×负极面密度×负极活性物含量比÷(正极活性物质克容量×正极面密度×正极活性物含量比)石墨负极类电池N/P要大于1.0,一般1.04~1.20,这主要是出于安全设计,主要为了防止负极析锂,设计时要考虑工序能力,如涂布偏差。
锂离子电池理论比容量计算方法

锂离子电池理论比容量
计算方法
Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT
理论比容量计算方法:mAh/g
先从单位着手,mAh→Ah→A·s,也即电量单位:库伦(C或A·s)。
举例说明:;LiC6;
(1)计算Si的理论比容量:;
1)取,也即1mol的Si可嵌入的Li;
2)计算所带的电量:
×(×1023)mol-1××10-19C=(A·s);
单位转换:×1000÷3600=
3)理论比容量计算:÷(1mol×28g/mol,1molSi的质量)=g。
(2)石墨理论比容量的计算:LiC6;
1)取1molLiC6,也即6mol的C可嵌入1mol的Li;
2)计算1molLi所带的电量:
1mol×(×1023)mol-1××10-19C=(A·s);
单位转换:×1000÷3600=26789mAh
3)理论比容量计算:26789mAh÷(6mol×12g/mol,6molC的质量)=g。
金属的比容量计算方法:
1molAl在发生电化学反应的时候能够提供3mol电子
3mol电子携带的电量是3×96500=289500C
将库仑单位转换为mAh单位,1C=1000mAs=1000/3600mAh
所以1molAl的容量就是289500/=80417mAh
比容量是80417/27=2978mAh/g
锌:825mAh/g
镁:2219mAh/g。
锂电池的相关参数以及计算方法

(1)(1)电极材料的理论容量电极材料理论容量,即假定材料中锂离子全部参与电化学反应所能够提供的容量,其值通过下式计算:其中,法拉第常数(F)代表每摩尔电子所携带的电荷,单位C/mol,它是阿伏伽德罗数NA=6.02214 ×1023mol-1与元电荷e=1.602176 ×10-19 C的积,其值为96485.3383±0.0083 C/mol故而,主流的材料理论容量计算公式如下:LiFePO4摩尔质量157.756 g/mol,其理论容量为:同理可得:三元材料NCM(1:1:1)(LiNi1/3Co1/3Mn1/3O2 ) 摩尔质量为96.461g/mol,其理论容量为278 mAh/g,LiCoO2摩尔质量97.8698 g/mol,如果锂离子全部脱出,其理论克容量274 mAh/g.石墨负极中,锂嵌入量最大时,形成锂碳层间化合物,化学式LiC6,即6个碳原子结合一个Li。
6个C摩尔质量为72.066 g/mol,石墨的最大理论容量为:对于硅负极,由5Si+22Li++22e- ↔ Li22Si5 可知,5个硅的摩尔质量为140.430 g/mol,5个硅原子结合22个Li,则硅负极的理论容量为:这些计算值是理论的克容量,为保证材料结构可逆,实际锂离子脱嵌系数小于1,实际的材料的克容量为:材料实际克容量=锂离子脱嵌系数×理论容量(2)电池设计容量电池设计容量=涂层面密度×活物质比例×活物质克容量×极片涂层面积其中,面密度是一个关键的设计参数,主要在涂布和辊压工序控制。
压实密度不变时,涂层面密度增加意味着极片厚度增加,电子传输距离增大,电子电阻增加,但是增加程度有限。
厚极片中,锂离子在电解液中的迁移阻抗增加是影响倍率特性的主要原因,考虑到孔隙率和孔隙的曲折连同,离子在孔隙内的迁移距离比极片厚度多出很多倍。
(3)N/P比负极活性物质克容量×负极面密度×负极活性物含量比÷(正极活性物质克容量×正极面密度×正极活性物含量比)石墨负极类电池N/P要大于1.0,一般1.04~1.20,这主要是出于安全设计,主要为了防止负极析锂,设计时要考虑工序能力,如涂布偏差。
锂离子电池理论比容量计算办法

锂离子电池理论比容量计算办法锂离子电池作为一种重要的储能设备,在现代社会中被广泛应用于电子产品、电动汽车等领域。
其理论比容量计算办法是通过计算锂离子电池内部化学反应的电化学反应方程来确定的。
以下将详细介绍锂离子电池理论比容量计算的基本原理和方法。
首先,要理解锂离子电池的原理。
锂离子电池是基于锂离子在正负极之间的迁移而工作的。
它由正极、负极、电解质和分离膜组成。
在充电时,锂离子从正极释放出来,并通过电解质和分离膜迁移到负极。
而在放电时,锂离子则从负极释放,并返回到正极。
基于以上原理,可以通过以下步骤计算锂离子电池的理论比容量:1.确定电极材料:首先需要确定正极和负极的电极材料。
通常正极材料为锂离子嵌入材料,例如钴酸锂(LiCoO2),负极材料为碳材料。
2.确定电化学反应方程:根据电极材料的特性,可以得到正负极的电化学反应方程。
例如,在以锂离子嵌入材料为正极的锂离子电池中,正极材料的化学反应方程可以表示为:LiCoO2↔Li++CoO2+e-。
同样地,负极材料的化学反应方程可以表示为:LiC6↔Li++6C+e-。
3.计算电极比容量:根据电化学反应方程以及电极中活性物质的质量,可以计算电极的比容量。
比容量表示单位质量的电极材料在化学反应中可以嵌入或释放的锂离子数量。
4.计算电池理论比容量:根据正负极的比容量以及电池设计中正负极的比例,可以计算出整个电池的理论比容量。
一般来说,锂离子电池的理论比容量约为150mAh/g。
需要注意的是,以上仅为计算锂离子电池理论比容量的基本步骤,实际情况中还需要考虑诸多因素,如电解质的性质、电极结构、电池尺寸等。
此外,锂离子电池的实际比容量通常会受到电池循环次数、温度等因素的影响,实际比容量往往会比理论值略低。
综上所述,锂离子电池的理论比容量计算是通过计算电化学反应方程、电极材料的比容量,并结合电池设计的参数来确定的。
这一计算方法可以为锂离子电池的设计和性能评估提供重要的理论指导。
锂离子电池正极材料理论电容量的计算

锂离⼦电池正极材料理论电容量的计算锂离⼦电池正极材料理论电容量的计算常常看见⽂献上说该材料的理论电容量是多少mA h/g下⾯给出理论计算⽅法:1mol正极材料Li离⼦完全脱嵌时转移的电量为96500C(96500C/mol是法拉第常数)由单位知mAh/g指每克电极材料理论上放出的电量:1mA·h=1×(10^-3)安培×3600秒=3.6C以磷酸锂铁电池LiFePO4为例:LiFePO4的分⼦量是157.756g/mol, 所以他的理论电容量是96500/157.756/3.6=170 mA h/g关于法拉第常数法拉第常数(F)是近代科学研究中重要的物理常数,代表每摩尔电⼦所携带的电荷,单位C/mol,它是阿伏伽德罗数NA=6.02214×1023mol-1与元电荷e=1.602176×10-19 C 的积。
尤其在确定⼀个物质带有多少离⼦或者电⼦时这个常数⾮常重要。
法拉第常数以麦可·法拉第命名,法拉第的研究⼯作对这个常数的确定有决定性的意义。
⼀般认为此值是96485.3383±0.0083C/mol,此值是由美国国家标准局所依据的电解实验得到的,也被认为最具有权威性。
最早法拉第常数是在推导阿伏伽德罗数时通过测量电镀时的电流强度和电镀沉积下来的银的量计算出来的。
在物理学和化学,尤其在电化学中法拉第常数是⼀个重要的常数。
它是⼀个基本常数,其值只随其单位变化。
在电解、电镀、燃料电池和电池等涉及到物质与它们的电荷的⼯艺中法拉第常数都是⼀个⾮常重要的常数。
因此它也是⼀个⾮常重要的技术常数。
在计算每摩尔物质的能量变化时也需要法拉第常数,⼀个例⼦是计算⼀摩尔电⼦在电压变化时获得或者释放出的能量。
在实际应⽤中法拉第常数⽤来计算⼀般的反应系数,⽐如将电压演算为⾃由能。
如何计算电池材料的理论容量值C=26.8nm/M,n是电⼦数,m是活性物质质量,M是活性物质的分⼦量电池的化成,有的采⽤常温化成,有的采⽤⾼温化成,这两种化成的优缺点:主要区别应该是SEI膜的厚度和致密程度吧,⾼温化成形成的SEI较厚但不致密,消耗的锂⽐较多,常温或低温形成的较薄切致密。
锂离子电池理论比容量计算方法

锂离子电池理论比容量计算方法首先,我们需要了解锂离子电池的基本构成。
锂离子电池一般由负极、正极和电解质组成。
负极材料主要有石墨、石墨化硅等;正极材料主要有锂镍酸锰、锂铁磷酸铁锂等;电解质常用有聚合物电解质、无机盐电解质等。
其次,比容量的计算需要考虑负极和正极材料的储锂容量。
储锂容量是指材料中能够储存锂离子的最大容量。
通常以每克材料能储存的锂离子数量来表示。
负极材料的储锂容量通常以mAh/g(毫安时/克)为单位表示,正极材料的储锂容量通常以mAh/g或mAh/cm3(毫安时/克或毫安时/立方厘米)为单位表示。
然后,计算方法可以分为理论计算方法和实验测定方法。
理论计算方法主要是通过材料的结构及其储锂机制进行计算,常用的方法有密度泛函理论(DFT)计算和一维核壳模型计算等。
理论计算方法需要考虑材料的晶体结构、晶格参数、电子结构以及离子扩散等因素,通过计算得到材料的储锂容量,从而得到比容量。
实验测定方法则是通过电池测试平台进行实验测试,通常是通过充放电循环测试来测定电池的电量和电压变化,从而得到比容量。
最后,除了考虑储锂容量,计算比容量还需要考虑电极材料的密度以及电池重量。
电池重量可以通过电池的称重得到,而电极材料的密度可以通过实验测定或文献查询得到。
综上所述,锂离子电池的比容量计算方法可以通过理论计算方法和实验测定方法来进行。
理论计算方法主要基于材料的晶体结构、晶格参数、电子结构以及离子扩散等因素进行计算,而实验测定方法则是通过电池测试平台进行实验测试来获得比容量。
需要考虑负极和正极材料的储锂容量、电极材料的密度以及电池重量等因素。
锂离子电池正极材料理论电容量的计算

锂离子电池正极材料理论电容量的计算常常看见文献上说该材料的理论电容量是多少mA h/g下面给出理论计算方法:1mol正极材料Li离子完全脱嵌时转移的电量为96500C(96500C/mol是法拉第常数)由单位知mAh/g指每克电极材料理论上放出的电量:1mA·h=1×(10^-3)安培×3600秒=3.6C以磷酸锂铁电池LiFePO4为例:LiFePO4的分子量是157.756g/mol, 所以他的理论电容量是96500/157.756/3.6=170 mA h/g关于法拉第常数法拉第常数(F)是近代科学研究中重要的物理常数,代表每摩尔电子所携带的电荷,单位C/mol,它是阿伏伽德罗数NA=6.02214×1023mol-1与元电荷e=1.602176×10-19 C 的积。
尤其在确定一个物质带有多少离子或者电子时这个常数非常重要。
法拉第常数以麦可·法拉第命名,法拉第的研究工作对这个常数的确定有决定性的意义。
一般认为此值是96485.3383±0.0083C/mol,此值是由美国国家标准局所依据的电解实验得到的,也被认为最具有权威性。
最早法拉第常数是在推导阿伏伽德罗数时通过测量电镀时的电流强度和电镀沉积下来的银的量计算出来的。
在物理学和化学,尤其在电化学中法拉第常数是一个重要的常数。
它是一个基本常数,其值只随其单位变化。
在电解、电镀、燃料电池和电池等涉及到物质与它们的电荷的工艺中法拉第常数都是一个非常重要的常数。
因此它也是一个非常重要的技术常数。
在计算每摩尔物质的能量变化时也需要法拉第常数,一个例子是计算一摩尔电子在电压变化时获得或者释放出的能量。
在实际应用中法拉第常数用来计算一般的反应系数,比如将电压演算为自由能。
如何计算电池材料的理论容量值C=26.8nm/M,n是电子数,m是活性物质质量,M是活性物质的分子量电池的化成,有的采用常温化成,有的采用高温化成,这两种化成的优缺点:主要区别应该是SEI膜的厚度和致密程度吧,高温化成形成的SEI较厚但不致密,消耗的锂比较多,常温或低温形成的较薄切致密。
锂离子电池理论比容量计算方法

锂离子电池理论比容量计算方法Document serial number【KKGB-LBS98YT-BS8CB-BSUT-BST108】理论比容量计算方法:m A h/g 先从单位着手,mAh→Ah→A·s,也即电量单位:库伦(C或A·s)。
举例说明:Li4.4Si;LiC6;(1)计算Si的理论比容量:Li4.4Si;1)取1molLi4.4Si,也即1mol的Si可嵌入4.4mol的Li;2)计算4.4molLi所带的电量:4.4mol×(6.02×1023)mol-1×1.602×10-19C=424337.76C(A·s);单位转换:424337.76×1000÷3600=117871.6mAh3)理论比容量计算:117871.6mAh÷(1mol×28g/mol,1molSi的质量)=4209.7mAh/g。
(2)石墨理论比容量的计算:LiC6;1)取1molLiC6,也即6mol的C可嵌入1mol的Li;2)计算1molLi所带的电量:1mol×(6.02×1023)mol-1×1.602×10-19C=96440.4C(A·s);单位转换:96440.4×1000÷3600=26789mAh3)理论比容量计算:26789mAh÷(6mol×12g/mol,6molC的质量)=372.07mAh/g。
金属的比容量计算方法:1molAl在发生电化学反应的时候能够提供3mol电子3mol电子携带的电量是3×96500=289500C将库仑单位转换为mAh单位,1C=1000mAs=1000/3600mAh所以1molAl的容量就是289500/3.6=80417mAh比容量是80417/27=2978mAh/g锌:825mAh/g镁:2219mAh/g。
锂电池理论容量公式

锂电池理论容量公式锂电池的理论容量公式是根据锂离子电池的电化学反应原理推导得出的,它可以用来计算锂电池的理论容量。
锂电池在充放电过程中,锂离子在正负极之间通过电解质进行迁移,从而产生电流。
锂离子的迁移数量和电荷数的乘积即为电池的容量。
下面将详细介绍锂电池的理论容量公式及其推导。
首先,锂电池是一种先进的储能装置,它由正极、负极和电解质组成。
正极通常使用金属氧化物如LiCoO2,负极通常使用石墨,而电解质则是锂盐的溶液。
锂电池在充放电过程中,正极的Li离子的Co原子减少,负极的Li离子则以Li_xC为形式嵌入到石墨层中。
这个过程可用以下方程式表示:正极反应:LiCoO2 = CoO2 + xLi+ + xe-负极反应:xLi+ + xe- + C = Li_xC这表明,每个锂离子在充放电过程中需要x个电子来完成氧化还原反应。
在充电过程中,锂离子是从正极释放出来,然后穿过电解质,最终嵌入到负极的石墨层中。
在放电过程中,锂离子则是从负极释放出来,穿过电解质,最终嵌入到正极中。
锂电池的理论容量公式可以通过计算锂离子的总数量来得到。
在锂电池中,理论上每个锂离子对应一个电子,那么总的锂离子数目等于总的电子数目。
根据法拉第电量的定义,电子数目等于电荷数除以电子电荷,即:n=Q/F根据电荷守恒定律,充放电过程中传递的电荷相等,所以我们可以分别计算正极和负极中电荷的总量,然后相加得到总的电荷数。
正极总电荷数的计算如下:Q正 = x * mol正 * Fmol正 = M / M正其中,Q正是正极的总电荷量,x是锂离子与电子的比例系数,mol 正是正极中锂离子的摩尔数,M是正极的质量,M正是正极金属氧化物的摩尔质量。
同理Q负 = mol负 * Fmol负 = M / M负其中,Q负是负极的总电荷量,mol负是负极中锂离子的摩尔数,M 是负极的质量,M负是负极材料的摩尔质量。
将正负极的总电荷数相加得到总的电荷量:Q=Q正+Q负根据上述公式,我们可以计算锂电池的理论容量。
锂离子电池正极材料理论电容量的计算

锂离子电池正极材料理论电容量的计算常常看见文献上说该材料的理论电容量是多少mA h/g下面给出理论计算方法:1mol正极材料Li离子完全脱嵌时转移的电量为96500C(96500C/mol是法拉第常数)由单位知mAh/g指每克电极材料理论上放出的电量:1mA·h=1×(10^-3)安培×3600秒=3.6C以磷酸锂铁电池LiFePO4为例:LiFePO4的分子量是157.756g/mol, 所以他的理论电容量是96500/157.756/3.6=170 mA h/g关于法拉第常数法拉第常数(F)是近代科学研究中重要的物理常数,代表每摩尔电子所携带的电荷,单位C/mol,它是阿伏伽德罗数NA=6.02214×1023mol-1与元电荷e=1.602176×10-19 C 的积。
尤其在确定一个物质带有多少离子或者电子时这个常数非常重要。
法拉第常数以麦可·法拉第命名,法拉第的研究工作对这个常数的确定有决定性的意义。
一般认为此值是96485.3383±0.0083C/mol,此值是由美国国家标准局所依据的电解实验得到的,也被认为最具有权威性。
最早法拉第常数是在推导阿伏伽德罗数时通过测量电镀时的电流强度和电镀沉积下来的银的量计算出来的。
在物理学和化学,尤其在电化学中法拉第常数是一个重要的常数。
它是一个基本常数,其值只随其单位变化。
在电解、电镀、燃料电池和电池等涉及到物质与它们的电荷的工艺中法拉第常数都是一个非常重要的常数。
因此它也是一个非常重要的技术常数。
在计算每摩尔物质的能量变化时也需要法拉第常数,一个例子是计算一摩尔电子在电压变化时获得或者释放出的能量。
在实际应用中法拉第常数用来计算一般的反应系数,比如将电压演算为自由能。
如何计算电池材料的理论容量值C=26.8nm/M,n是电子数,m是活性物质质量,M是活性物质的分子量电池的化成,有的采用常温化成,有的采用高温化成,这两种化成的优缺点:主要区别应该是SEI膜的厚度和致密程度吧,高温化成形成的SEI较厚但不致密,消耗的锂比较多,常温或低温形成的较薄切致密。
锂电池设计容量计算公式

锂电池设计容量计算公式摘要:1.锂电池设计容量的概念2.锂电池设计容量的计算公式3.锂电池设计容量的实例分析4.锂电池设计容量的注意事项正文:一、锂电池设计容量的概念锂电池设计容量是指在理想状态下,电池能够释放的最大电能。
它是电池性能评价的重要指标,直接影响设备的续航能力和使用体验。
锂电池的设计容量通常以毫安时(mAh) 或安时(Ah) 为单位表示。
二、锂电池设计容量的计算公式锂电池设计容量的计算公式较为复杂,一般由电极材料的理论容量、电极的实际容量和电池的放电效率三个因素决定。
其中,理论容量可以通过以下公式计算:理论容量= (电极材料的摩尔质量×电极材料的离子数目) / (电子数目×电池的电压)实际容量则是理论容量的一定比例,该比例受到电池制备工艺、电极材料性能和电池使用环境等因素的影响。
放电效率则是电池实际输出电能与理论电能之比,它受到电池的内阻、负载大小和温度等因素的影响。
三、锂电池设计容量的实例分析以三元材料NCM(1:1:1)(LiNi1/3Co1/3Mn1/3O2) 为例,其摩尔质量为96.461g/mol,理论容量为278mAh/g。
假设电池的放电效率为80%,则实际容量为222.4mAh/g。
如果电池的电压为3.6V,那么设计容量为:设计容量= 实际容量×电池的电压/ 1000 = 222.4mAh/g ×3.6V / 1000 = 83.984mAh四、锂电池设计容量的注意事项在计算锂电池设计容量时,需要注意以下几点:1.电极材料的理论容量仅是理想状态下的容量,实际容量受到制备工艺和使用环境等因素的影响。
2.电池的放电效率是一个比较复杂的参数,受到电池内阻、负载大小和温度等因素的影响。
在实际使用中,放电效率可能会低于理论值。
锂电池理论容量公式

锂电池理论容量公式1.法拉第常数F代表每摩尔电子所携带的电荷,单位C/mol,F=N*e=96500C/mol A23阿伏伽德罗数N=6.02×10 A-19元电荷e=1.602176×10 C+在锂离子电池中1mol Li完全脱嵌时将转移的1mol电子的电量,即1F=96500C/mol(法拉第常数)-3进行单位转换: 1mAh=1×10A×3600s=3.6C1Ah=1A×3600s=3600C所以96500C=96500 / 3600Ah=26.806 Ah ? 26.8 Ah 2.锂电池理论容量公式:C=26.8nm / M 0C为理论容量,单位为mAh/g 0n为成流反应的得失电数m为活性物质完全反应的质量M为活性物质的摩尔质量3.例子:例1 钴酸锂LiCoO,其摩尔质量为97.8,反应式如下: 2+-LiCoO = Li + CoO+ e 22其得失电子数为1,即1mol LiCoO完全反应将转移1mol电子的电量,2 所以1g LiCoO完全反应时将转移1/97.8 mol电子的电量。
2其理论容量C= 26.8nm/M=26.8×1×1/97.8=0.2738Ah/g =273.8mAh/g 0 例2 碳,其摩尔质量为12,反应式如下:+- 6C + Li + e= LiC6其得失电子数为1/6,即1mol C完全反应将转移1/6mol电子的电量,所以1g C完全反应时将转移1/12 mol电子的电量。
其理论容量C=26.8nm/M=26.8×(1/6)×1/12=0.372Ah/g =372mAh/g 0。
锂离子电极理论容量的计算

锂离子电极理论容量的计算
一、锂离子电池理论容量计算
1、介绍
锂离子电池是当今最先进的电力储存技术之一、相比于锂硫电池、钴酸锂电池等电池,锂离子电池具有较高的能量密度、有效的电力保存能力和低的温度冲击。
在当今快速发展的低碳能源领域,锂离子电池已经成为不可或缺的重要元素,能源储存技术的发展不可缺少锂离子电池这一重要因素。
与其他储能技术相比,锂离子电池的技术成熟度更高,并且有多种不同的构造结构。
锂离子电池具有体积小、重量轻、内阻低、能量密度高等优点,使其在汽车电池、手机电池、电子烟电池、摩托车电池等应用中得到了广泛的应用。
2、理论容量计算
锂离子电池理论容量的计算可以通过以下公式完成:
理论容量:
I=Q/(U‾t)
其中,I表示锂离子电池理论容量;
Q表示电池出入口电流,单位是安培;
U‾t表示电池常数,单位是伏。
I=Q/(U‾t)x1000:
其中,I表示锂离子电池理论容量;
Q表示电池出入口电流,单位为毫安;
U‾t表示电池常数,单位是伏。
假设该锂离子电池的出入口电流为2.5A,则Q=2.5,该锂离子电池的常数为3.6V。
锂离子电极理论容量的计算

在嵌锂过程中,Li + 通过电解液到达负极的活性物质表面,在负极上得到自由电子,形成锂原子后沉积到负极表面,之后锂原子从负极材料的表面扩散到负极材料的内部,发生合金化反应。
这个过程对应于外电路的放电过程;反之,在高电位下,锂原子由于化学性质活泼而在负极表面失去电子,形成Li + ,并在电场作用下迁移至正极;负极内部的锂原子扩散到负极表面,对于负极而言发生了合金的分解,这个过程对应于外电路的充电过程。
对于石墨电极,在电池充放电过程中,锂在石墨片层间实现嵌脱过程,并形成锂碳嵌入化合物LiC6 。
Li + 在层状石墨中的嵌脱反应只会引起层间距的变化,不会破坏晶体结构。
石墨负极中,锂嵌入量最大时,形成锂碳层间化合物,化学式LiC6,即6个碳原子结合一个Li。
石墨的最大理论容量为26.8/(12*6)=0.372Ah,即约372mAh/g。
其中26.8单位为Ah,由电子电量*阿伏伽德罗常数/3600得到,表示1mol电子所带电量,除以3600是把电量单位由库伦化为Ah。
其他材料的理论比容量也可按此计算。
常常看见文献上说该材料的理论电容量是多少mA h/g下面给出理论计算方法:1mol正极材料Li离子完全脱嵌时转移的电量为96500C(96500C/mol是法拉第常数)由单位知mAh/g指每克电极材料理论上放出的电量:1mA·h=1×(10^-3)安培×3600秒=3.6C以磷酸锂铁电池LiFePO4为例:LiFePO4的分子量是157.756g/mol, 所以他的理论电容量是96500/157.756/3.6=170 mA h/g关于法拉第常数法拉第常数(F)是近代科学研究中重要的物理常数,代表每摩尔电子所携带的电荷,单位C/mol,它是阿伏伽德罗数NA=6.02214×1023mol-1与元电荷e=1.602176×10-19 C的积。
尤其在确定一个物质带有多少离子或者电子时这个常数非常重要。
正极材料理论容量计算【范本模板】

锂离子电池正极材料理论电容量的计算常常看见文献上说该材料的理论电容量是多少mA h/g下面给出理论计算方法:1mol正极材料Li离子完全脱嵌时转移的电量为96500C(96500C/mol是法拉第常数)由单位知mAh/g指每克电极材料理论上放出的电量:1mA·h=1×(10^—3)安培×3600秒=3.6C 以磷酸锂铁电池LiFePO4为例:LiFePO4的分子量是157。
756g/mol,所以他的理论电容量是96500/157.756/3。
6=170 mA h/g关于法拉第常数法拉第常数(F)是近代科学研究中重要的物理常数,代表每摩尔电子所携带的电荷,单位C/mol,它是阿伏伽德罗数NA=6。
02214×1023mol—1与元电荷e=1.602176×10-19 C的积.尤其在确定一个物质带有多少离子或者电子时这个常数非常重要。
法拉第常数以麦可·法拉第命名,法拉第的研究工作对这个常数的确定有决定性的意义.一般认为此值是96485.3383±0.0083C/mol,此值是由美国国家标准局所依据的电解实验得到的,也被认为最具有权威性。
最早法拉第常数是在推导阿伏伽德罗数时通过测量电镀时的电流强度和电镀沉积下来的银的量计算出来的.在物理学和化学,尤其在电化学中法拉第常数是一个重要的常数。
它是一个基本常数,其值只随其单位变化.在电解、电镀、燃料电池和电池等涉及到物质与它们的电荷的工艺中法拉第常数都是一个非常重要的常数。
因此它也是一个非常重要的技术常数.在计算每摩尔物质的能量变化时也需要法拉第常数,一个例子是计算一摩尔电子在电压变化时获得或者释放出的能量。
在实际应用中法拉第常数用来计算一般的反应系数,比如将电压演算为自由能。
如何计算电池材料的理论容量值C=26。
8nm/M,n是电子数,m是活性物质质量,M是活性物质的分子量电池的化成,有的采用常温化成,有的采用高温化成,这两种化成的优缺点:主要区别应该是SEI膜的厚度和致密程度吧,高温化成形成的SEI较厚但不致密,消耗的锂比较多,常温或低温形成的较薄切致密。
正极材料理论容量计算

锂离子电池正极材料理论电容量的计算常常看见文献上说该材料的理论电容量是多少mA h/g下面给出理论计算方法:1mol正极材料Li离子完全脱嵌时转移的电量为96500C(96500C/mol是法拉第常数)由单位知mAh/g指每克电极材料理论上放出的电量:1mA·h=1×(10^-3)安培×3600秒=3.6C 以磷酸锂铁电池LiFePO4为例:LiFePO4的分子量是157.756g/mol,所以他的理论电容量是96500/157。
756/3.6=170 mA h/g关于法拉第常数法拉第常数(F)是近代科学研究中重要的物理常数,代表每摩尔电子所携带的电荷,单位C/mol,它是阿伏伽德罗数NA=6.02214×1023mol—1与元电荷e=1.602176×10-19 C的积。
尤其在确定一个物质带有多少离子或者电子时这个常数非常重要。
法拉第常数以麦可·法拉第命名,法拉第的研究工作对这个常数的确定有决定性的意义。
一般认为此值是96485。
3383±0.0083C/mol,此值是由美国国家标准局所依据的电解实验得到的,也被认为最具有权威性。
最早法拉第常数是在推导阿伏伽德罗数时通过测量电镀时的电流强度和电镀沉积下来的银的量计算出来的.在物理学和化学,尤其在电化学中法拉第常数是一个重要的常数。
它是一个基本常数,其值只随其单位变化.在电解、电镀、燃料电池和电池等涉及到物质与它们的电荷的工艺中法拉第常数都是一个非常重要的常数。
因此它也是一个非常重要的技术常数。
在计算每摩尔物质的能量变化时也需要法拉第常数,一个例子是计算一摩尔电子在电压变化时获得或者释放出的能量。
在实际应用中法拉第常数用来计算一般的反应系数,比如将电压演算为自由能。
如何计算电池材料的理论容量值C=26。
8nm/M,n是电子数,m是活性物质质量,M是活性物质的分子量电池的化成,有的采用常温化成,有的采用高温化成,这两种化成的优缺点:主要区别应该是SEI膜的厚度和致密程度吧,高温化成形成的SEI较厚但不致密,消耗的锂比较多,常温或低温形成的较薄切致密。
