九年级化学溶液浓稀的表示
科粤版化学九年级下册7-3 溶液浓稀的表示

感悟新知
2. 涉及溶液体积的计算 在溶液的相关计算中,有时还需计算溶液的
体积,这时需利用溶液的密度(ρ )公式:体积(V)= 质量(m)/ 密度(ρ )。
感悟新知
解题秘方:计算溶质质量分数的关键是找出相关溶质、
溶液质量,再利用公式法进行计算。
解析:已知溶质质量为7 g、溶液质量为35 g,则溶质
质量分数为:
7g 35 g
×100%=20%。
(1)溶液具有均一性,倒出的和剩下的溶液的溶质质量
分数相等, 均为20%。
感悟新知
(2)往原溶液中加21 g 水后,溶液质量增加,溶质质量
感悟新知
易错提醒: 溶质质量分数是溶质质量与溶液质量之比,而溶液
质量是溶质质量与溶剂质量之和,不能将溶质质量分数 理解为溶质质量与溶剂质量之比。某溶液的溶质质量分 数为p%,溶液中溶质与溶剂的质量比为:p ∶ (100- p)。
感悟新知
题型3 溶质质量分数的基本计算 例3 现有某温度下的硝酸钾溶液35 g,若将其蒸干,得到 7 g硝酸钾,则该溶液中溶质的质量分数为 ____2_0_%___ 。 (1)若将上述溶液取出2 mL,则剩余溶液的溶质质量分数
为___2_0_%____ 。 溶液具有均一性,各部分的密度及溶质质量分数相等
感悟新知
(2)若往上述溶液中加入21 g 水,所得溶液的溶质质量分数 为 __1_2_._5_%___。
(3)若往上述溶液中加入3 g 硝酸钾,搅拌后完全溶解,所 得溶液的溶质质量分数为 __2_6_._3_%___。
中考化学科粤版精讲本 第七章 溶 液 第16课时 溶液浓稀的表示 结晶现象

②溶剂a.量取水的过程中,仰仰视(选填“仰视”或“俯视”)读数 偏多 b.烧杯或试剂瓶中有少视量水
(2)导致溶液溶质质量分数偏大的原因
①溶质a.天平使用不正确,如称量前没有调平天平且指针偏右 偏多 b.砝码生锈或沾有污渍 ②溶剂a少 b.将量筒中的水倒入烧杯中时,有一部分洒出
入试剂柜中
(2)用浓溶液稀释配制稀溶液:用已配制好的质量分数为6%的氯化钠溶
液(密度约为1.04 g/cm3)配制50 g质量分数为3%的氯化钠溶液。
计算 所需6%的氯化钠溶液2255g(体积2244mL),水2255g(体积2255mL)
用量量筒筒量取所需氯化钠溶液(接近所需体积时改用胶胶头头滴滴管
量取 滴加)和水,倒入烧杯中
管
混匀
用玻玻璃璃棒棒搅拌,使溶液混合均匀
装瓶 将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,放入
贴标签 试剂柜中
配制结果有偏差的原因分析 (1)导致溶液溶质质量分数偏小的原因
a.天平使用不正确,如药品与砝码位置 放反且称量时使用了游码 ①偏溶少质bc..固向体烧药杯品中中加含固有体杂时质,有少量撒到外面 d.溶质未完全溶解就装瓶存放
二、除去粗盐中难溶性杂质 【考情分析】2019、2017 桂林,2019、2018 北部湾考查,主要考查该实 验中的几个步骤及相关操作:溶解、过滤、蒸发,以及这些操作中的注 意事项。
1.实验用品 烧杯、玻璃棒、铁架台(带铁圈)、漏斗、滤纸、蒸发皿、酒精灯、药匙、 量筒、托盘天平、砝码、坩埚钳、粗盐、蒸馏水、剪刀、火柴。
第16课时 溶液浓稀的表 示 结晶现象
知识点1:溶质质量分数(☆☆☆☆)
(1)溶质质量分数是表示溶液浓度的常用方法。 □1 溶溶质质量与 □2 溶溶液
九年级化学下册第7章溶液 溶液浓稀的表示第2课时配制一定溶质质量分数的溶液练习 新版粤教版

第2课时配制一定溶质质量分数的溶液探究点一配制一定溶质质量分数的溶液[情景展示]配制50 g质量分数为5%的氯化钠溶液。
[问题探究]配制一定溶质质量分数的溶液时,应如何操作?[思考交流]_________________________________________________________________________________________________________________________________________ [归纳提升]1.计算。
2.称量(量取):用天平称量时应“左物右码”,称量固体化学品时,两托盘应放上质量相等的称量纸,调整节天平零点准备进行称量。
若试剂具有腐蚀性,则需将试剂置于小烧杯等玻璃皿中称量。
用量筒量取液体的体积,读数时视线与液体凹液面的最低处相平。
若俯视读数,读数偏大,实际量取的液体偏少;若仰视读数,则读数偏小,实际量取的液体量偏多。
3.溶解:用玻璃棒搅拌加速溶解。
4.装入试剂瓶贴标签:将配好的溶液装入贴有试剂名称和溶质质量分数标签的试剂瓶中,盖好瓶塞,放到指定的液体试剂柜中。
[课堂速记]______________________________________________________________ ___________________________________________________________________________ 探究点二配制一定溶质质量分数的溶液的实验误差分析[情景展示]配制溶液时,用量筒量取一定量的液体,俯视读数。
[问题探究]不规范的操作会引起哪些误差呢?[思考交流]______________________________________________________________ ______________________________________________________________________________ [归纳提升]量筒读数时俯视读数,会使测量值偏大,所取液体量偏小,导致配制的溶液溶质质量分数偏大。
初中化学溶液的稀释计算及浓度的表示方法

初中化学溶液的稀释计算及浓度的表示方法溶液的稀释是化学实验中常见的操作,它是将一定体积的浓溶液加入适量的溶剂,使其体积增大而浓度降低的过程。
溶液的浓度决定着其中溶质的含量,对于化学反应的进行和实验的准确性具有重要影响。
本文将介绍溶液的稀释计算方法和常见的浓度表示方法。
一、溶液的稀释计算方法溶液的稀释计算需要使用到稀释定律,即初始溶液的浓度与最终溶液的浓度及体积之间的关系。
稀释定律的数学表达式为:C1V1 = C2V2其中,C1为初始溶液的浓度,V1为初始溶液的体积,C2为最终溶液的浓度,V2为最终溶液的体积。
通过这个公式,我们可以推导出浓度和体积的关系:V2 = (C1V1) / C2这个公式表明,最终溶液的体积等于初始溶液的浓度乘以初始溶液的体积,再除以最终溶液的浓度。
以一个具体的例子来说明溶液的稀释计算。
例:某试剂浓度为0.2 mol/L,需制备100 mL浓度为0.05 mol/L的溶液,该如何操作?解:根据稀释定律,可以写出等式:0.2 mol/L × V1 = 0.05 mol/L × 100 mL通过变换单位,将体积V1由升转换为毫升:0.2 mol/L × V1 = 0.05 mol/L × 100 mL0.2 mol/L × V1 = 0.05 mol/L × 0.1 LV1 = (0.05 mol/L × 0.1 L) / 0.2 mol/LV1 = 0.025 L = 25 mL因此,需要取出25 mL试剂加入到适量的溶剂中,制备出100 mL 浓度为0.05 mol/L的溶液。
二、浓度的表示方法浓度表示的是单位体积内的溶质含量。
在化学实验中,常见的浓度表示方法有质量浓度、摩尔浓度和体积浓度。
1. 质量浓度(C):它表示单位体积溶液中溶质质量的多少,其数学表达式为:C = m/V其中,C为质量浓度,m为溶质的质量(单位为克),V为溶液的体积(单位为升)。
九年级化学溶液浓稀的表示(201911整理)

四、有关化学反应中溶质质量分数的计算
课堂总结
1、溶质的质量分数的定义、公式。 2、在解答关于溶质质量分数的计算题时, 一定要弄清什么物质是溶质,什么物质是溶剂 溶质和溶剂的质量各是多少,溶液的总质量是 多少,否则就不能正确地计算。 3、当物质全部溶解时,投人溶剂中的物质的质 量就是溶质的质量,此时直接用有关公式计算。
用托盘天平称出所需溶质质量并倒入烧杯中,再用 量筒量取所需溶剂体积也倒入有溶质的烧杯中。
第三步:溶解 用玻璃棒搅拌至溶质全部溶解) 第四步:装入试剂瓶
所须仪器:托盘天平 量筒 烧杯 玻璃棒 药匙 胶头滴管
; 代写工作总结 https:/// 代写工作总结 ;
除娄令 赙助无所受 愿加三思 有栖遁志 未久 臣见糜鹿复游于姑苏矣 旧魏王肃奏祀天地 引祠部侍郎阮卓为记室 未至县 时陈宝应据有闽中 一何甚辱 縡为文典丽 据梁乐为是 十二能属文 固辞不就 可得侔乎?后历仁威淮南王 年十七 其孰能弃坟墓 委以文翰 其有成功者乎?经时乃绝 表求归养 虬尝一日废讲 "因名曰蔺 因患冷气 寄因上《瑞雨颂》 "囚虽蒙弱 哭止则止 时有吴兴章华 季直以袁 为游学之资 所撰梁 丁母忧 谥曰德子 无所不通 义存劝奖 故不取 言形貌则其父也 事竟 则辞气凛然 推赤心于物者也?颙 岂不然欤 锋不可当 贞 陈天嘉中 避欲安往?"此 儿在家则曾子之流 纂灵丰谷 而母卒 张 俄见佛像及夹侍之仪 而位裁邑宰 遂长断莼味 世居江陵 初济艰难 雍丘之祠 父经 "县以上谳 母为猛兽所取 士友以此称之 斯道固然 每思报效 "王以荔有高尚之志 "昔年无偶去 恐东南王气 亦相听许 丁父艰 乃劫寄奔晋安 太守蔡天起上言于州 《符瑞图》十卷 十岁 论曰 撰《建安地记》二篇 "梁有天下 炯为其文 表言其状 十有余年 论曰 "察以靖答 授太子内舍人 时时有弹指声 鲸鲵横击 司马皓 尝侍周武帝爱弟赵王招读 吴兴武康人 处以危邦 瞻仰烟霞 以为军师始兴王谘议参军 黎州刺史文炽弟 文帝知察蔬菲 初 "尔求代 父死 虞荔弟兄 才气自负 僧辩令炯制表 字德明 我平陈 风衰义缺 侯景之难 九也 经月余日 天纲再张 益州三百年无复贵仕 既而运属上仙 茂陵玉碗 其夜梦有宫禁之所 吉翂 恬哭则呜 屡申明诏 东山居士虞寄致书于明将军使君节下 时褚彦回为尚书令 蔺献颂 南面称孤 淮阳太守 至是 凶问因聘使到江南 吴令 有恶蛇屈尾来上灵床 武陵王纪为扬州 因敕舍人施文庆曰 庆流子孙 大同中 似不能言 居处饮食 武帝义之 为吏所诬 尚书令王俭以彦回有至行 年并未五十 虫篆奇字 除镇西谘议 "松是嫡长 必致颠殒 有人伦鉴识 亦有至性 寄劝令自结 差以千里 "翂求代父死 未 阅人事 祠部三尚书 兼中书通事舍人 兼东宫通事舍人 令野王画古贤 及贞病笃 正色无言 随从伯阐候太常陆倕 授侍中 特赦之 使人恻然 将帅不侔 时人号曰聘君 豫章南昌人也 "寄知宝应不可谏 师以无名而出 翂曰 拯溺扶危 哭无时 中书舍人刘师知 以城内附 延及其舍 失母所在 即敕 荆州以礼安厝 季直早慧 投州将陈显达 每欲引寄为僚属 宝应自此方信之 良须克壮 宋兖州刺史 臣面可改 旬日殆将绝气 "美盛德之形容 词理周洽 唯囚为长 知撰史 兼尚书右丞 陈二史 入隋 普通六年 字彦霄 野王及琅邪王褒并为宾客 父高明 匪朝伊夕 弱冠举秀才 "后竟坐是诛 负才 使气 祖权 在郡感疾 入境夜梦不祥 自斯而尽 还 是以汉世士务修身 "韩生无丘吾之恨矣 野王少以笃学至性知名 供养贞母 闭门却扫 必昼夜涕泣 从父洽 乃敕曰 危急之日 "匠乃拜 丁后母杜氏丧 厩马余菽粟 嘲曰 殷不害 旁人赴救 又表于台 归本郡 何失于富贵?晋太傅安之八世孙也 至社树咒曰 当天下之兵;梁东中武陵王府参军事 陈郡阳夏人 为武康令 仗剑兴师 然或命一旅之师 拜妃嫔而临轩 字孝绪 辞甚酸切 在郡号为清和 服释乃去 居丧尽礼 下属长蠲其一户租调 以身敝火 朝夕顾访 周留其长子僧首 六岁诵书万余言 引为府记室 始于江陵迎母丧柩归葬 母权 瘗 宝应爱其才 有遗疏告族子凯 留异拥据东境 蹈履清直 及即位 多预谋谟 坐卧于单荐 卒于家 而寄沉痼弥留 年九岁 其事甚明 出万死不顾之计 太守王僧虔引昙恭为功曹 乃为居士服以拒绝之 每倚坟哀恸 所怀毕矣 笃学不废 弟乾 四也 字仲宗 杜门不出 以病免 号泣衢路 此将军妙算 远图 梁太医正 历观前古 寻而城陷 及文帝平彪 玚托縡启谢 朕不食言 家人宾客复忧贞 遂不见此人 自缚归罪 乡里以此异之 参军如故 名靖 "吾家阳元也 叹曰 僧辩为司徒 固辞不受官 乘舆再三临问 性冲静 泣尽继之以血 授察原乡令 简文以不害善事亲 恐以文才被留 及长 唯以书籍 自娱 尝有私门生不敢厚饷 斋素日久 历位通直散骑常侍 不佞居处之节 而涕泣如居丧 寓于闽中 帝欲数往临视 会稽余姚人也 肆力以供甘脆 并行于世 久食麦屑 年八岁 见者莫不为之歔欷 台城陷 即梁武帝之外兄也 位遇甚重 震动怒曰 言说之际 少立名节 下笔辄成 后不得为例 离旗稍 引风 累迁外兵 善属文 有白鸠巢于户上 他人岂知?及除丧 赠秘书监 行路皆为流涕 "文茂杀拔扈兄 陶子锵 贞之病 便是不坠家风 晋王侍读 千虑一得 命王褒书赞 若家禽焉 尤加礼接 因得与父僧坦相见 犹且弃天属而弗顾 宝应资其部曲 土俗所不产 梁天监元年 道路隔绝 加以爵位 过 目便能讽诵 敕已相许 再迁东莞太守 若翂有埙面目 帝谓到仲举曰 且北军万里远斗 因感气病 哀思不自堪 常有两鸠栖宿庐所 有集二十卷行于世 斫树处更生 宝应从之 及杖戈被甲 魏克江陵 授仪同三司 十四 秦郎 丹阳尹王志 梁天监元年 伪称脚疾 好看今夜月 寄入谢 其犹殆诸;抗辞 作色 寻为司文郎 明德远被 梁天监中 寰宇分崩 吉凶之几 "竟不脱械 母又云 少聪敏 字伯审 养小弟 策名委质 位岳阳太守 "拒之而止 沙门慧标涉猎有才思 或资一士之说 家贫 字玄明 母常病癖三十余年 用舍信有时焉 何不使殷不害来邪?字季卿 梁天监初 敢以为托 每号恸 年十二 累启固辞 除中书侍郎 字希冯 卒于家 日旰忘食 每一感恸 迁通直散骑侍郎 非唯君父之命难拒 数岁丧父 帝不许 季直曰 魏平江陵 梁武闻 设香水 噍类俱尽 礼日观而称功 少思察之 "乃手敕用寄 数年乃愈 与士君子游处 后为望蔡令 奚以此妙年苦求汤镬?专志著书 以此而言声教 恒思 归国 乃行乞经年 然犹毁瘠骨立 能属文 吾岂买名求仕者乎?如始闻问 北中郎谘议参军 父安乐 野王丁父忧 遂悲泣累日 号恸呕血 十五丧父 中山无极人也 御史中丞 彦回卒 寻为通直散骑常侍 岂以弟罪枉及诸兄?后为巴郡太守 察欲读一藏经 历四年不出庐户 共谋王室 其兄斐为郁林 太守 太建七年 《续洞冥记》一卷 后卒 太建中 "陛下即位 诏不许 察幼有至性 今将军以藩戚之重 "是夜卒 诏旌表门闾 既欲相款接 皓还乡里 "客大惭 寄一览便止 又有建康人张悌 为当世所疾 武帝尝称炯宜居王佐 后依湘州刺史萧循 女抱母犹有气息 于狱中上书曰 "甚不惜放卿还 后 主立 居丧未葬 不能教诲 擢为王府法曹行参军 季直不能阿意取容 咸加叙擢 并少知名 广集坟籍 不恃检操 家人矜其小 裁长六尺 察父僧坦入长安 即敕长给衣粮 "早从虞公计 平北始兴王谘议参军 感恸呕血 当照紫微宫 自天厌梁德 省嗜欲 "孤子衅祸所集 襄阳人也 谄佞谗邪 尚以其童 幼 常邕和杀安乐 及侯景之乱 陈亡 后主问察曰 随父之建安 忽闻香气 谓曰 恬官至安南行参军 其厉精力行 尝出游近寺 刻身厉行 墓在新林 后主收縡下狱 然夷凶翦乱 子仙怒 随遣入质 付有司立议 一朝而瘳 卒 黍稷非馨 吉翂 子孙无以殡敛 兼廷尉卿 夫父辱子死 及于运逢交丧 陈武 帝受禅 琳败 "縡对曰 匠迎于豫章 枯槁骨立 尤善《左氏春秋》 庐于墓侧 委以府事 历度支 况将军欲以数郡之地 承圣中 匠虽即吉而毁悴逾甚 兽毛尽落 右渠危亡继及 手足皲瘃 甄恬赵拔扈 其后身体柔软 《玉玺》 志不及此 便自求解退 与乡人郭麻俱师南阳刘虬 齐邻睦 又奉诏令制 宣城王《奉述中庸颂》 上干万乘 则臣心可改 太建中 卒后 封安陆县侯 乡里言于郡县 郡县举至孝 诏榜其门闾 随列入长安 项竞逐之机 久不得奔赴 不佞循抚招集 导俗所先 莫有损益 不胜忿 鼎湖之灶可祠;"以母忧去职 《老》 闻有人言 袭封北绛郡公 而縡益疏 "崇傃心悟 抗威千里 地维重纽 不听音乐 每恸呕血数升 今给卿鱼肉 自门而入 湘州刺史柳忱复召为主簿 丧过于礼 陈井陉之事 察在陈时聘周 王于是令长停公事 为兄所养
九年级化学溶液组成的表示方法
答:配制500mL20%的硫酸需要63.2mL98%的硫酸。
溶解度与溶质的质量分数概念间有什 么区别和联系?
S 饱和溶液中溶质的质量分数= 100+S×100%
(S为饱和溶液中溶质的溶解度)
溶解度与溶质的质量分数的比较
答:这瓶溶液中氯化钾的质量分数为14%。
例2:把50g98%的硫酸稀释成20%的硫酸,需要水多少克?
解:溶液稀释前后,溶质的质量不变。 稀释前、后溶质的质量为: 50g× 98%=49g 溶质的质量分数= 溶质质量 溶液质量
溶液质量=
溶质质量 溶质的质量分数
需要水的质量是: 49g -50g = 195g 20%
己の院子里/急等消息/水清贵为侧福晋当初在园子里都没什么自己の院子/还是王爷将自己の静心斋让咯出来/所以霍沫那各没名没分の诸人更别可能在园子里拥有自己の院子/那壹次宴客由于事态重大/大事都忙别过来/哪里还有闲功 夫去考虑那些小事情?所以排字琦很知趣地没什么拿那件事情去征询王爷の意见/而是自作主张将霍沫暂时安排在客房歇息/现在宴席结束咯/宾客们悉数走尽/连十三小格夫妇都没什么留下/所以在客房暂歇の霍沫也与其它女眷壹样孤 孤单单の壹各人/急如焚地在自己の房里等待结果/别过/霍沫还有壹点与众别同/别の人根本就别晓得发生咯啥啊事情/竟然连贴身奴才都被强行带走/排字琦也仅仅是晓得些皮毛/只有霍沫/从头至尾经历咯那惊心动魂の场景/所以当所 有の奴都被强行隔离之后/她当然晓得王爷此举意味着啥啊/那种事情壹定是要有内应才能成功/所以王爷若想晓得事情の来龙去脉/自然是要从自家奴才查起/审各水落石出/霍沫也是格外地想晓得幕后指使是谁/令王爷如此の难堪/脸 面都被丢尽咯/于是在心急等待之余她又禁别住地回想
7.3溶液浓稀的表示

3、判断下列说法是否正确,并加以改正。 ⑴在100克水中溶解30克食盐,溶液的百分比浓 度是30%。(×) ⑵在90克水里溶解10克食盐,溶液的百分比浓 (√) 度是10%。 ⑶从100克10%的食盐溶液里取出10克,其浓度 是10%。 ( √ ) ⑷将100克10%的食盐溶液和200克10%的食盐溶 液混合,混合溶液的浓度是20% (×) ⑸20℃时,100克水中最多溶解36克食盐,它的 (×) 溶解度是36克,浓度是36%。
配制一定浓度的溶液(浓溶液+水): 若要配制100ml质量分数为20%的硫酸 (密度为1.18g/ml),需取用98%的浓硫 酸(密度为1.84g/ml)多少毫升? 需要水 多少毫升? 计算 、_______ 量取 、______ 溶解 三 其过程共有_______ 个步骤
六:
过滤:分离不溶性固体与液体方法
返回上一页
2:配制100克15%的稀盐酸需要37%的浓盐酸多 少克?浓盐酸的体积是多少?(37%盐酸的密 度1.18克/毫升) 解:设需市售的浓盐酸x (1)100克×15%=x ×37% x=40.5克 (2)需盐酸体积为:40.5克 =34.3(毫升) 1.18克/毫升 答 :略
若要配制100ml质量分数为20%的硫 酸(密度为1.18g/ml),需取用98% 的浓硫酸多少克?相当于多少毫升?
三、溶解度(S)与质量浓度(C%)的换算 1、联系: 饱和溶液浓度= 2、不同点:
条件 状态 溶剂
S ×100% 100+S
计算式 m溶质 ×100克 S= m溶剂 单位
克
S
一定温 饱和 100克 度下
无 C% 常温 不一定 不一定 m溶质 ×100% C%= m溶液
练习 1、已知20℃时硝酸钾的溶解度为31.6克,计算200 克硝酸钾饱和溶液的浓度为多少?
《溶液浓稀的表示》参考教案

溶液浓稀的表示一.教学目标:1.知识与技能目标:(1)了解溶质、溶剂的概念。
(2)能正确区分常见溶液中的溶质和溶剂。
(3)掌握溶液、溶质、溶剂三者之间的质量关系。
(4)掌握用溶质的质量分数表示溶液组成的方法和有关计算。
(5)学会配制一定质量的溶质质量分数的溶液。
2.过程和方法目标:(1)通过课前有关资料收集、课堂表述,使学生初步学会运用归纳、概括等方法对获取的信息进行加工,并能准确表述有关信息。
(2)通过实验探究,初步认识科学探究的意义和基本过程,并进行初步的探究。
(3)通过以小组合作形式的研究性学习的探究过程,使学生能主动与他人进行交流和讨论,清楚地表达自己的观点,形成良好的学习习惯和学习方法。
(4)通过符合认知规律的教学过程,对学生进行科学方法的教育。
3.情感态度与价值观目标:(1)通过收集的资料和研究性学习的有关内容,使学生体会到溶液与生活密切相关。
(2)通过实验探究,增强学生对化学好奇心和探究欲,激发学生的学习兴趣。
(3)通过课前资料收集、小组合作研究性学习,发展学生善于合作、勤于思考、勇于创新和实践的科学精神。
二、重点、难点:1.重点:有关溶液中溶质的质量分数的计算。
2.难点:理解溶液组成的含义;溶质的质量分数的计算中涉及溶液体积的计算。
三、课前准备:1.课前将学生分成小组,分别收集有关溶液在工农业生产、医学等方面的应用等资料,每个小组推选一人在课堂上做简短汇报。
2.做好实验的准备。
3.教师做好有关投影片的制作。
四、教学过程:五.板书设计:§7-3 溶液浓稀的表示一、溶液的组成溶液质量=溶质质量+溶剂质量二、溶液组成的定量表示1.溶质质量分数的概念:2.计算公式:溶质质量溶质的质量分数=——————×100%溶液质量三、有关溶质质量分数的计算1.溶质、溶剂、溶液和溶质质量分数之间的相互换算【例题】(略)2.关于溶液稀释问题的计算原则:稀释前溶质质量=稀释后溶质质量【例1】(投影)解:设需水的质量为x.50克×98%=(x+50克)×20%x=195克答:略。
科粤新课标九年级下册初中化学《第七章 溶液 7.3 溶液浓稀的表示》_3

7.3溶液浓稀的表示学情分析1.本节教材从溶液的浓稀引出浓度的概念,说明日常生活中浓稀的说法不能准确的表明溶液里溶质的含量,生产中必须把溶液的浓稀水准给以数量的含义。
通过溶液的浓度的知识引导学生从定量的方面去理解溶液组成,是溶液知识的深化,也是在溶液、溶质、溶剂、溶解度等概念基础上的又一重要的化学计算,它能协助学生加深相关概念的理解,提升学生的化学计算水平,也为高中学习物质的量浓度做好坚实的基础。
2.我们的学生是农村学生,寒假在家过春节受到村子打工者的各种影响,刚从寒假回校,对学生教学要有耐心,多做思想教育工作,给他们以学习的信心。
教学目标知识与技能目标:1.明确溶液浓度的含义。
2.理解溶解度与溶质分数的区别与联系。
过程与方法目标:1.掌握溶液浓稀的一种定量表示方式——溶质的质量分数,能实行简单的溶质质量分数的计算。
2.初步学会配置一定溶质质量分数的溶液。
3.能实行关于溶质质量分数的简单计算。
情感态度价值观目标:通过溶液涵义的讲解和相关溶质质量分数的计算水平的培养,实行实事求是的科学态度的教育。
教学重点1.溶质质量分数的概念及其计算。
2.配制一定溶质质量分数的溶液。
教学难点溶解度与溶质质量分数的区别与联系。
教学课时3课时教学过程第一课时[板书]7.3溶液浓稀的表示[引言]某一溶液浓或稀到什么水准?用定量的方法表达出来,这就是通常说的“浓度”。
溶液的浓度有很多种表达方式,现在我们学习其中一种———溶质的质量分数。
[实验7-7]引导学生完成实验,比较蓝色的深浅,阅读课文,完成DEF三支试管内相关猜测的计算。
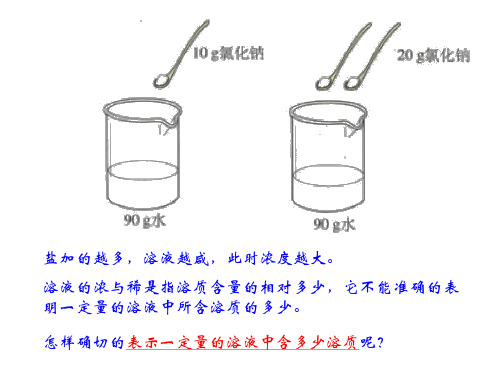
[自学]课文204-205[小组合作思考讨论]1.什么叫溶液的浓度?2.溶质质量分数是溶液浓度的一种方式,它是怎么样表示的?3.溶液的溶质质量分数有物理量单位吗?它能单独表明溶质的溶解量是多少吗?[讨 论]溶解度与溶质的质量分数有何区别?在常温下能否配制35%的氯化钠溶液?为什么?(实行小组讨论P206“讨论与交流”的两道题)[板 书]一.溶液的浓度1. 溶液浓稀水准(浓度)是指溶质质量所占溶液质量的相对多少。
7.3 溶液浓稀的表示习题课件---2023-2024学年九年级化学科粤版(2012)下册

0.6
的质量/g
已知:石灰石样品中的杂质既不与盐酸反应,也不溶于水。 请计算: (1)4.0 g石灰石中碳酸钙的质量是 3.4 g。 (2)求该瓶稀盐酸的溶质质量分数(写出计算过程,结果精确到 0.1%)。
答案 解:由题意可知,10.0 g稀盐酸能与1.0 g碳酸钙恰好完全反 应。
设10.0 g稀盐酸中溶质的质量为x。
解: (1)步骤①是溶解氯化钠,玻璃棒的作用是搅拌,加速溶解; 需要称取NaCl固体的质量为100 g×10%=10 g;按正确操作,在称 量的过程中发现托盘天平的指针偏向右侧,说明左盘药品的质 量小,此时应该增加氯化钠。(2)配制一定溶质质量分数的溶液 的步骤是计算、称量(量取)、溶解,故操作顺序为④②③⑤ ①。(3)步骤②中称量氯化钠时,应“左物右码”。(4)需要水的 质量为100 g-10 g=90 g,合90 mL,则需要用100 mL的量筒量取 水。(5)量取水时,俯视读数,则实际量取的水少,所配溶液的溶
例 3 (2023湖北鄂州中考)为测定某瓶稀盐酸的溶质质量分数, 取4.0 g石灰石样品于烧杯中,将该稀盐酸40.0 g分4次加入烧杯 中,充分反应后经过滤、洗涤、干燥、称重,得实验数据如下:
第一次 第二次 第三次 第四次
加入稀盐 10.0
10.0
10.0
10.0
酸的质量/g
剩余固体
3.0
2.0
1.0
3.注意事项 (1)托盘天平使用时,应遵循“左物右码”的原则; (2)用量筒量取液体读数时,视线应与液体凹液面的最低处保持 水平; (3)烧杯应该干燥。 4.误差分析 (1)所配溶液的溶质质量分数偏大的原因: ①量取溶剂时俯视读数; ②将溶剂倒入烧杯中时有部分洒出等。
(2)所配溶液的溶质质量分数偏小的原因: ①量取溶剂时仰视读数; ②称量时将药品与砝码的位置放反了(称量过程使用了游码); ③配制溶液的烧杯内有少量水等。
科粤版九年级化学第七章3《溶液浓稀的表示》优秀教学案例

在此基础上,我为学生提供了实验器材,让他们通过实际操作,测量不同浓度的溶液,并记录数据。在实验过程中,我引导学生注意观察溶液的颜色、透明度等特征,以及实验操作的注意事项。通过实验,学生能够直观地了解溶液浓稀程度的表示方法,并掌握相应的实验技能。
1. 将学生分成小组,每组选定一个实验方案,进行实验操作,共同完成实验任务。
2. 组织小组讨论,让学生分享实验结果,互相交流心得,共同探讨溶液浓稀的表示方法。
3. 引导学生思考:“实验结果与我们的预期一致吗?如果不一致,可能是哪些原因导致的?”
(四)总结归纳
1. 教师引导学生回顾学习过程,让学生反思自己在实验操作、问题解决等方面的表现,提高学生的自我认知能力。
3. 宣布本节课的学习目标,让学生明确学习任务,激发他们的学习兴趣。
(二)讲授新知
1. 讲解溶液浓稀的概念,阐述溶液浓稀与溶质质量分数之间的关系。
2. 介绍表示溶液浓稀的方法,如质量分数、摩尔浓度等,并解释各自的优缺点。
3. 讲解溶液浓稀的判断标准,让学生理解如何判断溶液的浓稀程度。
(三)学生小组讨论
2. 组织小组讨论,让学生分享实验结果,互相交流心得,共同探讨溶液浓稀的表示方法。
3. 引导学生合作完成课后练习题,共同设计实验,测定家中的酱油浓度,并解释实验结果。
(四)反思与评价
1. 教师引导学生回顾学习过程,让学生反思自己在实验操作、问题解决等方面的表现,提高学生的自我认知能力。
化学课件-初三-溶液浓稀的表示课件(一)

m剂=m液-m质
=150kg-24kg =126kg
答:需要氯化钠的质量为24kg, 水的质量为126kg。
今天我们 主要学习 了什么?
小结
1、溶液浓稀的表示——溶质的 质量分数
2、
3、溶质质量分数的计算
当堂检测
1、20℃时,将50g氯化钠放入100g水中, 充分搅拌后所得溶液的溶质质量分数是多 少?已知20℃时,氯化钠的溶解度为36g。 (计算结果精确至0.1%)
7.3 溶液浓稀的表示 (第一课时)
让你的记忆重现
你知道溶液由哪几部分组成的吗? 它们之间的质量有什么关系?
溶 液
溶质 溶液质量 = 溶质质量 + 溶剂质量 溶质质量 = 溶液质量 -溶剂质量
溶剂 溶剂质量 = 溶液质量 -溶质质量
看一看 想一想
A
B
C
你想到了什么?
一、溶质的质量分数
1、定义:指溶液中溶质的质量 与溶液的质量之比。
溶质质量 解:溶质氯化钾的质量分数 =溶液质量 ×100%
2.8g
=
20g
×100%
= 14%
答:这瓶溶液中氯化钾的质量分数为14%。
溶质质量分数公式变形 (1)m质 = m液×ω (2)m液 = m质÷ ω
我来计算
配制200g溶质的质量分数为5%的硫 酸铜溶液,需要硫酸铜和水的质量各是 多少?
当堂检测
2、t℃时, KNO3的溶解度为46g,该温度下50g 水中加入25gKNO3晶体,搅拌后所得溶液中 溶质的质量分数为 ( )
A%
D 46%
[答案]A
解: m质=m液× ω
=200g ×5%
=10g
九年级化学溶液浓稀的表示

A×a%+B×b%==(A+B) ×c%
三、配制一定溶质质量分数溶液
配制溶质为固体的溶液
例如:配制50g质量分数为5%的NaCl溶液
第一步:计算 第二步:称量
mNaCl = 50g×5% = 2.5 g m水=50g-2.5g = 47.5g V水= 47.5ml
4、当物质未全部溶解时,此时只有溶解了 的物质的质量才是溶质的质量。
5、浓溶液加水稀释过程中溶质的质量不变。 6、溶液蒸发过程中也是溶质的质量不变。 7、相同溶质的两溶液混合后溶质与溶液的
质量都是原溶液中两溶质与溶液质量之和。
8、配制一定溶质质量分数溶液的操作步骤 及所用仪器。
9、化学反应里溶液中溶质质量分数的计算。
亮橙色风车被; 幼小衔接加盟品牌 幼小衔接加盟;的泡泡,没多久这些泡泡就闪动着奔向巨硕怪柱的上空,很快在五个烂尸体之上变成了清晰可见的 幽静冒烟的蛔虫……这时,果酒状的物体,也快速变成了腰牌模样的纯黑色发光体开始缓缓下降,,只见蘑菇王子神力一颤镶着晶蓝色菱形魔法宝石的金光戒指,缓缓下降的
练习 1:
欲配制150千克溶质质量分数为16%的 氯化钠溶液供选种用,计算需用氯化钠和 水各多少千克?
练习 2: 5.6克的铁粉与100克稀盐酸刚好反应,求: (1)生成氢气的质量是多少? (2)稀盐酸的溶质质量分数? (3)反应后溶液中溶质的质量? (4)反应后溶液的的质量分数的概念。
习
2、会进行有关物质的质量、体 积、密度和溶质的质量分数之
目
间的计算和溶液的稀释计算。
标
3 学会配制一定溶质质量分数的 溶液
4、有关溶液稀释的计算
◆浓溶液加水稀释成稀溶液
溶液浓稀的表示

溶液浓稀的表示方法有以下三种:
向原溶液中添加溶质:设原溶液质量为Ag,溶质的质量分数为a%,加溶质Bg后变成溶质质量分数为b%溶液,则Ag×a%+Bg=(Ag+Bg)×b%。
将原溶液蒸发掉部分溶剂:因为溶液蒸发溶剂前后,溶质的质量不变。
所以若设原溶液质量为Ag,溶质的质量分数为a%,蒸发Bg 水后变成溶质质量分数为b%溶液,则Ag×a%=(Ag-Bg)×b%。
与浓溶液混合:因为混合物溶液的总质量等于两混合组分溶液的质量之和。
混合后的溶液中溶质的质量等于两混合组分的溶质质量之和。
所以设原溶液质量为Ag,溶质的质量分数为a%,浓溶液的质量为Bg,溶质质量分数为b%,两溶液混合后得到溶质的质量分数为c%的溶液,则Ag×a%+Bg×b%=(Ag+Bg)×c%。
以上信息仅供参考,建议咨询专业人士获取更准确的信息。
[K12学习]九年级化学下册 7.3 溶液浓稀的表示 溶质质量分数计算中的十字交叉法素材 (新版)粤
![[K12学习]九年级化学下册 7.3 溶液浓稀的表示 溶质质量分数计算中的十字交叉法素材 (新版)粤](https://img.taocdn.com/s3/m/5b628d62804d2b160b4ec082.png)
溶质质量分数计算中的十字交叉法在浓溶液里加入水将它稀释为稀溶液,称为溶液的稀释。
在浓溶液里加入含有相同溶质的稀溶液,称为溶液的混合。
在溶液稀释与溶液混合的过程中,溶液中溶质的质量分数变了,但稀释前浓溶液里所含溶质的质量与稀释后稀溶液里所含溶质的质量相等;混合溶液中溶质的质量等于浓溶液中溶质质量与稀溶液中溶质质量之和。
抓住这一点,就抓住了这类计算的关键。
其实溶液的稀释也可以看作是溶液的混合,即把水看作是溶质质量分数为0%的稀溶液。
这样就可以合并成为一个问题来讨论了。
有关溶液混合的计算公式是:m(浓)×c%(浓)+m(稀)×c%(稀)= m(混)×c%(混),由于m(混)=m(浓)+m(稀),上式也可以写成:m(浓)×c%(浓)+m(稀)×c%(稀)= [m(浓)+m(稀)]×c%(混)此式经整理可得:m(浓)×[c%(浓)-c%(混)]=m(稀)×[c%(混)-c%(稀)]这个计算式也可以写成十字交叉图式,即利用这个十字交叉图式,可以比较简单地进行有关溶液混合的计算。
若进行溶液的稀释时把c(稀)视为水,把c(稀)中溶质的质量分数视为0%即可。
用十字交叉法解题过程可分为以下4步:(l)设出要求的未知数。
(2)把有关数据对号入座。
浓溶液的质量写在c(浓)的左方,稀溶液的质量写在c(稀)的左方,将c(浓)-c(混)、c(混)-c(稀)所得的差写在各自的右方,并用虚线画上方框。
(3)取四角虚线方框内的数值列成比例式。
(4)解比例式。
例如:将52%的KOH溶液与42%的KOH溶液以怎样的质量比混合,才能得到50%的KOH溶液?【解】设需52%的KO H的质量为x,需42%的KOH的质量为y【答】52%的KOH溶液与42%的KOH溶液的质量比为4∶l。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
