链反应动力学思考题
第六章-化学反应动力学习题解答

第六章 化学反应动力学思考题解答一、是非题(判断下列说法是否正确,并说明理由)1. 错2. 对3. 错4. 错5. 错6. 错7. 对8. 对9.错 10. 对 二、选择题1. B2. A.3. B.4. D. 5 .C 6.D. 7. A. 8. B 9. B. 10. C.习题解答1.请根据质量作用定律,写出下列各基元反应或复合反应中Ad d c t与各物质浓度的关系。
(1)2A + B 2P k−−→ (2)A + 2B P + 2S k−−→ (3)22A + M A M k−−→+ (4)2A B (5)2A 2B+D B+A 2D(6)解:(1)2A A B d 2d c kc c t -= (2)2A A Bd d c kc c t -=(3)2A A M d 2d c kc c t -= (4)2A 2B 1A d 2+2d c k c k c t -=- (5)222A 1B D 1A 2A B 2D d 2+2+d c k c c k c k c c k c t ---=--(6)A 1A 2A 3C d d ck c k c k c t-=+-2.某人工放射性元素放出α粒子,半衰期为15min 。
试问多长时间后该试样能分解掉80%。
解:由题意得该反应为一级反应,符合一级反应的条件,则112ln 2t k =得 1k = ln 215=0.0462mol -1 由积分定义式 1ln ak t a x=- 令0.8xy a==得 11ln 1k t y =- 则 t=34.84mink 1 k-1 k 1 k-1 k k3.反应25222N O (g)4NO (g)O (g)−−→+,在318K 下测得N 2O 5的浓度如下: t /min 0 20 40 60 80 100 120 140 160 c /mol·m -317.69.735.462.951.670.940.500.280.16求该反应的级数和速率常数及半衰期。
高分子化学--各章思考题

高分子化学思考题第一章 绪 论(思考题)1、解释下列名词或术语:高分子化合物:由许多简单的结构单元通过共价键连接起来的,分子量410~610的大分子所组成的化合物。
聚合物:即是高分子,其分子量高达410~610。
单体:能够形成高分子化合物中结构单元的低分子化合物。
结构单元:构成高分子链并决定高分子结构以一定方式连接起来的原子组合。
重复单元:聚合物中化学组成相同的最小单位的重复单元。
单体单元:聚合物中具有与单体相同化学组成而不同电子结构的单元。
链节:即是重复单元的俗称。
聚合度:即是重复单元数。
热塑性聚合物:线形或支链形大分子以物理力聚集成聚集成聚合物,加热时可熔融,并能溶于适当溶剂中。
热固性聚合物:有不少聚合物或预聚物,在树脂合成阶段,须控制原料配比和反应条件,使停留在线形或少量支链的低分子阶段(预聚阶段)。
在成型阶段,经加热再使其中潜在的活性官能团继续反应成交联结构而固化。
分子量分布指数:分子量和结构的多分散性 连锁聚合反应 逐步聚合反应2、高分子化合物和低分子化合物的根本区别是什么?与低分子化合物比较,高分子化合物有哪些主要特征?3、能否用蒸馏或重结晶的方法提纯聚合物?为什么?举例说明提纯聚合物的方法。
4、请写出聚合物的聚合度和分子量的关系式,试述聚合物平均分子量和分子量分布的表示方法,并简述产生分子量多分散性的原因。
5、高分子链结构的形状有哪几种?它们的物理机械性能各有哪些特点?6、化学组成和平均分子量都相同的聚合物,其物理机械性能是否相同?为什么?7、作为材料使用的聚合物,其分子量高些好还是低些好?分子量分布宽些好还是窄些好?说明理由。
8、衡量聚合物耐热性的重要指标是什么?聚合物的耐热性受哪些因素的影响?它们与高分子化学有何关系?9、试述聚合物的命名和分类方法。
10、试述常见的几种塑料、橡胶、纤维的名称(包括缩写符号)、结构式及其单体。
第二章自由基聚合反应(思考题)1、解释下列名词或术语:序列结构等活性理论凝胶效应动力学链长数均聚合度分子量调节剂引发剂引发效率引发剂半衰期诱导分解笼蔽效应诱导期阻聚剂缓聚剂聚合上限温度2、自由基聚合中,为什么聚合物链中单体单元大部分按头-尾方式连接,且所得聚合物多为无规立构?3、试述聚合反应时如何选择合适的引发剂,及怎样确定其用量?4、用悬浮法生产PVC时,为什么要采用高活性和中活性并用的引发体系?5、试推导引发剂引发时的聚合速率方程、动力学链长、数均聚合度的表达式。
化学动力学习题

第5章化学动力学习题一、思考题1.化学反应速率是如何定义的反应速率方程如何表达2.影响反应速率的因素有哪些3.如何加快均相和多相反应的反应速率4.质量作用定律适用于什么样的反应5.能否根据反应方程式直接写出反应速率方程式为什么6.速率常数受哪些因素的影响浓度和压力会影响速率常数吗7.什么是反应级数零级反应和一级反应各有什么特征8.一个反应的活化能为180 kJ·mol-1,另一个反应的活化能为48 kJ·mol-1。
在相似的条件下,这两个反应中哪一个进行较快些为什么9.为什么说使用催化剂不会改变体系的热力学性能10.为什么不同的反应升高相同的温度,反应速率提高的程度不同11.是不是对于所有的化学反应,增加任意一个反应物的浓度都会提高反应速率为什么12.碰撞理论和过渡态理论的基本要点是什么两者有什么区别13.何为反应机理你认为要想了解反应机理,最关键是要怎么做14.试解释浓度、压力、温度和催化剂加快反应的原因。
15.总压力与浓度的改变对反应速率以及平衡移动的影响有哪些相似之处有哪些不同之处举例说明。
16.比较“温度与平衡常数的关系式”同“温度与反应速率常数的关系式”,有哪些相似之处有哪些不同之处举例说明。
17.反应2NO(g)+2H2(g)=== N2(g)+2H2O(g)的速率方程是r = k c2(NO)c(H2)试讨论以下各种条件变化时对反应速率的影响(1)NO的浓度增加1倍;(2)有催化剂参加;(3)升高温度;(4)反应容器的体积增大1倍18.对于下列平衡体系:C (s) + H2O (g) = CO (g) + H2(g),q为正值。
(1) 欲使平衡向右移动,可采取哪些措施(2) 欲使(正)反应进行得较快(平衡向右移动)的适宜条件如何这些措施对K及k(正)、k(逆)的影响各如何二、是非题(对的在括号内填“√”号,错的填“×”号)1.反应速率常数仅与温度有关,与浓度、催化剂等均无关系。
化学反应工程思考题详解

第一章 应用化学反应动力学及反应器设计基础 一、思考题1、间歇系统与连续系统中,反应速率的定义式有何异同?2、反应系统中反应速率与化学计量系数有何关系?3、反应速率可以用浓度c i 、分压p i 或摩尔分率y i 来表述,相应的速率常数k c 、k p 、k y 之间有何关系?4、温度增加,反应速率常数肯定增加,对否?5、空速的定义是什么?它的大小反映了反应器的什么能力?6、转化率的定义是什么?在复杂反应系统中,它是否能起到在简单反应系统中所起到的作用?7、化学反应中哪种吸附起主要作用?8、惰性物质不参加反应,所以对吸附、脱附无任何影响,对否?9、吸附或脱附为控制步骤时,关键组分A 的分压有何特点,非关键组分的分压有何特点? 10、表面反应为控制步骤时,反应物、生成物的分压有何特点? 11、表达反应系统体积变化的参数是什么?12、方程式中反应前后摩尔数的变化是否表示反应体积的变化?第二章 气-固相催化反应本证及宏观动力学 一、思考题1、对于球形催化剂,西勒模数(Thiele )越大,则催化剂的内扩散有效因子如何变化?2、如果在某催化剂上测得的反应速率为r ,而内扩散有效因子为0.8,则此反应速率是否为本征反应速率?3、对于气—固相反应,什么情况下,可以不考虑分子扩散的影响?4、对于球型催化剂粒子,西勒模数的定义式是什么?5、本征化学反应速度在内外扩散阻力完全消除的情况下与宏观化学反应速度有何关系?6、孔结构对内扩散有无影响?7、在气体的扩散过程中,如果催化剂的孔径远远小于分子的平均自由程时,可以不考虑哪种扩散? 8、对于气-固相反应,如果本征动力学方程式为r ,催化剂的内扩散有效因子为ζ,则宏观动力学方程式应如何表示? 二、计算题1、某可逆反应:A B C D k k +⇔+21,其均匀表面吸附机理的动力学方程式为:()()()r k P P P P K b P b P bP b P A A B C D A A C CBB D D=-++++1122试写出反应机理及控制步骤,并证明之。
物理化学答案——第九章-化学动力学基础
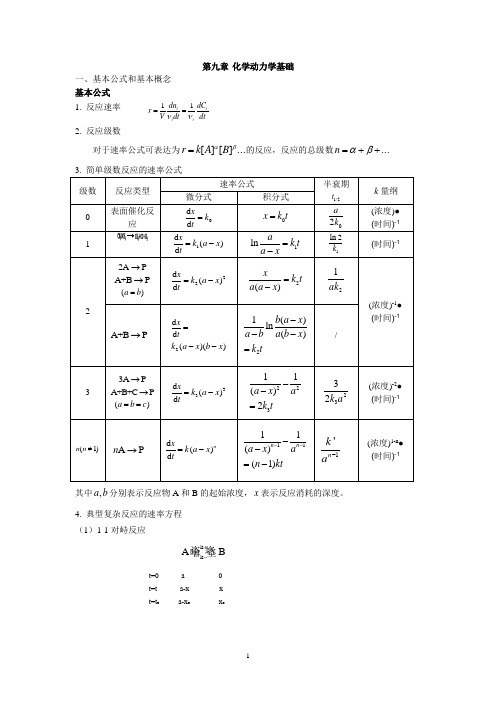
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
第5章 化学动力学习题

第5章化学动力学习题一、思考题1.化学反应速率是如何定义的?反应速率方程如何表达?2.影响反应速率的因素有哪些?3.如何加快均相和多相反应的反应速率?4.质量作用定律适用于什么样的反应?5.能否根据反应方程式直接写出反应速率方程式?为什么?6.速率常数受哪些因素的影响?浓度和压力会影响速率常数吗?7.什么是反应级数?零级反应和一级反应各有什么特征?8.一个反应的活化能为180 kJ·mol-1,另一个反应的活化能为48 kJ·mol-1。
在相似的条件下,这两个反应中哪一个进行较快些?为什么?9.为什么说使用催化剂不会改变体系的热力学性能?10.为什么不同的反应升高相同的温度,反应速率提高的程度不同?11.是不是对于所有的化学反应,增加任意一个反应物的浓度都会提高反应速率?为什么?12.碰撞理论和过渡态理论的基本要点是什么?两者有什么区别?13.何为反应机理?你认为要想了解反应机理,最关键是要怎么做?14.试解释浓度、压力、温度和催化剂加快反应的原因。
15.总压力与浓度的改变对反应速率以及平衡移动的影响有哪些相似之处?有哪些不同之处?举例说明。
16.比较“温度与平衡常数的关系式”同“温度与反应速率常数的关系式”,有哪些相似之处?有哪些不同之处?举例说明。
17.反应2NO(g)+2H2(g)=== N2(g)+2H2O(g)的速率方程是r = k c2(NO)c(H2)试讨论以下各种条件变化时对反应速率的影响(1)NO的浓度增加1倍;(2)有催化剂参加;(3)升高温度;(4)反应容器的体积增大1倍18.对于下列平衡体系:C (s) + H2O (g) = CO (g) + H2(g),q为正值。
(1) 欲使平衡向右移动,可采取哪些措施?(2) 欲使(正)反应进行得较快(平衡向右移动)的适宜条件如何?这些措施对K及k(正)、k(逆)的影响各如何?二、是非题(对的在括号内填“√”号,错的填“×”号)1.反应速率常数仅与温度有关,与浓度、催化剂等均无关系。
高分子化学思考讨论题

高分子化学思考讨论题第一章绪论1、与低分子化合物相比,高分子化合物有什么特征?2、何谓高聚物?何谓低聚物?3、简要解释重复单元、结构单元、单体单元、单体和聚合度的含义。
4、什么叫热塑性?什么叫热固性?试举例说明。
5、什么叫等规(全同立构)、间规(间同立构)和无规聚合物?试举例说明。
6、高分子链结构形状有几种?它们的物理、化学性质有何不同?7、何谓相对分子质量的多分散性?如何表示聚合物相对分子量的多分散性?试分析聚合物相对分子质量多分散性存在的原因。
8、数均分子量和重均分子量的物理意义是什么?试证明:≥。
9、聚合度和相对分子量间有什么关系?计算中对不同聚合反应类型的聚合物应注意什么?试举例说明。
10、如何用实验测定一未知单体的聚合反应是以逐步聚合还是按连锁聚合机理进行的。
11、有下列所示三成分组成的混合体系。
成分1:质量分数=0.5,相对分子质量=1×104成分2:质量分数=0.4,相对分子质量=1×105成分3:质量分数=0.1,相对分子质量=1×106求这个混合体系的数均分子量和重均分子量及相对分子质量分布宽度指数。
第二章自由基聚合1、总结烯类单体的聚合特征得到以下规律:(1)能形成聚合物的主要是乙烯、乙烯的一元取代物、乙烯的1,1-二元取代物。
乙烯的1,2-二元取代物除个别外一般不聚合。
(2)大部分烯类单体能按自由基机理聚合,只有少部分按离子型机理聚合。
(3)有些单体能按自由基、阳离子和阴离子机理进行聚合。
请对以上情况加以分析说明。
2、解释为什么引发剂的活性次序一般为:过氧化二碳酸酯类>过氧化二酰类>过氧化酯类>过氧化二烷基类3、过硫酸盐无论在受热、受光或受还原剂作用下均能产生SO4¯•?如果需要随时调整反应速度或随时停止反应,应该选择何种方式产生SO4¯•?如果工业上要求生产分子量很高的聚合物,聚合温度尽量低,则应选择何种方式产生这种自由基?4、在自由基聚合中,为什么聚合物链中单体单元大部分按头尾方式连接,且所得的聚合物多为无规立构。
物理化学核心教程(第二版)思考题习题答案—第7章 化学动力学

第七章化学反应动力学一.基本要求1.掌握化学动力学中的一些基本概念,如速率的定义、反应级数、速率系数、基元反应、质量作用定律和反应机理等。
2.掌握具有简单级数反应的共同特点,特别是一级反应和a = b的二级反应的特点。
学会利用实验数据判断反应的级数,能熟练地利用速率方程计算速率系数和半衰期等。
3.了解温度对反应速率的影响,掌握Arrhenius经验式的4种表达形式,学会运用Arrhenius经验式计算反应的活化能。
4.掌握典型的对峙、平行、连续和链反应等复杂反应的特点,学会用合理的近似方法(速控步法、稳态近似和平衡假设),从反应机理推导速率方程。
学会从表观速率系数获得表观活化能与基元反应活化能之间的关系。
5.了解碰撞理论和过渡态理论的基本内容,会利用两个理论来计算一些简单反应的速率系数,掌握活化能与阈能之间的关系。
了解碰撞理论和过渡态理论的优缺点。
6.了解催化反应中的一些基本概念,了解酶催化反应的特点和催化剂之所以能改变反应速率的本质。
7.了解光化学反应的基本定律、光化学平衡与热化学平衡的区别,了解光敏剂、量子产率和化学发光等光化反应的一些基本概念。
二.把握学习要点的建议化学动力学的基本原理与热力学不同,它没有以定律的形式出现,而是表现为一种经验规律,反应的速率方程要靠实验来测定。
又由于测定的实验条件限制,同一个反应用不同的方法测定,可能会得到不同的速率方程,所以使得反应速率方程有许多不同的形式,使动力学的处理变得比较复杂。
反应级数是用幂函数型的动力学方程的指数和来表示的。
由于动力学方程既有幂函数型,又有非幂函数型,所以对于幂函数型的动力学方程,反应级数可能有整数(包括正数、负数和零)、分数(包括正分数和负分数)或小数之分。
对于非幂函数型的动力学方程,就无法用简单的数字来表现其级数。
对于初学者,要求能掌握具有简单级数的反应,主要是一级反应、a = b的二级反应和零级反应的动力学处理方法及其特点。
思考题全 (1)

第一章第一节1.什么叫烃类热裂解过程的一次反应和二次反应?答:一次反应:由原料烃类经热裂解生成乙烯和丙烯的反应。
二次反应:主要是指一次反应生成的乙烯,丙烯等低级烯烃进一步发生反应生成多种产物,甚至最后生成焦或碳2.简述一次裂解反应的规律性。
答:1) 同碳原子数的烷烃,C-H键能大于C-C键能,故断链比脱氢容易。
2) 碳链越长的烃分子越容易断链。
3) 烷烃的脱氢能力与分子结构有关。
叔氢最易脱去,仲氢次之,伯氢又次之。
4) 有支链的烃容易断链或脱氢。
3.烃类热裂解的一次反应主要有哪几个?烃类热裂解的二次反应主要有哪几个?答:一次反应有:1) 烃热裂解:脱氢反应、断链反应2) 环烷烃热裂解:开环反应3) 芳香烃热裂解:脱氢缩合反应、断侧链反应4) 烯烃热裂解:断链反应、脱氢反应二次反应主要有:1) 烯烃的裂解(即二次反应—断链)2) 烯烃的聚合、环化、缩合与生焦反应3) 烯烃的脱氢和加氢反应4) 烃分解生碳4. 什么叫焦,什么叫碳?结焦与生碳的区别有哪些?答:有机物在惰性介质中经高温裂解,释放出氢或其它小分子化合物生成碳,并非独个碳原子,而是以若干碳原子稠合形式的碳,称为生碳。
若产物中尚含有少量氢,碳含量约为95%以上,称为结焦。
结焦是在较低温度下﹙<1200K﹚通过芳烃缩合而成,生碳是在较高温度下﹙>1200K﹚通过生成乙炔的中间阶段,脱氢为稠和的碳原子。
5. 试述烃类热裂解的反应机理。
答:热裂解的自由基反应机理:C2H6→C2H4+H26. 什么叫一级反应?写出一级反应动力学方程式和以转化率表示的动力学方程式。
答:一级反应:反应速度与浓度的一次方成正比一级反应动力学方程式:r=-dc/dt=kc以转化率表示的动力学方程式:㏑[β/(1-α)]=ktβ—体积增大率,它随转化深度而β=裂解气体积(标准态)/原料气体积(标准态)第一章第二节1. 烃类裂解有什么特点?答:1) 高温(反应温度高,一般为800℃以上,最高快可达900℃以上)2) 强吸热反应3) 短停留时间4) 低烃分压2. 裂解供热方式有哪两种?答:直接供热和间接供热。
物理化学-高盘良267-281第十六章链反应动力学

第16章链反应动力学主 要 公 式平均链长: ()l =链的传递速率链的引发或终止速率()16.6.1例 题 解 析例 16.1 791 K 乙醛气相热分解反应3CH CHO =4CH CO +在不同乙醛的初始压力Οp 下的反应初速数据如下:ΟPa p 11.29 15.52 20.11 28.37 34.26 48.40 57.79 70.931ΟPa s r -⋅6.40 10.13 1 5.86 23.99 36.26 50.25 74.25 95.44(1) 求乙醛热分解的反应级数;(2) 若乙醛热分解是按下述反应历程进行:3CH CHO 3CH ·+CHO 1k 11318kJ mol E -=⋅ 3CH ·3 CH CHO + 43CH CH CO +· 2k 1241.8kJ mol E -=⋅ 3CH CO · 3CH ·CO + 3k 1375.3kJ mol E -=⋅ 3CH ·3 CH +·26C H 4k 40E = 请利用稳态近似求该反应的速率方程,是否与(1)相一致?并求算表现活化能a E 。
(3) 实验求得表现活化能,今已知键能数据为:()1C C 356kJ mol E --=⋅,()1C H 423kJ mol E --=⋅请估算表现活化能,并与实验相对照。
解析: (1) 根据 ()3CH CHO n r kp =,可得{}{}{}ΟΟln ln ln r k n p =+将实验数据转化为ln(p 0/Pa) 9.33 9.65 9.91 10.25 10.44 10.79 10.96 11.17()1Οln Pa s r -⋅1.862.32 2.763.18 3.59 3.924.31 4.56作ln r 0-ln p 0图,由斜率可得n =1.5。
(2) 应用稳态近似时,只用各反应组分的消耗速率与生成速率,不是写元反应的反应速率。
练习题与思考题练习题与思考题以春季学期期末考核为例第

练习题与思考题(以2011春季学期期末考核为例)第一章绪论1、常规能源与新能源的辨析。
2、一次能源与二次能源怎么区别?3、举例说明一次能源。
4、核能在中国是否为新能源?5、天然气、煤炭、地热、生物质、太阳能等哪些能源可以作为终端能源使用?6、核能、可燃冰是否为清洁能源?7、钠/铜/镁在氯气中的剧烈反应、氢气与氯气的反应、燃放烟花爆竹是否为燃烧?8、将图1-2中装有预混可燃气体的瓶子瓶口向上,火焰传播方向会怎样变化,传播速度会变化吗?把瓶子立在90℃的水中传播速度会变化吗?9、粗细不同而长度一样的蜡烛燃尽时间一样吗,为什么?10、结合蜡烛燃烧火焰的分析如何判断蜡烛(燃烧)质量?11、试分析蜡烛芯对蜡烛燃烧的影响?12、蜡烛火焰的结构及温度大小?第二章燃料1.什么是燃料,它应具备哪些基本要求?2.燃料的可燃与不可燃部分各包含哪些主要成分?3.什么是煤的元素分析和工业分析?4.什么是燃料的发热量?弹筒发热量、高位发热量、低位发热量?5.煤中各元素对燃烧的影响如何?6.煤的各种分析基准,符号以及换算?7.为什么要对煤进行工业分析?8.如何进行挥发分测定?煤中的挥发分是定值还是变值?9.煤灰在变形温度、软化温度和流动温度下有什么特征?10.何为煤的高位发热量和低位发热量?工业应用中一般利用哪一种发热量?11.VAWST代表什么?12.工业锅炉行业煤主要以什么指标进行分类?练习题1、查阅资料,自己找出一种固体燃料,给出元素分析成分和工业分析成分,根据不同基准之间相互换算的原则,将该燃料的元素分析成分由一种基准变换到另一种基准。
2、查阅资料,详细说明影响灰的结渣温度和结渣状态的主要因素有哪些?第三章燃烧计算思考题1.何为煤的理论燃烧温度?2.煤的理论燃烧温度主要有那些量决定?3.煤的低位发热量、过量空气系数、空气中的氧浓度、以及煤和空气的温度对煤的理论燃烧温度有什么影响?第四章(a燃烧热力学)1、燃烧学中如何应用热力学第一定律——计算热效应,反应前后的绝对焓(总焓)相等,计算绝热燃烧温度2、燃烧学中如何应用热力学第二定律——采用熵函数判断燃烧化学反应的方向和化学反应的平衡条件。
化学反应工程实验思考题部分答案

1.本证动力学与宏观动力学有何区别?答:化工动力学是研究反应速率与操作参数(浓度、温度、压力和停留时间等)之关系的规律。
若只涉及化学反应本身的速率与反应组分浓度、温度、催化剂和溶剂种类的影响,则称为本征动力学,又称微观动力学、反应固有动力学(相对于表观动力学而言),排除流动、传质、传热等传递过程影响条件下的反应动力学,描述化学反应本身的规律。
相应的反应速率和速率方程,称为本征反应速率和本征速率方程。
答:本征动力学是指排除流动、传质、传热等传递过程影响条件下的反应动力学,描述化学反应本身的规律。
相应的反应速率和速率方程,称为本征反应速率和本征速率方程。
本征速率方程在形式上和表观速率方程并无差别,但方程中变量和参数的物理意义不相同。
宏观动力学是指反应器传递过程影响下的反应动力学。
相应的反应速率和反应速率方程称为表观反应速率和表观速率方程。
表观速率方程和本征速率方程的形式并无差别,但方程中的变量和参数的物理意义不同。
2.无梯度反应器属于微分反应器还是积分反应器?为什么?答:微分反应器。
因为当反应物系连续流过反应器后,由于催化剂床层很矮,反应压力、温度、浓度都接近常数不变,其组成无明显的变化,保证了本征试验所需的理想条件,即反应器内流体相中无浓度梯度,此种反应器称为微分反应器。
因为物系组成无明显的变化,反应热效应很小,若不计入热损失,微分反应器内流体相中也不存在温度梯度,因此,微分反应器又称为无梯度反应器。
当反应物系借助于安装在微分反应器体内的循环泵而循环流动时,称为内循环微分反应器。
实验室研究固体催化剂使用的流动型固定床管式反应器也称微分反应器。
通常包括单纯流动法和循环流动法两种形式。
无梯度反应器内循环无梯度反应器是一种气–固催化反应装置,它既能消除催化床层间的浓度和温度梯度,又能克服由于转化率低而造成的成份分析困难,从而可以取得准确的动力学数据,但对热效应较大的体系,数据精确性较差。
3反应速度的影响因素有哪些?答:浓度、温度、压力、催化剂。
作业 高分子化学

1、思考题:动力学链长的定义是什么?与平均聚合度有何关系?链转移反应对动力学链长和聚合度有何影响?试举 2-3 例说明利用链转移反应来控制聚合度的工业应用,试用链转移常数数值来帮助说明。
2、计算题:若在 1000 mL 甲基丙烯酸甲酯中加入 0.242 g 过氧化苯甲酰,于 60 o C 下聚合,反应 1.5 h 得聚合物 30 g ,测得其数均分子量为 831500,已知 60 o C 下过氧化苯甲酰的半衰期为 48 h ,引发效率 f =0.8,C I =0.02,C M =0.1x10-4,甲基丙烯酸甲酯的密度为 0.93 g/mL ,过氧化苯甲酰分子量为 242。
计算:(1)甲基丙烯酸甲酯在 60 o C 下的 k p 2/k t 值;(2)动力学链长;(3)歧化终止和偶合终止所占的比例1、 在聚合动力学研究中,常将一个活性种从引发开始到链终止所消耗的单体分子数定义为动力学链长ν。
聚合物平均聚合度Xn ----和动力学链长的关系与终止方式有关:偶合终止,Xn ----=2ν;歧化终止,Xn ----=ν;兼有两种终止方式,则ν<Xn ----<2ν,可按下式计算:Xn ----=ν/(C/2+D),其中C.D 分别代表偶合终止和歧化终止的分数。
平均聚合度就是链增长速率与形成大分子的所有链终止(包括链转移)速率之比,所以平均聚合度和动力学链长均会相对减小。
举例:丁苯橡胶的分子量有十二硫醇的用量来调节;聚氯乙烯分子量主要决定于向单体转移,由聚合温度来控制,温度升高链转移常数增加,分子量下降2、解:(1)Rp=ԁ[M]/ԁt= (30/100)/(1.5×3600)=5.56×10^(-5)mol/(l·s) 由已知可得Kd=ln2/(48×3600)=4×10^(-6)mol/(l·s)物质一位反应物,[M]=930/100=9.3mol/L物质二作为引发剂,[ I ]=0.242/242=0.001mol/L根据公式: Rp=Kp(f·Kd/Kt)½[M][I]½解之得:Kp ²/Kt ≈ 0.011mol/(l·s)(2)由公式:ν=Kp ²[M]²/(2KtRp)解之得 ν≈ 8556(3)由已知可知Xn -------=831500/100解之得 Xn -----=8315又因为 1/Xn -------=1/(Xn -------)0+C M+C I [I]/[M]其中(Xn -------)0为动力学链终止对数均聚合度的贡献解之得 :(Xn -------)0=9249又因为(Xn ----)0=ν/(C/2+D),其中C.D 分别代表偶合终止和歧化终止的分数。
燃烧理论思考题

《燃烧工程》思考题第一章煤的基本性质第一节煤的成分与表示方法1.煤中的主要成分是什么?其中的有机可燃质主要包括什么?2.收到基、空气干燥基、干燥基和干燥无灰基成分的表示方法?3.不同基煤的成分换算关系如何?第二节煤的分析1.煤的元素分析和工业分析分别分析什么?2.为什么要对煤进行工业分析?3.如何进行挥发分测定?煤中的挥发分是定值还是变值?4.煤灰在变形温度、软化温度和流动温度下有什么特征?5.何为煤的高位发热量和低位发热量?工业应用中一般利用哪一种发热量?6.不同基之间的发热量如何进行转换第三节煤的分类1.根据煤的碳化程度可将其分为几类?他们分别是什么?2.烟煤、无烟煤的最大特点是什么?3.V AWST代表什么?其高、中、低值如何区分?4.工业锅炉行业煤主要以什么指标进行分类?第四节煤的理论燃烧温度1.何为煤的理论燃烧温度?2.煤的理论燃烧温度主要有那些量决定?3.煤的低位发热量、过量空气系数、空气中的氧浓度、以及煤和空气的温度对煤的理论燃烧温度有什么影响?第二章煤燃烧化学反应动力学基础第一节化学反应的分类1.什么是简单反应、复杂反应、可逆反应、平行反应、串联反应、链锁反应?第二节化学反应速率及其方程式1.什么是质量作用定律?它的使用范围?第三节反应级数1.什么是反应级数?什么是零级反应、一级反应、二级反应、三级反应?2.一级反应、二级反应的速率方程?一级、二级反应的特点?3.反应级数与反应分子数有什么不同?第四节阿累尼乌斯定律及活化能1.常见的反应速率与温度关系的五种类型?2.什么是阿类尼乌斯定律?它的使用范围?3.什么是活化分子?活化能?活化能的大小说明了什么?第五节反应速率的理论1.什么是碰撞频率、有效碰撞频率、有效碰撞份额?2.什么是活化络合物?第六节影响化学反应速率的因素1.活化能的大小对化学反应速率有何影响?2.温度对化学反应速率有何影响?3.反应物浓度对化学反应速率有何影响?4.压力对化学反应速率有何影响?第七节链锁反应1.简述链锁反应过程的三个阶段。
动力学思考题

动力学思考题1、判断下列说法是否正确(1)反应级数等于反应分子数(2)反应级数不一定是简单的正整数(3)具有简单级数的反应是基元反应(4)不同反应若具有相同级数形式,一定具有相同反应机理(5)反应分子数只能是正整数,一般不会大于三(6)某化学反应式为A+B=C,则该反应为双分子反应2、阿累尼乌斯经验式的适用条件是什么?实验活化能Ea对基元反应和复杂反应有何不同?3、平行反应AE1>E2,若B是所需的产品,从动力学角度定性的考虑应采用怎样的反应温度?4、对1—1级的平行反应,若要改变两产物的浓度[B]、[C]的比,采用改变反应时间的办法行否?为什么?5、平行反应的速控步骤是快步骤;连串反应的速控步骤是慢步骤。
对吗?6、阀能的物理意义是什么?它与阿累尼乌斯经验活化能在数值上的关系如何?7、为什么在简单碰撞理论中,要引入概率因子P?8、一反应在一定条件下的平衡转化率为20%,当加入某催化剂后,保持其它反应条件不变,反应速率增加了10倍,问平衡转化率将是多少?9、某反应反应物反应掉5/9所需的时间是它反应掉1/3所需时间的2倍,该反应是几级反应?10、半衰期为10天的某放射形元素8克,40天后其净重为多少克?11、某反应速率常数的量纲是[浓度]-1[时间]-1,则该反应是几级反应?12、催化剂能极大的改变反应速率,以下说法错误的是(A)催化剂改变了反应历程(B)催化剂降低了反应历程(C)催化剂改变了反应平衡,使转化率提高了(D)催化剂同时加快了正向与逆向反应13、在一连串反应A→B→C中,如果需要的是中间产物B,为得其最高产率应当采用哪种做法?14、温度对反应速率的影响很大,温度变化主要是改变下列哪一项?(1)活化能;(2)反应机理,(3)物质浓度或分压;(4)速率常数;(5)指前因子动力学思考题答案1、判断下列说法是否正确(1)反应级数等于反应分子数(2)反应级数不一定是简单的正整数(3)具有简单级数的反应是基元反应(4)不同反应若具有相同级数形式,一定具有相同反应机理(5)反应分子数只能是正整数,一般不会大于三(6)某化学反应式为A+B=C,则该反应为双分子反应答:(1),(3),(4),(6)错;(2),(5)对2、阿累尼乌斯经验式的适用条件是什么?实验活化能Ea对基元反应和复杂反应有何不同?答:适用于温度区间不大的基元反应和具有明确反应级数和速率常数的复杂反应。
【2019年整理】化学反应动力学习题(可打印修改) (2)

二、 选择题 1.(C);2.(B);
三、 填空题 1. 一、是非题 下列各题中的叙述是否正确?正确的选“√”,错误的选“×”。
√ × 1. 设对行反应正方向是放热的,并假定正、逆都是元反应,则升高温度更利 于增大正反应的速率系数。
√ × 2.若反应 A
Y,对 A 为零级,则 A 的半衰期
。
二、选择题
2. 3. kA=0.01 mol-1×dm3×s-1 t1/2=100 s
4. t1/2=15min 5. k(310K)/k(300K)=25.36
1. 二甲醚的气相分解是一级反应:CH3OCH3(g)
CH4(g)+ H2(g) + CO(g)
504℃时把二甲醚充入真空的定容反应器内,测得时间 t 时总压力 pt, 总数据如下:
N2O2 (快);
N2O2+O2
2NO2 (慢)。
又已知 2NO
U Δ N2O2 的 r m <0。试导出总反应的动力学方程式,并解释其反应级数及
对比实验 1, 2:
B 过量: 实验 1: 实验 3
则 b=2。
两式相除,得 4=4×2a-1,则 a=1。反应速率方程为:-dpA/dt=kApApB2
由实验 1 数据,
=1.13×10-10 Pa2×h-1。
4.[题解]:(1)据 Arrhenius 方程的不定积分式: 给 kA=f(T)的经验式对比,得
在以下各小题的“
”处填上答案。
1.链反应的一般步骤是(i)
;(ii)
;(iii)
。
答案:一、是非题 1. √; 2. √;
二、选择题 1.(B); 2.(B); 3.(C);
三、填空题 1.链的引发 链的传递 链的终止
浙江大学高分子化学思考题答案
3 自由基聚合3.3 思考题及参考答案思考题【3-1】烯类单体加聚有下列规律:(1)单取代和 1,1-双取代烯类容易聚合,而 1,2-双取代烯类难聚合;(2)大部分烯类单体能自由基聚合,而能离子聚合的烯类单体却较少。
试说明原因。
答(1)单取代烯类容易聚合原因在于一个取代基的存在往往会降低双键对称性,改变其极性,从而提高单体参加聚合反应的能力。
1,1-双取代烯类在同一个碳原子上有两个取代基,促使极化,易于聚合,但若取代基体积较大,只形成二聚体。
1,2-双取代烯由于位阻效应,加上结构对称,极化程度低,一般都难均聚,或只形成二聚体。
(2)乙烯基单体中,C=C π键兼有均裂和异裂倾向,因此有可能进行自由基或离子聚合。
自由基呈中性,对π键的进攻和对自由基增长中的稳定作用并无严格的要求,几乎各种取代基对自由基都有一定的共振稳定作用。
所以大部分烯类单体能以自由基聚合。
而只有个别带强烈供电基团和吸电基团的烯类单体及共轭烯类单体可进行离子聚合。
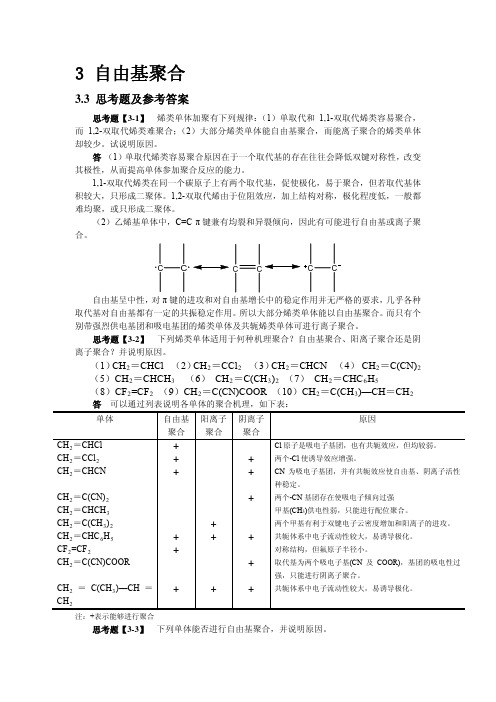
思考题【3-2】下列烯类单体适用于何种机理聚合?自由基聚合、阳离子聚合还是阴离子聚合?并说明原因。
(1)CH2=CHCl (2)CH2=CCl2(3)CH2=CHCN (4) CH2=C(CN)2(5)CH2=CHCH3(6) CH2=C(CH3)2(7) CH2=CHC6H5(8)CF2=CF2(9)CH2=C(CN)COOR (10)CH2=C(CH3)—CH=CH2 答可以通过列表说明各单体的聚合机理,如下表:单体自由基聚合阳离子聚合阴离子聚合原因CH2=CHCl+ Cl原子是吸电子基团,也有共轭效应,但均较弱。
CH2=CCl2+ +两个-Cl使诱导效应增强。
CH2=CHCN+ +CN为吸电子基团,并有共轭效应使自由基、阴离子活性种稳定。
CH2=C(CN)2+两个-CN基团存在使吸电子倾向过强CH2=CHCH3甲基(CH3)供电性弱,只能进行配位聚合。
CH2=C(CH3)2 +两个甲基有利于双键电子云密度增加和阳离子的进攻。
第四章 链反应动力学

§4.2 链反应的机理
一、链反应的引发过程
1. 链引发的活化能 链式反应中产生链载体的过程称为引发过程。 最常见的是稳定分子分解产生自由基(或自由原子)的过程。 此过程的活化能(通常等于反应热)很大,一般约在 200 ~ 400 kJ/mol,即链的断裂能 (D) : XY→X· + Y· 拟过程: XY→X : Y→X· + Y· • 第一过程表示分子劈裂为两个自由基,但保持其原来在分子 中的空间构型,此过程所需要的能量称为化学键的劈裂能D0
(7)惰性添加物也可能起到产生或消灭链载体的作用,故链式 反应对惰性添加物也敏感。 (8)链式反应的速率方程和动力学方程都很复杂。
五、自由基存在的检定
——确定链反应的重要手段和方法。 1. 化学法 (1)金属镜法 把金属放入管道内,当含有自由基的气流通 过时,自由基与金属作用,生成一定的化合物。如:
产生或消耗链载体,即相当于加入引发剂或阻化剂,对链
式反应的速率产生很多影响。例如: 亚硝酰氯: 加入H2+1/2 O2→H2O 反应后,反应温度由580℃下 降到330℃,起到正催化作用。 用在光气合成反应中,几乎使反应终止,起到阻化作用。 (6)链载体是非常活泼的,它对反应容器十分敏感。
容器的材料、形状、甚至大小不同都会对反应产生影响。
热引发:以加热的方式供给体系能量,增加分子的热运动, 加速分子间的碰撞,使一个共价键的单分子的一个键发生对 称分裂,形成两个自由基或自由态原子。 例如 合成HBr的热反应 Br2→2Br 引发产生Br。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章链反应动力学
1.链反应的活性物种一般是什么?生成活性物种主要有哪些途径?
答:一般是自由原子或是自由基。
其生成途径可以是外因(热,光,辐射等),但是更主要的是依靠反应进行中的不断再生并依次传递,像链一样传递下去。
2.一般支链反应分为几种?
答:1.稀有分支链反应
2.连续分支链
3.退化分支链
3.链反应有哪些特点?如何理解“链长”。
答:(1)几率因子
链反应的几率因子一般大于1。
(2)恒温下,链反应开始的速率为0,随后速率迅速递增达到极大值(图4-1),有可能发生爆炸。
(3)链反应存在诱导期。
(4)大多数链反应对痕量的其他物质异常敏感,这些物质往往对反应速率有明显的影响。
(5)链反应速率对反应器的形状和大小很敏感。
(6)链反应的级数大多为非整数级的,级数随反应器形状或其它实验参数变化。
(7)链反应中间体往往是自由基或自由态原子。
链长:从微观角度看,其定义为:一个链载体。
由引发生成,直至链终止时消亡,其间所引起的链传递元反应的次数。
从宏观角度看,链长的概念具有统计平均的意义,此时称为平均链长。
以l表示,可定义为l=r/r0。
式中r及r0分别是链反应速率和引发反应中链载体生成的速率。
4.直链反应的总级数由反应机理中的哪些基元步骤决定?根据反应的一般机理推导课本
中表7-2(P.272)中反应总级数为2时的速率方程。
答:反应总级数决定于(ki[A]/k4[M])1/2的形式,即链引发和终止的形式。
若链终止的方式不变,反应总级数由引发反应的方式决定
影响链终止方式的主要因素是自由基的相对浓度。
这一浓度与链增长的相对速率有关。
化学反应的速率方程中各物浓度的指数称为各物的分级数,所有指数的总和称为反应总级数,用n表示。
A → B为二级反应,有,可得即,亦是 Y = aX + b 型直线方程,作图,则直线斜率为s=k,截距为,k 的单位:(L·mol-1)1·s-1。
5.目前采用什么速率理论解释链反应的速率?
答:对基元反应的竞争起决定作用的是能量因素,对于有可能参与不同基元反应的同一物种,参与反应的可能性由反应步骤的活化能决定。
在2个不同自由基和相同分子的基元反应中,若基元反应的活化能相近,反应速率取决于自由基的浓度。
自由基浓度大的步骤反应速率大。
6.请根据支链反应的一般机理推导支链反应的速率方程。
答:支链反应的链中心浓度随时间的变化由链引发速率n0、链支化过程速率fn和链终
止速率k 'n 三种因素决定。
链引发和链支化过程使链中心浓度增加,链终止过程使链中心减少
链中心浓度按指数规律增长,直至爆炸。
7. 自由基加成聚合反应机理如何?该类反应的速率方程有何特点?
8. 答:设所有的链持续反应有相同的速率常数,而所有的链终止反应也有相同的速率常数。
自由基加成聚合的反应历程为:
(1)
引发反应(2)持续反应
(3)断链反应
42k p q p q RM RM R M ++−−→
• 反应速率可用单体M 在链增长反应中的消耗速率表示,速率方程为:
33231
12[][][][][][][][][][][]0n n d M k RM M k RM M k M RM dt d R k I k R M dt
∞=-=++==-=∑ 2341
2332421
31341
[][][][][][][]0[][][][][][][]0[][][][][][][]0n n n n n n n n n n d RM k R M k RM M k RM RM dt d RM k RM M k RM M k RM RM dt d RM k RM M k RM M k RM RM dt ∞=∞=∞-==--==--==--=∑∑∑21411/21/2114[]{[]}0
[]()[]n n n n k I k RM k RM
I k ∞
=∞=-==∑∑
聚合反应的速率方程为:
聚合反应总级数为1.5级。
其中,对单体M 是1级,对引发剂I 是0.5级。
自由基聚合反应的特点:
1.整个聚合过程分为链引发,链增长,链终止,各步反应速
率和活化能相差很大;
2.高分子瞬间形成,并产品的相对分子质量不随时间变化;
3.体系内始终由单体和高聚物组成,产物不能分离;
4.反应连锁进行,转化率随时间的延长而增加;
5.反应是不可逆的.。
