物质的量在化学方程式计算中的应用【新教材】人教版高中化学必修一教学课件
合集下载
物质的量在化学方程式中的应用课件-高一上学期化学人教版(2019)必修第一册

2 7g 3 22.4L 2.7g V(H 2 )
得n(NaOH)=0.1mol
得V(H2)=3.36L
答:(1)参加反应的NaOH的物质的量为0.1mol
(2)生成H2的体积(标准状况下) 为3.36L
V(H2)
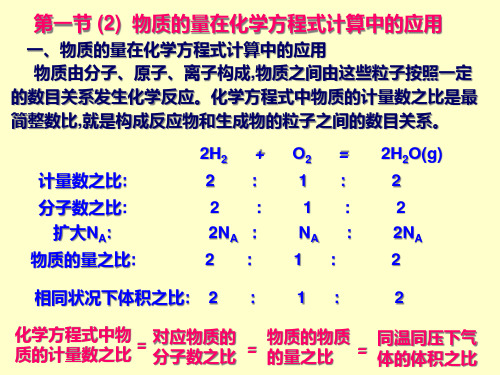
一、化学方程式中的定量关系
3、物质的量在化学方程式中计算的应用
注意事项
①设未知量时不带单位,已知量和未知量单位统一; ②化学方程式要书写正确。要注意配平、化学方程式的完整(注 明反应条件、气体和沉淀的符号); ③相对分子质量要计算正确,且需乘化学式前面的系数; ④已知量和未知量的位置要写对。 ⑤解题步骤规范,过程完整。
2∶
1
扩大6.02×1023倍:2×6.02×102∶3 2×6.02×1023∶ 2×6.02×10∶23 1×6.02×1023
扩大NA倍:
2 NA ∶ 2 NA ∶
2 NA ∶
1 NA
物质的量之比: 2 mol ∶ 2 mol ∶ 2 mol ∶ 1 mol
气体体积之比: 2 mol ∶ 2 mol ∶ 2 mol ∶ 1 mol
(2)利用关系式进行计算
CO ~ CaCO3
28
100
m(CO) 10 g
m(CO)=2.8 g
对应训练
[典例1] 已知 Fe+S
FeS , FeS+2HCl=FeCl2+H2S↑,
2H2S+3O2 2SO2+2H2O,一定量的铁粉和9 g硫粉混
合加热,待其反应后再加入过量盐酸,将生成的气体完全燃
0.1 mol 1 mol 0.05 mol 2 mol
m(H2SO4) n(H2SO4) • M(H2SO4) 0.05mol 98g/mol 4.9g
物质的量在化学方程式计算中的应用人教版高中化学必修一教学课件

7.3 g
n(HCl) =
= 0.2 mol
36.5g/mol
1 = 0.1 mol
2
n(HCl)
n(HCl)= 0.2 mol
物质的量 在化学 方程式 计算中 的应用 课件人 教版高 中化学 必修一
物质的量 在化学 方程式 计算中 的应用 课件人 教版高 中化学 必修一
【例 题 】 实验室用6.5g Zn与足量盐酸完全反应。求:① Zn的物质的 量;②参加反应HCl的物质的量;③生成H2的体积(标况下)。
③ Zn + 2HCl == ZnCl2 + H2↑
1mol
22.4L
0.1mol
V (H2)
单位应: 上下一致 左右对当
1mol
22.4L
0.1mol = V (H2)
V(H2)= 2.24 L
答:6.5gZn的物质的量是0.1mol;有0.2molHCl参加了反应;生 成H2的体积在标准状况下是2.24L.
【练 习】1、完全中和0 .5 mol NaOH需多少摩尔的 HNO3?
其质量是多少克?
解: NaOH + HNO3 == NaNO3 + H2O
1
1
0.5 mol n (HNO3 )
1 = 0.5 mol
1
n(HNO3)
n(HNO3)= 0.5 mol
m(HNO3)=n (HNO3)×M(HNO3)=0.5 mol×63 g/mol=31.5 g
物质的量应用于化学方程式的计算
一、原 理:
2Na+2H2O=2NaOH+ H2↑
化学计量数之比 2 : 2 : 2 : 1
扩大NA倍
物质的量(n)之比
物质的量在化学方程式计算中的应用 人教版高中化学必修一全册课件

A.1∶2
B.1∶3
C.3∶1 D.2∶1
解析 本题采用体积差量法求解。
2H2(g)+O2(g)=2H2O(g)
2
1
2
ΔV(减) 1
2L 1L
4 L-3 L=1 L
即实际参加反应的H2、O2的体积分别为2 L、1 L ①若O2过量,则V(H2)=2 L ,V(O2)=2 L,V(H2)∶V(O2) =1∶1。
解析 生成氢气的体积比即物质的量之比为n(甲)∶n(乙)
=5∶6,设甲中产生H2 5 mol,则乙中产生H2 6 mol。 甲:2Al + 3H2SO4=Al2(SO4)3+3H2↑
2
3
3
10 3 mol 5 mol
5 mol
乙:2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
22
3
4 mol 4 mol
自学导引
一、化学方程式计算的依据
化学计量数之比 物质的分子数之比 物质的物质的量之比
气体体积之比
N2+3H2
高温高压 催化剂
2NH3
1∶3 ∶ 2 1∶3 ∶ 2 1∶3 ∶ 2
1∶3 ∶ 2
结论:化学方程式中各物质的化学计量数之比,等于组 成各物质的粒子数之比,等于各物质的物质的量之比,即 ν1∶ν2∶ν3=N1∶N2∶N3=n1∶n2∶n3。
②若H2过量,则V(O2)=1 L,V(H2)=3 L,V(H2)∶V(O2) =3∶1。
故C项正确。
答案 C
跟踪练习3 将一定质量的钠投入24.6 g水中,反应完成
后,得到NaOH溶液31.2 g,则所得NaOH溶液中溶质的物质
的量为__________。
解析 设生成的NaOH的物质的量为x,由
3.1.3 物质的量在化学方程式计算中应用 课件-人教版高中化学必修一
答:生成铜的质量12.8g;c(FeSO4)是2mol/L。
例2.恒温恒压的密闭容中,合成塔中:N2(g)+3H2(g) 2NH3(g)反应达到平衡,测得平衡混合气体中NH3的体积 分数为25%,计算平衡时与起始时气体的体积比__4_:5__。
解析:设平衡混合气体的体积为100L,其中NH325L
左右对应(比例)。→正比例关系。 4.列出已知量和未知量比例式或列出方程式或方程组,利用数学方 法解出答案。
5.答。把求解的结论完整表达出来。
解→设未知数→写方程式→列出关系量→列比例式 →解比例式→ 答。
三、根据化学方程式的计算类型和方法
①简单计算(关系式法): 已知一种反应物或者生成物的量计算其他反应物或者生成
①计算生成Cu的质量。
②假若反应后溶液的体积是0.1L,计算FeSO4的物质的量浓度。
解:设生成Cu的质量为xg,生成FeSO4ymol。
CuSO4+Fe=FeSO4+ Cu
△m增加
56g 1mol 64g
8g
ymol xg
1.6g
列比例式并求解得:y=0.2mol x=12.8g
c(FeSO4)=0.2mol/0.1L=2mol/L
2mol
y=0.1mol
2.24L xg
ymol
44.8/2.24=32/x x=1.6g 答:标准状况下与2.24L氢气反应的O2是1.6g,生成水0.1mol。
例2. 6.0gCaO、Ca(OH)2、CaCO3的混合物,恰好溶解于100mL 2mol/L盐酸,然后稀释至1L,计算稀释后溶质的物质的量浓度。
(这里的“份”可以是g、kg、t等)。
d.2mol氢气和1mol氧气化合生成2mol水。 e.2个氢气分子和1个氧气分子化合生成2个水分子。
高中化学 3.1.3 物质的量在化学方程式计算中的应用课件 新人教版必修1

【解析】(1)2Na+2H2O====2NaOH+H2↑
46g
22.4L
m(Na)
0.224L
m(Na)=0.46g
(2)HCl
+
NaOH
====NaCl+H2O
1mol
1mol
1mol·L-1×0.03L n(NaOH)
n(NaOH)=0.03 mol c(NaOH)=0.03 mo=l 0.3 mol·L-1
的反应物或生成物的质量(或体积)成正比例关系。
注意:差量法的适用条件:反应不完全或有反应物;反应
前后有差量且差量易求。这是差量法的前提,只有在差量
易求得的情况下,差量法才快捷方便,否则,就要考虑其
他解法。
二、非选择题(本题包括3小题,共30分)
6.(6分)利用硫黄制硫酸时发生的反应有:
①S+O2 =点=燃= SO2
0.1 L
答案:(1)0.46g (2)0.3 mol·L-1
求出生成的HCl为0.5 mol。再根据
HCl+NaOH====NaCl+
H2O,可确定需要NaOH的物质的量为0.5 mol。故所需 NaOH
的体积为:0.5 mol/2.50 mol·L-1=0.2 L,即200 mL。
【错因剖析】知识掌握不扎实,思考问题不严密。过量的 Cl2也能够被NaOH吸收,其反应的化学方程式为:Cl2+ 2NaOH====NaCl+NaClO+H2O,故过量的0.05 mol Cl2可消耗0.1 mol NaOH,所以需要的NaOH总物质的量 为0.6 mol,体积为0.6 mol/2.50 mol·L-1=0.24 L,即240 mL。 【标准答案】240
高中化学人教版必修一课件:3.1 第3课时 物质的量在化学方程式计算中的应用

【答案】C
2.医疗上颇为流行的“理疗特效热”,就是利用铁缓慢氧化放出 均匀、稳定的热,使患处保持温热状态。若 56 g 铁粉完全氧化成 氧化铁,需要消耗氧气的质量为( )。 A.24 g B.32 g C.21 g D.16 g
【解析】1 mol Fe 生成 mol Fe2O3,消耗氧气 mol,质量为 24 g。 【答案】A
【答案】0.1 mol。(本题可以用差量法计算,1 mol 锌完全反 应生成 1 mol H2,溶液质量增加 63 g,现在溶液质量增加 6.3 g, 则反应的锌的物质的量为 0.1 mol)
在反应 3Cl2+8NH3 6NH4Cl+N2 中,标准状况下有 33.6 L 的氯 气参加反应,求: (1)参加反应的氨的质量。 (2)产生氮气的分子数目。 (3)被氧化的 NH3 的物质的量。
n1=0.2 mol,12 .1 g ×100%=46.3%。 m(Zn)=6.5 g,n2=0.2 mol, 消耗 HCl 的物质的量为 n1+n2=0.42)0.4 mol
活动探究 物质的量在化学方程式计算中的应用
1.将 6.5 g 锌放入足量的盐酸中充分反应,生成标准状况下 氢气的体积是多少?
1.掌握物质的量与其他物理量(质量、 气体体积、 微粒个数、 浓度等)的换算关系。 2.掌握物质的量在化学方程式计算中的应用。 3.了解化学计算中的常用方法。
1.化学计量数与化学计量间的关系 2Na + 2H2O 2NaOH+H2↑ 质量之比 46 g∶ 36 g ∶ 80 g ∶ 2 g 化学计量数之比 2 ∶ 2 ∶ 2 ∶ 1 扩大 NA 倍 2NA ∶ 2NA ∶ 2NA ∶ NA 物质的量之比 2 mol∶ 2 mol ∶ 2 mol ∶ 1 mol 结论:化学方程式中各物质的化学计量数之比等于 ① ,也等于② 对于有气体参加的反应还等于③ 。
人教版高中化学必修一第一章第二节物质的量在化学实验中的应用(共13张PPT)

俯视
cB
nB V
仰视
V偏小,C偏大
V偏大,C偏小
[练习]
错误操作
C
(1)未洗涤烧杯和玻璃棒
(2)转移液体时有液体溅出
(3)溶解后未冷却立即转移
(4)定容时仰视体积标线
(5)定容时俯视体积标线
(6)定容时不慎超过标线,再吸出
(7)定容摇匀后发现液面下降再加水
课堂小结
1 、 溶质的物质的量浓度 溶质的物质的量浓度与初中学习过的溶质的 质量分数一样都可以表示溶液的组成,它们有 什么区别和联系呢?
④读数时 ,应平视,使溶液的凹液面正好与刻度相切10;0m不l 能 作反应容器,不能长期存放溶液,只能用作配制的量具20℃。
配制100mL 1.00mol/L 的NaCl溶液
5.9gNaCl
(1)配制步骤 ⑴计算 ⑵称量⑶溶解
⑷转移 ⑸洗涤 ⑹定容 ⑺摇匀 (8)装瓶
(2)误差分析
cB
nB V
俯视或仰视刻度线对溶液浓度的影响
• You have to believe in yourself. That's the secret of success. 人必须相信自己,这是成的溶液
配制100ml 1.00mol/L的氯化钠溶液
精确的仪器
容 量 瓶
100ml 20℃
分析天平
5.85g 5.9g
容量瓶简介:
形状:细颈,梨形,平底的玻璃瓶; ①容量瓶
构造:瓶上标有容积,温度,颈部标有刻度线; 规格:50mL ,100mL,250mL,500mL,1000mL;
②使用之前要检查是否漏水.
加水 倒立 观察 瓶塞旋转180o 倒立 观察
③不能在其中溶解(有吸热或放热现象),不能将热的溶 液倒入,会影响体积的准确性。
【人教版】必修一:3-1-3《物质的量在化学方程式计算中的应用》ppt课件PPT课件

第3课时
物质的量在化学方程式计算中的应用
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
Байду номын сангаас
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
物质的量在化学方程式计算中的应用
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
Байду номын сангаас
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
◆ 全书优质试题随意编辑
◆ 课堂教学流程完美展示
◆ 独家研发错题组卷系统
《物质的量在化学方程式计算中的应用》第2课时PPT精品课件 人教版高中化学必修一

CaCO3 + 2HCl===CaCl2+H2O+CO2↑
1 mol
2 mol
22.4 L
0.15 mol n(HCl) 1 mol 22.4 L
0.15 mol=VCO2
V(CO2) 1 mol 2 mol 0.15 mol=nHCl
B.0.20 mol·L-1
C.0.50 mol·L-1
D.1.00 mol·L-1
栏目导航
D [CaO + 2HCl===CaCl2+H2O
56 g 0.56 g
2 mol c(HCl)×20×10-3 L
56 g
2 mol
则:0.56 g=cHCl×20×10-3 L ,
解得 c(HCl)=1.00 mol·L-1。]
栏目导航
15
1.15 g [解析] n(Na)=23 g·mol-1=0.05 mol,设生成标准状况下气体 的体积为V,溶液中溶质的物质的量浓度为c。 2Na+2H2O===2NaOH + H2↑ 2 mol 2 mol 22.4 L 0.05 mol 0.1 L×c V
栏目导航
22.4 L×0.05 mol
A.如果质量为 m1 的 A 与质量为 m2 的 B 恰好完全反应,则生成 的 C、D 的质量之和一定等于(m1+m2)
B.参加反应的 A 和 B 中的原子总数一定等于生成的 C 和 D 中的 原子总数
C.(a+b)不一定等于(c+d) D.A 和 B 中的元素种类,不一定等于 C 和 D 中的元素种类
V=
2 mol
=0.56 L;
2 mol×0.05 mol c= 2 mol×0.1 L =0.5 mol·L-1。
[答案] (1)0.56 L (2)0.5 mol·L-1
