底物浓度对反应速度的影响雅安职业技术学院
实验十一底物浓度对酶促反应速度的影响
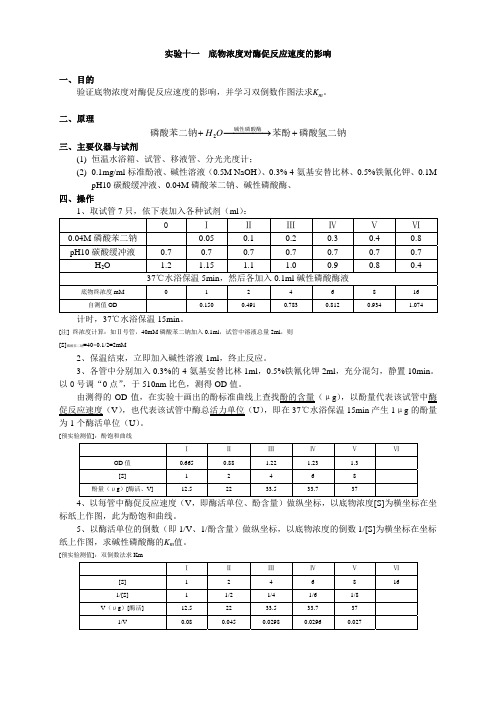
实验十一底物浓度对酶促反应速度的影响一、目的验证底物浓度对酶促反应速度的影响,并学习双倒数作图法求K m。
二、原理⎯⎯→+OH磷酸苯二钠碱性磷酸酶+磷酸氢二钠苯酚⎯⎯2三、主要仪器与试剂(1)恒温水浴箱、试管、移液管、分光光度计;(2)0.1mg/ml标准酚液、碱性溶液(0.5M NaOH)、0.3% 4-氨基安替比林、0.5%铁氰化钾、0.1MpH10碳酸缓冲液、0.04M磷酸苯二钠、碱性磷酸酶、四、操作1、取试管7只,依下表加入各种试剂(ml):0 ⅠⅡⅢⅣⅤⅥ0.04M磷酸苯二钠0.05 0.1 0.2 0.3 0.4 0.8pH10碳酸缓冲液0.7 0.7 0.7 0.7 0.7 0.7 0.7 H2O 1.2 1.15 1.1 1.0 0.9 0.8 0.4 37℃水浴保温5min,然后各加入0.1ml碱性磷酸酶液底物终浓度mM 0 1 2 4 6 8 16 自测值OD 0.150 0.491 0.783 0.812 0.934 1.074 计时,37℃水浴保温15min。
[注] 终浓度计算:如Ⅱ号管,40mM磷酸苯二钠加入0.1ml,试管中溶液总量2ml,则[S]磷酸苯二钠=40×0.1/2=2mM2、保温结束,立即加入碱性溶液1ml,终止反应。
3、各管中分别加入0.3%的4-氨基安替比林1ml,0.5%铁氰化钾2ml,充分混匀,静置10min。
以0号调“0点”,于510nm比色,测得OD值。
由测得的OD值,在实验十画出的酚标准曲线上查找酚的含量(μg),以酚量代表该试管中酶促反应速度(V),也代表该试管中酶总活力单位(U),即在37℃水浴保温15min产生1μg的酚量为1个酶活单位(U)。
[预实验测值]:酚饱和曲线ⅠⅡⅢⅣⅤⅥOD值0.665 0.88 1.22 1.23 1.3[S] 1 2 4 6 8 酚量(μg)[酶活、V] 12.5 22 33.5 33.7 374、以每管中酶促反应速度(V,即酶活单位、酚含量)做纵坐标,以底物浓度[S]为横坐标在坐标纸上作图,此为酚饱和曲线。
底物浓度对反应速度的影响-雅安职业技术学院只是课件

全酶
辅助因子
小分子有机化合物(维生素)
金属离子(K+、Na+ 、 Mg+)
科学出版社卫生职业教育出版分社
二、酶的活性中心
❖ 酶的必需基团 酶分子的氨基酸残基侧链的化学基团中,与酶活性密切 相关的化学基团 常见的必须基团:-COOH,-NH2,-OH,-SH
❖ 酶的活性中心 由酶的必需基团构成,存在于酶分子表面并形成具有特定 空间结构的区域(裂缝或凹陷)
科学出版社卫生职业教育出版分社
四、同工酶
同工酶(isoenzyme)是指催化相同的化学反应, 而酶蛋白的分子结构、理化性质乃至免疫学性质 不同的一组酶。如:乳酸脱氢酶(LDH)有5种同 工酶
科学出版社卫生职业教育出版分社
❖ LDH同工酶与疾病的诊断 健康成人血清LDH同工酶有如下的规律:
LDH2>LDH1>LDH3>LDH4>LDH5 急性心肌梗塞时,血清LDH1和LDH2显着升高 急性肝炎以LDH5明显升高,LDH4不增
1.氧化还原酶类
AH2+B
A+BH2
如:琥珀酸脱氢酶、细胞色素氧化酶等
2.转移酶类
A-R+C A+C-R
如:氨基转移酶、磷酸化酶等
科学出版社卫生职业教育出版分社
3.水解酶类
A-B+H2O
A-H+B-OH
如淀粉酶、蛋白酶、脂肪酶、磷酸酶等
4.裂合或裂解酶类
A-B A+B
如柠檬酸合酶、醛缩酶等
科学出版社卫生职业教育出版分社
底物浓度对反应速度的影响-雅 安职业技术学院
主要内容
1 概述 2 酶的结构与功能
酶的作用机制
化学反应速率与反应底物浓度的关系

化学反应速率与反应底物浓度的关系化学反应速率是指单位时间内反应物消耗的数量或产物生成的数量。
反应底物浓度是指反应物在溶液或气相中的浓度。
化学反应速率与反应底物浓度之间存在着密切的关系,本文将探讨这一关系并举例说明。
一、影响反应速率的因素化学反应速率受到多个因素的影响,其中反应底物浓度是重要的因素之一。
除了底物浓度外,还有温度、催化剂以及反应物的物理性质等因素也会影响反应速率。
然而,在本文中我们将重点讨论反应底物浓度对反应速率的影响。
二、反应底物浓度与反应速率的关系反应底物浓度对反应速率有直接的影响。
当底物浓度低时,活跃的反应底物分子之间的碰撞机会减少,导致反应速率变慢。
当底物浓度增加时,活跃的反应底物分子碰撞的频率增加,反应速率也随之增加。
举个例子来说明,考虑一种简单的反应A + B → C。
当反应底物A和B的浓度较低时,它们相互碰撞的机会较少,导致生成产物C的速率较慢。
然而,当底物A和B的浓度增加时,它们之间的碰撞频率增加,反应速率也增加。
这可以通过斯蒂芬-玻尔兹曼方程式来描述,即速率常数k与反应物浓度的乘积成正比。
三、反应底物浓度与速率方程反应底物浓度与反应速率之间的关系可以通过速率方程来表示。
速率方程是描述反应速率与反应物浓度之间关系的数学方程式。
常见的速率方程形式有零级、一级、二级等。
零级反应:当反应速率与反应物浓度无关时,称为零级反应。
速率方程可以写成v = k,其中v为反应速率,k为速率常数。
一级反应:当反应速率与一个反应物的浓度成正比时,称为一级反应。
速率方程可以写成v = k[A]或v = k[B],其中[A]代表反应物A的浓度,[B]代表反应物B的浓度。
二级反应:当反应速率与两个反应物的浓度的乘积成正比时,称为二级反应。
速率方程可以写成v = k[A][B]。
需要注意的是,速率方程不仅与反应物浓度有关,还与反应机理有关。
反应物浓度的影响可以通过实验得出,而速率常数则需要通过测量反应速率在不同底物浓度下的变化来确定。
底物浓度对酶促反应速度的影响曲线

在生物化学领域中,酶促反应是一个重要的研究课题,在许多生物生产和工业生产中都扮演重要角色。
而底物浓度对酶促反应速度的影响则是一个值得探讨的话题。
在本文中,我将从深度和广度的角度来探究底物浓度对酶促反应速度的影响曲线,并共享我的个人观点和理解。
一、底物浓度对酶促反应速度的影响底物浓度对酶促反应速度的影响是一个复杂而又有趣的问题。
当底物浓度较低时,酶的活性往往受到限制,反应速度较慢;而当底物浓度增加时,酶促反应速度也随之增加,但随着底物浓度的继续增加,反应速度达到一定的极限后便不再增加,形成一个饱和曲线。
这一现象反映了酶促反应速度与底物浓度之间的复杂关系,对此我深有感触。
从深度上来看,底物浓度对酶促反应速度的影响曲线可以用米氏方程来描述。
米氏方程是一种描述酶促反应速度与底物浓度之间关系的数学模型,在生物化学领域有着广泛的应用。
米氏方程可以清晰地展示出底物浓度对酶促反应速度的影响,帮助我们更好地理解和预测酶促反应的动力学特性。
从广度上来看,底物浓度对酶促反应速度的影响不仅在生物化学领域有着重要意义,在医药、食品和生物工程等领域也有着广泛的应用。
深入研究底物浓度对酶促反应速度的影响,可以帮助我们更好地优化酶促反应的条件,提高生产效率,节约成本,推动相关领域的发展。
二、个人观点和理解在我看来,底物浓度对酶促反应速度的影响是一个既简单又复杂的问题。
简单在于我们可以通过实验数据和米氏方程来描述和预测底物浓度对酶促反应速度的影响;复杂在于其背后涉及到了许多生物化学、生物动力学和生物工程等方面的知识,需要我们深入思考和研究。
总结回顾地看,底物浓度对酶促反应速度的影响曲线是一个既简单又复杂的话题,需要我们从深度和广度上加以理解和研究。
在未来的工作中,我将会更加深入地研究这一问题,希望可以为相关领域的发展贡献自己的一份力量。
通过以上分析,我们可以看到,底物浓度对酶促反应速度的影响曲线是一个非常有意义的话题,需要我们深入思考和研究。
底物浓度对酶促反应速度的影响曲线

底物浓度对酶促反应速度的影响曲线1. 序言底物浓度对酶促反应速度的影响曲线是一个在生物化学和酶动力学领域中备受关注的主题。
了解底物浓度对酶反应速度的影响可以帮助我们更好地理解生物体内酶的工作原理和代谢调控。
本文将对底物浓度对酶促反应速度的影响进行全面评估,并探讨其内在的机制。
2. 概述酶反应速度的定义酶是生物体内一类催化剂,能够加速化学反应的速率而不被消耗。
酶与底物之间的反应速度可以表征酶的活性。
酶促反应速度通常用反应物消失或产物生成的速率来描述。
酶反应速度受多个因素的影响,其中底物浓度是一个关键因素。
3. 底物浓度对酶促反应速度的影响曲线底物浓度对酶促反应速度的影响通常由一个叫做米氏动力学方程的曲线来描述。
米氏动力学方程由麦克斯韦-波尔兹曼方程推衍而来,其中底物浓度的增加将导致酶反应速度的增加,但增速将逐渐减缓。
这是因为酶的活性位点最初是空闲的,当底物与酶结合后,活性位点会被占用。
随着底物浓度的增加,活性位点逐渐被饱和,反应速度达到最大值,之后不再随底物浓度增加而增加。
4. 酶动力学参数的解释对于底物浓度对酶反应速度的影响曲线,通常会引入一些重要的酶动力学参数来解释。
其中最重要的参数是酶的最大反应速率(Vmax)和底物浓度为一半时的反应速率(Km)。
Vmax代表酶在饱和底物浓度下的最大催化能力,Km则表示底物浓度为一半时,酶反应速度的一半。
这两个参数可以通过拟合实验数据得到,进而通过计算来评估酶的活性和亲和力。
5. 底物浓度对酶反应速度的生理重要性了解底物浓度对酶反应速度的影响对于揭示生物体内代谢调控的机制具有关键意义。
在生物体内,不同底物的变化会引起底物浓度的波动,从而影响酶反应速度。
这种调控机制可以通过调节底物浓度来控制代谢途径的速率。
一些代谢疾病,如糖尿病,正是由于底物浓度的异常导致酶反应速率发生改变,从而引发一系列的病理生理变化。
6. 个人观点和理解对我而言,底物浓度对酶促反应速度的影响是一个既有理论又有实际应用价值的重要主题。
实验报告 酶的底物浓度与反应速率的实验研究

实验报告酶的底物浓度与反应速率的实验研究实验报告:酶的底物浓度与反应速率的实验研究摘要:本实验旨在研究酶的底物浓度对于反应速率的影响。
通过进行一系列实验,我们观察和记录了在不同底物浓度下酶催化反应的速率变化。
结果表明,底物浓度与反应速率呈正相关关系,随着底物浓度的增加,反应速率也随之增加。
这一实验结果对于深入理解酶催化反应机制以及优化酶催化反应工艺具有重要意义。
1. 引言酶是一类能够加速生化反应速率的生物催化剂。
在许多生物过程中,酶起着至关重要的作用,而其催化效率和底物浓度之间的关系则成为了科学家们关注的焦点。
本实验将通过调节底物浓度,研究其对酶催化反应速率的影响,以期增进对酶功能与催化机制的理解。
2. 材料与方法2.1 实验材料- 酶溶液- 底物溶液- 缓冲液- 反应容器- 显微镜- 实验记录表格2.2 实验方法2.2.1 实验前准备a) 根据实验要求,准备所需的酶溶液、底物溶液和缓冲液,并确保其纯度和浓度符合要求;b) 清洗好所用的实验容器,以避免杂质对实验结果的影响。
2.2.2 实验步骤a) 在一系列标准反应管中,分别加入不同浓度的底物溶液,保持酶浓度和其他条件不变;b) 将相同体积的酶溶液加入到每个标准反应管中,并迅速混合;c) 将每个反应管放置在恒温环境中,以符合酶催化反应所需的最适温度;d) 按照预定的时间点,取出少量反应液滴在显微镜片上,并在显微镜下观察反应进程;e) 记录实验数据并统计各反应体系的反应速率。
3. 结果与讨论在实验过程中,我们观察到随着底物浓度的增加,反应速率也呈现出增加的趋势。
这与我们的预期结果相符,即酶催化反应的速率与底物浓度呈正相关关系。
相关实验数据表明,随着底物浓度的增加,酶分子与底物之间的碰撞频率增加,从而加速了反应速率的提高。
此外,在一定范围内,反应速率可能随着底物浓度的增加而逐渐饱和,即增加底物浓度对于进一步提高反应速率的作用逐渐减弱。
这可能是由于底物浓度达到一定程度后,酶分子中的活性位点已经全部饱和,并且无法再催化更多的底物分子。
底物浓度对酶促反应速度的影响

7、利用上述结果, 即求出Vm与Km值。
定至微弱而持续的微红色。
4、在4分钟、8分钟时,分别取出10ml反
应液,加入2号、3号小三角瓶,同上操
作,记下耗去NaOH毫升数。
5、以滴定度(即耗去的NaOH毫升数)
对时间作图,得一直线,其斜率即初速 度为V40(相对于40g/L的酪蛋白浓
度)。
6、然后分别量取30g/L、20g/L、10g/L
底物浓度对酶促反应速度 的影响
实验目的
• 了解底物浓度对酶促反应的影响
• 掌握测定米氏常数Km的原理和方法
实验原理
• 酶促反应速度与底物浓度的关系可用米氏方 程来表示:
v
Km S
Vm S
v ── 反应初速度(微摩尔浓度变化/min); Vm── 最大反应速度(微摩尔浓度变化/min); [S] ── 底物浓度(mol/L); Km── 米氏常数(mol/L)。
键水解。水解时有自由氨基生成,可用
甲醛滴定法判断自由氨基增加的数量而
跟踪反应,求得初速度。
实验器材
• 10~40g/L酪蛋白溶液(pH8.5)
• 中性甲醛溶液 • 标准0.1mol/L NaOH溶液。 • 胰蛋白酶溶液
实验步骤
1、取50ml三角瓶3个,加入5ml甲醛与1
滴酚酞,以0.1mol/L标准NaOH滴定至
1 Km 1 1 v Vm [ S ] Vm
• 于是实验时可选择不同的[S],测对应的
v;以1/v对1/[S]作图,得到一个斜率
为Km/Vm的直线,其截距为-1/Km, 由此可以求得Km和Vm。
• 本实验以胰蛋白酶消化酪蛋白为例。
11-底物浓度对酶反应速度的影响

底物浓度对酶反应速度的影响---介绍酶反应动力学中底物浓度对酶反应速度影响米氏方程推导、参数含义及测定⏹中间络合物学说●1903年Henri 等以反应速度对底物浓度作图得双曲线a. 当底物浓度较低时,v 与[S]成正比一级反应b. 随底物浓度增加,v 不按正比升高混合级反应c. 再加大底物浓度,零级反应,酶已被饱和[S]:底物浓度;v :反应速度;Vmax:最大反应速度供需关系●酶与底物反应时,通过特异识别作用,先形成酶底物复合物,然后在形成产物和酶分子,酶分子重新结合底物。
●该学说已得到大量实验证实,酶反应动力学特征;抗体酶产生等ES 中间络合物一个有活性的酶一定含有相应的活性位点同反应的中间过渡状态相匹配ES complex E-transitionstate complex2016/11/5海洋生命学院5[][]S K S V v s +=max 1913年Michaelis 和Menten 根据中间产物学说推导出一个数学表达式表示了底物浓度与酶反应速度的定量关系通常称为米氏方程如下米氏公式的推导(单底物)E+S ES E+P K S 最大反应速率反应速率底物浓度底物常数:ES解离常数kE+S ES ES E+P 迅速建立平衡,底物浓度远大于酶浓度;分解忽略不计——快速平衡法。
k3k 4E+S ES E+P k 1k 2 1925年Briggs 和Haldane 提出稳态理论,根据:“稳态平衡”理论反应分二步进行中间复合物形成产物形成反应系统中ES 的生成速率和ES的分解速率相等时,复合物ES 浓度保持不变的这种状态称稳态米氏公式的推导k 3k 4E+S ES E+Pk 1k 2[][][]()[][]()ES S ES E k dtES d -∙-=1①[][][]ES k ES k dtES d 32+=-②在反应初期,ES 形成时一般[S]>>[E],[ES]非常小,(1)([S]-[ES])≈[S];K 4非常小,忽略不计(2)达到稳态平衡时,[ES]浓度不变,生成和分解量相等,此时酶的催化速度:v=k 3[ES]最大反应速度:v max =k 3[E]③④[][]()[][]132k k k ES S ESE +=-[][]()[][][]ES k ES k S ES E k 321+=∙-132k k k K m +=[][]()[][]mK ES SES E =-[][][][]S K S E ES m +=[][]s K S V v m +=max [][][]S K S E k v m +=3[]ES k v 3=代入③将④代入得米氏方程,Km 米氏常数[]E k V 3max =⑴当[S]<<Km 时,米氏公式为属一级反应动力学,酶未能被底物完全饱和,不适于测定酶活力⑵当[S]>>Km 时,米氏公式为⑶当[S]=Km 时,米氏公式为零级反应,适于测定酶活力Km 为最大反应速度一半时的底物浓度,单位mol/L小结⏹中间复合物学说是酶促反应动力学的理论基础⏹米氏方程是基于中间复合物学说推导出的,能较好地解释酶促反应动力学曲线●Km 的意义 Km 值是酶的特征常数,只与酶本身性质有关,而与酶浓度无关,每种底物有一个特征的Km 值,且对一定pH 、温度和离子强度而言。
生物化学资料:底物浓度及抑制剂对酶促反应速度的影响

x/Vm -1/Km -1/Km`
1/[S] L/mmol
绘图与数据处理:
第一管的底物浓度计算
0.02mol/L×0.2ml
[S] =
= 0.002 mol/L = 2mmol/L
2ml
1/[S] =1/2 L/mmol
酶的抑制剂:凡能降低酶的活性,甚至使酶完 全丧失活性,但不使底物变性的物质。
竞争性抑制
抑制作 用类型
可逆性 非竞争性抑制 反竞争性抑制
不可逆性
1.竞争性抑制曲线图
竞争性抑制剂与酶的 底物结构相似,与底物竞 争酶的活性中心,从而阻 碍酶与底物的结合.
特点: (1)V下降,发生抑制 (2)Vmax不变 (3)Km增大,亲和力下降
加酚试剂
①用1000μl移液枪加 ②在水浴箱中加 ③准确计时 ④立即混匀
1.取样量准确,保温准确,加样顺序要一致,每 步均混匀。
2.同一组实验用相同的比色计。
3.作图时,实验点不在同一条直线上时,尽量使各 点平均分布在直线的两侧,两图画在同一坐标 纸上,便于判断。
绘图与数据处理:
两条直线必须在纵轴上交于一点。
根据颜色深浅测出光密度值,计算不同底物浓度时A660值 (产物的生成量),以1/A660-1/[S]双倒数作图,获得Km值。
实验操作 1.米氏常数测定 按下表操作:
管号 试剂(ml)
012345
0.02mol/L底物
0.2 0.2 0.3 0.4 0.6 0.8
蒸馏水
0.8 0.7 0.6 0.5 0.3 0.1
的 [S],即Km值。
v
Vmax
½ Vmax
Vmax [S] V= Km + [S]
底物浓度对酶促反应速度的影响

1/[S] 1/Vm
(林-贝氏方程)
2. Hanes作图法 在林-贝氏方程基础上,两边同乘[S]
[S]/V
[S]/V=Km/Vmax + [S]/Vmax
Km/Vm
-Km
[S]
Km与Vmax的意义
Km值 定义:Km等于酶促反应速率为最大反应速率一半时的底 物浓度。 意义: 1.Km是酶的特征性常数之一,只与酶的结构、底物 和反应环境(如,温度、pH、离子强度)有关, 与酶的浓度无关。
2.Km可近似表示酶对底物的亲和力;
3.同一酶对于不同底物有不同的Km值。
• Km最小的底物大多数是此酶的天然底物 如:己糖激酶对葡萄糖的Km 1.5mmol/L 对果糖的Km 所以葡萄糖为最适底物 • 一种酶对每一种底物都各有一个特定的Km 28mmol/L
V
Vmax
[S]
当底物浓度较低时 反应速度与底物浓度成正比; 反应为一级反应。
V
Vmax
[S]
随着底物浓度的增高 反应速度不再成正比例加速; 反应为混合级反应。
V
Vmax
[S]
当底物浓度高达一定程度 反应速度不再增加,达最大速度; 反应为零级反应
(一)米-曼氏方程式揭示单底物反应的 动力学特性 解释酶促反应中底物浓度和反应速率关 系的最合理学说是中间产物学说: E+S
推导过程
• 稳态:是指ES的生成速度与分解速度相等,即 [ES]恒定。
K1 ([Et]-[ES]) [S]=K2 [ES] + K3 [ES]
整理得:
K2+K3 ([Et]-[ES])[S] (2) = [ES] K1 K2+K3 令: = Km (米氏常数) K1
关于底物浓度对酶促反应速度的影响实验

小知识点:
酚酞是碱性指示剂(变色范围是碱性),酸滴 碱时用碱性指示剂;反之碱滴酸时用酸性指示 剂比如甲基橙甲基红。
三、器材
锥形瓶 滴定管 移液管
等
四、试剂与材料
1. 酪蛋白
2. 胰蛋白酶
3. 甲醛
4. 酚酞
5. 氢氧化钠
水浴锅 量筒
五、操作 分别向6个小锥形瓶中加入5 mL甲醛溶液和1滴酚 酞,并滴加0.1 mol/L标准氢氧化钠溶液,直至混 合物呈微粉红色。注意:每个锥形瓶中的颜色应一 致。 取100 mL酪蛋白溶液,加入另一锥形瓶中,在 37℃水浴中保温10分钟。将胰蛋白酶也在37 ℃水 浴中保温10分钟。然后精确量取10 mL酶液加到 酪蛋白溶液中(同时计时)。
度作图。
【实验报告】 总结实验结果,并回答如下问题: 1. 试述底物浓度对酶促反应速度的影响。 2. 在什么条件下,测定酶的Km值可以作为
鉴定酶的一种手段,为什么? 3. 米氏方程中的Km值有何实际应用?
• 充分混合后,随即取出10 mL反应混合物(作 为零时的样品)吹至一含甲醛的锥形瓶中。用 0.1 mol/LNaOH溶液滴定,直至混合物呈微粉 红色,记下所用0.1 mol/LNaOH溶液的mL数。
在2、4、6、8和10分钟时,分别取出10 mL消化 样品,准确照上法操作。注意:在每个样品中滴定终 点的颜色应当一致。用增加的滴定度对时间作图,测 定初速度。
实验时选择不同的[S],测定相对应的υ。求出 两者的倒数,以1/υ对1/[S]作图,则得到一个斜 率为Km/V的直线。将直线外推与横轴相交,其 横轴截矩为:-1/[S]=1/ Km,由此求出Km值。 该法比较简便。
本实验以胰蛋白酶消化酪蛋白为例,采用
Lineweaver-Burk双倒数作图法测定Km值。
底物浓度及抑制剂对酶促反应速度的影响

底物浓度及抑制剂对酶促反应速度的影响一、实验目的:1、学习和掌握Km的测定原理和实验方法。
2、掌握竞争性抑制剂对酶活性的影响及竞争性抑制剂表观Km’的测定。
二、实验原理:1.酶的底物浓度和酶促反应速度的关系一般情况下符合米-曼氏方程:式中:v为反应初速度;Vmax为最大反应速度;[S]为底物浓度;Km为米氏常数,其单位为mmol/L。
Km值是酶的特征性常数,一般来说,Km可以近似地表示酶与底物的亲和力。
测定Km值是酶学研究中的一个重要方法。
Lineweaver-Burk作图法(双倒数作图法,图1)是用实验方法测定Km值的最常用的比较简单的方法。
Lineweaver-Burk将米氏方程改写成双倒数形式:1/ v = Km/ Vmax×1/[S] + 1/ Vmax以1/v-1/[S]作图得一个斜率为Km/ Vmax的直线,将直线外推与横轴相交,其横轴截距为-1/Km ,纵轴截距为1/Vmax ,因此实验时,选择不同的[S],测定相应的v,依L-B双倒数方程作图,即可求得Km 和Vmax;在抑制剂存在时,即可求得表观Km 和 Vmax,竞争性抑制的动力学特点见图2。
2.本实验以碱性磷酸酶(AKP)为例,磷酸苯二钠为底物,磷酸氢二钠为其竞争性抑制剂,茶碱为其非竞争性抑制剂。
AKP催化磷酸苯二钠水解产生游离酚和磷酸盐。
酚与酚试剂应用液在碱性溶液中生成蓝色的衍生物。
根据蓝色的深浅可测出酚的含量,从而算出相应的酶促反应速度(v)。
再根据Lineweaver—Burk法作图,计算其Km 值及抑制剂存在时表观Km值的改变。
三、实验步骤:1.米氏常数测定按下表操作:2.抑制剂对酶促反应速度的影响按下表操作:3.计算以1/A660-1/[S]作图,求出Km及表观Km。
四、结果与分析:实验数据处理表格:1.米氏常数Km测定管号0 1 2 3 4 5[S](mmol/L) 2 2 3 4 6 8A6600.206 0.318 0.412 0.496 0.5532.抑制剂存在时表观Km测定管号0 1 2 3 4 5[S](mmol/L) 2 2 3 4 6 8A6600.170 0.185 0.275 0.376 0.389作图:计算:1.Km计算:由直线方程y=7.0999x+0.9662知,当y=0时,x=-0.1361,即-1/Km=-0.1361,所以Km=7.35mmol/L,纵截距为0.96622.表观Km计算:由直线方程y=10.895x+0.9662知,当y=0时,x=-0.08868,即-1/Km=-0.08868,所以Km=11.28mmol/L,纵截距为0.9662表观Km>Km,,且纵截距相等,所以抑制剂是竞争性抑制剂。
底物对酶促反应的影响

底物对酶促反应的影响主要体现在以下几个方面:
1.底物浓度:在其他因素不变的情况下,底物浓度的变化与酶促反应速度之间呈
矩形双曲线关系。
在底物浓度较低时,反应速度随底物浓度的增加而加快;当底物浓度较高时,反应速度不再呈正比例加快;当底物浓度很大且达到一定限度时,反应速度达到一个最大值,此时即使再增加底物浓度,反应速度也几乎不再改变。
2.酶浓度:在其他因素不变的情况下,酶促反应的速度与酶浓度成正比。
3.温度:温度对酶促反应的影响表现为最适温度和耐热性。
在最适温度下,酶促
反应具有最高的反应速度。
超过最适温度后,酶促反应速度会降低。
4.pH值:每一种酶只能在一定限度的pH范围内才表现活性,超过这个范围酶就
会失去活性。
综上所述,底物浓度是影响酶促反应的重要因素之一,其他因素如酶浓度、温度和pH 值也会对酶促反应产生影响。
在实际应用中,需要综合考虑各种因素,选择合适的条件以实现最佳的酶促反应效果。
底物浓度对酶促反应速度的影响实验报告.doc

底物浓度对酶促反应速度的影响实验报告实验二抑制剂对酶促反应速度的影响(1)实验二抑制剂对酶促反应速度的影响Effects of Inhibitors on the V elocity of Enzymatic Reactions一、实验原理凡能降低酶活性甚至使酶丧失活性的物质,称为酶的抑制剂。
酶的特异性抑制剂可分为可逆性和不可逆性两类。
可逆性抑制剂又可分为竞争性和非竞争性两类。
竞争性抑制剂的作用特点是该酶的Km 值增大,但最大的反应速率不变,而非竞争性抑制剂的作用特点是不影响底物与酶结合,故其Km值不变,而能降低其最大反应速度。
本实验中观察无机磷酸盐对碱性磷酸酶的抑制作用,用磷酸苯二钠法测酶活性,使各管底物浓度不同,其他条件相同,除各管都加有同样量Na2HPO4外,实验操作完全同前一实验。
计算结果,画出曲线,判定Na2HPO4对碱性磷酸酶的影响。
充分摇匀,37℃准确保温15min充分摇匀,室温放置10min在510nm,以B管调零时读取各管光密度值。
计算并作图要领同实验一,求出Km值,判定结果,Na2HPO4属于哪种抑制剂。
三、思考题联系实验结果,讨论抑制剂对酶活性的影响。
四、英语关键词最大反应速度:Maximum velocity米—曼式方程:Michaelis—Menten Equation 特性常数:Characteristic constant 绘图:Plot直线:Straight Line 截距:Intercept 斜率:Slope磷酸苯二钠:Disodium Phenylphosphate 4-氨基安替比林:4-Aminoantipyrine篇二:影响酶促反应的因素常有酶的浓度影响酶促反应的因素常有酶的浓度、pH、温度、抑制剂、激活剂、底物浓度等,其变化规律有以下特点:篇三:影响酶促反应速率的因素和实验设计及分析理论影响酶活性和酶促反应速率的因素1.温度和pH对酶活性和反应速率的影响①请描述两条曲线,解释两图中A、B、C三点。
实验报告酶催化反应速率与底物浓度的关系

实验报告酶催化反应速率与底物浓度的关系实验报告:酶催化反应速率与底物浓度的关系摘要:在本实验中,我们旨在研究酶催化反应速率与底物浓度之间的关系。
通过测定不同底物浓度下酶的反应速率,我们得出了底物浓度与酶催化反应速率呈正相关的结论。
实验结果表明,随着底物浓度的增加,酶的催化能力也相应增加。
这一研究有助于更深入地理解酶催化反应的机制,并对生物学和医学领域的相关研究具有重要的意义。
引言:酶是一类生物催化剂,在生物体内起着至关重要的作用。
酶催化反应速率涉及底物浓度等多个因素,其中底物浓度对于酶催化反应速率的影响尤为明显。
本实验通过一系列的操作和测量,旨在研究底物浓度对酶催化反应速率的影响,并揭示该关系的一些特点和规律。
材料与方法:1. 实验材料:- 酶溶液:使用已知浓度的酶溶液,例如过氧化氢酶。
- 底物溶液:配制一系列不同浓度的底物溶液,例如过氧化氢底物。
每个底物浓度的配制需记录。
- 试剂:为确保实验操作的准确性和重复性,使用高纯度分析试剂,并遵循实验室安全操作规范。
2. 实验装置:- 酶反应容器:选用适合实验需求的容器,确保反应过程的可控性。
- 恒温水浴器:控制实验温度,保持恒定。
- 分光光度计:用于测量酶反应的光吸收值,反应速率的指标之一。
- 计时器:用于记录反应时间。
- 显微镜:用于观察酶反应过程中的细节变化。
实验步骤:1. 在酶反应容器中加入一定量的酶溶液。
2. 依次向不同的酶反应容器中加入不同浓度的底物溶液。
确保底物浓度范围广泛,例如0.1M、0.2M、0.3M等,每组浓度至少重复3次。
3. 放置酶反应容器于恒温水浴器中,控制反应温度为适宜的值,例如37摄氏度。
4. 启动计时器,开始记录酶反应时间。
5. 定期取出一定量的反应溶液,将其置于分光光度计中测量光吸收值。
记录吸光度值与时间的变化曲线。
6. 根据实验结果计算各底物浓度下的酶催化反应速率。
结果与讨论:经过实际操作和测量,我们获得了底物浓度与酶催化反应速率的结果数据,并绘制出相应的曲线图。
化学反应速率中底物浓度的影响

化学反应速率中底物浓度的影响化学反应速率是指化学反应在单位时间内消耗或生成反应物或产物的速度。
底物浓度是影响化学反应速率的重要因素之一。
本文将探讨底物浓度对化学反应速率的影响、原因以及应用。
首先,底物浓度对化学反应速率具有显著影响。
通常情况下,底物浓度越高,化学反应速率越快;底物浓度越低,反应速率越慢。
这是因为化学反应是通过底物的分子碰撞来进行的,底物浓度的增加会增加分子之间的碰撞频率,从而加快反应速率。
反之,底物浓度降低则会减少分子碰撞频率,使反应速率减慢。
其次,底物浓度对化学反应速率的影响与反应的速率定律密切相关。
在简单的一级反应中,反应速率正比于底物浓度。
这意味着当底物浓度增加一倍时,反应速率也会增加一倍。
然而,在一些复杂的反应中,底物浓度与反应速率的关系可能不是简单的线性关系,而是非线性的。
这是因为反应速率还受到其他因素(如催化剂、温度等)的影响,并且不同反应具有不同的速率定律。
进一步探究底物浓度对化学反应速率的影响原因,我们可以从分子碰撞论角度进行解释。
根据碰撞理论,反应发生的前提是底物分子之间的有效碰撞,即具有足够的能量和适当的碰撞角度。
当底物浓度增加时,碰撞频率增加,增加了有效碰撞的概率,从而加快反应速率。
此外,底物浓度越高,反应过程中底物分子之间的碰撞也更容易发生在活性位点上,提高了反应发生的概率。
除了影响化学反应速率,底物浓度对反应平衡态的达成也有重要作用。
在反应达到平衡态时,正反应速率相等,反应浓度保持不变。
根据Le Chatelier原理,当增加底物浓度时,平衡倾向于右移,增加生成物的产量。
相反,当底物浓度减少时,平衡倾向于左移,生成物的产量减少。
因此,底物浓度变化不仅可以影响反应速率,还可以影响反应的平衡态位置。
底物浓度对化学反应速率的影响在实际生活和工业生产中具有广泛的应用。
例如,酶催化反应中的底物浓度是影响酶活性和催化效率的关键因素。
通过调节底物浓度,可以控制反应速率和产物产量。
底物浓度对反应速度的影响-雅安职业技术学院

影响因素
酶浓度 底物浓度 pH 温度 抑制剂 激活剂
科学出版社卫生职业教育出版分社
一、酶浓度对酶促反应速度的影响 当[S]>>[E],酶可被底物饱和的情况下,反应 速度与酶浓度成正比。
V
0 酶浓度对反应速度的影响
[E]
科学出版社卫生职业教育出版分社
二、底物浓度对反应速度的影响
在其他因素不变的情况下,底物浓度对反应速度 的影响呈矩形双曲线关系。
LDH2>LDH1>LDH3>LDH4>LDH5
急性心肌梗塞时,血清LDH1和LDH2显着升高
急性肝炎以LDH5明显升高,LDH4不增
科学出版社卫生职业教育出版分社
五、酶活性的调节
一系列酶促反应中,起关键作用的酶叫做关键酶 酶活性的调节对象: 关键酶 酶活性的调节 (变构调节和化学修饰) 酶含量的调节 (酶合成与分解调节)
科学出版社卫生职业教育出版分社
四、 pH对反应速度的影响
不同的的pH下酶的解离状态不同,这直接影响酶 与底物的结合 或影响酶的空间结构, 从而改变 酶的活力。
科学出版社卫生职业教育出版分社
五、激活剂对反应速度的影响
使酶从无活性变为有活性或使酶活性增加的物 质称为酶的激活剂。可分为必需激活剂和非必需激 活剂 酶的激活剂: 无机离子(如Mg2+、Ca2+、K+、Cl- ) 简单有机物(如半胱氨酸,还原型谷胱甘肽等)
即当 V= Vmax
/
2 时,
Vmax 2
意义:
a)
Vmax[S] = Km + [S]
Km=[S]
Km是酶的特征性常数
(Km 只与酶的性质有关, 与酶的浓度无关)
化学反应速率由反应底物浓度决定

化学反应速率由反应底物浓度决定化学反应速率是指化学反应在单位时间内转化的底物或生成物的量。
反应速率的快慢直接影响到化学反应的进程和效率。
为了探究化学反应速率与反应底物浓度之间的关系,科学家们进行了大量的研究,并建立了相应的数学模型。
根据实验观察和理论分析,我们可以得出结论:化学反应速率与反应底物浓度之间存在着正相关关系。
换句话说,反应底物浓度的增加会导致反应速率的增加,反之亦然。
这一关系被称为浓度与速率定律。
浓度与速率定律可以通过实验数据得到。
在实验中,可以固定其他条件,只改变反应底物的浓度,然后观察反应的速率变化。
实验结果表明,当反应底物的浓度增加时,反应速率也随之增加,呈现出明显的正相关关系。
一般来说,反应底物浓度每增加一倍,反应速率也会相应增加一倍。
这种关系可以用数学模型来描述,其中最常见的数学表达式为速率与浓度的指数关系。
根据实验数据的曲线拟合,可以确定浓度与速率之间的关系式。
比如对于一个简单的一级反应,反应速率与反应底物浓度的关系可以用以下方程表示:速率 = k[A]其中,速率表示反应速率,k为速率常数,[A]表示反应底物A的浓度。
这个方程中的指数1表示反应的级数。
一级反应的速率与反应底物浓度成正比,即浓度每增加一倍,速率也增加一倍。
而对于其他级数的反应,则有不同的数学表达式。
反应底物浓度对于化学反应速率的影响可以从分子碰撞理论解释。
根据分子碰撞理论,化学反应需要分子之间发生碰撞才能进行。
当反应底物的浓度增加时,可参与反应的分子数也增加,从而增加了分子之间发生有效碰撞的机会,进而提高了化学反应的速率。
因此,反应底物浓度的增加会加快化学反应的进行。
除了反应底物浓度外,还有其他因素也会对化学反应速率产生影响。
比如温度、反应物质的物理状态、催化剂等。
其中,温度是最重要的因素之一。
一般来说,温度的升高会使反应速率加快,因为温度升高会增加分子的动能,使分子碰撞更加频繁和剧烈。
需要注意的是,反应底物浓度对于反应速率的影响是有限的。
生物化学 第二版 8底物浓度对反应速度的影响

v = —Vm—ax—·—[S] km v [S]
km + [S]
[S] v
谢谢
8.底物浓度对反应速度的影 响
主讲人:
底物浓度对反应速度的影响
酶可以加快反应速度 了解酶促反应速度的影响因素:
➢ 了解酶在代谢中的作用; ➢ 阐明酶的结构与功能的关系; ➢ 在实际生产中优化反应条件,发挥酶的最大作用。
底物浓度对反应速度的影响
酶促反应速度:单位时间内底物的减少或产物的增加;
酶空间结构
单位:mol/L
底物浓度对反应速度的影响
3、米氏常数的意义: ❖ ➢ 与酶的性质与催化的底物和反应条件有关; ➢ 与酶的浓度无关。 不同的酶有不同的Km值; 同一种酶与不同底物作用时,Km值不同;
底物浓度对反应速度的影响
3、米氏常数的意义: ❖ Km值越小,酶对底物亲和力越大,反应速度越快。 ❖ Km值最小的底物为最适底物(天然底物)。
❖当[S]很低时,[S]Km: v = —Vkmm—ax [S]
❖当[S]很高时,[S]Km:
v和[S]成正比
v = Vmax v与底物浓度无关
Байду номын сангаас
底物浓度对反应速度的影响
当[S]= Km时,v = —12 Vmax
即:
v
=
—1 2
Vmax
时,[S]=Km
米氏常数Km:
酶促反应速度为最大速度一半时的底物浓度;
酶的活性
酶促反应速度
酶促反应速度影响因素:
底物浓度、酶浓度、温度、pH、激活剂和抑制剂等。
底物浓度对反应速度的影响
酶与底物的结合:
E+S
ES
E +P
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胃、肠黏膜及肠道寄生虫均有抵抗消化酶的抗酶物质。
科学出版社卫生职业教育出版分社
四、同工酶
同工酶(isoenzyme)是指催化相同的化学反应, 而酶蛋白的分子结构、理化性质乃至免疫学性质不 同的一组酶。如:乳酸脱氢酶(LDH)有5种同工 酶
科学出版社卫生职业教育出版分社
酶的活性中心
活性中心以外 的必需基团
结合基团
底物
催化基团
活性中心
科学出版社卫生职业教育出版分社
三、酶原与酶原的激活
❖ 酶原
有些酶在细胞内合成或初 分泌时,没有催化活性, 这种无活性的酶的前体物 质称为酶原。
酶原
在特定条件下
水解掉一个或 几个短肽
❖ 酶原的激活
分子构象发生改变
形成或暴露出 酶的活性中心
❖酶的特异性可分为: 绝对特异性 相对特异性 立体异构特异性
科学出版社卫生职业教育出版分社
二、酶促反应的特点
(三)高度的不稳定性 酶是蛋白质,易变性,失去活性。
(四)酶促反应的可调节性 调节方式: • 对酶生成与降解量的调节 • 酶催化效力的调节 • 通过改变底物浓度对酶进行调节
科学出版社卫生职业教育出版分社
❖ 酶的活性中心 由酶的必需基团构成,存在于酶分子表面并形成具有特定 空间结构的区域(裂缝或凹陷)
酶的活性中心
科学出版社卫生职业教育出版分社
二、酶的活性中心
必需基团在一 级结构的排列上 可能相距遥远, 但肽链经过盘绕、 折叠后,在空间 结构上彼此靠近, 共同构成酶的活 性中心。
科学出版社卫生职业教育出版分社
❖ 酶所催化的化学反应称为酶促反应。酶促反应中 被酶催化的物质(基质、作用物)称为底物(S), 催化反应所生成的物质称为产物(P)
科学出版社卫生职业教育出版分社
二、酶促反应的特点
(一)高度的催化效率 酶的催化效率通常比非催化反应高108~1020倍,比一般
催化剂高107~1013倍。
(二)高度的特异性 一种酶仅作用于一种或一类化合物
L-天冬氨酸+α-酮戊二酸 草酰乙酸 +L-谷氨酸
L-精氨酸脒基水解酶
L-精氨酸 + H2O L-鸟氨酸+ 尿素
D-果糖1,6-二磷酸: D-果糖1,6-二磷酸 D-甘油醛3-磷酸裂合酶 磷酸二羟丙酮 + D-甘油醛3-磷酸
D-葡萄糖6-磷酸酮醇 异构酶
D-葡萄糖6-磷酸 D-果糖6-磷酸
L-谷氨酸:氨连接酶
科学出版社卫生职业教育出版分社
肠激酶
胰蛋白酶
缬天天天天赖异缬甘
组
46 丝
S
183
S
SS
缬天天天天赖
活性中心 缬
异甘组
丝
S
S
SS
胰蛋白酶原的激活过程
科学出版社卫生职业教育出版分社
酶原激活的生理意义 ❖ 酶原在特定部位和条件下才能被激活,既可避
免酶对自身进行消化,又有助于调控酶活性 ❖ 酶原是酶的储存形式,在需要时,酶原适时地
ATP + L-谷氨酸 + NH3 ADP+磷酸 + L-谷氨酰胺
科学出版社卫生职业教育出版分社
(二)酶的分类
1.氧化还原酶类
AH2+B
A+BH2
如:琥珀酸脱氢酶、细胞色素氧化酶等
2.转移酶类
A-R+C A+C-R
如:氨基转移酶Leabharlann 磷酸化酶等科学出版社卫生职业教育出版分社
3.水解酶类
A-B+H2O
❖ LDH同工酶与疾病的诊断 健康成人血清LDH同工酶有如下的规律:
LDH2>LDH1>LDH3>LDH4>LDH5 急性心肌梗塞时,血清LDH1和LDH2显着升高 急性肝炎以LDH5明显升高,LDH4不增
科学出版社卫生职业教育出版分社
五、酶活性的调节
❖ 一系列酶促反应中,起关键作用的酶叫做关键酶
生物化学
雅安职业技术学院生物化学课程组
第三章 酶
科学出版社卫生职业教育出版分社
主要内容
1 概述 2 酶的结构与功能
酶的作用机制
33
4 影响酶促反应速度的因素 5 酶与医学的关系
科学出版社卫生职业教育出版分社
第1节 概述
一、❖ 酶(的E概n念zyme,E):是一类由活细胞产生的,对 其特异底物具有高效催化作用的蛋白质。
三、酶的命名与分类
(一)酶的命名 1.习惯命名法——推荐名称
以酶催化的底物、反应的性质以及酶的来源命名。
2.系统命名法——系统名称 标明酶的所有底物与反应性质,并附有一个4位
数字的分类编号。
科学出版社卫生职业教育出版分社
一些酶的命名举例
编号 推荐名称
系统名称
催化的反应
EC1.4.1.3 谷氨酸 脱氢酶
A-H+B-OH
如淀粉酶、蛋白酶、脂肪酶、磷酸酶等
4.裂合或裂解酶类
A-B A+B
如柠檬酸合酶、醛缩酶等
科学出版社卫生职业教育出版分社
5.异构酶类
A
B
如:磷酸丙糖异构酶、磷酸己糖异构酶等
6.合成酶类
A+B+ATP A-B+ADP+Pi 如:谷氨酰胺合成酶、谷胱甘肽合成酶等
科学出版社卫生职业教育出版分社
科学出版社卫生职业教育出版分社
二、中间产物学说
酶能显著降低反应所需活化能,是因为在发挥 催化作用之前,酶的活性中心与底物定向结合生成 酶底物复合物(ES),然后生成产物,并释放出酶
E + S ES
E+P
❖酶活性的调节对象: 关键酶
❖ 调节方式
酶活性的调节 (变构调节和化学修饰)
酶含量的调节 (酶合成与分解调节)
科学出版社卫生职业教育出版分社
第3节 酶的作用机制
一、大幅降低反应的活化能
❖ 为什么酶具有高度的催化效率? ❖ 酶通过其特有的作用机制,使底物只需要较少的能量就能
进入活化态,进而转变成产物
EC2.6.1.1 天冬氨酸氨 基转移酶
EC3.5.3.1 精氨酸酶
EC4.1.2.13 果糖二磷酸 醛缩酶
EC5.3.1.9 磷酸葡萄糖 异构酶
EC6.3.1.2 谷氨酰胺 合成酶
L-谷氨酸:NAD+ 氧化还原酶
L-天冬氨酸:α-酮 戊二酸氨基转移酶
L-谷氨酸 + H2O + NAD+ α-酮戊二酸 + NH3 + NADH
第2节 酶的结构与功能
一、 根酶据的酶分的子分组子成组成分为单纯酶和结合酶
❖单纯酶:仅由氨基酸残基构成的酶 ❖结合酶:由蛋白质部分和辅助因子组成的酶
全酶
蛋白质部分:酶蛋白
辅助因子
小分子有机化合物(维生素)
金属离子(K+、Na+ 、 Mg+)
科学出版社卫生职业教育出版分社
二、酶的活性中心
❖ 酶的必需基团 酶分子的氨基酸残基侧链的化学基团中,与酶活性密切 相关的化学基团 常见的必须基团:-COOH,-NH2,-OH,-SH
