《预测同主族元素的性质》导学案.doc
《预测同主族元素的性质》名师教案

预测同主族元素的性质【教材分析】本节是课改后使用的新教材的鲁科版《化学2(必修)》第一章《原子结构和元素周期律》第三节元素周期表的应用。
本节内容是在学过原子结构和元素周期律、元素周期表之后,结合〈化学1(必修)〉中学过的元素化合物知识,让学生根据原子结构设计实验去验证。
这样可以培养学生的探究能力,并引导学生学会运用元素周期律和元素周期表进行化学的学习和科学研究。
【教学目标】1知识与技能目标:以卤素和碱金属元素为例,掌握同主族元素性质的递变规律;初步学会运用元素周期表。
2过程与方法目标:学会运用具体事物来研究抽象概念的思想方法;学会运用元素周期表指导探究化学知识的学习方法。
3情感态度与价值观目标:通过“活动探究”培养学生的实验能力以及对实验结果的分析、处理和总结能力。
【教学重难点】(一)、知识重、难点:1、同主族元素性质递变规律2、元素位、构、性三者的关系(二)、方法上的重、难点:学会用元素周期律和元素周期表探究和学习元素化合物知识的方法【教学方法】演示实验法小组讨论法【课型】新授课【课时】第二课时【教学过程】[新课引入]1871年,门捷列夫预言:在硅和锡之间肯定存在一种元素并预言了它的性质,门捷列夫将其称为“类铝”,并预测了它的性质。
四年之后,德国的化学家文克勒发现了这种元素---锗(Ge),并通过实验证实了门捷列夫的预测。
门捷列夫为何能做出如此惊人的预测你想拥有这样的“超”能力吗那就请走进我们今天的新课———预测同主族元素性质的递变规律。
学生自主学习环节(30分钟)[板书]第三节元素周期表的应用同主族元素性质的递变规律[学生活动]请学生书写卤族和碱金属元素原子的结构示意图进行分析,小组讨论大屏幕上的两个问题,一会派小组代表发言。
问题一:同主族元素原子的核外电子排布有哪些相同点和不同点问题二:尝试用元素原子的核外电子排布规律预测同主族元素原子失电子或得电子能力的相对强弱[小组讨论](3分钟)[学生小组代表发言](2分钟)[教师总结](1分钟)大家根据核外电子排布做出了预测,1相似性:同主族元素最外层电子数相等。
新编鲁科版化学必修2学案:第1章 第3节 第2课时 预测同主族元素的性质 Word版含解析

第2课时预测同主族元素的性质[课标要求]1.以第ⅠA族、第ⅦA族元素为例,掌握同主族元素性质的递变规律。
2.能运用原子结构理论初步解释同主族元素性质的递变规律。
3.能根据同主族中熟悉元素的性质特点预测不熟悉元素的性质。
4.了解元素周期表中各个区域元素的应用。
同主族元素,随核电荷数的增加:(1)元素原子得电子能力逐渐减弱,失电子能力逐渐增强。
(2)元素最高价氧化物对应水化物酸性逐渐减弱,碱性逐渐增强。
(3)气态氢化物稳定性逐渐减弱,还原性逐渐增强。
(4)单原子离子的还原性逐渐增强,氧化性逐渐减弱。
第ⅦA族元素性质的相似性和递变性1.第ⅦA族元素原子结构和性质的相似性(1)原子的最外电子层都有7个电子。
(2)最高正价除F外均显+7价,最低负价为-1价。
(3)气态氢化物的通式为HX(X表示卤素)。
(4)最高价氧化物对应的水化物的通式为HXO4(F除外),且都具有很强的酸性。
(5)在氧化还原反应中,它们的单质常做氧化剂。
2.性质的递变性[特别提醒](1)F元素无含氧酸,因F元素无正价。
(2)HF为弱酸,HCl、HBr、HI均为强酸。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大(×)(2)卤素单质都是有色物质(√)(3)HCl、HBr、HI的还原性依次减弱(×)(4)卤族元素的单质越活泼,其熔点和沸点就越高(×)2.已知砹(At)元素位于元素周期表第6周期、第ⅦA族,请利用所学知识分析下列说法错误的是()A.砹单质可能为黑色固体B.气态氢化物稳定性:HAt>HIC.还原性:At->I-D.AgAt难溶于水解析:选B根据同主族元素性质的相似性和递变性分析。
A项,由F2、Cl2、Br2、I2单质颜色逐渐加深可知A正确;B项,得电子能力I>At,故稳定性:HI>HAt;C项,由离子半径:r(At-)>r(I-)知还原性:At->I-;D项,由AgX(F除外)均难溶于水知AgAt难溶于水。
山东潍坊高中化学 1.3 元素周期表的应用预测同主族元

预测同主族元素的性质教学设计教学环节教师活动学生活动设计意图【知识回顾】通过上节课同周期元素性质的递变规律的学习,回顾:,1、如何判断元素原子失电子能力(元素金属性)的强弱?2、如何判断元素原子得电子能力(元素非金属性)的强弱?3、同周期元素(除稀有气体外)自左向右,随着元素序数的递增,原子半径,元素得电子能力(元素非金属性)、失电子能力(元素金属性)如何变化?学生回顾上节课主要内容,然后自由发言。
学生回忆上节课主要内容,在知识结构的构建上能形成知识网络。
【引入新课】门捷列夫的预言:1971年门捷列夫预言了类硅元素的存在。
并准思考问题:门捷列夫是如何准确的预言未知元素的性质的?确的预言了这种未知元素的相关性质。
15年后,科学家发现了这种元素,就是我们今天认识的锗。
通过图片中的数据,我们发现,锗的性质与门捷列夫的预言及其相似。
思考:同主族元素性质具有怎样的变化规律?请从原子结构方面给予预测学生画第1主族元素,结构示意图,预测同主族元素性质。
【学习目标】1.以第ⅠA族、ⅦA元素为例,掌握同主族元素相似性和递变性的变化规律,并能用原子结构理论初步加以解释。
2.通过探究金属钠、钾性质实验,锻炼实验设计和归纳概括能力。
3.了解元素“位置、结构、性质”三者间的关系,初步学会运用元素周期表推测物质性质。
学生了解本节课学习目标【评价方式】▪主动回答一次问题得1分。
▪主动展示实验成果得3分。
▪学习委员做好得分统计,纳入量化。
【自主学习】【提出问题】1. 以ⅠA族或ⅦA族元素为例,说明同主族元素原子的核外电子排布有什么特点?2. 请你推测同主族元素性质的相似性和递变性,并尝试着从你学过的物质及变化中为你的推测寻找依据。
自主学习课本23页到24页前两段,完成表格1-表格2学生思考总结归纳培养学生分析归纳能力。
【小组讨论】 1. 同主族元素的相似性和递变性性质为:2. 请你从学过的化学反应中为同主族元素性质递变性规律寻找证据。
研究同主族元素的性质 学案 高中化学新鲁科版必修第二册(2022年)

1.3.2 研究同主族元素的性质1.以ⅠA族和ⅦA族元素为例,理解同主族元素性质的相似性和递变性,并能解释原因。
2.结合实验事实了解原子结构、元素性质和元素在周期表中的位置的关系,巩固元素周期律,初步学会运用元素周期表。
同主族元素性质的相似性和递变性判断元素的金属性强弱的方法:①。
②。
判断元素非金属性强弱的方法:①。
②。
【情景引入】情景一:美国华裔科学家叶军领导一个研究小组成功制造出全球最准确的时钟,两亿年误差不足一秒。
它是一个锶原子钟,比铯原子喷泉钟准确的多,估计可大大促进不同的电讯网络的发展,将使全球各地的船只导航变得更为准确。
情景二:许多化学家试图从氢氟酸中提取出单质氟,但都因在实验中吸入过量氟化氢而死,于是被迫放弃了实验。
莫瓦桑设计了一整套抑制氟剧烈反应的办法,终于在1886年制得了单质氟,擒获了“死亡元素”。
【交流研讨1】1.锶位于元素周期表的位置?预测金属锶与水反应的现象?如果实验室有金属锶的话,你认为应该如何保存?2.氟元素的非金属性在元素周期表中是否是最强的?根据所学知识对比其性质与非金属氯的性质发现了什么?【交流研讨2】1.在元素周期表中,同主族元素原子的核外电子排布有什么特点?请以ⅠA族和ⅦA族元素为例,推测同主族元素性质的相似性和递变性。
2.阅读课本P22-24,填写下表。
尝试为你的推测寻找证据。
【小结】1.碱金属元素:①物理性质相似性:。
递变性:。
②化学性质相似性:。
递变性:。
2.卤族元素:①物理性质相似性:。
递变性:。
②化学性质相似性:。
递变性:。
【活动探究】探究卤族元素性质的相似性和递变性实验目的:分别以卤族元素单质和卤化物为典型代表物设计实验,验证卤族元素性质的相似性和递变性。
实验用品:NaCl溶液,NaBr溶液,KI溶液,氯水,溴水,碘水,淀粉溶液,四氯化碳;烧杯,试管,胶头滴管。
实验方案设计:以小组为单位,结合上述内容,预测性质并给出依据,设计实验方案验证:【归纳总结】同主族元素性质递变规律1.运用元素周期表和元素周期律分析下面的推断,下列说法不合理的是()A.PH3、H2S、HCl的热稳定性和还原性从左到右依次增强B.若X+和Y2-的核外电子层结构相同,则原子序数:X>YC.硅、锗都位于金属与非金属的交界处,都可以做半导体材料D.Cs和Ba分别位于第6周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)22.下列关于第ⅠA族和第ⅦA族元素的说法正确的是()①第ⅠA族元素都是金属元素②第ⅠA族元素都能形成+1价的离子③第ⅦA族元素的最高正价都为+7④第ⅦA族元素从上到下简单气态氢化物的热稳定性逐渐减弱A.①③B.②③C.②④D.③④3.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是()①金属性最强的是锂②形成的离子中,氧化性最强的是锂离子③在自然界中均以化合态形式存在④Li的密度最小⑤均可与水反应,产物均为MOH和H2⑥它们在O2中燃烧的产物都有M2O和M2O2两种形式⑦粒子半径:Rb+>K+>Na+,Cs>Cs+A.①②③④⑤B.③④⑤⑥⑦C.①②④⑥⑦D.②③④⑤⑦4.下列说法正确的是()A.碱金属元素单质的熔点随原子序数递增而降低B.同种元素的原子均有相同的质子数和中子数C.族序数等于其周期序数的元素一定是金属元素D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强5.下列关于卤素的说法正确的是()A.“加碘食盐”中的“碘”是指I2B.液溴有挥发性,保存时应加少量水液封C.F2可以从NaCl的水溶液中置换出Cl2D.卤化氢都易溶于水,其水溶液都是强酸6.A、B、C、D、E为原子序数依次递增的短周期主族元素。
高中化学鲁科版2019必修二第1章第3节第2课时研究同主族元素的性质预测元素及其化合物的性质学案

第2课时研究同主族元素的性质预测元素及其化合物的性质学习目标1.通过对同主族元素的原子结构特点的分析,理解并认识同主族元素性质的相似性与递变性。
2.通过ⅠA族、ⅦA族元素性质的变化规律,能形成同主族元素性质的认知模型,并利用该模型预测元素及其化合物的性质。
3.通过卤素的有关性质实验探究,培养设计元素性质比较实验的能力。
学习任务1 研究同主族元素的性质1.碱金属元素原子结构和性质的递变关系(1)碱金属元素的含义:除氢元素外ⅠA族的金属元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)。
(2)碱金属元素原子结构上的相似与递变。
(3)碱金属元素单质化学性质的相似与递变2.ⅦA族元素(卤族元素)原子结构与性质的递变关系(1)原子结构与性质的相似性。
(2)原子结构与性质的递变性。
3.同主族元素性质相似与递变的理论解释4.碱金属单质的物理性质及递变规律溴单质、碘单质在水中溶解度都很小,但在四氯化碳、汽油、苯等有机溶剂中的溶解度均远大于它们在水中的溶解度,且在这些有机溶剂中分别呈现橙色、紫色。
利用这一性质,可以向含有溴单质、碘单质的水溶液中加入有机溶剂,分别将它们从水溶液中提取出来,可据此来检验水溶液中溴单质或碘单质的存在。
为了验证卤族元素性质的相似性和递变性,设计如下实验并记录相关实验现象。
探究1 卤素单质的溶解性及溴、碘单质的检验问题1:通过实验1、2,对于溴、碘单质的溶解性有何认识?提示:溴、碘单质在有机溶剂CCl4中的溶解度均大于它们在水中的溶解度,CCl4能分别将它们从水溶液中提取出来。
问题2:实验1、2所体现出来的溴、碘的性质有何应用?提示:(1)用难溶于水的有机溶剂萃取溴、碘单质;(2)检验水溶液中的溴单质和碘单质。
问题3:呈现橙红色的溴、紫红色的碘的四氯化碳溶液都在下层,说明四氯化碳有何特点?如果换用汽油会怎么样?提示:说明四氯化碳的密度大于水的;若换用汽油,溶有溴、碘单质的有机层会在上层,因为汽油的密度小于水的。
高中化学_元素周期表的应用(第2课时)教学设计学情分析教材分析课后反思

鲁科版高一化学必修2第一章第三节元素周期表的应用第2课时预测同主族元素的性质§1-3 元素周期表的应用(第2课时)预测同主族元素的性质一、【教材分析】(一)知识脉络在学过原子结构、元素周期律和元素周期表之后,结合《化学1(必修)》中学习的大量元素化合物知识,通过对第3周期元素原子得失电子能力强弱的探究,整合ⅧA族元素及其化合物的性质,以及对金属钾性质的预测等一系列活动,归纳得出同周期、同主族元素的性质递变规律,体会元素在周期表中的位置、元素的原子结构、元素性质(以下简称“位、构、性”)三者间的关系,学会运用元素周期律和元素周期表指导化学学习、科学研究和生产实践。
(二)知识框架本节教学知识内容主要包括三个部分,即三个课时完成。
一是认识同周期元素性质递变外规律;二是预测同主族元素的性质递变规律分两个课时完成学习任务;三是“位、构、性”关系规律及应用。
本课时的是第二课时。
(三)与其它版本教材区别人教版教材是在元素周期表基础上,根据第ⅠA族和第ⅦA族元素性质的递变通过归纳得出元素周期律;而鲁科版教材则是在学过元素周期律和元素周期表之后,让学生根据原子结构理论预测第3周期、第ⅠA族和第ⅦA族元素原子得失电子能力的递变规律和金属钾性质,再通过自己设计实验去验证。
教材这样处理旨在培养学生的探究能力,引导学生学会运用元素周期律和元素周期表来指导化学学习和科学研究。
我认为这一点更符合学生认知规律。
(四)本课时地位和作用第二课时更是利用第一课时掌握的研究问题的方式方法的基础上,进一步探究同主族的规律,从而进一步完善元素周期表元素性质的相似性和递变性规律。
为第三课时研究“位、构、性”打下坚实基础。
二、【学情分析】本节是鲁科版《化学2(必修)》第一章《原子结构和元素周期律》第三节,元素周期表的应用。
本章第一节和第二节的内容主要介绍了原子结构、元素周期律和元素周期表的知识,学生已经掌握原子核外电子排布的规律和元素周期律的知识,认识了元素周期律是原子核外电子排布周期性变化的必然结果,元素周期表是周期律的具体表现形式,初步了解了元素周期表的意义和重要用途,知道了元素周期表是今后学习化学和进行科学研究的重要工具。
高中化学_预测同主族元素的性质教学设计学情分析教材分析课后反思

根据教材安排,在实际教学中应注意:1、将“VIIA族元素性质,IA族元素性质”的教学线索与“同主族元素的性质递变规律”相融合,借机对卤族元素的性质进行整合。
2、通过分析整合Cl2、Br2、I2的性质,经过交流研讨,发现同主族元素性质规律,整合思考之后,可用于IA族K元素性质的预测。
3、在预测K的性质之后,可适当进行演示实验以完善课堂内容,增加学生的学习兴趣。
教材分析教材安排设计有如下特点:1、依据已学过的氟氯溴碘的知识,进行知识总结,并进行原因探查,总结整合出的规律可应用指IA族检验,通过预测K的性质作为总结。
2、进一步拔高元素的位置——原子的结构——元素的性质的关系,整合同周期和同主族元素的性质变化规律。
3、元素周期表在生产实践中的指导作用,让学生领会到化学对个人生活和社会发展的贡献,培养学生将化学知识应用于生产生活实践的意识。
通过同周期和同主族元素性质变化的学习,学生进一步深化了元素的性质与结构之间的关系认识,能合理的分析解决有关周期律和周期表的相关题目。
学情分析在进行本部分内容之前,学生已经学习同周期元素性质的递变性,并能根据半径大小和金属性、非金属性强弱比较方法进行理论上的解释,注意到了结构与性质变化的关系,为同主族元素的性质的相似性和递变性做好了准备。
评测练习1.判断正误(正确的打“√”,错误的打“×”)。
(1)卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大(2)卤素单质都是有色物质(3)HCl、HBr、HI的还原性依次减弱(4)卤族元素的单质越活泼,其熔点和沸点就越高2.已知砹(At)元素位于元素周期表第6周期、第ⅦA族,请利用所学知识分析下列说法错误的是()A.砹单质可能为黑色固体B.气态氢化物稳定性:HAt>HIC.还原性:At->I-D.AgAt难溶于水3.在元素周期表中的金属元素和非金属元素的分界线附近可以找到() A.耐高温材料B.新型农药材料C.半导体材料D.新型催化剂材料4.碲(Te)是52号元素,位于周期表中第ⅥA族,处于金属区与非金属区的交界线上。
鲁科版高中化学必修第二册第1章第3节新知探究课6研究同主族元素的性质预测元素及其化合物的性质学案
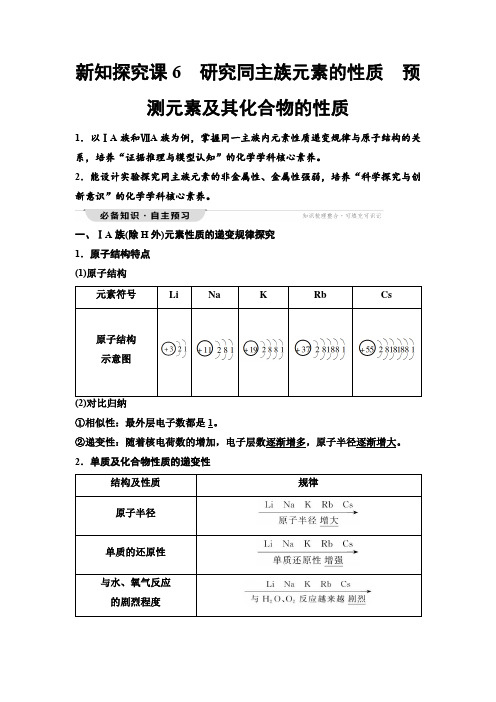
新知探究课6研究同主族元素的性质预测元素及其化合物的性质1.以ⅠA族和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系,培养“证据推理与模型认知”的化学学科核心素养。
2.能设计实验探究同主族元素的非金属性、金属性强弱,培养“科学探究与创新意识”的化学学科核心素养。
一、ⅠA族(除H外)元素性质的递变规律探究1.原子结构特点(1)原子结构元素符号Li Na K Rb Cs原子结构示意图①相似性:最外层电子数都是1。
②递变性:随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
2.单质及化合物性质的递变性结构及性质规律原子半径单质的还原性与水、氧气反应的剧烈程度最高价氧化物对应水化物的碱性3.碱金属元素的性质与原子结构之间的关系从Li→Cs,最外层电子数均为1,但随核电荷数的增加,电子层数逐渐增多→原子半径逐渐增大→原子核对最外层电子(1个)的引力逐渐减弱→元素原子的失电子能力逐渐增强→元素的金属性逐渐增强。
(正确的打“√”,错误的打“×”)(1)Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多。
()(2)碱金属元素在自然界中能以游离态存在。
()(3)碱金属元素的最外层电子数相同,所以与水反应的剧烈程度相同。
() [答案](1)√(2)×(3)×二、卤族元素性质的递变规律探究1.卤族元素原子结构和性质的相似性元素(名称与符号)氟(F)氯(Cl)溴(Br)碘(I)原子结构示意图最外层都为7电子数最高正价无+7价最低负价都为-1价自然界中存在形态全部以化合态形式存在最高价含氧酸无HClO4HBrO4HIO4气态氢化物HF HCl HBr HI (1)卤族元素单质的物理性质及递变性单质F2Cl2Br2I2物理性质颜色淡黄绿色黄绿色深红棕色紫黑色状态气体气体液体固体密度逐渐增大熔、沸点逐渐升高(2)卤素元素原子结构及单质化学性质递变性元素F Cl Br I 电子层数逐渐增多原子半径逐渐增大得电子能力逐渐减弱失电子能力逐渐增强单质与H2化合的条件暗处爆炸点燃或光照加热至一定温度不断加热的情况下,缓慢反应,可逆氢化物的稳定性逐渐减弱最高价氧化物对应水化物的酸性—逐渐减弱(3)探究卤族元素性质的相似性和递变性实验操作实验现象化学方程式静置后,液体分层,上层无色,下层橙色Cl2+2NaBr===2NaCl+Br2静置后,液体分层,上层无色,下层紫色Br2+2KI===2KBr+I2静置后,液体分层,上层无色,下层紫色Cl2+2KI===2KCl+I2结论:卤素单质的氧化性:Cl2>Br2>I2;卤素离子的还原性:I->Br->Cl -。
高中化学必修二《预测同主族元素的性质》教案

1.3.2 预测同主族元素的性质
课型:新授使用人使用时间
【知识序列要求的教学内容】:
了解元素周期表的结构以及周期、族等概念。
通过自学有关周期表的结构的知识,培养学生分析问题、解决问题的能力。
通过精心设计问题,激发学生的求知欲和学习热情,培养学生的学习兴趣。
【学情分析】通过本章前面两节的学习,学生对元素周期律和元素周期表有了初步的了解,本节课是对元素周期表的进一步学习,学习卤族元素性质的递变规律,并以此类推其它主族元素性质的递变规律。
并在此过程中培养学生自主学习的能力、归纳总结、推理等能力。
[教学目标]
1.以卤族元素、碱金属元素为例,掌握同主族元素性质的递变规律。
2.能运用原子结构理论初步解释同主族元素性质的递变规律。
[教学重难点] 同主族元素性质的相似性、递变性
【教学方法】讨论、比较、归纳。
《预测同主族元素的性质》导学案

第三节元素周期表的应用(第2课时)主备:邢永宁审核:李丽马伟民仵鸿雨教师寄语:成功源于不断的积累!【学习目标】1.掌握以ⅦA族和ⅠA族为代表的同主族元素性质的递变规律2.通过探究实验的学习,培养学生的实验设计能力。
3.了解元素周期表在生产实践中的指导作用。
【课前小测】1.同周期元素性质的递变规律2.第ⅠA族包括七种元素,第ⅦA族包括。
【预习】课本P22【交流·研讨】【预测同主族元素的性质】【自学课本P23】【自测填表】①ⅦA族元素元素符号原子结构示意图单质与H2化合最高价氧化物对应的水化物原子得电子能力条件难易氢化物稳定性化学式酸性强弱F ClBrI结论:第ⅦA族元素最外层都有个电子,在化学反应中都易电子,它们原子得电子能力都,都是的非金属元素。
它们都能形成气态氢化物,最高价氧化物的水化物都是,能与大多数金属,其单质常做剂。
但是从氟到碘,原子电子层数,原子半径,失电子能力,得电子能力。
②单质的氧化性实验探究(F2、Cl2、Br2、I2)实验步骤实验现象离子方程式向1mL溴化钠溶液中加入1mL氯水,再加入2mL四氯化碳用力振荡向1mL碘化钠溶液中加入1mL氯水,再加入2mL四氯化碳用力振荡向1mL碘化钠溶液中加入1mL溴水,再加入2mL四氯化碳用力振荡结论:注意:氧族、氮族等非金属主族元素性质的递变规律类似ⅦA族元素,但原子得电子能力比同周期的ⅦA族元素。
二、根据同主族元素性质的相似性和递变规律预测某种元素单质和化合物的性质【自学课本P23观察·思考】预测金属钾的性质【实验设计】(1)钠、钾跟水反应的实验(请填写课本上的表)注意:实验时,剩余的钠钾要。
(2)预测ⅠA族元素(又称碱金属元素)性质的递变元素符号原子结构示意图原子半径原子失电子能力最高价氧化物水化物单质反应的剧烈程度与水与O2的碱性【自学】三、元素周期表对生产实践的指导作用1、预测新元素2、寻找半导体材料3、催化剂的选择4、耐高温、耐腐蚀的特种合金材料的制取5、寻找合适的超导材料、磁性材料6、矿物的寻找【当堂检测】1.某主族元素最外层只有1个电子,则该元素一定是:A.第ⅠA族元素B.第ⅦA元素C.第三周期元素D.金属元素2.现在含有元素硒(Se)的保健品开始进入市场,已知硒元素与氧元素同主族,与钾元素同周期,则下列关于硒的叙述中不正确的是A.原子序数为34 B.最高价氧化物的化学式为SeO3C.原子得电子能力Se>S D.气态氢化物化学式为H2Se3.砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是A.AsH3比NH3稳定B.可以存在-3、+3、+5等多种化合价C.As2O5对应水化物的酸性比H3PO4弱D.单质的氧化性磷比砷强4.已知W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y,W原子最外层电子数不超过最内层电子数,X原子第二层电子数是其它各层电子数之和的2倍,Y原子形成的气态氢化物分子与形成的最高价氧化物分子的电子数之比为5:11,Z是地壳中含量最多的元素。
预测同主族元素的性质学案

第2课时预测同主族元素的性质[学习目标定位]能根据学习过的一些典型元素的性质预测同主族其他元素的性质,学会运用元素周期表学习元素化合物知识的方法。
【基础链接】1.在元素周期表中,同主族元素原子的核外电子排布有什么特点?它对元素的性质有何影响?2.第ⅦA族元素包括氟(F)、________、________、________、砹(At)五种元素。
它们的原子结构相同点是________________________________________,除氟外,它们的最高正化合价为________。
3.第ⅠA族元素除氢外,包括锂(Li)、________、__________、________、________、钫(Fr),都是金属,最外层有______电子,元素的最高化合价为________。
知识点一ⅦA族元素性质递变规律【探究活动】阅读教材P22两页内容,联系我们学过的Cl2、Br2、I2的性~23质,填写下表,体会原子结构、周期表中的位置及元素性质的关系,与大家共同交流。
【归纳总结】同主族从上到下,一方面,元素原子的最外层电子数相同,决定了该族元素的性质具有相似性。
另一方面,随着电子层数的增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。
同主族元素的单质及化合物的性质也呈现出相似性和递变性。
知识点二预测同主族元素的性质【探究活动】1.请你根据钾在周期表中的位置,预测金属钾的性质,并与金属钠的性质进行比较。
【实验探究】分别向两只培养皿中加水至其容积的1/2,并滴加2滴酚酞试液,然后分别加入绿豆大小的金属钾和钠,观察反应的剧烈程度,记录现象实验内容实验现象结论钾与水反应浮:金属钾浮在水面上钾和钠都能跟水发生剧烈反应,但钾跟水反应比钠跟水反应更剧烈,说明钾比钠失去电子能力更强,跟预测完全相符。
2K+2H2O===2KOH+H2↑2Na+2H2O===2NaOH+气:有气体产生球:熔化成闪亮的小球游:小球四处游动声:发出“嘶嘶”的声音色:反应后的溶液(滴有酚酞试液)变红燃:钾很快燃烧起来,并产生浅紫色火焰钠与水反应浮:金属钠浮在水面上阅读自学:教材P 24页两自然段。
专题1同周期同主族元素性质的递变(导学案)高一化学(原卷版)

第四章物质结构元素周期律第二节元素周期律专题1(实验活动3)同周期、同主族元素性质的递变【学习目标】1.通过重点知识回顾,结合实验探究,加深对同周期、同主族元素性质递变规律的认识。
2.通过典型问题讨论,核心知识深度理解及应用,进一步体会元素周期表和元素周期律在学习元素化合物知识中的重要作用。
3.通过讨论交流,强化概念的理解,培养运用比较、归纳等方法对信息进行加工及数据处理的能力,促进证据推理与模型认知、科学探究与创新意识等学科核心素养的形成。
【学习重点】实验探究同周期、同主族元素性质的递变【学习难点】同周期、同主族元素性质的递变原因分析【课前预习】旧知回顾:1.元素周期表中同周期主族元素从左至右,随原子序数增加,原子半径逐渐,原子核对最外层电子的吸引力逐渐,失电子能力逐渐,得电子能力逐渐,元素金属性逐渐,非金属性逐渐。
2.同周期主族元素(除稀有气体外),随原子序数的增加,原子半径逐渐;同主族元素的原子半径,随原子序数的增加,原子半径逐渐,元素金属性逐渐,非金属性逐渐。
新知预习:1.金属(填“有”或“无”,下同)负化合价,非金属既正化合价又负化合价,氟正价,氧最高正价;非金属的负化合价一般只有种,但正化合价可能有种;原子序数为11~17的元素的最高化合价和最低化合价的变化规律是、最高化合价和最低化合价的数值与原子核外最外层电子数的关系是。
情景导入:前面通过我们对最典型的金属元素(碱金属)、最典型的非金属元素(卤族元素)的学习可知:同一主族元素,随着元素原子序数的递增,原子核对外层电子的吸引力逐渐减弱,元素的金属性逐渐增强,而非金属性逐渐减弱,同一周期元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强,且呈周期性变化,本节课我们将在了解同周期、同主族元素性质的递变规律的基础上,进一步认识和理解同周期、同主族元素性质的递变性,并通过实验来进行验证。
一、重点知识回顾与突破活动一、同周期、同主族元素性质的递变任务一、讨论交流:同主族元素性质有哪些变化规律?并填写下表内容:些重要方法?【对应训练】1.能用于比较硫、氯两种元素非金属性强弱的是()A.熔点:S>Cl2B.酸性:HClO4>H2SO4C.相对原子质量:Cl>S D.氧化性:HClO>H2SO32.下列说法不正确的是()A.ⅠA族元素的金属性一定比ⅠA族元素的金属性强B.锗和硅都可用作半导体材料C.同周期主族元素(除零族元素)的原子半径从左到右逐渐减小D.1mol气态氢化物断键所需能量由大到小:HF>HCl>HBr>HI活动二、探究元素“位、构、性”之间的关系任务一、结合所学知识,思考判断元素金属性、非金属性强弱的方法有哪些?【注意】任务二、讨论交流:元素的“位置、结构、性质”之间有何关系及其应用?【注意】【对应训练】1.下列有关性质的比较,不能..用元素周期律解释的是( ) A .非金属性:Cl >S B .热稳定性:Na 2CO 3>NaHCO 3 C .酸性:HNO 3>H 2CO 3D .金属性:K>Na>Li2.短周期的主族元素X 、Y 、Z 、W 在元素周期表中的相对位置如表所示,下列有关说法正确的是( )A .X 的简单氢化物有可能与Z 、W 的氢化物反应B .Y 的单质、氧化物均只能与强碱反应,不能与酸反应C .Z 的最高价氧化物对应的水化物一定是强酸D .X 、Y 、Z 、W 四种元素中可能有两种为金属元素 二、实验探究同周期、同主族元素性质的递变 【实验仪器】试管、试管夹、试管架、量筒、胶头滴管、酒精灯、白色点滴板、镊子、砂纸、火柴。
高中化学《预测同主族元素的性质》导学案+课后提升练习

第2课时预测同主族元素的性质[学习目标] 1.能根据学习过的一些典型元素的性质预测同主族其他元素的性质。
2.学会运用元素周期表学习元素化合物知识的方法。
一、卤族元素性质的相似性与递变性[自主学习]1.第ⅦA族元素原子结构和性质的相似性(1)原子的最外电子层都有□017个电子。
(2)最高正价除F外均显□02+7价,最低负价为□03-1价。
(3)气态氢化物的通式为□04HX(X表示卤素)。
(4)最高价氧化物对应的水化物的通式为□05HXO4(F除外),且都具有很强的□06酸性。
(5)在氧化还原反应中,它们的单质常做□07氧化剂。
2.性质的递变性写出证明卤族元素单质的氧化性由上到下逐渐减弱的离子方程式。
提示:Cl2+2Br-===Br2+2Cl-,Cl2+2I-===I2+2Cl-,Br2+2I-===I2+2Br-。
[点拨提升]1.卤素单质性质的相似性(1)与H 2反应:X 2+H 2==============一定条件2HX(I 2与H 2的反应为可逆反应)。
(2)与活泼金属(如Na)反应:2Na +X 2=====点燃2NaX 。
(3)与H 2O 反应 ①X 2+H 2OHX +HXO(X =Cl 、Br 、I);②2F 2+2H 2O===4HF +O 2。
2.卤素单质性质的递变性 (1)氧化性与还原性随着原子序数的递增:卤素单质的氧化性逐渐减弱,卤素阴离子的还原性逐渐增强。
①单质间的置换反应 Cl 2+2Br -===Br 2+2Cl -, Cl 2+2I -===I 2+2Cl -, Br 2+2I -===I 2+2Br -。
②卤素单质与变价金属(如Fe)反应时,F 2、Cl 2、Br 2生成高价卤化物(如FeX 3),而I 2只能生成低价卤化物(如FeI 2)。
(2)与H 2反应的难易及氢化物稳定性随着原子序数的递增,与H 2反应越来越难,生成的氢化物的稳定性逐渐减弱。
F 2+H 2===2HF(暗处发生爆炸), Cl 2+H 2==============光照或点燃2HCl , Br 2+H 2=====200℃2HBr ,I 2+H 2高温2HI 。
2017_2018学年高中化学元素周期表的应用第2课时预测同主族元素的性质同步备课学案鲁科版
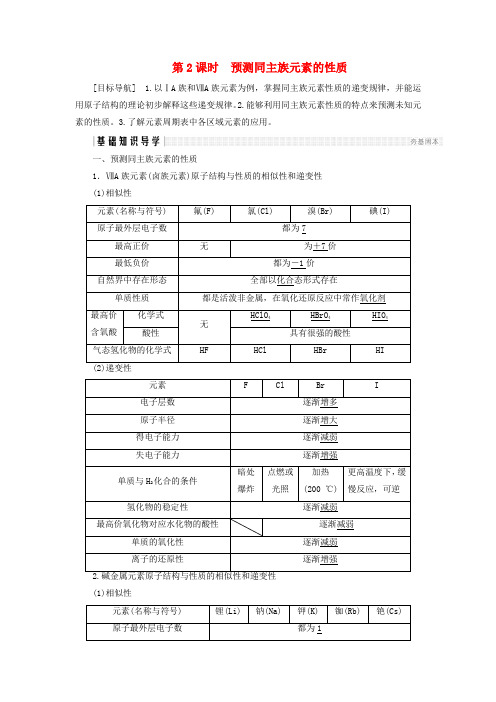
第2课时预测同主族元素的性质[目标导航] 1.以ⅠA族和ⅦA族元素为例,掌握同主族元素性质的递变规律,并能运用原子结构的理论初步解释这些递变规律。
2.能够利用同主族元素性质的特点来预测未知元素的性质。
3.了解元素周期表中各区域元素的应用。
一、预测同主族元素的性质1.ⅦA族元素(卤族元素)原子结构与性质的相似性和递变性(1)相似性(1)相似性(1)同主族元素性质的相似性同主族元素原子的最外层电子数相同,所以同主族元素性质具有相似性。
(2)同主族元素性质的递变性同主族元素原子的电子层数依次增多,原子半径逐渐增大,原子得电子的能力(元素的非金属性)逐渐减弱,失电子的能力(元素的金属性)逐渐增强。
【议一议】1.根据元素周期表推断第1~6周期中最活泼的金属元素和非金属元素分别是什么?在元素周期表中处于什么位置?答案最活泼的金属元素为铯,在元素周期表的左下角,最活泼的非金属元素为氟,位于元素周期表的右上方。
2.元素周期表中ⅠA族元素全部是碱金属元素吗?答案ⅠA族元素除H外都是碱金属元素。
3.你能说明同主族元素性质相似性和递变性的原因吗?答案同主族元素原子的最外层电子数相同,所以同主族元素性质具有相似性。
同主族元素原子的电子层数逐渐增多,原子半径增大,所以元素原子失电子能力增强,得电子能力减弱,元素的金属性增强,非金属性减弱。
二、元素周期表在科研及生产中的应用1.科学预测物质的性质根据元素在元素周期表中的位置,推测元素的原子结构,从而可以预测其主要性质。
2.寻找可合成特定性质的物质(1)在金属元素和非金属元素的交界处寻找制备半导体材料的元素。
(2)在过渡金属元素中寻找制备催化剂的材料,并通过加入少量稀土元素改善催化剂的性能。
(3)在ⅣB到ⅥB族的过渡金属元素中寻找耐高温、耐腐蚀的材料,用以制造火箭、导弹、宇宙飞船等。
(4)利用元素周期表寻找合适的超导材料、磁性材料等。
(5)研究元素周期表右上角的元素,合成新农药。
鲁科版高一化学必修二第三节第二课时预测同主族元素的性质课后延伸导学案设计

第一章第3节元素周期表的应用第二课时认识同元素性质的递变规律课后延伸1.下列有关元素性质的递变规律不正确的是( )A.Na、Mg、Al的还原性逐渐减弱B.HCl、PH3、H2S气态氢化物的稳定性逐渐减弱C.NaOH、KOH的碱性逐渐增强D.Na、K、Rb的原子半径依次增大2.下列递变规律不正确的是( )A.Na、Mg、Al还原性依次减弱 B.I2、Br2、Cl2氧化性依次增强C.C、N、O原子半径依次增大 D.P、S、Cl最高正价依次升高3.下列说法正确的是( )A.SiH4比CH4稳定 B.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强C.O2-半径比F-的小 D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱4.下列说法正确的是( )A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高C.同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增强D.第三周期元素的离子半径从左到右逐渐减小5.下列各组中化合物的性质比较,不正确的是( )A.酸性:HClO4>HBrO4>HIO4B.碱性:NaOH>Mg(OH)2>Al(OH)3C.稳定性:PH3>H2S>HCl D.非金属性:F>O>S6.下列叙述不正确的是( )A.H2S、H2O、HF的稳定性依次增强 B.RbOH、KOH、Ca(OH)2的碱性依次减弱C.Na+、Mg2+、Al3+的半径依次增大 D.H2SiO3、H2CO3、H2SO4的酸性依次增强7.碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列对其性质的预言中,错误的是( )A.在碱金属元素中它具有最大的原子半径B.它的氢氧化物化学式为FrOH,是一种极强的碱C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸8.砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是( )A.砹的非金属性在卤素中是最弱的,At-易被氧化B.砹化氢很稳定不易分解C.砹化银不溶于水或稀HNO3D.砹在常温下是白色固体9、短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是()A、X一定是活泼的非金属元素B、Y的最高价氧化物的水化物是一种强酸C、1molY的单质跟足量水反应时,发生转移的电子为2molD、Y的氢化物稳定性与Z的氢化物稳定性相同17.A、B、C为短周期元素,在周期表中所处的位置如下图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节元素周期表的应用(第2课时)
主备:邢永宁审核:李丽马伟民件鸿雨
教师寄语:成功源于不断的积累!
【学习口标】
1•掌握以V1IA族和I A族为代表的同主族元素性质的递变规律
2.通过探究实验的学习,培养学生的实验设计能力。
3•了解元素周期表在生产实践中的指导作用。
【课前小测】
1 •同周期元素性质的递变规律___________________________________________________
2.第I A族包括___________ 七种元素,第VUA族包括________________________ o
【预习】课木P22【交流•研讨】
【预测同主族元索的性质】
【自学课本P23】
【自测填表】
%1V1IA族元素
元素符号原子结构
示意图
单质与虫化合最高价氧化物对应的水化
物
原子得
电子能
力条件难
易
氢化物
稳定性
化学式酸性强弱
F C1
Br
I
结论:第V1IA族元索最外层都有个电子,在化学反应中都易电子,它们原子得电子能力都_____ ,都是—的非金屈元素。
它们都能形成气态氢化物,最高价氧化物的水化
物都是______ ,能与大多数金属 ,其单质常做_____________ 剂。
但是从氟到碘,原子电子层数,原子半径,失电子能力,得电子能力______________________ 」
%1单质的氧化性实验探究
(F2> CI2、Br2> I2)
实验步骤实验现象离子方程式
向ImL澳化钠溶液中加入
ImL氯水,再加入2mL四氯
化碳用力振荡
向ImL碘化钠溶液中加入
ImL氯水,再加入2mL四氯
化碳用力振荡
向ImL碘化钠溶液中加入
ImL溪水,再加入2mL四氯
化碳用力振荡
结论:______________________________________
注意:氧族、氮族等非金属主族元索性质的递变规律类似VIIA族元索,但原子得电子能力比同周期的VIIA族元素 ___ 。
二、根据同主族元素性质的相似性和递变规律预测某种元素单质和化合物的性质
【自学课本P2?观察•思考】预测金屈钾的性质
【实验设计】
(1)钠、钾跟水反应的实验(请填写课本上的表)
注意:实验吋,剩余的钠钾要____________________ o
(2)预测I A族元素(乂称碱金属元素)性质的递变
元素符号原子结构示
意图
原子
半径
原子失
电了能
最高价
单质反应的剧烈程
度
力
氧化物
水化物与水与02
的碱性
【自学】
三、元素周期表对生产实践的指导作用
1、预测新元索
2、寻找半导休材料
3、催化剂的选择
4、耐高温、耐腐蚀的特种合金材料的制取
5、寻找合适的超导材料、磁性材料
6、矿物的寻找
【当堂检测】
1.某主族元素最外层只有1个电了,则该元素一定是:
A.第I A族元索
B.第V1IA元索
C.第三周期元索
D.金属元索
2•现在含有元素硒(Se)的保健品开始进入市场,已知硒元素与氧元素同主族,与钾元素同周期,则下列关于硒的叙述中不正确的是
A.原子序数为34
B.最高价氧化物的化学式为SeO3
C.原了得电了能力Se>S D・气态氢化物化学式为H?Se
3 •神为第4周期第VA族元索,根据它在元索周期表中的位置推测,神不可能具有的性质是
A.AsHs比NH3稳定
B.可以存在・3、+3、+5等多种化合价
C. A S2O5对应水化物的酸性比H3PO4弱
D.单质的氧化性磷比不巾强
4.已知W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y,W原子最外层电子数不超过最内层电了数,X原了第二层电了数是其它各层电了数Z和的2倍,Y原了形成的气态氢化物分了与形成的最高价氧化物分子的电子数之比为5: 11, Z是地壳屮含量最多的元索。
(1) Y和Z形成的化合物可与W和Z形成的化合物反应,其化学方程式可能是:
___________________________ 或____________________________ O
(2)______________________________________________________ X、W元素的最高价氧化物对应水化物的碱性强弱为:___________________________________ > _________
(用化学式表示)
(3)______________________________ 这四种元素原子半径的大小: > > >
(填元素符号)
【本节课后口测】
1.若Q、E是同周期的非金属元素,如果Q原子半径比E大,则下列叙述正确的是()
A、Q的最高价氧化物对应水化物的酸性比E的最高价氧化物对应水化物的酸性强。
B、Q的阴离子比E的阴离子还原性强
C、Q原了得电了的能力比E原了得电了的能力强
D、Q的气态氢化物比E的气态氢化物稳定
2.下列叙述中,能肯定金属A比金属B活泼的是()
A、A原子的最外层电子数比B原子的最外层电子数少
B、A原了的电了层数比B原了的电了层数多
C、ImolA从酸中置换出的H2比ImolB从酸屮置换出的H2多
D、常温时,A能从水小置换出H2,而B不能
3.列关丁吨如的说法错误的是()
①原了半径比Na、K大②原了失电了能力比Na、K强
%1述原性比Na、K强④跟水反应比Na、K缓和
⑤其最高价氧化物对应的水化物能与A1(OH)3反应
A、①+②+④
B、②+⑤
C、④
D、②+④
4•下列关于各组元素性质递变说法错误的是()
A.Li、Be、B原子最外层电子数逐渐增多
B.P、S、C1最高化合价依次升高
C.N、O、F原子半径依次增大
D・ Li、Na、K、Rb原子失电子能力逐渐增强
5. 3.72g过氧化钠、氧化钠和钠的混合物与足量的水反应,在标准状况下生成672mL混合气休,该混合气体在一定条件下恰好完全反应,贝U混合物屮Na, Na2O2, Na?。
?的物质的量之比为()
A、2: 1: 1
B、1: 1: 1
C、1: 2: 1
D、1: 2: 4
6••某元素X的气态氢化物的化学式为H?X,下面的叙述不止确的的是()
A.该元索最外电子层上有4个电子
B.该元素最高价氧化物的化学式为XO2
C.该元素是非金属元素
D.该元素最高价氧化物对应的水化物的化学式为H2XO4
7.下列关于物质性质的比较,错误的是()
A.酸性强弱:H2SO4>H2SeO4
B・原子半径:Na>S>O
C・碱性强弱:KOH > NaOH > LiOH
D.还原性强弱:F>cr>r
8.X、Y、Z三种元素的原子具有相同的电子层数,而Y的核电荷数比X大2, Z的质子数比
Y多4, 1摩尔X的单质跟足量的酸起反应能置换出1克氢气,这时X转为具有与氛原子相同的电子层结构的离子,根据上述条件推测:(1)X ___ Y ___ Z ____ ;(2)X、Y最高
价氧化物对应水化物跟Z的气态氢化物的水溶液反应的离了方程式分別为
①___________________________________________________ ,②__________________________________________________ o
③X、Y最高价氧化物对应的水化物Z间发生反应的离子方程式
为________________________________________ O。
