盐酸标准溶液的标定计算公式
盐酸溶液浓度的标定

盐酸溶液浓度的标定盐酸溶液浓度的标定是化学分析实验中常见的一种实验操作,旨在确定盐酸溶液中盐酸的含量,从而获得溶液的浓度值。
本文将介绍盐酸溶液浓度的标定实验的操作流程、注意事项以及实验结果处理方法。
实验原理盐酸是一种无色透明易挥发的液体,具有强酸性。
盐酸溶液的浓度通常用摩尔浓度表示,即每升溶液中所包含的盐酸的物质的量。
盐酸溶液浓度的标定实验是通过与已知浓度的氢氧化钠溶液反应,测定反应后剩余的氢氧化钠浓度来确定盐酸的浓度。
该反应为酸碱滴定反应,反应式为:HCl + NaOH → NaCl + H2O在盐酸溶液中加入苯酚指示剂,使溶液呈现出酸性环境时的颜色,然后再以氢氧化钠溶液滴定至中性。
当盐酸与氢氧化钠滴定剂的物质的量相等时,称为终点,此时溶液中的酸碱物质的量相等,反应已达到完全中和的状态。
通过计算加入氢氧化钠溶液的体积和浓度,可以计算出盐酸溶液的浓度。
实验操作流程1. 实验器材准备:氧化钠粉末、盐酸标定溶液、已知浓度的氢氧化钠溶液、苯酚指示剂、滴定管、烧杯、容量瓶、量筒、移液管、胶头滴管、玻璃棒等。
2. 测定已知浓度氢氧化钠溶液的体积 V1 :用移液管取出一定体积的已知浓度氢氧化钠溶液加入烧杯中,在其中加入一滴苯酚指示剂,然后开始以盐酸标定溶液进行滴定至溶液呈现出粉红色,标志着滴定已达到终点。
4. 实验数据处理:用已知浓度氢氧化钠溶液的体积 V1 和浓度计算出加入滴定管中的氢氧化钠物质的量n1;用盐酸标定溶液的体积 V2 和滴定到终点所加入的氢氧化钠溶液体积 V3 计算出被滴定溶液中氢氧化钠的物质的量n2。
由于酸碱滴定反应是一种1:1的反应,因此n1=n2,再根据摩尔浓度的定义,计算出盐酸的浓度。
注意事项1. 操作前需认真阅读实验方法,理解实验原理与需要达到的实验目的。
2. 选择合适的荧光杯和荧光检测器对溶液进行检测。
3. 滴定剂的浓度应该确保准确,避免对实验结果产生影响。
4. 实验操作应该严格按照指定步骤进行,避免出现误差。
盐酸标准溶液的配置及标定

实验五盐酸标准溶液的配置及标定一、实验目的1、掌握酸式滴定管的使用和操作方法2、学会酸碱溶液浓度的标定方法3、学会使用电子天平差量法称重二、实验原理滴定反应Na2CO3+2HCl→2NaCl+CO2+H2O106g 2molW(g) (c∙V/1000)molc(HCl)=(2W×1000)/(106×V)=(1000W)/(53V)基准物-硼砂(Na2B4O7∙10H2O),Na2CO3指示剂-甲基橙终点:黄色→红色三、仪器及试剂HCl标准溶液,无水碳酸钠,甲基橙,酸式滴定管,烧杯,锥形瓶,电子天平。
四、实验步骤1、计算碳酸钠的称量范围2、用差量法准确称取称量范围的无水碳酸钠于锥形瓶中。
3、在锥形瓶中加入30ml蒸馏水,在温水中加热,摇动使其完全溶解,并滴加2-3滴甲基橙。
4、用50ml的酸式滴定管装入标准盐酸,调节好刻度,记下初读数后,左手控制玻璃赛,右手摇动锥形瓶使锥形瓶中液体作圆周运动,控制好滴速,当黄色变为橙色时显示滴定终点,停止滴定。
取下滴定管正确读数,并记录刻度值。
读数结果保留小数点后两位。
5、分别称取称量范围的碳酸钠于洁净的锥形瓶中,按照上述方法重复两次。
五、数据记录与处理六、结果与讨论实验注意事项:1、计算Na2CO3的称量范围。
Na2CO3+2HCl→2NaCl+CO2+H2O106g 2molW(g) (0.2×(20~30)/1000)molW=0.2120~0.31802、用差量法准确称取0.2~0.3g Na2CO3于锥形瓶中⑴将锥形瓶用自来水冲洗,再用蒸馏水淋洗三遍。
⑵称量瓶的取放要用纸条,不能用手直接拿。
⑶用差量法称一份在称量范围内的Na2CO3于锥形瓶中。
⑷不能有Na2CO3洒在锥形瓶外。
⑸记录数据(四位有效数字)。
3、配置Na2CO3溶液⑴在锥形瓶中加入30ml纯水。
⑵在温水浴中加热使之完全溶解。
4、酸式滴定管的准备⑴检查玻璃塞是否配套,有无橡皮套。
盐酸标准溶液的标定与碱灰总碱度的测定

盐酸标准溶液的标定与碱灰总碱度的测定一、实验目的1、掌握盐酸标准溶液的制备方法和标定方法;2、了解碱灰总碱度的测定原理和方法;3、掌握实验室常用的酸碱滴定技巧。
二、实验原理盐酸标准溶液是指其浓度已知、溶液质量稳定、可作为较高精度测定其他酸或碱的滴定溶液。
盐酸标准溶液的制备条件:① 用纯净的水将质量浓度高于95%的盐酸稀释掉;② 用重量法准确称取适量的草酸标准物质,溶于纯净水中;③ 用多余的2~3滴甲基橙作指示剂,以盐酸为滴定剂,滴定至甲基橙红色的终点;④ 计算出草酸标准物质的准确浓度,制成相应的盐酸标准溶液即可。
盐酸标准溶液的标定是指用不同的方法、不同的浓度的氢氧化钠溶液来测定标准盐酸溶液的浓度。
盐酸标准溶液的标定分为两种方法:①固定酸量法;②平均滴定法。
碱灰总碱度是指一种常见的土壤测定方法,可以用来评估土壤的酸碱程度。
其原理为:①用氢氧化钠标准溶液处理土样;②转移土样至烧杯中;③加入过量氢氯酸,使反应中止;④加入甲基橙指示剂,以标准硫酸为滴定剂,滴定至指示剂从黄色变为红色的终点,计算出总碱度。
①选择合适的指示剂,尽可能使滴定曲线的中点与计量瓶的刻线重合;②加入水样或溶液的方法,应使得加水滴的大小、速度均匀且节奏一致。
三、实验仪器和药品仪器:酸碱分析仪、加热板、电子天平、枪头、滴管、烧杯等。
药品:碱灰、甲基橙指示剂、盐酸标准溶液、氢氧化钠标准溶液、硫酸标准溶液等。
四、实验步骤① 按照实验室标准程序从标准物质柜台上获取草酸标准物质,称取0.5g(准确至0.0001g);② 将草酸标准物质放进一个干净的250mL容量瓶中,加入70mL纯净水并充分摇匀;③ 用玻璃棒将溶液中的草酸标准物质充分溶解,并补充水至刻度线;④ 用枪头从草酸标准溶液中吸取样品,加入滴定瓶,并加入2-3滴甲基橙指示剂;⑤ 取出氢氧化钠标准溶液,加入滴定瓶中,缓慢滴加,清晰观察反应机理,待甲基橙由橙色变成浅黄色为终点,记录实验数据。
盐酸标准溶液的配制与标定

实验一盐酸标准溶液的配制与标定一、目的要求1.练习溶液的配制和滴定的准备工作,训练滴定操作,进一步掌握滴定操作。
2.学会用基准物质标定盐酸浓度的方法。
3.了解强酸弱碱盐滴定过程中 pH 的变化。
4.熟悉指示剂的变色观察,掌握终点的控制。
二、实验原理市售盐酸为无色透明的HCl水溶液,HCl含量为36%~38%(W/W),相对密度约为1.18。
由于浓盐酸易挥发出HCl气体,若直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。
标定盐酸的基准物质常用碳酸钠和硼砂等,本实验采用无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点,无水碳酸钠作基准物质的优点是容易提纯,价格便宜。
缺点是碳酸钠摩尔质量较小,具有吸湿性。
因此Na2CO3固体需先在270℃~300℃高温炉中灼烧至恒重,然后置于干燥器中冷却后备用。
计量点时溶液的 pH为3.89,用待标定的盐酸溶液滴定至溶液由绿色变为暗红色后煮沸2 min,冷却后继续滴定至溶液再呈暗红色即为终点。
根据Na2CO3的质量和所消耗的 HCl 体积,可以计算出HCl 的准确浓度。
用Na2CO3标定时反应为:2HCl + Na2CO3→ 2NaCl + H2O + CO2↑反应本身由于产生H2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。
三、实验用品分析天平(感量0.01mg/分度),量筒,称量瓶,25mL酸式滴定管,250mL锥形瓶。
工作基准试剂无水Na2CO3:先置于270℃~300℃高温炉中灼烧至恒重后,保存于干燥器中。
浓HCl(浓或0.1mol/L),溴甲酚绿(3.8-5.4)一甲基红(4.4-6.2)指示液(变色点pH=5.1):溶液Ⅰ: 称取0.1 g 溴甲酚绿,溶于乙醇(95%),用乙醇(95%)稀释至100m L;溶液Ⅱ; 称取0.2 g 甲基红,溶于乙醇(95%),用乙醇(95% )稀释至100m L;取 30 m L溶液I, 10m L溶液Ⅱ,混匀。
实验 盐酸标准溶液的配制和标定

实验五盐酸标准溶液的配制和标定一、实验目的1. 掌握减量法准确称取基准物的方法。
2. 掌握滴定操作并学会正确判断滴定终点的方法。
3. 学会配制和标定盐酸标准溶液的方法。
二、实验原理由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:Na2CO3 +2HCl=2NaCl+CO2 +H2O滴定至反应完全时,溶液pH为3.89,通常选用溴甲酚绿-甲基红混合液或甲基橙作指示剂。
三、仪器及试剂仪器:25ml酸式滴定管、烧杯、锥形瓶、玻璃棒、250ml容量瓶试剂:浓盐酸(密度1.19)、无水Na2CO3、甲基橙或者溴甲酚绿-甲基红混合液指示剂:量取30mL溴甲酚绿乙醇溶液(2g/L),加入20mL甲基红乙醇溶液(1g/L),混匀。
四、实验内容(一)0.1mol·L-1盐酸标准溶液的配制:量取2.2ml浓盐酸,注入250 mL水中,摇匀。
装入试剂瓶中,贴上标签。
(二)盐酸标准溶液的标定:准确称取0.19~0.21克于270—300℃灼烧至质量恒定的基准无水碳酸钠,称准至0.0002 g,(至少二份)。
溶于50mL水中,加2~3滴甲基橙作指示剂,用配制好的盐酸溶液滴定至溶液由黄色变为橙色,记下盐酸溶液所消耗的体积。
同时作空白试验。
(空白试验即不加无水碳酸钠的情况下重复上述操作。
)五、数据记录与处理 1.数据记录2. 盐酸标准溶液的浓度计算式:1000106)()(2)(032⨯⋅-=V V CO Na m HCl c l HC式中:c (HCl )——盐酸标准溶液之物质的量浓度,mol/L ;m ——无水碳酸钠之质量,g V ——盐酸溶液之用量,mLV 0——空白试验盐酸溶液之用量,mL 106——无水碳酸钠的摩尔质量,g/ mol 。
HCL标准溶液的配制和标定

盐酸标准溶液的配置与标定
1.配制
按规定量取盐酸,注入1000ml水中,摇均。
盐酸标准滴定液的浓度[ C(HCl)]1(mol/L)盐酸的体积 90 mL 盐酸标准滴定液的浓度[ C(HCl)]0.5(mol/L)盐酸的体积 45 mL 盐酸标准滴定液的浓度[C(HCl)]0.1(mol/L)盐酸的体积 9 mL 2. 标定
按表4的规定称取于270℃~300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红,用配好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2分钟,冷却后继续滴定至溶液再呈暗红色。
同时做空白试验。
表 4
盐酸标准滴定液的浓度 C(NaOH) 1mol L工作基准试剂无水碳酸钠的质量1.9g
盐酸标准滴定液的浓度 C(NaOH) 0.5mol L工作基准试剂无水碳酸钠的质量0.95g
盐酸标准滴定液的浓度 C(NaOH) 0.1mol L工作基准试剂无水碳酸钠的质量0.2g
3.计算
盐酸标准滴定液的浓度[ C(HCl)],数值以摩尔每升(mol/L)表示,按式(2)计算:
C(HCl)=m/[v1-v2]*0.05299
式中:m-----无水碳酸钠的质量的准确数值,单位为克(g);
V1---盐酸溶液的体积的数值,单位是毫升(mL);
V2---空白试验盐酸溶液的体积的数值,单位是毫升(mL);。
盐酸标准溶液的标定实验报告

盐酸标准溶液的标定实验报告盐酸标准溶液的标定实验报告摘要:本实验旨在通过标定盐酸标准溶液的浓度,以便在后续实验中准确测定未知溶液的浓度。
实验采用酸碱滴定法,通过滴定过程中溶液的反应生成终点指示剂的颜色变化来确定滴定终点,并据此计算出盐酸标准溶液的浓度。
实验结果表明,盐酸标准溶液的浓度为0.1 mol/L,相对误差在可接受范围内。
1. 引言盐酸是一种常用的酸性试剂,在化学实验中广泛应用。
为了准确测定未知溶液的浓度,需要先标定盐酸标准溶液的浓度。
本实验采用酸碱滴定法进行标定,通过滴定过程中溶液的反应生成终点指示剂的颜色变化来确定滴定终点,并据此计算出盐酸标准溶液的浓度。
2. 实验原理酸碱滴定法是一种常用的分析方法,通过滴定溶液中的酸和碱来确定其浓度。
在本实验中,我们使用稀盐酸作为滴定溶液,使用氢氧化钠溶液作为标定溶液。
滴定过程中,盐酸和氢氧化钠发生中和反应,生成氯化钠和水。
当滴定终点达到时,溶液中的氢氧化钠完全反应,溶液呈现中性。
为了确定滴定终点,我们使用了酚酞作为指示剂。
酚酞在酸性溶液中呈现无色,在碱性溶液中呈现粉红色。
当滴定终点接近时,滴加的盐酸会迅速改变溶液的颜色,从无色变为粉红色,这时滴定终点已经达到。
3. 实验步骤3.1. 准备工作:清洗滴定管、瓶口滴管等玻璃仪器,并用去离子水冲洗,以避免杂质对实验结果的影响。
3.2. 称取一定量的盐酸标准溶液,转移到滴定瓶中。
3.3. 取少量的酚酞溶液,加入滴定瓶中。
3.4. 用氢氧化钠溶液定容至刻度线,摇匀使溶液均匀混合。
3.5. 将滴定瓶放置在白色背景下,用氢氧化钠溶液滴定盐酸溶液,记录滴定过程中溶液的颜色变化。
3.6. 当溶液由无色变为粉红色时,停止滴定,记录滴定用量。
4. 实验结果与分析根据实验步骤所述,我们进行了三次滴定,并记录了滴定用量。
根据滴定用量和滴定液的浓度,可以计算出盐酸标准溶液的浓度。
实验结果如下表所示:滴定次数 | 滴定用量 (mL)------------------------1 | 9.82 | 9.73 | 9.9根据滴定用量的平均值,我们可以计算出盐酸标准溶液的浓度为0.1 mol/L。
各浓度盐酸标准滴定溶液的配制

各浓度盐酸标准滴定溶液的配制盐酸标定一、配制:0.02mol/LHCl溶液:量取1.8毫升盐酸,缓慢注入1000ml水。
0.1mol/LHCl溶液:量取9毫升盐酸,缓慢注入1000ml水。
0.2mol/LHCl溶液:量取18毫升盐酸,缓慢注入1000ml水。
0.5mol/LHCl溶液:量取45毫升盐酸,缓慢注入1000ml水。
1.0mol/LHCl溶液:量取90毫升盐酸,缓慢注入1000ml水。
二、标定:1、反应原理: Na2CO3-+2HCl→2NaCl+CO2++H2O为缩小批示剂的变色范围,用溴甲酚绿-甲基红混合指示剂,使颜色变化更加明显,该混合指示剂的碱色为暗绿,它的变色点PH值为5.1,其酸色为暗红色很好判断。
2、仪器:滴定管50ml;三角烧瓶250ml;135ml;瓷坩埚;称量瓶。
3、标定过程:基准物处理:取预先在玛瑙研钵中研细之无水碳酸钠适量,置入洁净的瓷坩埚中,在沙浴上加热,注意使运动坩埚中的无水碳酸钠面低于沙浴面,坩埚用瓷盖半掩之,沙浴中插一支360℃温度计,温度计的水银球与坩埚底平,开始加热,保持270-300℃1小时,加热期间缓缓加以搅拌,防止无水碳酸钠结块,加热完毕后,稍冷,将碳酸钠移入干燥好的称量瓶中,于干燥器中冷却后称量。
称取上述处理后的无水碳酸钠(标定0.02mol/L称取0.02-0.03克;0.1mol/L 称取0.1-0.12克;0.2mol/L称取0.2-0.4;0.5mol/L称取0.5-0.6克;1mol/L称取1.0-1.2克称准至0.0002克)置于250ml锥形瓶中,加入新煮沸冷却后的蒸馏水(0.02mol/L加20ml;0.1mol/L加20ml;02mol/L加50;0.5mol/L加50ml;1mol/L加100ml水)定溶,加10滴溴甲酚绿-甲基红混合指示剂,用待标定溶液滴定至溶液成暗红色,煮沸2分钟,冷却后继续滴定至溶液呈暗红色。
同时做空白4、计算:C=m/(V*0.0529)C(HCl)——盐酸标准溶液量浓度 mol/Lm——无水碳酸钠的质量(克)V1——滴定消耗HCl ml数V2——滴定消耗HCl ml数0.05299--与1.000盐酸标准溶液相当的以克表示的无水碳酸钠的质量。
0.1molL盐酸标准滴定溶液的标定
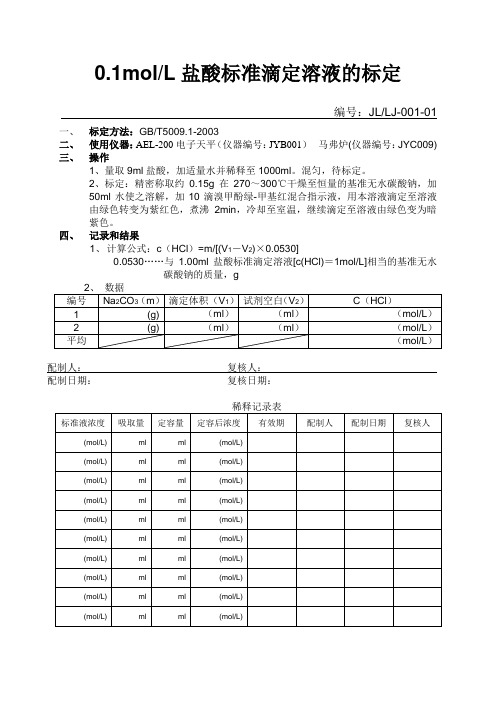
0.1mol/L盐酸标准滴定溶液的标定
编号:JL/LJ-001-01
一、标定方法:GB/T5009.1-2003
二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)
三、操作
1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定。
2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加
50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液
由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗
紫色。
四、记录和结果
1、计算公式:c(HCl)=m/[(V1-V2)×0.0530]
0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水
碳酸钠的质量,g
配制人:复核人:
配制日期:复核日期:。
盐酸标准溶液的配制及标定

盐酸标准溶液的配制及标定(总1页)本页仅作为文档封面,使用时可以删除This page is only the cover as a document 2021year盐酸标准溶液的配制及标定一、配制:LHCl溶液:量取毫升盐酸,缓慢注进1000ml水。
LHCl溶液:量取9毫升盐酸,缓慢注进1000ml水。
LHCl溶液:量取18毫升盐酸,缓慢注进1000ml水。
LHCl溶液:量取45毫升盐酸,缓慢注进1000ml水。
LHCl溶液:量取90毫升盐酸,缓慢注进1000ml水。
二、标定:1、反应原理: Na2CO3-+2HCl→2NaCl+CO2++H2O为缩小批示剂的变色范围,用溴甲酚绿-甲基红混合指示剂,使颜色变化更加明显,该混合指示剂的碱色为暗绿,它的变色点PH值为,其酸色为暗红色很好判定。
2、仪器:滴定管50ml;三角烧瓶250ml;135ml;瓷坩埚;称量瓶。
3、标定过程:基准物处理:取预先在玛瑙研钵中研细之无水碳酸钠适量,置进洁净的瓷坩埚中,在沙浴上加热,留意使运动坩埚中的无水碳酸钠面低于沙浴面,坩埚用瓷盖半掩之,沙浴中插一支360℃温度计,温度计的水银球与坩埚底平,开始加热,保持270-300℃1小时,加热期间缓缓加以搅拌,防止无水碳酸钠结块,加热完毕后,稍冷,将碳酸钠移进干燥好的称量瓶中,于干燥器中冷却后称量。
称取上述处理后的无水碳酸钠(标定L称取克;L称取克;L称取-;L称取克;1mol/L称取克称准至克)置于250ml锥形瓶中,加进新煮沸冷却后的蒸馏水(L加20ml;L加20ml;L加50;L加50ml;1mol/L加100ml水)定溶,加10滴溴甲酚绿-甲基红混合指示剂,用待标定溶液滴定至溶液成暗红色,煮沸2分钟,冷却后继续滴定至溶液呈暗红色。
同时做空缺4、计算:C(HCl)——盐酸标准溶液量浓度 mol/Lm——无水碳酸钠的质量(克)V1——滴定消耗HCl ml数V2——滴定消耗HCl ml数--与盐酸标准溶液相当的以克表示的无水碳酸钠的质量。
盐酸溶液的标定

盐酸溶液的标定盐酸的标定用的基准物质是碳酸钠,所用的指示剂为甲基橙(pH3.1-4.4)到达终点时,溶液有黄色恰好变到橙色。
计算公式C(盐酸)=2000W(碳酸钠)/M(碳酸钠)V(盐酸)文字表述为:盐酸的浓度=2000乘以碳酸钠的质量除以碳酸钠的摩尔质量与盐酸体积的积标定的步骤用减量法准确称取基准物质,碳酸钠的质量在0.1–0.15g 三份,分别放入锥形瓶中,各加入25ml蒸馏水,使其溶解,加入两滴甲基橙指示剂,用待测盐酸溶液滴定至溶液由黄色变成橙色即为滴定的终点,记下盐酸的体积。
混合碱的分析(双指示剂法)混合碱是碳酸钠与氢氧化钠或碳酸氢钠与碳酸钠的混合物,欲测定同一份试样中各组分的含量,可用盐酸标准溶液滴定(就是标定了浓度的盐酸滴定混合碱)根据滴定过程中的ph 值的变化的情况,选用两种不同的指示剂分别指示第一、二化学计量点的到达,因此称为双指示剂法。
混合碱分析的操作步骤首先指出的是盐酸是已经标定好的盐酸,用5ml移液管准确吸取5ml混合碱试样溶液,加入锥形瓶,加20ml蒸馏水,加酚酞2滴用已标定出的盐酸溶液进行滴定,颜色有红色恰好褪去(白里透红的颜色,很淡的一种粉色),记下盐酸溶液的用量记为盐酸1,再加上甲基橙指示剂一滴或两滴,(据颜色的深浅而定,自己斟酌着放)继续用盐酸溶液滴定到由黄色恰好变成橙色,记下此时的读数记为盐酸2,测定三次求平均值。
计算公式1.当混合碱样为碳酸钠+碳酸氢钠时碳酸钾的质量分数=C(盐酸)V(盐酸)M(碳酸钠)/1000/G(试样的总质量)*100%碳酸氢钠的质量分数=C(盐酸)(V(盐酸2) -V(盐酸1))M(碳酸钠)/1000/G(试样的总质量)*100%2. 当混合碱样为碳酸钠+氢氧化钠时碳酸钾的质量分数=C(盐酸)V(盐酸)M(碳酸钠)/1000/G(试样的总质量)*100%碳酸钠的质量分数=C(盐酸)(V(盐酸1)-V(盐酸2))M(碳酸氢钠) /1000/G(试样的总质量)*100%G的求法:V(所取的混合碱)/V(混合碱的总体积)*M(混合碱的总质量)得出所取的混合碱的质量。
盐酸标准溶液的配制和标定

盐酸标准溶液的配制和标定一、目的要求掌握减量法准确称取基准物的方法。
掌握滴定操作并学会正确判断滴定终点的方法。
学会配制和标定盐酸标准溶液的方法。
二、实验原理由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:Na2CO3+2HCI===2NaCl+H2O+CO2滴定至反应完全时,-甲基红混合液或甲基橙作指示剂。
三、试剂1.浓盐酸(密度1.19g/mL)2.甲基橙指示剂四、实验步骤1.0.1mol·L-1HCl溶液的配制用量筒量取浓盐酸9mL,倒入预先盛有适量水的试剂瓶中,加水稀释至1000mL,摇匀,贴上标签。
2.盐酸溶液浓度的标定用减量法准确称取约0.15—0.2g在270~300℃干燥至恒量的基准无水碳酸钠,置于250mL锥形瓶,加50mL水使之溶解,再加甲基橙指示剂1—2滴,用配制好的HCl溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
若用甲基橙做指示剂,则终点颜色变化为:由黄色变为橙色。
由Na2CO3的重量及实际消耗的HCl溶液的体积,计算HCl溶液的准确浓度。
实验流程五、数据记录与处理编号 实验项目倾出前(称量瓶+基准物)质量 倾出后(称量瓶+基准物)质量取出基准物的质量HCl 溶液 终读数 HCl 溶液 初读数 消耗HCl 溶液体积 HCl 溶液的浓度HCl 溶液的平均浓度相对平均偏差六、注意事项干燥至恒重的无水碳酸钠有吸湿性,因此在标定中精密称取基准无水碳酸钠时,宜采用“减量法”称取,并应迅速将称量瓶加盖密闭。
在滴定过程中产生的二氧化碳,使终点变色不够敏锐。
因此,在溶液滴定进行至临近终点时,应将溶液加热煮沸,以除去二氧化碳,待冷至室温后,再继续滴定。
盐酸标准溶液的配制与标定

盐酸标准溶液(0.1 mol L-1)的配制与标定一、原理市售盐酸为无色透明的HCI水溶液,HCI含量为36%-38%(W/W) 由于浓盐酸易挥发出HCI气体,若直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。
采用无水碳酸钠为基准物质标定盐酸,以甲基红-溴甲酚绿混合指示剂指示终点。
用NaCO标定时反应为:2HCI + Na z CO —2NaCI + H 2O + CQ执行标准:GB/T 601-2002 化学试剂标准滴定溶液的制备二、实验用品分析天平(感量0.1mg/分度),量筒,称量瓶,25mL酸式滴定管,250mL隹形瓶,工作基准试剂无水NaCO,浓HCI (浓或0.1mol/L ), 溴甲酚绿一甲基红指示液(变色点pH=5.1)。
三、实验步骤(1) 0.1mol丄-1盐酸溶液的配制:用小量筒取浓盐酸9ml,注入1000 ml, 摇匀。
(2) 盐酸标准滴定溶液的标定取在270〜300C干燥至恒重的基准无水碳酸钠约0.2g,精密称定3份,分别置于250ml锥形瓶中,加50ml蒸馏水溶解后,加甲基红-溴甲酚绿混合指示剂10滴,用盐酸溶液(0.1mol •L-1)滴定至溶液又由绿变暗红色,煮沸约2mi n。
冷却至室温,继续滴定至暗红色,记下所消耗的标准溶液的体积,同时做空白试验四、实验结果(1)数据记录盐酸标准滴定溶液的浓度 [c(HCI)].数值以摩尔每升(mol/L)表 示,按下式计算:式中:m —无水碳酸钠的质量的准确数值,单位为克(g); V —盐酸溶液的体积的数值,单位为毫升(mL); V 2 —空白试验盐酸溶液的体积的数值,单位为毫升 (mL)M —无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol), [ (1/2Na 2CO)=52.994 ]。
C H CI = M NCO =105.99计算步骤:M=0.00 mL同理可得 II: c(HCI)=0.1327(moI/L) III : c(HCI)=0.1335(moI/L)相对平均偏差 0.1331-0.13270.1335-0.1331 /0.1331X100%=0.20%极差(X ma>rX min ) =0.1335-0.1327=0.0008I : C HCI0-1241 1000=0.1331(moI/L)m 1000 (V i V 2) M (17.600.00) 52.994=丄 0.1331 -0.13313。
标准溶液的配制和标定方法

标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.313mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取 120gNaOH,溶于 100mL无 CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无 CO2的水稀释至1000mL,摇匀。
C(NaOH), mol/L NaOH饱和溶液, mL1560.5280.31317.5280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于 105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至 0.0001 g ,溶于下列规定体积的无 CO2的水中,加 2 滴酚酞指示液( 10 g/L ),用配制好的 NaOH溶液滴定至溶液呈粉红色并保持 30S。
同时做空白试验。
C(NaOH),mol/L基准邻苯二甲酸氢钾 ,g无 CO水 ,mL21 6.0800.5 3.0800.313 1.878800.10.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC( NaOH)= ------------------------(V—V0)× 0.2042式中: C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L ;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042 ——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol 。
二、盐酸标准溶液的配制和标定(依据国标 GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL 水中,摇匀。
盐酸标准溶液的配制和标定

盐酸标准溶液的配制和标定一、目的要求掌握减量法准确称取基准物的方法。
掌握滴定操作并学会正确判断滴定终点的方法。
学会配制和标定盐酸标准溶液的方法。
二、实验原理由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:Na2CO3+2HCI===2NaCl+H2O+CO2滴定至反应完全时,溶液通常选用溴甲酚绿-甲基红混合液或甲基橙作指示剂。
三、试剂1.浓盐酸(密度mL)2.甲基橙指示剂四、实验步骤溶液的配制用量筒量取浓盐酸9mL,倒入预先盛有适量水的试剂瓶中,加水稀释至1000mL,摇匀,贴上标签。
2.盐酸溶液浓度的标定用减量法准确称取约—在270~300℃干燥至恒量的基准无水碳酸钠,置于250mL锥形瓶,加50mL水使之溶解,再加甲基橙指示剂1—2滴,用配制好的HCl溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
若用甲基橙做指示剂,则终点颜色变化为:由黄色变为橙色。
由Na2CO3的重量及实际消耗的HCl溶液的体积,计算HCl溶液的准确浓度。
实验流程五、数据记录与处理编号 实验项目倾出前(称量瓶+基准物)质量 倾出后(称量瓶+基准物)质量取出基准物的质量HCl 溶液 终读数 HCl 溶液 初读数 消耗HCl 溶液体积 HCl 溶液的浓度HCl 溶液的平均浓度相对平均偏差六、注意事项干燥至恒重的无水碳酸钠有吸湿性,因此在标定中精密称取基准无水碳酸钠时,宜采用“减量法”称取,并应迅速将称量瓶加盖密闭。
在滴定过程中产生的二氧化碳,使终点变色不够敏锐。
因此,在溶液滴定进行至临近终点时,应将溶液加热煮沸,以除去二氧化碳,待冷至室温后,再继续滴定。
