汽车发动机原理热力学PPT演示文稿
合集下载
发动机ppt课件

燃油经济性
燃油消耗率
燃油消耗率是指发动机每千瓦时或每马力小时所消耗的燃油量,通常以克/千瓦时(g/kWh)或克/马力小时( g/hp-hr)表示。低燃油消耗率意味着发动机效率高,能够降低运行成本。
油耗
油耗是指在一定时间内发动机所消耗的燃油量,通常以升/百公里(L/100km)表示。低油耗意味着在行驶相同 距离下,发动机所消耗的燃油量较少。
船舶工业
船用发动机
为船舶提供推进动力,分为内燃 机和电动机。
辅助发动机
用于船舶上的各种辅助设备,如 泵、压缩机等。
农业机械
拖拉机发动机
为拖拉机提供动力,驱动农机具进行 耕作、播种、收割等作业。
灌溉泵发动机
为灌溉泵提供动力,实现农田的灌溉 。
THANKS
02
发动机的性能参数
功率与扭矩
功率
功率是指发动机在单位时间内所做的功,通常以千瓦(kW)或马力(hp)表 示。功率决定了发动机能够克服的阻力和负载,是评估发动机性能的重要参数 。
扭矩
扭矩是指发动机输出的力矩,通常以牛顿米(Nm)表示。扭矩决定了发动机在 特定转速下能够克服的负载,以及车辆加速和爬坡能力。
发动机ppt课件
目录
• 发动机概述 • 发动机的性能参数 • 发动机的维护与保养 • 发动机的未来发展 • 发动机的应用领域
01
发动机概述
发动机的定义与分类
01
总结词
02
详细描述
发动机是一种将其他形式的能量转换为机械能的装置,通常用于驱动 车辆、船舶、飞机等。根据不同的分类标准,发动机可以分为多种类 型。
排放性能
一氧化碳(CO)
一氧化碳是燃料不完全燃烧的产物, 对人体健康有害。低一氧化碳排放是 发动机性能良好的表现。
汽车发动机作用和工作原理课件PPT课件

冷却系统
组成
由水泵、散热器、风扇、节温器、冷 却液温度表等组成。
作用
将受热零件吸收的部分热量及时散发 出去,保证发动机在最适宜的温度状 态下工作。
汽车发动机的性能指
05
标与评价
发动机的性能指标
功率
发动机在单位时间内所做的功,是衡量发动 机动力性能的重要指标。
燃油消耗率
发动机在单位时间内消耗的燃油量,是评价 发动机经济性能的关键指标。
排放特性曲线
表示发动机排放物含量随转速和负荷 变化的关系曲线,体现了发动机的环 保性能。
汽车发动机的维护与
06
保养
发动机的日常维护
1 2 3
清洁空气滤清器
定期清洁或更换空气滤清器,以确保发动机吸入 的空气干净,防止杂质进入发动机内部。
检查油位和油质
每天检查发动机机油油位,确保机油在正常范围 内;定期更换机油和机油滤清器,以保持机油清 洁并延长发动机寿命。
THANKS.
汽车发动机的作用
02
提供动力
驱动汽车行驶
爬坡和载重
发动机是汽车的心脏,通过燃烧燃料 产生动力,驱动汽车前进或后退。
在面对坡道或承载重物时,发动机需 要提供更大的动力以克服重力或负载。
加速和减速
根据驾驶员的操作,发动机可以调整 输出的动力,使汽车加速或减速。
转换能量
燃料燃烧
发动机将燃料的化学能转 换为热能,通过燃烧过程 释放能量。
排气门打开,活塞向上运动,将燃烧后的 废气排出气缸。
发动机的工作循环
发动机的工作循环由四个基本过程组成: 进气、压缩、做功和排气。这四个过程周 而复始地进行,称为一个工作循环。
发动机的工作循环是发动机产生动力的 基础,了解工作循环的原理对于理解发 动机的工作原理和性能至关重要。
汽车发动机ppt课件

。
05
汽车发动机的节能与环保技术
节能技术
01
02
03
缸内直喷技术
通过将燃料直接喷入汽缸 内部,提高燃油的利用率 和燃烧效率。
可变气门正时技术
根据发动机转速和负荷的 变化,自动调整气门开度 和气门关闭时间,以提高 燃烧效率。
轻量化设计
采用高强度材料和结构优 化设计,降低汽车重量, 从而提高燃油经济性。
汽车发动机的性能指标与评价
汽车发动机的性能指标
主要包括功率、扭矩、油耗、排放等。
汽车发动机的评价
根据不同使用需求和行驶环境,对汽车发动机进行综合评价,包括动力性、经 济性、环保性等方面。
02
汽车发动机的种类和特点
汽油机
点燃式发动机
依靠电火花点燃混合气,具有较高的燃烧效率,但需要复杂的点火系统和供油系 统。汽车发动机ppt课件Fra bibliotek目 录
• 汽车发动机概述 • 汽车发动机的种类和特点 • 汽车发动机的组成和工作过程 • 汽车发动机的故障诊断与维修 • 汽车发动机的节能与环保技术 • 汽车发动机的发展趋势与展望
01
汽车发动机概述
汽车发动机的定义与分类
汽车发动机的定义
汽车发动机是一种将燃料燃烧产 生的热能转化为机械能的装置。
压燃式发动机
依靠压缩空气和燃料混合气的自燃,具有较高的热效率,但需要较高的压缩比和 复杂的燃烧室设计。
柴油机
直接喷射式柴油机
将燃料直接喷入汽缸内,具有较高的燃油经济性和动力性, 但噪音和振动较大。
间接喷射式柴油机
将燃料喷入进气口,具有较低的噪音和振动,但燃油经济性 和动力性较差。
燃气机
燃气轮机
使用燃气作为燃料,具有较高的热效率和较快的加速性能,但噪音较大且需要复杂的燃烧室设计。
05
汽车发动机的节能与环保技术
节能技术
01
02
03
缸内直喷技术
通过将燃料直接喷入汽缸 内部,提高燃油的利用率 和燃烧效率。
可变气门正时技术
根据发动机转速和负荷的 变化,自动调整气门开度 和气门关闭时间,以提高 燃烧效率。
轻量化设计
采用高强度材料和结构优 化设计,降低汽车重量, 从而提高燃油经济性。
汽车发动机的性能指标与评价
汽车发动机的性能指标
主要包括功率、扭矩、油耗、排放等。
汽车发动机的评价
根据不同使用需求和行驶环境,对汽车发动机进行综合评价,包括动力性、经 济性、环保性等方面。
02
汽车发动机的种类和特点
汽油机
点燃式发动机
依靠电火花点燃混合气,具有较高的燃烧效率,但需要复杂的点火系统和供油系 统。汽车发动机ppt课件Fra bibliotek目 录
• 汽车发动机概述 • 汽车发动机的种类和特点 • 汽车发动机的组成和工作过程 • 汽车发动机的故障诊断与维修 • 汽车发动机的节能与环保技术 • 汽车发动机的发展趋势与展望
01
汽车发动机概述
汽车发动机的定义与分类
汽车发动机的定义
汽车发动机是一种将燃料燃烧产 生的热能转化为机械能的装置。
压燃式发动机
依靠压缩空气和燃料混合气的自燃,具有较高的热效率,但需要较高的压缩比和 复杂的燃烧室设计。
柴油机
直接喷射式柴油机
将燃料直接喷入汽缸内,具有较高的燃油经济性和动力性, 但噪音和振动较大。
间接喷射式柴油机
将燃料喷入进气口,具有较低的噪音和振动,但燃油经济性 和动力性较差。
燃气机
燃气轮机
使用燃气作为燃料,具有较高的热效率和较快的加速性能,但噪音较大且需要复杂的燃烧室设计。
汽车发动机原理第一章工程热力学
三、卡诺循环及应用
卡诺循环告诉我们,两个给定热源之间的所有热力 循环,以卡诺循环的热效率为最高,一切实际的循 环都是不可逆循环,因此实际循环的热效率必小于 相同热源条件下卡诺循环的热效率,所以提高热效 率的途径是尽量减少过程的不可逆性,使实际循环 尽量接近卡诺循环。
第五节 发动机的理想循环
一、发动机工作循环的简化与评价
(一)发动机工作循环的简化
(1)假设工质是在闭口系统中进行热力循环,不考虑进、 排气过程,并忽略气体流动阻力的影响。 (2)假设压缩与膨胀过程是绝热过程,忽略气缸壁传热、 摩擦及漏气等热损失。 (3)假设以定容过程、定压过程或先定容后定压过程向工 质加热以代替燃烧过程;工质的放热过程则视为等容过程。 (4)以空气作为循环中的工质并假设其为理想气体,其比 热容视为定值,忽略变比热容的影响。 (5)忽略实际过程中的各种损失,把循环的每一过程都假 定为可逆过程。
表压力、真空度与绝对压力的关系
(二)温度T
温度表示气体冷热的程度。按照分子运动论,气体的 温度是气体内部分子不规则运动激烈程度的量度,是 与气体分子平均速度有关的—个统计量。气体的温度 越高,表明气体分子的平均动能越大。
热力学温度T的单位为K,是国际单位制中的基本单位, 选取水的三相点温度为基本定点温度,规定其温度为 273.16K,1K等于水的三相点热力学温度的1/273.16。 国际单位制允许使用摄氏温度t。
绝热过程在p-v图与T-s图上的表示
五、多变过程
许多过程可以近似地用下面的关系式描述
pvn 定值
当n=0时,p=定值,为定压过程; 当n=1时,pv=定值,为定温过程; 当n=k时,pvn=定值,为绝热过程;
当 n 时,v=定值,为定容过程。
汽车发动机系统的工作原理(ppt 57页)_8865

活塞的不同部位会受到交变的拉伸、压缩或弯曲载荷。
➢活塞的结构:活塞的基本结构可分为顶部、头部和裙部。
❖活塞顶部:活塞顶部的形状主要取决于燃烧室的
形式。G4JS/4GA1发动机的活塞为凹顶活塞。
江淮汽车乘用车制造公司
目录
汽油发动机基本规格 发动机的部分系统工作原理 发动机编码规则介绍
江淮汽车乘用车制造公司
发动机基本规格
目前发动机生产的汽油发动机 以HFC4GA1(GA00)为基础,包括2.0L、2.4L共2种 排量的新机型, 2.0L发动机技术规格均为:直列四缸、双顶置凸轮轴、 16气门,额定转速为5500r/min,额定功率为95KW, 缸径85mm,行程88mm,最大扭矩172N.m。 2.4L(GA、GB)技术规格为:直列四缸、双顶置凸 轮轴、16气门,额定转速5500r/min,额定功率为 100KW,缸径86.5mm,行程100mm,最大扭矩193N.m。
曲柄连杆机构:包括活塞、连杆、带有飞轮的曲轴等。这是将活塞的直 线往复运动变为曲轴的旋转运动并输出动力的机构。
配气机构:包括进气门、排气门、摇臂、气门间隙调节器(液压挺柱)、 凸轮轴以及凸轮轴定时带轮。其作用是使可燃混合气及时充入气缸并及 时从气缸排出废气。
江淮汽车乘用车制造公司
发动机概述—四冲程汽油机的总体构造
江淮汽车乘用车制造公司
发动机概述—四冲程汽油机的总体构造
发动机是一部由许多机构和系统组成的复杂机器,其结构形 式很多,具体构造也是各种各样的。四冲程汽油机的一般构造主 要包括两大机构和五大系统,具体包括:曲柄连杆机构、配气机 构、供给系、点火系、冷却系、润滑系和起动系。
机体组:包括气缸盖、气缸体及油底壳。机体的作用是作为发动机各机 构、各系统的装配基体,而且其本身的许多部分又分别是曲轴连杆机构、 配气机构、供给系、冷却系和润滑系的组成部分。气缸盖和气缸体的内 壁共同组成燃烧室的一部分,是承受高温、高压的机件。
➢活塞的结构:活塞的基本结构可分为顶部、头部和裙部。
❖活塞顶部:活塞顶部的形状主要取决于燃烧室的
形式。G4JS/4GA1发动机的活塞为凹顶活塞。
江淮汽车乘用车制造公司
目录
汽油发动机基本规格 发动机的部分系统工作原理 发动机编码规则介绍
江淮汽车乘用车制造公司
发动机基本规格
目前发动机生产的汽油发动机 以HFC4GA1(GA00)为基础,包括2.0L、2.4L共2种 排量的新机型, 2.0L发动机技术规格均为:直列四缸、双顶置凸轮轴、 16气门,额定转速为5500r/min,额定功率为95KW, 缸径85mm,行程88mm,最大扭矩172N.m。 2.4L(GA、GB)技术规格为:直列四缸、双顶置凸 轮轴、16气门,额定转速5500r/min,额定功率为 100KW,缸径86.5mm,行程100mm,最大扭矩193N.m。
曲柄连杆机构:包括活塞、连杆、带有飞轮的曲轴等。这是将活塞的直 线往复运动变为曲轴的旋转运动并输出动力的机构。
配气机构:包括进气门、排气门、摇臂、气门间隙调节器(液压挺柱)、 凸轮轴以及凸轮轴定时带轮。其作用是使可燃混合气及时充入气缸并及 时从气缸排出废气。
江淮汽车乘用车制造公司
发动机概述—四冲程汽油机的总体构造
江淮汽车乘用车制造公司
发动机概述—四冲程汽油机的总体构造
发动机是一部由许多机构和系统组成的复杂机器,其结构形 式很多,具体构造也是各种各样的。四冲程汽油机的一般构造主 要包括两大机构和五大系统,具体包括:曲柄连杆机构、配气机 构、供给系、点火系、冷却系、润滑系和起动系。
机体组:包括气缸盖、气缸体及油底壳。机体的作用是作为发动机各机 构、各系统的装配基体,而且其本身的许多部分又分别是曲轴连杆机构、 配气机构、供给系、冷却系和润滑系的组成部分。气缸盖和气缸体的内 壁共同组成燃烧室的一部分,是承受高温、高压的机件。
《汽车发动机原理》课件

曲轴
将活塞的直线运动转化为旋转运动,输出 动力。
活塞
在气缸内上下运动,通过与气缸盖的配合 完成工作循环。
发动机的工作原理
01
02
03
04
进气过程
空气通过气。
压缩过程
活塞向上运动,压缩可燃混合 气,提高其温度和压力。
燃烧过程
当活塞达到上止点时,火花塞 产生电火花点燃可燃混合气, 产生能量推动活塞向下运动。
点火系统
燃烧过程
燃烧效率
排放控制
排放污染物
一氧化碳、碳氢化合物、氮氧化物等。
排放法规
各国对汽车排放标准的规定。
排放控制技术
三元催化转换器、颗粒物捕集器等,降低污染物排放 。
03
发动机的性能指标
动力性能
总结词
衡量汽车加速、爬坡和最高车速的能力。
详细描述
动力性能主要通过汽车的加速时间、最大爬坡度以及最高车速来衡量。加速时 间越短,车辆的加速性能越好;最大爬坡度越大,车辆的爬坡能力越强;最高 车速越高,车辆的极速性能越好。
燃料电池技术
总结词
燃料电池技术是一种将化学能转换为电 能的发电技术,通过燃料和氧化剂之间 的化学反应产生电流。
VS
详细描述
燃料电池技术利用燃料(如氢气)和氧化 剂(如氧气)之间的化学反应来产生电能 。与传统的内燃机相比,燃料电池技术具 有更高的效率和更少的排放。然而,目前 燃料电池技术的成本较高,且需要特殊的 燃料和氧化剂。
排气过程
燃烧后的废气通过排气门排出 气缸,完成一个工作循环。
02
发动机的工作循环
四冲程发动机工作循环
吸气冲程
空气通过进气门进入汽缸,与 汽油混合形成可燃混合气。
汽车发动机原理PPT课件

gi,ηi,经济性指标。
精选ppt
28
四、指示热效率ηi
定义:实际循环指示功Wci与所用燃油的发
热量Q1之比值,用ηi表示。
Ni —[KW]; Hu —[KJ/kg]燃料热值; Gf —[kg/h]; gi —[g/kw·h]
可以看出:ηi∝1/gi
标定工况下,ηi,gi的大致范围:
gi
ηi
汽油机: 205~320 0.25~0.40
1-2的压缩过程 绝热压缩;
2-3的燃烧过程 等压加热;
3-4的膨胀过程 绝热膨胀;
4-1的排气过程 等容放热。
等容加热循环的热效率:
ηT=1-1/εk-1×(ρK-1 )/K(ρ -1)
二、影响内燃机理想循环的主要因素
分析循环的主要目的是找出影响循环热 效率的因素,找到提高热效率的途径。
常用的方法有: 1、解析法: 从循环热效率的公式出发进行分析。 2、图示法: 由P—V图、T—S图入手分析。
二、影响ηm的因素
使用因素:转速、负荷、润滑油品质、水温等; 结构设计因素:最高燃烧压力、气缸尺寸数目、大气状态等。
1.转速n
负荷一定=>Pi、Ni基本不变
n↑=>摩擦损失↑ =>机械损失↑=>Pm↑
mN Nei 1N Nm i P Pei 1P Pm i
得: n↑,ηm↓
故用提高n来增加发动机的 动力性指标受到限制。 精选p图pt 2-3 ηm随转速的变化38关系
顺时针 正功-循环指示功; 逆时针 负功-泵气功;机械
损失功
示功图上循环曲线所围成的面
积的大小表示功的多少。
精选ppt
25
2、平均指示压力Pi
1)定义:发动机单位气缸工作容积每循环做的指 示功。
汽车发动机原理及构造PPT课件
排气行 程
800~1000
105~125 kPa
思考
四冲程汽油机 和柴油机的工 作循环有什么 相同之处呢?
共同点
1. 每个工作循环曲轴转两周,每一行 程曲轴转半周。
2. 只有作功行程产生动力。
思考
2能2够00按~2时80在0火(瞬花时塞最电高极) 间产生电火花的全部设备称为点火系,点火系通常由蓄电池、发电机、分电器、点火线圈和火花塞等组成。
配还气会机 引构起大发多动采机用过顶热置,气功门率式下配降气,机燃构油,消一耗般量由增气加门等组一、系气列门不传良动后组果和。气门驱动组组成。 (38)活压塞缩行比程—S——气—缸上总、容下积止与点燃之烧间室的容距积离之称比为称活为塞压行缩程比(。S=2R)。
同呢? 3功0用0~是50向0作kP相a对(作运功动终的了零) 件表面输送定量的清洁润滑油,以实现液体摩擦,减小摩擦阻力,减轻机件的磨损。
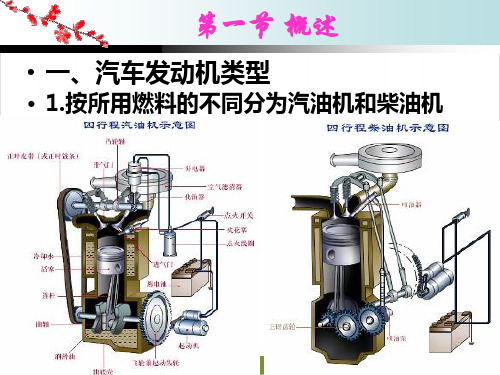
第一节 概述
(3)活塞行程S——上、下止点之间的距 离称为活塞行程 (S=2R)。
第一节 概述
(4)曲柄半径R——曲轴旋转中心到曲柄 销中心之间的距离称为曲柄半径。通常活 塞行程为曲柄半径的两倍,即s=2R 。
第一节 概述
(5)气缸工作容积Vh——活塞从一个止点 运动到另一个止点所扫过的容积,称为气 缸工作容积。一般用Vh 表示。单位是L
排气行程 900~1200
105~125 kPa
柴油机工作时各行程状态参数
状态 行程
温度(K)
压力
进气行 程
320~350
800~900 kPa
压缩行 程
800~1000
3~5MPa
作功行 程
2200~2800(瞬时最高)
3~5MPa (瞬时最高)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
间不变,即具有均匀一致的P、V、 T。
2、状态参数:用来描述气体热力状态的物理量 主要状态参数:压力P、比容ν、温度T、内能U、
熵S、焓H。
基本状态参数:可直接测量的状态参数,包括:
压力(P)、比容(ν)、温度(T)。
基本状态参数:
1、比容:用ν表示,单位是m3/kg 。
定义:单位质量的物质所占的容积。即:
比热:单位质量工质的热容量,用c表示。即 c=C/m 单位J/(kgK)或c=dq/dT(单位质量的物质
作单位温度变化时吸放的热量)
2、比热与过程的关系 功量和热量都是过程量,故比热与过程有关。 热力过程中最常见的加热过程是保持压力不变
和容积不变,因此比热也相应的分为定压质量 比热和定容质量比热,分别以符号cP 和cν 表
※热力学第一定律是能量转换与守恒定律在热力学上的具体应用, 它阐明了热能和其它形式的能量在转换过程中的守恒关系。 它表达工质在受热作功过程中,热量、作功和内能三者之间的平 衡关系。
二、内能-工质内部所具有的各种能量总称
系统本身所具有的能量包括:
宏观能量 微观能量
宏观能量包括:动能 位能
机械能
微观能量即系统的内能,包括:
q=Q/m J/kg
规定:传入热力系统的热量为正值, 即吸热为正;传出热力系统的热量为 负值,即放热为负。
※热量与功一样,是系统在热力过程 中与外界传递的能量形式,因此是过 程量,不是状态参数。
四.熵和温熵图
熵S的增量等于系统在
过程中交换热量除以传
热时绝对温度所得的商
ds=δq/T
1Kg工质的熵的单位J/kgK mKg工质熵的单位J/K
态到另一个平衡状态的变 化历程。
P-V图上,一个点表示
W12=∫12PdV 对单位质量的工质:
气体的一个热力状态; 一条曲线表示一个热 力过程。
二、膨胀功W(J)
w12=W/m=∫12PdV/m =∫12Pdν
※故P-V图上,
气体在热力过程中由于体 积发生变化所做的功(又
W12为过程线与横轴围 成的面积。
称为容积功)
规定:热力系统对外界做功为正,外界对热
力系统做功为负。
由δW=PdV得:
dV>0,膨胀,δW>0, 系统对外界做功;
膨胀,W>0
dV<0,压缩,δW<0,
压缩,W<0
外界对系统做功;
dV=0,δW=0,
系统与外界之间无功量
传递。
三、热量
是系统与外界之间依靠温差来传递的 能量形式,用Q表示
ቤተ መጻሕፍቲ ባይዱ
内动能 内位能
内位能与分子间的距离、吸引力有关,是比容的函数; 内动能包括移动动能、转动动能和振动动能,是温度的单 值函数。
★对于理想气体,不考虑分子间的位能,故内能只
是分子的内动能,仅与温度有关,是温度的单值函 数,用符号u表示,单位J。
三、闭口系统的能量方程
1、定义:
与外界没有质量交换的系统。
且 w =0,
推出:Δu=cv(T2-T1)
★内能是一状态量,与热力过程无关,且理想气体的内
能只是温度的函数,故上述公式适用于任何热力过程。
第四节 理想气体的热力过程
过程、发动机特性、发动机的排放与控制等。
第一章 工程热力学基础
本章要求:
了解:热力系统、工质、 功、热量、内能和熵等 概念,理想气体和卡诺 循环等。 理解:热力学第一和第 二定律,P-V图和P -S图,理想气体的热 力过程和发动机的理想 循环。
第一节 气体的状态及状态方程
一、热力系统
1、在热力学中,从若干个物体 中规划出所要研究的对象,称 为热力系统;
示。绝热指数:K= cP / cν
3、比热与气体性质、温度的关系
实验证明,多数气体的比热随温度的升高而增大, 但为使计算简便,不考虑比热随温度的变化,即采用定 值比热(或定比热)。
五、理想气体内能的计算
在保持系统容积不变的加热过程中,加热量为:
qν=cν(T2-T1) 由热力学第一定律 q=w+Δu
1、理想气体:气体分子本身不占有体积,分 子之间无相互作用力的气体。 2、理想气体的状态方程:
Pν=RT PV= mRT V= mν 对空气,R=0.287kJ/kg·K 3、压容图
气体的状态也可用PV图上的一个点表示,比 较直观。
第二节 热力过程及过程量
一、热力过程
热力系统从一个平衡状
功:δW=Fdx=APdx=PdV
ν=V/M
V--物质的容积,[m3]; M--物质的质量,[kg]。 比容的倒数是?
2、压力:用P表示,单位是Pa,Mpa、kPa。
定义:系统单位面积上受到的垂直作用力。
即:P=F/A
压力的测量
3、温度:用T表示,单位是K。 (T↑气体分子的平均 定义:表征物体的冷热程度 动能越大)
三、理想气体的状态方程
汽车发动机原理
课程概述
一、课程的性质和任务
1、研究发动机的工作过程和性能指标,主要包括 动力性、经济性、排放性等。
2、分析影响发动机性能指标的因素。 3、找出提高发动机性能指标的途径。
三、课程主要内容 主要内容包括:工程热力学基础、发动机示功图和 性能指标、燃料和燃烧、发动机换气、汽油机混合 气的形成与燃烧过程、柴油机混合气的形成与燃烧
吸热,Q>0
放热Q<0
熵s是一个状态参数
ds>0,Q>0,吸热;
ds<0,Q<0,放热;
ds=0,无热量交换.
※比容ν的变化量标志着有无做功,熵s的变化 量标志着有无传热。
第三节 热力学第一定律
一、热力学第一定律
表述为:当热能与其它形式的能量相互转换时,能的总
量保持不变。
对于一个热力系统:
进入系统的能量-离开系统的能量 =系统内部储存能量的变化量
界面
热力系
外界
研究对象以外的一切物质,称为外界;
热力系统和外界的分界面,称为界面。
2、工质:在热力设备中用来实现热能与其它 形式的能量交换的物质。 ※热力设备通过工质状态的变化实现与外界的 能量交换。
二、热力状态与状态参数
1、热力状态: 热力系统在某一瞬间所呈现的
宏观物理状况。
热力平衡状态:当外界条件不变系统内状态长时
2、能量方程式
Q-W=ΔU
故Q=ΔU+W
对于微元过程: δQ=dU+δW
对于1kg工质:
q=Δu+w (J/Kg)
—闭口系统能量方程
★以上各项均为代数值,可正可负或零,且 不受过程的性质和工质性质的限制。
四、理想气体的比热
1、比热的定义和单位
热容量:向热力系统加热(或取热)使之温度 升高(或降低)1K所需的热量,用C表示。
2、状态参数:用来描述气体热力状态的物理量 主要状态参数:压力P、比容ν、温度T、内能U、
熵S、焓H。
基本状态参数:可直接测量的状态参数,包括:
压力(P)、比容(ν)、温度(T)。
基本状态参数:
1、比容:用ν表示,单位是m3/kg 。
定义:单位质量的物质所占的容积。即:
比热:单位质量工质的热容量,用c表示。即 c=C/m 单位J/(kgK)或c=dq/dT(单位质量的物质
作单位温度变化时吸放的热量)
2、比热与过程的关系 功量和热量都是过程量,故比热与过程有关。 热力过程中最常见的加热过程是保持压力不变
和容积不变,因此比热也相应的分为定压质量 比热和定容质量比热,分别以符号cP 和cν 表
※热力学第一定律是能量转换与守恒定律在热力学上的具体应用, 它阐明了热能和其它形式的能量在转换过程中的守恒关系。 它表达工质在受热作功过程中,热量、作功和内能三者之间的平 衡关系。
二、内能-工质内部所具有的各种能量总称
系统本身所具有的能量包括:
宏观能量 微观能量
宏观能量包括:动能 位能
机械能
微观能量即系统的内能,包括:
q=Q/m J/kg
规定:传入热力系统的热量为正值, 即吸热为正;传出热力系统的热量为 负值,即放热为负。
※热量与功一样,是系统在热力过程 中与外界传递的能量形式,因此是过 程量,不是状态参数。
四.熵和温熵图
熵S的增量等于系统在
过程中交换热量除以传
热时绝对温度所得的商
ds=δq/T
1Kg工质的熵的单位J/kgK mKg工质熵的单位J/K
态到另一个平衡状态的变 化历程。
P-V图上,一个点表示
W12=∫12PdV 对单位质量的工质:
气体的一个热力状态; 一条曲线表示一个热 力过程。
二、膨胀功W(J)
w12=W/m=∫12PdV/m =∫12Pdν
※故P-V图上,
气体在热力过程中由于体 积发生变化所做的功(又
W12为过程线与横轴围 成的面积。
称为容积功)
规定:热力系统对外界做功为正,外界对热
力系统做功为负。
由δW=PdV得:
dV>0,膨胀,δW>0, 系统对外界做功;
膨胀,W>0
dV<0,压缩,δW<0,
压缩,W<0
外界对系统做功;
dV=0,δW=0,
系统与外界之间无功量
传递。
三、热量
是系统与外界之间依靠温差来传递的 能量形式,用Q表示
ቤተ መጻሕፍቲ ባይዱ
内动能 内位能
内位能与分子间的距离、吸引力有关,是比容的函数; 内动能包括移动动能、转动动能和振动动能,是温度的单 值函数。
★对于理想气体,不考虑分子间的位能,故内能只
是分子的内动能,仅与温度有关,是温度的单值函 数,用符号u表示,单位J。
三、闭口系统的能量方程
1、定义:
与外界没有质量交换的系统。
且 w =0,
推出:Δu=cv(T2-T1)
★内能是一状态量,与热力过程无关,且理想气体的内
能只是温度的函数,故上述公式适用于任何热力过程。
第四节 理想气体的热力过程
过程、发动机特性、发动机的排放与控制等。
第一章 工程热力学基础
本章要求:
了解:热力系统、工质、 功、热量、内能和熵等 概念,理想气体和卡诺 循环等。 理解:热力学第一和第 二定律,P-V图和P -S图,理想气体的热 力过程和发动机的理想 循环。
第一节 气体的状态及状态方程
一、热力系统
1、在热力学中,从若干个物体 中规划出所要研究的对象,称 为热力系统;
示。绝热指数:K= cP / cν
3、比热与气体性质、温度的关系
实验证明,多数气体的比热随温度的升高而增大, 但为使计算简便,不考虑比热随温度的变化,即采用定 值比热(或定比热)。
五、理想气体内能的计算
在保持系统容积不变的加热过程中,加热量为:
qν=cν(T2-T1) 由热力学第一定律 q=w+Δu
1、理想气体:气体分子本身不占有体积,分 子之间无相互作用力的气体。 2、理想气体的状态方程:
Pν=RT PV= mRT V= mν 对空气,R=0.287kJ/kg·K 3、压容图
气体的状态也可用PV图上的一个点表示,比 较直观。
第二节 热力过程及过程量
一、热力过程
热力系统从一个平衡状
功:δW=Fdx=APdx=PdV
ν=V/M
V--物质的容积,[m3]; M--物质的质量,[kg]。 比容的倒数是?
2、压力:用P表示,单位是Pa,Mpa、kPa。
定义:系统单位面积上受到的垂直作用力。
即:P=F/A
压力的测量
3、温度:用T表示,单位是K。 (T↑气体分子的平均 定义:表征物体的冷热程度 动能越大)
三、理想气体的状态方程
汽车发动机原理
课程概述
一、课程的性质和任务
1、研究发动机的工作过程和性能指标,主要包括 动力性、经济性、排放性等。
2、分析影响发动机性能指标的因素。 3、找出提高发动机性能指标的途径。
三、课程主要内容 主要内容包括:工程热力学基础、发动机示功图和 性能指标、燃料和燃烧、发动机换气、汽油机混合 气的形成与燃烧过程、柴油机混合气的形成与燃烧
吸热,Q>0
放热Q<0
熵s是一个状态参数
ds>0,Q>0,吸热;
ds<0,Q<0,放热;
ds=0,无热量交换.
※比容ν的变化量标志着有无做功,熵s的变化 量标志着有无传热。
第三节 热力学第一定律
一、热力学第一定律
表述为:当热能与其它形式的能量相互转换时,能的总
量保持不变。
对于一个热力系统:
进入系统的能量-离开系统的能量 =系统内部储存能量的变化量
界面
热力系
外界
研究对象以外的一切物质,称为外界;
热力系统和外界的分界面,称为界面。
2、工质:在热力设备中用来实现热能与其它 形式的能量交换的物质。 ※热力设备通过工质状态的变化实现与外界的 能量交换。
二、热力状态与状态参数
1、热力状态: 热力系统在某一瞬间所呈现的
宏观物理状况。
热力平衡状态:当外界条件不变系统内状态长时
2、能量方程式
Q-W=ΔU
故Q=ΔU+W
对于微元过程: δQ=dU+δW
对于1kg工质:
q=Δu+w (J/Kg)
—闭口系统能量方程
★以上各项均为代数值,可正可负或零,且 不受过程的性质和工质性质的限制。
四、理想气体的比热
1、比热的定义和单位
热容量:向热力系统加热(或取热)使之温度 升高(或降低)1K所需的热量,用C表示。
