罗丹明123染色检测线粒体膜电位
细胞凋亡、坏死、细胞活性检查常见方式及试剂

线粒体膜电位指示染料线粒体膜电位的下降是细胞凋亡初期的一个标志性事件. 它在凋亡进程中与caspase 活化同时发生并先于磷脂酰丝氨酸(PS)的外翻。
基于以上研究,Biotium 研发了各类的新型的荧光探针用于测量线粒体膜电位。
MitoView ™ 633MitoView ™ 633 是一种新型的用于测量线粒体膜电位的深红染料(激发光/发射光622/648 nm)。
利用NucView ™ 488 和MitoView ™ 633 凋亡检测试剂盒能够在荧光显微镜(图.1)或流式细胞仪(图.2、3)下同时进行线粒体膜电位和caspase-3活性的检测。
图 1. 利用MitoView ™ 633进行活细胞染色:Hela 细胞图 2. 流式细胞仪分析:Jurkat 细胞一组用CCCP 使线粒体去极化,另一组利用staurosporine 作为凋亡诱导剂。
利用MitoView ™633 染色图3. 流式细胞仪分析:对照(A)与经staurosporine 处置(B)的Jurkat 细胞(JC-1 染色). FL1 (x- 轴) 为绿色荧光; FL2 (y-轴) 为红色荧光。
(A 图) 较高的红绿荧光比例说明线粒体膜电位未下降. (B 图)较低的红绿荧光比例说明:由于staurosporine诱导了凋亡的发生,细胞的线粒体膜电位大幅下降。
JC-1 线粒体膜电位检测试剂盒JC-1通常被用于检测细胞中线粒体膜电位的转变。
在健康细胞中,JC-1以聚合体(J-aggregates),的形式存在在线粒体基质中,能够产生红色的荧光(激发光/发射光585/590nm)。
相反,在正在凋亡或坏死的细胞中,JC-1不能聚集在基质中,以单体的形式存在,从而发出绿色的荧光( 激发光/ 发射光510/527nm),如此能够利用流式细胞仪和荧光显微镜、荧光计数仪通过测量荧光颜色的转变来检测线粒体膜电位的转变。
经常使用红绿荧光的相对照例来衡量线粒体去极化的比例。
JC 线粒体膜电位的检测方法
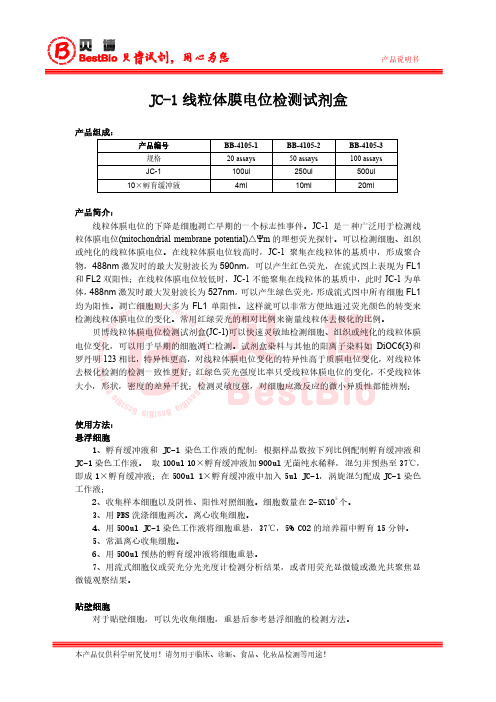
JC-1线粒体膜电位检测试剂盒产品组成:产品编号BB-4105-1 BB-4105-2 BB-4105-3规格20 assays 50 assays 100 assaysJC-1 100ul 250ul 500ul10×孵育缓冲液4ml 10ml 20ml产品简介:线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。
JC-1是一种广泛用于检测线粒体膜电位(mitochondrial membrane potential)△Ψm的理想荧光探针。
可以检测细胞、组织或纯化的线粒体膜电位。
在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,488nm激发时的最大发射波长为590nm,可以产生红色荧光,在流式图上表现为FL1和FL2双阳性;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,488nm激发时最大发射波长为527nm,可以产生绿色荧光,形成流式图中所有细胞FL1均为阳性。
凋亡细胞则大多为FL1单阳性。
这样就可以非常方便地通过荧光颜色的转变来检测线粒体膜电位的变化。
常用红绿荧光的相对比例来衡量线粒体去极化的比例。
贝博线粒体膜电位检测试剂盒(JC-1)可以快速灵敏地检测细胞、组织或纯化的线粒体膜电位变化,可以用于早期的细胞凋亡检测。
试剂盒染料与其他的阳离子染料如DiOC6(3)和罗丹明123相比,特异性更高,对线粒体膜电位变化的特异性高于质膜电位变化,对线粒体去极化检测的检测一致性更好;红绿色荧光强度比率只受线粒体膜电位的变化,不受线粒体大小,形状,密度的差异干扰;检测灵敏度强,对细胞应激反应的微小异质性都能辨别;使用方法:悬浮细胞1、孵育缓冲液和JC-1染色工作液的配制:根据样品数按下列比例配制孵育缓冲液和JC-1染色工作液。
取100ul 10×孵育缓冲液加900ul无菌纯水稀释,混匀并预热至37℃,即成1×孵育缓冲液;在500ul 1×孵育缓冲液中加入5ul JC-1,涡旋混匀配成JC-1染色工作液;2、收集样本细胞以及阴性、阳性对照细胞。
线粒体膜电位(MMP)检测的具体步骤及方法

线粒体膜电位(MMP)检测的具体步骤及方法线粒体膜电位(MMP)检测的具体步骤及方法一、技术简介大量的研究表明线粒体与细胞凋亡密切相关,其中线粒体跨膜电位(MMP)的下降,被认为是细胞凋亡级联反应过程中最早发生的事件之一。
它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转。
JC-1是一种碳氰化合物类阳离子荧光染料,可作为检测线粒体跨膜电位指示剂。
JC-1在细胞内以聚合体和单体两种不同的物理形式存在,分别处于不同的荧光发射峰。
当JC-1 浓度低或膜电位水平低时,主要以单体形式存在,激发波长为527nm,呈绿色荧光;当JC-1浓度升高或线粒体膜电位水平较高时,形成聚合物,发出红色的荧光,激发波长为590nm。
当细胞发生凋亡时,线粒体跨膜电位被去极化,JC-1从线粒体内释放,红光强度减弱,以单体的形式存在于胞质内发绿色荧光,根椐这一特征就可以检测线粒体膜电位的变化。
二、实验流程1. 细胞培养。
2. 用适当的方法诱导细胞凋亡,同时设立阴性依照组合阳性对照组,收集细胞。
3. 用PBS洗涤细胞三次,收集不多于1×106的细胞。
4. 取100μL 10×Incubation Buffer加900μL灭菌去离子水稀释成1×Incubation Buffer,混匀并预热至37℃。
5. 吸取500μL 1×Incubation Buffer,加入1μL JC-1,涡旋混匀配成JC-1工作液。
6. 取500μL JC-1工作液将细胞均匀悬浮,37℃,5% CO2的培养箱中孵育15~20min。
7. 室温离心(2000rpm, 5min)收集细胞,用1×Incubation Buffer洗两次。
8. 吸取500μL 10×Inc ubation Buffer重新悬浮细胞。
9. 流式细胞仪检测,分析。
线粒体膜电位标准_概述及解释说明

线粒体膜电位标准概述及解释说明1. 引言1.1 概述线粒体膜电位是指线粒体内外质间存在的一种电压差。
在细胞呼吸过程中,通过线粒体内外质间的质子转运,维持产生和维持着该电位。
线粒体膜电位不仅是维持细胞能量代谢所必需的,也与许多生理病理状态密切相关。
1.2 文章结构本文将首先对线粒体膜电位进行解释说明,包括其定义、作用以及测量方法。
随后将进行线粒体膜电位标准概述,探讨其重要性和意义,常见的标准值及其影响因素,并介绍相关研究进展,探索线粒体膜电位变化与生理病理状态之间的关系。
最后得出结论点。
1.3 目的本文旨在全面了解和阐述线粒体膜电位标准及其相关内容,从而增加对该领域的认识和理解。
同时,通过对相关研究进展的概述和分析,为今后深入研究提供思路和启示。
注意:以上内容仅为示例,请根据实际情况进行修改和适当补充。
2. 线粒体膜电位标准解释说明:2.1 线粒体膜电位的定义和作用:线粒体是细胞内的一个重要器官,它在维持细胞正常功能和生存中起着至关重要的作用。
线粒体膜电位(Mitochondrial Membrane Potential, MMP)指的是线粒体内外两侧膜的电势差。
具体来说,线粒体内侧带有负电荷,而线粒体外侧则带有正电荷,在这种情况下形成了一个负向电位。
MMP的主要作用之一是为ATP合成提供动力。
通过氧化磷酸化过程中所产生的负载(如NADH、FADH2),线粒体通过细胞呼吸链将这些负载传递给高效能合成ATP所需的蛋白质复合物。
这个过程需要由MMP提供能量驱动。
除了ATP合成外,MMP还参与调节许多其他的线粒体功能,如离子平衡、物质转运、抗氧化反应等。
此外,MMP也与细胞凋亡密切相关,高水平的MMP 可能导致细胞程序性死亡。
2.2 线粒体膜电位测量方法:目前,有各种各样的方法可用于测量线粒体膜电位。
其中最常用和可靠的方法是使用荧光探针染料。
这些染料可以穿过细胞膜并进入到线粒体内部,然后根据MMP的变化而发生荧光信号变化。
荧光探针汇总

1.Fluo-3 AM (钙离子荧光探针)原理 Fluo-3 AM是一种可以穿透细胞膜的荧光染料。
Fluo-3 AM的荧光非常弱,进入细胞后可以被细胞内的酯酶剪切形成Fluo-3,从而被滞留在细胞内,和细胞内游离的钙离子结合,结合钙离子后可以产生较强的荧光。
生理意义细胞内钙离子增多是细胞损伤的结果,因此此探针能表征细胞损伤程度激发波长506nm 发射波长 526nm (绿色)备注推荐使用2.Mag-fura-2 AM(钙离子荧光探针)原理Fura-2 AM是一种可以穿透细胞膜的荧光染料。
Fura-2 AM进入细胞后可以被细胞内的酯酶剪切形成Fura-2,从而被滞留在细胞内。
Fura-2可以和钙离子结合,结合钙离子后在330-350nm激发光下可以产生较强的荧光,而在380nm激发光下则会导致荧光减弱。
这样就可以使用340nm和380nm这两个荧光的比值来检测细胞内的钙离子浓度,可以消除不同细胞样品间荧光探针装载效率的差异,荧光探针的渗漏,细胞厚度差异等一些误差因素。
生理意义细胞内钙离子增多是细胞损伤的结果,因此此探针能表征细胞损伤程度激发波长为340nm和380nm 发射波长 510nm (蓝色)备注仪器滤光片不适用3 Fluo-4-AM (钙离子荧光探针)原理Fluo 4 是一种将Fluo 3结构中的Cl替换成F的钙荧光探针。
由于将Cl替换成了电子吸引力更强的F,它的最大激发波长会向短波长处偏离10 nm左右。
所以用氩激光器激发时,Fluo 4的荧光强度比Fluo 3强1倍。
由于Fluo 4及钙离子的亲和力和Fluo 3近似,所以使用上和Fluo 3也基本相同生理意义细胞内钙离子增多是细胞损伤的结果,因此此探针能表征细胞损伤程度激发波长494nm 发射波长516nm (绿色)备注用激光器激发时荧光强度强,因此不推荐4.DCFH-DA (活性氧荧光探针)原理DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,被细胞内的酯酶水解生成DCFH。
Rhodamine 123染色检测

产品号 BB-4104 BB-4105 BB-4106 BB-4107 BB-4108 BB-4112 BB-4123 BB-4137 BB-4132
本产品仅供科学研究使用!请勿用于临床、诊断、食品、化妆品检测等用途!
产品号 BB-4101 BB-4102 BB-4201 BB-4202 BB-4203 BB-4204 BB-4131 BB-4133 BB-4122
产品 细胞周期检测试剂盒 JC-1 线粒体膜电位试剂盒 Caspase 3 活性检测试剂盒 Caspase 8 活性检测试剂盒 Caspase 9 活性检测试剂盒 Caspase 10 活性检测试剂盒 细胞凋亡形态学检测试剂盒 Rhodamine 123 染色试剂盒 AO/EB 双染试剂盒
产品说明书
Rhodamine 123 染色试剂盒
产品组成:
产品编号 规格
Rhodamine 123 染色液
BB-4137 100 -200assays
1ml
产品简介: 贝博 Rhodamine 123 染色液可用于细胞凋亡检测,Rhodamine 123 是一种细胞通透性的、
阳离子的荧光探针,容易被有活性的线粒体摄取,没有细胞毒性,Rhodamine 123 由于带阳 离子所以当线粒体膜电位存在的时候就会透过细胞膜在活细胞的线粒体内聚集,发出黄绿色 荧光,而当膜电位下降的时候,聚集的 Rhodamine 123 就减少,从而发光强度降低。Rhodamine 1arin Acetate)等组合进行多色荧光分析, 相互间无 颜色交叉; 分析细胞凋亡时, 可用 Rhodamine 123 来检测线粒体的膜电位, 而用 NAO 来检测 线粒体结构的完整性。Rhodamine 123,可用于对许多种细胞进行染色,包括植物细胞和细 菌。由于细胞内 ATP 的量与 Rhodamine 123 的荧光强度之间有相关性,Rhodamine 123 也可 应用于检测细胞内的 ATP。
线粒体膜电位(MMP)检测的具体步骤及方法

线粒体膜电位(MMP)检测的具体步骤及方
法
线粒体膜电位(MMP)是细胞凋亡过程中最早发生的事
件之一,因此MMP的检测对于研究细胞凋亡具有重要意义。
JC-1是一种碳氰化合物类阳离子荧光染料,可以作为检测线
粒体跨膜电位的指示剂。
当MMP水平较高时,JC-1形成聚合物,发出红色的荧光;而当MMP水平低时,JC-1主要以单体形式存在,呈绿色荧光。
因此,根据JC-1的荧光特征可以检
测线粒体膜电位的变化。
实验流程包括以下步骤:
1.细胞培养。
2.用适当的方法诱导细胞凋亡,并设立阴性和阳性对照组,收集细胞。
3.用PBS洗涤细胞三次,收集不多于1×10的细胞。
4.取100μL 10×___加900μL灭菌去离子水稀释成1×n Buffer,混匀并预热至37℃。
5.吸取500μL 1×n Buffer,加入1μL JC-1,涡旋混匀配成JC-1工作液。
6.取500μL JC-1工作液将细胞均匀悬浮,37℃,5% CO2的培养箱中孵育15~20min。
7.室温离心(2000rpm。
5min)收集细胞,用1×___洗两次。
8.吸取500μL 10×___重新悬浮细胞。
9.使用流式细胞仪检测并分析。
通过以上步骤,可以得到线粒体膜电位的变化情况,从而研究细胞凋亡的机制。
罗丹明123染色检测线粒体膜电位

罗丹明123染色检测线粒体膜电位化学名:Rh123 罗丹明123别名:Rhodamine 123; Rh123分子式:C21H17CLN2O3分子量:380.82配制:罗丹明123粉剂用甲醇配成1mg/mlde 储备液,染色时用DPBS缓冲液将其稀释为所需浓度保存:冰箱-20度避光一、检测原理:罗丹明123(Rhodamine 123)是一种可透过细胞膜的阳离子荧光染料,是一种线粒体跨膜电位的指示剂。
其在正常细胞中能够依赖线粒体跨膜电位进入线粒体基质,荧光强度减弱或消失。
而在凋亡发生时,线粒体膜完整性破坏,线粒体膜通透性转运孔开放,引起线粒体跨膜电位(ΔΨm) 的崩溃, Rh123 重新释放出线粒体, 从而发出强黄绿色荧光,可用荧光显微镜、荧光光度计或流式细胞仪检测,通过荧光信号的强弱来检测线粒体膜电位的变化和凋亡的发生,可用于培养的细胞或从组织中提取出的线粒体的膜电位检测。
二、使用方法:1.细胞染色及分析(1)培养细胞1×106/mL重悬于培养基中;(2)加入罗丹明123染液0.1μg/mL~50 μg/mL(根椐细胞种类不同而浓度不同,一般3~10 μg/mL);(3)37℃,5% CO2细胞培养箱孵育1~30 min(根椐细胞种类不同而不同,一般10 min);(4)离心以培养基洗细胞两次;2.组织提取的线粒体染色及分析(1)按常规方法提取的线粒体,用适量的1×Assays Buffer(将5×Assays Buffer 用水稀释5倍)重悬;(2)常规方法进行蛋白含量测定后,用1×Assays Buffer调配成3mg/mL的线粒体溶液;(3)取2mL 1×Assays Buffer和1mL线粒体溶液;(4)加入适量待测化合物(同时设空白对照组),250C保温min;(5)加入罗丹明123染液10 μL;(6)荧光光度计检测:上述混合液全部加入石英比色皿中,置于250C下测定,激发波长488~505nm,发射波长530nm,连续记录从0 min~30 min内荧光强度的变化。
荧光探针汇总

1.Fluo-3 AM (钙离子荧光探针)原理 Fluo-3 AM是一种可以穿透细胞膜的荧光染料。
Fluo-3 AM的荧光非常弱,进入细胞后可以被细胞内的酯酶剪切形成Fluo-3,从而被滞留在细胞内,和细胞内游离的钙离子结合,结合钙离子后可以产生较强的荧光。
生理意义细胞内钙离子增多是细胞损伤的结果,因此此探针能表征细胞损伤程度激发波长506nm 发射波长 526nm (绿色)备注推荐使用2.Mag-fura-2 AM(钙离子荧光探针)原理Fura-2 AM是一种可以穿透细胞膜的荧光染料。
Fura-2?AM进入细胞后可以被细胞内的酯酶剪切形成Fura-2,从而被滞留在细胞内。
Fura-2可以和钙离子结合,结合钙离子后在330-350nm激发光下可以备注3原理F,Fluo 3备注4.原理。
而DCFH 的备注5.原理123备注氧化后成罗丹明123,荧光强度可能受到线粒体膜电位的影响6.RhodamineI23 (线粒体膜电位荧光探针)原理细胞膜通透的阴离子绿色荧光染料, 能够迅速被活线粒体摄取, 而无细胞毒性。
生理意义标记线粒体膜电位激发波长488nm 发射波长515 ~ 575nm (绿色)生理意义检测线粒体膜电位备注正在使用7.Hoechst 33342 (DNA荧光探针)原理 Hoechst 33342是一种可对DNA 染色的细胞核染色试剂,常用于细胞凋亡检测。
Hoechst染料可透过细胞膜在聚AT序列的富集区域的小沟处与DNA结合并对DNA染色而发出强烈的蓝色荧光。
生理意义标记双链DNA激发波长355nm 发射波长465nm (蓝色)备注正在使用8.FDA原理FDA可透过细胞膜并作为荧光素积蓄在活细胞内。
生理意义反映细胞膜完整性和细胞活力激发波长495nm 发射波长520nm (绿色)备注正在使用9.PI (DNA荧光探针)原理它不能透过完整的细胞膜,但能透过凋亡中晚期的细胞和死细胞的膜而将细胞核染红,与细胞核中的DNA结合的PI发出的荧光,与未结合的PI相比,强度会增强20-30倍。
线粒体膜电位检测方法

线粒体膜电位检测方法线粒体膜电位是细胞内线粒体膜的电压差,是维持线粒体功能和细胞生存的重要参数。
线粒体膜电位的变化与细胞凋亡、代谢活动、细胞增殖等密切相关,因此对线粒体膜电位进行准确、可靠的检测具有重要的生物学意义。
本文将介绍几种常用的线粒体膜电位检测方法。
1. 荧光探针法。
荧光探针法是一种常用的线粒体膜电位检测方法。
通过使用荧光探针染色线粒体,当线粒体膜电位发生变化时,荧光探针的荧光强度也会相应变化。
常用的荧光探针包括JC-1、TMRE等,这些荧光探针可以在荧光显微镜或流式细胞仪上进行检测,能够实时监测线粒体膜电位的变化。
2. 膜电位敏感染料法。
膜电位敏感染料法是另一种常用的线粒体膜电位检测方法。
这种方法利用膜电位敏感染料如DiSC3(5)、Safranin O等,这些染料在不同电位下的荧光强度不同,通过检测荧光强度的变化可以准确测定线粒体膜电位的变化。
3. 膜片钳技术。
膜片钳技术是一种直接测量细胞膜电位的方法,通过将膜片钳贴附在线粒体膜上,可以直接测定线粒体膜电位的变化。
这种方法需要专业的设备和技术支持,但能够提供非常准确的线粒体膜电位数据。
4. 光电压法。
光电压法是一种新兴的线粒体膜电位检测方法,利用光电极探测线粒体膜电位的变化。
这种方法具有高灵敏度、高时效性和高空间分辨率,能够实现对线粒体膜电位的高分辨率实时监测。
综上所述,线粒体膜电位检测是生物学研究中的重要内容,不同的检测方法各有优缺点,选择合适的方法需要根据具体实验要求和设备条件进行综合考虑。
通过准确可靠的线粒体膜电位检测,可以更好地理解线粒体功能和细胞生存状态,为相关疾病的研究和临床治疗提供重要参考。
应用流式细胞仪检测细胞凋亡的4种方法的比较

应用流式细胞仪检测细胞凋亡的4种方法的比较范宁娟;项萍;段敏【摘要】[目的]比较4种测定细胞凋亡方法的优缺点.[方法]应用流式细胞仪,分别采用PI单染法、Annexin V-FITC/PI复染法、罗丹明123染色法及Fluo-3染色法测定细胞凋亡.[结果]每种分析方法均有自己优势和不足,在检测过程中应进行多参数分析.[结论]该研究可为后续研究提供试验方法支持.【期刊名称】《安徽农业科学》【年(卷),期】2014(042)032【总页数】3页(P11240-11242)【关键词】流式细胞仪;细胞凋亡;检测方法【作者】范宁娟;项萍;段敏【作者单位】西北农林科技大学生命科学学院,陕西杨凌712100;西北农林科技大学植物保护学院,陕西杨凌712100;西北农林科技大学生命科学学院,陕西杨凌712100【正文语种】中文【中图分类】S1088;G306.01972年,Kerr等[1]首次提出细胞凋亡(Apoptosis, APO)的概念,宣告对细胞凋亡探索的真正开始。
细胞凋亡是细胞在多重因素参与调控下正常的、自动死亡的生理过程。
它不同于一般意义上的细胞坏死。
异常凋亡状态的出现会导致多种疾病的发生[2-4]。
因此,细胞凋亡的检测在生物学研究中备受关注。
流式细胞仪(Flow cytometry,FCM)是20世纪70年代发展起来的高科技产品[5-7],在检测细胞凋亡方面具有简单、快速和敏感性高的特点,是研究细胞凋亡的主要手段[8-9]。
笔者使用PARTEC 流式细胞仪,通过比较PI单染法、Annexin V-FITC/ PI复染法、罗丹明123染色法及Fluo-3染色法4种测定细胞凋亡的方法,分析优缺点,以期为后续研究提供理论和试验支持。
1.1 试验材料人脐静脉内皮细胞(HUVEC)购自武汉细胞库,脂多糖(Lipopolysaccharides,LPS)购自sigma 公司,细胞周期与细胞凋亡检测试剂盒、Annexin V-FITC/PI 细胞凋亡检测试剂盒、罗丹明123膜电位检测试剂盒、Fluo-3钙离子浓度检测试剂盒均购自碧云天生物技术研究所。
JC-1单标法和JC-1 PI双标法荧光探针检测山羊附睾精子线粒体膜功能的研究

JC-1单标法和JC-1 PI双标法荧光探针检测山羊附睾精子线粒体膜功能的研究摘要:为准确、全面研究超低温冷冻技术对山羊附睾精子线粒体膜电位的影响效果,本试验采用荧光探针JC-1单标和JC-1/PI双标2种荧光染色方法,通过流式细胞仪和荧光显微镜两种检测手段对精子线粒体膜电位(Mitochondrialmembranepotential,MMP)变化进行检测分析,用JC-1单独染色,能准确、快速地区分高、低MMP精子,但不能明确区分精子的存活状态,采用JC-1与碘化丙啶(Propidiumiodide,PI)双标法,则能明显判定精子的存活状态。
通过对绒山羊附睾精子在冷冻前和解冻后线粒体膜电位检测,结果表明,单标记后高MMP精子尾部呈橙红色,低MMP精子尾部为绿色;双标后死亡精子头部呈红色(PI+)。
对两种检测手段的比较研究,结果显示,荧光显微镜能够有效地区分出高、低MMP及死精子,但对于活精子中MMP的高低检测效果不理想;流式细胞仪则能够有效地区分活精子MMP的高低,而且结果准确,速度快,敏感性高。
试验表明,两种检测方法相关性很高,分析同一处理样品时用JC+%和JC+/PI-%检测结果呈显著正相关(r=0.815,r=0.982,P<0.01)。
因此,对于精子线粒体MMP的分析,采用JC-1单染与JC-1/PI双染的方法,利用流式细胞仪与荧光显微镜进行联合检测,能比较全面、准确的反映出精子线粒体的功能状态。
关键词:山羊;精子;线粒体膜电位;JC-1线粒体是活性氧形成的主要场所,活性氧的生成是导致电子传递过程的中断,氧化磷酸化与电子传递的耦合是维持高的线粒体膜电位(△ψm)的重要环节,而这种高的线粒体膜电位状态是细胞和精子维持活性在线粒体中产生ATP能量所必需的保障,因此,在精子整个代谢过程所需的能量主要由线粒体提供[1,2]。
线粒体活性的改变会影响精子的能量供应[3],且线粒体还是细胞凋亡的调控中枢[4]。
瑞巴派特对NSAIDs肠病中肝线粒体功能的影响

瑞巴派特对NSAIDs肠病中肝线粒体功能的影响刁磊;梅俏;许建明;刘晓昌;金娟【摘要】To investigate the effect of rebamipide on liver mitochondria in NSAIDs enteropathy model in mice. Methods The model group was induced by intragastric administration with diclofenac( 2. 5 mg/kg ) in mice. Normal group and model group were intragastric administrated with solvent, glutamine group and rebamipide group were intragastric administrated with the glutamine ( 1 000 mg/kg ) and rebamipide ( 400 mg/kg ) respectively. At the end of the experiment, the parameters of mitochondrial function including the mitochondrial swelling and membrane protential, mitochondrial NADH levels, SDH and ATPase activities were measured. At the same time, the changes of mitochondrial morphological in the small intestinal mucosa were detected by electron microscope. Results Compared with normal group, the small intestinal epithelial in model group showed the mitochondrial swelling and mitochondria cristac breaking, with the mitochondrial membrane potential significantly changed. The NADH content;SDH and ATPase were activity decreased significantly( P <0. 01 ). At the mitochondrial level, rebamipide could evidently increase the SDH, ATPase activities and NADH levels, decrease the swelling extent significantly. Conclusion Rebamipide has a protective effect on liver mitochondria in NSAIDs enteropathy model in mice.%目的探讨瑞巴派特对小鼠非甾体类抗炎药(NSAIDs)肠病模型中肝线粒体功能的影响研究.方法选用双氯芬酸钠2.5 mg/kg灌胃3 d制备小鼠NSAIDs肠病模型,实验分为正常对照组、模型对照组、瑞巴派特组(400 mg/kg)、谷氨酰胺组(1 000 mg/kg),各组给药时间3 d,正常对照组和模型对照组以溶媒灌胃.实验结束后测定小鼠肝脏线粒体膜电位、线粒体肿胀度、NADH水平、SDH及ATPase活性.同时电镜检测小肠黏膜线粒体形态改变.结果与正常对照组比较,模型对照组小肠黏膜上皮细胞线粒体肿胀,线粒体嵴突破坏.肝线粒体膜电位及肿胀度明显改变,NADH含量,SDH及ATPase活性降低(P<0.01).瑞巴派特组小肠黏膜上皮细胞线粒体形态接近正常.肝线粒体膜电位及肿胀度改善,NADH含量,SDH及ATPase 活性升高(P<0.01).结论瑞巴派特对NSAIDs肠病模型中线粒体功能具有保护作用.【期刊名称】《安徽医科大学学报》【年(卷),期】2011(046)010【总页数】4页(P993-996)【关键词】非甾体类抗炎药;瑞巴派特;NSAIDs肠病;线粒体【作者】刁磊;梅俏;许建明;刘晓昌;金娟【作者单位】安徽医科大学第一附属医院消化内科,合肥,230022;安徽医科大学第一附属医院消化内科,合肥,230022;安徽医科大学第一附属医院消化内科,合肥,230022;安徽医科大学第一附属医院消化内科,合肥,230022;安徽医科大学第一附属医院消化内科,合肥,230022【正文语种】中文【中图分类】R574.53;R916.63;R965.1非甾体类抗炎药(non-steroid anti-inflammatory drugs,NSAIDs)导致小肠黏膜损伤[1],引起NSAIDs肠病。
线粒体功能学研究常用实验方法

线粒体功能学研究常用实验方法刘江涛;王霖霖【摘要】线粒体作为细胞病变或损伤时最敏感的指标之一,对其功能的研究是分子细胞病理学检查的重要内容.目前研究线粒体功能的方法主要有线粒体耗氧量、线粒体呼吸链复合体活性、线粒体膜电位、细胞内ATP水平、线粒体膜离子通道的开放状态、活性氧类的变化、免疫蛋白印迹以及线粒体DNA拷贝数检测等.该文就线粒体功能学研究常用实验方法进行综述.【期刊名称】《医学综述》【年(卷),期】2015(021)001【总页数】3页(P6-8)【关键词】线粒体;呼吸链复合体;线粒体膜电位;活性氧类【作者】刘江涛;王霖霖【作者单位】宁波市第二医院骨科中心,浙江宁波315010;宁波市第一医院妇产科,浙江宁波315010【正文语种】中文【中图分类】R34线粒体是一种存在于大多数真核细胞中的双层膜细胞器。
线粒体具有自身的遗传系统,但其基因组大小有限,且受核基因组的调控,所以是一种半自主的细胞器[1]。
线粒体产生ATP为细胞供能,并在细胞中间代谢产物的氧化、细胞内环境稳态的调节等细胞活动中发挥着重要作用[2]。
线粒体是细胞内氧自由基产生的场所,同时本身也是氧自由基攻击的靶目标[3]。
线粒体功能障碍可引起细胞内多种信号级联反应、氧化应激反应,并启动程序性细胞死亡,其在几乎所有疾病的发生、发展中起至关重要的作用[4]。
线粒体作为细胞病变或损伤时最敏感的指标之一,对其功能的研究是分子细胞病理学检查的重要内容[5]。
现就线粒体功能学研究常用实验方法综述如下。
1 线粒体的提取蔗糖密度梯度离心法是提取线粒体的经典方法[6],其根据细胞各组分密度的不同,将细胞或组织匀浆液悬浮于均匀的悬浮介质中,采用差速离心的方法进行分离。
缓冲的蔗糖溶液(0.25 mol/L蔗糖)比较接近细胞质的分散相,可在一定程度上保持各种细胞器的结构以及酶的活性,成为最常应用的悬浮介质。
此外,在pH值=7.2的条件下,各亚细胞组分不容易重新聚集,有利于分离。
线粒体染色还原电位

线粒体染色还原电位
线粒体染色还原电位(Mitochondrial Staining Reduction Potential,MRP)是一种在细胞学实验室中常用的技术,用于检测细胞里线粒体的状态。
线粒体由内质网组成,因而称为线粒体网。
该网内含有多种微量元素,并可控制细胞的能量代谢,影响细胞的活力水平。
由于它的重要性,需要对线粒体进行有效的监控,MRP技术即是用来做这项工作的。
MRP是一种光学技术,利用染色剂和非恒定指示剂,根据其在线粒体内的还原电位,实现对线粒体状态的检测。
MRP有两种标记方法:一种是染料指示法,用于直接检测线粒体活性。
一种是放射性标记方法,用于间接检测线粒体功能。
对于后者,以甲基磺酸(Methyl Succinate)标记一种非恒定指示剂,配合甲烷,将Methyl Succinate 阳性电荷转移到线粒体网的正极,然后检测其在网内体积的吸收率。
MRP技术可以帮助科学家及医学工作者更深入地了解细胞和组织的生理和生物学状态。
它可以用于识别细胞的损伤、功能失调和病理性状态。
此外,来自学术方面也受益于有效的线粒体功能检测,帮助研究人员更好地理解细胞及组织内复杂的代谢反应网络。
总之,MRP技术是一种快速、准确、有效的线粒体检测方法,它可以用来检测细胞和组织的生理状态。
这种技术的发展为生物科学的研究和医学的应用提供了实用的技术支持。
不仅在临床诊断中有重要应用,而且在研究细胞及组织的代谢网络方面,也提供了重要参考。
代谢及药理研究平台操作规程

药物代谢及抗炎药理研究平台操作规程目录LPS致HUVECs高表达IL-8/IL-6炎症模型的建立 (3)TNF-α致HUVECs高表达VCAM-1及ICAM-1模型的建立 (6)H2O2致HUVECs凋亡研究模型的建立 (8)N9细胞经LPS刺激后的NOS合酶表达研究 (11)附录1:PCR实验操作规程 (13)附录2:Western blot 操作规程 (16)附录3:细胞免疫组化操作规程 (21)附录4:TNF-α诱导的内皮与U937单核细胞粘附实验 (22)附录5:琼脂糖凝胶电泳缓冲液的配制 (23)附录6:Western blot实验试剂配制 (24)附录7:考马斯亮蓝染色及丽春红染色操作规程 (28)附录8:Griess法检测NO含量 (29)附录9:苏木精-伊红染色 (31)附录10: BCA蛋白定量实验 (32)附录11: Stripping buffer 配制及操作规程 (33)附录12:自由基清除实验 (34)附录13:DNA抽提实验操作规程 (39)附录14:细胞创伤愈合实验 (40)附录15:罗丹明123流式及荧光染色操作规程 (41)附录16:JC-1流式操作规程 (42)附录17: 胞内ROS流式及荧光检测操作规程 (43)附录18:胞内Ca2+流式检测操作规程 (44)附录19:细胞周期流式检测操作规程 (45)附录20:植物花有机溶剂抽提操作规程 (46)附录21:CFSE细胞毒实验操作规程 (49)附录22: 油红O染色操作规程 (50)附录23: 台盼蓝染色 (51)附录24:MTT实验操作规程 (52)附录25:凝胶酶谱实验操作 (53)附录26. 组织切片、HE染色及免疫组化操作规程 (55)附录27: 细胞的冻存及复苏 (57)附录28: 细胞复苏 (58)LPS致HUVECs高表达IL-8/IL-6炎症模型的建立1.1. 细胞传代①以PBS(2 ml)洗涤2次;加入0.125%胰酶1ml(针对50ml培养瓶而言),于37 °C培养箱中消化2 min;加入2 ml完全培养基,终止消化;室温离心4 min,转速为600 rpm。
线粒体荧光探针,线粒体膜电位探针,ATP检测...

线粒体荧光探针,线粒体膜电位探针,ATP检测...线粒体是存在于所有真核细胞中的独特的膜结合细胞器,作为ATP生产和细胞能量供应的主要场所,线粒体的独特方面(包括称为mDNA的单独遗传物质,其自身的蛋白质合成机制以及严格调节的膜电位梯度)使其成为重要的研究课题,另外,随着衰老过程和更多其他人类疾病方面的研究发现,线粒体的作用比以往更加值得我们研究。
这期主要给大家带来线粒体荧光探针(活细胞和固定细胞),线粒体膜电位探针,ATP检测,线粒体自噬检测,线粒体通透性转换孔(MPTP)检测相关工具。
一.细胞线粒体染料1. 用于标记活细胞线粒体的可用MitoLite™染料线粒体蓝色荧光染料MitoLite Blue FX490,货号:AAT-226742. CytoFix™红色固定线粒体染色CytoFix™Red线粒体染色剂增强的细胞维持能力可使线粒体局部荧光得到保持,即使固定过程中线粒体膜电位丧失后也可以保留。
该染料产生的荧光信号在溶酶体中得到很好的保留,使其便于长期跟踪线粒体。
CytoFix™红色线粒体染色剂可与GFP表达的细胞,其他荧光偶联物和其他细胞器染色剂一起使用,进行多色分析。
它既可用于悬浮细胞,也可用于贴壁细胞,并易于适应各种荧光平台。
CytoFix™红色线粒体染色的特征:线粒体染色效率高固定后可长期保留操作时间短,标记步骤简便在96孔黑边框透明底板上用CytoFix™MitoRed染色的HeLa细胞的荧光图像。
CytoFix™Red—适用于固定细胞线粒体染色CytoFix™红色线粒体染色,货号:AAT-23200二.线粒体膜电位:电子传输链产生的线粒体膜电位(ΔΨm)是健康的线粒体功能所必需的关键参数。
与质子梯度一起,它产生了线粒体ATP合成背后的驱动力。
它通过选择性消除功能异常的线粒体在线粒体稳态中发挥关键作用,并且是线粒体钙稳态的重要组成部分。
凋亡早期的显着特征是正常线粒体功能的破坏,线粒体膜的破坏和氧化还原电位可能会引起细胞活力的不必要损失,并成为导致各种疾病的原因。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
罗丹明123染色检测线粒体膜电位
化学名:Rh123 罗丹明123
别名:Rhodamine 123; Rh123
分子式:C21H17CLN2O3
分子量:380.82
配制:罗丹明123粉剂用甲醇配成1mg/mlde 储备液,染色时用DPBS缓冲液将其稀释为所需浓度
保存:冰箱-20度避光
一、检测原理:
罗丹明123(Rhodamine 123)是一种可透过细胞膜的阳离子荧光染料,是一种线粒体跨膜电位的指示剂。
其在正常细胞中能够依赖线粒体跨膜电位进入线粒体基质,荧光强度减弱或消失。
而在凋亡发生时,线粒体膜完整性破坏,线粒体膜通透性转运孔开放,引起线粒体跨膜电位(ΔΨm) 的崩溃, Rh123 重新释放出线粒体, 从而发出强黄绿色荧光,可用荧光显微镜、荧光光度计或流式细胞仪检测,通过荧光信号的强弱来检测线粒体膜电位的变化和凋亡的发生,可用于培养的细胞或从组织中提取出的线粒体的膜电位检测。
二、使用方法:
1.细胞染色及分析
(1)培养细胞1×106/mL重悬于培养基中;
(2)加入罗丹明123染液0.1μg/mL~50 μg/mL(根椐细胞种类不同而浓度不同,一般3~10 μg/mL);
(3)37℃,5% CO2细胞培养箱孵育1~30 min(根椐细胞种类不同而不同,一般10 min);
(4)离心以培养基洗细胞两次;
2.组织提取的线粒体染色及分析
(1)按常规方法提取的线粒体,用适量的1×Assays Buffer(将5×Assays Buffer 用水稀释5倍)重悬;
(2)常规方法进行蛋白含量测定后,用1×Assays Buffer调配成3mg/mL的线粒体溶液;
(3)取2mL 1×Assays Buffer和1mL线粒体溶液;
(4)加入适量待测化合物(同时设空白对照组),250C保温min;
(5)加入罗丹明123染液10 μL;
(6)荧光光度计检测:上述混合液全部加入石英比色皿中,置于250C下测定,激发波长488~505nm,发射波长530nm,连续记录从0 min~30 min内荧光强度的变化。
三、注意事项
1、操作时需戴手套
2、罗丹明123为通透性染料,可以自由进入细胞
3、孵育时,必须避免光照
4、使用时,避免污染母液
5、染色完成后,即刻进行荧光检测分析。
