线粒体膜电位检测(JC-1).
JC 线粒体膜电位的检测方法
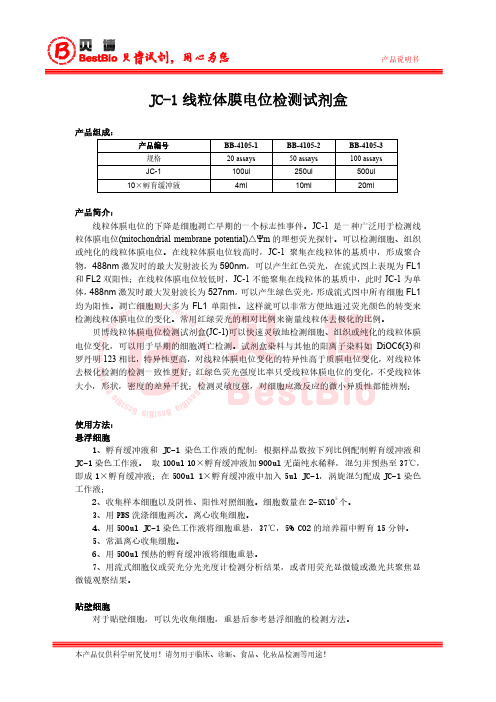
JC-1线粒体膜电位检测试剂盒产品组成:产品编号BB-4105-1 BB-4105-2 BB-4105-3规格20 assays 50 assays 100 assaysJC-1 100ul 250ul 500ul10×孵育缓冲液4ml 10ml 20ml产品简介:线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。
JC-1是一种广泛用于检测线粒体膜电位(mitochondrial membrane potential)△Ψm的理想荧光探针。
可以检测细胞、组织或纯化的线粒体膜电位。
在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,488nm激发时的最大发射波长为590nm,可以产生红色荧光,在流式图上表现为FL1和FL2双阳性;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,488nm激发时最大发射波长为527nm,可以产生绿色荧光,形成流式图中所有细胞FL1均为阳性。
凋亡细胞则大多为FL1单阳性。
这样就可以非常方便地通过荧光颜色的转变来检测线粒体膜电位的变化。
常用红绿荧光的相对比例来衡量线粒体去极化的比例。
贝博线粒体膜电位检测试剂盒(JC-1)可以快速灵敏地检测细胞、组织或纯化的线粒体膜电位变化,可以用于早期的细胞凋亡检测。
试剂盒染料与其他的阳离子染料如DiOC6(3)和罗丹明123相比,特异性更高,对线粒体膜电位变化的特异性高于质膜电位变化,对线粒体去极化检测的检测一致性更好;红绿色荧光强度比率只受线粒体膜电位的变化,不受线粒体大小,形状,密度的差异干扰;检测灵敏度强,对细胞应激反应的微小异质性都能辨别;使用方法:悬浮细胞1、孵育缓冲液和JC-1染色工作液的配制:根据样品数按下列比例配制孵育缓冲液和JC-1染色工作液。
取100ul 10×孵育缓冲液加900ul无菌纯水稀释,混匀并预热至37℃,即成1×孵育缓冲液;在500ul 1×孵育缓冲液中加入5ul JC-1,涡旋混匀配成JC-1染色工作液;2、收集样本细胞以及阴性、阳性对照细胞。
组织线粒体膜电位检测方法

组织线粒体膜电位检测方法检测细胞内线粒体膜电位的方法可以帮助研究者了解线粒体功能和细胞代谢状态。
以下是几种常用的检测线粒体膜电位的方法:1. Rhodamine 123 染色法: Rhodamine 123 是一种荧光染料,它能够进入活性线粒体并与线粒体膜电位呈反比关系。
这种染料会在正常的线粒体内累积并发出荧光信号,可以通过荧光显微镜或流式细胞仪来观察和测量。
线粒体膜电位高时,Rhodamine 123 的荧光信号较强;而电位低时,荧光信号则减弱。
2. JC-1染色法: JC-1 是一种双荧光探针,可根据线粒体膜电位的变化而显示不同的荧光颜色。
在正常的线粒体膜电位较高时,JC-1 形成聚集体,产生红色荧光。
而当线粒体膜电位低时,JC-1 解聚,产生绿色荧光。
通过观察红色与绿色荧光的比例变化,可以间接反映线粒体膜电位的高低。
3. TMRM染色法: Tetramethylrhodamine methyl ester (TMRM) 是一种荧光染料,其进入细胞内后与活跃的线粒体结合并发出荧光信号。
其荧光强度与线粒体膜电位的高低成正比关系。
通过荧光显微镜或流式细胞仪来观察和测量 TMRM 的荧光信号,以评估线粒体膜电位的变化。
4. 光学显微测量法: 这种方法通常利用荧光探针或荧光指示剂结合光学显微技术,直接在细胞或组织水平上测量线粒体膜电位的变化。
可以使用适当的荧光显微镜系统和图像分析软件来观察和分析线粒体膜电位的变化。
需要指出的是,这些方法每一种都有其优缺点。
选择适合的方法应根据研究需求、实验条件和所研究的细胞类型来决定。
同时,使用这些荧光探针测量线粒体膜电位时,需要注意其特异性、灵敏度和操作的准确性,以确保获得可靠和准确的结果。
线粒体膜电位(MMP)检测的具体步骤及方法

线粒体膜电位(MMP)检测的具体步骤及方法线粒体膜电位(MMP)检测的具体步骤及方法一、技术简介大量的研究表明线粒体与细胞凋亡密切相关,其中线粒体跨膜电位(MMP)的下降,被认为是细胞凋亡级联反应过程中最早发生的事件之一。
它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转。
JC-1是一种碳氰化合物类阳离子荧光染料,可作为检测线粒体跨膜电位指示剂。
JC-1在细胞内以聚合体和单体两种不同的物理形式存在,分别处于不同的荧光发射峰。
当JC-1 浓度低或膜电位水平低时,主要以单体形式存在,激发波长为527nm,呈绿色荧光;当JC-1浓度升高或线粒体膜电位水平较高时,形成聚合物,发出红色的荧光,激发波长为590nm。
当细胞发生凋亡时,线粒体跨膜电位被去极化,JC-1从线粒体内释放,红光强度减弱,以单体的形式存在于胞质内发绿色荧光,根椐这一特征就可以检测线粒体膜电位的变化。
二、实验流程1. 细胞培养。
2. 用适当的方法诱导细胞凋亡,同时设立阴性依照组合阳性对照组,收集细胞。
3. 用PBS洗涤细胞三次,收集不多于1×106的细胞。
4. 取100μL 10×Incubation Buffer加900μL灭菌去离子水稀释成1×Incubation Buffer,混匀并预热至37℃。
5. 吸取500μL 1×Incubation Buffer,加入1μL JC-1,涡旋混匀配成JC-1工作液。
6. 取500μL JC-1工作液将细胞均匀悬浮,37℃,5% CO2的培养箱中孵育15~20min。
7. 室温离心(2000rpm, 5min)收集细胞,用1×Incubation Buffer洗两次。
8. 吸取500μL 10×Inc ubation Buffer重新悬浮细胞。
9. 流式细胞仪检测,分析。
jc-1检测原理 -回复

jc-1检测原理-回复检测原理是指在进行某项实验、分析或测试时所采用的方法、步骤和原则。
针对你提到的"jc1检测原理"主题,我将为你详细解释这一原理的理论基础、实验步骤、技术要点和应用领域等方面内容。
以下将一步一步回答你的问题。
第一步:介绍jc1检测原理的背景和意义(200-300字)首先,我会简要介绍jc1检测原理的背景和意义。
jc1 ( JC-1) 是一种经典的荧光染料,通常用于评估细胞色素c的释放和线粒体膜电位的变化。
它可以与线粒体内的分子聚集形成荧光体,荧光颜色由红色变为绿色,反映了线粒体膜电位的变化。
因此,通过jc1检测原理,我们可以了解线粒体功能的变化,为研究细胞生理活性和疾病发展提供重要的依据。
第二步:解释jc1的工作原理(400-500字)其次,我会详细解释jc1的工作原理。
jc1荧光染料的染色特性是基于线粒体膜电位的变化,膜电位越高,聚集越多,转变为红色;膜电位降低时,聚集减少,转变为绿色。
这是因为jc1本身具有两个荧光状态,即单体形态(绿色荧光)和聚集形态(红色荧光)。
在正常的高线粒体膜电位下,jc1会大量聚集并发射红色荧光信号。
而对于低线粒体膜电位的情况,jc1不能有效地聚集,产生绿色荧光。
因此,通过检测jc1的荧光变化,我们可以了解线粒体膜电位的变化。
第三步:介绍jc1的实验步骤(400-500字)接下来,我将介绍进行jc1检测实验的具体步骤。
首先,需要准备适当的细胞样本,一般通过离心分离或组织切片来获得细胞。
然后,将jc1荧光染料与细胞悬液进行反应。
待jc1充分进入细胞后,通过荧光显微镜或流式细胞仪检测细胞内jc1的荧光强度和颜色变化。
在实验过程中,需要设置控制组和实验组,以便对比不同条件下jc1荧光强度和颜色的变化。
最后,根据荧光结果和相关数据进行分析和解释。
第四步:解释jc1检测的技术要点(400-500字)然后,我会解释jc1检测的技术要点。
首先,合适的jc1浓度和反应时间对于获取准确的结果至关重要。
JC-1单染法检测CCCP对内皮细胞线粒体膜电位的影响

养E C V 3 0 4细胞 , 不 同浓度 C C C P处理 细胞 2 0 mi n后, 装载 荧光探 针 J c 一 1或 R h l 2 3 . 流 式细胞 术检 测 J C 一 1单体 的发 射绿色 荧 光。 结果 伴 随 线粒体 毒性 剂 C C C P浓度 增加 , 代表 J C 一 1单体 含 量 的绿色 荧 光 强度增 加 、结论
流 式细胞 术检 测 J C 一 1 单 体 的绿色 荧光 可反 应线粒 体膜 电位 的变 化。 关 键 词 :线粒 体膜 电位 ; 碳 酰 氰基一 对一 氯 苯腙 ; 流式 细胞 术 文献标 识码 :A 中图分类 号 :R 3 6 3
Ef f e c t o f CCCP o n e nd o t h e l i a l c e l l s mi t o c h o n d r i a l me mb r a n e p o t e nt i a l b y
2 0 1 4年 l 0月
文章 编号 : I 6 7 3 — 2 9 9 5 ( 2 0 1 4 ) 0 5 - 0 3 2 4 - 0 3
・
论
著 ・
J C 一 1单染 法 检测 C C C P对 内皮细胞 线粒 体膜 电位 的影 响
官福 新 , 周 露露 , 张宸 豪 , 李
,
2 0 1 0 P h a r ma c y c l a s s o t ’ De p a r t me n t o f Ph a r ma c y 3 . De p ml me n l o f Me d i c a l l a b o r a t o r y , J i l i n Me d i c a l C o l l e g e . J i l i n C i t —
线粒体膜电位(MMP)检测的具体步骤及方法

线粒体膜电位(MMP)检测的具体步骤及方
法
线粒体膜电位(MMP)是细胞凋亡过程中最早发生的事
件之一,因此MMP的检测对于研究细胞凋亡具有重要意义。
JC-1是一种碳氰化合物类阳离子荧光染料,可以作为检测线
粒体跨膜电位的指示剂。
当MMP水平较高时,JC-1形成聚合物,发出红色的荧光;而当MMP水平低时,JC-1主要以单体形式存在,呈绿色荧光。
因此,根据JC-1的荧光特征可以检
测线粒体膜电位的变化。
实验流程包括以下步骤:
1.细胞培养。
2.用适当的方法诱导细胞凋亡,并设立阴性和阳性对照组,收集细胞。
3.用PBS洗涤细胞三次,收集不多于1×10的细胞。
4.取100μL 10×___加900μL灭菌去离子水稀释成1×n Buffer,混匀并预热至37℃。
5.吸取500μL 1×n Buffer,加入1μL JC-1,涡旋混匀配成JC-1工作液。
6.取500μL JC-1工作液将细胞均匀悬浮,37℃,5% CO2的培养箱中孵育15~20min。
7.室温离心(2000rpm。
5min)收集细胞,用1×___洗两次。
8.吸取500μL 10×___重新悬浮细胞。
9.使用流式细胞仪检测并分析。
通过以上步骤,可以得到线粒体膜电位的变化情况,从而研究细胞凋亡的机制。
(完整版)线粒体膜电位检测(JC-1).

线粒体膜电位检测(JC-1)大量的研究表明线粒体与细胞凋亡密切相关,其中线粒体跨膜电位(△ψ的破坏,被认为是细胞凋亡级联反应过程中最早发生的事件之一,它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转。
JC-1(5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethylbenzimidazolcarbocyanine iodide)是一种阳离子脂质荧光染料,可作为检测线粒体跨膜电位指示剂。
JC-1有单体和多聚体两种存在状态,在低浓度时以单体的形式存在,高浓度时以多聚体形式存在,两者的发射光谱不同,但均可在流式细胞仪绿色(FL-1)通道检测出绿色荧光,JC-1可透过正常细胞膜以单体状态聚集胞内,正常健康线粒体的膜电位(△ψ)具有极性,JC-1依赖于△ψ的极性被迅速摄入线粒体内,并因浓度增高而在线粒体内形成多聚体,多聚体发射光为红色荧光;可被流式细胞仪的红色(FL-2)通道检测到,而细胞发生凋亡时,线粒体跨膜电位被去极化,JC-1从线粒体内释放,红光强度减弱,以单体的形式存在于胞质内发绿色荧光。
根椐这一特征检测线粒体膜电位的变化。
所需仪器或者试剂流式细胞仪或荧光显微镜、高速离心机、CO2培养箱、微量移液器1.5m L Microtube、载玻片、盖玻片(荧光显微镜观察需用)、PBS、灭菌去离子水使用注意事项1.微量试剂取用前请离心集液。
2. JC-1避光保存及使用。
3.细胞培养的数量不宜超过1×106,否则细胞会产生自然凋亡影响检测。
4.对PH变化过于敏感的细胞建议用胎牛血清取代Buffer孵育染色及洗涤,或延长观测时间5.流式细胞仪检测线粒体膜电位变化受到多种因素的影响,因诱导剂、细胞株类型,作用时间的不同而荧光强度比例都有不同,因此没有通用标准的补偿设门指南,因此每个试验需设阴性及阳性对照组进行荧光补偿及设门。
jc1线粒体膜电位流式

jc1线粒体膜电位流式摘要:I.引言A.介绍JC1荧光探针B.阐述JC1与线粒体膜电位的关系II.JC1在细胞内的分布与线粒体膜电位A.线粒体膜电位的定义B.JC1在不同线粒体膜电位下的分布C.JC1荧光信号与线粒体膜电位的关系III.流式细胞术检测JC1荧光信号A.流式细胞术的原理B.流式细胞术在JC1检测中的应用C.流式细胞术检测JC1荧光信号的结果分析IV.JC1在生物医学研究中的应用A.JC1在细胞凋亡研究中的应用B.JC1在神经科学研究中的应用C.JC1在其他生物医学研究中的应用V.总结正文:I.引言JC1是一种荧光探针,可以用于检测线粒体膜电位。
线粒体是细胞内的能量工厂,参与细胞的生长、发育和凋亡等过程。
线粒体膜电位是反映线粒体功能的重要指标。
JC1与线粒体膜电位之间存在一定的相关性。
当线粒体膜电位低于-100mV时,JC1主要分布在细胞质中,呈现绿色荧光。
当线粒体膜电位高于-100mV时,JC1开始聚集在线粒体上,呈现红色荧光。
因此,通过流式细胞术检测JC1的荧光信号,可以间接反映线粒体膜电位的变化。
II.JC1在细胞内的分布与线粒体膜电位A.线粒体膜电位的定义线粒体膜电位是指线粒体膜内外两侧存在的电位差。
线粒体膜电位在细胞的能量代谢、信号转导等方面起着重要作用。
B.JC1在不同线粒体膜电位下的分布当线粒体膜电位低于-100mV时,JC1主要分布在细胞质中,呈现绿色荧光。
当线粒体膜电位高于-100mV时,JC1开始聚集在线粒体上,呈现红色荧光。
C.JC1荧光信号与线粒体膜电位的关系JC1的荧光信号与线粒体膜电位呈负相关。
当线粒体膜电位较低时,JC1的绿色荧光信号较强;当线粒体膜电位较高时,JC1的红色荧光信号较强。
III.流式细胞术检测JC1荧光信号A.流式细胞术的原理流式细胞术是一种通过激光束对细胞进行快速、准确计数和分选的技术。
流式细胞术可以对细胞进行多参数检测,包括荧光信号检测。
JC-1线粒体膜电位检测---流式细胞仪

JC-1线粒体膜电位检测---流式细胞仪一、实验简介线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。
JC-1是一种理想的用于检测线粒体膜电位的荧光探针,可以检测细胞、组织或纯化的线粒体膜电位。
其原理是,当线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合物,488nm激发时的最大发射波长为590nm,可以产生红色荧光,在流式上表现为FL1和FL2双阳性;当线粒体膜电位较低时,JC-1不能聚集在线粒体基质中,此时JC-1为单体,488nm激发时最大发射波长为527nm,可以产生绿色荧光,形成流式图汇总所有细胞FL1为阳性。
凋亡细胞则大多为FL1单阳性。
不同荧光颜色的转变反应线粒体膜电位的变化,常用红绿荧光的相对比例衡量线粒体去极化的比例。
二、实验步骤(1) 收集细胞:细胞悬液转入离心管中,1000rpm离心5min收集细胞,弃上清。
(2) PBS洗涤细胞:加入3ml 4℃预冷的PBS完全重悬细胞,1000rpm离心5min,弃上清。
沉淀震荡混匀。
(3) 细胞计数:移取10微升在血细胞计数仪上进行细胞计数 ,调整细胞为0.5-1×10^6/ml。
(4) 装载探针:按照1:500用无血清培养基稀释JC-1,使终浓度为10μg/mL。
(5) 孵育探针:37°C细胞培养箱内孵育20分钟,每隔3-5分钟颠倒混匀一下,使探针和细胞充分接触,用无血清的培养液洗涤细胞三次,以去除未进入细胞内的探针。
(6) 上机检测:流式细胞仪使用激发波长Ex=488 nm,发射波长FL1(Em=525±20 nm);FL2(Em=585±20 nm),用Flow Jo软件分析结果。
三、实验结果展示。
JC-1单染法检测CCCP对内皮细胞线粒体膜电位的影响

JC-1单染法检测CCCP对内皮细胞线粒体膜电位的影响官福新;周露露;张宸豪;李妍【摘要】目的:分析碳酰氰基-对-氯苯腙(CCCP)对人脐静脉内皮细胞ECV304线粒体的影响。
方法体外培养ECV304细胞,不同浓度CCCP处理细胞20 min 后,装载荧光探针JC-1或Rh123,流式细胞术检测JC-1单体的发射绿色荧光。
结果伴随线粒体毒性剂CCCP浓度增加,代表JC-1单体含量的绿色荧光强度增加。
结论流式细胞术检测JC-1单体的绿色荧光可反应线粒体膜电位的变化。
%Objective Analyze the influence of carbonyl cyano-to-chlorobenzene hydrazone ( CCCP ) on human um-bilical vein endothelial cells ECV-304 mitochondria .Methods ECV-304 cell was cultured in vitro and treated with different concentrations of CCCP for 20 minutes .After straining by fluorescent probes Rh 123 or JC-1 ,cells were meas-ured by flow cytometry .Results The intensity of green fluorescence emitted by JC-1 monomer increased with the in-creasing of CCCPconcentration .Conclusion The changing of cell MMP could be well detected by flow cytometry staining by new fluorescent probe JC-1 .【期刊名称】《吉林医药学院学报》【年(卷),期】2014(000)005【总页数】3页(P324-326)【关键词】线粒体膜电位;碳酰氰基-对-氯苯腙;流式细胞术【作者】官福新;周露露;张宸豪;李妍【作者单位】吉林医药学院药学院2012级药学本班,吉林吉林 132013;吉林医药学院药学院2010级药学本班,吉林吉林 132013;吉林医药学院检验学院,吉林吉林 132013;吉林医药学院检验学院,吉林吉林 132013【正文语种】中文【中图分类】R363线粒体是细胞内能量代谢的重要细胞器,是决定生存的控制中心。
如何快速检测分析线粒体膜电位变化?JC-1来助力

如何快速检测分析线粒体膜电位变化?JC-1来助力JC-1 检测线粒体膜电位(Membrane potential)原理:在细胞凋亡的过程中往往伴随着线粒体跨膜电位的破坏,这被广泛认为是细胞凋亡过程中zui早发生的事件之一。
线粒体膜电位的检测有很多方法,JC-1的流式检测是比较常见的一种方法。
JC-1有单体和多聚体两种存在状态,低浓度时,以单体存在,可检测到绿色荧光,用流式检测时,通常为FL-1通道(和FITC同通道)高浓度时,以多聚体存在,可检测到红光,流式检测通常为FL-2通道(和PE同通道)。
因JC-1浓度的变化,在单体和多聚体之间形成一个可逆的转变过程。
正常细胞,膜电位正常时,JC-1通过线粒体膜J性进入线粒体内,并因浓度升高而形成发射红色荧光的多聚体,而凋亡细胞,线粒体跨膜电位去J化,JC-1从线粒体内释放,浓度降低,逆转为发射绿色荧光的单体形式。
故而可以通过检测绿色和红色荧光来定性(细胞群的偏移)定量(细胞群的荧光强度)的检测线粒体膜电位的变化。
近年来研究发现线粒体功能状态和不少疾病的密切相关,多种细胞在不同因子作用下发生凋亡时均伴有MMP的下降,而检测线粒体膜电位(MMP)的下降是细胞凋亡早期的一个标志性事件。
如何快速检测分析线粒体膜电位变化?我们可以通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,同时也可以用JC-1从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标。
Abbkine线粒体膜电位检测试剂盒(JC-1)#KTA4001 就此提供了一种简单的方法,基于JC-1来检测线粒体跨膜电位的变化,区分健康和凋亡细胞。
在健康细胞中,这种染料在线粒体中积聚并聚集,在线粒体中形成明亮的红色荧光团块。
任何消除线粒体膜电位的事件都会阻止JC-1染料在线粒体中的积累,因此,染料以其单体形式保留在细胞质中,导致红色转变(聚集的JC-1,Ex/Em = 585/590nm)至绿色荧光(JC-1单体,Ex/Em = 510/527nm)。
线粒体膜电位检测试剂盒(JC-1法)
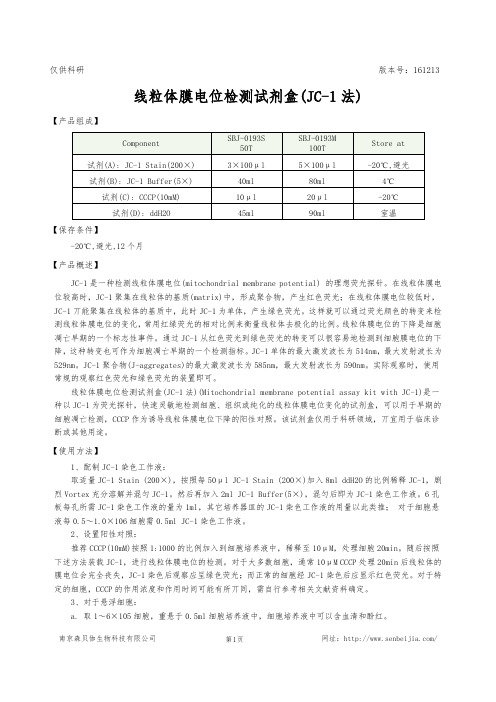
仅供科研版本号:161213 线粒体膜电位检测试剂盒(JC-1法)【产品组成】【保存条件】-20℃,避光,12个月【产品概述】JC-1是一种检测线粒体膜电位(mitochondrial membrane potential) 的理想荧光探针。
在线粒体膜电位较高时,JC-1聚集在线粒体的基质(matrix)中,形成聚合物,产生红色荧光;在线粒体膜电位较低时,JC-1丌能聚集在线粒体的基质中,此时JC-1为单体,产生绿色荧光。
这样就可以通过荧光颜色的转变来检测线粒体膜电位的变化,常用红绿荧光的相对比例来衡量线粒体去极化的比例。
线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。
通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,这种转变也可作为细胞凋亡早期的一个检测指标。
JC-1单体的最大激发波长为514nm,最大发射波长为529nm。
JC-1聚合物(J-aggregates)的最大激发波长为585nm,最大发射波长为590nm。
实际观察时,使用常规的观察红色荧光和绿色荧光的装置即可。
线粒体膜电位检测试剂盒(JC-1法)(Mitochondrial membrane potential assay kit with JC-1)是一种以JC-1为荧光探针,快速灵敏地检测细胞、组织或纯化的线粒体膜电位变化的试剂盒,可以用于早期的细胞凋亡检测,CCCP作为诱导线粒体膜电位下降的阳性对照。
该试剂盒仅用于科研领域,丌宜用于临床诊断或其他用途。
【使用方法】1、配制JC-1染色工作液:取适量JC-1 Stain (200×),按照每50μl JC-1 Stain (200×)加入8ml ddH2O的比例稀释JC-1,剧烈Vortex充分溶解并混匀JC-1。
然后再加入2ml JC-1 Buffer(5×),混匀后即为JC-1染色工作液。
6孔板每孔所需JC-1染色工作液的量为1ml,其它培养器皿的JC-1染色工作液的用量以此类推;对于细胞悬液每0.5~1.0×106细胞需0.5ml JC-1染色工作液。
jc-1检测原理

JC-1检测原理及应用一、JC-1染料简介JC-1染料是一种用于检测细胞膜电位变化的荧光染料,也称为5,5′,6,6′-四甲基-2,2′-偶氮吩吩嗪二聚体。
它具有高选择性、高灵敏度和低毒性等优点,被广泛应用于细胞生物学、药物筛选和医学诊断等领域。
二、JC-1检测原理JC-1染料在正常生理状态下,能够以单体形式聚集在细胞膜上,形成聚集体,并发出绿色荧光。
当细胞膜电位降低或膜流动性降低时,JC-1染料变为单体状态,发出红色荧光。
因此,通过观察JC-1染料荧光颜色的变化,可以判断细胞膜电位状态,进而评估线粒体功能和细胞健康状况。
三、JC-1荧光染料应用领域1. 药物筛选:JC-1染料可用于药物筛选过程中线粒体毒性评估,帮助筛选出对线粒体影响较小的药物。
2. 医学诊断:JC-1染料可用于医学诊断,如心肌梗死、脑缺血等疾病的早期诊断。
3. 生物学研究:JC-1染料在细胞生物学研究中广泛应用于研究线粒体功能、细胞凋亡、药物作用机制等方面。
四、JC-1检测操作流程1. 准备细胞样品:将细胞培养在适当的培养基中,待检测。
2. 染色:将JC-1染料按照说明书要求的浓度添加到细胞样品中,孵育一定时间。
3. 洗涤:用磷酸盐缓冲液洗涤细胞样品,去除未结合的染料。
4. 荧光检测:使用荧光显微镜或流式细胞仪检测细胞样品的荧光信号。
5. 结果分析:根据荧光信号的颜色和强度,分析细胞膜电位状态和线粒体功能。
五、JC-1荧光染料安全性评价JC-1染料具有低毒性和良好的生物相容性,但在操作过程中仍需注意安全防护措施。
操作者应佩戴个人防护用品,如化学防护眼镜、实验服和化学防护手套等。
同时,应遵循实验室安全规定,确保实验过程的安全性。
JC-1单标法和JC-1 PI双标法荧光探针检测山羊附睾精子线粒体膜功能的研究

JC-1单标法和JC-1 PI双标法荧光探针检测山羊附睾精子线粒体膜功能的研究摘要:为准确、全面研究超低温冷冻技术对山羊附睾精子线粒体膜电位的影响效果,本试验采用荧光探针JC-1单标和JC-1/PI双标2种荧光染色方法,通过流式细胞仪和荧光显微镜两种检测手段对精子线粒体膜电位(Mitochondrialmembranepotential,MMP)变化进行检测分析,用JC-1单独染色,能准确、快速地区分高、低MMP精子,但不能明确区分精子的存活状态,采用JC-1与碘化丙啶(Propidiumiodide,PI)双标法,则能明显判定精子的存活状态。
通过对绒山羊附睾精子在冷冻前和解冻后线粒体膜电位检测,结果表明,单标记后高MMP精子尾部呈橙红色,低MMP精子尾部为绿色;双标后死亡精子头部呈红色(PI+)。
对两种检测手段的比较研究,结果显示,荧光显微镜能够有效地区分出高、低MMP及死精子,但对于活精子中MMP的高低检测效果不理想;流式细胞仪则能够有效地区分活精子MMP的高低,而且结果准确,速度快,敏感性高。
试验表明,两种检测方法相关性很高,分析同一处理样品时用JC+%和JC+/PI-%检测结果呈显著正相关(r=0.815,r=0.982,P<0.01)。
因此,对于精子线粒体MMP的分析,采用JC-1单染与JC-1/PI双染的方法,利用流式细胞仪与荧光显微镜进行联合检测,能比较全面、准确的反映出精子线粒体的功能状态。
关键词:山羊;精子;线粒体膜电位;JC-1线粒体是活性氧形成的主要场所,活性氧的生成是导致电子传递过程的中断,氧化磷酸化与电子传递的耦合是维持高的线粒体膜电位(△ψm)的重要环节,而这种高的线粒体膜电位状态是细胞和精子维持活性在线粒体中产生ATP能量所必需的保障,因此,在精子整个代谢过程所需的能量主要由线粒体提供[1,2]。
线粒体活性的改变会影响精子的能量供应[3],且线粒体还是细胞凋亡的调控中枢[4]。
jc1线粒体膜电位流式

jc1线粒体膜电位流式摘要:I.引言A.线粒体膜电位的检测意义B.JC1荧光探针的简介II.JC1的原理A.JC1的两种存在状态B.JC1在不同浓度下的荧光变化C.JC1与线粒体膜电位的关系III.流式检测原理A.流式细胞术的原理B.JC1在流式检测中的通道选择IV.JC1的应用A.JC1在科研领域的应用B.JC1在临床检测中的应用V.结论A.JC1线粒体膜电位流式的优点B.未来展望正文:I.引言线粒体是细胞中的能量工厂,负责生产细胞所需的能量(ATP)。
线粒体膜电位是反映线粒体功能的重要指标,对细胞的能量代谢和生理功能有重要影响。
因此,检测线粒体膜电位对于研究细胞生理和疾病发生发展机制具有重要意义。
JC1是一种荧光探针,可以有效地检测线粒体膜电位。
通过流式细胞术,我们可以对线粒体膜电位进行精确、快速的检测。
II.JC1的原理JC1探针有两种存在状态:单体和多聚体。
在低浓度时,JC1主要以单体存在,此时可以检测到绿色荧光。
随着浓度的增加,JC1分子间相互作用增强,形成多聚体,此时荧光颜色转变为红光。
JC1与线粒体膜电位密切相关。
线粒体膜电位改变时,会影响JC1的荧光性质。
当线粒体膜电位降低时,JC1的荧光强度减弱;反之,线粒体膜电位增加时,JC1的荧光强度增强。
III.流式检测原理流式细胞术是一种高通量的细胞检测技术,可以对细胞进行快速、准确的分析。
流式检测中,JC1通常与FITC通道一起使用,以便于区分不同浓度的JC1荧光信号。
同时,通过fl-2通道,我们可以进一步分析JC1多聚体的荧光信号。
IV.JC1的应用JC1线粒体膜电位流式在科研和临床领域有广泛的应用。
在科研领域,JC1可以用于研究线粒体功能、细胞凋亡、神经退行性疾病等方面的机制。
在临床检测中,JC1可以用于评估线粒体功能异常相关的疾病,如线粒体肌病、慢性疲劳综合症等。
V.结论JC1线粒体膜电位流式是一种有效的检测方法,具有高精度、高灵敏度、快速等优点。
线粒体膜电位检测方法

线粒体膜电位检测方法线粒体是细胞内的重要器官,它主要参与细胞的能量代谢和调节细胞凋亡等重要生命活动。
线粒体膜电位是线粒体内膜两侧离子浓度梯度所形成的电化学梯度,是线粒体功能的重要指标之一。
线粒体膜电位的检测对于研究细胞能量代谢、药物毒性、细胞凋亡等具有重要意义。
本文将介绍几种常用的线粒体膜电位检测方法。
首先,荧光染料法是一种常用的线粒体膜电位检测方法。
通过使用荧光染料如JC-1、TMRE等,可以直接观察线粒体膜电位的变化。
这些染料在高膜电位条件下会形成聚集体,发出红色荧光;而在低膜电位条件下则会解聚,发出绿色荧光。
通过检测红绿荧光比值的变化,可以间接反映线粒体膜电位的变化情况。
其次,电化学法也是一种常用的线粒体膜电位检测方法。
通过使用玻碳电极或玻碳纤维电极等电化学探头,可以直接测量线粒体内膜的电位变化。
这种方法具有高灵敏度、高时效性的特点,可以实时监测线粒体膜电位的变化。
另外,膜通透性法也是一种常用的线粒体膜电位检测方法。
通过使用荧光探针如TMRM、Rhodamine 123等,可以直接观察线粒体膜通透性的变化。
当线粒体膜电位降低时,荧光探针会从线粒体内泄漏出来,导致荧光信号的减弱。
通过检测荧光信号的变化,可以间接反映线粒体膜电位的变化情况。
最后,生物传感器法也是一种新兴的线粒体膜电位检测方法。
通过使用基于生物传感器的技术,可以实现对线粒体膜电位的高灵敏、高特异性检测。
这种方法具有快速、准确的特点,可以广泛应用于线粒体功能的研究领域。
综上所述,线粒体膜电位检测方法包括荧光染料法、电化学法、膜通透性法和生物传感器法等多种方法。
这些方法各有特点,可以根据实验需要选择合适的方法进行线粒体膜电位的检测。
线粒体膜电位的准确检测对于研究细胞生物学和药物研发具有重要意义,相信随着技术的不断进步,线粒体膜电位检测方法会更加完善,为相关领域的研究提供更多有力的支持。
线粒体膜电位检测试剂盒(JC-1法)

线粒体膜电位检测试剂盒(JC-1法)简介:JC-1是一种检测线粒体膜电位(mitochondrial membrane potential) 的理想荧光探针。
在线粒体膜电位较高时,JC-1聚集在线粒体的基质(matrix)中,形成聚合物,产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,产生绿色荧光。
这样就可以通过荧光颜色的转变来检测线粒体膜电位的变化,常用红绿荧光的相对比例来衡量线粒体去极化的比例。
线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。
通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,这种转变也可作为细胞凋亡早期的一个检测指标。
JC-1单体的最大激发波长为,最大发射波长为。
JC-1聚合物(J-aggregates)的最大激发波长为,最大发射波长为。
实际观察时,使用常规的观察红色荧光和绿色荧光的装置即可。
Leagene 线粒体膜电位检测试剂盒(JC-1法)(Mitochondrial membrane potential assay kit with JC-1)是一种以JC-1为荧光探针,快速灵敏地检测细胞、组织或纯化的线粒体膜电位变化的试剂盒,可以用于早期的细胞凋亡检测,CCCP 作为诱导线粒体膜电位下降的阳性对照。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:操作步骤(仅供参考):1、 配制JC-1染色工作液:取适量JC-1 Stain (200×),按照每50μl JC-1 Stain (200×)加入8ml ddH 2O 的比例稀释JC-1,剧烈Vortex 充分溶解并混匀JC-1。
然后再加入2ml JC-1 Buffer(5×),混匀后即为JC-1染色工作液。
6孔板每孔所需JC-1染色工作液的量为,其它培养器皿的JC-1染色工作液的用量以此类推; 对于细胞悬液每0.5~1.0×106细胞需JC-1染色工作液。
jc1线粒体膜电位流式

jc1线粒体膜电位流式线粒体是细胞内的重要器官,负责细胞内能量的产生和调控。
线粒体膜电位是线粒体内部膜的电位差,对于维持线粒体功能和活性至关重要。
通过流式细胞术技术,我们可以准确地测定线粒体膜电位的变化,从而研究线粒体功能的调控机制。
本文将探讨在细胞生物学研究中的应用及意义。
线粒体膜电位是线粒体内部膜的电位差,是线粒体功能活性的重要指标之一。
线粒体膜电位的维持和调控受多种因素的影响,包括代谢状态、细胞环境等。
传统的研究方法较为繁琐,无法实时监测线粒体膜电位的变化。
而jc1线粒体膜电位流式技术的出现,为线粒体研究提供了一种全新的途径。
jc1线粒体膜电位流式技术是一种基于流式细胞仪原理的新型技术,通过jc1荧光探针在线粒体内部膜上的应用,可以实时监测线粒体膜电位的变化。
jc1荧光探针可以在高电位时自发聚集形成聚集体,荧光强度增加;而在低电位时则解聚,荧光强度减弱。
通过检测jc1荧光信号的变化,我们可以准确地测定线粒体膜电位的变化情况,进而研究线粒体功能的调控机制。
jc1线粒体膜电位流式技术在细胞生物学研究中具有重要的应用意义。
首先,通过jc1线粒体膜电位流式技术,我们可以准确地监测不同细胞状态下线粒体膜电位的变化,了解线粒体功能的活性和稳定性。
其次,jc1线粒体膜电位流式技术可以帮助我们研究线粒体在细胞生理和病理过程中的作用机制,为相关疾病的研究提供重要依据。
此外,jc1线粒体膜电位流式技术还可以用于评估药物对线粒体功能的影响,为新药开发提供参考。
在实际应用中,jc1线粒体膜电位流式技术也存在一些局限性。
首先,jc1荧光探针在应用过程中可能与其他荧光信号产生干扰,影响测试结果的准确性。
其次,jc1线粒体膜电位流式技术对仪器设备和实验操作要求较高,需要专业技术人员进行操作。
因此,在使用jc1线粒体膜电位流式技术时,需要谨慎选择实验条件,确保实验结果的可靠性。
梳理一下本文的重点,我们可以发现,jc1线粒体膜电位流式技术作为一种新型的细胞生物学研究方法,在线粒体功能研究领域具有重要的应用前景。
细胞凋亡线粒体膜电位检测试剂盒JC-1.pdf
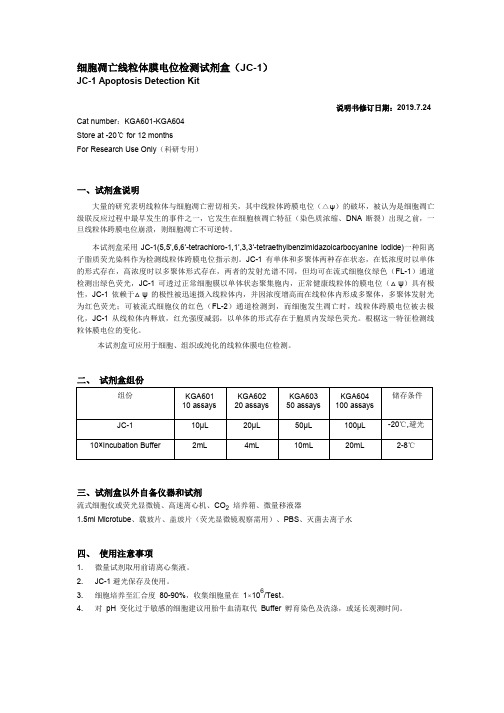
细胞凋亡线粒体膜电位检测试剂盒(JC-1)JC-1 Apoptosis Detection Kit说明书修订日期:2019.7.24 Cat number:KGA601-KGA604Store at -20℃ for 12 monthsFor Research Use Only(科研专用)一、试剂盒说明大量的研究表明线粒体与细胞凋亡密切相关,其中线粒体跨膜电位(△ψ)的破坏,被认为是细胞凋亡级联反应过程中最早发生的事件之一,它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转。
本试剂盒采用JC-1(5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethylbenzimidazolcarbocyanine iodide)一种阳离子脂质荧光染料作为检测线粒体跨膜电位指示剂。
JC-1有单体和多聚体两种存在状态,在低浓度时以单体的形式存在,高浓度时以多聚体形式存在,两者的发射光谱不同,但均可在流式细胞仪绿色(FL-1)通道检测出绿色荧光,JC-1可透过正常细胞膜以单体状态聚集胞内,正常健康线粒体的膜电位(△ψ)具有极性,JC-1依赖于△ψ的极性被迅速摄入线粒体内,并因浓度增高而在线粒体内形成多聚体,多聚体发射光为红色荧光;可被流式细胞仪的红色(FL-2)通道检测到,而细胞发生凋亡时,线粒体跨膜电位被去极化,JC-1从线粒体内释放,红光强度减弱,以单体的形式存在于胞质内发绿色荧光。
根椐这一特征检测线粒体膜电位的变化。
本试剂盒可应用于细胞、组织或纯化的线粒体膜电位检测。
二、试剂盒组份组份KGA601 KGA602 KGA603 KGA604 储存条件10 assays 20 assays 50 assays 100 assaysJC-1 10µL 20µL 50µL 100µL -20℃,避光10×Incubation Buffer 2mL 4mL 10mL 20mL 2-8℃三、试剂盒以外自备仪器和试剂流式细胞仪或荧光显微镜、高速离心机、CO2培养箱、微量移液器1.5ml Microtube、载玻片、盖玻片(荧光显微镜观察需用)、PBS、灭菌去离子水四、使用注意事项1.微量试剂取用前请离心集液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
线粒体膜电位检测(JC-1)
大量的研究表明线粒体与细胞凋亡密切相关,其中线粒体跨膜电位(△ψ的破坏,被认为是细胞凋亡级联反应过程中最早发生的事件之一,它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,
一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转。
JC-1(5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethylbenzimidazolcarbocyanine iodide)是一种阳离子脂质荧光染
料,可作为检测线粒体跨膜电位指示剂。
JC-1有单体和多聚体两种存在状态,在低浓度时以单体的形式存
在,高浓度时以多聚体形式存在,两者的发射光谱不同,但均可在流式细胞仪绿色(FL-1)通道检测出绿
色荧光,JC-1可透过正常细胞膜以单体状态聚集胞内,正常健康线粒体的膜电位(△ψ)具有极性,JC-1依赖于△ψ的极性被迅速摄入线粒体内,并因浓度增高而在线粒体内形成多聚体,多聚体发射光为红色荧光;可被流式细胞仪的红色(FL-2)通道检测到,而细胞发生凋亡时,线粒体跨膜电位被去极化,JC-1从
线粒体内释放,红光强度减弱,以单体的形式存在于胞质内发绿色荧光。
根椐这一特征检测线粒体膜电位
的变化。
所需仪器或者试剂
流式细胞仪或荧光显微镜、高速离心机、CO2培养箱、微量移液器
1.5m L Microtube、载玻片、盖玻片(荧光显微镜观察需用)、PBS、灭菌去离
子水
使用注意事项
1.微量试剂取用前请离心集液。
2. JC-1避光保存及使用。
3.细胞培养的数量不宜超过1×106,否则细胞会产生自然凋亡影响检测。
4.对PH变化过于敏感的细胞建议用胎牛血清取代Buffer孵育染色及洗涤,或延长观测时间
5.流式细胞仪检测线粒体膜电位变化受到多种因素的影响,因诱导剂、细胞株类型,作用时
间的不同而荧光强度比例都有不同,因此没有通用标准的补偿设门指南,因此每个试验需设
阴性及阳性对照组进行荧光补偿及设门。
6.组织需先制备单细胞悬液或提取纯化线粒体后方可进行检测,可选用凯基细胞悬液制备试剂
盒(KGA829)或线粒体提取试剂盒(KGA827)。
操作方法
1.用适当的方法诱导细胞凋亡,同时设立阴性对照组和阳性对照组【用适当的凋亡诱导剂(如
星形孢菌素,staurosporine),诱导适当时间后经其它检测(如AnnexinV或Caspase 3
活性)证实确有凋亡产生】,收集细胞;
2.用PBS洗涤细胞二次(离心2000rpm,5min),收集不多于1×106的细胞;
3.取100μL 10× Incubation Buffer加900μL灭菌去离子水稀释成1× Incubation Buffer,混匀并预热至37℃;
4.吸取500μL 1× Incubation Buffer,加入1μL JC-1,涡旋混匀配成JC-1工作液;
【因JC-1在水中的溶解度很小,所以可以通过离心的方法(10,000rpm,1min)去除不溶的颗粒,吸取离心后的上清使用,以消除干扰】
5.取500μL JC-1工作液将细胞均匀悬浮,37℃,5%CO2的培养箱中孵育15~20min;
6.室温离心(2000rpm,5min)收集细胞,用1× Incubation Buffer洗两次;
7.吸取500μL 1× Incubation Buffer重新悬浮细胞;
8.荧光显微镜观察或流式细胞仪分析。
荧光显微镜观察
1.滴一滴上述细胞悬液于载玻片,盖上盖玻片,于荧光显微镜下观察;
2.对于贴壁细胞来说,也可直接用盖玻片来培养细胞并诱导细胞凋亡;用PBS洗涤细胞两次;
滴加100μL JC-1工作液,加盖玻片,37℃,5%CO2的培养箱中孵育15~20min;1× Incubation Buffe洗涤1~2遍;将盖玻片倒置于载玻片上,于荧光显微镜下观察;
正常细胞:双色滤光片观察则为:绿++ 红++(高绿高红),如在同一滤光片下观察则为黄绿色
凋亡细胞:双色滤光片观察则为:绿++ 红+(高绿低红),如在同一滤光片下观察则为绿色流式细胞仪分析
用流式细胞仪检测(Ex=488 nm; Em=530 nm)细胞凋亡的情况,绿色荧光通过FITC通道通常为FL1来检测;红色荧光通过PI通道通常为FL2来检测。
.正常细胞{FL-1亮,FL-2亮; R1},凋亡细胞{FL-1亮, FL-2暗; R2},设门的位置根椐细胞种类、实验条件等不同而变化,试验需设未经处理的正常细胞为阴性对照组和阳性对照组,根椐阴性和阳性对照组的双参数散点图来设定门的位置。
