欧洲药典8.0版附录2.9.40具体内容
欧洲药典附录中文版

欧洲药典附录中文版第二部分、附录附录1 溶液的澄清度 (3)附录2 溶液颜色检查 (4)附录3 旋光度 (9)附录4 铵盐检查法 (11)附录5 氯化物检查法 (13)附录6 硫酸盐灰分 (14)附录7 铁 (16)附录8 重金属 (18)附录9 干燥失重 (23)附录10 硫酸盐检查法 (24)附录11 红外吸收分光光度法 (26)附录12 pH测定 (31)附录13 滴定 (37)附录14 氯化物鉴别反应 (40)附录15 指示剂颜色与溶液pH 的关系 (41)附录1 溶液的澄清度在内径15~25mm,平底,无色、透明、中性玻璃管中,加入等量的供试溶液与浊度标准液,使液位的深度都为40mm,按如下所述方法进行比较。
浊度标准液制备5分钟后,以色散自然光照射浊度标准溶液和供试溶液,在黑色背景下从垂直方向观察、比较澄清度或浑浊程度。
色散自然光必须较容易区分浊度标准溶液Ⅰ与水,浊度标准溶液Ⅱ与浊度标准溶液Ⅰ。
如果供试溶液的澄清、透明程度与水相同,或者与所用溶剂相同,或者其澄清度不超过Ⅰ号浊度标准溶液,那么可判定该溶液为澄清。
试剂:硫酸肼溶液:取1.0g硫酸肼溶于水,加水稀释至100.0ml,静置4~6小时。
乌洛托品(六亚甲基四胺)溶液:在100ml容量平中,以25.0ml水溶解2.5g乌洛托品。
浊度标准贮备液:在存放乌洛托品溶液的100ml容量瓶中,加25.0ml的硫酸肼溶液。
混合,静置24小时,贮存在无表面要求的玻璃容器中,可在2个月内使用。
该浊度液不得黏附玻璃,用前必须充分摇匀。
浊度标准原液:取浊度标准贮备液15ml,加水稀释、定容至1000ml。
该液临用前制备,至多保存24小时。
浊度标准液:由浊度标准原液与水按表1-1配制,即得。
本液应临用前配制。
表1-1附录2 溶液颜色检查按本药典规定,用下面两种方法之一可以检出溶液在棕色-黄色-红色范围内的颜色。
如果溶液A的外观与水或所用溶剂相同,或者颜色浅于标准比色液B9,则可判定溶液A为无色。
欧洲药典附录

第二部分、附录附录1 溶液的澄清度在内径15~25mm,平底,无色、透明、中性玻璃管中,加入等量的供试溶液与浊度标准液,使液位的深度都为40mm,按如下所述方法进行比较。
浊度标准液制备5分钟后,以色散自然光照射浊度标准溶液和供试溶液,在黑色背景下从垂直方向观察、比较澄清度或浑浊程度。
色散自然光必须较容易区分浊度标准溶液Ⅰ与水,浊度标准溶液Ⅱ与浊度标准溶液Ⅰ。
如果供试溶液的澄清、透明程度与水相同,或者与所用溶剂相同,或者其澄清度不超过Ⅰ号浊度标准溶液,那么可判定该溶液为澄清。
试剂:硫酸肼溶液:取硫酸肼溶于水,加水稀释至,静置4~6小时。
乌洛托品(六亚甲基四胺)溶液?:在100ml容量平中,以水溶解乌洛托品。
浊度标准贮备液:在存放乌洛托品溶液的100ml容量瓶中,加的硫酸肼溶液。
混合,静置24小时,贮存在无表面要求的玻璃容器中,可在2个月内使用。
该浊度液不得黏附玻璃,用前必须充分摇匀。
浊度标准原液:取浊度标准贮备液15ml,加水稀释、定容至1000ml。
该液临用前制备,至多保存24小时。
浊度标准液:由浊度标准原液与水按表1-1配制,即得。
本液应临用前配制。
附录2 溶液颜色检查按本药典规定,用下面两种方法之一可以检出溶液在棕色-黄色-红色范围内的颜色。
如果溶液A的外观与水或所用溶剂相同,或者颜色浅于标准比色液B9,则可判定溶液A为无色。
方法I用外径为12mm的无色、透明中性玻璃管取2ml的供试溶液,与相同玻璃管中的2ml 的水,或2ml本文所规定的标准比色液(见标准比色液表)进行比较。
在散射自然光,白色的背景下,水平观察比较颜色。
方法Ⅱ用同样平底、内径为15~25mm的无色透明中性玻璃管,液位的深度为40mm,将供试溶液与水或溶剂或本文中规定的标准比色液(见标准比色液表)对比。
在散射自然光,白色的背景下,垂直地观察比较颜色。
贮备液黄色液称取46克氯化铁,加大约900ml盐酸溶液(25ml浓盐酸和975ml水混和)溶解,继续添加,并定容。
欧洲药典——精选推荐

欧洲药典◇欧洲药典8为欧洲药典最新版本;◇ 2013年7⽉出版;◇ 2014年1⽉⽣效。
欧洲药典第8版包括两个基本卷,于2013年7⽉出版发⾏,以后在每次欧洲药典委员会全会做出决定后,通过⾮累积增补本更新,每年出3个增补本。
第8版累计共有8个⾮累积增补本(8.1~8.8)。
各增补版的出版⽇期及执⾏的⽇期。
最初的两卷包括第7版完整的内容,以及欧洲药典委员会在2012年12⽉全会上通过或修订的内容,共收载了2224个个论,345个含插图或⾊谱图的总论,以及2500种试剂的说明。
变化的内容(插⼊或删除的内容)在页边标注出⾃2014年1⽉起,在欧洲药典成员国,包括欧盟国家,将执⾏第8版并取代第7版。
第7版⾄12⽉31⽇都是有效的。
欧洲药典有英⽂版与法⽂版,英语与法语是欧洲委员会的官⽅语⾔。
欧洲药典有印刷版、USB闪存版和在线版。
其西班⽛⽂版正在翻译之中,将来包括在在线版中,不再另收取费⽤。
欧洲药典:⼀部药品与药⽤物质的标准欧洲药典是欧洲药品质量控制的标准。
已有多项法律⽂件使欧洲药典成为法定标准:2009年经36个欧洲国家和欧盟批准的编撰欧洲药典协议;关于⼈⽤或兽⽤药品的欧盟指令2001/82/EC、2001/83/EC(修正案)和2003/63/EC,维持了欧洲药典对在欧洲上市药品的强制执⾏性。
这些标准规定了药品、⽣产⽤原材料与合成⽤中间体成份的定性、定量和所⽤的检验项⽬。
所有药品、药⽤物质⽣产企业在欧洲销售或使⽤其产品时,都必须遵循欧洲药典标准。
欧洲药典的内容具有法律约束⼒,由⾏政管理或司法部门强制要求符合欧洲药典。
成员国的国家当局必须采⽤欧洲药典,必要时可替代相同物质国家标准中的个论。
欧洲药典的内容包括活性物质、辅料、化学、动物、⼈或植物来源的药⽤物质或制品、顺势疗法制剂和顺势疗法原料、抗⽣素,以及制剂和容器等。
欧洲药典还适⽤于⽣物制品、⾎液和⾎浆制品、疫苗和放射药品。
欧洲药典8 EP8相关内容Index 8.0 EP8.0索引Index 8.3 EP8.3索引Index 8.5 EP8.5索引Index 8.6 EP8.6索引欧洲药典8.6内容变更NEW TEXTSThe texts below appear for the first time in the European Pharmacopoeia. They will be implemented on 1 January 2016 at the latest.MONOGRAPHSRadiopharmaceutical preparations and starting materials for radiopharmaceutical preparations Copper tetramibi tetrafluoroborate for radiopharmaceuticalpreparations (2547)Herbal drugs and herbal drug preparationsAnemarrhena asphodeloides rhizome (2661)Hamamelis bark (2532)Indigo plant leaf (2727)Homoeopathic preparationsBelladonna for homoeopathic preparations (2489)Petroleum rectificatum for homoeopathic preparations (2683)Staphysagria for homoeopathic preparations (2289)MonographsExemestane (2766)Nicorandil (2332)Pirfenidone (2856)Sodium selenite (2740)Solifenacin succinate (2779)Somatropin solution for injection (2370)REVISED TEXTSThe texts below have been technically revised since their last publication. They will be implemented on 1 January 2016.GENERAL CHAPTERS2.2.4. Approximate pH of solutions2.2.19. Amperometric titration2.2.20. Potentiometric titration2.2.34. Thermal analysis2.2.36. Potentiometric determination of ionic concentration using ion-selective electrodes 2.4.29. Composition of fatty acids in oils rich in omega-3 acids2.5.5. Peroxide value2.5.32. Water: micro determination2.9.3. Dissolution test for solid dosage forms2.9.40. Uniformity of dosage units4. Reagents (new, revised, corrected)5.2.4. Cell cultures for the production of veterinary vaccines5.8. Pharmacopoeial harmonisation5.22. Names of herbal drugs used in traditional Chinese medicineMONOGRAPHSVaccines for veterinary use Brucellosis vaccine (live) (Brucella melitensis Rev. 1 strain) for veterinary use (0793)Radiopharmaceutical preparations and starting materialsfor radiopharmaceutical preparationsPentetate sodium calcium for radiopharmaceuticalpreparations (2353)Technetium (99mTc) medronate injection (0641)Herbal drugs and herbal drug preparationsBenzoin, Siam (2158)Bilberry fruit, dried (1588)Bilberry fruit, fresh (1602)Centella (1498)Fresh bilberry fruit dry extract, refined and standardised (2394)Ginseng (1523)Java tea (1229)Homoeopathic preparationsMethods of preparation of homoeopathic stocks and potentisation (2371)MonographsAluminium phosphate, hydrated (1598)Amidotrizoic acid dihydrate (0873)Amiloride hydrochloride dihydrate (0651)Amlodipine besilate (1491)Anticoagulant and preservative solutions for human blood (0209)Aprotinin (0580)Aprotinin concentrated solution (0579)Bromhexine hydrochloride (0706)Buserelin (1077)Carbomers (1299)Carnauba wax (0597)Chymotrypsin (0476)Crospovidone (0892)Demeclocycline hydrochloride (0176)Dihydralazine sulfate, hydrated (1310)Diphenhydramine hydrochloride (0023)Dithranol (1007)Doxapram hydrochloride (1201)Filgrastim concentrated solution (2206)Fluticasone propionate (1750)Fructose (0188)Fulvestrant (2443)Galactose (1215)Glimepiride (2223)Glucose, anhydrous (0177)Glucose monohydrate (0178)Hexylresorcinol (1437)Human coagulation factor IX (rDNA) concentrated solution (2522) Hypromellose (0348)Iopanoic acid (0700)Ioxaglic acid (2009)Isoleucine (0770)Lactose, anhydrous (1061)Lactose monohydrate (0187)Leucine (0771)Lysine hydrochloride (0930)Methionine (1027)Methylcellulose (0345)Methylprednisolone acetate (0933)Methylprednisolone hydrogen succinate (1131) Methylthioninium chloride (1132)Naftidrofuryl hydrogen oxalate (1594)Nicotinamide (0047)Orphenadrine citrate (1759)Orphenadrine hydrochloride (1760)Oxeladin hydrogen citrate (1761)Oxolinic acid (1353)Pancreas powder (0350)Phenazone (0421)Phentolamine mesilate (1138)Polysorbate 80 (0428)Potassium hydroxide (0840)Povidone, iodinated (1142)Propylene glycol dicaprylocaprate (2122)Quinidine sulfate (0017)Quinine hydrochloride (0018)Quinine sulfate (0019)Risedronate sodium 2.5-hydrate (2572)Rivastigmine hydrogen tartrate (2630)Sodium amidotrizoate (1150)Sodium hydroxide (0677)Sodium nitroprusside (0565)Sodium selenite pentahydrate (1677)Spirapril hydrochloride monohydrate (1766)Sucrose (0204)Sugar spheres (1570)Sulfacetamide sodium (0107)Theophylline-ethylenediamine hydrate (0301)Thiamine hydrochloride (0303)Thiamine nitrate (0531)Thiamphenicol (0109)Tribenoside (1740)Trypsin (0694)CORRECTED TEXTSThe texts below have been corrected and are republished in their entirety. These corrections are to be taken into account from the publication date of Supplement 8.6 (1 July 2015), unless otherwise indicated.GENERAL CHAPTERS2.4.22. Composition of fatty acids by gas chromatography2.5.1. Acid value2.7.14. Assay of hepatitis A vaccine2.8.13. Pesticide residues5.7. Table of physical characteristics of radionuclides mentioned in the European PharmacopoieaMONOGRAPHSRadiopharmaceutical preparations and starting materials for radiopharmaceutical preparations Gallium (68Ga) edotreotide injection (2482)MonographsCimetidine (0756)Cimetidine hydrochloride (1500)Flucytosine (0766)Goserelin (1636)Human antithrombin III concentrate (0878)(1)Insulin, bovine (1637)Insulin, human (0838)Insulin, porcine (1638)Insulin preparations, injectable (0854)Isomalt (1531)Miconazole nitrate (0513)Nitric acid (1549)Oxaliplatin (2017)Polyoxypropylene stearyl ether (2602)HARMONISED TEXTSThe texts below have undergone pharmacopoeial harmonisation (see chapter 5.8. Pharmacopoeial harmonisation).GENERAL CHAPTERS2.2.34. Thermal analysis2.9.3. Dissolution test for solid dosage forms2.9.40. Uniformity of dosage unitsMONOGRAPHSMonographsCrospovidone (0892)Glucose, anhydrous (0177)Glucose monohydrate (0178)Hypromellose (0348)Methylcellulose (0345)Polysorbate 80 (0428)TEXTS WHOSE TITLE HAS CHANGEDThe titles of the following texts have been changed in Supplement 8.6.GENERAL CHAPTERS2.2.4. Approximate pH of solutions (previously Relationship between reaction of solution, approximate pH and colour of certain indicators)MONOGRAPHSMonographsAmiloride hydrochloride dihydrate (0651) (previously Amiloride hydrochloride)DELETED TEXTSThe following texts are deleted as of 1 January 2016.MONOGRAPHSImmunosera for veterinary useClostridium novyi alpha antitoxin for veterinary use (0339)Clostridium perfringens beta antitoxin for veterinary use (0340)Clostridium perfringens epsilon antitoxin for veterinary use (0341)The following text is deleted as of 1 April 2015.MONOGRAPHSMonographsLiquorice ethanolic liquid extract, standardised (1536)下载PDF格式订购欧洲药典版本货期⽣效⽇期价格欧洲药典8[2卷]及增补1、2 [印刷/英⽂]现货2014年1⽉¥4950.00欧洲药典8 增补3、增补4、增补5 [印刷/英⽂]现货2014年4⽉¥4950.00欧洲药典8.3、8.4、8.5 [U盘/英⽂/含8.0-8.2内容]现货2014年4⽉¥4950.00欧洲药典8.6、8.7、8.8 [U盘/英⽂/含8.0-8.5内容]现货2016年1⽉¥4950.00。
欧洲药典8.0-凡例双语版

1 GENERAL NOTICES凡例1.1 GENERAL STATEMENTS概述The General Notices apply to all monographs and other texts of the European Pharmacopoeia.凡例的内容适用于各论和欧洲药典中的其它章节。
The official texts of the European Pharmacopoeia are published in English and French. Translations in other languages may be prepared by the signatoryStates of the European Pharmacopoeia Convention. In case of doubt or dispute, the English and French versions are alone authoritative.欧洲药典以英语和法语形式发行,欧洲药典委员会的签署国可将药典内容译成其它语言,但若发生争议,应以英语和法语版为权威。
In the texts of the European Pharmacopoeia, the word ‘Pharmacopoeia’ without qualification means the European Pharmacopoeia. The official abbreviation Ph.Eur. may be used to indicate the European Pharmacopoeia.在欧洲药典中,如无特殊规定,“药典”是指欧洲药典,官方缩写 Ph. Eur.也指欧洲药典。
The use of the title or the subtitle of a monograph implies that the articlecomplies with the requirements of the relevant monograph. Such references to monographs in the texts of the Pharmacopoeia are shown using themonograph title and reference number in italics.文章中如果引用了各论中的标题和副标题意味着文章内容符合相关各论的要求。
欧洲药典8.0-凡例双语版

1 GENERAL NOTICES凡例1.1 GENERAL STATEMENTS概述The General Notices apply to all monographs and other texts of the European Pharmacopoeia.凡例的内容适用于各论和欧洲药典中的其它章节。
The official texts of the European Pharmacopoeia are published in English and French. Translations in other languages may be prepared by the signatoryStates of the European Pharmacopoeia Convention. In case of doubt or dispute, the English and French versions are alone authoritative.欧洲药典以英语和法语形式发行,欧洲药典委员会的签署国可将药典内容译成其它语言,但若发生争议,应以英语和法语版为权威。
In the texts of the European Pharmacopoeia, the word ‘Pharmacopoeia’ without qualification means the European Pharmacopoeia. The official abbreviation Ph.Eur. may be used to indicate the European Pharmacopoeia.在欧洲药典中,如无特殊规定,“药典”是指欧洲药典,官方缩写 Ph. Eur.也指欧洲药典。
The use of the title or the subtitle of a monograph implies that the articlecomplies with the requirements of the relevant monograph. Such references to monographs in the texts of the Pharmacopoeia are shown using themonograph title and reference number in italics.文章中如果引用了各论中的标题和副标题意味着文章内容符合相关各论的要求。
国外药典介绍概要

修订公告
和在线版)中发布的标准。 在 USP 网站上发布的修订公告指示 其正式日期和纳入正式出版物中的日期。 IRA 在 PF 中发布,征求公众意见期为 90 天。 在意见(如果有) 通过审查并且 IRA 得到相关专家委员会的批准后,最终 IRA 将发 布在 USP 网站上。 与修订公告一样,IRA 可取代在印刷版和在线 版的 USP–NF 及其增补中发布的标准。 IRA 被纳入下一个可用的 USP–NF 或增补中。 是指在 USP–NF 或其增补中发布的文字有误,不能准确地反映专
查看
在通则、附录及各论中,凡是和欧洲药典完全一致的, 均加入 标志,并在名称项下用斜体字标示出了
欧洲药典中的索引页码。
2018/10/14
欧洲药典简介
欧洲药典简介
《欧洲药典》由欧洲药品质量委员会(EDQM)编辑出版,有英文和法 文两种法定文本。其全称为European Pharmacopoeia,缩写为Ph.Eur.。
英国药典2014版新增内容
相对于英国药典2013版,最新版英国药典共有如下更新:
新增兽药版索引
英国药典专论 (BP. Monograph) 新增 40
英国药典专论 (BP. Monograph) 修订 272
/
2018/10/14 10
英国药典各册内容介绍
国外药典简介
专业:分析化学 姓名:刘良琴 同组人:蒋正萌 喻子恒
CONTENTS
美国药典简介及内容介绍 英国药典简介及内容介绍 欧洲药典简介及内容介绍 日本药典简介及内容介绍 国际药典简介及内容介绍
2018/10/14
美国药典简介
美国药典简介
(U.S. Pharmacopeia / National Formulary)(USP-NF):美国药典-国家处方集, 美国药典是美国政府对药品质量标准和检定方法作出的技术规定,也是药品生产、 使用、管理、检验的法律依据。NF收载了美国药典(USP)尚未收入的新药和 新制剂。 美国药典是唯一由美国食品药品监督管理局 (FDA) 强制执行的法定标准。此外, 对于制药和质量控制所必需的规范,例如测试、程序和合格标准,USP-NF 还可 以作为明确的逐步操作指导。USP 标准在全球 130 多个国家得到认可和使用。
欧洲药典80纯化水微生物检测译
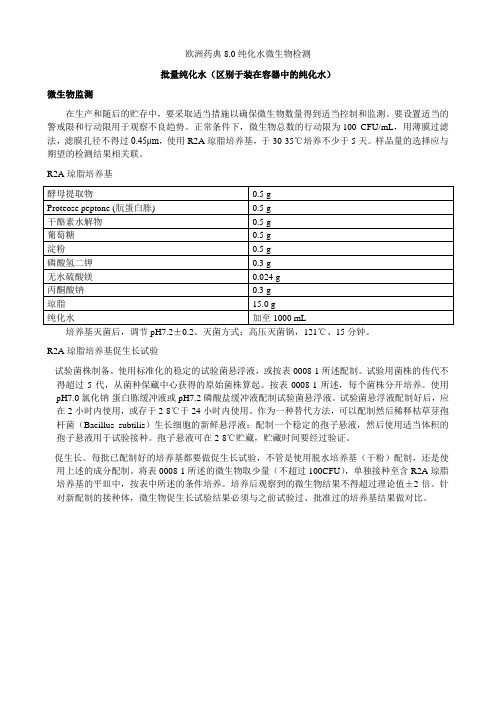
欧洲药典8.0纯化水微生物检测批量纯化水(区别于装在容器中的纯化水)微生物监测在生产和随后的贮存中,要采取适当措施以确保微生物数量得到适当控制和监测。
要设置适当的警戒限和行动限用于观察不良趋势。
正常条件下,微生物总数的行动限为100 CFU/mL,用薄膜过滤法,滤膜孔径不得过0.45μm,使用R2A琼脂培养基,于30-35℃培养不少于5天。
样品量的选择应与期望的检测结果相关联。
R2A琼脂培养基培养基灭菌后,调节pH7.2±0.2。
灭菌方式:高压灭菌锅,121℃、15分钟。
R2A琼脂培养基促生长试验- 试验菌株制备。
使用标准化的稳定的试验菌悬浮液,或按表0008-1所述配制。
试验用菌株的传代不得超过5代,从菌种保藏中心获得的原始菌株算起。
按表0008-1所述,每个菌株分开培养。
使用pH7.0氯化钠-蛋白胨缓冲液或pH7.2磷酸盐缓冲液配制试验菌悬浮液。
试验菌悬浮液配制好后,应在2小时内使用,或存于2-8℃于24小时内使用。
作为一种替代方法,可以配制然后稀释枯草芽孢杆菌(Bacillus subtilis)生长细胞的新鲜悬浮液:配制一个稳定的孢子悬液,然后使用适当体积的孢子悬液用于试验接种。
孢子悬液可在2-8℃贮藏,贮藏时间要经过验证。
- 促生长。
每批已配制好的培养基都要做促生长试验,不管是使用脱水培养基(干粉)配制,还是使用上述的成分配制。
将表0008-1所述的微生物取少量(不超过100CFU),单独接种至含R2A琼脂培养基的平皿中,按表中所述的条件培养。
培养后观察到的微生物结果不得超过理论值±2倍。
针对新配制的接种体,微生物促生长试验结果必须与之前试验过、批准过的培养基结果做对比。
表0008-1R2A琼脂促生长试验微生物试验菌株制备促生长条件。
欧洲药典8.0-凡例双语版

1 GENERAL NOTICES凡例1.1 GENERAL STATEMENTS概述The General Notices apply to all monographs and other texts of the EuropeanPharmacopoeia.凡例的内容适用于各论和欧洲药典中的其它章节。
The official texts of the European Pharmacopoeia are published in English andFrench. Translations in other languages may be prepared by the signatoryStates of the European Pharmacopoeia Convention. In case of doubt or dispute,the English and French versions are alone authoritative.欧洲药典以英语和法语形式发行,欧洲药典委员会的签署国可将药典内容译成其它语言,但若发生争议,应以英语和法语版为权威。
In the texts of the European Pharmacopoeia, the word ‘Pharmacopoeia’ without qualification means the European Pharmacopoeia. The official abbreviation Ph.Eur. may be used to indicate the European Pharmacopoeia.在欧洲药典中,如无特殊规定,“药典”是指欧洲药典,官方缩写 Ph. Eur.也指欧洲药典。
The use of the title or the subtitle of a monograph implies that the articlecomplies with the requirements of the relevant monograph. Such references tomonographs in the texts of the Pharmacopoeia are shown using themonograph title and reference number in italics.文章中如果引用了各论中的标题和副标题意味着文章内容符合相关各论的要求。
欧洲药典在线查询全文
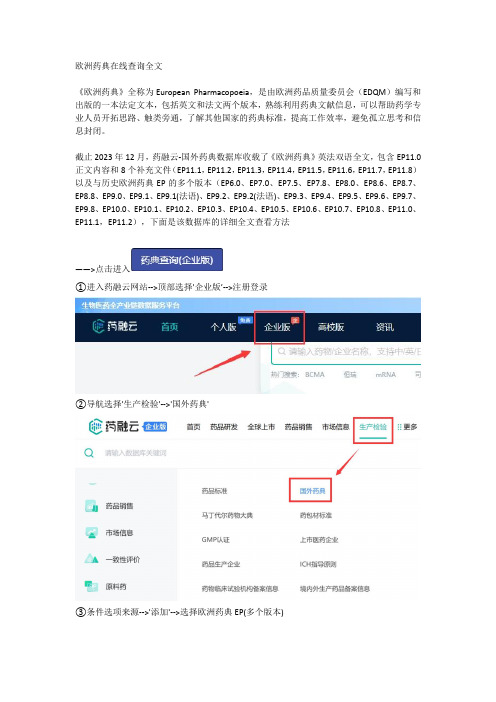
欧洲药典在线查询全文《欧洲药典》全称为European Pharmacopoeia,是由欧洲药品质量委员会(EDQM)编写和出版的一本法定文本,包括英文和法文两个版本,熟练利用药典文献信息,可以帮助药学专业人员开拓思路、触类旁通,了解其他国家的药典标准,提高工作效率,避免孤立思考和信息封闭。
截止2023年12月,药融云-国外药典数据库收载了《欧洲药典》英法双语全文,包含EP11.0正文内容和8个补充文件(EP11.1,EP11.2,EP11.3,EP11.4,EP11.5,EP11.6,EP11.7,EP11.8)以及与历史欧洲药典EP的多个版本(EP6.0、EP7.0、EP7.5、EP7.8、EP8.0、EP8.6、EP8.7、EP8.8、EP9.0、EP9.1、EP9.1(法语)、EP9.2、EP9.2(法语)、EP9.3、EP9.4、EP9.5、EP9.6、EP9.7、EP9.8、EP10.0、EP10.1、EP10.2、EP10.3、EP10.4、EP10.5、EP10.6、EP10.7、EP10.8、EP11.0、EP11.1,EP11.2),下面是该数据库的详细全文查看方法——>点击进入①进入药融云网站-->顶部选择'企业版’-->注册登录②导航选择'生产检验'-->'国外药典'③条件选项来源-->'添加'-->选择欧洲药典EP(多个版本)-----最后说下关于欧洲药典新版本EP11---《欧洲药典》EP11.0于2023年1月1日开始实施,是欧洲药品行业的权威参考书,EP11.0版本对之前版本的内容进行了全面更新和重新组织,新增和修改了600多个单体和试剂。
因此欧洲药典2024版将涵盖超过4000个全新的认证试剂,并提供7000多个化学物质的简要概述。
EP11.0版本的欧洲药典引入了一些重要的改进。
欧洲药典附录 1-9

第二部分、附录附录1 溶液的澄清度 (1)附录2 溶液颜色检查 (2)附录3 旋光度 (5)附录4 铵盐检查法 (7)附录5 氯化物检查法 (8)附录6 硫酸盐灰分 (9)附录7 铁 (10)附录8 重金属 (11)附录9 干燥失重 (14)附录1 溶液的澄清度在内径15~25mm,平底,无色、透明、中性玻璃管中,加入等量的供试溶液与浊度标准液,使液位的深度都为40mm,按如下所述方法进行比较。
浊度标准液制备5分钟后,以色散自然光照射浊度标准溶液和供试溶液,在黑色背景下从垂直方向观察、比较澄清度或浑浊程度。
色散自然光必须较容易区分浊度标准溶液Ⅰ与水,浊度标准溶液Ⅱ与浊度标准溶液Ⅰ。
如果供试溶液的澄清、透明程度与水相同,或者与所用溶剂相同,或者其澄清度不超过Ⅰ号浊度标准溶液,那么可判定该溶液为澄清。
试剂:硫酸肼溶液:取1.0g硫酸肼溶于水,加水稀释至100.0ml,静置4~6小时。
乌洛托品(六亚甲基四胺)溶液:在100ml容量平中,以25.0ml水溶解2.5g乌洛托品。
浊度标准贮备液:在存放乌洛托品溶液的100ml容量瓶中,加25.0ml的硫酸肼溶液。
混合,静置24小时,贮存在无表面要求的玻璃容器中,可在2个月内使用。
该浊度液不得黏附玻璃,用前必须充分摇匀。
浊度标准原液:取浊度标准贮备液15ml,加水稀释、定容至1000ml。
该液临用前制备,至多保存24小时。
浊度标准液:由浊度标准原液与水按表1-1配制,即得。
本液应临用前配制。
表1-1ⅠⅡⅢⅣ浊度标准液 5.0ml 10.0ml 30.0ml 50.0ml水95.0ml 90.0ml 70.0ml 50.0ml附录2 溶液颜色检查按本药典规定,用下面两种方法之一可以检出溶液在棕色-黄色-红色范围内的颜色。
,则可如果溶液A的外观与水或所用溶剂相同,或者颜色浅于标准比色液B9判定溶液A为无色。
方法I用外径为12mm的无色、透明中性玻璃管取2ml的供试溶液,与相同玻璃管中的2ml的水,或2ml本文所规定的标准比色液(见标准比色液表)进行比较。
欧洲药典EP8.0硫酸灰

欧洲药典EP8.0硫酸灰2.4.14. SULFATED ASH 硫酸灰分Ignite a suitable crucible (for example, silica, platinum, porcelain or quartz) at 600+/-50℃ for 30 min, allow to cool in a desiccator over silica gel or other suitable desiccant and weigh. Place the prescribed amount of the substance to be examined in the crucible and weigh. Moisten the substance to be examined with a small amount of sulfuric acid R (usually 1 mL) and heat gently at as low a temperature as practicable until the sample is thoroughly charred. After cooling, moisten the residue with a small amount of sulfuric acid R (usually 1 mL), heat gently until white fumes are no longer evolved and ignite at 600+/-50℃ until the residue is completely incinerated. Ensure that flames are not produced at any time during the procedure. Allow the crucible to cool in a desiccator over silica gel or other suitable desiccant, weigh it again and calculate the percentage of residue.将合适的坩埚(例如硅、铂、瓷或石英)在600+/-50℃灼烧30分钟,在有硅胶或其它合适的干燥剂的干燥器内冷却,称重。
新产品的转移

新产品转移(如,对乙酰氨基酚片1000mg)1.熟悉商业协议和技术协议产品规格和标准价格:单价、币种、出口方式(CIF、FOB)结算方式:支付时间,支付方式,汇率标准。
供货要求:时间,地点,运输条件。
赔付条款:违约及合同终止;保密条款。
技术协议:GMP方面职责的综述、起始物料和包材、生产、包装、质量控制和检测记录、存储和运输、文件、附录(产品信息、行政信息等)2.技术资料传递下发和更新的程序和方式:以打印稿的形式分发给相关部门。
自己保留一份,并登记记录。
涉及部门:质保部,化验室,制剂室,202车间。
3.小试中试安排物料来源:康乐,河北冀衡。
小试:100片—1000片小试放大:1000片—1万片小试主要检查项目:含量、有关物质、溶出度、崩解时限等中试:1万片以上,检测项目包括成品所有的检测项目。
4.生产设备确认需确认的信息设备的名称、型号、容量、效率。
5.模具流转适用的包装设备:设备科板块尺寸,材质:车间和QA片模:设备科、制剂室、车间和QA6.包材流转(小盒,说明书,铝箔,瓶签,箱签,大箱)铝箔:厚度、印字的排版。
小盒:材质、尺寸。
说明书:材质、尺寸。
大箱:尺寸、材质。
瓶签、箱签:不干胶粘贴7.验证文件起草,流转(文件类型,客户审批情况)•对乙酰氨基酚质量标准和SOP•对乙酰氨基酚片质量标准和SOP•对乙酰氨基酚片验证文件•对乙酰氨基酚片批生产记录•对乙酰氨基酚片批包装记录•对乙酰氨基酚片稳定性方案•对乙酰氨基酚片模拟使用考察方案8.供应商审计情况根据技术协议要求了解原料,辅料和包材供应商审计情况EDQM网站:可以查到CEP。
MA:规定了审计内容。
9.验证前信息确认时间、物资、模具、设备、文件、场地、人员、培训10.需了解的技术信息配方本品含对乙酰氨基酚应为标示量的95.0~105.0%。
该产品有效期:36个月。
质量标准1000mg对乙酰氨基酚片的质量标准Specification of Paracetamol Tablets(1000mg)#Total impurities=Total known impurities+ Total of other impurities 总杂质=总已知杂质+总其他杂质1000mg对乙酰氨基酚片中间体的质量标准Specification of Intermediate of Paracetamol Tablets(1000mg)1000mg对乙酰氨基酚片半成品的质量标准Specification of IPC-finished Product of Paracetamol Tablets(1000mg)稳定性考察方案职责:Responsibility研究一所:负责方案的起草和审核。
欧洲药典附录

第二部分、附录附录1 溶液的澄清度在内径15~25mm,平底,无色、透明、中性玻璃管中,加入等量的供试溶液与浊度标准液,使液位的深度都为40mm,按如下所述方法进行比较。
浊度标准液制备5分钟后,以色散自然光照射浊度标准溶液和供试溶液,在黑色背景下从垂直方向观察、比较澄清度或浑浊程度。
色散自然光必须较容易区分浊度标准溶液Ⅰ与水,浊度标准溶液Ⅱ与浊度标准溶液Ⅰ。
如果供试溶液的澄清、透明程度与水相同,或者与所用溶剂相同,或者其澄清度不超过Ⅰ号浊度标准溶液,那么可判定该溶液为澄清。
试剂:硫酸肼溶液:取硫酸肼溶于水,加水稀释至,静置4~6小时。
乌洛托品(六亚甲基四胺)溶液?:在100ml容量平中,以水溶解乌洛托品。
浊度标准贮备液:在存放乌洛托品溶液的100ml容量瓶中,加的硫酸肼溶液。
混合,静置24小时,贮存在无表面要求的玻璃容器中,可在2个月内使用。
该浊度液不得黏附玻璃,用前必须充分摇匀。
浊度标准原液:取浊度标准贮备液15ml,加水稀释、定容至1000ml。
该液临用前制备,至多保存24小时。
浊度标准液:由浊度标准原液与水按表1-1配制,即得。
本液应临用前配制。
表1-1ⅠⅡⅢⅣ浊度标准液水附录2 溶液颜色检查按本药典规定,用下面两种方法之一可以检出溶液在棕色-黄色-红色范围内的颜色。
如果溶液A的外观与水或所用溶剂相同,或者颜色浅于标准比色液B,则可9判定溶液A为无色。
方法I用外径为12mm的无色、透明中性玻璃管取2ml的供试溶液,与相同玻璃管中的2ml的水,或2ml本文所规定的标准比色液(见标准比色液表)进行比较。
在散射自然光,白色的背景下,水平观察比较颜色。
方法Ⅱ用同样平底、内径为15~25mm的无色透明中性玻璃管,液位的深度为40mm,将供试溶液与水或溶剂或本文中规定的标准比色液(见标准比色液表)对比。
在散射自然光,白色的背景下,垂直地观察比较颜色。
贮备液黄色液称取46克氯化铁,加大约900ml盐酸溶液(25ml浓盐酸和975ml 水混和)溶解,继续添加,并定容。
欧洲药典8.0~凡例双语版

1 GENERAL NOTICES凡例1.1 GENERAL STATEMENTS概述The General Notices apply to all monographs and other texts of the European Pharmacopoeia.凡例的内容适用于各论和欧洲药典中的其它章节。
The official texts of the European Pharmacopoeia are published in English and French. Translations in other languages may be prepared by the signatoryStates of the European Pharmacopoeia Convention. In case of doubt or dispute, the English and French versions are alone authoritative.欧洲药典以英语和法语形式发行,欧洲药典委员会的签署国可将药典内容译成其它语言,但若发生争议,应以英语和法语版为权威。
In the texts of the European Pharmacopoeia, the word ‘Pharmacopoeia’ without qualification means the European Pharmacopoeia. The official abbreviation Ph.Eur. may be used to indicate the European Pharmacopoeia.在欧洲药典中,如无特殊规定,“药典”是指欧洲药典,官方缩写 Ph. Eur.也指欧洲药典。
The use of the title or the subtitle of a monograph implies that the articlecomplies with the requirements of the relevant monograph. Such references to monographs in the texts of the Pharmacopoeia are shown using themonograph title and reference number in italics.文章中如果引用了各论中的标题和副标题意味着文章内容符合相关各论的要求。
EP7.0 欧洲药典 2.9.38. Particle-size distribution 粒度分布_中文_翻译

2.9.38. 筛分法评估颗粒度大小分布(17)PARTICLE-SIZE DISTRIBUTION ESTIMATION BY ANALYTICAL SIEVING(17)筛分是对粉末和颗粒通过颗粒大小分布进行分级的最老的方法之一。
当使用织物筛布时,筛分基本上依据筛网的中间尺寸大小(即幅度或宽度)对颗粒进行分类。
如果大部分的颗粒大于75微米左右,采用机筛法是最合适的。
对于更小的颗粒,由于质量轻,在筛分过程中,它们不能克服表面凝聚力和粘附力,使颗粒相互粘在一起或粘在筛网上,从而导致那些本该能通过筛孔的颗粒而未能通过。
对于这样的材料,其它的振动方式,如喷气筛分或声波筛分器筛分可能更为合适。
然而,筛分有时可被用于一些中值颗粒尺寸小于75微米的粉末或颗粒,只要该方法经过验证。
在制药行业,对单一粉末或颗粒进行粗略等级分类时,筛分通常是被选择的方法。
这是一个尤其引人注目的方法,因为该方法仅依据粒径大小对粉末和颗粒进行颗粒大小分级,在大多数情况下,干粉状态下即可进行检测。
Sieving is one of the oldest methods of classifying powders and granules by particle-size distribution. When using a woven sieve cloth, the sieving will essentially sort the particles by their intermediate size dimension (i.e. breadth or width). Mechanical sieving is most suitable where the majority of the particles are larger than about 75 µm. For smaller particles, their light weight provides insufficient force during sieving to overcome the surface forces of cohesion and adhesion that cause the particles to stick to each other and to the sieve, and thus cause particles that would be expected to pass through the sieve to be retained. For such materials other means of agitation such as air-jet sieving or sonic-sifter sieving may be more appropriate. Nevertheless, sieving can sometimes be used for some powders or granules having median particle sizes smaller than 75 µm where the method can be validated. In pharmaceutical terms, sieving is usually the method of choice for classification of the coarser grades of single powders or granules. It is a particularly attractive method in that powders and granules are classified only on the basis of particle size, and in most cases the analysis can be carried out in the dry state.筛分方法的局限性包括:需要可观质量的样品(通常至少为25克,这取决于粉末或颗粒的密度和试验筛的直径);以及在筛分那些容易堵塞筛孔的油性或有粘着力的粉末或颗粒时存在困难。
欧洲药典附录译文

第二部分、附录附录1 溶液的澄清度 (2)附录2 溶液颜色检查 (3)附录3 旋光度 (7)附录4 铵盐检查法 (9)附录5 氯化物检查法 (11)附录6 硫酸盐灰分 (13)附录7 铁 (14)附录8 重金属 (16)附录9 干燥失重 (21)附录10 硫酸盐检查法 (23)附录11 红外吸收分光光度法 (25)附录12 pH测定 (29)附录13 滴定 (34)附录14 氯化物鉴别反应 (37)附录15 指示剂颜色与溶液pH 的关系 (38)附录1 溶液的澄清度在内径15~25mm,平底,无色、透明、中性玻璃管中,加入等量的供试溶液与浊度标准液,使液位的深度都为40mm,按如下所述方法进行比较。
浊度标准液制备5分钟后,以色散自然光照射浊度标准溶液和供试溶液,在黑色背景下从垂直方向观察、比较澄清度或浑浊程度。
色散自然光必须较容易区分浊度标准溶液Ⅰ与水,浊度标准溶液Ⅱ与浊度标准溶液Ⅰ。
如果供试溶液的澄清、透明程度与水相同,或者与所用溶剂相同,或者其澄清度不超过Ⅰ号浊度标准溶液,那么可判定该溶液为澄清。
试剂:硫酸肼溶液:取1.0g硫酸肼溶于水,加水稀释至100.0ml,静置4~6小时。
乌洛托品(六亚甲基四胺)溶液:在100ml容量平中,以25.0ml水溶解2.5g乌洛托品。
浊度标准贮备液:在存放乌洛托品溶液的100ml容量瓶中,加25.0ml的硫酸肼溶液。
混合,静置24小时,贮存在无表面要求的玻璃容器中,可在2个月内使用。
该浊度液不得黏附玻璃,用前必须充分摇匀。
浊度标准原液:取浊度标准贮备液15ml,加水稀释、定容至1000ml。
该液临用前制备,至多保存24小时。
浊度标准液:由浊度标准原液与水按表1-1配制,即得。
本液应临用前配制。
表1-1附录2 溶液颜色检查按本药典规定,用下面两种方法之一可以检出溶液在棕色-黄色-红色范围内的颜色。
如果溶液A的外观与水或所用溶剂相同,或者颜色浅于标准比色液B9,则可判定溶液A为无色。
欧洲药典附录

3.1.3.聚烯轻定义聚烯轻是通过乙烯或丙烯的聚合而成,或是通过这些不超过25%勺高同系物的物质或毯酸或酯的共聚作用获得。
某些材料可能是聚烯轻的混合物。
成品添加一定数量的添加剂到聚合物中是为了优化它们的化学性质,物理性质和机械性能,为了使它们适用于预定用途。
所有的这些添加剂都是选自附件列表,并指出了每一种产品中的最大允许含量。
产品中最多包含有三种抗氧化剂,一种或几种润滑剂或抗粘连剂以及当材料必须提供光照保护时,还要添加二氧化钛作为遮光剂。
-二叔丁基对甲酚(增塑剂07):限量:0.125%-四钛季戊四醇松香酸酯[3-(3,5-二叔丁基-4-羟苯基)丙酸酯](增塑剂09):限量:0.3%-1,3,5-三羟甲基氨基甲烷(3,5-二叔丁基-4-邻羟节基)-三嗪-2,4,6(1H,3H,5H)-三酮,(增塑剂13):限量:0.3%- 二乙烯[3,3-二[3-(1,1-dimethylethyl)-4- 羟苯基]丁酸甲酯](增塑剂08):限量:0.3% -二(十八烷基)二硫化物(增塑剂15)限量:0.3%4,4 ,4 〃 -(2,4,6- 三甲基苯-1,3,5-triyltrismethylene)-三羟甲基氨基甲烷[2,6-二(1,1-dimethylethyl)苯酚](增塑剂10)限量:0.3%2,2 '-二(octadecyloxy)- 5,5 ' -spirobi[1,3,2-dioxaphosphinane](增塑剂14):限量:0.3 %; -didodecyl 3,3 '-硫代二丙酸(增塑剂16):限量:0.3 %;-dioctadecyl3,3 '-硫代二丙酸(增塑剂17): 限量:0.3 %;-三羟甲基氨基甲烷[2,4-二(1,1-dimethylethyl)苯基]业磷酸盐(增塑剂12):限量:0.3 %;-增塑剂18:限量:0.1%;-琥珀酸二甲酯和(4-hydroxy-2,2,6,6-tetramethylpiperidin-1-yl)乙醇的共聚物(增塑剂22): 限量:0.3%上面列出的抗氧化添加剂总含量不超过0.3%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
欧洲药典8.0版附录2.9.40是一项具有重要意义的内容,它包含了关
于卫生产品和医药制剂的质量要求和标准。
在这篇文章中,我们将深
入探讨这一主题,从基础概念到具体内容,帮助你更好地理解欧洲药
典8.0版附录2.9.40。
1. 了解欧洲药典8.0版附录
2.9.40
欧洲药典是欧洲药典委员会制定的标准规范,旨在保障卫生产品和医
药制剂的质量、安全和有效性。
附录2.9.40则是其中的重要内容之一,它详细规定了一系列的质量要求,涵盖了原材料的选择、生产过程的
控制、成品的质量检验等方方面面。
这些要求旨在确保药品的质量稳定、安全性高、有效性强。
2. 欧洲药典8.0版附录2.9.40的具体内容
欧洲药典8.0版附录2.9.40的具体内容主要包括以下几个方面:
- 原材料的要求:包括对原材料的来源、制备、存储和使用的规定,确保原材料的质量稳定和可追溯性。
- 生产过程的控制:包括药品的生产工艺、设备、人员培训等方面的要求,确保生产过程稳定可控、符合GMP要求。
- 药品的质量检验:包括对成品药品的各项质量指标和检测方法的规定,确保药品符合质量标准。
3. 个人观点和理解
欧洲药典8.0版附录2.9.40的具体内容凸显了对药品质量和安全的高
标准要求,这种规范的制定对保障患者用药安全、促进药品质量提升
有着重要的意义。
而且,这种规范也对制药企业的生产经营提出了更
高的要求,能够推动行业向着更加规范、科学的方向发展。
总结回顾
通过本文的阐述,相信你对欧洲药典8.0版附录2.9.40有了更深入的
了解。
这一规范的制定和实施,促进了药品质量的提升、促进了医药
行业的良性发展,对患者和企业来说都具有重要意义。
希望你能在日
常工作和学习中,更加关注和重视这一规范,促进药品质量和安全的
保障。
4. 药品质量和安全的重要性
药品质量和安全对于患者的健康和生命安全具有重要的意义。
优质的
药品能够有效治疗疾病,保障患者的健康。
然而,如果药品质量不达
标或者存在安全隐患,可能会导致患者用药失败或者出现严重的副作用,危及患者的生命安全。
药品质量和安全是医药行业的基础,也是
医药制造企业的社会责任。
通过制定和执行相关规范,如欧洲药典8.0版附录2.9.40,可以有效确保药品质量和安全,保障患者的用药权益。
5. 药品生产企业的责任与义务
制药企业作为生产药品的主体,承担着保障药品质量和安全的重要责任。
企业应严格遵守药典规范,对原材料的选择、生产过程的控制、
成品的质量检验等方方面面进行严格监控,确保产品达标。
除了质量
的控制,企业还应该积极开展质量管理体系,建立健全GMP、ISO等
质量管理体系,推动企业向着更加规范、科学的方向发展。
另外,企业也应当注重质量安全意识培训,加强员工的质量安全意识,确保每个环节都严格按照规范执行,保证产品的质量和安全性。
6. 欧洲药典的影响及启示
欧洲药典作为医药行业的标准规范,对整个行业具有重要影响。
其要求对于欧洲地区的药品生产企业来说,是一种必须遵守的行业规范,也是一种提高自身品质的机会。
而对于其他国家和地区的生产企业来说,欧洲药典的标准也是一个值得学习和借鉴的范本。
欧洲药典对于全球医药行业有着积极的引领作用,促进了医药行业的整体改进和提高。
7. 对患者的意义
欧洲药典8.0版附录2.9.40的实施,对于患者来说也具有积极意义。
质量稳定的药品能够有效治疗疾病,降低患者的痛苦和康复时间;安全的药品能够避免出现药物不良反应或者其他意外情况,保护患者的健康和生命安全;规范的药品制造企业和产品,也能够提供患者对于用药品质的信心,增加患者对治疗效果的信任,提高患者遵医嘱的积极性。
8. 对医药行业的影响
欧洲药典8.0版附录2.9.40的实施,对医药行业的影响是深远的。
规范推动了医药行业的技术和管理水平不断提高,促进了医药行业向着
更加规范、科学、合理的方向发展,推动医药行业的健康发展;规范
也提高了医药制造企业的效益和竞争力,有利于医药企业保持良好的
经济运行状态,为行业的可持续发展提供了保障。
9. 制药企业的应对之策
面对欧洲药典8.0版附录2.9.40的要求,制药企业需要采取积极的应
对之策。
企业应当认真严格遵守药典的规范,对于原材料、生产过程、成品质量等各个环节都要进行严格监控,确保产品符合规范要求;企
业还应该加强质量管理体系建设,推动企业内部的各项管理规范化、
标准化,促进企业质量管理水平的不断提升;另外,企业还要加强员
工的质量安全培训,提高员工的质量意识,确保每个环节的执行标准
规范。
10. 结语
欧洲药典8.0版附录2.9.40的实施,对药品的质量和安全具有重要的
意义,同时也对医药行业和患者具有积极的影响。
希望整个医药行业
能够认真严格执行这一规范,推动行业的发展,保障患者的用药安全,推动生产企业的质量管理水平不断提高。
也希望欧洲药典8.0版附录2.9.40能够不断完善,与时俱进,为医药行业的更好发展和患者的更
好用药体验做出更大贡献。
