流式细胞仪操作方法
dxflex流式细胞仪的使用流程

dxflex流式细胞仪的使用流程1. 准备工作在使用dxflex流式细胞仪之前,需要进行一些准备工作,以确保设备正常运行和结果准确可靠。
1.1. 检查设备首先,检查dxflex流式细胞仪是否在良好的工作状态。
确认仪器上的连接线是否完好,仪器表面是否有损坏或污垢。
如有异常情况,应及时联系维修人员。
1.2. 准备样本在使用dxflex流式细胞仪之前,需要准备好待测试的样本。
样本应按照预先确定的实验方案进行处理和染色。
确保样本具备可靠的标记和专一性。
1.3. 标准品设置根据实验需要,根据实验方案中的相关要求设置标准品。
标准品可用来校准仪器,以确保结果的准确性。
2. 操作流程完成准备工作后,可以按照以下操作流程使用dxflex流式细胞仪。
2.1. 打开电源请确保dxflex流式细胞仪已连接好电源线,并将其插入可用的电源插座。
然后,通过按下电源按钮或拨动电源开关将仪器打开。
2.2. 打开软件在计算机上打开dxflex流式细胞仪的控制软件。
通常情况下,软件将会自动连接到设备。
如果没有自动连接,可以手动选择设备并建立连接。
2.3. 样本加载在软件中选择“新建实验”或类似选项,并按照提示操作。
将预先准备好的样本加载到dxflex流式细胞仪中,确保样本管的直径和长度适合仪器要求。
注意,应将样本管中的空气排除。
2.4. 设置参数根据实验要求,在控制软件中设置采样参数。
这些参数包括采样速度、激光功率、筛选门等等。
确保参数的设置合理与准确。
2.5. 开始实验完成参数设置后,可以开始实验。
点击软件上的“开始”或类似按钮,开始流式细胞仪的运行。
仪器会自动收集数据并进行分析。
2.6. 停止实验实验结束后,点击软件上的“停止”或类似按钮,停止实验运行。
此时,仪器将不再收集数据。
2.7. 数据分析在实验结束后,可以使用dxflex流式细胞仪软件对收集到的数据进行分析。
软件通常提供各种分析工具和图表生成功能,方便用户对数据进行处理和解读。
流式细胞仪的日常操作规范

流式细胞仪的日常操作规范
一、仪器开/关机程序
1、开机程序
检查仪器鞘液桶和废液桶。
打开流式细胞仪。
气压阀置于加压位置,并排除管路中气泡。
打开电脑。
等待机器预热5—10分钟后可开始实验。
2、关机程序
用4ml10%漂白剂作样品,将样品支撑架置于旁位,以外管吸入2ml。
将样品支撑架置于中位,以HI RUN 5分钟,使内管吸入2ml。
将样品换成蒸馏水重复1-2步。
放置盛有1ml蒸馏水的试管于样品支撑架上。
选择Standby模式10分钟。
关闭电脑,再关掉仪器。
二、维护保养
1、每日保养
用蒸馏水作样品,将样品支架支撑置于旁路,以外管吸入2ml
将样品支撑架置于中位,以HI RUN 5分钟,使内管吸入2ml.
选择Standby模式10分钟。
关闭电脑,再关掉仪器。
2、每月保养
将10%漂白剂装入鞘液桶。
旁路鞘液过滤器,以防损害。
将盛有3ml10%漂白剂的试管置于样品支架上,以HI RUN 20-30分钟。
将鞘液和样品换成蒸馏水重复步骤。
流式细胞仪操作流程(单标)

流式细胞仪操作流程(单标)一、开机(务必按照此顺序开机)1、打开下面的小门,推上电源2、打开插线板电源开关3、开电脑4、打开流式细胞仪开关二、软件准备1、打开软件2、点击菜单栏的Cytometer,待流式细胞仪与电脑自动连接后会自动出现startup 和shutdown选项,点击startup,系统提示按确定。
(等待5~6min startup 完成后再继续)2、在出现的Browser栏中依次选择new folder——new experiment——new specimen——new tubes,按照实验组数给new specimen编号,按照每一组实验试管数给new tubes 编号。
3、在右边显示屏中拽出Global sheet,点击Dot Plot绘制散点图,点击Histogram绘制直方图。
以FITC单标抗体为例,首先绘制FSC-A为横坐标、SSC-A为纵坐标的散点图(图1),然后绘制以FITC-A为横坐标、SSC-A为纵坐标的散点图(图2),最后绘制以FITC-A为横坐标、count为纵坐标的直方图(图3)。
4、点击菜单栏中的populations,选择create statistics view。
三、上机操作1、将试管放置在流式细胞仪上,在左侧显示屏的Acquisition Dashboard中点击acquire data,此时流式细胞仪开始工作。
2、根据图1中细胞的位置,在Cytometer FACScanto 栏中的parameters标签中调节FSC和SSC的电压大小,使主群细胞在图1上处于居中的位置。
3、点击右侧显示屏的Polygon Gate按钮,在图1中选择要求测量的主群细胞,可见图1中出现P1,并且其中的细胞变成红色。
4、选择图2、图3,分别在左侧显示屏的Inspector-Dot Plot栏中点击P1的复选框,可见图2、3中的图象均变成红色,即要求细胞仪检测选定的细胞P1。
成像流式细胞仪操作流程

成像流式细胞仪操作流程流式细胞仪是一种广泛应用于生物学研究领域的仪器,可以用来对单个细胞进行高速、高灵敏度的分析和检测。
成像流式细胞仪是其一种新型的变种,结合了传统流式细胞仪的流式分析功能和显微镜成像功能,能够对细胞形态、结构和功能进行直接观察和分析。
本文将介绍成像流式细胞仪的操作流程。
一、准备工作1. 清洁工作台和操作仪器,确保工作环境整洁。
2. 准备所需的实验材料,包括培养基、细胞样品和标记抗体等。
3. 打开成像流式细胞仪的电源,等待其初始化完成。
二、调试参数1. 根据实验需要,设置激光器和滤光片的参数,确保光源的波长和强度适合所需观察的标志物。
2. 调整放大倍率和对焦距离,以保证成像的清晰度。
3. 根据细胞样品特点,设置流速和吸光度的阈值,以获得最佳的成像效果。
三、样品处理1. 获取细胞样品,可以通过培养基中的细胞培养、动物组织提取等方式获得。
2. 用适当的缓冲液将细胞样品悬浮均匀,避免细胞团聚。
3. 如有需要,可以使用荧光染料或标记抗体对细胞进行标记,以便观察特定的结构。
四、样品加载1. 将处理好的细胞样品转移到流式细胞仪的试剂管中。
2. 将试剂管放入样品流动系统中,并将样品连接到成像流式细胞仪。
3. 开启样品注入泵,使样品流入流动系统,确保样品稳定地流过激光器和成像仪。
五、数据采集与分析1. 在计算机上打开成像流式细胞仪的控制软件。
2. 设置采集参数,包括曝光时间、图像大小等。
3. 开始采集数据,成像流式细胞仪会自动将细胞图像采集下来,并存储在计算机中。
4. 对采集到的细胞图像进行分析和处理,可以量化细胞形态参数和标志物表达水平。
六、数据解读与结果分析1. 根据实验的研究目的,对采集到的数据进行解读和分析。
2. 结合其他实验结果和文献资料,判断细胞样品中的结构和功能特点。
3. 根据分析结果,得出相应的结论,并编写相应的研究报告或论文。
七、清洁与关闭1. 实验结束后,关闭流式细胞仪的电源。
8. Attune NxT流式细胞仪标准操作规程

Attune NxT流式细胞仪标准操作规程一、启动Attune NxT流式细胞仪1、依次打开电脑主机电源、显示器及仪器电源。
电脑用户名为INSTR-ADMIN,密码为INSTR-ADMIN(全部大写)。
2、双击Attune软件图标,用户名为admin,密码为password1(全部小写)。
3、检查仪器内四个液体容器,清空“waste”桶中的废液,确认“Focusing fluid”、“Wash solution”和“Shutdown solution”三个桶中的液体量是否满足实验要求(液面较高)。
4、点击startup,等待机器启动,整个过程大约需要3分钟。
仪器指示灯显示为绿色,软件左下角出现绿色对勾即为启动完成。
5、点击performance test,在2mL鞘液中滴入3滴performance tracking beads,混匀后上机,点击Run Performance test。
Performance test每天运行1次。
这个过程大约耗时3分钟。
二、检测样品1、点击new experiment新建一个实验,选择tube或plate实验,输入实验名称,采用默认的Workspace和仪器设置参数,输入Tube Groups和Tube Samples 的数量,点击OK。
2、双击软件右侧Experiment下的Compensation,在弹出的对话框中选择相应的荧光通道,点击OK。
3、双击UC后上样,点击Run,并调节电压,电压调好后点击Record,依次将每个单染色的样本上样,并点击Record记录其荧光信号。
4、荧光补偿调好之后双击sample,上样后点击Run即可得到样本的荧光信号。
根据需要建立散点图并建门。
三、关闭Attune NxT流式细胞仪1、确认”wash solution”和”shutdown solution”桶中液面高度至少在桶高的一半以上,清空“waste”桶。
2、点击shutdown,选择Quick、Standard或Full,样品管内加入3ml 10% bleach液,点击next启动关机程序,此时请勿关闭软件或者终止shutdown过程,关机程序大约需要35分钟,关机程序完毕后仪器将自动关机。
流式细胞操作流程

流式细胞操作流程
流式细胞术是一种用于分析和分类细胞的生物学技术。
以下是典型的流式细胞操作流程:
1.细胞样本准备:
•收集要分析的细胞样本,可以是细胞悬液、组织细胞悬液或血液等。
•对样本进行必要的预处理,如裂解红细胞,去除细胞碎片等。
2.标记细胞:
•使用荧光标记物(荧光染料、抗体等)标记细胞中的特定分子,以便流式仪器能够检测到这些标记。
•标记的目标可以是表面抗原、细胞器、DNA或RNA等。
3.样本染色:
•添加染色剂(荧光标记物)到细胞样本中,使其能够在流式仪器中发光。
•染色通常通过孵育样本和染色剂混合物来实现。
4.细胞固定(可选):
•如果需要保持细胞在染色后的状态,可以进行细胞固定步骤。
5.样本混合:
•将经过标记和染色的细胞混合均匀,以确保获得代表性的样本。
6.样本注射到流式细胞仪:
•将样本通过流式细胞仪的进样口注入,使其形成单个细胞的流动流。
7.激光激发和信号检测:
•使用激光激发样本中的荧光标记物。
•流式细胞仪会检测细胞产生的荧光信号,并记录下来。
8.数据分析:
•通过计算机软件对收集到的数据进行分析。
•分析可以包括对不同细胞亚群的鉴定、数量统计、染色物的表达水平等。
9.结果呈现:
•将分析结果呈现为图表、图像或表格,以便更好地理解和解释实验结果。
流式细胞术可以用于许多研究领域,如免疫学、细胞生物学、肿瘤学等,以研究和识别不同细胞类型、表达分子的水平等。
流式细胞术操作规程

流式细胞术操作规程流式细胞术是一种常用的细胞分析技术,它可以用来检测和分析细胞表面标记物、细胞数量、细胞分布等信息。
以下是一份流式细胞术操作规程,详细介绍了该技术的操作步骤和注意事项。
一、实验前准备1. 准备所需的实验材料,包括流式细胞仪、标记抗体、孵育培养基、样本组织、显微镜片等。
2. 检查流式细胞仪的功能是否正常,确认仪器能够正常运行。
3. 清洁实验台面,确保操作环境干净整洁。
4. 准备所需的试剂和溶液,如PBS缓冲液、抗体染色溶液等。
二、样本处理1. 准备样本组织,将其转移到离心管中,并添加适量的孵育培养基使其完全浸泡。
2. 使用离心机将样本离心,去除上清液。
3. 重悬样本,将其转移到离心管中,并加入足够的PBS缓冲液进行洗涤。
4. 重复洗涤过程,直到样本完全洗净。
三、标记抗体染色1. 取出经过洗涤的样本,将其转移到离心管中,并加入足够的标记抗体溶液。
2. 在黑暗条件下孵育样本,使其与标记抗体充分结合。
3. 静置反应15-30分钟,确保充分染色。
4. 在光线和温度适宜的条件下冰冻样本,避免抗体的结合。
5. 根据实验需求,可以选择单标记或多标记抗体。
四、样本准备1. 取出经过标记抗体染色的样本,将其转移到离心管中,并加入足够的PBS缓冲液进行洗涤。
2. 将样本离心并去除上清液。
3. 重悬样本,并根据实验需要加入适量的PBS缓冲液进行稀释。
4. 检查样本的细胞数目和活性是否符合实验要求,如有必要,可以使用显微镜进行观察和计数。
五、流式分析1. 打开流式细胞仪,并确认仪器的设置和参数是否符合实验要求。
2. 调整仪器的流速和灵敏度,使其适应样本的特性。
3. 将样本转移至流式细胞仪的样本管中。
4. 开始流式细胞分析,记录并保存实验数据。
5. 根据实验需要,可以进行不同的数据分析和处理,包括细胞分布、细胞数量、表面标记物的表达等。
六、实验后处理1. 关闭仪器,清洁工作台和操作区域。
2. 处理和储存实验数据,可以使用相应的图像科学软件进行数据处理和结果分析。
FACSCalibur流式细胞仪中文操作手册
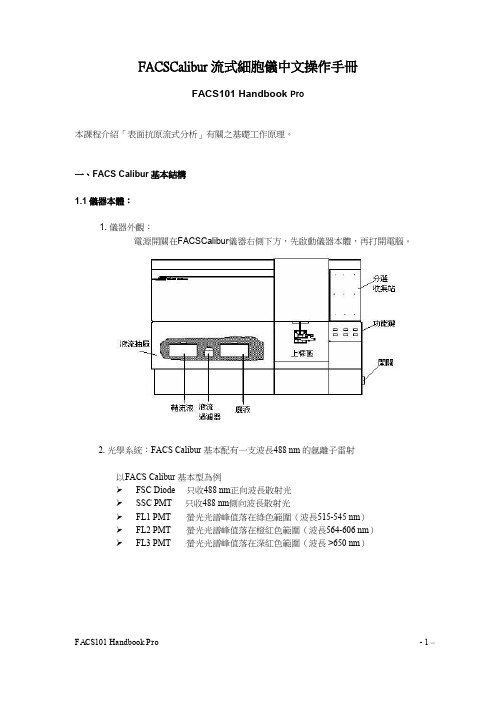
5. 上樣區: 上樣區是樣本管的上樣位置。它包括三個部 分,一個是進樣針 Sample Injection Tube,將 樣本輸入流動室,還有就是支撐架 Tube Support Arm、和液滴存留系統 Droplet Containment System。 進樣針:是一根不鏽鋼管,將細胞從樣本針中吸入流動室。進樣管外有一套管, 是液滴保留系統的一部分。 支撐架:用於支撐樣本管、並負責啟動液滴存留系統。支撐架有三個位置:位於 樣本管之下的中位,樣本管左側或右側。 液滴存留系統:系統由支撐架、真空幫浦和外套 管組成。當支撐架位於左側或右側位置時,真空 幫浦就會啟動,將液體從外管吸入廢液桶內。上 樣時,須注意將支撐架位於中位,以避免過多樣 品被抽吸到廢液筒內(當支撐架位於中位,真空 幫浦停止工作)。更換樣品時,讓儀器保持 RUN 的模式,使得進樣針可以反沖;切換到 STANDBY 模式前,確保液路已沖洗徹底以免碎片沈積到流 動室中。
FACS101 Handbook Pro
-7–
4. 從 Acquire 功能表中選擇 Connect to Cytometer,建立儀器和電腦之間通訊。此時 會出現 Browser 方框。將之移至適當位置。
5. 從工具板中點擊散點圖圖示。在實驗文件的空白區點擊,拖曳對角線至適當大小, 然後放開滑鼠。此時應可以在右方看到 Inspector:Dot Plot 對話框。
FACS101 Handbook Pro
-8–
6. 從螢幕上方 Edit 功能表中選擇 Duplicate 功能,可複製一個同樣大小的散點圖,完 成後可將重製圖移至原圖右方。
7. 從螢幕上方 Edit 功能表中選擇 Select All 功能,文件中所有圖譜的四角會出現黑色 方塊,表示被選取。可在出現之 Inspector:2 Objects 方框中將 Plot Type 改成 Acquisition。 8. 因應實驗需求來修改所有圖譜中顯示之參數。第一圖 X 和 Y 軸參數分別設為 FSC-H 1024、SSC-H 1024;第二圖 X 和 Y 軸參數分別設為 FL1-H 1024、FL2-H 1024。 修改動作為輕擊圖譜,並在出現之 Inspector 方框依需要選擇。 FSC:細胞大小 SSC:細胞顆粒性 FL1:FITC 綠色螢光 FL2:PE 橙色螢光 FL3:PerCP 紅色螢光 儀器設定 注意:實驗數據品質,取決於最適化儀器設定。儀器設定文件不能在數據收取後再更 改,研究人員必須在第一次就使用正確的儀器設定。 儀器設定(Instrument settings),含偵測器電壓(Detector/ Amps),閾值 (Threshold),螢光補償(Compensation)等儀器條件的組合。一般而言,儀器設 定的順序為 Detector/Amps -- Threshold -- Compensation。
流式细胞仪操作流程

流式细胞仪操作流程流式细胞仪(Flow Cytometer)是一种广泛应用于生物医学研究领域的仪器,它能够对单个细胞进行快速、准确的细胞分析和分类。
本文将详细介绍使用流式细胞仪的操作流程。
一、实验准备在进行流式细胞仪实验之前,需要做好以下准备工作:1. 准备样品:收集和准备待分析的细胞样品,确保样品质量符合要求。
处理样品时要注意细胞的保存和处理条件,以避免样品的污染或破坏。
2. 准备反应体系:根据实验的需要,按照标准操作规程制备所需的反应液和缓冲溶液。
3. 检查和校准仪器:在使用流式细胞仪前,需要对仪器进行检查和校准,确保仪器状态良好,获得准确的实验结果。
二、仪器开机和设置1. 打开流式细胞仪电源,并等待仪器启动完成。
2. 进行仪器的初始化设置,包括选择所需的参数和实验模式等。
3. 设置流式细胞仪的激发和检测通道,根据实验需要选择适当的滤光片和荧光探针。
调整激光功率和检测灵敏度,确保后续实验过程中的信号质量。
三、样品加载和检测1. 将样品转移到适当的离心管中,并进行样品标记。
根据实验需要可以使用荧光标记物、抗体等对细胞进行特异标记。
2. 打开流式细胞仪的样品载架,将样品离心管安置在载架上,并将载架插入流式细胞仪的样品槽中。
3. 启动数据采集软件,设置样品参数和实验条件。
选择合适的采集速度和事件数目,确保获得足够的数据。
4. 开始数据采集,点击软件上的“实时运行”按钮,流式细胞仪将开始读取样品中的细胞信息,并将其转化为电子信号。
5. 采集完成后,保存数据并关闭数据采集软件。
四、数据分析1. 导出数据文件:根据实验需要,将采集到的数据文件导出到数据分析软件中进行进一步处理。
2. 进行数据筛选和清洗,去除噪音污染和非特异信号。
3. 根据实验的目的和问题,选择合适的数据分析方法,对细胞数据进行统计学和生物学分析。
4. 生成结果图表:根据数据分析结果,生成合适的图表或图像,用于展示实验结果和研究发现。
5. 结论和讨论:根据数据分析结果,撰写实验结论和讨论,解释实验结果并提出相应的科学推论。
流式细胞仪使用方法说明书

流式细胞仪使用方法说明书1. 概述流式细胞仪是一种用于细胞分析和排序的先进仪器。
本方法说明书旨在向用户介绍如何正确操作流式细胞仪以及最佳的使用方法。
请用户在使用前仔细阅读本说明书并遵循相关的安全操作规程。
2. 仪器组成流式细胞仪主要由以下几个组成部分构成:- 流体传送系统:用于将样本引入仪器并排除废弃物。
- 激光系统:产生激光束以激发样本中的荧光染料。
- 光学系统:收集样本产生的荧光信号并进行检测。
- 数据分析系统:用于解析和分析收集到的数据。
3. 使用准备在进行流式细胞仪实验之前,请确保以下几个步骤已经完成:- 仪器校准:根据仪器的使用手册进行仪器校准,确保仪器工作在最佳状态。
- 样本准备:按照实验需求,对待测样本进行合适的处理,例如细胞培养、染色等。
- 试剂准备:准备好所需的荧光染料、缓冲液等试剂。
4. 仪器操作以下是流式细胞仪的一般操作步骤:- 打开仪器电源,并等待仪器启动完成。
- 将样本装入合适的样本管,并在样本管中加入适量的荧光染料或其他试剂。
- 将样本管放入仪器中的样本槽,并调整流速和其他参数。
- 启动激光系统,并调整激光强度和波长以适应实验需求。
- 开始数据采集,根据仪器界面指示收集所需数据。
- 数据分析:根据实验需要,使用相应的数据分析软件对采集到的数据进行解析和处理。
5. 安全注意事项在使用流式细胞仪时,务必注意以下安全事项:- 佩戴个人防护装备,包括实验手套和护目镜。
- 遵循实验室的生物安全规程,确保样本处理符合相关的安全要求。
- 避免直接暴露于激光束下,以免损伤眼睛和皮肤。
- 在清洁仪器时使用合适的溶剂,并按照仪器清洁的标准程序进行操作。
6. 故障排除在实际操作中,有时可能会遇到仪器故障或其他问题。
以下是一些常见问题及其排除方法:- 仪器无法启动: 检查电源连接是否正常,重启仪器。
- 数据质量差: 检查样本制备和染色的质量,调整参数和仪器校准。
- 清洗困难: 检查是否有阻塞,按照清洁程序进行清洗。
流式细胞仪操作步骤(FACSCalibur)

流式细胞仪操作步骤(FACSCalibur)⼀、开机程序:1.检查鞘液桶和废液桶。
确认鞘液充满状态(鞘液为鞘液桶体积的3/4位置,可以连续⼯作3个⼩时左右)、盖紧⿊盖、管道畅通、废液桶有⾜够空间容纳本批标本排弃的废液。
如果要添加鞘液,要先释放鞘液桶中⽓压。
2.依次打开流式细胞仪FACSCalibur稳压器、主机开关、电脑开关,打印机。
3.⽓压阀置于加压位置,待流式细胞仪处于STANDBY状态,做Prime,以排除管路中⽓泡。
⼆、运⾏FACSComp软件、检查仪器状况1.制备三⾊标准微球样本。
⼀般情况向1ml鞘液(或过滤PBS)中加⼊1滴质控⼩微球,也可以根据实际情况调节浓度。
2.机器预热5 min,打开FACSComp软件,选择保持路径。
选择所需校正内容,如果使⽤的微球是新⼀批产品要输⼊微球的批号。
3.在软件界⾯左侧Assay Selection选项中选择质控类型,即实验过程中是否需要清洗样品。
4.上样品,微球溶液上样之前要充分混匀。
功能键设置在“RUN”。
5.仪器⾃动检查,并做电压、补偿等设置。
6.FACSComp软件运⾏完毕,显⽰结果通过测试。
7.做Set up。
8.打印校正结果,退出FACSComp程序。
备注:在质控过程中,如果提⽰收集细胞速度慢可以提⾼细胞收集速度,但是在调节灵敏度(Sens)时,⼀定要⽤“Low”的状态上样,保证仪器灵敏度的准确。
在使⽤仪器过程中要养成好的习惯,在上样品过程中,仪器保持在“Low”“Standby”状态。
三、样品分析软件:CellQuest Pro软件,选择“联机”。
1.(2)对实验样本进⾏命名;(3)对实验通道进⾏预设(FSC,SSC,FL1-FL4)。
备注:如果界⾯被关闭,重新调出步骤:2.调出质控模板。
3.画图选择画图⼯具(⼀般选择散点图),Inspect界⾯会⾃动弹出,对⼏个常⽤选项进⾏设定:将散点图选中(⽤⿏标点击散点图边框才能够选中图形),将更改横纵坐备注:第⼀个散点图横坐标为FSC,纵坐标为SSC。
流式细胞仪操作步骤

流式细胞仪操作步骤一、样品准备1. 确认样品是否符合实验要求,如细胞浓度、荧光标记等。
2. 根据实验需求,选择合适的试管和细胞样品。
3. 确认样品中是否有杂质或污染物,必要时进行离心和洗涤。
4. 尽可能缩短样品处理时间,避免细胞活性受到影响。
二、样品上机1. 打开流式细胞仪,确认仪器正常工作。
2. 将样品加入到流式细胞仪的样品管中。
3. 根据实验需求,设置合适的流速和压力。
4. 开始采集数据,观察仪器工作状态,确保数据准确可靠。
三、参数设置1. 根据实验需求,选择合适的荧光标记和检测参数。
2. 根据细胞类型和特性,设置合适的门控和阈值。
3. 确认仪器校准和定标工作已完成。
4. 根据需要,设置多色分析,以便于进行细胞分群和定量分析。
四、数据采集1. 在采集数据时,观察仪器工作状态,确保数据准确可靠。
2. 根据实验需求,确定采集的数据量,确保数据具有代表性。
3. 记录采集数据的时间和条件,以便于后续数据分析。
4. 在采集数据时,注意观察细胞活性、浓度和分布情况,及时调整实验条件。
五、数据分析1. 使用专业软件对采集的数据进行处理和分析。
2. 根据实验需求,对数据进行去噪、归一化和定量分析。
3. 进行细胞分群、细胞周期和细胞凋亡等分析。
4. 对数据进行统计学分析和可视化展示。
六、结果输出1. 根据分析结果,输出相应的图表和数据表格。
2. 对结果进行解释和注释,以便于读者理解和应用。
3. 如果需要,可将结果整理成报告形式,提供给相关人员参考和使用。
七、质量控制八、实验室清理。
流式细胞仪的原理和操作过程

流式细胞仪的原理和操作过程介绍如下:
流式细胞仪是以流式细胞术为理论基础,集流体力学、激光技术、电子工程学、分子免疫学、细胞荧光化学和计算机为一体的一种新型高科技仪器。
流式细胞仪的操作过程:
1.将待测细胞经特异性荧光染料染色后放入样品管中,在气体的
压力下进入充满鞘液的流动室。
2.在鞘液的约束下细胞排成单列由流动室的喷嘴喷出,形成细胞
柱。
3.流式细胞仪通常以激光作为发光源。
4.前向光电二极管和90°方向的光电倍增管接收散射光和激发
荧光。
流式细胞仪原理及操作步骤

(标本在试管中可保存 5~ 7 天 )
(三 ) 试剂和器材 1. 各种特异性单克隆抗体。 2. 荧光标记的羊抗鼠或兔抗鼠第二抗体,灭活正常兔血清。 3. 10% FCS RPMI1640, DPBS 、洗涤液、固定液 (见附录 )。 4. 玻璃管、塑料管、离心机、荧光显微镜等。
FCS 50ml ( 终浓度 5 % )
4% NaN 3
50ml ( 终浓度 0.2 %)
3. 固定液
DPBS
1000ml
葡萄糖
20g ( 终浓度 2 % )
甲醛
10ml
NaN 3
0.2g ( 终浓度 0.02 % )
2/2
流式细胞仪原理及操作步骤 流式细胞仪 (FCM) 是八十年代集单克隆抗体、荧光化学、激光、计算机等高技术发展起 来的一种先进仪器, 已广泛应用于免疫学、生物化学、生物学、肿瘤学以及血液学等方面的 研究和临床常规工作。 其中检测人白细胞表面标志可对白血病、 淋巴瘤作用迅速正确的诊断, 对淋巴细胞群和亚群进行精确分类, 还能分离纯化某一群或亚群细胞。 活细胞免疫荧光技术 是用于 FCM 检测的标本准备,染色后也能在荧光显微镜下进行观察,在某些实验条件下, 活细胞免疫荧光染色后的特异性和敏感性要优于滴片固定的常规间接免疫荧光的 结果。 (一 ) 原理 活细胞表面保留有较完整的抗原或受体, 先用特异性鼠源性单克隆抗体与细胞表面相应 抗原结合, 再用荧光标记的第二抗体结合, 根据所测定的荧光强度和阳性百分率即可知相应 抗原的密度和分布。 (二 ) 操作步骤
制备活性高的细胞悬液 (培养细胞系、外周血单个核细胞、 胸腺细胞、脾细胞等均可用于本法 )
↓ 用 10% FCS RPMI1640 调整细胞浓度为 5×10 6~1 ×10 7/ ml
流式细胞仪检测细胞周期操作步骤

流式细胞仪检测细胞周期操作步骤流式细胞仪是一种能够对处在快速直线流动状态中的细胞或生物颗粒进行多参数、快速定量分析和分选的技术。
在细胞生物学研究中,流式细胞仪常用于检测细胞周期,这对于了解细胞的增殖、分化和凋亡等生理过程具有重要意义。
以下是流式细胞仪检测细胞周期的详细操作步骤:一、实验前准备1、细胞培养选择处于对数生长期的细胞进行实验,以保证细胞状态良好且增殖活跃。
根据细胞类型和实验要求,在合适的培养条件下培养细胞。
2、试剂和材料70%乙醇:用于固定细胞。
碘化丙啶(PI)染液:用于染色细胞核中的 DNA。
RNA 酶:用于去除 RNA 对染色的干扰。
磷酸盐缓冲液(PBS):用于洗涤细胞。
流式细胞仪专用的上样管。
3、仪器设备流式细胞仪,并确保仪器处于正常工作状态,包括光路校准、液流系统稳定等。
离心机:用于离心细胞。
二、细胞收集1、当细胞培养达到所需的密度和状态时,小心吸出培养基。
2、用 PBS 轻轻洗涤细胞两次,以去除残留的培养基和杂质。
3、加入适量的胰蛋白酶或其他细胞解离试剂,将细胞从培养容器表面解离下来。
4、加入含有血清的培养基终止胰蛋白酶的作用,防止过度消化细胞。
5、将细胞悬液转移到离心管中,离心(一般 1000 1500 rpm,510 分钟),使细胞沉淀。
三、细胞固定1、弃去上清液,留下细胞沉淀。
2、缓慢加入预冷的 70%乙醇,边加边轻轻涡旋或吹打细胞,使细胞充分分散在乙醇中。
乙醇的最终浓度应在 70%左右。
3、将细胞在 4°C 下固定至少 1 小时,可固定过夜以确保固定效果。
四、PI 染色1、离心固定后的细胞,弃去乙醇。
2、用 PBS 洗涤细胞两次,以去除残留的乙醇。
3、加入适量的 RNA 酶溶液,在 37°C 水浴中孵育 30 分钟,以去除 RNA 对染色的干扰。
4、加入 PI 染液,使其终浓度达到合适的范围(通常为 50 100μg/mL),在室温下避光孵育 30 分钟。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、样品制备
1、取样(大约1×106 cells),离心弃上清,以PBS洗两遍,逐滴加入1ml 70%的冷乙醇固定细胞,﹣20℃冻存过夜。
分析时,离心弃上清,以PBS洗两遍,加入100μl的Rnase(GenScript试剂A),37℃水浴30min,然后再加入400μl的PI染液(GenScript试剂B),在4℃避光条件下孵育30min后即可上FCM检测。
每个样品至少获取2×104cells,
二、上流式测细胞
1.1、打开液流抽屉,确认气压阀处于减压状态;打开金属挡板;取出鞘液桶,倒掉废液,将鞘液桶加至2/3满(一般可用三蒸水,做分选必须用PBS或FACSFLow),拧紧鞘液桶盖,安上金属挡板,保证管路畅通无扭曲。
检查废液桶,将废液桶的气路和液路的快速连接阀打开,倒掉废液(加鞘液一定要倒废液)向废液桶中倒入400ml浓度为10%的次氯酸钠溶液,合上压力阀。
确实盖紧桶盖,检查所有管路是否妥善安置。
1.2、依此接通电源、打开稳压器电源(指示灯由bypass变Ac putput)、变压器电源,稳定5分钟。
将FACSCalibur开关打开,此时仪器功能控制钮的显示应是STANDBY。
如果需要打印,打开打印机电源。
打开电脑(密码:BDIS),等待屏幕显示出标准的苹果标志(先开仪器,后开电脑主机)。
1.3、将压力阀置于加压位置,轻拍过滤器,使气泡位于滤器的上方,打开管路开关,将过滤器中的气泡排除,关闭管路开关。
若滤器管路中有气泡,打开连接头,挤出鞘液,以排除气泡。
关闭液流抽屉。
执行仪器PRIME功能一次,以排除Flowcell中的气泡(反向压力使鞘液从进样针中流出)。
结束后自动STANDBY,5分钟后即可进行试验。
2.1、从苹果画面中选取CELLQuest,最大化,选散点图标,打开,Plot type选择Acq-analysis,X参数和Y参数分别取FSC-H、SSC-H(选择散点图主要是确定所需细胞的细胞群)。
选择单参数图标,打开,Plot type选择Acq-analysis,X参数选择FL2-H 1024(此属于荧光,根据荧光染料的波长范围选择不同的荧光,本实验使用PI作为荧光染料,故选择FL2-H)
2.2、从屏幕上方Acquire指令栏中,选取Connect to Cytometer(快捷键:+B)进行电脑和仪器的连机。
此时出现Parameter description对话框,选择BD files,设置文件存放的位置{在Acquire指令栏中,选择Parameter Description,以决定文件存储位置(folder),文件名称(file),样品代号以及各种参数的标记(panel),即安排tube1,2,3…的检测参数。
一般本仪器获取的数据按照检测对象的不同分别储存于FACStation G3\BD Applications \CELLQuest \XXX 和DNA 文件夹中。
文件根据日期命名。
}同时将出现的Acquisiton Control对话框,将其移至合适位置。
2.3、从Cytometer指令栏中,开启Detectors/Amps,Threshold,Compensation,Status等四个对话框,并将他们移至屏幕右方,以便获取数据时随时调整获取文件。
也可以用&+1,2,3,4获得此四个对话框。
2.4、在Detectors/Amps(可通过调整电压,是FSC、SSC放大或者缩小)对话框中,先为每个参数选择适当的倍增模式(amplifiermode):线性模式Lin或对数模式Log。
一般进行细胞表面抗原分析如分析外周血的淋巴细胞亚群时,FSC和SSC 多以线性模式Lin测量,且DDMParam选择FL2,而FL1,FL2,FL3皆以对数模式Log 测量;分析细胞DNA含量时,FSC,SSC,FL1,FL2,FL3皆以Lin进行测量,且DDMParam 选择FL2;分析血小板表型时, FSC,SSC,FL1,FL2,FL3皆以Log进行测量。
在Threshold对话框中选择适当的参数设定阀值,并调整Threshold的高低,以减少噪音信号(细胞碎片)。
一般做细胞表型时用FSC-H而做DNA时用FL2-H。
Threshold并不影响检测器对信号的获取,但可改善画面质量。
在Compensation对话框中,根据所用的调整补偿用标准荧光样品调整双色(或多色)荧光染色所需的荧光补偿。
.在Status对话框中,LaserPower:正常值-Run/Ready为14.7mW,Standby为5mW;LaserCurrent:正常值为6Amps 左右。
2.5、通过预设的获取模式文件进行样品分析。
从Cytometer指令栏中选取Instrument Settings,在其对话框中选择Open以调出以前存储的相同实验的仪器设定,按Set ,Done确定。
2.6、加样:混匀、上样、按run(放上待检测的样品,将流式细胞仪设定于RUN,流速可在HIGH或LOW上)
2.6.1.工具板中选择多角形区隔工具, FSC/SSC散点图上, R1区域的界定,
我们将以此区域来圈选本次测量的细胞。
(如果要删除R1区域,您可以在工具栏中点选Gates → Region list,以鼠标点选 R1,再按Delete 键删除R1 区域。
删除R1区域后,可用绘图工具板,重画R1。
)
在单参数的图上,gate位置选择“G1=R1”使在单参数的图上显示的是R1区域的细胞的荧光。
2.6.2选择“acquire”----“counters”打开计数器,本实验计数10000个细
胞为准。
测量期间,几十秒后(待电压稳定),点击Abort,去掉勾选setup 开始测量,如需暂停请按“stndby”,可按run继续。
三、样品分析
使用Modfit软件分析数据。
打开file----选择需要分析的文件。
Define gate 1选择 X:FSC-H Y:SSC-H 点击OK Define gate 1选择 X:FL2-W Y:FL2-A 点击OK
以上分别选择合适的范围一个是对细胞的处理一个是对荧光的处理点击Mode -----OK
点击Fit
四、流式细胞仪使用完毕后的维护
从File中选择Quit, 退出软件,选择Don’t Save至苹果屏幕。
将4ml 1:10稀释的次氯酸钠溶液(10%稀释至1% )用滤纸过滤后作样品,将样品置于旁位(vacuum is on),以外管吸去约1ml,在将样品架置于中位(vacuum is off),再HIGH RUN 10分钟(内管吸去2ml)。
改用三蒸水6-10ml作样品,同上处理,但是使用三蒸水的量一定比次氯酸钠的时间更长以清洗掉次氯酸钠残夜。
仪器置于STANDBY状态10分钟,依次关掉计算机、打印机(此二者可以提前关掉)、液流抽屉内的压力阀,FACSCalibur开关、变压器、稳压电源置于(OFF),以延长激光管寿命,并确保应用软件的正常运行。
并填写使用登记表。
五、月维护程序
清洗液为有效浓度为1-2%的次氯酸钠溶液
5.1将压力阀关闭,将鞘液桶取出换上专门用于月维护的鞘液桶,内装1-2%的次氯酸钠溶液2/3,将鞘液过滤器短路,即将过滤器连接头saline filter断开,将鞘液白色液路管路取下,然后连接至saline filter端口,使鞘液直接进入流动室。
5.2打开压力阀,将装有3ml有效浓度为1-2%的次氯酸钠溶液的流式管置于支撑架上中位,再HIGH RUN 30分钟后选择STANDBY。
5.3关闭压力阀,换回鞘液桶,打开压力阀,取下流式管,换上三蒸水的流式管,HIGH RUN 40分钟后选择STANDBY。
5.4关闭压力阀,将鞘液过滤器管路安装回原位置。
