紫外吸收光谱基本原理
紫外吸收光谱法名词解释

紫外吸收光谱法名词解释
紫外吸收光谱法是一种分析化学技术,通过测量样品在紫外光波
长范围内对光的吸收程度来确定其物质成分。
在紫外光谱法中,使用
紫外可见光谱仪或分光光度计测量样品溶液或气体在紫外光波长范围
内的吸收光强。
紫外吸收光谱法的原理是,当紫外光照射到物质样品时,部分光
会被物质吸收,而其余光会通过或反射。
吸收的光的数量与物质的浓
度成正比,因此可以利用吸收光的强度来推断物质的浓度。
通过测量
不同波长下的吸收光强,可以绘制出物质的吸收光谱图,帮助确定物
质的成分。
紫外吸收光谱法广泛应用于许多领域,包括生物化学、药物分析、环境监测和食品安全等。
在生物化学中,紫外吸收光谱法常用于测量
核酸、蛋白质和酶的浓度。
在药物分析中,紫外吸收光谱法可用于药
物纯度和含量的检测。
在环境监测中,可以利用紫外吸收光谱法测量
水中污染物的含量。
在食品安全方面,紫外吸收光谱法可用于检测食
品中的添加剂和农药残留。
总之,紫外吸收光谱法是一种常用的分析技术,可以用于快速、准确地分析物质的成分和浓度。
它具有灵敏度高、无损伤性、操作简便等优点,广泛应用于各个领域的科学研究和工业生产中。
紫外光谱分析基本原理

TYPES OF TRANSITIONS
提示 分子轨道理论:一个成键轨道必定有一 个相应的反键轨道。通常外层电子均处 于分子轨道的基态,即成键轨道或非键 轨道上。
v Not
all transitions that are possible will be observed. Some electronic transitions are "forbidden" by certain selection rules. However, even forbidden transitions can be observed, but these are usually not very intense.
to *
Chromophore
lmax
Alkanes ~ 150 v__________________________
_____________________________
to *
Chromophore lmax ______________________ Alkenes ~ 175 Alkynes ~ 170 Carbonyls ~ 188 ________________________
真空 紫外区
近紫外区
可见光区
100nm
200nm
400nm
800nm
真空紫外区——波长范围在200nm以下的区域。 真空紫外区对普通有机物的结构分析的用处不大。 近紫外区——波长范围在200nm-400nm之间的区域。 近紫外区对有机物结构分析的用处最大。共轭体系以及 芳香族化合物在此区域内有吸收,是紫外光谱讨论的主要对 象。 可见光区——波长范围在400nm-800nm之间的区域。 可见光区与近紫外区基本上没有太大的差别, 只是光源不同,普通紫外区用氢灯,可见光区用钨丝灯。
紫外吸收光谱的基本原理

紫外吸收光谱的基本原理,应用与其特点紫外吸收光谱的基本原理吸收光谱的产生许多无色透明的有机化合物,虽不吸收可见光,但往往能吸收紫外光。
如果用一束具有连续波长的紫外光照射有机化合物,这时紫外光中某些波长的光辐射就可以被该化合物的分子所吸收,若将不同波长的吸收光度记录下来,就可获的该化合物的紫外吸收光谱.紫外光谱的表示方法通常以波长λ为横轴、吸光度A(百分透光率T%)为纵轴作图,就可获的该化合物的紫外吸收光谱图。
吸光度A,表示单色光通过某一样品时被吸收的程度A=log(I0/I1), I0入射光强度,I1透过光强度;透光率也称透射率T,为透过光强度I1与入射光强度I0之比值,T= I1/I0透光率T与吸光度A的关系为A=log(1/T)根据朗伯-比尔定律,吸光度A与溶液浓度c成正比A=εbc ε为摩尔吸光系数,它是浓度为1mol/L的溶液在1cm的吸收池中,在一定波长下测得的吸光度,它表示物质对光能的吸收强度,是各种物质在一定波长下的特征常数,因而是检定化合物的重要数据;c为物质的浓度,单位为mol/L;b为液层厚度,单位为cm。
在紫外吸收光谱中常以吸收带最大吸收处波长λmax和该波长下的摩尔吸收系数εmax来表征化合物吸收特征。
吸收光谱反映了物质分子对不同波长紫外光的吸收能力。
吸收带的许多无色透明的有机化合物,虽不吸收可见光,但往往能吸收紫外光。
如果用一束具有连续波长的紫外光照射有机化合物,这时紫外光中某些波长的光辐射就可以被该化合物的分子所吸收,若将不同波长的吸收光度记录下来,就可获的该化合物的紫外吸收光谱.通常以波长λ为横轴、吸光度A(百分透光率T%)为纵轴作图,就可获的该化合物的紫外吸收光谱图。
吸光度A,表示单色光通过某一样品时被吸收的程度A=log(I0/I1), I0入射光强度,I1透过光强度;透光率也称透射率T,为透过光强度I1与入射光强度I0之比值,T= I1/I0透光率T与吸光度A的关系为A=log(1/T)根据朗伯-比尔定律,吸光度A与溶液浓度c成正比A=εbc ε为摩尔吸光系数,它是浓度为1mol/L的溶液在1cm的吸收池中,在一定波长下测得的吸光度,它表示物质对光能的吸收强度,是各种物质在一定波长下的特征常数,因而是检定化合物的重要数据;c为物质的浓度,单位为mol/L;b为液层厚度,单位为cm。
紫外-可见吸收光谱法的原理

紫外-可见吸收光谱法的原理
紫外-可见吸收光谱法是一种常用的分析方法。
其原理是,当
分子吸收紫外或可见光时,电子从基态能级激发到高能态能级,从而发生光谱吸收现象。
紫外光谱的波长范围通常为185-400
纳米,可见光谱的波长范围为400-800纳米。
这种吸收现象与分子的电子结构有关,不同分子有不同的吸收峰位和吸收强度,因此可以通过测量样品在一定波长范围内的吸收光谱,来确定样品中有哪些化合物以及其浓度。
通常使用紫外或可见光源照射样品,然后使用光谱仪测量样品在不同波长下的光强度,计算出样品的吸光度。
紫外-可见吸收光谱法广泛应用于药物、生物分子、环境监测
和食品安全等领域的分析研究。
紫外可见吸收光谱基本原理
n→π* < π→π* < n→σ* < σ→σ*
11:51:47
2
σ→σ*跃迁
所需能量最大;σ电子只有吸收远紫外光的能量
才能发生跃迁;
饱和烷烃的分子吸收光谱出现在远紫外区; 吸收波长λ <200 nm; 例:甲烷的λ max为125nm , 乙烷λ max为135nm 。 只能被真空紫外分光光度计检测到; 作为溶剂使用;
max(甲醇) max(水) max(氯仿)
n → p*跃迁:蓝移; ;
max(正己烷)
p → p* n → p*
230 329
11:51:47
238 315
237 309
243 305
溶剂的影响
苯 酰 丙 酮 1 1:乙醚 2:水
2
250
300
极性溶剂使精细结构 消失;
11:51:47
11:51:47
11:51:47
精品课件!
11:51:47
精品课件!
11:51:47
(三) 金属离子影响下的配位体内π→π*跃迁 金属离子的微扰,将引起配位体吸收波长和 强度的变化。变化与成键性质有关,若共价 键和配位键结合,则变化非常明显。 茜素磺酸钠: 弱酸性介质:黄色(λ max=420nm) 弱碱性介质:紫红色(λ max=560nm )
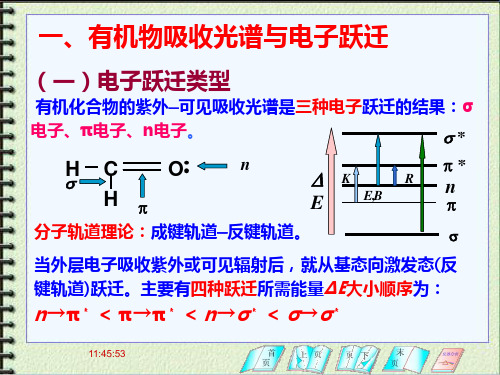
一、有机物吸收光谱与电子跃迁
(一)电子跃迁类型
有机化合物的紫外—可见吸收光谱是三种电子跃迁的结果: σ电子、π电子、n电子。 s*
E p 分子轨道理论:成键轨道—反键轨道。
s
H
C H
OnKR Nhomakorabeap*
E,B
n
p
s
当外层电子吸收紫外或可见辐射后,就从基态向激发态(反 键轨道)跃迁。主要有四种跃迁所需能量ΔΕ大小顺序为:
紫外吸收光谱基本原理
13:04:14
注:当出现几个发色团共轭,则几个发色团所产生的 吸收带将消失,代之出现新的共轭吸收带,其波 长将比单个发色团的吸收波长长,强度也增强
2) 助色团:本身无紫外吸收,但可以使生色团吸收 峰加强同时使吸收峰长移的基团
13:04:14
1) σ→σ*跃迁
所需能量最大;σ电子只有吸收远紫外光的能量才能发 生跃迁;
饱和烷烃的分子吸收光谱出现在远紫外区;
吸收波长λ<200 nm;
s*
例:甲烷的λmax为125nm ,
乙 烷λmax为135nm。 只能在真空环境被真空紫外
E K
R
E, B
p*
n
p
分光光度计检测到;
s
常作为溶剂使用
收强度发生变化:
λmax向长波方向移动称
为红移,向短波方向移动称 为蓝移 (或紫移)。如图所示
13:04:14
4) 增色效应和减色效应 吸收强度即摩尔吸光系数ε增大或减小 的现象分别称为: 增色效应(吸收强度增强的效应)或 减色效应(吸收强度减小的效应)。 如图所示:
5) 强带和弱带 εmax>105 → 强带 εmin<103 → 弱带
13:04:14
2.物质对光的选择性吸收及吸收曲线
M + h → M *
M +热
基态
激发态
M + 荧光或磷光
E1 (△E) E2
E = E2 - E1 = h 量子化 ;选择性吸收
吸收曲线与最大吸收波
紫外吸收光谱的基本原理

紫外吸收光谱的基本原理
紫外吸收光谱的基本原理是基于物质对紫外光的吸收特性。
当一束紫外光照射到被测物质上时,物质中的电子会吸收能量跃迁到高能级,形成激发态。
然后,电子会以辐射或非辐射的形式返回到基态,释放出吸收光的能量。
根据表达式A = log(I0/I),其中A是吸光度,I0是入射光的强度,I是透射光的强度,可以得知吸光度与溶液中物质的浓度
成正比。
因此,可以通过测量吸光度的变化来确定物质的浓度。
在紫外吸收光谱中,常用的检测器是光电二极管或光电倍增管。
这些检测器可以测量透射光的强度,并将其转换为电信号进行处理。
紫外吸收光谱通常在200-400纳米的波长范围内进行测量。
这
个范围对应着紫外光的波长,因为紫外光的能量较高,能够引起物质中电子的激发跃迁。
通过测量样品在不同波长下的吸光度,可以得到紫外吸收光谱图。
从光谱图中可以得知物质在不同波长下的吸收峰,进而可以确定物质的分子结构、浓度以及反应动力学等信息。
总之,紫外吸收光谱是一种常用的分析方法,它通过测量物质对紫外光的吸收特性来分析物质的成分和性质。
紫外可见吸收光谱仪 原理

紫外可见吸收光谱仪原理
紫外可见吸收光谱仪是一种常用的分析仪器,用于测量物质在紫外和可见光范围内的吸收特性。
它的原理基于光的吸收和发射现象,通过测量样品对特定波长的光的吸收程度来分析样品的化学成分和浓度。
光谱仪的工作原理是基于比尔-朗伯定律,该定律描述了溶液中溶质浓度与光强度之间的关系。
当样品被照射时,其中的分子会吸收特定波长的光,导致光的强度减弱。
光谱仪通过测量入射光和透射光之间的差异,可以确定样品对特定波长的光的吸收程度。
光谱仪通常包括光源、样品室、光栅或棱镜、检测器和数据处理系统。
光源会发出一束宽谱的光,经过样品后,透射光会被分解成不同波长的光,然后被检测器检测到。
检测器会将光信号转换为电信号,并传输给数据处理系统进行分析和显示。
通过测量样品对不同波长光的吸收情况,可以得到样品的吸收光谱图,从而分析样品的化学成分、浓度和其他特性。
紫外可见吸收光谱仪在化学、生物化学、制药和环境监测等领域有着广泛的应用,为科学研究和工业生产提供了重要的分析手段。
紫外可见吸收光谱基本原理

紫外可见吸收光谱基本原理紫外可见吸收光谱的基本原理是物质吸收紫外可见光时,电子从低能级跃迁到高能级,吸收的光子能量与吸收带的能带宽度相符合,形成吸收峰。
在可见光区域的吸收通常是由于电子跃迁引起的。
在紫外区域,主要发生的是电子的径向跃迁或电子对的激发,而在可见光区域主要发生的是π-π*跃迁或n-π*跃迁。
紫外光谱仪一般由光源、刺激器、样品室和检测器组成。
光源产生能量较高的紫外光,刺激器通过选择合适的波长、宽度和形状的光束,将光束转化成单色光;样品室用于放置待测样品,并调节光束的强度和位置;检测器可以将吸收光转化成电信号并输出。
在紫外可见吸收光谱实验中,一般使用的溶液法测定。
首先,将待测样品溶解在适当的溶剂中,通过稀释制备一系列不同浓度的溶液。
然后,将样品溶液放入光谱仪样品室中,设置好波长范围和扫描速度等参数。
通过扫描整个波长范围,记录吸收光谱曲线。
根据光谱曲线中的吸收峰,可以确定化合物的电子能级跃迁情况以及其浓度。
紫外可见吸收光谱的分析应用非常广泛。
其中一个重要的应用是定量分析。
根据光谱测得的吸光度和已知浓度的标准溶液数据,可以建立吸光度与浓度之间的标准曲线,通过测量待测样品的吸光度,即可根据标准曲线计算出待测样品的浓度。
这种方法可用于药物和环境分析中。
另一个重要的应用是结构分析。
不同的化合物因为其分子结构的不同,会吸收不同波长的光,形成各自独特的吸收光谱曲线。
通过比对待测样品的光谱特征与已知化合物的光谱特征,可以确定待测样品的结构和成分。
这种方法在有机化学和材料科学领域具有重要意义。
总之,紫外可见吸收光谱是一种广泛应用的分析技术,可以从电子能级跃迁角度解释物质的吸收特性。
它具有快速、灵敏、经济以及非破坏性等优点,在化学研究、药物分析、环境监测等领域发挥着重要作用。
紫外-可见吸收光谱

6.生化反应动力学的研究
如果某生化反应中一种反应物的浓度发生变化, 则可以利用紫外-可见吸收光谱研究反应进行的快慢 即反应的动力学。例如在酶反应中,底物的减少会使 其吸收幅度下降,产物的吸收峰幅度增加,因此可以 利用底物或产物吸收峰的变化来研究反应的进行情况 及其反应速度。
乳酸脱氢酶
乳酸盐 + NHD+
2. 纯度的检验
如果有机物在紫外可见光区没有明 显的吸收峰,而杂质在紫外区区有较强 的吸收,则可利用紫外光谱检验化合物 的纯度。
3. 样品浓度的测定
根据吸收定律: A=εcl
同一物质的消光系数ε是一定的,因 此在光径相同的样品池中,A与样品浓度c 成正比。
• 比较法
• 标准曲线
配置一系列不同浓度的标准溶液,在波 长最佳处分别测定标准溶液的吸光度A,然后 一浓度为横坐标,以相应的A为纵坐标绘制出 标准曲线。
1. 化合物的鉴定
利用紫外光谱可以推导有机化合物的分子骨架 中是否含有共轭体系,如CH2=CH-CH=CH2 , CH2=CH-CH=O ,CH2=CH-C≡N ,苯环等,利用 紫外光谱鉴定有机化合物远不如利用红外有效,因 为紫外光谱特征性不强。
苯丙氨酸 酪氨酸 色氨酸
具有环状共轭双键
鉴定的方法
时,测量到的透射光的强度与入射光强度之差即为样品 对入射光的吸收。
Io
It
A=lg(Io/It)
二.紫外光谱的特点
1. 紫外吸收光谱所对应的电磁波波长短,能量大, 反映分子中价电子能级跃迁的情况,主要用于
共轭体系及芳香族化合物的分析。
2. 但是由于谱峰宽,重叠多,而不是像红外吸收 光谱或核磁共振谱那样得到的是各个特定化学 键的峰。
丙酮酸盐 + NADH + H+
紫外吸收光谱基本原理

能级跃迁
电子能级间跃 迁的同时,总伴 随有振动和转动 能级间的跃迁。 即电子光谱中总 包含有振动能级 和转动能级间跃 迁产生的若干谱 线而呈现宽谱带 。
2019/8/17
讨论:
(1) 转动能级间的能量差Δ Ε r:0.005~0.050eV,跃迁
产生吸收光谱位于远红外区。远红外光谱或分子转动光谱; (2) 振动能级的能量差Δ Ε v约为:0.05~1eV,跃迁产 生的吸收光谱位于红外区,红外光谱或分子振动光谱; (3) 电子能级的能量差Δ Ε e较大1~20eV。电子跃迁产生 的吸收光谱在紫外—可见光区,紫外—可见光谱或分子的电 子光谱.
2019/8/17
(3)羰基化合物共轭烯烃中的 p → p*
R
CO Y
p*
p*
① Y=H,R n → s* 180-190nm p → p* 150-160nm
KR K
R n
n → p* 275-295nm
p
②Y= -NH2,-OH,-OR 等助色基团 p
K 带红移,R 带兰移;
p*
R带max =205nm ;e10-100
ultraviolet spectrometry of metal complexometric compounds
2019/8/17
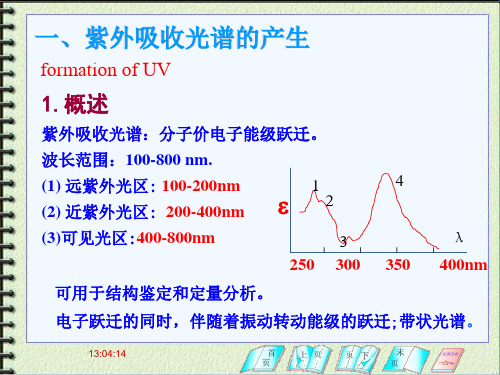
一、紫外吸收光谱的产生
formation of UV
1.概述
紫外吸收光谱:分子价电子能级跃迁。
波长范围:100-800 nm. (1) 远紫外光区: 100-200nm (2) 近紫外光区: 200-400nm (3)可见光区:400-800nm
规
烷基(-R)
+5
烷氧基(-OR) +6
紫外吸收光谱

三、红移与蓝移
λmax向长波方向移动称为红移;
向短波方向移动称为蓝移 (或紫移)。
§2.3 有机化合物的紫外吸收光谱特征
一、饱和化合物
1、烷烃
C—C,C—H 只产生σ→σ* 跃迁, λmax<150 nm,在近紫外区无吸收。 因而饱和烷烃可用作紫外吸收测定的溶剂。 如:CH4 λmax=125 nm;
O
★⑷ n →π*跃迁—R带
C
分子中孤对电子和π键同时存在时发生n→π* 跃 迁,这类跃迁在跃迁选律上属禁阻跃迁,εmax为10 ~100L·mol-1 ·cm-1,吸收谱带强度较弱。丙酮n→π *跃迁的λmax为275nm εmax为22 L·mol-1 ·cm -1( 溶剂环己烷)。
共轭双键数增加, λmax增大
A、吸收峰的强度
B、吸收峰的数目
C、吸收峰的位置
D、吸收峰的形状
2、n→π﹡跃迁的吸收峰在下列哪种溶剂中测 量,其最大吸收波长最大 ( )
A、水 B、甲醇
C、乙醇 D、正已烷
习题
1.丙酮的羰基有几种类型的价电子。 说明能产生何种电子跃迁?试写出。
下列化合物是否存在 n →π*跃迁
OH
O
A
B
C
指出下述各对化合物中,哪一个化合物能吸 收波长较长的光线(只考虑π→π*-可见吸收光谱是分子的价电子吸收紫 外-可见光区的电磁波由低能级跃迁到高能级后 而产生的吸收光谱,简称紫外光谱(UV)。
紫外可见光可分为3个区域: 远紫外区 10190 nm (研究较少) 近紫外区 190400 nm (研究较多) 可见区 400800 nm
§2.2 UV光谱的基本原理
(1) CH3 CH CH2 及 CH3 CH CH OCH3
紫外可见吸收光谱基本原理

p
R带max =205nm ;10-100
p
p
p
③不饱和醛酮 K带红移:165250nm R 带兰移:290310nm
165nm n p
n
p
p
p
cc
cO
cO
13:02:19
(4)芳香烃及其杂环化合物
苯:
E1 带 1 8 0 1 8 4 nm; =47000
E2 带 2 0 0 2 0 4 nm =7000 苯环上三个
13:02:19
苯环上助色基团对吸收带的影响
13:02:19
苯环上发色基团对吸收带的影响
13:02:19
(三) 溶剂对吸收光谱的影响
n<p
CO
p
C
C
n
p
>p
p
p
n
p
n
n
p
p p
CO
CC
非极性 极性
非极性 极性
n → p*跃迁:蓝移; ; p → p*跃迁:红移; ;
p → p*
max(正己烷)
第三章 紫外-可见吸收
光谱法
一、 有机化合物的 紫外可见吸收光谱
第二节
二、无机化合物的吸 收光谱
紫外-可见吸收光谱
13:02:18
一、有机物吸收光谱与电子跃迁
(一)电子跃迁类型
有机化合物的紫外—可见吸收光谱是三种电子跃迁的结果:σ
电子、π电子、n电子。
s*
HC O
n
s
Hp
p*
K
R
E
E,B
n
p
分子轨道理论:成键轨道—反键轨道。
并,红移;
取代基使B带简化;
紫外吸收光谱基本原理

同环共轭双键
39
每增一个共轭双键
30
环外双键, 五(七)元环内双键(酸或酯)
5
取代基
α
β
γ
δ
溶剂校正
-R(烷或环)
10
12
18
18
水
-8
-OH -OR -OCOR -Cl
35
30
50
50
甲醇
0
35
30
17
31
氯仿
1
6
6
ቤተ መጻሕፍቲ ባይዱ
6
6
15
12
二氧六环 5
-Br
25
30
乙醚
7
-SR
85
乙烷 11
-NRR’
95
环己烷 11
1
4
e2
3 250 300 350
λ 400nm
可用于结构鉴定和定量分析。
电子跃迁的同时,伴随着振动转动能级的跃迁;带状光谱。
01:07:04
分子吸收光谱的产生——由能级间的跃迁引起 能级:电子能级、振动能级、转动能级 跃迁:电子受激发,从低能级转移到高能级的过程
E分 E电 E振 E转
p*
p*
p*
③不饱和醛酮 K带红移:165250nm R 带红移:290310nm
165nm n p
n
p
p
p
cc
cO
cO
01:07:04
α ,β -不饱和醛、酮K吸收带计算规则(乙醇溶剂)
δγ β α
基
酮
δ-C=C-C=C-C=O
本 值
215
醛
酸(酯) 五元环酮
209
紫外可见吸收光谱法基本原理

⑵n →σ*跃迁
所需能量较大。吸收波长为150~250nm,大部分在远紫
外区,近紫外区仍不易观察到。含非键电子的饱和烃衍生物(
含N、O、S和卤素等杂原子)均呈现n →σ*跃迁。如一氯甲烷 、甲醇、三甲基胺n →σ*跃迁的λ分别为173nm、183nm和 227nm。
⑶π→π*跃迁
所需能量较小,吸收波长处于远紫外区的近紫外端或近 紫外区,摩尔吸光系数εmax一般在104L· 液的浓度为4.5×10-3g· L-1,在530nm 波长下用2.0cm的吸收池所测得的吸光度为0.300,试 计算(a)吸收系数;(b)使用5cm的吸收池时溶液的百分 透光度。 解: (a)a=A/bc=0.300/2.0×4.5×10-3=33.3L· g-1· cm-1
(b)T=10-ab’c=10-A’ T%=10-ab’c×100%=10-A’×100%=17.81%
T = It /I0 吸光度A与透光度T的关系: A = -lgT 朗伯-比尔定律是吸光光度法的理论基础和定量测定的依据。应 用于各种光度法的吸收测量。
应用举例
某有色物质溶液的浓度为4.5×10-3g· L-1,在530nm 波长下用2.0cm的吸收池所测得的吸光度为0.300,试 计算 (a)吸收系数; (b) 使用5cm的吸收池时溶液的百分透光度。 解:
是非单色光作为入射光引起的偏离。
非单色光作为入射光引起的偏离
假设由波长为λ1和λ2的两单色光 组成的入射光通过浓度为c的溶液,则: A 1 = lg(Io1 /It1 )=ε1bc A 2 = lg(Io2 /It2 )=ε2bc
故:
I t1 I O1 10
ε 1bc
; I t 2 I O1 10
n →π* < π→π* < n →σ* < σ→σ*
紫外吸收光谱基本原理
图3.1 电子跃迁图
15:36:00
• 其中б→б* 跃迁所需能量最大,n→π*及 配位场跃迁所需能量最小,因此,它们 的吸收带分别落在远紫外和可见光区。
• 从图中纵坐标可知π→π*及电荷迁移跃迁 产生的谱带强度最大,n→π*、n→б*跃 迁产生的谱带强度次之,配位跃迁的谱 带强度最小。
15:36:00
一、有机化合物的紫外—可见吸收光谱 (一)电子跃迁类型
*
反键*轨道
*
反键*轨道
E
n→ * → * n→ * → *
n
N非键轨道
成键轨道
成键轨道
图3.2 分子的电子能级和跃迁
15:36:00
15:36:00
15:36:00
15:36:00
15:36:00
4. n→π*跃迁
15:36:
不同波长的光
L
图3-1 紫外可见吸收光谱示意图
A
末端吸收
最强峰
肩 峰
次强峰 峰谷
15:36:00
max
min
A
分析吸收曲线 可以看到:
1.同一浓度的 待测溶液对不 同波长的光有 不同的吸光度;
max
min
2. 对于同一待测溶液,浓度愈大,吸光度也愈大;
3. 对于同一物质,不论浓度大小如何,最大吸收峰所对应的 波长(最大吸收波长 λmax) 不变。并且曲线的形状也完 全相同。
含有杂原子的双键化合物中杂原子的n电子 跃迁到π*轨道。
所需能量小,εmax很小,一般在小于100
L·mol-1·cm-1以上,属于弱吸收。
例如:丙酮 n→π*跃迁的λmax为280nm, εmax为: 10~30 L·mol-1·cm-1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
能级跃迁
电子能级间跃迁 的同时,总伴随有振 动和转动能级间的跃 迁。即电子光谱中总 包含有振动能级和转 动能级间跃迁产生的 若干谱线而呈现宽谱 带。
二、电子跃迁与吸收带类型
(一)紫外—可见吸收光谱
有机化合物的紫外—可见吸收光谱是三种电子跃迁的结果:
(2) 近紫外光区: 200-400nm
1
4
(3)可见光区:400-800nm
ε2
可用于结构鉴定和定量分析。
3
电子跃迁的同时,伴随着振 250 300 350
动转动能级的跃迁;带状光谱。
λ 400 nm
2.物质对光的选择性吸收及吸收曲线
M + hν → M *
M +热
基态
激发态
M + 荧光或磷光
E1 (△E) E2
λ基-----是由非环或六环共轭二烯母体决定的基 准值;
无环、非稠环二烯母体: λ max=217 nm
异环(稠环)二烯母体:
λmax=214 nm
同环(非稠环或稠环)二烯母体:
λmax=253 )每增加一个共轭双键 +30
(2) 环外双键
4.π→π*跃迁
σ*
� 所需能量较小,吸收波长处于远紫外区
π*
的近紫外端或近紫外区。
∆K
R
E E,B
n
π
�εmax一般在104L·mol-1·cm-1以上,属
于强吸收。
σ
π→π*跃迁依产生的体系不同,其吸收带不 同
(1) 不饱和烃π→π*跃迁(孤立)
乙烯 发色基团C=C , 但 π → π*<200nm;ε>103-104
σ电子、π电子、n电子。
σ*
HC O
σ
Hπ
n
π*
∆K
R
E
E,B
n
π
分子轨道理论:成键轨道—反键轨道。
σ
当外层电子吸收紫外或可见辐射后,就从基态向激发态(反 键轨道)跃迁。主要有四种跃迁所需能量ΔΕ大小顺序为:
n→π* < π→π* < n→σ* < σ→σ*
(二)电子跃迁 1. σ→σ*跃迁
所需能量最大;σ电子只有吸收远紫外光的能量才能发
+5
(3) 双键上取代基:
酰基(-OCOR) 0 卤素(-Cl,-Br) +5
烷基(-R)
+5 烷氧基(-OR) +6
(3)羰基化合物共轭烯烃中的 π → π*
R
CO Y
π∗
π∗
① Y=H,R n → σ* 180-190nm π → π* 150-160nm
KR K
R n
n → π* 275-295nm
强吸收 K带——共轭非封闭体系的p → p* 跃
H
H
迁
cc
H
H
λmax=162nm
(2)共轭烯烃中的 π → π*
π π∗
π∗ 165nm
π∗₃ 217nm π₂
π∗
(HOMO LVMO) π
π₁
π
∆Ε⇓
λmax ⇑
共轭烯烃(不多于四个双键)π π*跃迁吸收峰位置可由伍德
沃德——菲泽 规则估算。 λmax= λ基+Σniλi
配体微扰的金属离子d-d电子跃迁和 f - f 电子跃迁
在配体的作用下过渡金属离子的d轨道和镧系、锕系的f轨 道裂分,吸收辐射后,产生d一d、 f 一f 跃迁;
必须在配体的配位场作用下才可能产生也称配位场跃 迁;
摩尔吸收系数ε很小,对定量分析意义不大。
金属离子微扰的配位体内电子跃迁
金属离子的微扰,将引起配位体吸收波长和强度的变化。 变化与成键性质有关,若共价键和配位键结合,则变化非常 明显。
∆E = E2 - E1 = hν 量子化 ;选择性吸收
吸收曲线与最大吸收波 长λ max
用不同波长的单色光 照射,测吸光度;
3.电子跃迁与分子吸收光谱
♣物质分子内部三种运动形式: (1)电子相对于原子核的运动; (2)原子核在其平衡位置附近的相对振动; (3)分子本身绕其重心的转动。 ♣分子具有三种不同能级:电子能级、振动能级和转动能级 ♣三种能级都是量子化的,且各自具有相应的能量。 ♣分子的内能:电子能量Ee 、振动能量Ev 、转动能量Er
不易观察到。
含非键电子的饱和烃衍生物(-OH,-NH2,-X.-S)均呈现n→σ
σ* 跃迁。
电子能量取决于,n电子的原子性质和分子结构如:
CH3Cl、 CH3Br 、 CH3I, n电子能量依次增大,n→σ*跃 迁能量ΔE 依次减小
化合物
λmax(nm)
εmax
H2O
167
CH3OH
184
CH3CL
紫外吸收光谱分析法
ultraviolet spectrometry, UV
第一节 紫外吸收光谱分析基本原理 principles of UV
一、紫外吸收光谱的产生
formation of UV
1.概述
紫外吸收光谱:分子价电子能级跃迁。
波长范围:100-800 nm.
(1) 远紫外光区: 100-200nm
的电荷转移到配位体L的轨道,或按相反方向转移,所产生的
吸收光谱称为荷移光谱。
Mn+—Lb- hν
M(n-1) +—L(b-1) -
hν
[Fe3+CNS-]2+
[Fe2+CNS]2+
电子给予体 电子接受体
分子内氧化还原反应;ε > 104 Fe2+与邻菲罗啉配合物的紫外吸收光 谱属于此。
5.金属配合物的紫外吸收光谱 ultraviolet spectrometry of metal complexometric compounds
173
CH3I
258
CH3NH2
215
1480 150 200 365 600
3. n→ π *跃迁
σ*
π*
∆E K
R
E,B
n
π
所需能量较小。
σ
吸收波长为200~400nm,大部分在近紫外区。
含杂原子不饱和基团,(C=O、C=S、-N=N-、);
ε小(10-100),丙酮λmax=279 ε:10-30
生跃迁;
饱和烷烃的分子吸收光谱出现在远紫外区;
吸收波长λ<200 nm;
例:甲烷的λmax为125nm , 乙烷λmax为135nm。
只能被真空紫外分光光度计检测到;
σ*
作为溶剂使用;
π*
∆E K
R
E,B
n
π
σ
2. n→σ*跃迁
σ*
所吸需收能波量长较为大 150。~250nm,大部分在∆远E紫外K 区E,,B 近紫R 外区πnπ仍*
π
②Y= -NH2,-OH,-OR 等助色基团 π
K 带红移,R 带兰移;
π∗
R带λmax =205nm ;ε=10-100
π∗
π∗
π∗
③α,β−不饱和醛酮 K带红移:165→250nm R 带红移:290→310nm
165nm π
nπ
n
π
π
cc
cO
cO
4.电荷转移吸收光谱
电荷转移跃迁:辐射下,分子中原定域在金属M轨道上
