2020年中考化学考点之气体的溶解度
2024年中考化学专题强化训练溶解度曲线
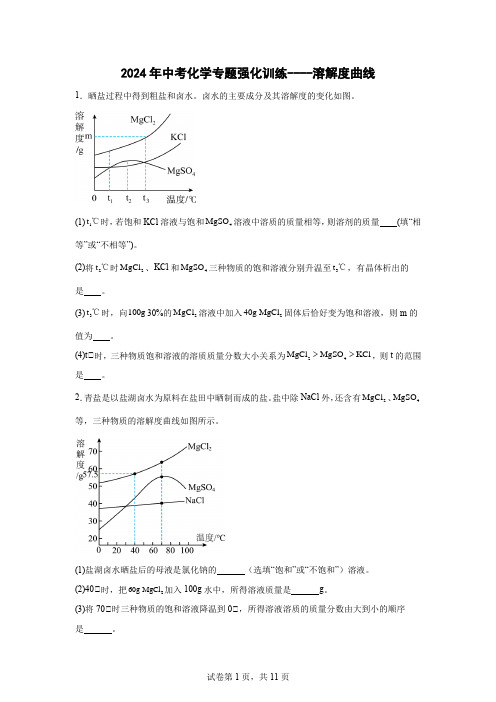
2024年中考化学专题强化训练----溶解度曲线1.晒盐过程中得到粗盐和卤水。
卤水的主要成分及其溶解度的变化如图。
(1)1t ℃时,若饱和KCl 溶液与饱和4MgSO 溶液中溶质的质量相等,则溶剂的质量 (填“相等”或“不相等”)。
(2)将2t ℃时2MgCl 、KCl 和4MgSO 三种物质的饱和溶液分别升温至3t ℃,有晶体析出的是 。
(3)3t ℃时,向100g 30%的2MgCl 溶液中加入240g MgCl 固体后恰好变为饱和溶液,则m 的值为 。
(4)t℃时,三种物质饱和溶液的溶质质量分数大小关系为24MgCl MgSO KCl >>,则t 的范围是 。
2.青盐是以盐湖卤水为原料在盐田中晒制而成的盐。
盐中除NaCl 外,还含有2MgCl 、4MgSO 等,三种物质的溶解度曲线如图所示。
(1)盐湖卤水晒盐后的母液是氯化钠的 (选填“饱和”或“不饱和”)溶液。
(2)40℃时,把260g MgCl 加入100g 水中,所得溶液质量是 g 。
(3)将70℃时三种物质的饱和溶液降温到0℃,所得溶液溶质的质量分数由大到小的顺序是 。
(4)氯化钠中含有少量硫酸镁,若要提纯氯化钠,可采用的方法是。
3.某同学进行了如图1所示实验,结合硝酸钾和氯化钠的溶解度曲线回答下列问题。
(1)20℃时,氯化钠的溶解度是g;(2)若氯化钠中混有少量硝酸钾,可采用的方法提纯氯化钠;(3)图1中烧杯℃为硝酸钾的(填“饱和”或“不饱和”)溶液;若通过升高温度使℃中固体继续溶解,则其溶液中溶质的质量分数(填“增大”“减小”或“不变”)。
4.如图是A、B、C三种固体物质的溶解度曲线,据图作答:(1)P点的意义是。
(2)A、B、C三种物质中,溶解度随着温度上升而减小的物质是。
(3)t2℃时,将30g A物质加入50g水中可形成g溶液。
5.如图是某苏打气泡水的标签。
(1)该气泡水中溶剂的化学式是。
C H O。
从赤藓糖醇的化学式中能获得与其有关的(2)赤藓糖醇是一种甜味剂,其化学式为4104信息是(任写一条)。
2020-2021中考化学 化学溶解度 综合题附答案

2020-2021中考化学化学溶解度综合题附答案一、初中化学溶解度1.甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确A.甲的溶解度大B.t1℃,甲、乙两种物质的饱和溶液质质量分数相等C.t2℃时,向100g水中加入100g甲后形成溶液的质量为200gD.将t2℃甲、乙的饱和溶液分别降到t1℃时,两溶液的溶质质量分数相等【答案】B【解析】【分析】【详解】A、在比较物质的溶解度时,需要指明温度,故A错误;B、t1℃,甲、乙两种物质的溶解度相等,一定温度下饱和溶液的溶质分数=s100%100g+s⨯,所以饱和溶液质质量分数相等,故B正确;C、t2℃时,甲物质的溶解度是80g,根据溶解度概念,向100g水中加入100g甲最多溶解80g的甲,形成溶液的质量=100g+80g=180g,故C错误;D、将t2℃时甲、乙两种物质的饱和溶液降温到t1℃时,甲的溶解度减小,乙的溶解度随温度的降低而增大,甲有晶体析出,质量分数变小,溶液仍为饱和溶液,乙没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=s100%100g+s⨯,溶解度越大,质量分数越大,t1℃时甲的溶解度大于t2℃时乙的溶解度,所以t1℃时两种物质的溶质质量分数由大到小的顺序是甲>乙,故D错误。
故选B。
【点睛】在分析饱和溶液温度改变后溶质质量分数的变化时,首先根据溶解度曲线判定溶液的状态,再根据一定温度下饱和溶液的溶质分数=s100%100g+s⨯,判定溶液溶质质量分数的大小。
2.现有30℃时的氯化钾饱和溶液,在下列情况下溶液中溶质的质量分数不变的是()A.温度不变,向溶液中加入氯化钾晶体B.温度不变,向溶液中加入水C .降低温度至10℃D .升高温度蒸发掉一部分水,温度保持在40℃ 【答案】A 【解析】 【分析】=100% 溶质质量溶质的质量分数溶液质量【详解】A 、因温度不变,虽向溶液中加入氯化钾晶体,但溶质及溶液的质量未变,溶质的质量分数也不变,故A 正确;B 、因溶液的质量变了,所以溶质的质量分数也相应发生变化,故B 不正确;C 、降低温度有晶体析出,溶剂质量不变,其溶质的质量分数变小,故C 不正确;D 、因溶液中溶剂质量减小,所以溶质的质量分数将增大,故D 不正确。
2020年中考化学试题汇编:溶解度曲线图表题(解析版)

溶解度曲线图表题1.(2020湘潭)甲、乙、丙三种固体物质的溶解度曲线如图1所示,请回答下列问题:(1)t1℃时,甲、乙、丙三种物质中溶解度最大的是____。
(2)t2℃时,甲物质的溶解度为____g。
(3)将t2℃时的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液溶质质量分数由大到小的顺序为_______。
(4)如图2,t1℃时,若向烧杯中加入足量的_____(填字母序号)并使之充分溶解,在试管中可观察到有晶体析出。
A 氯化钠B 氢氧化钠C 硝酸铵【答案】丙60乙>甲>丙C【解析】(1)根据甲、乙、丙三种固体物质的溶解度曲线图,t1℃时,甲、乙、丙三种物质中溶解度最大的是丙。
(2)根据甲物质的溶解度曲线图,t2℃时,甲物质的溶解度为60g。
(3)甲、乙溶解度随温度降低而减小,丙溶解度随温度降低而增大,t2℃时溶解度关系为:甲>乙>丙,t1℃时,溶解度关系为:丙>乙>甲,将t2℃时的甲、乙、丙三种物质的饱和溶液降温至t1℃,甲、乙析出晶体得到的是饱和溶液,此温度下甲的溶解度小于乙,故乙的溶质质量分数大于甲,而丙的溶解度随温度的降低而增大,溶液组成不变,所得溶液溶质质量分数由大到小的顺序为乙>甲>丙。
(4)丙的溶解度随温度的升高而减小,则t1℃时,若向烧杯中加入足量的硝酸铵并使之充分溶解,在试管中可观察到有晶体析出,因为硝酸铵溶于水吸热使温度降低;而氯化钠溶于水温度几乎不变,氢氧化钠溶于水放热使温度升高,均不符合题意;故填:C。
2.(2020长沙)数据处理是对数据进行加工的过程,列表法和作图法是常用的数据处理方法。
请你根据图表分析:表:两种物质在不同温度时的溶解度(1)KNO3对应的是图中的_____物质。
(2)25℃时,向100g水中加入45.8g KNO3,充分搅拌后,所得的溶液是_____溶液(填“饱和”或“不饱和”)。
(3)当甲中含有少量乙时,应采用_____结晶法提纯甲。
【答案】甲饱和降温【解析】(1)由表中数据可知,硝酸钾的溶解度随温度的升高而增大,硝酸钾的溶解度受温度变化影响较大,氯化钠溶解度受温度变化影响较小,故KNO3对应的是图中的甲物质。
2020年中考化学压轴题专题复习:溶解度(含答案)

2020 年中考化学压轴题专题复习:溶解度一、选择题1.(2019•安徽)压强为101k P a下,硝酸钾和氨气在不同温度下的溶解度如下表。
下列说法正确的是()A.两种物质的溶解度均随温度升高而增大B.0℃时,K N O3饱和溶液中溶质的质量分数为31.6%C.60℃的KNO3 饱和溶液降温至30℃,有晶体析出D.NH3 的溶解度与压强大小无关【答案】C【解答】解:A、由表中的数据可知,硝酸钾的溶解度均随温度升高而增大,氨气的溶解度均随温度升高而减小,故 A 错误;B、20℃时,K N O3的溶解度是31.6g,饱和溶液中溶质的质量分数为:≈24%,故 B 错误;C、由于硝酸钾的溶解度随温度的升高而增大,所以 60℃的 KNO3 饱和溶液降温至 30℃,有晶体析出,故C 正确;D、NH3 是气体,NH3 的溶解度随压强增大而增大,故 D 错误。
故选:C。
2.(2019•铜仁市)下表为甲、乙、丙三种物质的溶解度,请结合表中信息判断下列说法正确的是()A.三种物质的溶解度大小为:甲>乙>丙B.随着温度变化,甲的溶解度变化最小C.0℃时,100g丙的饱和溶液中,溶质的质量为36.3gD.分别将 50℃时甲、乙的饱和溶液降温至 T℃,两种溶液中溶质的质量分数相等【答案】D【解答】解:A、比较溶解度必须在同一温度下,故 A 错误;B、由表中的数据可知,随着温度变化,丙的溶解度变化最小,故 B 错误;C、在30℃时丙的溶解度是36.3g,由溶解度的含义可知,30℃时,100g丙的饱和溶液中,溶质的质量为26.6g,故C错误;D、由于甲、乙的溶解度都随温度的降低而减小,在 T℃时甲、乙的溶解度相同,分别将 50℃时甲、乙的饱和溶液降温至 T℃,两种溶液中溶质的质量分数相等,故D 正确。
故选:D。
3.(2019•株洲)如图为K N O3和N a C l的溶解度曲线,下列说法不正确的是()A.20℃时,K N O3的溶解度为31.6gB.a点处K N O3和N a C l两种溶液中溶质的质量分数相等C.40℃时,100g水中可溶解K N O3固体63.9gD.0℃时,N a C l饱和溶液中溶质的质量分数为35.7%【答案】D【解答】解:A、通过分析溶解度曲线可知,20℃时,K N O3的溶解度为31.6g,故A 正确;B、a点处K N O3和N a C l两种物质的溶解度相等,所以a点处溶液中溶质的质量分数相等,故B 正确;C、40℃时,硝酸钾的溶解度是63.9g,所以100g水中可溶解K N O3固体63.9g,故C 正确;D、0℃时,氯化钠的溶解度是35.7g,所以N a C l饱和溶液中溶质的质量分数为×100%≠35.7%,故D错误。
2020中考化学复习专题03 溶解度曲线
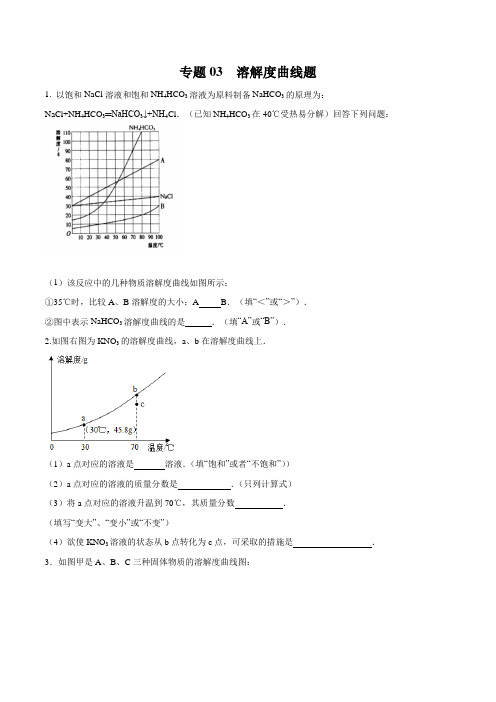
专题03 溶解度曲线题1. 以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl.(已知NH4HCO3在40℃受热易分解)回答下列问题:(1)该反应中的几种物质溶解度曲线如图所示:①35℃时,比较A、B溶解度的大小;A B.(填“<”或“>”).②图中表示NaHCO3溶解度曲线的是.(填“A”或“B”).2.如图右图为KNO3的溶解度曲线,a、b在溶解度曲线上.(1)a点对应的溶液是溶液.(填“饱和”或者“不饱和”))(2)a点对应的溶液的质量分数是.(只列计算式)(3)将a点对应的溶液升温到70℃,其质量分数.(填写“变大”、“变小”或“不变”)(4)欲使KNO3溶液的状态从b点转化为c点,可采取的措施是.3.如图甲是A、B、C三种固体物质的溶解度曲线图:(1)甲图中,P点所表示的含义为.(2)将B 物质的不饱和溶液转变饱和溶液可采取的方法有(写1种方法).(3)在t1℃时,将30gA物质完全溶解于蒸馏水中可得到A的饱和溶液g.(4)t2℃时,将等质量的三种物质的饱和溶液分别降至t1时,析出晶体最多的是.(5)如图乙所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的.若要生成氢气0.1g,则至少需要镁条的质量为g.4.请根据你学习的有关溶液知识,回答下列问题.(1)水是一种良好的溶剂,下列物质在水中能配成溶液的是(填字母).A.氢氧化镁B.氯化镁C.金属镁D.植物油(2)当硝酸钾中混有少量氯化钠时,可采用(填“降温结晶”或“蒸发结晶”)的方法提纯.(3)20℃时,将25g 硝酸钾充分溶解在50g水中,得到的溶液是(填“饱和”或“不饱和”)溶液.此时溶液溶质的质量分数为.(保留到0.1%)(4)40℃时,硝酸钾、氯化钠、A三种物质溶解度由大到小顺序为:.5.分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:(1)氯化钠的溶解度曲线是(填“甲”或“乙”).(2)20℃时,将40gNH4Cl加入100g的水中,充分搅拌后得到的是溶液(填“饱和”或“不饱和”),将上述溶液升温到30℃,该溶液的溶质质量分数为(只列计算式,不需计算结果).(3)如图,t1℃时,将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体最多的是(填“甲”或“乙”).(4)计算配制50g质量分数为3%的NaCl溶液所需要质量分数为6%的NaCl溶液的体积,需要用到的数据是.A.3%的NaCl溶液的密度B.水的密度 C.6%的NaCl溶液的密度.6.图为甲、乙、丙三种物质的溶解度曲线.(1)图中P点表示的意义.(2)t3℃时,A点表示溶液为乙的(填“饱和”或“不饱和”溶液).(3)t3℃时,完全溶解6g甲物质至少需要g水,该温度下的饱和溶液溶质质量分数最大为.(4)将t3℃时质量相等的甲的饱和溶液与丙的饱和溶液均降温到t1℃,所得溶液质量大小关系为:甲丙(填“<”、“>”或“=”).7.如图是a、b、c三种物质的溶解度曲线,请据图回答:(1)t2℃时,将30g a物质加入到50g水中并充分搅拌,则所得的溶液为溶液(填“饱和”或“不饱和”);形成溶液的质量为g;(2)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是(填序号,下同);(3)将t2℃时a、b、c三种物质的饱和溶液降低温度到t1℃时,这三种溶液中溶质质量分数的大小关系是。
备战2020中考化学知识点归类训练——溶解度

备战2020中考化学知识点归类训练——溶解度知识点一:溶解度1.增加二氧化碳在水中的溶解度,可行的操作是( )A.升温B.加压C.增加水量D.不断通入二氧化碳2.生活中的下列现象,能说明气体的溶解度随压强变化而变化的是( )A.夏天,鱼塘中的鱼常常会浮在水面呼吸B.烧开水时,沸腾前水中有气泡产生C.打开饮料瓶盖会有大量气泡冒出D.喝了汽水以后,常常会打嗝3.打开汽水瓶盖,有大量气体逸出,下列说法不正确的是( )A.溶质减少B.溶解度减小C.浓度减小D.饱和溶液变成不饱和溶液4.判断下列说法中正确的是( )A.20℃时,100 g水里最多溶解36 g氯化钠,所以20℃时氯化钠的溶解度为36 gB.硝酸钾的溶解度为31.6 gC.20℃时,在100 g水中加入35 g氯化钠完全溶解,则20℃时氯化钠的溶解度为35 gD.20℃时,100 g氯化钠的饱和溶液中有27 g氯化钠,则20℃时氯化钠的溶解度为27 g5.将2.5 g硼酸在20℃时溶于50 g水中即达到饱和,则一般把这种物质的溶解性划分为( )A.易溶物质B.可溶物质C.微溶物质D.难溶物质6. 25℃时,50 g水中最多可溶10 g A,30℃时,50 g水中最多可溶15 g B,则A、B溶解度比较为( )A.无法比较B.A大于BC.A小于BD.A等于B7.20℃时,氯化钠的溶解度为36 g。
将40 g氯化钠放入100 g水中,所得氯化钠溶液的质量是多少( )A.40 gB.140 gC.136 gD.100 g8.下列加速物质溶解措施中,能改变固体溶解度的是( )A.加热B.搅拌C.振荡D.把固体研细9.某温度时,将10 g饱和氯化钾溶液蒸干,得氯化钾晶体2 g,则氯化钾在此温度下的溶解度为( )A.10 gB.2 gC.20 gD.25 g10.控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有①溶质的种类;②溶剂的种类;③溶质最多被溶解的质量;④溶剂的质量;⑤温度。
2024年中考化学专题训练——溶解度

2024年中考化学专题训练——溶解度一、选择题1.要将饱和的KNO3溶液变成不饱和溶液,下列措施中不正确的是A.加水B.升高温度C.与另一不饱和KNO3溶液混合D.加KNO3晶体2.要使二氧化碳气体大量溶解在水里,可以采用的方法是A.降温加压B.升温加压C.降温减压D.升温减压3.不能影响物质溶解度大小的因素为A.温度高低B.溶质、溶剂的量C.溶剂种类D.溶质种类4.下列叙述正确的是A.在饱和溶液中再加入任何物质都不可能溶解B.只有增加溶剂的质量,饱和溶液才可能变成不饱和溶液C.某种溶液可以是稀溶液,但同时又是饱和溶液D.浓溶液一定是饱和溶液5.利用海水晒盐的原理是A.海水受热分解B.升高温度,降低氯化钠在水中的溶解度C.温度升高,使食盐的溶解度增大D.利用阳光和风蒸发水分,使氯化钠成晶体析出6.a、b、c、d四只烧杯中分别盛有10℃、T1℃、T2℃、T3℃不同温度的水各100g,分别向其中加入50g硝酸钾,充分溶解后的情况如下图所示,下列有关判断正确的是A.T1℃<T2℃<T3℃B.T2℃时,硝酸钾的溶解度为50g/100g水C.a、b、c三只烧杯中的溶液都是饱和溶液D.四只烧杯中溶液的溶质质量分数大小关系为:a<b<c=d7.某同学自制汽水(如下图)并记录了心得,下列记录正确的是A.℃中溶质和溶液质量比为1:50B.℃中溶液为碳酸氢钠的不饱和溶液C.℃摇匀放入冰箱后气泡增多D.℃摇匀放入冰箱后有碳酸氢钠析出8.如图为KC1和Na2CO3的溶解度曲线,下列说法错误的是A.T2℃时,Na2CO3饱和溶液质量分数为49.0%B.将两物质的饱和溶液由T1℃升温至T4℃,均无固体析出C.T4℃时,分别将等质量的KC1和Na2CO3溶于水配成饱和溶液,所得溶液的质量前者小于后者D.若KCl溶液中含有少量Na2CO3,可采取蒸发浓缩控制温度T3℃以上降温结晶、过滤等操作提纯9.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是A.甲、乙物质是易溶物质B.t1℃时,甲和丙的饱和溶液中所含溶质质量相等C.将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法D.若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙10.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是A.NaCl的溶解度一定大于KNO3B.NaCl的溶解度受温度影响的程度比KNO3大C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g二、实验题11.下表为硝酸钾和氯化钠的部分溶解度数据,某同学进行了如图的溶解实验。
中考化学题型解读:溶解度及溶解度曲线

1.下表是Ca(OH)2和NaOH 的溶解度随温度变化的数据。
请回答下列问题:(1)根据上表数据,绘制Ca(OH)2和NaOH 的溶解度曲线,下图中能表示NaOH 溶解度曲线的是 (选填“A ”或“B ”)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水后再恢复到原温度;⑥加入生石灰。
其中措施正确的是 (填序号)。
A.②④⑥B.③④C.①③⑤⑥D.①②⑤⑥ (3)20°C 时,将191g 饱和NaOH 溶液蒸发掉10 g 水后,再降温到20°C ,可析出NaOH 晶体的质量为 。
(4)现有20°C 时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO 后得到溶液乙,此时乙溶液中溶质的质量分数 (选填“>”“˂”或“=”)20°C 时甲溶液中溶质的质量分数。
(5)现有60°C 时含Ca(OH)2和NaOH 两种溶质的饱和溶液,若要得到较纯净的NaOH 晶体,应采取的物理方法是 。
【答案】(1)A (2)D (3)9.1g (4)˂ (5)降温结晶,过滤 补充选题1.如图是 A、B、C 三种物质的溶解度曲线。
请回答: (1)交点K的含义是 。
(2)t 2℃ 的C物质的饱和溶液变到t 1℃时,是 ( 选填“饱和”或“ 不饱和”)溶液。
(3)三种物质的溶解度为B>C>A 时的温度范围是℃ 。
(4)在t 3℃ 时,将40g C物质放入50g 水中,充分溶解,所得溶液溶质质量分数为 。
【答案】(1)t 3℃ 时,A、C两种物质的溶解度相等(答案补充:t 3℃ 时,A、C两种物质的饱和溶液的溶质质量分数相等) (2)不饱和 (3)t 2 ~t 3 (4)37.5% 2.根据图一的甲、乙溶解度曲线和图二实验现象回答下列问题:(1)图一中,甲物质的四种溶液状态“a、b、c、d”中, 处于不饱和状态的是 (填写编号) 。
专题5溶解度及溶解度曲线(课件)-2023年中考化学新课标一轮复习

36 × 64
A.该溶液是饱和溶液
64g水中最多溶解NaCl:
= 23.04g
100
B.溶液中Na+和Cl-个数一定相等 得到饱和溶液的质量:
C.溶液质量为100克
64+23.04=87.04(g)
溶质、溶剂的质量比:36∶100 = 9∶25
D.溶质与溶剂质量比为 9∶25
考点突破
6.我国古代提纯焰硝(含KNO3和少量NaCl、CaCl2等)工艺的主要过程示意如图所示。
专题5
溶解度及溶NE
溶解度
溶液的浓度
1、溶液的浓度常用溶质的 质量分数
来表示,即溶质的质量与溶液的质量
比。
溶质质量
(1)溶质质量分数(%)=
×100%
溶液质量
溶剂质量
注意: ① 溶液质量 = 溶质质量
+
;
② 溶质的质量是指已经溶解在水中的那一部分溶质的质量。
溶解度
③ 饱和溶液中溶质质量分数(%)=
,
(3)由图可知,a、b两物质的溶解度受温度影响
较大的是 a 。
考点突破:比较溶解度大小,一定要指明温度。
考点突破
2.(1)1 ℃时,100g水中最多溶解 20
g物
质c恰好形成饱和溶液;
(2)2 ℃时,向50g水中加入30g物质a,充
分溶解后,得到的溶液是 饱和
(填“饱和”
或“不饱和”)溶液,此时溶液的质量为 g。
硝酸钾 ;、氯化铵等
; 氯化钠
。氢氧化钙
气体的溶解度
减小
减小
结晶
不大
较大
考点突破
1.室温时,向25g某固体中分批次加人水,充分搅拌,结果如图所示(保持温
聚焦2020中考化学考题专项训练——专题二:溶液

聚焦2020中考化学考题专项训练——专题二:溶液考点一:溶液1.下列洗涤方法中,利用乳化原理的是()A.用食醋除水垢B.用稀盐酸除铁锈C.用汽油清洗油渍D.用洗洁精清洗油污2.在盛有水的烧杯中加入以下某种物质,形成溶液的过程中,温度下降。
这种物质是()A.氢氧化钠B.氯化钠安C.浓硫酸D.硝酸铵3.将少量下列物质分别放入水中,充分搅拌,不能形成溶液的是()A.蔗糖B.牛奶C.酒精D.白醋4.下列有关溶液的叙述错误的是()A.溶液中的溶剂只能是水B.固体NaOH溶于水时,溶液温度升高C.一定条件下,饱和溶液和不饱和溶液可以相互转化D.溶液是均一、稳定的混合物5.碘是紫黑色晶体,可以溶解在汽油中,形成紫红色溶液。
(1)碘的汽油溶液中,溶质是________,溶剂是________。
(2)甲、乙、丙三个同学分别画出下面的示意图,表示溶液中碘分子的分布(汽油分子没有画出)。
①如果乙同学的示意图符合事实,应该观察到的现象是____________________________。
②根据你在实验中观察到的现象,________(选填“甲”“乙”或“丙”)的示意图符合事实。
6.病人在医院接受静脉注射或滴注时,常用到生理盐水,即氯化钠注射液。
某药业公司生产的氯化钠注射液包装标签上的部分文字如下:请回答:(1)该注射液里的溶质是_______________。
(2)常温下,一瓶合格的氯化钠注射液密封放置一段时间后,是否会出现浑浊现象?为什么?(3)该文字说明包含哪些化学知识?7.一天,小松不小心将碘酒洒到衣服上,他妈妈立即用水和洗洁精清洗衣服,但怎么洗也洗不掉这些斑点,还是小松给妈妈出了个好主意。
你认为小松的主意是什么?这种方法和用洗洁精除油污的方法比较,在原理上有什么不同?考点二:溶解度1.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图象不正确的是()2.20℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四个各盛有50 g水的烧杯中,充分溶解,其溶解情况如下表:下列说法正确的是()A.所得四杯溶液都是饱和溶液B.丁溶液的溶质质量分数最大C.20℃时四种物质溶解度的关系为:丙>乙>甲>丁D.四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液3.下表是KCI和KNO在不同温度时的溶解度。
2020-2021备战中考化学化学溶解度(大题培优)及答案
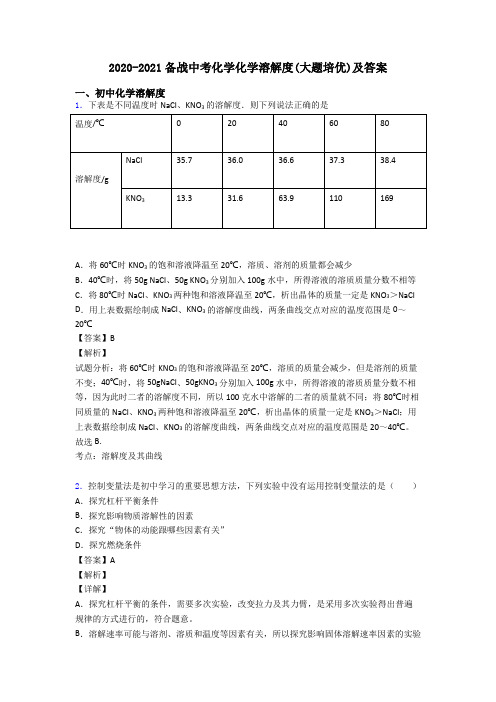
2020-2021备战中考化学化学溶解度(大题培优)及答案一、初中化学溶解度1.下表是不同温度时NaCl、KNO3的溶解度.则下列说法正确的是A.将60℃时KNO3的饱和溶液降温至20℃,溶质、溶剂的质量都会减少B.40℃时,将50g NaCl、50g KNO3分别加入100g水中,所得溶液的溶质质量分数不相等C.将80℃时NaCl、KNO3两种饱和溶液降温至20℃,析出晶体的质量一定是KNO3>NaCl D.用上表数据绘制成NaCl、KNO3的溶解度曲线,两条曲线交点对应的温度范围是0~20℃【答案】B【解析】试题分析:将60℃时KNO3的饱和溶液降温至20℃,溶质的质量会减少,但是溶剂的质量不变;40℃时,将50gNaCl、50gKNO3分别加入100g水中,所得溶液的溶质质量分数不相等,因为此时二者的溶解度不同,所以100克水中溶解的二者的质量就不同;将80℃时相同质量的NaCl、KNO3两种饱和溶液降温至20℃,析出晶体的质量一定是KNO3>NaCl;用上表数据绘制成NaCl、KNO3的溶解度曲线,两条曲线交点对应的温度范围是20~40℃。
故选B.考点:溶解度及其曲线2.控制变量法是初中学习的重要思想方法,下列实验中没有运用控制变量法的是()A.探究杠杆平衡条件B.探究影响物质溶解性的因素C.探究“物体的动能跟哪些因素有关”D.探究燃烧条件【答案】A【解析】【详解】A.探究杠杆平衡的条件,需要多次实验,改变拉力及其力臂,是采用多次实验得出普遍规律的方式进行的,符合题意。
B.溶解速率可能与溶剂、溶质和温度等因素有关,所以探究影响固体溶解速率因素的实验应使用控制变量法,不合题意;C.在速度一定时,质量越大,动能越大;在质量一定时,速度越大,动能越大,采用的是控制变量法,不合题意;D.燃料的燃烧与温度、可燃物种类及氧气浓度都有关系,探究燃烧的条件,需要保持其中两个物理量一定,改变一个物理量,采用的是控制变量法,不合题意。
2020南京化学中考题型----溶解度专题

2020南京中考题型-----溶解度曲线专题知识储备:1.固体溶解度[S]:⑴定义:一定温度下,某固态物质在100g溶剂里达到饱和状态所溶解的质量。
没指明溶剂时,通常所说的溶解度就是指在水中的溶解度。
简而言之,溶解度就是一个“数”,这个“数”就是物质在一定温度下的“100g 水”里所能溶解的“最大值”。
⑵溶解度含义及简单计算:20℃时氯化钠溶解度为36g,含意是20℃时100g水中最多溶解36g氯化钠。
20℃时,50g水最多溶解氯化钠18g,此时欲溶解36g氯化钠至少需水100g,欲溶解108g氯化钠至少需水300g。
(饱和溶液中,质:剂==S:100)⑶影响固体溶解度的因素:溶质的性质、溶剂的性质、温度。
注意:颗粒大小和搅拌只能影响溶解的速率。
2.溶解度曲线应用:(注:A、B、C代表物质依次为——硝酸钾、氯化钠、熟石灰或气体)⑴会比较S大小:0℃时溶解度大小顺序为B、C、A ,t2℃时三种物质溶解度大小顺序为A、B、C。
⑵会查S并进行简单推算、判断:①t2℃50g水中最多能溶解A物质25g。
②t2℃一瓶饱和A溶液的浓度为33.3%。
③t2℃把25gA物质放入100g 水中,所得溶液质量为125g,浓度为20%,所得溶液是否饱和:不是;降温至t1℃,所得溶液质量为115g,此时溶液是否饱和:是。
⑶会判断饱和溶液浓度随温度变化情况:①t2℃三物质的饱和溶液降温至t1℃,A溶液浓度将变小,B溶液浓度将变小,C溶液浓度将不变。
②t1℃三物质的饱和溶液升温至t2℃,A溶液浓度将不变,B溶液浓度将不变,C溶液浓度将变小。
③t1℃三物质的饱和溶液(杯内有剩余晶体),升温至t2℃,A溶液浓度将变大,B溶液浓度将变大,C溶液浓度将变小。
A溶液中能看到的现象是晶体减少,C溶液中能看到的现象是晶体增多。
④t1℃的三种物质饱和溶液,升温时浓度变小的是C,降温时浓度变小的是A、B。
⑤t2℃时三个物质饱和溶液的浓度大小顺序为A、B、C,降温至t1℃时溶液浓度的大小顺序为B、A、C(可画水平线判断:A溶解度虽下降但并没有低于C在t2℃的“高度”)。
中考化学 溶解度曲线及溶解度表

微专题9 溶解度曲线及溶解度表
命题角度2 饱和溶液与不饱和溶液的判断及转化(10年3考) 例3 如图是A、B固体的溶解度曲线。 (1)40 ℃时,30 g A物质加入50 g水中充分溶解 形成_饱__和__(填“饱和”或“不饱和”)溶液。 (2)50 ℃时,A溶液中溶质与溶剂的质量比是 3∶8,那么A溶液是_不__饱__和___(填“饱和”或 “不饱和”)溶液。
微专题9 溶解度曲线及溶解度表
具体考查情况
考查内容
溶解度大 溶液稀 温度变化引起 类型 年份 题号 题型 分值
小的判断 释的相 的溶液中各种
其他
及比较 关计算 量的变化
溶解度 2022
曲线
溶解度随 17 填空题 2分 温度变化
的趋势
饱和溶液 溶质质量 分数的 计算
微专题9 溶解度曲线及溶解度表
考查内容
计算饱和溶
配制等质
液与水混合
溶解度
溶解度相
2018 18 填空题 3分
所得溶液的
曲线
等的温度
溶质质量Βιβλιοθήκη 量饱和溶 液所需水 的质量
分数
比较
微专题9 溶解度曲线及溶解度表
考查内容
溶解度大 溶液稀释 温度变化引起 类型 年份 题号 题型 分值
小的判断 的相关 的溶液中各种
其他
及比较 计算
量的变化
计算稀释
物质与溶
微专题9 溶解度曲线及溶解度表
例2 如图是X、Y两种固体物质的溶解度曲线。下列说法正确的是( D ) A. t1 ℃时X的溶解度大于Y的溶解度 B. t2 ℃时X、Y饱和溶液中溶质质量相等 C. t3 ℃时50 g X的饱和溶液的溶质质量分数 小于100 g Y的饱和溶液的溶质质量分数 D. 在t1 ℃~t3 ℃之间X、Y物质能配制溶质 质量分数相同的饱和溶液
中考化学二轮复习溶解度及溶解度曲线

30
40
硝酸钾溶解度/g 13.3 20.9 31.6 45.8 63.9
⑴请利用上表给出的硝酸钾的 溶解度数据,在答题卡的坐标 图中绘制硝酸钾的溶解度曲 线。
知识应用
⑵“加热蒸发浓缩”操作时所用到的仪器除铁架台、陶土网、坩埚钳 外,还需要 玻璃棒、蒸发皿、酒精灯 。
⑶“冷却到一定温度”能获得较纯的硝酸钾晶体的原因是 KNO3 的溶解度随着温度的降低而显著减小,氯化钠量少且溶解度受温度影响
知识应用
5.甲、乙两种固体的溶解度曲线如右图所示。下列说法中,不正确的是 (D)
A. M点表示在20℃时,甲、乙的溶解度相同B. 20℃时,分 别在50 g水中加入50 g甲、乙,加热到40℃时,二者均为饱 和溶液C.40℃时,分别在100g水中加入50g甲、乙,所得溶 液中溶质的质量分数:甲大于乙D.40℃时,分别在100g水 中加入30g甲、乙,同时降温至20℃,析出固体质量:甲>乙
知识应用
7.下表为氯化钠和氯化铵在不同温度时的溶解度,回答下列问题:
温度/℃ NH4Cl溶解度/g NaCl溶解度/g
0 29.4 35.7
10 33.3 35.8
20 37.2 36.0
30 41.4 36.3
40 45.8 36.6
50 50.4 37.0
(1)由表中数据可知,溶解度随温度变化较大的物质是__N__H__4_C__l _______。
两种白色固体
碳酸钙、 氧化钙
主要操作、现象和结论
分别取适量两种固体于烧杯中,向其中加如足量水, 难溶于水的是碳酸钙,与水反应放热的是氧化钙。
知识应用
探究三:溶质在水中的溶解与结晶. 【查阅资料】 20℃时,五种物质的溶解度如下表.
2020中考化学基础知识分类演练——专题六十四:溶液(解析版)

2020中考化学基础知识分类演练——专题六十四:溶液考点一:溶液的形成1.下列物质不属于溶液的是()A. 冰水B. 碘酒C. 食盐水D. 浓盐酸2. 下列关于溶液的说法正确的是()A. 能溶解其他物质的物质叫做溶剂B. 凡是均一的、稳定的液体一定是溶液C. 溶液一定是无色透明的D. 饱和溶液一定是浓溶液3. 生活中的下列现象,能说明气体的溶解度随压强变化而变化的是()A. 夏季,鱼塘中的鱼常常会浮在水面呼吸B. 喝了汽水以后,常常会打嗝C. 打开汽水瓶盖,有大量气泡冒出D. 烧开水时,沸腾前水中有气泡产生4.如图所示,将少量液体X加入烧瓶中,观察到气球逐渐膨胀。
下表中液体X和固体Y的组合,符合题意的是()A ①② B. ①③ C. ①③④ D. ②③④5.指出下列溶液中的溶质和溶剂.(1)澄清石灰水中,溶质是_____,溶剂是_____.(2)医用酒精溶液中,溶质是_____,溶剂是_____.(3)白磷溶解在二硫化碳液体中所得的溶液里,溶质是_____,溶剂是_____.(4)锌和稀硫酸恰好完全反应后的溶液里,溶质是_____,溶剂是_____.(5)5%的氯化钠注射液,溶质是_____,溶剂是_____.考点二:饱和溶液与不饱和溶液1.能将不饱和KCl溶液变为饱和KCl溶液的方法是( )A 升高温度 B. 加水 C. 加KCl固体 D. 倒出部分溶液2.对于大多数固体溶质的不饱和溶液,要使之变为饱和溶液,可采取的方法有:①降低温度;②升高温度;③加入含相同溶质的浓溶液;④加入该固体溶质;⑤增大压强。
其中正确的方法有( )A. ①②③B. ②③④C. ③④⑤D. ①④3.如图所示,在室温下的饱和食盐水中放了一个塑料小球。
(1) 现加入少量食盐晶体,充分搅拌和静置后,在温度不变的情况下,小球在液面沉浮情况有何变化?并简述原因:____________。
(2) 若要在不用外力的情况下,使小球略上浮,你准备采取的具体方法是______________。
2020-2021中考化学化学溶解度(大题培优 易错 难题)及答案

2020-2021中考化学化学溶解度(大题培优易错难题)及答案一、初中化学溶解度1.下图是A、B、C三种物质的溶解度曲线,下列说法错误的是( )A.将t2℃时A、B、C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是C>B>AB.当A中含有少量B时,可以通过降温结晶的方法提纯AC.升高温度可使接近饱和的C溶液变为饱和D.t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A【答案】A【解析】A、由溶解度曲线可知,AB两种物质的溶解度随温度的升高而升高,C物质的溶解度随温度的升高和降低,将t2℃时A、B、C的饱和溶液同时降温至t1℃后AB两种物质仍然为饱和溶液,C为不饱和溶液,C溶液中溶质的质量分数不变,t1℃时B的溶解度大于A的溶解度,故B 的质量分数大于A 的质量分数,C 的质量分数小于B的质量分数,故错误;B、A的溶解度随温度的变化较大,B 的溶解度随温度的变化不大,故当A中含有少量B 时,可以通过降温结晶的方法提纯A,正确;C、由图可知,C物质的溶解度随温度的升高而降低,故升高温度可使接近饱和的C溶液变为饱和,正确;D、由图可知,t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A,正确。
故选A。
2.室温下,饱和食盐水露置在干燥的空气中,过一段时间后有少量固体析出,这是因为()A.氯化钠的溶解度减小了B.溶液中溶质的质量分数减小了C.溶剂质量减小了D.溶液变成不饱和溶液了【答案】C【解析】A、温度不变溶质的溶解度不变,错误;B、析出溶质后溶液仍为这一温度下的饱和溶液,溶质质量分数不变,错误;C、饱和食盐水露置在干燥的空气中,水分会不断蒸发减小,正确;D、析出溶质的溶液所剩溶液一定饱和,错误。
故选C。
点睛:在本题中蒸发溶剂,溶质会析出,始终保持室温时的饱和溶液。
3.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是()A.t2℃时,在两个各盛有100g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,所得甲、乙溶液中溶质的质量不等B.t1℃时,等质量甲、乙溶液中所含溶剂的质量甲等于乙C.乙中含有少量甲,可以用冷却热饱和溶液的方法提纯甲D.t2℃时,将甲、乙的饱和溶液降温至t1℃,甲溶液析出晶体的质量大于乙【答案】A【解析】试题分析:A、从溶解度曲线可看出,t2℃时,甲的溶解度=50g,而乙的溶解度<50g,故在两个各盛有l00g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,甲能全部溶解,而乙有剩余,故所得甲、乙溶液中溶质的质量不等,正确,B、t1℃时,甲、乙物质的溶解度相等,但没有指明是饱和溶液,故等质量甲、乙溶液中所含溶剂的质量甲不一定等于乙,错误, C、从溶解度曲线可看出,甲的溶解度随温度的升高变化较大,而乙的溶解度随温度的升高而变化较小,故乙中含有少量甲,可以用冷却热饱和溶液的方法提纯乙,错误,D、没有指明高温时的溶液是否是等质量,故无法判断析出晶体量的多少,错误,故选A考点:溶解度曲线的意义4.在0 ℃时,配成甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),如图所示。
