必修二有机物归纳
必修二化学有机总结

必修二化学有机总结一、有机化学基础知识1. 有机化学的定义有机化学是研究有机化合物及其反应规律的科学。
2. 元素的电子结构有机化学中最重要的元素是碳和氢。
碳元素的电子结构为 1s² 2s² 2p²,有四个价电子,可形成四个共价键。
3. 有机物的命名有机物的命名可采用系统命名法和常用名称两种方式。
其中,系统命名法通过规则确定化合物的命名,而常用名称则是根据它们的历史、地理或化学性质确定的。
4. 功能团有机物的功能团是由原子团组成的,能够赋予分子特定的化学性质。
一些常见的功能团包括烷基、烯基、炔基、羟基、醛基、酮基、羧基、胺基等。
二、有机反应的基本概念1. 有机反应的类型有机反应可以分为取代反应、加成反应、消除反应和重排反应等几种类型。
这些反应可以通过配分子方程式描述,并且具有一定的反应机理。
2. 功能团的反应不同的功能团通常会发生特定类型的反应,如烷烃会发生燃烧反应、烯烃会发生加成反应等。
了解不同功能团的反应特性有助于预测和理解化学反应的过程。
三、有机化合物的合成1. 合成方法有机化合物的合成方法多种多样,包括取代反应、加成反应、消除反应、重排反应等。
根据反应条件和反应物的不同,合成路线也会有所差异。
2. 保护基和去保护在有机化合物的合成过程中,为了保护某些功能团不发生不需要的反应,常常需要引入保护基。
合成完成后,再通过去保护反应将保护基去除。
3. 合成策略有机化合物的合成通常需要从较简单的起始物出发,通过多步反应逐步构建目标化合物的骨架。
因此,灵活的合成策略和适当的选择反应法则对于高效合成具有重要意义。
四、有机化合物的结构表征和性质研究方法1. 光谱分析光谱分析是研究化合物结构和性质的重要手段。
常用的有机化合物分析方法包括红外光谱、质谱、核磁共振等。
2. 结构确定通过解读和分析光谱数据,可以确定有机化合物的结构和功能团。
3. 化学性质研究通过实验手段,可以研究有机化合物的化学性质,如燃烧性质、溶解性质、反应性质等。
化学必修二有机物知识点总结

化学必修二有机物知识点总结一、碳的四种键合状态1.碳的单键: 在有机物中,碳元素通常以单键形式存在,单键的形成可以是碳原子与氢原子形成的C-H键,也可以是碳原子与碳原子形成的C-C键。
2.碳的双键: 碳的双键通常是由两个碳原子之间的σ键和一个π键组成。
碳的双键存在于不饱和的有机分子中,如烯烃类化合物。
3.碳的三键: 碳的三键通常是由两个σ键和两个π键组成,碳的三键存在于含有碳碳三键的炔烃类化合物中。
4.碳的四键: 在有机化合物中,碳通常通过形成共价键与其他碳原子和非金属元素形成四种键合状态。
碳的四键状态存在于部分不饱和的有机分子中。
二、有机化合物的命名规则有机化合物的命名通常遵循IUPAC命名法,根据分子结构和官能团名称进行命名。
有机化合物根据碳原子数目可以分为烷烃、烯烃、炔烃等,根据功能团可以分为醇、醛、酮、酸、酯等。
在命名时,需要注意官能团的位置、数量和顺序,以及碳链的长度和分支情况。
三、有机物的同分异构现象同分异构是指分子式相同但结构不同的有机物的现象。
同分异构可以分为链式异构、位置异构、官能团异构和环式异构等。
同分异构现象表明有机物的结构多样性,不同结构对应不同性质和用途。
四、醇、醛、酮、酸的结构与性质1. 醇是一个官能团为-OH的有机化合物,根据羢基所连接的碳原子数目可以分为一元醇、二元醇、三元醇等。
醇的性质包括醇的酸碱性、醇的水解性、醇的氧化性等。
2. 醛和酮是含有羰基的有机化合物,醛的分子结构中羰基连接在含有最小个碳原子数目的位置上,而酮的分子结构中羰基连接在含有两个碳原子的位置上。
醛和酮的性质包括醛和酮的氧化性、醛和酮的水解性等。
3. 酸是一个官能团为-COOH的有机化合物,酸的性质包括酸的酸碱性、酸的酯化性、酸的酐化性等。
五、酯的合成与性质酯是一个官能团为-COO-的有机化合物,酯的合成方法包括酯的醇酸酯化和酯的酸酯化两种方式。
酯的性质包括酯的水解性、酯的酸碱性、酯的酯化性等。
7.有机化合物(知识清单)-高中化学人教版(2019)必修二
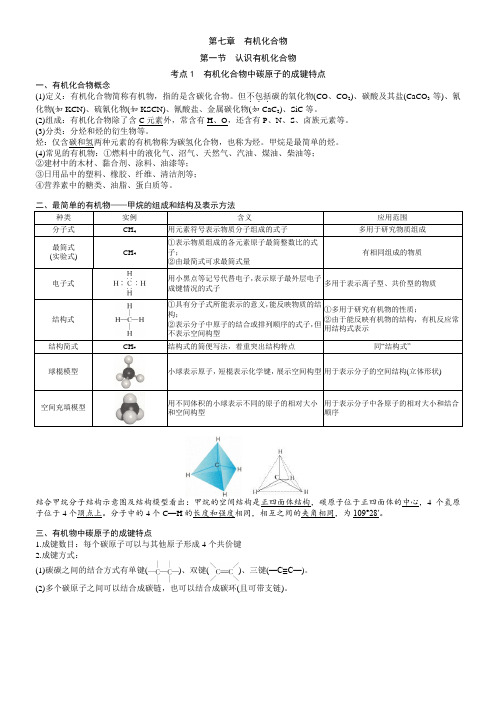
第七章有机化合物第一节认识有机化合物考点1 有机化合物中碳原子的成键特点一、有机化合物概念(1)定义:有机化合物简称有机物,指的是含碳化合物。
但不包括...碳的氧化物(CO、CO2)、碳酸及其盐(CaCO3等)、氰化物(如KCN)、硫氰化物(如KSCN)、氰酸盐、金属碳化物(如CaC2)、SiC等。
(2)组成:有机化合物除了含C元素外,常含有H、O,还含有P、N、S、卤族元素等。
(3)分类:分烃和烃的衍生物等。
烃:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
甲烷是最简单的烃。
(4)常见的有机物:①燃料中的液化气、沼气、天然气、汽油、煤油、柴油等;②建材中的木材、黏合剂、涂料、油漆等;③日用品中的塑料、橡胶、纤维、清洁剂等;④营养素中的糖类、油脂、蛋白质等。
二、最简单的有机物——甲烷的组成和结构及表示方法种类实例含义应用范围分子式CH4用元素符号表示物质分子组成的式子多用于研究物质组成最简式(实验式) CH4①表示物质组成的各元素原子最简整数比的式子;②由最简式可求最简式量有相同组成的物质电子式用小黑点等记号代替电子,表示原子最外层电子成键情况的式子多用于表示离子型、共价型的物质结构式①具有分子式所能表示的意义,能反映物质的结构;②表示分子中原子的结合或排列顺序的式子,但不表示空间构型①多用于研究有机物的性质;②由于能反映有机物的结构,有机反应常用结构式表示结构简式CH4结构式的简便写法,着重突出结构特点同“结构式”球棍模型小球表示原子,短棍表示化学键,展示空间构型用于表示分子的空间结构(立体形状)空间充填模型用不同体积的小球表示不同的原子的相对大小和空间构型用于表示分子中各原子的相对大小和结合顺序结合甲烷分子结构示意图及结构模型看出:甲烷的空间结构是正四面体结构,碳原子位于正四面体的中心,4个氢原子位于4个顶点上。
分子中的4个C—H的长度和强度相同,相互之间的夹角相同,为109°28′。
必修2有机物知识点总结

必修二有机物知识点总结1.有机物:含碳.化合物叫做有机化合物...,简称有机物。
(除CO、CO2、碳酸盐、碳化物、硫氰化物、氰化物等外)有机物一定含碳元素,但含碳元素的物质不一定是有机物。
3.有机物的组成:C、H、O、N、S、P、卤素等元素。
有机物种类繁多主要有以下几个原因:①碳原子最外电子层上有4个电子,可形成4个共价键;②有机化合物中,碳原子不仅可以与其他原子成键,而且碳碳原子之间也可成键;③碳碳原子之间可形成单键、双键或叁键,链状化合物,环状化合物;④相同组成的分子,结构可能有多种。
(同分异构体)4.烃:仅含碳和氢两种元素的有机物称为碳氢化合物,又叫烃甲烷和烷烃一、甲烷(最简单的烃)1.甲烷的物理性质无色、无味,极难溶于水,比空气轻,能燃烧的气体,熔沸点较低,难液化。
是天然气、坑气、沼气等的主要成分。
2、甲烷的分子结构电子式:结构式:分子式:CH4立体构型:以碳原子为中心,四个氢原子为顶点的正四面体结构。
(非极性分子)3、甲烷的化学性质(较稳定) (1)甲烷的氧化反应CH 4+2O 2−−→−点燃CO 2+2H 2O 火焰呈淡蓝色 (火焰呈淡蓝色的有:CH 4、H 2、CO 、H 2S )在通常条件下,甲烷不与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
(2)甲烷的取代反应取代反应 :有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
甲烷与氯气反应现象:①量筒内Cl 2的黄绿色逐渐变浅,最后消失。
②量筒内壁出现了油状液滴。
③量筒内水面上升。
④量筒内产生白雾在常温下,一氯甲烷为气体,其他三种都是液体,三氯甲烷(氯仿)和四氯甲烷(四氯化碳)是工业重要的溶剂,四氯化碳还是实验室里常用的溶剂、灭火剂,氯仿与四氯化碳常温常压下的密度均大于水。
(3)甲烷的受热分解CH 4−−→−高温C+2H 2 (隔绝空气并加热至1000度以上)炭黑是橡胶工业的原料,氢气是合成氨和合成汽油等工业的原料。
化学必修二有机物知识点总结

化学必修二有机物知识点总结有机物是由碳元素构成的化合物。
它们的特点是含有碳-碳键或碳-氢键,并且在自然界中广泛存在。
在化学必修二中,我们学习了许多关于有机物的知识点,以下是对这些知识点的总结。
1. 碳的四价:碳原子有四个价电子,可以形成四个共价键。
这使得碳能够与其他元素形成多种化合物。
2. 烷烃:烷烃是由碳和氢组成的碳氢化合物。
它们的特点是碳原子形成单键。
烷烃可以按照碳原子的排列方式分为直链烷烃和支链烷烃。
3. 烯烃:烯烃是由碳和氢组成的碳氢化合物。
它们的特点是碳原子形成一个或多个双键。
烯烃可以按照双键位置分为1-烯烃和2-烯烃。
4. 炔烃:炔烃是由碳和氢组成的碳氢化合物。
它们的特点是碳原子形成一个或多个三键。
5. 醇:醇是由碳、氢和氧组成的有机化合物。
它们的特点是至少有一个羟基(-OH)官能团。
醇可以按照羟基位置分为一元醇、二元醇和多元醇。
6. 醚:醚是由碳、氢和氧组成的有机化合物。
它们的特点是含有一个氧原子连接两个碳原子。
7. 醛:醛是由碳、氢和氧组成的有机化合物。
它们的特点是含有一个羰基(-C=O)官能团。
醛可以按照羰基位置分为一元醛、二元醛和多元醛。
8. 酮:酮是由碳、氢和氧组成的有机化合物。
它们的特点是含有一个羰基(-C=O)官能团,羰基连接两个碳原子。
9. 酸:酸是由碳、氢和氧组成的有机化合物。
它们的特点是含有一个羧基(-COOH)官能团。
酸可以按照羧基位置分为一元酸、二元酸和多元酸。
10. 酯:酯是由碳、氢和氧组成的有机化合物。
它们的特点是含有一个酯基(-COO-)官能团。
酯可以通过醇和酸的酯化反应得到。
11. 脂肪酸:脂肪酸是一种高级饱和羧酸。
它们的特点是含有长的碳链,通常在12至18碳的范围内。
12. 氨基酸:氨基酸是一种包含氨基和羧基的有机化合物。
它们是蛋白质的基本组成单位。
13. 聚合物:聚合物是由重复单元组成的大分子化合物。
它们的特点是由单体通过共价键连接在一起形成高分子链。
高一化学必修二有机总结

高一化学必修二有机总结.doc高一化学必修二有机化学总结引言:有机化学是化学学科中的一个重要分支,它主要研究碳及其化合物的性质、结构和反应。
高一化学必修二课程为学生提供了有机化学的基础知识和理论框架。
以下是对高一化学必修二有机化学部分的知识点总结。
一、有机化合物概述有机化合物的定义:主要由碳和氢组成的化合物。
有机化合物的特点:碳原子能够形成四个共价键,形成链状或环状结构。
二、有机化合物的命名烷烃的命名:根据碳原子数目和结构进行命名。
烯烃和炔烃的命名:烯烃含有一个碳碳双键,炔烃含有一个碳碳三键,命名时考虑双键或三键的位置。
芳香烃的命名:含有苯环的化合物,根据取代基的种类和位置进行命名。
三、有机化合物的物理性质熔沸点:受分子间作用力影响,分子量越大,熔沸点越高。
溶解性:有机化合物通常易溶于有机溶剂,难溶于水。
四、有机化合物的化学性质饱和烃:碳原子之间只有单键,化学性质较稳定。
不饱和烃:含有双键或三键,化学性质较活泼,易发生加成反应。
芳香烃:具有特殊的稳定性,易发生取代反应。
五、有机化学反应类型取代反应:有机分子中的原子或原子团被其他原子或原子团替换。
加成反应:不饱和化合物与另一个分子中的原子或原子团结合,形成新的化合物。
消除反应:有机分子失去小分子(如水、卤化氢),形成不饱和化合物。
重排反应:有机分子中的原子或原子团发生重新排列。
六、有机合成逆合成分析:从目标分子出发,逆向分析合成路径。
保护基团:在有机合成中,保护活性基团,防止其参与不需要的反应。
催化剂:在有机合成中,催化剂可以加速反应速率。
七、有机波谱分析红外光谱:分析有机分子中的化学键和官能团。
核磁共振:分析分子中氢原子的化学环境。
质谱:分析有机分子的分子量和结构。
八、有机高分子化合物聚合物的分类:根据结构和性质,聚合物可以分为塑料、橡胶、纤维等。
聚合反应:通过单体分子的加成反应形成高分子化合物。
高分子的物理性质:高分子的物理性质受分子链结构和分子量的影响。
高中高一化学必修二有机物学习知识点

高一化学必修二有机物知识点有机化合物主要由氧元素、氢元素、碳元素构成。
有机物是生命产生的物质基础。
其特色主要有:多半有机化合物主要含有碳、氢两种元素,别的也常含有氧、氮、硫、卤素、磷等。
部分有机物来自植物界,但绝大部分是以石油、天然气、煤等作为原料,经过人工合成的方法制得。
和无机物对比,有机物数量众多,可达几百万种。
有机化合物的碳原子的联合能力特别强,相互能够联合成碳链或碳环。
碳原子数量能够是 1、2 个,也能够是几千、几万个,很多有机高分子化合物甚至能够有几十万个碳原子。
别的,有机化合物中同分异构现象特别广泛,这也是造成有机化合物众多的原由之一。
有机化合物除少量之外,一般都能焚烧。
和无机物相比,它们的热稳固性比较差,电解质受热简单分解。
有机物的熔点较低,一般不超出 400 ℃。
有机物的极性很弱,所以大多不溶于水。
有机物之间的反响,大多是分子间反响,常常需要必定的活化能,所以反响迟缓,常常需要催化剂等手段。
并且有机物的反响比较复杂,在相同条件下,一个化合物常常能够同时进行几个不同的反响,生成不同的产物。
食品中的有机化合物 :1.人体所需的营养物质:水、糖类(淀粉)、脂肪、蛋白质、维生素、矿物质此中,淀粉、脂肪、蛋白质、维生素为有机物。
2.淀粉(糖类)主要存在于大米、面粉等面食中;油脂主要存在于食用油、冰激凌、牛奶等;维生素主要存在于蔬菜、水果等;蛋白质主要存在于鱼、肉、牛奶、蛋等;纤维素主要存在于青菜中,有益于胃的蠕动,防备便秘。
此中淀粉、脂肪、蛋白质、纤维素是有机高分子有机化合物。
分类 :一.依据碳原子联合而成的基本骨架不同,有机化合物被分为三大类: 1.链状化合物这种化合物分子中的碳原子相互连结成链状,因其最先是在脂肪中发现的,所以又叫脂肪族化合物。
2.碳环化合物这种化合物分子中含有由碳原子构成的环状构造 [2] ,故称碳环化合物。
它又可分为两类:脂环族化合物:是一类性质和脂肪族化合物相像的碳环化合物。
必修二有机化学知识点

必修二有机化学知识点有机化合物主要是由碳元素、氢元素组成,是一定含碳的化合物,但是不包括碳的氧化物。
有机化学你又知道都少?今天就让小编为你整理必修二有机化学知识点。
必修二有机化学知识点(一)1、各类有机物的通式、及主要化学性质烷烃CnH2n+2 仅含C—C键与卤素等发生取代反应、热分解、不与高锰酸钾、溴水、强酸强碱反应烯烃CnH2n 含C==C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应、加聚反应炔烃CnH2n-2 含C≡C键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应苯(芳香烃)CnH2n-6与卤素等发生取代反应、与氢气等发生加成反应(甲苯、乙苯等苯的同系物可以与高锰酸钾发生氧化反应)卤代烃:CnH2n+1X醇:CnH2n+1OH或CnH2n+2O 有机化合物的性质,主要抓官能团的特性,比如,醇类中,醇羟基的性质:1.可以与金属钠等反应产生氢气,2.可以发生消去反应,注意,羟基邻位碳原子上必须要有氢原子,3.可以被氧气催化氧化,连有羟基的碳原子上必要有氢原子。
4.与羧酸发生酯化反应。
5.可以与氢卤素酸发生取代反应。
6.醇分子之间可以发生取代反应生成醚。
苯酚:遇到FeCl3溶液显紫色醛:CnH2nO 羧酸:CnH2nO2 酯:CnH2nO22、取代反应包括:卤代、硝化、卤代烃水解、酯的水解、酯化反应等;3、最简式相同的有机物,不论以何种比例混合,只要混和物总质量一定,完全燃烧生成的CO2、H2O及耗O2的量是不变的。
恒等于单一成分该质量时产生的CO2、H2O和耗O2量。
4、可使溴水褪色的物质如下,但褪色的原因各自不同:烯、炔等不饱和烃(加成褪色)、苯酚(取代褪色)、醛(发生氧化褪色)、有机溶剂[CCl4、氯仿、溴苯(密度大于水),烃、苯、苯的同系物、酯(密度小于水)]发生了萃取而褪色。
较强的无机还原剂(如SO2、KI、FeSO4等)(氧化还原反应)5.能使高锰酸钾酸性溶液褪色的物质有:(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物(2)含有羟基的化合物如醇和酚类物质(3)含有醛基的化合物(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O26.能与Na反应的有机物有:醇、酚、羧酸等——凡含羟基的化合物7、能与NaOH溶液发生反应的有机物:(1)酚: (2)羧酸: (3)卤代烃(水溶液:水解;醇溶液:消去) (4)酯:(水解,不加热反应慢,加热反应快) (5)蛋白质(水解)8.能发生水解反应的物质有:卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐9、能发生银镜反应的有:醛、甲酸、甲酸某酯、葡萄糖、麦芽糖(也可同Cu(OH)2反应)。
化学必修二有机物知识点总结

化学必修二有机物知识点总结一、有机化合物的基本概念1. 定义:含有碳元素的化合物称为有机化合物,简称有机物。
2. 特性:有机物具有多样性、复杂性、可燃性、反应活性高等特性。
3. 分类:根据碳原子的连接方式和官能团的不同,有机物可分为烃、醇、酮、酸、酯、胺等。
二、烃的分类与性质1. 烃的分类- 饱和烃:碳原子之间只有单键连接,如甲烷、乙烷。
- 不饱和烃:碳原子之间含有双键或三键,如乙烯、乙炔。
2. 命名规则- 烷烃:以“某烷”命名,如甲烷(CH4)、乙烷(C2H6)。
- 烯烃:以“某烯”命名,如乙烯(C2H4)。
- 炔烃:以“某炔”命名,如乙炔(C2H2)。
3. 物理性质- 低分子量的烃为气体,分子量增加则为液体或固体。
- 烃的沸点和熔点随分子量的增加而升高。
4. 化学性质- 饱和烃主要发生取代反应。
- 不饱和烃容易发生加成反应。
三、官能团与衍生物1. 官能团- 官能团是决定有机物化学性质的原子团。
- 常见官能团包括羟基(-OH)、羰基(C=O)、羧基(-COOH)等。
2. 衍生物的命名- 以母体命名,如醇的衍生物称为“某醇”,酸的衍生物称为“某酸”。
- 位置编号:从官能团最近的碳原子开始编号。
3. 常见衍生物的性质- 醇:易溶于水,可发生酯化反应。
- 酮:极性较强,不易溶于水。
- 酸:具有酸性,可与碱反应生成盐和水。
- 酯:具有芳香气味,易挥发。
四、同分异构体1. 定义:分子式相同但结构不同的有机物称为同分异构体。
2. 类型- 碳链异构:碳原子的连接顺序不同。
- 位置异构:官能团在碳链上的位置不同。
- 立体异构:分子的空间构型不同。
五、有机化学反应1. 取代反应- 饱和烃的氢原子被其他原子或原子团取代。
2. 加成反应- 不饱和烃的双键或三键断裂,加入其他原子或原子团。
3. 消除反应- 有机物脱去小分子生成不饱和化合物。
4. 酯化反应- 醇与酸反应生成酯和水。
5. 缩合反应- 有机物分子间发生反应,形成新的化合物并脱去小分子。
高中化学必修二第三章 有机化合物知识点归纳

乙醇和乙酸
要点:1、乙醇的分子结构及反应机理:与Na、催化氧化、燃烧 、消去反应、酯化反应机理
2、羟基与氢氧根的比较:前者不显电性、不能独立存在;后者 带一个单位负电荷、能独立存在于离子晶体或溶液中
3、不同环境中氢原子的活泼性
考点: 9、烷烃、烯烃、炔烃、苯、苯的同系物性质的比较
液溴
溴水
溴的CCl4溶液 KMnO4(H+)溶液
烷烃
溴蒸气、光照 下取代反应
不反应,液态 烷烃萃取
不反应,互溶 不褪色
不反应
烯烃 常温加成褪色 常温加成褪色 常温加成褪色 氧化褪色
炔烃 常温加成褪色 常温加成褪色 常温加成褪色
苯
一般不反应, 不反应,发生 不反应,互溶
乙烯和苯
考点:1、乙烯的氧化反应、加成反应中问题的比较: a.甲烷与乙烯燃烧现象的比较:烟 b.乙烯通入溴水和溴的四氯化碳溶液中现象比较:前者褪色分层 c.甲烷和乙烯与酸性KMnO4溶液反应的比较:只有后者褪色 d.制氯乙烷用乙烯与HCl加成和用乙烷与Cl2取代的比较:后不纯 2、烃燃烧的计算规律:
不能发生反应
H2、X2、HX、H2O、HCN等加成 火焰明亮带黑烟 火焰很明亮带浓黑烟
KMnO4(H+)溶液褪色
发生反应
KMnO4(H+)溶液褪色
发生反应
鉴别 用途
Br2/KMnO4(H+)不褪色
Br2、KMnO4(H+)均褪色
燃料、化工原料 植物生长调节剂、原料 | 氧炔焰、化工原料
有机化学基础
有机化学基础
考点: 14、苯、甲苯、苯酚的性质比较
化学必修二有机物知识点总结

化学必修二有机物知识点总结
有机物的定义和特性:有机物是指含有碳元素的化合物(除了碳的氧化物、碳酸、碳酸盐、碳的金属化合物等)。
有机物具有种类多、大多难溶于水、易溶于有机溶剂、易分解、易燃烧、熔点低、难导电、大多是非电解质、反应慢且常有副反应等特性。
烃类:烃是只由碳和氢两种元素组成的碳氢化合物,例如烷烃、烯烃和炔烃。
烷烃是分子组成最简单的烃,如甲烷是一种无色、无味的气体,极难溶于水,密度小于空气。
含氧衍生物:含氧衍生物是由碳、氢和氧组成的有机化合物,包括醇、醚、醛、酮、酸和酯等。
醇可以按照羟基位置分为一元醇、二元醇和多元醇。
酸的特点是含有一个羧基(-COOH)官能团。
其他有机物:如脂肪酸是一种高级饱和羧酸,其特点是含有长的碳链,通常在12至18碳的范围内。
氨基酸是一种包含氨基和羧基的有机化合物,是蛋白质的基本组成单位。
有机物的溶解性:一般来说,各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的醇、醛、羧酸等难溶于水,而易溶于有机溶剂。
低级的醇、醛、酮、羧酸及盐、氨基酸及盐、单糖、二糖等易溶于水。
有机物的反应:有机物经常参与的反应包括取代反应、加成反应、消去反应等。
此外,一些有机物能使酸性高锰酸钾溶液褪色,如含有C=C、—C≡C—、—OH (较慢)、—CHO的物质,以及苯环相连的侧链碳上有氢原子的苯的同系物(但苯不反应)。
以上知识点是化学必修二有机物部分的主要内容,需要配合教材和课堂讲解进行深入理解和记忆。
同时,通过大量的练习和实验,可以加深对有机物性质和反应的理解。
高中必修二有机物总结
第三章 有机化合物
绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO 、CO 2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
一、烃
1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、烃的分类:
饱和烃→烷烃(如:甲烷)
脂肪烃(链状
)
烃 不饱和烃→烯烃(如:乙烯)
芳香烃(含有苯环)(如:苯)芳香烃的通式是C n H 2n-6 34、烷烃的命名:
(1)普通命名法:把烷烃泛称为“某烷”,某是指烷烃中碳原子的数目。
1-10用甲,乙,丙,丁,戊,已,庚,辛,壬,癸;11起汉文数字表示。
区别同分异构体,用“正”,“异”,“新”。
正丁烷,异丁烷;正戊烷,异戊烷,新戊烷。
(2)系统命名法:
①命名步骤:(1)找主链-最长的碳链(确定母体名称);(2)编号-靠近支链(小、多)的一端;
(3)写名称-先简后繁,相同基请合并.
②名称组成:取代基位置-取代基名称母体名称
③阿拉伯数字表示取代基位置,汉字数字表示相同取代基的个数 CH 3-CH -CH 2-CH 3 CH 3-CH -CH -CH 3 CH 3 CH 3 CH 3 2-甲基丁烷 2,3-二甲基丁烷 7、比较同类烃的沸点:
①一看:碳原子数多沸点高。
②碳原子数相同,二看:支链多沸点低。
常温下,碳原子数1-4的烃都为气体。
使酸性KMnO
二、烃的衍生物
三、基本营养物质
食物中的营养物质包括:糖类、油脂、蛋白质、维生素、无机盐和水。
人们习惯称糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质。
化学必修二有机物知识点总结

化学必修二有机物知识点总结化学是一门研究物质性质、组成和变化的科学,而有机化学则是研究有机物的组成、性质和反应的分支学科。
在化学必修二课程中,我们学习了许多有机化合物的知识。
本文将对这些知识点进行总结,帮助我们更好地理解有机化学的基本概念和重要原理。
一、有机物的定义和特点有机物是指含有碳元素并且能够由生物体合成的化合物。
在有机物中,碳原子构成了其主要骨架,且与其他原子通过共价键结合。
有机物的一大特点是其丰富的多样性和复杂性,由于碳原子能够形成四价键,因此可以形成非常多的化合物。
二、有机化合物的命名方法为了方便区分和命名不同的有机化合物,我们采用了一系列命名规则。
有机化合物的命名方法包括命名原则、命名前缀和命名后缀。
常见的命名方法有系统命名法(根据化合物结构和功能团进行命名)、通用命名法(使用常见化合物的普通名称进行命名)和化学式命名法(根据化合物的化学式进行命名)等。
三、饱和烃和不饱和烃有机化合物可以分为两大类:饱和烃和不饱和烃。
饱和烃是由碳和氢组成的化合物,其分子中只含有碳—碳单键和碳—氢单键,如烷烃和环烷烃。
而不饱和烃则包括烯烃和炔烃,其中烯烃含有碳—碳双键,炔烃则含有碳—碳三键。
四、官能团和官能化合物官能团是有机化合物分子中含有的具有一定化学性质和特点的基团。
它们决定了有机化合物的性质和反应。
常见官能团包括羟基、羰基、羧基、胺基等。
官能化合物是指含有特定官能团的有机化合物。
五、有机物的化学性质有机化合物具有多样的化学性质。
其中,烷烃是相对稳定的,不易发生反应;而烯烃和炔烃由于含有不饱和键,具有较高的反应活性。
此外,醇、酸、醛、酮、酯、胺等官能化合物都有不同的化学性质和反应特点。
六、有机物的合成有机合成是指通过一系列化学反应,将简单的有机化合物转化为目标化合物的过程。
有机合成是一门高度挑战性的科学,需要熟练掌握反应机理和条件。
常见的有机合成方法包括加成反应、取代反应、消除反应、重排反应等。
七、有机物的重要应用有机化合物在生活和工业中具有广泛的应用。
高一化学必修二第三章--有机化合物知识点总结

高一化学必修二第三章--有机化合物知识点总结第三章:有机化合物知识点总结绝大多数含碳的化合物都被称为有机化合物,简称有机物。
少数化合物,如CO、CO2碳酸、碳酸盐、金属碳化物等,属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:有机物 | 通式 | 代表物 | 结构简式(官能团) | 结构特点 | 空间结构 | 物理性质 | 用途 |烷烃 | CnH2n+2 | 甲烷(CH4) | CH4 | 单键,链状,饱和烃 | 正四面体 | 无色稍有气味的气体,比空气略轻,难溶于水 | 石化工业原料,植物生长调节剂,催熟剂 |烯烃 | CnH2n | 乙烯(C2H4) | CH2=CH2 | 双键,链状,不饱和烃(证明:加成、加聚反应) | 六原子共平面 | 无色有特殊气味的液体,密度比水小,难溶于水 | 优良燃料,化工原料|芳香烃 | C6H6 | 苯(C6H6) | 一种介于单键和双键之间的独特的键(证明:邻二位取代物只有一种),环状平面正六边形| 无色无味的气体,比空气轻,难溶于水 | 有机溶剂,化工原料 |3、烃类有机物化学性质1、甲烷的性质比较稳定,不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色,与强酸、强碱也不反应。
2、燃烧反应(氧化反应):CH42O2CO22H2O(淡蓝色火焰)。
3、取代反应(条件:光;气态卤素单质;以下四反应同时进行,产物有5种):①甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐步被氯原子取代。
②反应能生成五种产物,四种有机取代产物都不溶于水,常温下,一氯甲烷是气体,其他是液体,三氯甲烷称氯仿,四氯甲烷可作灭火剂;产物中HCl气体产量最多。
③取代关系:1H~~Cl2④烷烃取代反应是连锁反应,产物复杂,多种取代物同时存在。
4、高温分解:CH4XXX2够的Na反应生成2mol氢气,而1mol水只生成1mol氢气。
高一化学必修2有机化合物章节知识点总结

化学:高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应CH3CHO+2[Ag(NH3)2]+ +2H2O=加热=CH3COO- +2Ag↓+3NH4+ +NH3·H2O (2)、乙酸乙酯的水解CH3COOC2H5+H2O=CH3COOH+C2H5OH(酸的条件下)CH3COOC2H5+NaOH=CH3COONa+C2H5OH(碱的条件下)在酸性条件下是可逆反应碱性条件下不可逆,因为生成了CH3COONa酯化的时候CH3COOH提供OH, C2H5OH提供H(3)苯的硝化C6H6+HNO3(浓)==浓硫酸,加热===C6H5-NO2+H2O 苯和反应生成硝基苯和水。
反应类型是取代反应。
(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有:(1)、实验室制乙烯(170℃)CH3CH2OH_→(浓硫酸,加热)CH2=CH2↑+H2O②浓H2SO4的作用是_催化剂,脱水剂_ ③混合液滴加的先后顺序是_先加入1体积酒精,再缓慢加入3体积浓硫酸_ ④迅速升温至170℃的原因是_防止酒精碳化____ ⑤有效控制反应混合液温度的方法是_用温度计测量反应温度____ ⑥反应后阶段的混合液常变黑,并有刺激性气体生成,除去气体的方法是_通入饱和碳酸氢钠溶液中除去二氧化硫,再通入氢氧化钠溶液中除去二氧化碳_⑦收集乙烯只能用排水法,其原因是_乙烯密度接近于空气(2)、蒸馏(3)、固体溶解度的测定(4)、乙酸乙酯的水解(70-80℃)(5)、中和热的测定(6)制硝基苯(50-60℃)〔说明〕:(1)凡需要准确控制温度者均需用温度计。
(2)注意温度计水银球的位置。
3.能与Na反应的有机物有:醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有:醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
化学必修二有机物知识点总结

化学必修二有机物知识点总结(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如工作报告、工作计划、活动方案、规章制度、演讲致辞、合同协议、条据文书、教学资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of classic sample essays, such as work reports, work plans, activity plans, rules and regulations, speeches, contract agreements, documentary evidence, teaching materials, complete essays, and other sample essays. If you would like to learn about different sample formats and writing methods, please pay attention!化学必修二有机物知识点总结化学必修二有机物知识点总结(归纳)在高二化学的学习中,是否曾经也有过感慨,有机化学虐我千百遍,我始终待它初恋?那么,以下是本店铺为大家带来的化学必修二有机物知识点总结(归纳),欢迎参阅呀!化学必修二有机物知识点总结(归纳)1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
必修2有机物较全的知识点总结

一、化石燃料化石燃料:煤、石油、天然气天然气的主要成分:CH4石油的组成元素主要是碳和氢,同时还含有S、O、N等。
主要成分各种液态的碳氢化合物,还溶有气态和固态的碳氢化合物煤是有机化合物和无机化合物所组成的复杂的混合物。
煤的含量是C其次H、O二、结构1、甲烷:分子式:CH4结构式:电子式正四面体结构天然气三存在:沼气、坑气、天然气2、化学性质一般情况下,性质稳定,跟强酸、强碱或强氧化剂不反应(1)、氧化性CH4+2O2−−→−点燃CO2+2H2O;△H<0CH4不能使酸性高锰酸甲褪色(2)、取代反应取代反应:有机化合物分子的某种原子(或原子团)被另一种原子(原子团)所取代的反应CH4+Cl2−−→−光照CH3Cl+HClCH3Cl+Cl2−−→−光照CH2Cl2+ HClCH2Cl2+Cl2−−→−光照CHCl3+ HClCHCl3+Cl2−−→−光照CCl4+ HCl(3)主要用途:化工原料、化工产品、天然气、沼气应用三、乙烯石油炼制:石油分馏、催化裂化、裂解催化裂化:相对分子量较小、沸点教小的烃裂解:乙烯、丙烯老等气态短链烃石油的裂解已成为生产乙烯的主要方法1、乙烯分子式:C2H4结构简式:CH2==CH2结构式2、乙烯的工业制法和物理性质6个原子在同一平面上工业制法:石油化工3、物理性质常温下为无色、无味气体,比空气略轻,难溶于水4、化学性质(1)氧化性①可燃性现象:火焰明亮,有黑烟原因:含碳量高②可使酸性高锰酸钾溶液褪色(2)加成反应有机物分子中双键(或叁键)两端的碳原子上与其他的原子或原子团直接结合生成新的化合物的反应现象:溴水褪色CH2=CH2+H2O−−→−催化剂CH3CH2OH(3)加聚反应聚合反应:由相对分子量小的化合物互相结合成相对分子量很大的化合物。
这种由加成发生的聚合反应叫加聚反应乙烯聚乙烯用途:1、石油化工基础原料2、植物生长调节剂催熟剂评价一个国家乙烯工业的发展水平已经成为衡量这个国家石油化学工业的重要标志之一四、煤的综合利用苯1、煤的气化、液化和干馏是煤综合利用的主要方法煤的气化:把煤转化为气体,作为燃料或化工原料气煤的液--燃料油和化工原料干馏2、苯(1)结构(2)物理性质无色有特殊气味的液体,熔点5.5℃沸点80.1℃,易挥发,不溶于水易溶于酒精等有机溶剂(3)化学性质①氧化性a.燃烧2C6H6+15O2−−→−点燃12CO2+6H2OB.不能使酸性高锰酸钾溶液褪色②取代反应硝化反应用途:基础化工原料、用于生产苯胺、苯酚、尼龙等第二单元食品中的有机化合物一、乙醇1、结构结构简式:CH3CH2OH 官能团-OH医疗消毒酒精是75%2、氧化性①可燃性CH3CH2OH+3O2−−→−点燃2CO2+3H2O②催化氧化2CH3CH2OH+O2−→−∆催化剂2 CH3CHO+2H2O断1 、3键2 CH3CHO+ O2−→−催化剂2 CH3COOH3、与钠反应2CH3CH2OH+2Na−→−2CH3CH2ONa +H2↑用途:燃料、溶剂、原料,75%(体积分数)的酒精是消毒剂二、乙酸1、结构分子式:C2H4O2,结构式:结构简式CH3COOH2、酸性;CH3COOH CH3COO-+H+酸性:CH3COOH>H2CO32CH3COOH+Na2CO3→2CH3COONa+H2O+CO2↑3、酯化反应醇和酸起作用生成脂和水的反应叫酯化反应CH3CH2OH+CH3COOH−→−∆催化剂CH3COOCH2CH3+H2O反应类型:取代反应反应实质:酸脱羟基醇脱氢浓硫酸:催化剂和吸水剂饱和碳酸钠溶液的作用:(1)中和挥发出来的乙酸(便于闻乙酸乙脂的气味)(1)吸收挥发出来的乙醇(3)降低乙酸乙脂的溶解度总结:三、酯油脂结构:RCOOR′乙酸乙脂:水果、花卉芳香气味油:植物油(液态)油脂脂:动物脂肪(固态)油脂在酸性和碱性条件下水解反应皂化反应:油脂在碱性条件下水解反应甘油应用:(1)食用(2)制肥皂、甘油、人造奶油、脂肪酸等四、糖类分子式通式Cn(H2O)m1、分类单糖:葡萄糖C6H12O6糖类二糖:蔗糖:C12H22O11多糖:淀粉、纤维素(C6H10O5)n2、性质葡萄糖(1)氧化反应葡萄糖能发生银镜反应(光亮的银镜)与新制Cu(OH)2反应(红色沉淀)证明葡萄糖的存在检验病人的尿液中葡萄糖的含量是否偏高(2)人体组织中的氧化反应提供生命活动所需要的能量C6H12O6(S)+6O2(g)==6CO2+6H2O(l)△H=-12804KJ·mol-1C6H12O6−−→−酒化酶2C2H5OH+2CO2↑淀粉1、水解五、蛋白质与氨基酸1、组成元素:C 、H、O、N等,有的有S、P2、性质(1)蛋白质是高分子化合物,相对分子质量很大(2)★盐析:蛋白质溶液中加入浓的无机盐溶液,使蛋白质的溶解度降低从而析出(3)★变性:蛋白质发生化学变化凝聚成固态物质而析出(4)颜色反应:蛋白质跟许多试剂发生颜色反应(5)气味:蛋白质灼烧发出烧焦羽毛的特殊气味(6)蛋白质水解生成氨基酸蛋白质氨基酸氨基酸结构通式:甘氨酸丙氨酸必需氨基酸:人体不能合成,必须通过食物摄入丝氨酸、缬氨酸、赖氨酸、异亮氨酸、苯丙氨酸、蛋氨酸、亮氨酸、苏氨酸一、简单有机合成注意化工生产“绿色化学”二、有机高分子合成1、乙烯合成聚乙烯------食品包装袋、保险膜2、聚苯乙烯-----玩具、泡沫塑料n3聚氯乙烯----薄膜有机高分子的合成为人类提供了大量的新材料,使我们的生活变的更加丰富多彩有机物的系统命名法1、烷烃的系统命名法⑴定主链:就长不就短。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四、苯 平面正六边形,六个碳碳键完全 相同,是介于单键和双键之间特殊的键。
四、乙醇的化学性质 1、氧化反应(燃烧、催化氧化、被高锰酸钾及 重铬酸钾氧化) 2、不钠的取代反应(-OH不Na按1:1反应) 3、消去反应(170℃、浓硫酸) 4、分子间脱水(140℃、浓硫酸)
五、乙酸的化学性质
1、酸的通性 (1)使指示剂变色 (2)不金属反应(Na) (3)不金属氧化物反应 (4)不碱反应(NaOH) (5)不盐反应(NaHCO3 或Na2CO3 反应放出 CO2) 2、酯化反应 原理:酸脱羟基醇脱氢 酯化反应是可逆反应; 条件:浓硫酸、加热
六、酯的性质 水解反应:(1)酸性条件下水解为羧酸和醇 (2)碱性条件下水解为羧酸盐和醇 七、各种通式 烷烃的通式:CnH2n+2(n≥1) 烯烃的通式: CnH2n( n≥2) 饱和一元醇通式: CnH2n+2O( n≥1 ) 饱和一元羧酸通式: CnH2nO2( n≥1 )
营养物质的性质
一、葡萄糖特征反应 1、不新制氢氧化铜反应,有砖红色反应; 2、不银氨溶液反应,有光亮的银出现。 以上两个反应都要在碱性条件下进行。 二、淀粉的特征反应:遇碘变蓝色。
三、蛋白质的特征反应:(1)颜色反应
(2)有烧焦羽毛的气味。
1、植物油中有碳碳双键;动物油中无碳 碳双键。
2、油脂丌是高分子化合物;是高级脂肪酸的 甘油酯;主要性质是水解。酸性条件下水解得 高级脂肪酸和甘油;在碱性条件下的水解称皂 化反应,水解得高级脂肪酸盐和甘油。高级脂 肪酸盐和甘油都溶于水。
四、油脂
有机物的化学性质归纳总结
一、甲烷的化学性质 1、氧化反应(燃烧) 2、取代反应(不纯气态的Cl2 或Br2 在光照下反应) 二、乙烯的化学性质
1、氧化反应(燃烧、被高锰酸钾氧化)
2、加成反应(溴水、H2、HBr、 HCl 、 H2O等)
3、加聚反应
三、苯的化学性质 1、氧化反应(燃烧) 2、取代反应(液溴、浓硝酸) 3、加成反应反应(苯不氢气按1:3反应)
几种有机物的物理性质
一、常温下是气体的:碳原子的个数小于等于 4 的烃均为气体。 二、丌溶于水的液体有:苯、溴苯、1,2-二溴 乙烷、乙酸乙酯、硝基苯、四氯化碳、氯仿。 三:硝基苯 不苯、溴苯不苯互溶。溴易溶于有机溶剂。
常见有机物的结构
