铝 金属材料知识点总结
铝材设计知识点总结图

铝材设计知识点总结图一、引言铝材作为一种常见的金属材料,在工程设计中有着广泛的应用。
本文将总结铝材设计的关键知识点,并以图文形式呈现。
以下是铝材设计知识点的总结图:二、铝材的物理性能1. 密度:铝材相较于其他金属具有较低的密度,重量轻,便于携带和加工。
2. 熔点:铝材的熔点较低,约为660摄氏度,熔化过程较容易控制。
3. 导电性能:铝材具有良好的导电性能,可以广泛应用于电子设备等领域。
4. 导热性能:铝材具有较好的导热性能,适用于制造散热器等产品。
三、铝材的优点1. 良好的可塑性:铝材可以通过各种加工方式进行塑性变形,制造出复杂形状的产品。
2. 耐腐蚀性:铝材对大多数酸、碱等化学物质具有较好的耐腐蚀性能。
3. 高强度:虽然铝材的密度较低,但其具有较高的强度,在承载能力方面表现出色。
四、铝材的应用领域1. 建筑工程:铝材常用于建筑幕墙、铝合金门窗等,具有轻质、防火、耐腐蚀等优点。
2. 汽车工业:铝材在汽车制造中广泛应用,可以减轻车身重量,提高燃油效率。
3. 电子设备:铝材用于制造散热器、电路板等,可有效散发热量,保护设备安全运行。
4. 包装材料:铝材可以制成食品包装盒、饮料罐等,具有保鲜、密封等优势。
五、铝材设计的注意事项1. 结构设计:根据使用环境和载荷要求,合理设计铝材的结构,确保其强度和稳定性。
2. 表面处理:铝材在使用过程中容易发生氧化反应,因此需要进行表面处理,如阳极氧化等。
3. 加工工艺:选择合适的加工工艺,对铝材进行切割、焊接、铆接等操作,确保产品质量。
六、结论本文通过图文形式总结了铝材设计的关键知识点,包括物理性能、优点、应用领域以及设计注意事项等。
对于铝材设计感兴趣的读者,这些知识点将有助于更好地理解和应用铝材。
铝基本知识介绍

铝基本知识介绍铝基本知识介绍铝是一种轻金属,其化合物在自然界中分布极广,地壳中铝的含量约为8%(重量),仅次于氧和硅,居第三位。
在金属品种中,仅次于钢铁,为第二大类金属。
铝的导电性、延展性良好,应用范围十分广泛,涉及轻工、电力、电气、电子、汽车、机械制造、建筑、包装等行业,是国民经济发展的重要基础原材料。
世界上铝的主要生产国为:美国、俄罗斯、加拿大、中国、澳大利亚、巴西等,我国1998年的产量排名世界第三,主要的生产商有:青海铝厂(19.8万吨)、贵州铝厂(19.5万吨)、包头铝业集团(11.3万吨)、广西平果铝厂(10.5万吨)、宁夏青铜峡铝厂(10.2万吨)等。
影响铝价格变动的主要因素:(1)产量及进出口量;(2)库存量;(3)电费的高低;(4)相关替代产品的应用程度;(5)生产工艺的改进与革新。
适合期货交易的主要特征:A、产销数量大,拥有众多的买方和卖方;B、品质均一,规格简单,等级标准容易划分;C、易于储存,运输方便;D、价格波动频国际国内交易概况:国际上铝合约交易量最大的交易所是伦敦金属交易所(LME),1997年铝合约交易量达2250万手,为世界当年铝产量的28倍;国内也有多家交易所先后上市铝标准合约,上海金属交易所是其中较有影响的交易所之一,从1992年开业到1997年底累计成交1494万吨,其中1994年成交1140万吨,为当年铝产量的7.6倍。
铝及铝合金与其它一般特性铝及铝合金其它金属材料相比,具有以下一些特点:1、密度小铝及铝合金的密度接近2.7g/,约为铁或铜的1/3。
2、强度高铝及铝合金的强度高。
经过一定程度的冷加工可强化基体强度,部分牌号的铝合金还可以通过热处理进行强化处理。
3、导电导热性好铝的导电导热性能仅次于银、铜和金。
4、耐蚀性好铝的表面易自然生产一层致密牢固的AL2O3保护膜,能很好的保护基体不受腐蚀。
通过人工阳极氧化和着色,可获得良好铸造性能的铸造铝合金或加工塑性好的变形铝合金。
高二 铝 金属材料 知识点
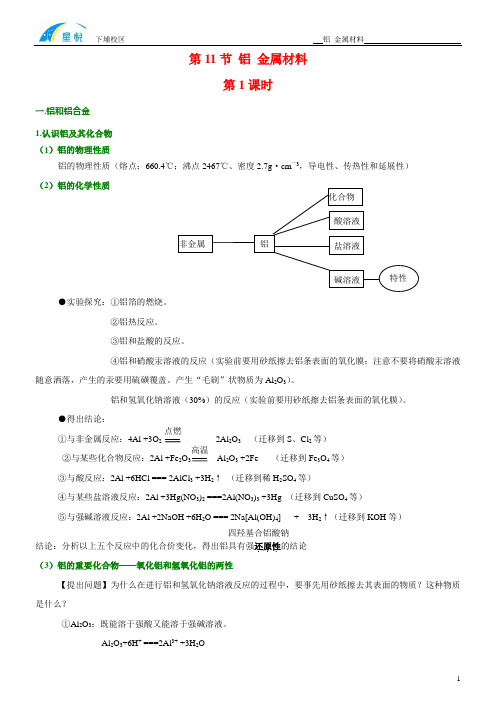
第11节 铝 金属材料第1课时一.铝和铝合金1.认识铝及其化合物(1)铝的物理性质铝的物理性质(熔点:660.4℃;沸点2467℃、密度2.7g ·cm —3,导电性、传热性和延展性) (2)铝的化学性质●实验探究:①铝箔的燃烧。
②铝热反应。
③铝和盐酸的反应。
④铝和硝酸汞溶液的反应(实验前要用砂纸擦去铝条表面的氧化膜;注意不要将硝酸汞溶液随意洒落,产生的汞要用硫磺覆盖。
产生“毛刷”状物质为Al 2O 3)。
铝和氢氧化钠溶液(30%)的反应(实验前要用砂纸擦去铝条表面的氧化膜)。
●得出结论:①与非金属反应:4Al +3O2Al 2O 3 (迁移到S 、Cl 2等)②与某些化合物反应:2Al +Fe 2OAl 2O 3 +2Fe (迁移到Fe 3O 4等)③与酸反应:2Al +6HCl === 2AlCl 3 +3H 2↑ (迁移到稀H 2SO 4等)④与某些盐溶液反应:2Al +3Hg(NO 3)2 ===2Al(NO 3)3 +3Hg (迁移到CuSO 4等)⑤与强碱溶液反应:2Al +2NaOH +6H 2O === 2Na[Al(OH)4] + 3H 2↑(迁移到KOH 等) 四羟基合铝酸钠结论:分析以上五个反应中的化合价变化,得出铝具有强还原性...的结论 (3)铝的重要化合物——氧化铝和氢氧化铝的两性【提出问题】为什么在进行铝和氢氧化钠溶液反应的过程中,要事先用砂纸擦去其表面的物质?这种物质是什么?①Al 2O 3:既能溶于强酸又能溶于强碱溶液。
Al 2O 3+6H + ===2Al 3+ +3H 2O(迁移到相关的化学方程式1~2例)Al2O3+2OH—+3H2O ===2[Al(OH)4]—(迁移到相关的化学方程式1~2例)【提出问题】为什么不用铝制品盛放酸梅汤和碱水等物质?②Al(OH)3:制备:铝盐和氨水反应(实验探索)。
如Al2(SO4)3 +6NH3·H2O ===2Al(OH)3↓+3(NH4)2SO4AlCl3 +3 NH3·H2O ===2Al(OH)3↓+3 NH4 lCl【提出问题】为什么不用铝盐和强碱溶液反应制备氢氧化铝?性质(实验探索——在两份氢氧化铝中分别加入盐酸和氢氧化钠溶液)Al(OH)3+3H+ ===2Al3+ +3H2OAl(OH)3+OH—===[Al(OH)4]—(迁移到相关的化学方程式1~2例)2.铝合金及其制品(1)合金:两种或两种以上的金属(或金属和非金属)熔合而成的具有金属特性的物质。
铝及其化合物知识点总结

铝及其化合物知识点总结(一)铝单质——Al(两性单质)1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高,有良好的导电、导热性和延展性。
用途:铝有良好的导电、导热性和延展性,主要用于导线、炊具等,铝的最大用途是制合金。
铝合金特点:①密度小①强度高①塑性好①制造工艺简单①成本低①抗腐蚀力强2、化学性质:铝是较活泼的金属,自然界中没有铝单质(1)与非金属:4Al + 3O2 == 2Al2O3生成致密的氧化膜起保护作用。
(2)与酸的反应:2Al + 6HCl == 2AlCl3+ 3H2↑ 2Al + 6H+ == 2Al3+ + 3H2↑钝化:在常温下,铝与浓硝酸、浓硫酸反应,在表面生成致密的氧化膜,阻止进一步反应,保护铝。
(3)与碱的反应:2Al + 2NaOH + 6H2O == 2Na[Al(OH)4] + 3H2↑ 2Al + 2OH− + 6H2O == 2[Al(OH)4]− +3H2↑ (4)与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
(5)铝热反应:高温下铝与某些金属氧化物的反应(如Fe、Cr、Mn、V的氧化物)2Al + Fe2O3Al2O3 + 2Fe。
Al和Fe2O3的混合物叫做铝热剂(混合物)。
可用于焊接钢轨、冶炼金属。
(二)氧化铝——Al2O3(两性氧化物)白色固体,熔点高(2054①),常作为耐火材料和冶炼金属铝的原料。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物。
1、与酸的反应:Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O2、与碱的反应:Al2O3 + 2NaOH + 3H2O == 2Na[Al(OH)4] Al2O3 + 2OH− + 3H2O == 2[Al(OH)4]−3、电解熔融的氧化铝制备金属铝:(三)氢氧化铝——Al(OH)3(两性氢氧化物)白色难溶于水的胶状沉淀,是两性氢氧化物,加热易分解。
《铝 金属材料》 知识清单

《铝金属材料》知识清单一、铝的基本性质1、物理性质铝是一种银白色的轻金属,具有良好的延展性、导电性和导热性。
它的密度较小,约为 270 g/cm³,这使得铝在航空航天、汽车制造等领域有广泛的应用。
铝的熔点为 66037℃,沸点为 2467℃。
2、化学性质(1)铝在空气中容易与氧气反应,形成一层致密的氧化铝保护膜,阻止内部的铝进一步被氧化。
化学方程式为:4Al + 3O₂= 2Al₂O₃。
(2)铝能与酸反应,生成铝盐和氢气。
例如,与盐酸反应的化学方程式为:2Al + 6HCl = 2AlCl₃+ 3H₂↑ 。
(3)铝也能与碱溶液反应,生成偏铝酸盐和氢气。
例如,与氢氧化钠溶液反应的化学方程式为:2Al + 2NaOH + 2H₂O = 2NaAlO₂+ 3H₂↑ 。
二、铝的制备1、电解法工业上通过电解熔融的氧化铝来制取铝。
氧化铝在电解槽中,在高温和直流电的作用下分解为铝和氧气。
化学反应方程式为:2Al₂O₃(熔融)通电 4Al + 3O₂↑ 。
三、铝合金1、定义铝合金是以铝为基添加一定量其他合金化元素的合金,是轻金属材料之一。
2、性能特点(1)强度高:铝合金的强度比纯铝高,能够满足许多结构件的强度要求。
(2)耐腐蚀:通过添加一些合金元素和进行适当的表面处理,铝合金具有较好的耐腐蚀性能。
(3)加工性能好:易于进行各种加工,如铸造、锻造、挤压、轧制等。
3、常见的铝合金种类(1)防锈铝合金:主要合金元素是锰和镁,具有良好的耐蚀性和塑性。
(2)硬铝合金:合金元素包括铜、镁、锰等,强度较高。
(3)超硬铝合金:含有较多的锌、铜、镁等元素,强度和硬度很高。
(4)锻铝合金:具有良好的热塑性、锻造性能和较高的力学性能。
四、铝在生活中的应用1、航空航天领域由于铝的密度小、强度高,在飞机制造中大量使用,如机身、机翼等部件。
2、汽车工业用于制造汽车的车身、发动机部件等,减轻车辆重量,提高燃油效率。
3、建筑行业铝合金门窗具有美观、耐腐蚀、质量轻等优点。
金属铝的知识点归纳总结

金属铝的知识点归纳总结金属铝(Aluminum)是一种常见的轻金属,具有良好的导热、导电性能,广泛应用于工业和日常生活中。
本文将对金属铝的制备方法、物理性质、化学性质、应用领域以及可持续性开发等方面进行归纳总结。
一、制备方法金属铝的制备主要有电解法和热还原法两种常见方法。
1. 电解法电解法是目前生产金属铝最常用的方法。
该方法通过在氧化铝熔体中通入直流电流,使氧化铝电解分解成金属铝和氧气。
这种方法具有高效、经济的优点,被广泛应用于铝的大规模工业生产过程中。
2. 热还原法热还原法是通过将含铝矿石与还原剂在高温条件下反应,使氧化铝还原为金属铝。
这种方法适用于小规模生产或临时铝锭的制备过程中。
二、物理性质金属铝具有以下主要的物理性质:1. 密度轻金属铝的密度相对较低,约为2.7g/cm³。
这使得铝成为一种重要的轻金属材料,在航空航天、交通运输等领域得到广泛应用。
2. 导电导热性能良好金属铝具有良好的导电导热性能,其导电性能仅次于银和铜。
这使得铝能够广泛应用于电力传输、散热器等领域。
3. 抗腐蚀性强金属铝能够与氧气迅速反应生成致密的氧化铝膜,该膜具有一定的抗腐蚀性能,能够保护铝材不受其他物质的侵蚀。
三、化学性质金属铝的化学性质主要表现在以下方面:1. 建立致密氧化铝膜金属铝在空气中与氧气迅速反应生成致密的氧化铝膜。
这一膜层能够阻止进一步的铝材氧化,具有一定的抗腐蚀性。
2. 与酸反应金属铝可以与酸反应,生成相应的盐和氢气。
然而,由于氧化铝膜的存在,金属铝对许多常见酸的腐蚀性较弱。
3. 不与碱反应金属铝与碱反应生成相应的盐和氢气。
与酸相比,铝在碱性溶液中更容易发生化学反应。
四、应用领域金属铝由于其独特的物理性质和化学性质,在众多领域广泛应用:1. 轻型结构材料金属铝的轻质、高强度特性使其成为制造轻型结构材料(如航空器、汽车等)的理想选择。
2. 食品包装材料金属铝具有良好的抗腐蚀性和热传导性能,常用于食品罐、饮料包装盒等的制作。
高考化学铝的知识点

高考化学铝的知识点高考化学中,铝是一个非常重要的元素,它在我们的日常生活中起着重要的作用。
本文将从铝的性质、制备、应用以及环境问题等方面来探讨铝的知识点。
一、铝的性质铝是一种常见的金属元素,属于周期表中的第13族元素。
它具有低密度、良好的导电性、导热性和抗腐蚀性等优良性质。
铝的密度只有2.7g/cm³,比许多金属都要轻,因此被广泛应用于制造轻便材料,如航空器、汽车等。
二、铝的制备铝主要通过电解法来制备,这是一种重要的冶金过程。
制备铝的主要原料是氧化铝,通常是以铝矿石的形式存在。
首先将铝矿石破碎、研磨成粉末,再与氢氟酸反应产生氟铝酸,最后通过电解还原的方式得到纯铝。
三、铝的应用铝在许多领域都有广泛的应用。
首先,铝是一种很好的结构材料,被广泛应用于建筑、交通运输和航空航天等领域。
其次,铝也是一种重要的电池材料,如锂电池中的正极材料。
此外,铝还可以用于制造包装材料、电器导线等。
值得一提的是,高纯度的铝可以制成铝箔,常用于包装食品、药品等。
四、铝的环境问题尽管铝在许多领域中有重要的应用,但与此同时,铝也存在一些环境问题。
首先,铝的生产过程需要大量的能源消耗,并产生大量的废气、废水,对环境造成一定的污染。
其次,铝在自然界中容易与其他物质相结合形成氧化物等不溶性化合物,从而影响土壤和水体的生态平衡。
此外,铝与人体健康也有一定的关系,过多摄入铝可引发一些健康问题,如骨质疏松等。
为了解决这些问题,我们应该采取一系列措施。
首先,应该优化铝的生产工艺,减少能源消耗和污染排放。
其次,应该加强对铝及其化合物的监测,确保环境不会受到过度污染。
此外,人们应该合理使用铝制品,避免过度摄入铝,保持健康的生活方式。
总结起来,铝作为一种重要的金属元素,在我们的生活中扮演着重要的角色。
了解铝的性质、制备、应用和环境问题等知识点,不仅有助于我们对化学知识的理解,还能引发我们对环境保护和合理使用资源的思考。
希望大家能够加强对铝知识的学习和应用,为未来的可持续发展做出贡献。
高一化学al的相关知识点

高一化学al的相关知识点高一化学:关于铝(Al)的相关知识点铝(Al)是我们生活中广泛应用的一种金属元素。
它的轻巧、强度高、耐腐蚀等特性,使得它在航空、建筑、包装等领域有着广泛的应用。
本文将从铝的性质、制备、化合物以及环境问题等方面,来探讨关于铝的相关知识点。
一、铝的性质1. 密度:铝的密度较低,仅为2.7 g/cm³,是一种轻金属。
因此,铝制品通常都比较轻便,适用于制作飞机零部件、轻型汽车等。
2. 导电性:铝是良好的导电材料,其电导率在金属中属于中等水平。
因此,铝制电线非常常见。
3. 耐腐蚀性:铝具有良好的耐腐蚀性,可以在空气中迅速产生一层致密的氧化铝膜,该膜可以防止物质进一步腐蚀铝本体。
4. 反射性:铝具有高反射率,特别是对于紫外线和红外线的反射性极佳。
因此,在制造反光镜、太阳能集热板等方面有着广泛应用。
二、铝的制备铝的制备主要有电解法和热还原法两种方法。
1. 电解法:通过电解铝矾土(Al2O3)的熔融物质制得铝。
铝矾土经过煅烧后转化为氧化铝,然后与熔融的氟铝狂反应,经过电解,析出纯铝。
2. 热还原法:将铝矾土与焦炭在高温下反应,生成气相的三氯化铝,然后通过金属铝与氯化铝反应,得到纯铝。
三、铝的化合物1. 氧化铝(Al2O3):氧化铝是铝最常见的氧化物,常见于铝矾土。
氧化铝是陶瓷的主要原料,也是制备金属铝的重要中间体。
2. 氯化铝(AlCl3):氯化铝是一种具有较强脱水能力的无机盐,广泛应用于有机合成反应和催化剂制备中。
3. 硫酸铝(Al2(SO4)3):硫酸铝是一种重要的工业化学品,广泛用于水处理、纺织工业和制备其他铝盐等领域。
四、铝的环境问题尽管铝在工业和生活中有着广泛的应用,但其排放和处理也会对环境造成一定的影响。
1. 铝的污染:铝制造过程中,主要会产生废气和废水,其中含有一定的氧化铝和有害金属离子。
这些废物的排放会对空气、土壤和水体造成污染。
2. 铝对生物的影响:铝离子对大多数植物和动物生命不产生直接的有害影响,但在过量暴露的情况下,铝会对一些生物体造成毒性和生长发育异常等问题。
《铝 金属材料》知识清单

《铝金属材料》知识清单一、铝的基本信息1、存在形式铝在自然界中以化合态存在,这是因为铝的化学性质比较活泼。
比如说,我们在大自然中很难找到纯铝,就像在一群穿着各种衣服(化合物)的人里,很难找到一个啥也不穿(单质)的人。
铝元素在地壳中的含量非常丰富,是地壳中含量最多的金属元素。
可以想象一下,如果把地壳里的金属元素都集合起来排队,铝元素肯定是排在最前面的那一大群。
2、物理性质铝是一种银白色的金属,有金属光泽。
就像那些亮晶晶的银色装饰品一样,看起来特别漂亮。
它的密度比较小,质地比较软。
这使得铝在航空航天领域有很大的用途。
我曾经参观过一个航空模型展览,那些飞机模型好多都是用铝或者铝合金做的,因为它轻啊,这样飞机就能更容易飞起来。
而且用手捏一捏铝制品,感觉它没有铁那么硬邦邦的。
铝具有良好的导电性、导热性和延展性。
我们家里的电线有时候就会用到铝,它能很好地把电从一个地方传到另一个地方。
铝锅也很常见,它能快速地把热量传递给食物,让食物煮熟。
铝还可以被拉成很细的丝或者压成很薄的片,就像我们吃的面条可以拉得长长的,或者像把面团擀成薄薄的饼一样。
二、铝的化学性质1、与氧气反应铝在常温下就能和氧气发生反应,表面会形成一层致密的氧化铝薄膜。
这层薄膜就像铝的保护盔甲一样,把铝和外界隔开,防止铝进一步被氧化。
我有一次看到一个旧的铝制窗框,虽然用了很久,但是里面的铝并没有被腐蚀得很厉害,就是因为这层氧化铝薄膜在保护着它。
反应方程式是\(4Al + 3O_{2}=2Al_{2}O_{3}\)。
铝在点燃的条件下也能和氧气剧烈反应,发出耀眼的白光,生成氧化铝。
这就像一个低调的人(常温下的铝)平时不怎么显山露水,但是一旦被激发(点燃),就会释放出惊人的能量,闪耀出耀眼的光芒。
2、与酸反应铝能和稀盐酸、稀硫酸等酸反应,生成相应的盐和氢气。
比如说和稀盐酸反应的方程式是\(2Al+6HCl = 2AlCl_{3}+3H_{2}\uparrow\)。
高一化学知识点总结必修一铝金属材料

铝 金属材料一、铝:1、物理性质:银白色金属, 硬度和密度小,具有良好的导电、导热性和延展性.其导电性在银铜金之后 2、化学性质: 1 与非金属单质反应: 2Al+3Cl 22AlCl 3 4Al+3O 2 2Al 2O 3常温也可以反应,生成致密氧化膜,常用来解释为什么铝不容易生锈2 与酸反应:A 、与非氧化性酸反应盐酸,稀硫酸等,生成氢气 2Al+6HCl===2AlCl 3+3H 2↑2Al+6H +=2Al 3++3H 2↑2Al+3H 2SO 4===Al 2SO 43+3H 2↑ 2Al+6H +=2Al 3++3H 2↑B 、与氧化性酸反应,发生钝化,即铝、铁在冷的浓硫酸,浓硝酸中发生钝化注意: ① 如果是稀硫酸或者是稀硝酸,则不会发生钝化② 如果是热的浓硫酸或者是热的浓硝酸,也不会发生钝化 3 与碱反应:生成四羟基合铝酸钠 2Al+2NaOH+6H 2O===2NaAlOH 4+3H 2↑2Al+2OH –+6H 2O=2AlOH 4–+3H 2↑4 与盐反应:按照金属活动性顺序,发生置换反应 2Al+3Cu 2+===3Cu+2Al 3+5 与氧化物反应:发生铝热反应 2Al+Fe 2O 3Al 2O 3+2Fe注意事项:① 反应物铝和金属氧化物统称铝热剂② 铝热反应的实验现象为:发出耀眼的光芒、放出大量的热、有熔融物生成.③ 铝热反应常用于焊接铁轨和冶炼金属 二、氧化铝1、存在形式:氧化铝主要存在刚玉中,刚玉的主要成分是Al 2O 3 , A 、其中把含少量铬元素的刚玉称为红宝石; B 、含少量的铁和钛元素的刚玉称为蓝宝石.2、物理性质:白色固体、不溶于水、熔沸点高.3、化学性质:1 电解反应:电解氧化铝用于制取金属铝2Al 2O 3 ========= 2Al + 3 O 2 ↑ 2 两性氧化物即能与酸反应,也能与碱反应 A 、氧化铝与酸反应: Al 2O 3+6HCl =AlCl 3+3H 2O B 、氧化铝与碱反应: Al 2O 3+2NaOH+3H 2O =2NaAlOH 4 三、氢氧化铝 1、物理性质:白色胶状物质, 不溶于水,强吸附性,可以吸附水中的悬浮物和各种色素. 2、化学性质:1 不稳定性:氢氧化铝不稳定,受热易分解.2AlOH 3 ===== Al 2O 3+2H 2O 这是工业上制取纯净氧化铝的方法.2 两性氢氧化物:A 、与酸反应:AlOH 3 + 3HCl= AlCl 3 + 3H 2OB 、与碱反应:AlOH 3 + NaOH =NaAlOH 43、制取:实验室一般用铝盐跟氨水反应制取氢氧化铝 AlCl 3+3NH 3·H 2O === AlOH 3↓+3NH 4Cl电解△Al3+ + 3NH3·H2O === AlOH3↓+3NH4+注意:弱酸比如碳酸,弱碱比如氢氧化钠均不能使氢氧化钠溶解4、知识补充:四羟基合铝酸盐{AlOH4– }的性质:AlOH4–可以看成AlOH4–= AlOH3+OH–(1)与不能共存的离子:只要不能与氢氧根共存的离子,都不能与AlOH4–共存,比如:铁离子、铝离子、碳酸氢根等(2)铝盐可以跟四羟基合铝酸盐反应,生成氢氧化铝Al3+ + 3AlOH4–=4 AlOH3↓(3)四羟基合铝酸盐也可以和酸反应,比如实验室也可以利用四羟基合铝酸盐跟二氧化碳反应来制取氢氧化铝A、当CO2不足时,2AlOH4–+ CO2 = 2 AlOH3↓+H2O+CO32-B、当CO2过量时,AlOH4–+ CO2 = AlOH3↓+ HCO3-四、铝合金:1、合金的概念:金属跟金属,或者金属跟非金属通过加热融合而形成的混合物.2、合金的特征:两大一小1 合金的硬度一般比组成它的金属大2 合金的熔点一般比组成它的金属低3 合金的抗腐蚀性一般比组成它的金属强3、铝合金的优点:密度小、强度高、塑性好、易于成型等优点4、铝合金的用途:经常用于制造飞机构件,建筑业及电子行业等.五、金属材料:1、分类:分为黑色金属材料和有色金属材料1 黑色金属:黑色金属是指铁、锰、铬以及它们的合金2 有色金属:除黑色金属外所有的金属材料统称有色金属注意事项:① 黑色金属只是一种称呼,并不是说黑色金属都是黑色的② 黑色金属材料是人类使用最广泛的金属材料2、黑色金属—钢铁:1 铁的合金主要包括钢铁和生铁,其中生铁的含碳量比较高2 铁的使用经历了一个“铁—普通钢—不锈钢等特种钢”的演变3 不锈钢主要是在普通钢的基础上加入铬、镍等元素,不锈钢有很多类型,但是有一个共同的特征是:其含铬量一般都大于12%.3、有色金属材料—金、银、铜1 金银铜的三性导电性、导热性、延展性导电性:银>铜>金 导热性:银>铜>金 延展性:金>银>铜2 物理性质:金是黄色金属、银是银白色金属、铜是紫红色金属 其中铜是人类最早使用的金属.3 化学性质:金:金的化学性质很稳定,基本不与任何物质反应.银:银的化学性质也很稳定,除了跟硝酸、浓硫酸等少数氧化剂反应外,也基本不与其它物质反应铜:铜的化学性质相对比较活泼(1) 常温下,铜在干燥的空气中性质稳定,但是在潮湿的空气中容易被腐蚀,生成绿色的铜锈或者铜绿,方程式为: 2Cu+O 2+H 2O+CO 2====Cu 2OH 2CO 3(2) 铜在加热或者点燃的条件下,能与许多非金属反应:2Cu+O 2====2CuO 2Cu+S====Cu 2S(3) 铜及其化合物之间可以相互转化,而且转化时常伴着颜色变化4 CuO ======2Cu 2O + O 2↑ CuSO 4·5H 2O====CuSO 4+5H 2O ↑△ △△高温六、铝的图象问题总结:1、铝盐与氨水的反应由于产物氢氧化铝不溶于氨水,因此无论是铝盐里面加入氨水,还是氨水里面加入铝盐,反应都是一样的,因此图像也应该相同,具体如下所示:A、实验现象:加入试剂后,生成沉淀,沉淀不消失B、离子方程式:Al3+ + 3NH3·H2O === AlOH3↓+3NH4+1mol 3molC、图像:1 铝盐里面加入氨水:2 氨水中加入铝盐2、铝盐与强碱以氢氧化钠为例因为产物氢氧化铝溶于氢氧化钠,因此往铝盐里面加入氢氧化钠,跟氢氧化钠里面加入铝盐,反应情况应该是有所不同的,图像也应该是有所不同的,具体如下所示:1 铝盐里面加入氢氧化钠A、实验现象:①先生成沉淀铝盐里面Al3+较多,加入OH-后生成AlOH3沉淀②沉淀消失AlOH3与OH-继续反应,生成〔AlOH4〕-B、离子方程式:① Al3+ + 3OH - = AlOH3↓ 1mol 3mol② AlOH3 + OH- = 〔AlOH4〕-1mol 1mol C、图像:D、习题:例1. 向30毫升1 mol/L的AlCl3溶液中逐渐加入浓度为4 mol/L的 NaOH 溶液,若产生白色沉淀,则加入的NaOH溶液的体积可能为A. 3mLB.C. 15mLD.例2 向含有a mol AlCl3的溶液中加入含b mol KOH的溶液,生成沉淀的物质的量可能是1a mol 2b mol 3 a/3 mol4b/3 mol 50 mol 64a-bmolA. 12456B. 1456C. 12356D. 135总结:a mol AlCl3与b mol NaOH反应,沉淀的物质的量的讨论情况:A、 b≤3a 时,先写离子方程式,计算沉淀时,要以不足的量来计算Al 3+ + 3 OH-==== AlOH3↓amol 3amol amol∨bmol b/3 mol所以当b≤3a 时,即氢氧化钠不足时,沉淀的物质的量为b/3molB、 3a<b<4a时,同样写离子方程式,然后判断哪个反应物不足,要以不足的物质来计算沉淀的质量.① Al 3+ + 3 OH-==== AlOH3↓amol 3amol amol∧即AlCl3不足bmol amol 此时沉淀应该以AlCl3来算②AlOH3 + OH- = 〔AlOH4〕-amol amolb-3amol b-3amol b-3amol 则生成的沉淀为a-b-3a=4a-bmol所以当3a<b<4a 时,此时沉淀的物质的量为4a-bmol C 、 当b ≥4a 时,沉淀的物质的量为02 往氢氧化钠溶液里面加入铝盐 A 、实验现象:① NaOH 溶液中出现沉淀,沉淀立即消失氢氧化钠溶液里面OH -较多,加入Al 3+后生成AlOH 3沉淀,沉淀马上又跟OH -反应② 继续滴加Al 3+后沉淀突然增多后不变Al 3+与〔AlOH 4〕-反应生成AlOH 3后,AlOH 3不消失 B 、离子方程式:① Al 3+ + 3OH - = AlOH 3↓ ,AlOH 3 + OH - = 〔AlOH 4〕- 1mol 1mol 1mol 1mol 1mol 3mol 1mol 1mol 即第一步发生 Al 3+ + 4OH - = 〔AlOH 4〕- ② Al 3+ + 3 〔AlOH 4〕- = 4 AlOH 3↓1mol 3 mol即加入的Al 3+要先花3mol 去跟OH -反应形成1mol 〔AlOH 4〕-,然后1mol Al 3+再跟1mol 〔AlOH 4〕-反应形成沉淀. C 、图像:3、Na〔AlOH4〕与CO2的反应:由于产物氢氧化铝不溶于碳酸,因此无论是Na〔AlOH4〕里面加入CO2,因此生成的沉淀应该不会消失,具体如下所示:A、实验现象:加入试剂后,生成沉淀,沉淀不消失B、离子方程式:当CO2不足时,2AlOH4–+ CO2 = 2 AlOH3↓+H2O+CO32-当CO2过量时,AlOH4–+ CO2 = AlOH3↓+ HCO3-C、图像:4、Na〔AlOH4〕与HCl的反应:因为产物氢氧化铝溶于盐酸,因此往Na〔AlOH4〕里面加入HCl,跟往HCl里面加入Na〔AlOH4〕,反应情况应该是有所不同的,图像也应该是有所不同的,具体如下所示:1 往Na〔AlOH4〕里面加入HClA、实验现象:① Na〔AlOH4〕溶液出现沉淀②继续滴加HCl,沉淀消失B、离子方程式:①〔AlOH4〕-+ H+ = AlOH3↓+H2O1mol 1mol② AlOH3+ 3H+ = Al3+ +3H2O1mol 3mol C、图像:2 往HCl 里面加入Na 〔AlOH 4〕: A 、实验现象:① HCl 溶液先出现沉淀,沉淀迅速消失 ② 继续滴加Na 〔AlOH 4〕,沉淀不变 B 、离子方程式:① 〔AlOH 4〕-+ H + = AlOH 3↓+H 2O AlOH 3+ 3H + = Al 3+ +3H 2O 即第一步的总反应为:〔AlOH 4〕-+ 4H + = Al 3+ +3H 2O ② Al 3+ + 3AlOH 4–=4 AlOH 3↓ C 、图像:5、向AlCl 3、MgCl 2溶液中滴加NaOH 溶液1实验现象:溶液中先出现白色沉淀,达最大值后继续滴加NaOH溶液沉淀部分溶解.2离子方程式: Al 3++3OH -=AlOH 3↓ Mg 2++2OH - =MgOH 2↓ AlOH 3+OH -=〔AlOH 4〕- 3 图像:。
铝的知识点总结

铝的知识点总结1. 简介铝是一种常见的金属元素,化学符号为Al,原子序数为13。
它是地壳中含量最丰富的金属元素之一。
铝具有轻质、导电性好、耐腐蚀等优点,因此广泛应用于各个领域,如建筑、汽车、航空航天、包装等。
2. 物理性质•密度:铝的密度相对较低,约为2.7g/cm³。
•熔点:铝的熔点为660.3摄氏度。
•沸点:铝的沸点约为2467摄氏度。
•导电性:铝具有良好的导电性,是一种良好的电导体。
3. 化学性质•耐腐蚀性:铝具有良好的耐腐蚀性,其表面会形成一层氧化膜,起到保护作用。
•反应性:铝在常温下不与水反应,但可以与多种非金属元素发生反应,如氧、氮、硫等。
•可燃性:铝粉末具有可燃性,能够与氧气剧烈反应,释放大量热量。
4. 应用领域4.1 建筑领域铝在建筑领域中得到广泛应用,主要体现在以下方面:•门窗:铝合金门窗具有轻质、耐腐蚀等特点,被广泛应用于住宅和商业建筑中。
•幕墙:铝合金幕墙具有隔热、隔音、防水等功能,被广泛用于高层建筑外墙的装饰和保护。
•屋顶:铝合金屋顶材料具有耐候性好、轻质等特点,在建筑中被用于屋面材料的制作。
4.2 汽车领域铝在汽车制造领域中的应用越来越广泛,主要体现在以下方面:•车身材料:铝合金可以降低汽车的整体重量,提高燃油效率和行驶性能。
•发动机零部件:铝合金材料可以减少发动机的重量,提高散热效果,从而提高发动机的功率输出。
4.3 航空航天领域铝在航空航天领域中扮演着重要的角色,主要体现在以下方面:•飞机结构:铝合金被广泛应用于飞机的机身、翼梁、襟翼等结构部件,因其轻质、强度高等优点。
•航天器:铝合金在航天器的结构材料、推进系统中得到广泛应用,承担着重要的任务。
4.4 包装领域铝在包装领域中有广泛的应用,主要体现在以下方面:•食品包装:铝箔可以用于食品包装,具有良好的保鲜性和隔氧性,能够有效保护食品的质量。
•药品包装:铝箔可用于药品包装,具有良好的密封性和保护性,能够防止药品受潮、受光等。
金属铝的知识点归纳总结

金属铝的知识点归纳总结一、铝的历史铝是一种化学元素,化学符号为Al,原子序数为13,原子量为26.9815。
铝是地壳上丰富的金属元素之一,占地壳中的8.23%,是第三丰富的金属元素。
早在古代,人们就已经发现了含铝的矿石,但是由于铝矿石的提取和精炼技术不成熟,并且成本较高,因此铝曾经被视为贵重金属。
直到19世纪末20世纪初,随着化学冶金技术的发展,铝的生产成本大大降低,铝材料开始大规模应用于工业生产中。
二、铝的性质1. 物理性质:铝是一种银白色的金属,具有良好的导电性和导热性,密度较小,具有良好的延展性和可塑性,可以轧制成各种形状,且易于加工。
2. 化学性质:铝在空气中可以生成一层致密的氧化膜,具有一定的耐腐蚀性,可以在酸性环境下迅速溶解,但是在碱性环境下稳定性较高。
3. 热性能:铝的熔点为660℃,熔化后可以通过挤压、轧制等方式进行加工。
三、铝的生产工艺铝的生产主要分为两个环节,铝矿的提取和精炼。
铝矿主要有赤铁矿、柱石铝土矿、硫铝土矿等。
提取铝矿的方法主要有采矿、选矿和浸出等。
在提炼方面,主要有铝电解、热法、氟化铝法等方法。
其中最常用的方法是铝电解法,通过电解氧化铝溶液来制取铝。
四、铝的应用领域1. 轻量化材料领域:由于铝的密度较小,强度较高,被广泛应用于航空航天领域,如飞机、卫星等。
2. 建筑材料领域:铝合金门窗、铝合金型材、铝合金膜结构等材料在建筑领域有着广泛的应用。
3. 电力领域:铝是一种良好的导电材料,被广泛用于输电线路、电缆等。
4. 化工领域:铝制品在化工领域也有广泛的应用,如制酸性化工设备、制氧化铝、硫酸铝等。
五、铝的发展前景随着轻量化材料的需求不断增加,铝作为一种轻质、高强度的材料,具有广阔的发展前景。
未来铝的应用领域会更加广泛,如汽车制造、船舶制造、电子领域等都将有着更大的需求。
总之,铝作为一种广泛应用的金属材料,具有较高的强度和良好的加工性能,被广泛用于航空航天、汽车制造、建筑材料等领域。
铝的归纳总结

铝的归纳总结铝是一种常见的金属元素,属于周期表中的13号元素,化学符号为Al,原子序数为13。
它的存在对我们的日常生活和工业生产都有着重要的作用。
以下是对铝的一些归纳总结。
1. 物理性质铝是一种银白色的金属,具有良好的延展性和导电性。
它的密度相对较低,为2.7克/立方厘米,但其强度却相对较高。
铝的熔点为660摄氏度,沸点约为2519摄氏度。
此外,铝是非磁性物质,对磁场没有反应。
2. 化学性质铝在常温下对氧气具有很高的亲和力,与氧反应会生成氧化铝,即Al2O3。
氧化铝形成了一层稳定的氧化膜,能够防止进一步的氧化反应。
这一氧化膜赋予了铝良好的耐腐蚀性。
此外,铝也能够与其他非金属元素反应,如硫、氯等。
3. 生产与应用铝是地壳中丰富的金属元素之一,其生产主要通过电解法来获得。
铝的高导电性和良好的导热性使得它在电力传输和散热领域得到广泛应用。
此外,铝也具有轻质、强度高、可塑性好的特点,被广泛用于航空、汽车、建筑等行业。
铝的良好耐腐蚀性使得它成为制造食品和药品容器的理想材料。
4. 环境意义铝是一种可回收利用的金属,其回收利用率较高。
回收铝不仅可以减少资源的消耗,还可以减少对环境的污染。
与从矿石提炼铝相比,回收铝可以节约大量的能源,减少二氧化碳等温室气体的排放。
因此,鼓励铝的回收利用对于环境保护具有重要意义。
5. 健康影响铝是一种广泛存在于环境中的金属,人体摄入铝主要通过饮食和饮水。
尽管铝在一定程度上对人体有害,但通过正常的饮食摄入并不会造成明显的健康问题。
然而,过量摄入铝可能对大脑和骨骼有一定的负面影响。
因此,合理控制摄入铝的量是很有必要的。
总结起来,铝是一种重要的金属元素,具有良好的物理性质和化学性质。
它的广泛应用使其在各个领域都发挥着重要作用。
同时,铝的回收利用和健康控制也是需要关注的问题。
通过科学合理地利用铝,我们可以最大程度地发挥其优点,同时减少其潜在的负面影响,为可持续发展做出贡献。
铝的化学知识点总结

铝的化学知识点总结一、铝的性质1. 物理性质铝是一种银白色、柔软的轻质金属,在常温下具有良好的导电性和导热性。
纯铝的密度为2.7g/cm3,熔点为660°C,沸点为2467°C,具有一定的延展性和塑性,易于加工成各种形状的制品。
2. 化学性质铝是一种较活泼的金属,具有一定的化学活性。
在常温下,铝能与氧、氮、硫等非金属元素反应,在高温下能与氢、氨等元素发生反应。
铝在空气中易被氧化形成一层致密的氧化膜,这层氧化膜可以保护铝不被更多的氧气侵蚀,使铝具有较好的耐腐蚀性。
此外,铝还能与非金属元素形成盐类化合物,如氯化铝、硫酸铝等。
3. 与其他元素的化合物铝与氧形成的氧化铝是最常见的化合物,化学式为Al2O3。
氧化铝具有很强的耐火性和耐腐蚀性,被广泛应用于陶瓷、耐火材料、磨料等工业领域。
此外,铝还能与氯、硫、氮等元素形成不同的盐类化合物,这些化合物在工业生产和日常生活中也有着重要的应用。
二、铝的用途1. 工业领域由于铝具有较好的导电性、导热性和耐腐蚀性,被广泛应用于电力、电子、航空航天等工业领域。
铝及其合金在制造导线、散热器、飞机、汽车等方面有着重要的作用。
2. 包装材料铝具有轻质、不透水、不透气、耐高温等特点,被广泛应用于包装材料的制造。
铝箔、铝包装盒、铝罐等产品在食品、药品、化妆品等行业起着重要的包装保护作用。
3. 建筑领域铝及其合金在建筑领域有着广泛的应用,如制造铝门窗、铝合金型材、铝幕墙等。
铝制品具有轻质、耐腐蚀、美观等特点,能满足建筑材料的需求,受到建筑行业的青睐。
4. 化工领域氧化铝、硫酸铝、氯化铝等铝化合物在化工领域应用广泛,用于制造催化剂、吸附剂、电解铝等产品,具有重要的工业价值。
三、铝的生产铝的生产主要有两种方式,一种是电解法,另一种是氧化铝法。
1. 电解法电解法是目前铝的主要生产方式。
该方法首先需要从矿石中提取氧化铝,随后通过电解法将氧化铝转化为铝金属。
电解法具有生产效率高、产品质量稳定等优点,被广泛应用于工业生产中。
铝知识点总结框架

铝知识点总结框架
一、铝的基本信息
1.1 铝的发现及历史
1.2 铝的性质
1.3 铝的用途
二、铝的生产
2.1 天然铝的提取
2.2 工业铝的生产过程
2.3 铝的制备方法
三、铝的物理性质
3.1 密度
3.2 熔点和沸点
3.3 热导率
3.4 电性能
3.5 热膨胀系数
四、铝的化学性质
4.1 与水的反应
4.2 与酸的反应
4.3 与碱的反应
4.4 与氧的反应
4.5 与其他元素的化合物
五、铝的合金与化合物
5.1 铝合金
5.2 氧化铝
5.3 氢氧化铝
5.4 硫化铝
六、铝的环境影响
6.1 铝对环境的影响
6.2 铝的回收利用
七、铝的健康影响
7.1 铝对人体健康的影响
7.2 铝中毒
7.3 铝相关疾病
八、铝在工业和日常生活中的应用
8.1 铝在航空航天工业中的应用
8.2 铝在汽车工业中的应用
8.3 铝在建筑工业中的应用
8.4 铝在包装工业中的应用
九、未来发展趋势
9.1 铝产业结构调整
9.2 新技术、新材料的发展
9.3 环保和可持续性发展
十、结语
10.1 铝的重要性和发展前景
10.2 对铝产业的展望
以上铝知识点总结框架,是一个系统地概括了铝的基本信息、生产、性质、合金和化合物、环境影响和健康影响、应用以及未来发展趋势等方面的内容。
为了深入了解铝,我们将从
这十个方面逐一展开探讨。
铝合金材料知识大全

铝合金材料知识大全铝合金是一种广泛应用于各个领域的材料,具有轻、强、耐腐蚀等特点。
本文将为您提供一份铝合金材料的知识大全,包括以下几个方面的内容:1. 铝合金的组成和分类铝合金是由铝与其他金属元素共同合金化而成的材料。
根据不同的金属合金元素,铝合金可以分为几个不同的分类,如铜铝合金、锌铝合金、镁铝合金等。
每种不同的合金元素组成会赋予铝合金不同的特性和用途。
2. 铝合金的特性和优势铝合金具有许多优秀的特性和优势。
例如,它具有高强度、低密度,可以减轻结构负荷;具有优良的导热性和导电性;具有良好的耐腐蚀性,能够在恶劣环境下长时间使用。
3. 铝合金的应用领域铝合金广泛应用于各个领域。
例如,汽车工业中使用铝合金制造车身和发动机零部件,以减轻车辆重量提高燃油效率;航空航天领域中使用铝合金制造飞机结构件,具有良好的强度和耐蚀性;建筑领域使用铝合金制造门窗、幕墙等,具有美观轻便的特点。
4. 铝合金的加工和制造铝合金的加工和制造方法有很多种,包括铸造、锻造、轧制、拉伸等。
不同的加工方法可以获得不同形状和性能的铝合金制品。
5. 铝合金的维护和保养铝合金制品在使用过程中需要进行适当的维护和保养,以延长其使用寿命。
维护和保养方法包括清洁、涂层保护、定期检查等。
以上是关于铝合金材料的知识大全,希望能对您有所帮助。
如有任何疑问,请随时与我们联系。
谢谢!(总字数:XXX)Please note that the word count placeholder (XXX) should be replaced with the actual word count of the document.。
金属铝重要知识点总结

金属铝重要知识点总结一、铝的性质1. 物理性质铝是一种轻质、有良好导热、导电性能的金属,具有良好的可锻性和延展性。
它的密度约为2.7g/cm³,熔点约为660℃,沸点约为2327℃,是一种具有低熔点的金属。
2. 化学性质铝具有很强的还原性,在空气中容易被氧化形成一层氧化膜,所以铝是一种具有良好的耐腐蚀性的金属。
但在酸性溶液中会被腐蚀。
3. 其他性质铝是一种活泼的金属,它具有很强的反应性,在与其他元素发生化学反应时会放出大量的热。
此外,铝也是一种良好的光反射材料,因此在建筑和交通工具的制造中被广泛应用。
二、铝的生产1. 铝的提取铝主要是从铝土矿中提取得到的。
铝土矿中含有较高比例的氧化铝,首先需要将铝土矿进行粉碎和浸出,然后用化学方法提取出氧化铝,并通过电解的方法还原成金属铝。
2. 电解法电解法是现代工业中铝的主要生产方法。
首先,将氧化铝溶解在氢氟酸中,形成氢氟酸铝,然后将氢氟酸铝溶液通过电解槽电解,就可以得到纯净的金属铝。
三、铝的应用1. 航空领域铝是航空领域的重要材料,轻质的铝合金可以减轻飞机的自重,提高飞机的航空性能。
因此,铝被广泛用于制造飞机机身、翼梁和发动机部件。
2. 汽车制造铝在汽车制造中也有广泛的应用,轻质的铝合金可以减轻汽车的自重,提高燃油经济性。
同时,铝合金的强度可以提高汽车零部件的结构强度,提高汽车的安全性能。
3. 电力传输铝是一种良好的导电材料,因此在电力传输线路中得到了广泛的应用。
铝导线重量轻、价格低廉,因此可以降低电力传输线路的成本。
4. 建筑材料铝合金是一种轻质、耐腐蚀的材料,因此在建筑材料中也有广泛的应用。
铝合金可以制造各种建筑构件,如窗框、门框和幕墙等。
5. 包装材料铝箔是一种非常常见的包装材料,它具有良好的隔热和防潮性能,因此被广泛用于食品包装和药品包装等领域。
四、铝的环保与再生利用1. 环保铝是一种可以很好被循环利用的金属,其制造过程中能耗较低,而且在回收利用时,能够很好地节约能源和减少二氧化碳排放。
铝相关知识点总结

铝相关知识点总结1.铝的性质铝是一种化学性质稳定的金属,在常温下具有良好的韧性和塑性,可以轧制成薄板、挤压成型、拉伸成丝等。
铝的密度较低,为 2.70g/cm3,约为铁的1/3,因此具有较轻的重量。
另外,铝具有优良的导热性和导电性,对热和电的传导性能表现出较好的特性。
2.铝的生产工艺铝的生产主要是通过电解法从氧化铝中提取金属铝。
首先,氧化铝经过熔炼成为氧化铝电解质,然后在电解槽中进行电解,利用电流将氧化铝还原为金属铝。
此外,还可以通过熔炼还原法和金属热还原法等工艺提取铝。
3.铝的应用领域(1)航空航天领域:铝合金是航空航天领域最重要的结构材料,其轻质、高强度、耐腐蚀等优点使其成为制造飞机、飞船、卫星等航空器件的材料。
(2)建筑领域:铝合金因其良好的耐候性和装饰性能,被广泛应用于建筑结构、门窗、幕墙、铝板材等装饰材料。
(3)包装领域:铝制品被用于食品包装、药品包装等领域,因其对光线、氧气、水汽的良好阻隔性能,可以保护产品的质量和安全。
(4)汽车领域:铝合金被广泛用于汽车车身、发动机零部件等领域,以减轻汽车自重,提高燃油经济性和安全性。
(5)电子领域:铝是一种优良的导热导电材料,被应用于电子产品散热片、电解电容器壳体等领域。
4.铝的环保性铝具有良好的可回收性,可以循环利用。
铝制品在使用结束后可以通过回收再生工艺,重新生产成铝材料,减少对资源的消耗和环境的污染。
因此,铝被认为是一种环保的材料,符合可持续发展的要求。
5.铝的市场发展趋势随着全球工业化进程的加速和技术的不断进步,铝合金作为轻质、高强度、耐腐蚀的材料,将在航空航天、汽车、电子等领域得到更广泛的应用。
同时,铝在包装、建筑等领域的应用也将进一步扩大。
另外,绿色环保的理念将推动铝材料的可持续利用和再生利用。
因此,铝产业具有广阔的发展前景。
以上是对铝的相关知识点进行的总结,铝的轻质、耐腐蚀、导热导电等优点使得其在各个领域得到了广泛的应用,并且具有良好的市场发展前景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2节铝金属材料知识点总结
1 铝与铝合金
1.铝
(1)物理性质:硬度较,色质轻,密度为2.7g/cm,具有一定的耐磨性,有很好的
,熔点低(666.4℃),沸点高(2467℃)。
(2)化学性质①与非金属反应
a 与氧气反应:
常温下,铝被空气中的氧气氧化,表面生成,失去金属光泽。
点燃时,金属铝可以在氧气中燃烧:(方程式)
该反应的现象为,因而铝可用于制造燃烧弹、信号弹、火箭推进剂等。
b. 与氯气、硫等非金属反应(写出方程式)
②与酸的反应
a. 与非氧化酸(盐酸、稀硫酸)反应,有生成:(离子方程式)
b. 与氧化酸(硝酸,浓硫酸)反应,无氢气生成:Al+4HNO3 (稀)=
注意:Al遇冷的浓硫酸、浓硝酸会,但加热可反应。
③与碱的反应
化学方程式:
离子方程式:
④与金属氧化物的反应(铝热反应)
金属铝在高温下可与Fe2O3反应:(方程式)
说明:a该反应称为铝热反应,称为铝热剂。
利用铝热反应可焊接钢轨大截面的钢材部件,定向爆破,冶炼钒、锰等难熔金属。
2、铝合金
(1)合金:合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
一般来说,合金的性能优于纯金属,合金的熔点比它的各成分金属熔点都低,硬度比它的各成分金属大。
但合金的性质并不是各成分金属性质的总和。
(2)铝合金
金属铝中加入其他元素如铜、镁、硅、锌、锂等,即形成各种性能优良的铝合金。
①性质特征
铝合金具有等特点,并且表面易形成致密的氧化物保护膜而具有一定的能力。
②用途
铝合金主要用于建筑业、容器和包装业、交通运输及电子行业,如汽车车轮的骨架,硬盘抽取盒等。
另外,还广泛用于制造飞机构件。
2 铝的重要化合物
1.氧化铝
(1)存在:自然界中纯净的Al2O3为无色晶体,俗称刚玉,硬度仅次于金刚石,可作人造宝石。
(2)物理性质:色体,于水,熔点。
难分解,因而可做良好的耐火材料。
(3)化学性质
①与酸反应:Al2O3+HCl=离子方程式
②与碱反应:离子方程式
说明:氧化铝具有不同于一般氧化物的性质,既与强酸反应也与强碱反应,属于两性氧化物。
2.氢氧化铝
(1)物理性质:A l(O H)3是几乎于水的固体,具有性。
(2)化学性质与酸反应:Al(OH)3 +HCl=离子方程式
②与碱反应:离子方程式
说明:Al(OH)3与Al2O3一样,既与酸反应又与碱反应,具有两性,属于两性氢氧化物。
①受热易分解:大部分难溶性的氢氧化物在受热时可以分解生成相应的氧化物和水,写出Al(OH)3受热易分解方程。
(3)Al(OH)3的制取:
①铝盐与碱反应:用可溶性铝盐与弱碱氨水反应制Al(OH)3:
(方程式)离子方程式
说明:制取Al(OH)3也可用铝盐与强碱作用,但应严格控制加入碱的量,因为。
所以,实验室一般不采用这种方法制Al(OH)3。
②四羟基合铝酸盐与弱酸碳酸反应反应:
当CO2不足或适量时:;
CO2过量时:
说明:一般不用强酸,因为
(4)Al(OH)3的用途:由于A l(O H)3具有吸附性,既能凝聚水中悬浮物,又能吸附色素,因此A l(O H)3可作。
3 金属与金属材料
1.金属的分类
黑色金属:(黑色金属的颜色不一定是黑色,如纯净的铁、铬的颜色是银白色)
有色金属:
2.金属的通性:有金属光泽、有延展性,是电和热的良导体,具有还原性。
4.钢铁(1)生铁:(2)普通钢:(3)不锈钢:
5.金、银、铜等金属材料
(1)物理性质
①特性:金是色金属;银是色金属;铜是色金属。
②共性:硬度,熔点,密度,具有金属光泽、良好的。
(2)化学性质:金、银、铜都属于不活泼金属,相对而言,其活泼程度依次增强。
①金:金是最稳定的金属之一,在高温下也不能与氧气反应,不能被硝酸等强氧化性酸氧化。
②银:银虽然不能与盐酸、稀硫酸反应,但却能溶解在硝酸等强氧化性酸中:Ag+2HNO3 (浓)=AgNO3+NO2↑+H2O;3Ag+4HNO3 (稀)=3AgNO3+NO↑+2H2O
③铜:
a 与非金属单质反应:Cu+O2△Cu+S△;Cu+Cl2点燃
b 与酸反应:与银相似,铜不能与盐酸、稀硫酸反应,但却能溶解在硝酸等强氧化性酸中:
Cu+H2SO4(浓) △
Cu+HNO3 (浓)=
Cu+HNO3 (稀) =
c 与盐溶液反应:Cu+FeCl3=(离子方程式)
d 铜的锈蚀:铜在干燥空气中性质稳定,但在潮湿空气中会被腐蚀,在其表面逐渐形成一层绿色的铜锈:
6.铜的常见化合物
(1)颜色、溶解性:CuO——黑色、难溶;Cu2O——红色、难溶;Cu2S——黑色、难溶;CuSO4——白色、易溶;CuSO4·5H2O——蓝色、易溶;Cu2(OH)2CO3——绿色、难溶;Cu(OH)2——蓝色、难溶。
(2)化学性质
①氧化铜
a. 氧化铜与酸反应,例如:CuO+HCl=
b. 氧化铜具有弱氧化性,可与某些还原剂反应。
例如:
H2+CuO △;C+2CuO 高温2Cu+CO2↑;CO+CuO△;
c. 氧化铜在高温下可发生分解反应:4CuO高温2Cu2O+O2↑
②硫酸铜:CuSO4 晶体与无水CuSO4之间可以相互转化
CuSO4·5H2O△CuSO4+5H2O;CuSO4+5H2O=CuSO4·5H2O。
