无菌检查法方法验证及操作要点共29页文档
无菌检查方法验证方案

安徽捷众生物化学有限公司无菌检查方法(薄膜过滤法)验证方案文件编号:QY·TS·05·007-00批准日期:年月日实施日期年月日安徽捷众生物化学有限公司无菌检查方法(薄膜过滤法)验证方案目录1.验证目的2. 验证频次3. 验证操作内容与要求3.1. 验证操作试验3.2 试验菌要求3.3.验证方法步骤3.4. 验证准备3.5验证试验操作4.验证结果评价分析5.附件1.验证目的确认所采用的方法适合于供试品的无菌检查。
即确认供试品在该检验量、该检验条件下无抑菌活性,以保证检验结果的准确、可靠及检验方法的完整性。
2. 验证频次2.1. 建立药品的无菌检查法时2.2. 修订检验方法时2.3. 供试品的组分或原检验条件发生改变可能影响检验结果时3. 验证操作内容与要求:3.1. 验证时,按“供试品的无菌检查”的规定要求进行验证操作试验:3.1.1. 对每一试验菌应逐一进行验证。
3.1.2.硫乙醇酸盐流体培养基—金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、生孢梭菌。
3.1.3. 改良马丁琼脂培养基—白色念珠菌、黑曲霉。
3.2试验菌要求:3.2.1验证试验所用的菌株传代次数不得超过5代,并采用适宜的菌种保藏技术,以保证试验菌株的生物学特性。
3.2.2验证试验可在供试品的无菌检查之前或与供试品的无菌检查同时进行。
当同时进行时,若验证试验失败,则供试品的无菌检查结果是不成立的3.3.验证方法步骤:3.3.1验证试验的操作计划用3个不同批号产品按照无菌检查方法(薄膜过滤法)进行平行试验,通过计算回收率来判断无菌检查方法(薄膜过滤法)是否对产品有影响。
3.3.2试验结果可接受标准用无菌标准评价方法“0.9%氯化钠注射液(三层共挤膜袋)的无菌检查”对检品中无菌检查试验结果应显示3次独立的平行试验中,稀释剂对照组的菌回收率应不小于70%,试验组的回收率也不低于70%。
3.4. 验证准备:准备验证所需的供试品、培养基、试药试剂、仪器设备和菌种。
无菌检查方法验证
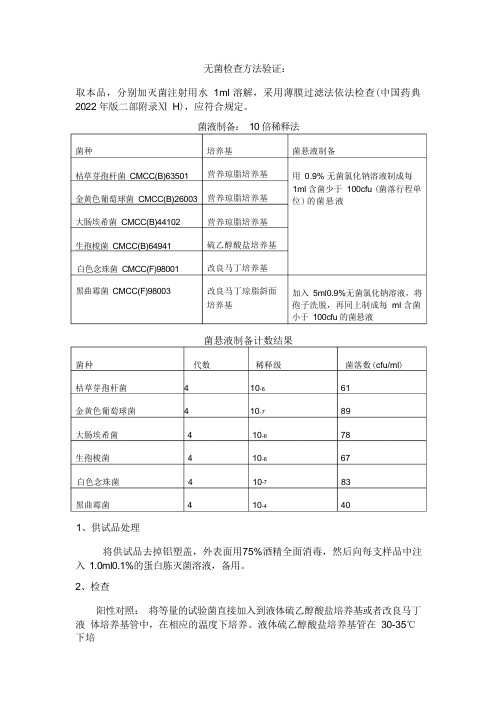
无菌检查方法验证:取本品,分别加灭菌注射用水 1ml 溶解,采用薄膜过滤法依法检查(中国药典 2022 年版二部附录Ⅺ H ),应符合规定。
菌液制备: 10 倍稀释法培养基 营养琼脂培养基营养琼脂培养基营养琼脂培养基硫乙醇酸盐培养基改良马丁培养基改良马丁琼脂斜面 培养基菌悬液制备计数结果菌种 代数 稀释级 菌落数(cfu/ml )枯草芽孢杆菌 4 10-6 61金黄色葡萄球菌 4 10-7 89大肠埃希菌 4 10-6 78生孢梭菌 4 10-6 67白色念珠菌 4 10-7 83黑曲霉菌 4 10-4 401、供试品处理将供试品去掉铝塑盖,外表面用75%酒精全面消毒,然后向每支样品中注 入 1.0ml0.1%的蛋白胨灭菌溶液,备用。
2、检查阳性对照: 将等量的试验菌直接加入到液体硫乙醇酸盐培养基或者改良马丁液 体培养基管中,在相应的温度下培养。
液体硫乙醇酸盐培养基管在 30-35℃下培菌种枯草芽孢杆菌 CMCC(B)63501 金黄色葡萄球菌 CMCC(B)26003 大肠埃希菌 CMCC(B)44102生孢梭菌 CMCC(B)64941白色念珠菌 CMCC(F)98001黑曲霉菌 CMCC(F)98003菌悬液制备用 0.9% 无菌氯化钠溶液制成每 1ml 含菌少于 100cfu (菌落行程单 位)的菌悬液加入 5ml0.9%无菌氯化钠溶液,将 孢子洗脱,再同上制成每 ml 含菌 小于 100cfu 的菌悬液养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
阴性对照:将灭菌的液体硫乙醇酸盐培养基或者改良马丁液体培养基管直接放在相应的温度下培养。
液体硫乙醇酸盐培养基管在30-35℃下培养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
样品 (薄膜过滤法):每种实验菌取10 支处理好的供试品溶液,将溶液合并后加入制备好的菌悬液1ml,用0.1%的蛋白胨灭菌溶液稀释至100ml,按薄膜过滤法过滤,取出滤膜,将其分为3 等份,分别置于含硫乙醇酸盐流体培养基及改良马丁培养基的容器中,其中一份作为阳性对照用。
无菌微生物限度检查及方法验证

甘油冷冻管保藏法
• 将待保藏菌接种至平板或琼脂斜面,培养 • 用无菌接种环轻轻刮取菌台,用接种环使细菌充分扩散到预先装于
试管中的无菌蒸馏水中 • 调整菌液浓度,使其等同于麦氏比浊管第10号管 • 向已制备好的菌悬液中加入等体积、浓度为20%的无菌甘油,得到
10%甘油菌悬液。 • 轻轻振摇小管,使内容物充分混合,分装于无菌小试管。 • 制好的甘油冷冻管最好在-30℃条件下贮存。
•建立无菌室使用登记册
•使用日期,时间,使用人,设备运转状况,温、湿度,洁净度状况 (沉降菌数、浮游菌数、尘埃粒子数),报修原因,报修结果,清洁 工作(台面、地面、墙面、天花板、传递窗、门把手),消毒液名称 等
微生物实验室的质量管理
实验室使用管理
1. 每天工作前用消毒液消毒工作台,开紫外灯(最少半小时)进行空气消 毒,每月定期做彻底清洁工作,适当时用消毒剂进行熏蒸。
• 将微生物接种至一新鲜培养基上/内,每萌发一次即称为“一代”。
冷冻真空干燥保藏法
主要是将待保藏菌种混于有保护作用介质内制成菌液,分装在安 瓿中于冷冻条件下使其快速冻结,因冻结可使晶型细致,不致损伤活 菌细胞。然后用真空抽气减压,是安瓿内的冰晶液体升华,水气迅速 被真空抽走,冰晶型的菌液很快变成疏松的干燥固体物,最后在真空 状态下熔封管口,使干燥物在局部真空条件下封存,并置冷暗处,在 很长时间内菌种仍可维持活力不变。
•应定期更换消毒剂品种,按标准准确配制。
微生物实验室的质量管理
一、菌种的保存与管理
菌种名称:金黄色葡萄球菌
1. 菌种—特殊的标准品 应保持基生长特性和减少污染,是微生物实 验结果一致性的重要保证。
2. 制定菌种保藏管理制度
菌种系列号:[CMCC(B)26003]
无菌、微生物限度检查及方法验证

01
02
03
直接接种法
将样品接种在培养基上, 观察是否有微生物生长。
薄膜过滤法
将样品通过薄膜过滤,收 集滤膜上的微生物,再进 行培养。
离心沉淀法
将样品离心,收集沉淀物 中的微生物,再进行培养 。
无菌检查的注意事项
确保环境洁净
无菌检查需要在洁净的环境中进行,以避免 外界微生物的污染。
避免样品中防腐剂的影响
方法验证
方法验证的定义与目的
定义
方法验证是对检测方法的可靠性、准确性和可重复性的评估过程,以确保该方 法能够满足预期的检测要求。
目的
方法验证的目的是确保所采用的无菌、微生物限度检查方法具有足够的灵敏度 、特异性、重现性和可操作性,以保证检测结果的准确性和可靠性。
方法验证的流程
准备验证计划
制定详细的验证计划,包括验 证实验的设计、实验步骤、数 据收集和分析等内容。
进出口检验
进出口药品需要进行严格的微生物限度检查,以确保药品符合进口 国或地区的质量标准,保障公众健康。
方法验证在药品质量控制中的应用
验证无菌、微生物限度检查方法的可靠性
通过方法验证可以确保无菌、微生物限度检查方法的准确性和可靠性,提高药品质量控制 水平。
评估检测方法的性能指标
方法验证过程中需要对检测方法的性能指标进行评估,如灵敏度、特异性、重现性等,以 确保检测结果的准确性和可靠性。
如果样品中含有防腐剂,可能会抑制微生物 的生长,因此需要进行相应的处理。
正确选择培养基
根据待测样品的特性,选择适合的培养基, 以确保微生物能够正常生长。
定期进行方法验证
无菌检查方法需要定期进行验证,以确保其 可靠性。
0义与目的
药典无菌检查方法验证及操作要点

2. 培养基
2.1 培养基的灭菌 配制后应采用验证合格的灭菌程序灭菌。
2.2 培养基的保存 制备好的培养基应保存在2~25℃、避光的
环境。培养基若保存于非密闭容器中,一般在三 周内使用;若保存于密闭容器中一般可在一年内 使用。
•
2.3 培养温度 硫乙醇酸盐流体培养基置30~35℃培养
。改良马丁培养基置23~28℃培养。 2.4 培养基的适用性检查
•
黑曲霉
改良马丁琼脂斜面培养基上, 23~28℃培养5~7天,
加入3~5ml 0.9%无菌氯化钠溶液,将孢子洗
脱
吸出孢子悬液(用管口带有薄的无菌
棉花或纱布能过滤菌丝的无菌毛细吸管)至无菌
试管内
用0.9%无菌氯化钠溶液制成每lml含孢
子数小于l00cfu的孢子悬液。 •
4.3 薄膜过滤法 将规定量的供试品按薄膜过滤法过滤,冲
药典无菌检查方法验证 及操作要点
2020年4月29日星期三
1 前言 1.1 定义
无菌检查法系用于检查药典要求无菌的药
品、原料、辅料及其他品种是否无菌的一种方
法。若供试品符合无菌检查法的规定,仅表明
了供试品在该检验条件下未发现微生物污染。
•
1.2 实验环境条件要求
无菌检查应在环境洁净度10 000级下的 局部洁净度100级的单向流空气区域内或隔 离系统中进行,其全过程必须严格遵守无 菌操作,防止微生物污染。单向流空气区、 工作台面及环境应定期按《医药工业洁净 室(区)悬浮粒子、浮游菌和沉降菌的测试方 法》的现行国家标准进行洁净度验证。隔 离系统按相关的要求进行验证,其内部环 境的洁净度须符合无菌检查的要求。
3)枯草芽孢杆菌
(Bacillussubtilis)[CMCC(B)63 501]
无菌检查法及其验证

无菌检查法及其验证
第8页
培养基储存
• 制备好培养基应该保留在2-25℃、避光环 境,若保留于非密闭容器中,普通在3周内 使用;若保留于密闭容器中,普通可在1年 内使用。
※应结合实际情况进行验证,以确定培养基 使用期。
无菌检查法及其验证
第9页
培养基适用性检验
本检验可在供试品无菌检验前或与供试品 无菌检验同时进行。 • 无菌性检验
无菌检查法及其验证
第24页
阳性对照试验
• 目标:①验证供试品经灭活后或用其它方式(稀 释、冲洗等)处理后是否仍有抑菌或杀菌作用, 确保检验条件符合要求,预防出现假阴性。②培 养条件是否符合要求。
• 应依据供试品特征选择阳性对照菌。 ①无抑菌及抗革兰阳性-金黄色葡萄球菌 ②抗革兰阴性-大肠埃希菌
③抗厌氧菌-生孢梭菌 ④抗真菌-白色念珠菌
无菌检查法及其验证
第28页
• 对无菌检验试验所用设备及环境微生物监控结果不 符合无菌检验法要求;
• 回顾无菌试验过程,发觉有可能引发微生物污染原 因;
• 供试品管中生长微生物经判定后,确证有微生物生 长是因无菌试验中所使用物品和(或)无菌操作技 术不妥引发。
无菌检查法及其验证
第29页
试验若经确认无效,应重试。重试时,重 新取同量供试品,依法重试,若无菌生长, 判供试品符合要求,若有菌生长判供试品 不符合要求。
2支
1 ml 5天
※其中硫乙醇酸盐及改良马丁培养基都有 1支不接种作为空白 ※接种量 <100cfu(不能多)
无菌检查法及其验证
第14页
培养基适用性检验
⑤结果判断
• 空白对照应无菌生长,若加菌培养 基管均生长良好,判该培养基灵敏 度检验符合要求。
无菌检验技术—无菌检查方法验证

• 3.3无菌检查的范围 • 凡进入人体无菌部位(人体的血液循环பைடு நூலகம்统、肌肉、皮下组织)或接触创
伤、溃疡面等部位而发生作用的制品或要求无菌的材料、无菌器具均应 进行无菌检查。对于规定灭菌的药物,包括注射剂及用于体腔、严重烧 伤、溃疡及眼科用药等,必须严格无菌,即在规定检验量的供检品中不 得检出活微生物。
任务3 无菌检验方法验证 知识点3 无菌检查方法
• 3 无菌检查方法 • 3.1无菌检查法概念 • 无菌检查法是指检查《中国药典》要求应无菌的药品、医疗器具、原料、 辅料及其他要求无菌的品种是否染有活菌的一种方法(供试品符合无菌检查 法的规定,仅进表明了供试品在该检查条件下未发现被微生物污染)。 • 为了保证药品的卫生质量,保证药品在临床上的安全使用和保障人民的健 康,《中国药典》规定:注射用药、灭菌的外用制剂等均需做无菌检查。
• 的制剂。心脏瓣膜以及固定金属板和有机器材等。
• (3)冲洗剂,即用于冲洗开放性伤口或腔体的冲洗剂。
• (4)眼用制剂。
• (5)用于烧伤、创伤或溃疡的制剂。包括:用于烧伤或严重创伤的局部用 散剂、凝胶剂、软膏剂、乳膏剂;用于烧伤、创伤或溃疡的气雾剂和喷 雾剂等。
• (6)用于手术、耳部伤口或耳膜穿孔的滴耳剂或洗耳剂。 • (7)用于手术或创伤的鼻用制剂。 • (8)用于止血并可被组织吸收的制剂。如明胶发泡剂、凝血酶等,用于止
• 3.2验证目的 • 确认所用的无菌检查方法适用于“所有无菌产品”的无菌检查。 • 确保检查结果的准确性、可靠性、准确性和重现性以及检查方法的完整 性。 • 通过对不同批次产品无菌检查的比较,对医用即无菌产品的生产全过程 进行质量监控。 • 3.3验证范围 • “所有无菌产品”的无菌检查。
• 3.4验证条件 • 3.4.1验证用菌株 • 金黄色葡萄球菌 • 菌种传代次数铜绿假单胞菌 • 枯草芽孢杆菌 • 生孢梭菌 • 白色念珠菌
无菌检验方法验证

⽆菌检验⽅法验证1. ⽬的(PURPOSE)规范药品质量检查⽅法的管理,确保药品所⽤⽆菌检验⽅法的可⾏性、检验结果的可靠性。
2. 适⽤范围(SCOPE)适⽤于药品的⽆菌检验⽅法验证。
3. 职责(RESPONSIBILITY)质量控制部微⽣物组负责4. 关键词(KEY WORDS)⽆5. 定义(DEFINITION)⽆6. 程序(PROCEDURE)6.1 验证的原理6.1.1验证试验⽅案的设计需要满⾜两个⽅⾯的要求:1)在检测前样品的预处理⽅式能有效抵消(或中和)产品中抑菌性;2)样品的预处理⽅式和检测过程以及培养条件等均不会影响样品中的微⽣物⽣长。
6.1.2 对同类产品三个不同批号样品进⾏微⽣物挑战试验后,通过⽐较三批样品中挑战菌株的恢复⽣长结果来评价整个检验⽅法的准确性、有效性和重现性。
6.2 验证试验⽤供试品的制备与检查6.2.1 样品组(A组):⽤适当的⽅法中和样品,再向其中接⼊少量的挑战微⽣物(接种量控制在10~100cfu之间),按照常规检测程序和培养条件检查挑战微⽣物的恢复⽣长情况。
6.2.2 蛋⽩胨对照组(B组):除了⽤A溶液(0.1%蛋⽩胨溶液)替代实际样品外,中和⽅式、检测程序和培养条件等均与样品组(A组)相同。
6.2.3 阳性对照组(C组):不经中和处理,将微⽣物挑战菌株直接接种于培养基培养,接种量与前两组相同,均在10~100cfu 之间。
6.3 验证⽤挑战微⽣物6.3.1⽤于验证试验的挑战微⽣物要具有⼴泛代表性,⾄少包括需⽓菌、厌氧菌、兼性菌等,所选⽤的菌株要基本上涵盖样品中可能存在的各类微⽣物。
在验证中常选⽤的微⽣物有⾦黄⾊葡萄球菌、枯草芽孢杆菌、⼤肠杆菌、铜绿假单胞菌、⽣孢梭菌、⽩⾊念珠菌、⿊曲霉等。
6.3.2 挑战微⽣物的培养条件及贮存条件需按《QC-6.2菌种管理》进⾏,以确保各代微⽣物细胞的⽣理状态保持稳定⼀致。
6.3.3验证时,选择的挑战微⽣物传代次数不应超过5代,并且详细记录所⽤菌株的来源、传代次数。
无菌检查法要点介绍及检验操作关键点培训

无菌检查法要点介绍及检验操作关键点培训无菌检查法是一种用来检验物品是否受到微生物污染的方法。
在医疗、食品生产等领域都有广泛的应用。
下面我们就来介绍一下无菌检查法的要点和检验操作关键点。
一、无菌检查法的要点介绍1.原理:无菌检查法主要是通过将待检物品在无菌条件下接种到含有富集培养基的培养基上,然后进行培养观察,确定是否有微生物生长来判断物品是否受到污染。
2.方法:无菌检查主要包括直接接种法和膜过滤法。
直接接种法适用于液体和固体物品的检验,而膜过滤法适用于液体物品的检验。
通过这两种方法可以有效地检验物品是否受到微生物污染。
3.操作流程:进行无菌检查的操作流程一般包括样品的采集、无菌操作台的准备、操作者的衣着换洗、培养基的配置、样品的接种和培养观察等环节。
4.结果判定:通过观察接种后的培养基是否有微生物生长,来判断物品是否受到微生物污染。
根据不同的培养基和生长条件,可以确定是否存在细菌、真菌等微生物。
5.记录和报告:无菌检查的结果需要进行记录和报告,如样品信息、接种情况、培养观察结果等,以便于后续的跟踪和管理。
二、无菌检查法的操作关键点培训1.无菌操作培训:操作者需要接受无菌操作的相关培训,包括穿戴无菌服、洗手消毒、操作台的准备等技能的培训。
2.培养基的准备:操作者需要了解不同类型的培养基的准备方法和要求,包括培养基的pH值、温度、灭菌条件等。
3.样品采集:对于不同类型的样品,采集方法和采集点会有所不同,操作者需要了解样品采集的相关知识和技能。
4.接种方法:无菌操作台的准备、样品的接种和培养基的密封等操作步骤需要掌握,以保证接种的无菌条件。
5.培养观察:操作者需要了解不同微生物的培养观察条件和特征,以便于正确地判断培养基上的微生物生长情况。
6.结果判定:根据培养基上的微生物生长情况来判断样品是否受到微生物污染,需要操作者具备相关的判定能力。
7.记录和报告:对无菌检查结果进行准确地记录和报告,需要操作者具备良好的记录和沟通能力。
新版中国药典中关于无菌检查法的要点

新版《中国药典》中关于无菌检查法的要点7月2日,国家药品监督管理局、国家卫生健康委发布公告,正式颁布2020年版《中国药典》,新版药典将于今年12月30日起正式实施。
新版药典对环境监测、无菌检查方法、微生物检测、灭菌验证等都做出了相关要求。
本文结合了《医疗器械无菌试验检查要点指南》中的检查内容,对新版《中国药典》中关于无菌检查法的要点进行了整理,供大家参考。
1、无菌检查要求(1)无菌检查应在无菌条件下进行,试验环境必须达到无菌检查的要求,检验全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。
(2)单向流空气区域、工作台面及受控环境应定期按医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度确认。
隔离系统应定期按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。
(3)日常检验需对试验环境进行监测。
注意:“受控环境”主要的关注指标应该是悬浮粒子、浮游菌和沉降菌受控,其他如压差、温湿度等的指标和监测频度也应满足《药品洁净实验室微生物监测和控制指导原则》的要求。
2、培养基的制备及培养条件(1)培养基可使用按该处方生产的符合规定的脱水培养基或商品化的预制培养基。
配制后应采用验证合格的灭菌程序灭菌。
(2)制备好的培养基若不即时使用,应置于无菌密闭容器中,在2~25°C 、避光的环境下保存,并在经验证的保存期内使用。
注意:新版药典将“成品培养基”调整为“商品化的预制培养基”。
新版药典不再强调“非密闭-三周”、“密闭-一年”的规定,便于企业实践掌握;但企业应最好具备稳定的验证过程和结果,以支持封闭条件和保存周期。
3、培养基的适用性检查无菌性检查每批培养基一般随机取不少于 5 支(瓶),置各培养基规定的温度培养14 天,应无菌生长。
注意:应考虑实践中用于无菌性检查培养的试管装灭菌培养基与无菌检验用的三角瓶装培养基在灭菌方法验证时的两种包装的温度、F0等结果。
无菌检查法要点介绍及检验操作关键点培训

无菌检查法要点介绍及检验操作关键点培训1.无菌检查法是用来检验物体表面或物体内部是否有细菌或其他微生物存在的方法。
The aseptic inspection method is used to test whether there are bacteria or other microorganisms on the surface or inside of an object.2.无菌检查法要点包括选择合适的培养基、控制温度和湿度、以及严格的无菌操作。
The key points of aseptic inspection include selecting appropriate culture medium, controlling temperature and humidity, and strict aseptic operation.3.检验操作的关键点包括消毒操作、避免空气污染、以及避免人为污染。
The key points of inspection operation includedisinfection operation, avoiding air pollution, and avoiding artificial contamination.4.检查前需确保工作台面、器具和试剂都已进行消毒处理。
Before the inspection, it is necessary to ensure that the workbench, equipment, and reagents have been disinfected.5.操作人员要做好无菌操作前的准备工作,包括穿戴好无菌手套、口罩和工作服。
Operators should prepare for aseptic operation, including wearing sterile gloves, masks, and work clothes.6.在进行无菌操作时,要控制好空气流动,避免造成物体表面的污染。
医疗药品无菌检查法验证(ppt 29页)

C组:阳性对照组,不经中和处理,将实验菌株 直接接种于培养基中(接种量少于100cfu)。
b.结果分析:A组与B组微生物生长数量相似,表明中 和剂的中和方式有效消除了样品的抑菌性,如果B 组与C组的微生物数量相似,表明样品预处理用中 和剂的毒性、检测程序和培养条件等均不影响微 生物生长。样品如无抑菌性,省去B组试验,A组 与C组直接比较。A组微生物生长数量不及C组微 生物生长数量,表明试验用器具材料或培养条件 等方面存在对微生物生长不利因素。
5.3.2 参照药典规定确定培养基用量,按无菌检查要求向上 述其中一瓶加入规定量供试品,另一瓶为阳性对照。
5.3.3 将种好的容器按药典规定温度培养14 days。
5.3.4 验证结果评价:
供试品与阳性对照相比、供试品容器内微生物生长不明显, 说明有抑菌性。可使用中和剂如比温-80。 β-内酰胺酶 等消除抑菌效果。中和剂不能消除抑菌作用,适当增加培 养基体积稀释。
3.4.4 灵敏度检查:
3.4.4.1检查用菌株传代不得超过5代。 3.4.4.2常用菌株: 金黄色葡萄球菌(CMCC(B)26003) 铜像假单胞菌[CMCC(B)10104] 枯草芽胞杆菌[CMCC(B)63501] 生孢梭菌[CMCC(B)64941] 白色念珠菌[CMCC(F)98001] 黑曲霉[CMCC(F)98003] 3.4.4.3菌液配制、保存、接种培养按药典要求。 3.4.4.4结果判断:空白对照应无细菌增长,加菌液的培养基管均
的有效性,使用量及微生响。 ③ 不需前处理的供试品免做。
4.5.4 无抑菌性样品的验证方法:依据产品溶解性和 微生物限度选择合适的中性稀释剂溶解和稀释, 用直接接种法验证,常用中性稀释液或淋洗液。
无菌检查法标准操作程序要点

1目的建立一个无菌检查法标准操作程序,保证实验的准确性、可靠性。
2范围适用于原料、辅料及成品的无菌检查。
3职责微生物检验员遵照执行。
4内容无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。
若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在无菌条件下进行,试验环境必须达到无菌检查的要求,检验全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区、工作台面及环境应定期按医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度确认。
隔离系统应定期按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。
日常检验还需对试验环境进行监控。
4.1 培养基硫乙醇酸盐流体培养基主要用于厌氧菌的培养,也可用于需氧菌的培养;胰酪大豆胨液体培养基用于真菌和需氧菌的培养。
4.1.1 培养基的制备及培养条件培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基或成品培养基。
配制后应采用验证合格的灭菌程序灭菌。
制备好的培养基应保存在2〜25°C、避光的环境,若保存于非密闭容器中,一般在3 周内使用;若保存于密闭容器中,一般可在一年内使用。
4.1.1.1 硫乙酵酸盐流体培养基胰酪胨15. 0g 氯化钠 2. 5g酵母浸出粉 5. 0g 新配制的0. 1 % 刃天无水葡萄糖 5.0g 青溶液 1.0mlL-胱氨酸0. 5g 琼脂0. 75g硫乙醇酸钠0.5g 水1000ml(或硫乙醇酸)(0.3ml)除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节p H 为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节p H , 使灭菌后在25℃的p H 值为7.1 土0.2。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。
