临床试验审批表(药物类)
临床试验审批表(药物类)

临床试验审批表(药物类)
临床试验审批表(药物类)
项目名称:
申请科室:
试验范围:国内多中心□国际多中心□亚洲多中心□
项目负责人(签名):职称:手机号:
该负责人目前在研项目:项;与该方案有竞争项目项质控员(签名):职称:手机号:
试验药物类别:新药类期或其他
申办单位:联系人及电话:
CRO: 联系人及电话:
SMO:联系人及电话:
一、该药物的临床试验批准机关:
批准文件号:
二、试验目的:
三、组长单位:负责人
四、受试者是否需要签署知情同意:是□否□
您认为知情同意书内容是否完整:是□否□
五、试验样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、试验药剂量用法疗程
剂量用法疗程
六、对照样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、对照组剂量用法疗程
七、适应症:
八、禁忌症(注意事项):
九、可能出现的不良反应:
1、4、
2、5、
3、6、
十、对不良反应是否有相应的防治措施
1、有□无□未考虑□
2、有□无□未考虑□
3、有□无□未考虑□
4、有□无□未考虑□
5、有□无□未考虑□
6、有□无□未考虑□
填表时间:年月日
药物临床试验机构审批意见:
□同意立项
□补充完善资料后同意
□不同意原因:
□其他:
机构主任签字:日期:年月日。
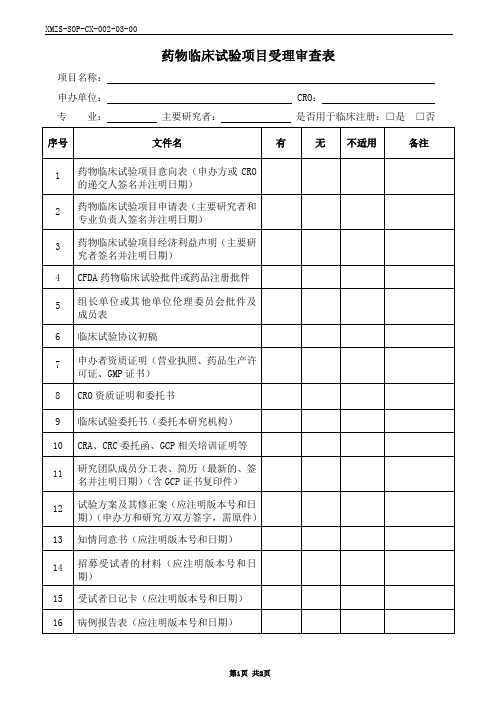
药物临床试验项目受理审查表
试验用药品检验报告(包括试验药物和对照药品)
20
设盲试验的破盲规程
21
保险合同或说明
22
参加单位名单及联系方式
23
其他
备注:
1.所有文件提交纸质版并加盖首页章和骑缝章,同时提交电子版。
2.目录中要求注明版本号和日期的,请务必在备注栏写明。
3.提交的材料按照清单的顺序依次排列,如需自行添加目录的,请写明添加的内容。目录顺序不能变动,如该项资料没有,请空页。
4.请使用快劳夹(黑色,高315mm)装订,且必须提供册封,册封注明项目名称和申办方名称。
5.送审人签字为本项目的主要研究者。
机构审查结论:□同意递交伦理,机构编号:
□不同意递交伦理,原因:
送审人签字:时间:年月日
受理人签字:时间:年月日
4
CFDA药物临床试验批件或药品注册批件
5
组长单位或其他单位伦理委员会批件及成员表
6
临床试验协议初稿
7
申办者资质证明(营业执照、药品生产许可证、GMP证书)
8
CRO资质证明和委托书
9
临床试验委托书(委托本研究机构)
10
CRA、CRC委托函、GCP相关培训证明等
11
研究团队成员分工表、简历(最新的、签名并注明日期)(含GCP证书复印件)
药物临床试验项目受理审查表
Hale Waihona Puke 项目名称:申办单位:CRO:
专业:主要研究者:是否用于临床注册:□是□否
序号
文件名
有
无
不适用
备注
1
药物临床试验项目意向表(申办方或CRO的递交人签名并注明日期)
2
药物临床试验项目申请表(主要研究者和专业负责人签名并注明日期)
药物临床试验项目审批表

签字: 年月日
例
二. 申办方信息
公司名称
申办方
通讯地址 法人代表
联系人
联系电话
公司名称
CRO
通讯地址
(如有)
法人代表
联系人
联系电话
临床监查员姓名
联系电话
组长单位(如有)
组长单位主要研 究者(如有)
三. 附件材料(纸质版和电子版均需要)
□ NMPA 药物临床试验批件或通知书(上市药物应有药品注册证书)
□ 药物检验合格报告
GCP 机构办主任签字:
学科办主任签字:
年月日 伦理委员会审查意见:
年月日
盖章: 年月日
1.合同/协议 2.法律意见书: GCP 机构办审批意见: 学科办意见:
财务部意见:
机构副主任意见:
审计科意见:
总会计师意见:
机构主任意见:
签字: 年月日
签字: 年月日
签字: 年月日
签字: 年月日
签字: 年月日
加盖单位红章。
□ 项目经理的法人委托书原件,项目经理身份证或/和工作证复印件,GCP 证书,
并加盖单位红章。
□ 临床试验方案(需注明版本号)
□ 病例报告表样表(需注明版本号)
□ 知情同意书样本(需注明版本号) □ 研究者手册(需注明版本号) □ 受试者招募方案和广告(需注明版本号) □ 课题负责人简历、医师资格证、注册证、GCP 培训证书 □ 药物临床试验团队名单 □ 申办方公司/CRO 公司委托医院试验的委托函,加盖申办方公章。 □ 组长单位伦理批件(如有) □ 保险凭证(如有) □ 其他
申办方单位联系人签字(盖章):
年月日
经费预算情况(请罗列该项目涉及的所有经费情况,包括但不限于检验检测费、
临床试验立项申请审批表CTI-A--A02-V0临床试验立项申请审批表

临床试验申请审批表(申请者签名、盖章并签署日期)
2.
国家食品药品监督管理总局《药物临床试验批件》部分Ⅳ期可不要求
3.
申办者资质证明及委托函;
4.
试验用药物检验合格报告
5.
临床试验方案摘要
6.
临床试验方案(注明版本号和日期)
7.
病例报告表(注明版本号和日期)
8.
知情同意书(注明版本号和日期)
9.
研究者手册(注明版本号和日期)
临床试验申请审批表(申请者签名、盖章并签署日期)
2.
申办者资质证明(法人证书、营业执照、GMP证书)
3.
医疗器械说明书
4.
注册产品标准或相应的国家、行业标准
5.
试验用医疗器械/诊断试剂研制的质量保证和质量控制文件
6.
试验用医疗器械/诊断试剂的自检报告
7.
临床试验方案摘要
8.
临床试验方案(注明版本号和日期)
□义肢□特殊管理药物(麻醉药申办者签字
(盖章)
日期
以下由专业科室及机构办填写
专业科室评估:
1.是否能保证招募足够的受试人群:是□,否□
2.研究者是否具备足够的试验时间:是□,否□
3.是否具备相应的仪器设备和其他技术条件:是□,否□
4.目前科室承担的与试验药物疾病相同的在研项目:无□,1项□,2项□,2项以上□
科室是否使用过同类药物或医疗器械是□否□
试验用产品
□药物
名称
CFDA批件号:
□食品
名称
CFDA批件号:
□医疗器械
1.□境内II类□境内III类□进口II类□进口III类
2.□有源□无源
3.□植入□非植入
药物临床试验伦理初始审查申请与审批表

年月日——年月日
分类
1.□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期2.□新药□仿制药3.□国家药品监督管理局批文:
多中心临床试验
ห้องสมุดไป่ตู้1.□是□否
2.该临床试验方案有无其他伦理委员会意见?
□有(请提供副本)□无3.本中心招募受试者人数/总人数
临床试验对象
□正常人□病人
受试者年龄范围
弱势群体
(如涉及请提交弱势群体保护措施)
□是□否
11
组长单位伦理委员会审查意见(如有)
□是□否
12
其它伦理委员会对该项目伦理审查的重要决定(如有)
□是□否
13
申办者及代理人资质证明文件(如有)
□是□否
14
国家药品监督管理局临床试验批文
□是□否
15
保险合同
□是□否
16
申办者保证所提供资料真实性的声明
□是□否
17
研究者保证所提供资料真实性的声明
□精神疾病□病危者□孕妇□文盲
□未成年人□认知损伤者□其他(请具体说明)
□无
要求排除对象
□无□男性□女性□儿童□其他(请具体说明)
要求具备的特殊条件
□重症监护□隔离区□手术□儿童重症监护
□静脉输注□计算机断层扫描□基因治疗
□义肢□管制药品(麻醉药/精神药)□妇科
□其他(请具体说明)□无
需提交的文件
1
□是□否
18
其他与伦理审查相关的材料
□是□否
主要研究者签名:
主要研究者所在科室意见:
负责人签名:
临床试验机构的药物器械临床试验管理部门意见及签章:
签章
年月日
伦理委员会审查意见:
药物临床试验申请审批表

3.申办者对试验过程质量保证的能力:强□,一般□,弱□
评估意见:同意□ →主要研究者:研究者:
不同意□
机构办主任签字:
日期:年月日
3.是否具备相应的仪器设备和其他技术条件:是□,否□
4.目前科室承担的与试验药物疾病相同的在研项目:无□,1项□,2项□,2项以上□
5.主要研究者在研科研课题:无□,1项□,2项□,3项□,3项以上□
6.主要研究者:
评估意见:同意□,不同意□
主要评估者签字:
日期:年月日
机构办公室评估、立项备案:
1.临床前研究资料是否齐全:是□,否□
药物临床试验申请审批表
项目名称
试验类型
Ⅱ期□,Ⅲ期□,IV期□,其他□
承担科室
临床试验项目主要研究者PI联系电话临床试验专业负责人联系电话
申办者/CRO
申办者/CRO项目经理
联系电话
申办者/CRO监察员CRA
联系电话
专业科室评估:
1.是否能保证招募足够的受试人群:是□,否□
2.研究者是否具备足够的试验时间:是□,否□
药物临床试验立项资料审核表

备注:
如为注册临床试验项目(BE除外),本条款任何一项为“否”且括号中也为“否”,本条款不合格;如为BE项目或非注册临床试验项目,本条款不适用。
3
组长单位伦理委员会批件(如有)
□是□否□NA
3.1 设组长单位
□是□否
3.2盖申办方红章
□是□否
3.3附签名的伦理委员会成员表
□是□否
备注:
7
药品说明书(对照药品、联合用药品、IV期药物等)
□是□否□NA
7.1 有上市后药品
□是 □否
7.2盖申办方红章
□是 □否
7.3 涵盖了方案中所有的上市药品
□是 □否
备注:
如有上市后药品,本条款均为“是”,本条款合格;如无上市后药品条款不适用。
8
主要研究者资质
□是□否
8.1 履历表已签名、签日期
□是 □否
□是 □否
备注:
本条款任何一项为“否”,本条款不合格。
12
(电子)病例报告表(样表)
□是 □否 □ NA
12.1 有病例报告表
□是 □否
12.2盖申办方红章
□是 □否
12.3为本项目病例报告表
□是□否□NA
备注:
如果有病例报告表,本条款任何一项为“否”,本条款不合格;如果无病例报告表,本条款不适用。
药物临床试验立项资料审核表
项目名称
方案编号
专业组
主要研究者
序号
内容
是否合格
1
药物临床试验立项申请表
□是□否
1.1盖申办方红章
□是□否
1.2项目名称与方案一致
□是□否
1.3 主要研究者签名、签日期
药物临床试验申请表药物临床试验申请表
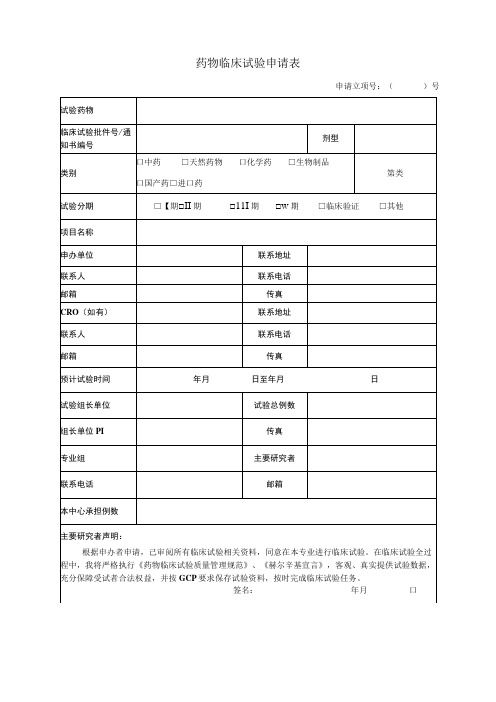
申请立项号:()号
试验药物
临床试验批件号/通知书编号
剂型
类别
口中药□天然药物口化学药□生物制品
口国产药□进口药
第类
试验分期
□【期□II期□11I期□w期□临床验证□其他
项目名称
申办单位
联系地址
联系人
联系电话
邮箱
传真
CRO(如有)
联系地址
联系人
联系电话
邮箱
传真
预计试验时间
年月日至年月日
□
□
15
招募受试者材料(包括广告)
□
□
16
保险凭证
□
□
17
其他有关资料(受试者日记卡、试验协议初稿、光盘、
CRC授权委托书等,如有必要请自行增加)
□
□
递交人(PI):日期:年月日
机构办公室审核人签字:日期:年月日
备注:1、递交的材料封面均盖上公章,递交一份完整资料即可;
2、如有特殊情况,请在备注栏说明。
□
□
7
病例报告表(样表)
□
□
8
知情同意书(盖章)
□
□
9
申办者/合同研究组织;第三方检测机构资质证明
□
□
10
申办者对监查员的授权委托书
□
□
11
试验药物的药检证明
□
□
12
对照药品的药检证明、药品说明书
□
□
13
研究团队的人员组成名单及分工表
□
□
14
主要研究者及参加试验其他研究者的最新简历
(签名并注明日期)
签名:年月口
机构办公室审查意见:
AA医院药物临床试验合同审批表

合同金额(元)
合同金额(大写)
临床批件 □药检报告 □研究者手册 □伦理委员会批件
主要研究者审核意见
签名:
日期
年月日
专业负责人审核意见
签名:
日期
年月日
临床试验研究中心办公 室审核意见
签名:
日期
年月日
财务处审核意见 审计处审核意见
签名:
日期
年月日
(合同总金额>5 万时) 临床试验研究中心 审核意见
签名: 签名:
YWSYHT:
AA 医院药物临床试验合同审批表
试验药物名称
试验全称
申办者
合同单位
合同类型
主协议 □补充协议 □CRC 协议 □其他:
类别
□中药 化学药 □生物制品 □放射性药 □进口药 第类
□其他(请注明):
临床研究分期
□ Ⅰ期 □Ⅱ期 Ⅲ期 Ⅳ期 生物等效
试验
剂
型
□临床验证 □Ⅰ期方法学 □其他(请注明):
日期
年月日
日期
年月日科研处审批意见签名: Nhomakorabea日期
年月日
主管院长审批意见 (合同金额≥ 30 万元
时)
签名:
日期
年月日
总会计师审批意见 ( 合 同 金 额 ≥ 30 万 元 时)
签名:
日期
年月日
院长审批意见 (合同金额>50 万元
时)
签名:
日期
年月日
备注: 请科研处处长、主管院长、院长根据审批权限在合同的我院法人/法人委托人处签字或书面委托 他人签字。
药物临床试验申请审批表

试验名称
CFDA批件号
药物名称
药物剂型
适应症
注册分类
化药类生物制剂类进口注册国际多中心其他
试验分期
Ⅰ期Ⅱ期Ⅲ期Ⅳ期生物等效性试验临床验证
项目立项类别
新启动项目增加中心项目
申请审查形式
快速审查会议审查
申办者
联系方式
CRO(如有)
联系方式
组长单位
主要研究者
本中心承担专业
主要研究者
试验计划完成总例数
本中心计划完成例数
申办者
代表人(签章):
日 期:
CRO
(如有)
代表人(签章):
日 期:
研究专业
审查意见
同意,进入机构审查程序
不同意,原因:
专业负责人:
年 月 日
机构办公不同意,原因:
机构办公室主任:
年 月 日
项目审查人员:
年 月 日
机构负责人
审批意见
同意,进入伦理审查程序
不同意,原因:
机构负责人:
年 月 日
临床试验立项审查表药物
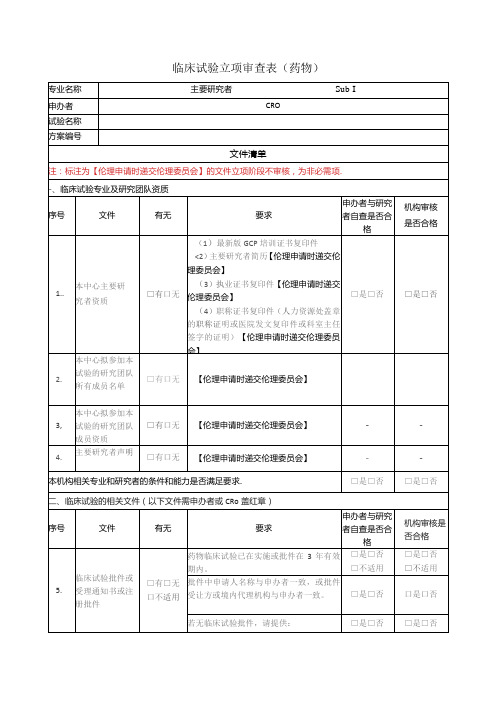
-
12.
研究病历样表
□有口无
【伦理申请时递交伦理委员会】
-
-
13.
病例报告表样
口有口无
【伦理申请时递交伦理委员会】
-
-
14.
研究者手册
口有口无
试验用药品的储存条件与方案中的规定保持一致。
□是□否
□不适用
□是口否口不适用
15.
药物标签
□有□无
方案涉及的由申办者提供的试验用药品均需提供药物标签,包括研究药物、对照药品、安慰剂、基础用药、急救用药等*
2)CDE沟通会会议纪要(如适用).
□不适用
□不适用
6.
组长单位伦理委员会批件
口有一£
□不适用
【伦理申请时递交伦理委员会】
-
7.
试验用药品检验合格报告
口有口无
方案涉及的由申办者提供的药品均有检验报告。
口是口否
□不适用
□是□否
□不适用
提供有效期内的最新批次药检报告
□是□否
□不适用
口是□否
口不适用
若为进口药品,需提供进口药品通关单:且进口通关单中的药物批号与药检报告一致.
2)文件内容按照项目组要求制定.
□是□否
口是□否
20.
项目风脸的预评估及风隆处置预案
口有□无
1)注明版本号及版本日期.
2)文件内容按照项目组要求制定。
□是□否
□是□否
三、申办者及CRO资质(以下文件需申办者或CRo盖红章)
序号
文件
有无
要求
申办者自查是否合格
机构审核是否合格
21.
申办者资质证明
口有□无
□是□否
AA大学附属医院药物器械临床试验审批表

项目质控员签字:机构办质管员签字:
时间:时间:
四、SAE专项审查
伦理委员会审核意见:
伦理委员会秘书签字:时间:
项目质控员和机构办质管员审核意见:
项目质控员签字:机构办质管员签字:
时间:时间:
五、试验完成审查
伦理委员会结题审核意见:
伦理委员会秘书签字:时间:
1.机构办人员是否参加该试验的总结会?□
CFDA批准证明(器械):
试验类型(器械/诊断试剂):□临床试用□临床验证
专业:欲委托PI:
组长单位:组长单位PI:
试验总设计例数_________例我院专业设计例数_________例
试验预计开始时间:预计结束时间:
申办方:申办者代表:联系方式:
CRO:CRO代表:联系方式:
申办方代表签字:CRO代表签字:
伦理委员会签字(公章):
年月日
科教部
意见
科教部负责人签字:
年月日
机构
意见
机构负责人签字(公章):
年月日
二、试验中质控审查
(试验质控审查流程和记录详见药物/器械临床试验质控SOP和质控表的记录,质控表填写完成后,附在该审批表后,作为质控审查记录)
三、提走CRF表时的审查
伦理委员会审核意见:
伦理委员会秘书签字:时间:
AA大学附属医院药物/器械临床试验审批表
一、试验前审批
药物
/器械
临床
研究
基本
信息
试验项目名称:
药物/器械名称:规格:药物/器械类别:
申办方:CRO:
是否为国际多中心:□是□否研究代号:_____研究(例如UKPDS研究)
CFDA批件号(药物):
药物临床试验审批表

滨州医学院附属医院国家药物临床试验机构文件编码:JG-SOP-005-3.0
药物临床试验审批表
项目名称
申办者CRO
药物名称剂型规格
研究分期注册分类
专业科室主要研究者
形式审查资料目录:
□临床试验申请表□SFDA批件、组长单位批件
□委托公函□申办者及CRO资质
□研究者手册□药检报告
□临床试验方案□研究者简历
□知情同意书□病例报告表
□研究病历□药品说明书
□受试者日记卡□招募广告
□监查员名片、GCP培训证书、身份证及学位证复印件
□如果样本在外地检测的要提供检测实验室的名称和资质证明;
□其它
机构办公室秘书形式审查意见:
签字:日期:年月日机构办公室主任对立项审核要点:
1.本项目主要研究者是否已对项目充分了解,提交了申请并做出试验相关保证?□是□否
2.本专业组在研项目数量是否符合要求?□是□否
3.本项目监查员是否被机构认可?□是□否
4.本项目是否在机构进行过充分讨论?□是□否
5.关于项目费用分配问题,机构是否已了解并初步同意?□是□否
6.提交的备案资料是否还存在不全或者不符合要求等问题?□是□否
7.本项目是否存在需要说明或者有争议的问题?□是□否如存在,请简单说明:。
机构办公室主任意见:
□同意□不同意□补充完善资料后同意□修改部分内容后同意
□其他:
签字:日期:年月日机构主任意见:
□同意□不同意□其他:
签字:日期:年月日。
药物临床试验审批表

药物临床实验审批表
项目名称
申办者
药物名称剂型规格
研究分期注册分类
专业科室主要研究者
形式审查资料目录:
□临床实验申请表□批件、组长单位批件
□委托公函□申办者及资质
□研究者手册□药检报告
□临床实验方案□研究者简历
□知情同意书□病例报告表
□研究病历□药品说明书
□受试者日记卡□招募广告
□监查员名片、培训证书、身份证及学位证复印件
□如果样本在外地检测的要提供检测实验室的名称和资质证明;
□其它
机构办公室秘书形式审查意见:
签字:日期:年月日
机构办公室主任对立项审核要点:
.本项目主要研究者是否已对项目充分了解,提交了申请并做出实验相关保证?□是□否
.本专业组在研项目数量是否符合要求?□是□否
.本项目监查员是否被机构认可?□是□否
.本项目是否在机构进行过充分讨论?□是□否
.关于项目费用分配问题,机构是否已了解并初步同意?□是□否
.提交的备案资料是否还存在不全或者不符合要求等问题?□是□否
.本项目是否存在需要说明或者有争议的问题?□是□否
如存在,请简单说明:。
机构办公室主任意见:
□同意□不同意□补充完善资料后同意□修改部分内容后同意
□其他:
签字:日期:年月日机构主任意见:
□同意□不同意□其他:
签字:日期:年月日。
药物临床试验项目承接审查表
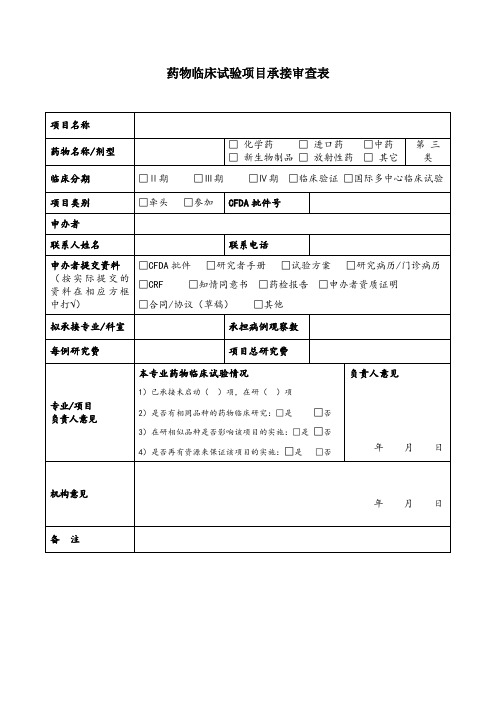
药物临床试验项目承接审查表项目名称
药物名称/剂型□化学药□进口药□中药
□新生物制品□放射性药□其它
第三
类
临床分期□Ⅱ期□Ⅲ期□Ⅳ期□临床验证□国际多中心临床试验项目类别□牵头□参加CFDA批件号
申办者
联系人姓名联系电话
申办者提交资料(按实际提交的资料在相应方框中打√)□CFDA批件□研究者手册□试验方案□研究病历/门诊病历□CRF □知情同意书□药检报告□申办者资质证明
□合同/协议(草稿)□其他
拟承接专业/科室承担病例观察数每例研究费项目总研究费
专业/项目负责人意见本专业药物临床试验情况
1)已承接未启动()项,在研()项
2)是否有相同品种的药物临床研究:□是□否
3)在研相似品种是否影响该项目的实施:□是□否
4)是否再有资源来保证该项目的实施:□是□否
负责人意见
年月日
机构意见
年月日备注。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
临床试验审批表(药物类)
项目名称:
申请科室:
试验范围:国内多中心□国际多中心□亚洲多中心□
项目负责人(签名):职称:手机号:
该负责人目前在研项目:项;与该方案有竞争项目项质控员(签名):职称:手机号:
试验药物类别:新药类期或其他
申办单位:联系人及电话:
CRO: 联系人及电话:
SMO:联系人及电话:
一、该药物的临床试验批准机关:
批准文件号:
二、试验目的:
三、组长单位:负责人
四、受试者是否需要签署知情同意:是□否□
您认为知情同意书内容是否完整:是□否□
五、试验样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、试验药剂量用法疗程
剂量用法疗程
六、对照样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、对照组剂量用法疗程
七、适应症:
八、禁忌症(注意事项):
九、可能出现的不良反应:
1、4、
2、5、
3、6、
十、对不良反应是否有相应的防治措施
1、有□无□未考虑□
2、有□无□未考虑□
3、有□无□未考虑□
4、有□无□未考虑□
5、有□无□未考虑□
6、有□无□未考虑□
填表时间:年月日
药物临床试验机构审批意见:
□同意立项
□补充完善资料后同意
□不同意原因:
□其他:
机构主任签字:日期:年月日。
