3、酶-(3)影响酶催化作用的因素
《酶工程》课后知识题目解析

《酶工程》课后知识题目解析第一章酶工程基础1.名词解释:酶工程、比活力、酶活力、酶活国际单位、酶反应动力学①酶工程:由酶学与化学工程技术、基因工程技术、微生物学技术相结合而产生的一门新技术,是工业上有目的地设计一定的反应器和反应条件,利用酶的催化功能,在常温常压下催化化学反应,生产人类所需产品或服务于其它目的地一门应用技术。
②比活力:指在特定条件下,单位质量的蛋白质或RNA所拥有的酶活力单位数。
③酶活力:也称为酶活性,是指酶催化某一化学反应的能力。
其大小可用在一定条件下,酶催化某一化学反应的速度来表示,酶催化反应速度愈大,酶活力愈高。
④酶活国际单位: 1961年国际酶学会议规定:在特定条件(25℃,其它为最适条件)下,每分钟内能转化1μmol底物或催化1μmol产物形成所需要的酶量为1个酶活力单位,即为国际单位(IU)。
⑤酶反应动力学:指主要研究酶反应速度规律及各种因素对酶反应速度影响的科学。
2.说说酶的研究简史酶的研究简史如下:(1)不清楚的应用:酿酒、造酱、制饴、治病等。
(2)酶学的产生:1777年,意大利物理学家 Spallanzani 的山鹰实验;1822年,美国外科医生Beaumont 研究食物在胃里的消化;19世纪30年代,德国科学家施旺获得胃蛋白酶。
1684年,比利时医生Helment提出ferment—引起酿酒过程中物质变化的因素(酵素);1833年,法国化学家Payen和Person用酒精处理麦芽抽提液,得到淀粉酶;1878年,德国科学家K?hne提出enzyme—从活生物体中分离得到的酶,意思是“在酵母中”(希腊文)。
(3)酶学的迅速发展(理论研究):1926年,美国康乃尔大学的”独臂学者”萨姆纳博士从刀豆中提取出脲酶结晶,并证明具有蛋白质的性质;1930年,美国的生物化学家Northrop分离得到了胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶结晶,确立了酶的化学本质。
3.说说酶工程的发展概况I.酶工程发展如下:①1894年,日本的高峰让吉用米曲霉制备淀粉酶,酶技术走向商业化:②1908年,德国的Rohm用动物胰脏制得胰蛋白酶,皮革软化及洗涤;③1911年,Wallerstein从木瓜中获得木瓜蛋白酶,用于啤酒的澄清;④1949年,用微生物液体深层培养法进行-淀粉酶的发酵生产,揭开了近代酶工业的序幕;⑤1960年,法国科学家Jacob和Monod 提出的操纵子学说,阐明了酶生物合成的调节机制,通过酶的诱导和解除阻遏,可显著提高酶的产量;⑥1971年各国科学家开始使用“酶工程”这一名词。
酶

酶活力,规定为:在最适反应条件(25℃)下,每
分钟内催化1微摩尔底物转化为产物所需的酶量定为 一个酶活力单位,即1U=1μmol/min。
酶的催化作用受测定环境的影响,因此测定
酶活力要在最适条件下进行,即最适温度、最适 pH、最适底物浓度和最适缓冲液离子强度等,只
性失活;(3)酶是两性电解质,在不同pH下呈现不
同的离子状态(4)和蛋白质一样具有胶体性质;(5) 具有蛋白质所具有的化学呈色反应。
2. 酶的组成分类
酶作为一种具有催化功能的蛋白质,与其它蛋白质 一样,相对分子质量很大,一般从一万到几十万以至大
到百万以上。
从化学组成来看酶可分为单纯蛋白质和结合(缀合) 蛋白质两类。属于单纯蛋白质的酶类,除了蛋白质外, 不含其它物质,如脲酶、蛋白酶、淀粉酶、脂肪酶和核 糖核酸酶等。属于结合蛋白质的酶类,除了蛋白质外, 还要结合一些对热稳定的非蛋白质(辅助因子)小分子 物质或金属离子,其酶蛋白(脱辅酶)与辅助因子结合
酶反应的速度曲线
反应时间的延长,酶反应速度逐渐下降。因此,研
究酶反应速度应以酶促反应的初速度为准。
2. 酶的活力单位(U, activity unit)
酶活力的大小即酶含量的多少,用酶活力单位 表示,即酶单位(U)。 酶单位的定义是:在一定条件下,一定时间内 将一定量的底物转化为产物所需的酶量。
1961年国际生物化学协会酶学委员会及国际纯
一、习惯命名法
1961年以前使用的酶的名称都是习惯沿用的,称为 习惯名。
1. 根据酶作用的底物命名,如淀粉酶、蛋白酶。 2. 根据酶催化反应的性质及类型命名,如水解酶、氧 化酶等。 3. 结合上述两个原则命名,如琥珀酸脱氢酶。 4. 在这些命名的基础上,加上酶的来源或其它特点, 如胃蛋白酶、胰蛋白酶。
酶工程1-3影响酶催化作用的因素详解

四点假设: ①、②、③ 同“快速平衡法”; ④中间复合体[ES]在一开始浓度增高后,可在相当一段 时间内保持浓度的恒定;在这段时间里,[ES]的生成速度 和[ES]消失(包括分解成 E+S 和 E+P)的速度相等,达 到动态的平衡,即“拟稳态”。
c[ES]不随时间而变化
dc[ES ] dt
k1cE cS
k1c[ES ]
k2c[ES ]
0
c
cE0 cE c[ES ]
vP
dcP dt
k2c[ES ]
cS c[ ES ]
c[ E ]
拟稳态
cp t
vP
k2cE0 cs Km cs
vP ,max cs Km cs
Km
k1 k2 k1
为米氏常数(mol/L)
Km
Ks
k2 k1
当k+2远小于k-1时,Km=Ks
每一种酶的催化反应都有其最适宜的温度范围及最 适温度。
添加酶的作用底物或者某些稳定剂可以适当提高酶 的热稳定性。
4、pH值的影响
在不同的pH值条件下,酶分子和底物分子中的基 团的解离状态发生改变,从而影响酶分子的构象以 及酶与底物的结合能力和催化能力。 在极端的pH值条件下,酶分子的空间结构发生改 变,从而引起酶的变性失活。 每种酶都有其各自的适宜pH值范围和最适pH值。
k1cEcS k1c[ES ]
cE0 cE c[ES ]源自vPdcP dtk2c[ES ]
vP
k2cE0 cs Ks cs
vP ,max cs Ks cs
Ks
k 1 k 1
为解离常数(mol/L)
M-M 方程的修正
1925年,Brigg 和 Haldane 认为:许多酶有很大的催化 能力,当[ES]形成后,即迅速转化成产物P而释放出酶, 即当k+2>k-1时,M-M 方程不成立。
酶工程习题(答案全)

第一章绪论一、名词解释1、酶: 是具有生物催化功能的生物大分子2、酶工程:酶的生产与应用的技术过程称为酶工程。
它是利用酶的催化作用进行物质转化的技术,是将酶学理论与化工技术、微生物技术结合而形成的新技术,是借助工程学手段利用酶或细胞、细胞器的特定功能提供产品的一门科学3、核酸类酶:为一类具有生物催化功能的核糖核酸分子。
它可以催化本身RNA 剪切或剪接作用,还可以催化其他RNA,DNA多糖,酯类等分子进行反应4、蛋白类酶:为一类具有生物催化功能的蛋白质分子,它只能催化其他分子进行反应。
5、酶的生产:是指通过人工操作获得所需酶的技术过程。
主要包括微生物发酵产酶,动植物培养产酶,酶提取和分离纯化等6、酶的改性是通过各种方法改进酶的催化特性的技术过程,主要包括酶分子的修饰,酶固定化,酶非水相催化等7、酶的应用:是通过酶的催化作用获得人们所需要的物质或者不良物质的技术过程,主要包括酶反应器的选择和设计以及酶在各领域的应用等。
8、酶的专一性:又称为特异性,是指酶在催化生化反应时对底物的选择性,即在一定条件下,一种酶只能催化一种或一类结构相似的底物进行某种类型反应的特性。
亦即酶只能催化某一类或某一种化学反应.9、酶的转换数:酶的转换数Kp。
又称为摩尔催化活性,是指每个酶分子每分钟催化底物转化的分子数二、填空题1、根据分子中起催化作用的主要组分的不同,酶可以分为_________和____________两大类。
2、核酸类酶分子中起催化作用的主要组分是__________,蛋白类酶分子中起催化作用的主要组分是________________.3、进行分子内催化作用的核酸类酶可以分为________________,_________________。
4、酶活力是_______________的量度指标,酶的比活力是_______________的量度指标,酶的转换数的主要组分是________________的度量指标。
第二节影响酶催化作用的特点

应物的有效质量成正比
(2)形成的中间产物决定整个反应的速度
Michaelis & Menten 提出了中间络合物学说。
(二) 米氏方程
1. 米氏方程的推导
一.底物浓度的影响
Michaelis-Menten的三个假设: (1)推导的v为反应初速度
对于单底物、单产物反应,其反应过程需经过中 间复合物ES,即
第二节影响酶催化作用的因素
3.4 酶促反应动力学
酶促反应动力学
酶促反应动力学(kinetics of enzymecatalyzed reactions)是研究酶促反应速度 及其影响因素的科学。酶促反应的影响因素 主要包括酶的浓度、底物的浓度、pH、温度、 抑制剂和激活剂等。
一. 酶浓度的影响
在一定温度和pH下,酶 促反应在底物浓度大于 100 Km时,速度与酶的浓 度呈正比。 酶浓度对速度的影响机 理:酶浓度增加,[ES]也 增加,而V=k3[ES],故反 应速度增加。
Vmax指该酶促反应的最大速度,[S]为底 物浓度,Km是米氏常数,V是在某一底物浓 度时相应的反应速度。从米氏方程可知: 当底物浓度很低时 [S] << Km,则 V≌Vmax[S]/Km ,反应速度 与底物浓度呈正比; 当底物浓度很高时, [S]>> Km ,此时V≌Vmax ,反应速度达最大 速度,底物浓度再增高也不影响反
一.底物浓度的影响
刚反应时,若形成的速度为v,则
v1k1 [Et][S] k1[(E)-(ES)][S] (1)
ES消失速度:
v2 k2[ES]; v3 k3[ES]
v23 k2 [ES] k3[ES] (k2 k3)[ES] (2)
(二) 米氏方程
酶

第一章1.酶是具有生物催化功能的生物大分子。
2.酶活力是指在一定条件下,酶所催化的反应初速度。
3酶活力单位:在特定条件下(温度可采用25℃,pH值等条件均采用最适条件),每1min催化1µmol的底物转为产物的酶量定义为一个酶活力单位,这个单位称为国际单位(IU)。
4酶转换数Kp,又称为摩尔催化活性,是指每个酶分子每分钟催化底物转化的分子数。
即每摩尔酶每分钟催化底物转化为产物的摩尔数,是酶催化效率的一个指标。
5转换数的倒数称为酶的催化周期,即催化周期是指酶进行一次催化所需的时间,单位为毫秒(ms)或微秒(µs)的。
6酶结合效率又称为酶的固定化效率,是指酶与载体结合的百分率。
酶结合效率的计算一般由固定化的总活力减去未结合的酶活力所得到的差值,再除以用于固定化的总酶活力而得到。
7酶活力回收率是指固定化酶的总活力与用于固定化的总酶活力的百分率。
8.核酸酶(ribozyme):即具有催化活性的RNA。
抗体酶(Abzyme):具有催化活力的抗体。
9.酶催化作用的特点(一)、酶催化作用的专一性强:酶的专一性是指在一定的条件下,一种酶只能催化一种或一类结构相似的底物进行某种类型反应的特性。
①绝对专一性:一种酶只能催化一种底物进行一种反应,这种高度的专一性称为绝对专一性。
②相对专一性:一种酶能够催化一类结构相似的底物进行某种相同类型的反应,这种专一性称为相对专一性。
(二)、酶催化作用的效率高:酶催化效率高,比非酶催化反应的速度高107~1013倍。
(三)、酶催化作用的条件温和:酶的催化作用一般都在常温、常压、pH值近乎中性的条件下进行。
(四)酶活性受到调节和控制10. 影响酶催化作用的因素①、底物浓度的影响②、酶浓度的影响③、产物浓度的影响④、温度的影响⑤、pH值的影响⑥、抑制剂的影响⑦、激活剂的影响11从如下实验方法和结果分析酶生物合成的调节作用。
实验方法:将大肠杆菌细胞接种于营养肉汤培养中,于37℃振荡培养,当OD550达到0.3左右时,将培养液分装到4个小三角瓶中,每瓶17ml培养液。
生物化学05.第五章 酶

时,酶原适时地转变成有活性的酶,发挥其催
化作用。
3.胃、肠黏膜及肠道寄生虫均有抵抗消化酶
的抗酶物质。
三、酶促反应的机制
(一)活化分子与活化能
1.活化能:底物分子从基态转变到活化态所需的能量。 2.活化分子:从基态转变到活化态的底物分子。
能 量 非催化反应活化能
一般催化剂催 化反应的活化能 酶促反应 活化能
底物 反应总能量改变 产物 应 过 程
反
酶促反应活化能的改变
(二)诱导契合假说
酶底物复合物
E+S
ES
E+P
酶与底物相互接近 时,其结构相互诱导、 相互变形和相互适应, 进而相互结合。这一过 程称为酶-底物结合的诱 导契合假说 。
酶的诱导契合动画
(三)邻近效应与定向排列
位于活性中心以外,维持酶活性中心应有的空间 构象所必需。
活性中心以外 的必需基团 底物
+ +
催化基团
结合基团
活性中心
二、酶原与酶原的激活
(一)酶原
有些酶在细胞 内合成或初分泌时 无活性,此无活性 前体称为酶原。
(三)激活过程
酶原
在特定 条件下
特定的肽链水解 分子构象发生改变 酶的活性中心形成
(二)酶原的激活
一些代谢物可与某些酶分子活性中心外的 某部分可逆地结合,使酶构象改变,从而改变 酶的催化活性,此种调节方式称变构调节。
1.变构酶 (allosteric enzyme) 2.变构部位 (allosteric site) 3.变构效应剂 (allosteric effector)
变构激活剂
变构抑制剂
(二) 共价修饰调节
影响酶催化作用的因素
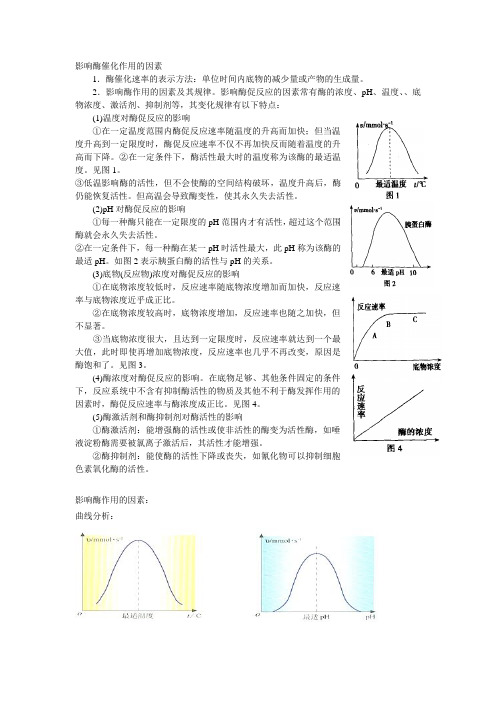
影响酶催化作用的因素1.酶催化速率的表示方法:单位时间内底物的减少量或产物的生成量。
2.影响酶作用的因素及其规律。
影响酶促反应的因素常有酶的浓度、pH、温度、、底物浓度、激活剂、抑制剂等,其变化规律有以下特点:(1)温度对酶促反应的影响①在一定温度范围内酶促反应速率随温度的升高而加快;但当温度升高到一定限度时,酶促反应速率不仅不再加快反而随着温度的升高而下降。
②在一定条件下,酶活性最大时的温度称为该酶的最适温度。
见图1。
③低温影响酶的活性,但不会使酶的空间结构破坏,温度升高后,酶仍能恢复活性。
但高温会导致酶变性,使其永久失去活性。
(2)pH对酶促反应的影响①每一种酶只能在一定限度的pH范围内才有活性,超过这个范围酶就会永久失去活性。
②在一定条件下,每一种酶在某一pH时活性最大,此pH称为该酶的最适pH。
如图2表示胰蛋白酶的活性与pH的关系。
(3)底物(反应物)浓度对酶促反应的影响①在底物浓度较低时,反应速率随底物浓度增加而加快,反应速率与底物浓度近乎成正比。
②在底物浓度较高时,底物浓度增加,反应速率也随之加快,但不显著。
③当底物浓度很大,且达到一定限度时,反应速率就达到一个最大值,此时即使再增加底物浓度,反应速率也几乎不再改变,原因是酶饱和了。
见图3。
(4)酶浓度对酶促反应的影响。
在底物足够、其他条件固定的条件下,反应系统中不含有抑制酶活性的物质及其他不利于酶发挥作用的因素时,酶促反应速率与酶浓度成正比。
见图4。
(5)酶激活剂和酶抑制剂对酶活性的影响①酶激活剂:能增强酶的活性或使非活性的酶变为活性酶,如唾液淀粉酶需要被氯离子激活后,其活性才能增强。
②酶抑制剂:能使酶的活性下降或丧失,如氰化物可以抑制细胞色素氧化酶的活性。
影响酶作用的因素:曲线分析:曲线含义的准确表述:B 点:该酶发挥催化作用的最适温度或最适pH 值AB 段:达到最适温度(pH 值)前,随着温度(pH 值)升高,酶的催化效率提高酶的最适pH 值往往随底物种类、浓度等的变化而不同,因此,并不是一个常数,只是在一定条件下才有意义。
酶工程习题集LLQ

第一章绪论【内容提要】1.重点介绍酶和酶工程的研究简史和发展概况;2.简要回顾酶催化特点、影响酶活性的因素、测定酶活力方法以及酶反应动力学。
【习题】一、名词解释酶工程;转换数;催化周期;比活力;酶活力;酶活国际单位;酶反应动力学异构酶变构酶核酶抗体酶竞争性抑制反竞争性抑制非竞争性抑制酶结合效率酶活力回收率固定化酶的相对酶活力二、填空1.酶是具有功能的生物大分子。
2.酶催化作用的专一性包括和。
3.影响酶催化作用的因素有、、、、、。
4.按照酶分子中起催化作用的主要组分不同可分为和。
5.分子内催化的R酶可分为和。
6.分子间催化的R酶可分为、、、、、。
7.固定化酶的活力测定方法主要有、和。
8.固定化酶的比活力一般用所具有的酶活力单位数来表示。
9.酶的生产方法主要有、和。
三、判断1.核酸类酶的作用底物均为核酸2.核酸类酶仅能作用于其他分子3.核酸类酶可以以DNA为底物4.酶的化学本质是蛋白质五、简答题1. 简述酶的研究简史。
2. 简述酶工程的发展概况。
3. 简要回答酶的催化特点。
4. 简要回答影响酶催化作用的因素。
5. 简要回答米氏方程的意义。
6. 简述酶工程的研究内容及主要任务。
答案:酶的生产与应用的技术过程称为酶工程,其主要内容包括酶的生产、分离纯化、酶的固定化、酶及固定化的反应器、酶和固定化酶的应用。
7. 举例说明酶活力的测定在酶的研究、生产和应用过程中的重要性。
酶活力是指在一定条件下,酶催化某一反应的反应速度(一般测初速度)。
酶促反应速度是指单位时间、单位体积中底物的减少量或产物的增加量。
单位:浓度/单位时间(2分)酶的活力单位(U)国际单位(IU单位):在最适反应条件下,每分钟催化1umol底物转化为产物所需的酶量,称一个国际单位(IU),1 IU = 1umol /min国际单位(Katal, Kat单位):在在最适反应条件下,每秒钟催化1mol底物转化为产物所需的酶量,称Kat单位。
1 Kat=60 X 106 IU酶活力的测定方法:分光光度法;荧光法;同位素法;电化学法。
第三章 酶催化反应动力学

32
33
二、影响酶催化作用的因素
34
2.1 底物浓度的影响
底物浓度是决定酶催化反应速度的主要因素。在其他条件不变的情况下, 酶催化反应速度与底物浓度的关系如图。
35
2.2 酶浓度的影响
在底物浓度足够高的条件下,酶催化反应速度与酶浓度 成正比,它们之间的关系可以用下式表示:
36
2.3 温度对反应速度的影响
When [S] << KM, the enzyme is largely unbound and [E]≈[E]T
27
S+E
kcat/KM
E+P
When [S] << KM, kcat/KM is the rate constant for the interaction of E and S. kcat/KM can be used as a measure of catalytic efficiency.
24
25
(3). Kcat/Km
Kcat:反映的是一种酶被底物饱和时的 酶性质。在低[S]下, Kcat则失去了意义。 当[s]<<km, Kcat/Km是一个比较酶催 化效率较好的一个动力学参数。
26
(3)酶的催化效率:kcat/KM 评价
kcat/KM通常被看做酶的效率,Kcat越大或是Km越小,都使得Kcat/Km越 大 在生理条件下,大多数的酶不被底物所饱和,且底物浓度与Km相比要小 的多 。
酶工程与蛋白质工程
第三章 酶催化反应动力学
1
本节主要内容
一、酶催化反应动力学 二、影响酶催化作用的因素 三、酶活测定
2
动力学研究的主要目的
[工学]《酶工程》教案
![[工学]《酶工程》教案](https://img.taocdn.com/s3/m/9fe9e605a31614791711cc7931b765ce05087abe.png)
《酶工程》教案安排:本课总学时为48,其中理论课40,实验课8,周学时为3学时。
要求:要求同学们课前预习教材,带着问题听课,这样学习效果好;学生上课作笔记,动动脑;学生课后复习和整理笔记,教师作课后小结和布置作业,达到教学相长的目的。
绪论1教学目标:使学生掌握酶、酶工程的概念,酶的化学性质与催化特性,了解酶的分类与命、酶活力测定、酶的生产方法。
2教学内容:主要讲酶和酶工程的基本概念与发展史、影响酶催化作用的因素、酶的分类与命名、酶的化学性质与催化特性、酶活力测定、酶的生产方法。
3重点和难点:酶、酶工程、酶活力有关的概念;酶的化学性质与催化特性、酶活力测定。
4教学方法:采用讲授式、启发式、图示法、问答式相结合的教学方法。
5板书设计:从上至下,从左至右;大标题始终留在黑板的左边;书写规范。
6学时分配:理论3学时,实验2学时。
7教学进程:第一节酶和酶工程的基本概念与发展史1酶的基本概念酶是生物体内进行新陈代谢不可缺少的受多种因素调节控制的具有催化能力的生物催化剂。
按化学组成分:蛋白类酶(Enzyme proteins)和核酸类酶(Ribozyme RNAs)。
a蛋白类酶(Enzyme proteins)酶是由生物体产生的具有催化活性的蛋白质。
b核酸类酶(Ribozyme RNAs)本身就是一段RNA,不需要额外的蛋白酶就可以对自身进行剪切。
提问:酶一定是蛋白质吗?2酶的发展史1.2.1酶在中国的发展史人们对酶的认识起源于生产与生活实践。
夏禹时代,人们掌握了酿酒技术。
公元前12世纪周朝,人们酿酒,制作饴糖和酱。
春秋战国时期已知用麴(曲)治疗消化不良的疾病。
酶者,酒母也。
1.2.2酶在西方的发展史1878年, 给酶一个统一的名词,叫Enzyme,这个字来自希腊文,其意思“在酵母中”。
1896年,日本的高峰让吉首先从米曲霉中制得高峰淀粉酶,用作消化剂,开创了有目的的进行酶生产和应用的先例。
西方国家19世纪对酿酒发酵过程进行了大量研究。
酶学基础三酶促反应的机制讲解学习

3、影响酶催化的有关因素
(1)底物与酶的靠近及定向 (2) “张力”和“形变” (3) 酸碱催化 (4) 共价催化 (5) 金属离子催化作用
3、影响酶催化的有关因素
(1)底物与酶的靠近及定向
• 在酶促反应中,底物分子结合到酶的活 性中心,一方面底物在酶活性中心的有效 浓度大大增加,有利于提高反应速度;
(ቤተ መጻሕፍቲ ባይዱ) 共价催化
某些酶在催化过程中,能通过共价 键与底物结合成不稳定的酶-底物复 合物,这个中间产物很容易变成过渡 中间物,反应的活化能大大降低。
1)亲核催化 指酶分子中具有非共用电子对的
亲核基团攻击底物分子中具有部分正 电性的原子,并与之作用形成共价键 而产生不稳定的过渡态复合物,活化 能降低。
酶学基础(三)
1.1.5 酶促反应的机制 1. 酶-底物复合物的形成
(1)中间产物学说:
E+S k1
ES k2
E+P
k-1
(2) 酶与底物结合特点:
1)可逆的、非共价的结合;
2)底物只与酶的活性中心结合;
3)酶与底物结合是通过一种称为诱导契 合模式进行的。
2. 活化能降低
• 酶促反应:E + S === ES EP E + P
• 另一方面,由于活性中心的立体结构和相 关基团的诱导和定向作用,使底物分子中 参与反应的基团相互接近,并被严格定向 定位,使酶促反应具有高效率和专一性特 点。
临近效应
定向效应
(2) “张力”和“形变”
底物与酶结合诱导酶的分子构象变化,变 化的酶分子又使底物分子的敏感键产生“张力” 甚至“形变” ,从而促使酶-底物中间产物进
酶

酶作用的 专一性
立体异构专一性
绝对专一性 旋光专一性
几何专一性
目录
族专一性:可作用于一类或一些结构很相似的底物。
O 酯酶:R—C—O—R′ + H2O
CH2OH
RCOO- + R′ OH + H+
CH2OH
5
α-葡萄糖 OH 苷酶 OH
5
O
1
O
1
O R
+H2O
OH
OH
+ ROH
OH
OH OH
绝对专一性:只能作用于某一底物。
k1
E+S
K-1
ES
k2
E+P
+
E (enzyme)
+
E (enzyme) 酶
S (substrate) 底物
中间产物
P (product) 产物
目应速度的影响,并 加以定量的阐述。
影响因素包括有 酶浓度、底物浓度、pH、温度、
抑制剂、激活剂等。
※ 研究一种因素的影响时,其余各因素均恒定。
目录
酶的活性中心的一级结构
应用化学修饰法对多种酶的活性中心进行研究发现,在酶 的活性中心处存在频率最高的氨基酸残基是:丝氨酸、组氨 酸、天冬氨酸、酪氨酸、赖氨酸和半胱氨酸。如果用同位素 标记酶的活性中心后,将酶水解,分离带标记水解片段,对 其进行一级结构测定,就可了解酶的活性中心的一级结构。 对各种蛋白水解酶进行类似的分析,功能类似的酶在 一级结构上有惊人的相似性。
2H2O2 2H2O + O2
1mol过氧化氢酶 5×106molH2O2 1mol离子铁 6×10-4molH2O2
酶促反应的速率和影响因素PPT(完整版)

Km——米氏常数
Vmax——最大反应速率
Leonor Michaelis (1875-1949) Maud Menten (1879-1960
3、当反应速率等于最大速率一半时,即V=0.5Vmax时。则
Km=【S】
米氏方程所规定动力学规律,是酶促反应的一项基本熟悉属性
米氏常数的求法,双倒数作图法
可以将米氏方程的形式加以改变,将方程两边同时取倒数,使方 程变成y=ax+b的直线方程
米氏常数K,m的意义
由米氏方程可知,当反应速度等于最大反应速度的一半时,即
适合条件下,酶促反应速率最大,在不同的pH条件下,酶的活性
中心与底物之间形成氢键的能力和方向不同,其结果是影响了 酶——底物过渡态的形成和稳定程度,从而对酶的活性产物影响。
pH对于不同的酶也不一样
E-S复合物的形成的速率和酶与底物的性质有关。 3、当反应速率等于最大速率一半时,即V=0. 酶促反应的速率和影响因素 温度对酶促反应速率的影响有俩个方面 酶促反应的速率和影响因素 反应速率与底物浓度成正比; Leonor Michaelis (1875-1949) Maud Menten (1879-1960 反应速率与底物浓度成正比; 反应速率不再增加,达最大速率; 酶促反应的速率和影响因素 酶促反应的速率和影响因素 动物 最适温度=35度-40度 pH对于不同的酶也不一样 少数酶特殊,如液化淀粉酶 的最适温度为90度 由米氏方程可知,当反应速度等于最大反应速度的一半时,即 适合条件下,酶促反应速率最大,在不同的pH条件下,酶的活性中心与底物之间形成氢键的能力和方向不同,其结果是影响了酶——底物过渡态的形成和稳定程度,从而对酶的活 性产物影响。 医学上,实验室中高温消毒,高温使酶蛋白变性 1931年,德国化学家Michaelist和Menten根据中间产物学说对酶促反应的动力学进行研究,推导出了整个反应中的底物浓度和反应速度关系著名公式,即米氏方程
酶-3影响酶催化作用的因素

第四节 酶与医学的关系
The Relation of Enzyme and Medicine
一、酶与疾病的关系
(一) 酶与疾病的发生 (二) 酶与疾病的诊断 (三) 酶与疾病的治疗
二、酶在医学上的其他应用
(一)酶作为试剂用于临床检验和科学研究
1.酶法分析 即酶偶联测定法(enzyme
coupled assays),是利用酶作为分析试剂, 对一些酶的活性、底物浓度、激活剂、抑制 剂等进行定量分析的一种方法。
当v=Vmax/2时
Vmax 2
= Vmax[S] Km + [S]
[S]
Km=[S]
二、酶浓度对反应速度的影响
V
➢当[S]>>[E], 反应速度与酶浓 度成正比。
0
ห้องสมุดไป่ตู้
[E]
➢关系式为:V = K[E]
三、温度对反应速度的影响
双重影响
最适温度 (optimum temperature):
酶促反应速度最 快时的环境温度。
琥珀酸脱氢酶
FAD
FADH2
COOH
CH 2 C H2 COOH 琥珀酸
COOH CH 2 C OOH 丙二酸
延胡索酸
2. 磺胺药对细菌FH2合成酶的抑制
Glu
H2N
+ FH2合成酶
COOH PAB A
FH2 FH2还原酶
+ 二氢蝶呤
H2N
氨甲蝶呤 SO2NHR
磺胺药
FH4
3. 抗代谢物的抗癌作用
练习
1.有机磷农药中毒受抑制的酶是: • A.乳酸脱氢酶 B.丙酮酸脱氢酶 • C.胆碱酯酶 D.葡萄糖激酶
2.Hg2+或As3+进入体内与酶活性中心结合的 基团是:
酶作为生物催化剂的特点

酶作为生物催化剂的特点:1,用量少而催化效率高;2,专一性高;3,反应条件温和4,可调节性影响酶催化作用的因素:1,底物浓度对酶促反应速度的影响在低底物浓度时, 反应速度与底物浓度成正比,表现为一级反应特征。
当底物浓度达到一定值,几乎所有的酶都与底物结合后,反应速度达到最大值(Vmax),此时再增加底物浓度,反应速度不再增加,表现为零级反应。
2. pH 的影响在一定的pH 下, 酶具有最大的催化活性,通常称此pH 为最适pH。
pH影响酶活力的原因可能有以下几个方面:(1)过酸或过碱可以使酶的空间结构破坏,引起酶构象的改变,酶活性丧失。
(2)当pH改变不很剧烈时,酶虽未变性,但活力受到影响。
(3)pH影响维持酶分子空间结构的有关基团解离,从而影响了酶活性部位的构象,进而影响酶的活性3. 温度的影响一方面是温度升高,酶促反应速度加快。
另一方面,温度升高,酶的高级结构将发生变化或变性,导致酶活性降低甚至丧失。
因此大多数酶都有一个最适温度。
在最适温度条件下,反应速度最大。
4.酶浓度的影响在一个反应体系中,当[S]>>[E]反应速率随酶浓度的增加而增加(v=k[E]),这是酶活测定的基础之一。
5 抑制剂对酶活性的影响使酶的活性降低或丧失的现象,称为酶的抑制作用。
能够引起酶的抑制作用的化合物则称为抑制剂酶的抑制剂一般具备两个方面的特点:a.在化学结构上与被抑制的底物分子或底物的过渡状态相似。
能够与酶的活性中心以非共价或共价的方式形成比较稳定的复合体或结合物。
6.激活剂对酶反应的影响凡能提高酶活力的物质都称为激活剂,有的酶反应的系统需要一定的激活剂。
酶的分类与命名(1) 氧化还原酶AH2 + B = A +BH2主要包括脱氢酶(dehydrogenase)和氧化酶例,醇+NAD+=醛或酮+NADH +H+→氢供体是醇,氢受体是NAD+系统命名→醇:NAD+氧化还原酶;推荐名→采用某供体脱氢酶,如醇脱氢酶(2) 转移酶AB +C =A +BC系统命名:“供体:受体某基团转移酶”。
酶工程((复习资料)

第一章绪论一.1 酶的变性与失活失活作用:凡可使酶蛋白变性而引起酶活力丧失的作用称为酶的失活作用。
2 酶的回收率与纯化比3 酶的结合效率及酶活力回收率酶的结合效率又称酶的固定化率,是指酶与载体结合的百分率酶的结合效率=(加入的总酶活力-未结合的酶活力)/加入的总酶活力*100%酶活力回收率是指固定化酶的总活力与用于固定化的总酶活力的百分率酶活力回收率=固定化酶总活力/用于固定化的总酶活力*100%4 底物抑制及其产生的三个原因(1)、竟争性抑制某些抑制剂的化学结构与底物相似,因而能与底物竟争与酶活性中心结合。
当抑制剂与活性中心结合后,底物被排斥在反应中心之外,其结果是酶促反应被抑制了(2)、非竟争性抑制酶可以同时与底物及抑制剂结合,但是,中间产物ESI不能进一步分解为产物,因此,酶的活性降低。
(3)、反竞争性抑制作用酶只有在与底物结合后,才能与抑制剂结合,引起酶活性下降。
二.1 什么是酶工程?酶工程(Enzyme Engineering))又称为酶技术,是指酶的生产与应用的技术过程。
是将酶学理论与化工技术、微生物技术结合起来利用酶的催化作用进行物质转化的技术它是借助工程学手段利用酶或细胞、细胞器的特定功能提供产品的一门科学。
就酶工程本身的发展来说,包括下列主要内容:酶的产生、酶的制备、酶和细胞固定化、酶分子改造、有机介质中的酶反应、酶传感器、酶反应器、抗体酶、人工酶和模拟酶2 什么是酶的最适PH及其影响酶的反应机理在一定的pH 下, 酶具有最大的催化活性,通常称此pH 为最适pH(optimum pH)。
a.过酸或过碱影响酶蛋白的构象,使酶变性失活。
b.影响酶分子中某些基团的解离状态(活性中心的基团或维持构象的一些基团)c.影响底物分子的解离状态故酶反应一般在一定的缓冲液体系中进行3 简述酶活力的测定方法(要求:快速,两个阶段,四个步骤)要求:快速、简便、准确两个阶段:酶在一定条件下与底物反应一段时间然后再测定反应物中底物或产物的浓度变化量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
V=
Vmax[S]
Km + [S]
Vmax
定义:Vm是酶完全被底物饱和时的反应速度, 与酶浓度成正比。
2.
Km可近似表示酶对底物的亲和力;
Km是酶的特征性常数之一,可以判断酶作用 的最适底物
(二)Km与Vmax的意义
1. Km值等于酶促反应速度为最大反应速度一 半时的底物浓度,单位是mol/L。 当v=Vmax/2时
练习
名词解释 • 1、Km值 • 2、酶的竞争性抑制作用 简答题 1、举例说明竞争性抑制的特点是什么? 2、举例说明可逆性抑制作用,并说明其特点。 3、举例说明竞争性抑制作用在临床的应用。
第四节 酶与医学的关系
The Relation of Enzyme and
Medicine
一、酶与疾病的关系
FH 4
氨甲蝶呤 H2N 磺胺药 SO2NHR
3. 抗代谢物的抗癌作用
* 概念
(二) 可逆性抑制作用
抑制剂以非共价键与酶或酶 - 底物复合物 可逆性结合,使酶的活性降低或丧失;抑制剂 可用透析、超滤等方法除去。
* 类型 竞争性抑制
非竞争性抑制
反竞争性抑制
练习
• 有机磷农药杀虫剂对胆碱酯酶的抑制作用 属于: • A.可逆性抑制作用 • B.竞争性抑制作用 • C.非竞争性抑制作用 • D.不可逆性抑制作用
上节课复习
• • • • • •
•
1、酶的活性中心与必需基团 2、酶原与酶原的激活 3、同工酶 4、酶的作用机制 5、 酶的调节
(1)活性调节: 变构调节 、化学修饰调节 (2)含量调节
• 6、、命名、分类 • 7、催化作用的特点 • 催化剂一般特点
• 高效性、特异性、可调节性、不稳定性
第三节 影响酶促反应速度的因素
V Vmax Vmax/2 Km [S]
Vmax 2
Vmax[S] = Km + [S] Km=[S]
二、酶浓度对反应速度的影响
V
当 [S]>>[E], 反应速度与酶浓 度成正比。
0 [E]
关系式为:V = K[E]
三、温度对反应速度的影响
双重影响 最适温度
酶
2.0
(optimum temperat活的酶
BAL
巯基酶 BAL与砷剂结合物
* 概念
(二) 可逆性抑制作用
抑制剂以非共价键与酶或酶 - 底物复合物 可逆性结合,使酶的活性降低或丧失;抑制剂 可用透析、超滤等方法除去。
* 类型 竞争性抑制
非竞争性抑制
反竞争性抑制
1. 竞争性抑制作用 定义
抑制剂与底物的结构相似,能与底物竞 争酶的活性中心,从而阻碍酶底物复合物的 形成,使酶的活性降低。
活
性
1.5
酶促反应速度最 快时的环境温度。
* 低温的应用
1.0
0.5
0
10 20 30 40 50 60
温度 º C
四、 pH对反应速度的影响
酶
活 性
胃蛋白酶
淀粉酶
胆碱酯酶
最适pH
(optimum pH):
酶催化活性最 大时的环境pH。
0
2
4
6
8
10
pH
五、激活剂对反应速度的影响
激活剂(activator) 使酶由无活性变为有活性或使酶活性增 加的物质。 • 必需激活剂 (essential activator) • 非必需激活剂 (non-essential activator)
练习
• • • • • Km值: A.与酶对底物的亲和力无关 B.是达到Vm所必须的底物浓度 C.所有酶的Km值相同 D.等于最大反应速度一半时的底物浓度
练习
• • • • • 对竞争性抑制剂错误的叙述是: A. 抑制剂结构与底物结构相似 B. 抑制剂与酶的活性中心结合 C. 抑制剂与酶的结合是不可逆的 D.抑制程度与抑制剂和底物浓度有关
inhibition):
可逆性抑制
{
竞争性抑制 (competitive inhibition) 非竞争性抑制 (non-competitive inhibition)
反竞争性抑制 (uncompetitive inhibition)
(一) 不可逆性抑制作用
* 概念 抑制剂通常以共价键与酶活性中心的必需 基团相结合,使酶失活,不能用透析、超滤等 方法予以除去。
练习
1.有机磷农药中毒受抑制的酶是: • A.乳酸脱氢酶 B.丙酮酸脱氢酶 • C.胆碱酯酶 D.葡萄糖激酶 2.Hg2+或As3+进入体内与酶活性中心结合 的基团是: • A .-OH B.-SH C .-NH2 D. -COOH
练习
1.有机磷农药进入体内与酶活性中心结合的 基团是: • A .–OH B.-SH • C .-NH2 D. –COOH 2.下列哪项不是影响酶促反应的因素: A.底物浓度和酶浓度 B.酶原浓度 C.反应环境的温度 D.反应环境的pH
Kinetics of Enzyme-Catalyzed Reaction
影响因素包括有
酶浓度、底物浓度、pH、温度、
抑制剂、激活剂等。
一、底物浓度对反应速度的影响
矩形双曲线
※1913年 Michaelis 和 Menten提出反应速度与
底物浓度关系的数学方程式,即米-曼氏方 程式,简称米氏方程式(Michaelis equation)。
有机磷化合物对羟基酶的抑制
芥 子 气 毒 气 弹
SH E SH +
Cl As Cl
H C
S CHCl E S As
H C
CHCl + 2HCl
巯基酶
路易士气
H2C SH SH E SH
失活的酶
H2C S + HC S H2C OH
酸
S E S
H As C CHCl + HC SH H2C OH
从而使该物质被酶所标记。
通过测定酶的活性来判断被
标记物质或与其定量结合的
物质的存在和含量。 酶联免疫测定法 (enzyme-linked immunosorbent assay,ELISA)
* 举例
有机磷化合物 羟基酶
解毒 -- -- -- 解磷定(PAM)
重金属离子及砷化合物 巯基酶
解毒 -- -- -- 二巯基丙醇(BAL)
RO P
X + E OH
RO P
O E
+ HX 酸
O R'O 有机磷化合物 羟基酶
+
O R'O 磷酰化酶 CHNOH
N
CH3 解磷定
+
N CH3
E OH O OR' P CHNO OR
六、抑制剂对反应速度的影响
酶的抑制剂(inhibitor)
凡能有选择地使酶的催化活性降低或丧 失而不引起酶蛋白变性的物质统称为酶的抑 制剂。
区别于酶的变性
抑制剂对酶有一定选择性,而变性的因 素对酶没有选择性
抑制作用类型
{
不可逆性抑制 (irreversible
inhibition)
可逆性抑制 (reversible
竞争性抑制
* 举例
1.丙二酸对琥珀酸脱氢酶的抑制
琥珀酸脱氢酶
琥珀酸
FAD FADH2
延胡索酸
COOH CH2 C H2 COOH 琥珀酸
COOH CH2 COOH 丙二酸
2. 磺胺药对细菌FH2合成酶的抑制
Glu + H2N COOH PAB A + 二氢蝶呤
FH2合成酶
FH 2
FH2还原酶
(一) 酶与疾病的发生 (二) 酶与疾病的诊断 (三) 酶与疾病的治疗
二、酶在医学上的其他应用
(一)酶作为试剂用于临床检验和科学研究 1.酶法分析 即酶偶联测定法(enzyme
coupled assays),是利用酶作为分析试剂, 对一些酶的活性、底物浓度、激活剂、抑制
剂等进行定量分析的一种方法。
最简单的酶偶联反应模式: Ei Ex
A
B
C
Ex为所要测定的酶 A、B二物质分别为其底物和产物,对此二 物质变化,无法直接监测, 指示酶Ei:其底物为Ex的产物B,其反应产物C可 直接监测, 这样通过第二个酶反应有可能推测出第一个酶 的活性浓度
2 .酶标记测定法 酶可以代
替同位素与某些物质相结合,
