光谱分析2
第二章-光谱分析法概论

E单位:电子伏(eV)或焦耳(J) h -普朗克常数,h=6.626×10-34 J·s-1; C为光速。
例:波长为200nm的电磁波,其能量是多少电子伏特(eV)? 解:
电磁波谱
13
二、电磁辐射与物质相互作用
电磁辐射与物质的相互作用是复杂的物理现象。 涉及能量变化:吸收、发射; 不涉及能量变化:反射、散射、折射、衍射。
第二章 光谱分析法概论
1
本章主要内容:
一、电磁辐射及其与物质的相互作用 二、光学分析法的分类 三、光谱分析仪器
概述
光学分析法是基于电磁辐射与物质相互作用后,电磁辐 射发生某些变化或被作用物质的某些性质发生改变而产 生各种信号,利用这些信号对物质的性质、组成及结构 进行分析的一种方法。
光学分析法的原理主要包含三个过程: (1)能源提供能量; (2)能量与被测物质相互作用; (3)产生被检测的信号。
3
第一节 电磁辐射及其与物质的相互作用
4
电磁辐射的性质:波粒二象性
1.波动性
电磁辐射的传播以及反射、折射、散射、衍射及 干涉等现象表现出电磁辐射具有波的性质。
图2-1 电磁波的传播
6
波动性参数描述
(1)周期 T 相邻两个波峰或波谷通过某一固定点所需要的时间间隔称为周期。单 位:s(秒)。
(2)频率ν 单位时间内电磁波振动的次数称为频率。单位:Hz或周/秒。 ν =1/T
范围的谱带。
2.组成:
单色器
入射狭缝 色散元件 准直镜
棱镜 光栅
分光系统
出射狭缝
滤光器
47
(1)狭缝 狭缝为光的进出口, 狭缝宽窄直接影响分 光质量。狭缝过宽, 单色光不纯,将使吸 光度变大;过窄,则 通光量变小,灵敏度 降低。因此狭缝宽度 要适当。
2紫外吸收光谱分析
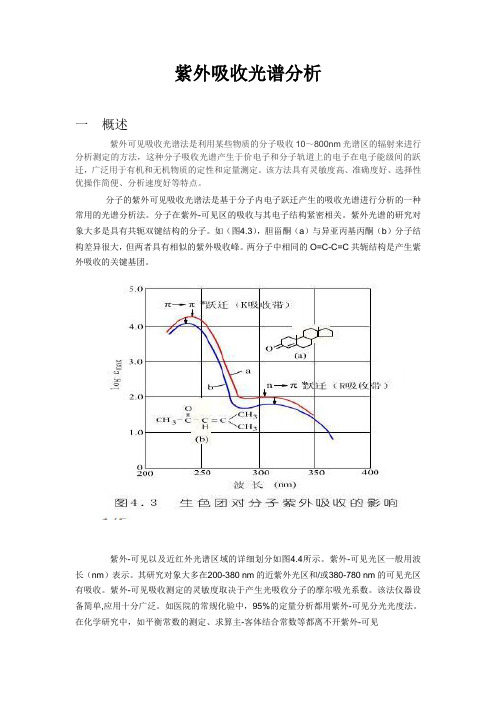
紫外吸收光谱分析一概述紫外可见吸收光谱法是利用某些物质的分子吸收10~800nm光谱区的辐射来进行分析测定的方法,这种分子吸收光谱产生于价电子和分子轨道上的电子在电子能级间的跃迁,广泛用于有机和无机物质的定性和定量测定。
该方法具有灵敏度高、准确度好、选择性优操作简便、分析速度好等特点。
分子的紫外可见吸收光谱法是基于分子内电子跃迁产生的吸收光谱进行分析的一种常用的光谱分析法。
分子在紫外-可见区的吸收与其电子结构紧密相关。
紫外光谱的研究对象大多是具有共轭双键结构的分子。
如(图4.3),胆甾酮(a)与异亚丙基丙酮(b)分子结构差异很大,但两者具有相似的紫外吸收峰。
两分子中相同的O=C-C=C共轭结构是产生紫外吸收的关键基团。
紫外-可见以及近红外光谱区域的详细划分如图4.4所示。
紫外-可见光区一般用波长(nm)表示。
其研究对象大多在200-380 nm的近紫外光区和/或380-780 nm的可见光区有吸收。
紫外-可见吸收测定的灵敏度取决于产生光吸收分子的摩尔吸光系数。
该法仪器设备简单,应用十分广泛。
如医院的常规化验中,95%的定量分析都用紫外-可见分光光度法。
在化学研究中,如平衡常数的测定、求算主-客体结合常数等都离不开紫外-可见二基本原理紫外可见吸收光谱的基本原理是利用在光的照射下待测样品内部的电子跃迁,电子跃迁类型有:(1)σ→σ* 跃迁指处于成键轨道上的σ电子吸收光子后被激发跃迁到σ*反键轨道(2)n→σ* 跃迁指分子中处于非键轨道上的n电子吸收能量后向σ*反键轨道的跃迁(3)π→π* 跃迁指不饱和键中的π电子吸收光波能量后跃迁到π*反键轨道。
(4)n→π* 跃迁指分子中处于非键轨道上的n电子吸收能量后向π*反键轨道的跃迁。
电子跃迁类型不同,实际跃迁需要的能量不同:σ→σ* ~150nmn→σ* ~200nmπ→π* ~200nmn→π* ~300nm吸收能量的次序为:σ→σ*>n→σ*≥π→π*>n→π*特殊的结构就会有特殊的电子跃迁,对应着不同的能量(波长),反反映在紫外可见吸收光谱图上就有一定位置一定强度的吸收峰,根据吸收峰的位置和强度就可以推知待测样品的结构信息三特点1、紫外可见吸收光谱所对应的电磁波长较短,能量大,它反映了分子中价电子能级跃迁情况。
第二章 光谱分析法导论

26
分子发射
分子发射与分子外层的电子能级、振动能级和转动能 级相关。因此分子发射光谱较原子发射光谱复杂。 为了保持分子的形态,分子的激发不能采用电、热等 极端方式,而采用光激发或化学能激发。 分子发射的电磁辐射基本处于紫外、可见和红外光区 。因此分子主要发射紫外、可见电磁辐射,据此建立 了荧光光谱法、磷光光谱法和化学发光光谱法。 与分子吸收光谱一样,由于相邻两个转动能级之间的 能量差很小,因此由相邻两个转动能级跃迁回同一较 低能级的两个跃迁的能量差也很小,故发射过程所发 射的两个辐射的频率或波长很接近,通常的检测系统 很难分辨出来。而分子能量相近的振动能级又很多, 因此表观上分子发射表现为对特定波长段电磁辐射的27 发射,光谱上表现为连续光谱。
E=(n+1)hv
hv
E=nhv
能量降低
发射(Emission)
物质受到激发而跃迁
到激发态后,由激发态跃迁回到基态时以辐
射的方式释放能量。
能量:光、电、热、化学能等
M → M
M→ M+h
24
发射跃迁可以理解为吸收跃迁相反的过程。由于原子 、分子和离子的基态最稳定,,所以发射跃迁涉及的 是从较高能态向基态的跃迁。 可以通过实验得到发射强度对波长或频率的函数图, 即发射光谱图。 通常情况下,分子、原子和离子处于基态,因此要产 生发射,必须使分子、原子和离子处于激发态,这个 过程称为激发。 激发可以通过提供不同不同形式的能量来实现。包括 三种:1.热能。将试样置于高压交流火花、电弧、火 焰、高温炉体之中,物质以原子、离子形式存在,可 获取热能而处于激发态,并产生紫外、可见或红外辐 射;2.电磁辐射。即用光辐射作用于分子或原子,使 之产生吸收跃迁,并发射分子荧光、分子磷光或原子 荧光;3.化学能。即通过放热的化学反应是反应物或 产物获取化学能而被激发,并产生化学发光。
X射线荧光光谱分析技术简介2

9
光分析法
非光谱分析法 光谱分析法
圆 折 二 射 色 法 性 法
X 射 干 线 涉 衍 法 射 法
39
全固态检测器
40
仪器结构和微区分析系统 专利]
可以在30mm直径内的任意位置进行分析。
41
250um成图分析,世界首创
实用的详细显示
岩石样品
Ba 250μm 成图
Ba 1mm 成图
42
滤光片
初级滤光片 次级滤光片
43
初级滤光器(光源滤光片)
作用
–降低背景 –改善荧光
样品
初级滤光片 检测器 X射线源
6
7
波长λ(m) 10-13 10-12 10-11 10-10 10-9 10-8 10-7 10-6 10-5 10-4 10-3 10-2 10-1 1Å
pm nm μm
1 10 1 10 2 10 3
10 4
m
km
射 线
射 线
紫 可 外 见 线 光
红 外 线
微 波
超 短 中 短 波 波 波
X射线荧光光谱仪
1
基础知识简介
2ቤተ መጻሕፍቲ ባይዱ
什么是仪器分析?
仪器分析是一大类分析方法的总称,一般的说,仪 器分析是指采用比较复杂或特殊的仪器设备,通过 测量物质的某些物理或物理化学性质的参数及其变 化来获取物质的化学组成、成分含量及化学结构等 信息的一类方法。或者说通过施加给测试样品一定 的能量,然后分析其对声、光、电等物理或物理化 学信号的响应程度或变化大小。分析仪器即测量这 些信号及变化的装置。根据待测物质在分析过程中 被测量或用到的性质,仪器分析可分为光分析方法、 电分析方法、分离分析方法等。
原子发射光谱分析 (2)

火焰 电弧 火花
直流电弧 交流电弧
电感耦合等离子体,ICP 激光光源
(1)、直流电弧:接触引燃,二次电子发射放电
L
E 220~380V V
5~30A
G
R
A
直流电作为激发能源,电压150 ~380V,电流5~ 30A;
两支石墨电极,试样放置在一支电极(下电极)的凹槽内;
阴极释放的电子不断撞击阳极,产生高温阳极斑(4000 K);
等离子体是一种电离度大于0.1%的电离气体,由电子、 离子、原子和分子所组成,其中电子数目和离子数目基本相等, 整体呈现中性。
通常产生等离子体的气体为氩气。 最常用的等离子体光源是直流等离子焰(DCP)、电感耦 合高频等离子炬(ICP)、容耦微波等离子炬(CMP)和微波诱 导等离子体(MIP)等。
电感耦合等离子体
ms 光谱的多重性(M):
M=2S+1
内量子数(J):光谱支项 J = L+S、•••、 L-S J = S+L、•••、 S-L
(LS )
(S >L)
(二).原子的能级与能级图
1.光谱项:原子发射光谱是由原子或离子的核外电子在高低级间跃迁 而产生的,原子或离子的能级通常用光谱项符号来表示:
n2S+1LJ or n M LJ
第八章 原子发射光谱分析法
•原子光谱法(Atomic spectroscopy methods)是基于激 发(热能、电能或光能)下的气态原子的外层电子的能级 间跃迁过程中吸收或发射的特征谱线而建立的光学分析法。 •研究与光谱线有关的特征物理量:波长和强度 波长—定性 强度—定量 •原子光谱类型 原子发射光谱:发射(吸收热能、激发以后回到基态时) 原子荧光光谱:发射(吸收光辐射、激发以后回到基态时) 原子吸收光谱:吸收(吸收光辐射、基态到激发态时) •分析对象:元素分析(Elemental analysis)
现代光谱分析-2-上转换

80年代后期,随着泵浦源、上转换材料的进展和对 激光机理研究的深入,上转换发光研究进入一个新 的时期。上转换激光器可以在红、绿、蓝、紫外的 宽广波段实现众多的激光谱线,并且在一定的波段 范围内可调,利用储能效应容易获得高峰值功率输 出,并且在多摸二级管激光泵浦下很容易获得好的 基摸输出。它弥补了半导体激光向短波方向发展的 困难与不足,在全色显示、光信息存储、生物医疗、 传感器及海底光通讯等方面显示出广阔的应用前景。 1986年, Sliver smith用BaY2F8: Er 3+首次实现了 连续波上转换激光;1987年,AntiPenko用BaY2F8: Er 3+首次实现了室温下的上转换激光。
P∝N0N1
合作上转换( CU)
CU 过程发生在同时位于 激发态的同一类型的离子之 间, 可以理解为三个离子之 间的相互作用, 其原理如图4 所示: 首先同时处于激发态 的两个离子将能量同时传递 给一个位于基态能级的离子 使其跃迁至更高的激发态能 级, 而另外两个离子则无辐 射驰豫返回基态。
图4 合作上转换图示
合作上转换的一个明显特征就是不存在与发射光子 相匹配的能级。CU 过程是稀土离子之间的相互作用, 强烈依赖于稀土离子的浓度,一般情况下高掺杂浓度 时容易发生合作上转换发光。
“光子雪崩”(Photon Avalanche)
“光子雪崩”过程引起的上转换发光是1979 年Chivian等研究Pr3+ 离子在LaCl3 晶体中的上 转换发光时首次提出的,当时并未认为它是主 要抽运机制。随后十几年,相继报道了在不同 基质材料中掺不同稀土离子的光子雪崩现象, 如Tm3+:LaF3, Tm3+:CaF2等。
2-1 上转换发光的发展历史
2-2 稀土元素的上转换发光 2-3 上转换纳米颗粒及生物 学应用 2-4上转换发光成像技术与 靶向成像应用
实验一苯甲酸红外光谱测定及谱图解析(2)

苯甲酸的红外光谱测定及谱图解析—KBr晶体压片法制样一、目的要求(1)学习用红外吸收光谱进行化合物的定性分析,(2)掌握用压片法制作固体试样晶片的方法;(3)熟悉红外分光光度仪的工作原理及其使用方法。
二、实验原理当一定频率(一定能量)的红外光照射分子时,如果分子某个基团的振动频率和外界红外辐射频率一致,二者就会产生共振。
此时,光的能量通过分子偶极矩的变化传递给分子,这个基团就吸收一定频率的红外光,产生振动跃迁(由原来的基态跃迁到了较高的振动能级),从而产生红外吸收光谱。
如果红外光的振动频率和分子中各基团的振动频率不一致,该部分红外光就不会被吸收。
用连续改变频率的红外光照射某试样,将分子吸收红外光的情况用仪器记录下来,就得到试样的红外吸收光谱图。
由于振动能级的跃迁伴随有转动能级的跃迁,因此所得的红外光谱不是简单的吸收线,而是一个个吸收带。
在化合物分子中,具有相同化学键的原子基团,其基本振动频率吸收峰(简称基频峰)基本上出现在同一频率区域内,例如,CH3(CH2)5CH3、CH3(CH2)4C≡N和CH3(CH2)5CH=CH2等分子中都有-CH3,-CH2-基团,它们的伸缩振动基频峰都出现在同一频率区域内,即在<3000cm-1波数附近,但又有所不同,这是因为同一类型原子基团,在不同化合物分子中所处的化学环境有所不同,使基频峰频率发生一定移动,例如C=O基团的伸缩振动基频峰频率一般出现在1850~1860cm-1范围内,当它位于酸酐中时,C=O为1820~1750cm-1、在酯类中时,为1750~1725cm-1;在醛中时,为1740~1720cm-1;在酮类中时,为1725~17l0cm-l;在与苯环共轭时,如乙酞苯中C=O为1695~1680cm-1,在酰胺中时,C=O 为1650cm-1等。
因此,掌握各种原子基团基频蜂的频率及其位移规律,就可应用红外吸收光谱来确定有机化合物分子中存在的原子基团及其在分子结构中的相对位置。
第2章原子吸收光谱分析

2.1.2谱线轮廓与谱线宽度 2.1.2谱线轮廓与谱线宽度 谱线轮廓
吸收光谱与发射光谱的关系 共振线与吸收线
从基态 跃迁第一激发态,又回到基 跃迁第一激发态,又回到基 态,发射出光谱线,称共振发射线 态,发射出光谱线,称共振发射线。 共振发射线。 同样从基态跃迁 同样从基态跃迁至第一激发态所产生的吸 共振吸收线(简称为共振线)。 收谱线称为共振吸收线 收谱线称为共振吸收线(简称为共振线)。
第2 章
原子吸收光谱分析
Atomic absorption spectroscopy AAS
2.1.1 一、历史
概述
原子吸收光谱法是一种基于待测基态原子对特征 谱线的吸收而建立的一种分析方法。这一方法的发展 经历了3 经历了3个发展阶段:
1、原子吸收现象的发现
• 1802年Wollaston发现太阳光谱的暗线; 1802年Wollaston发现太阳光谱的暗线; • 1859年Kirchhoff和 Bunson解释了暗线产生的原因; 1859年Kirchhoff和 Bunson解释了暗线产生的原因;
3、电热原子化技术的提出
1959年里沃夫提出电热原子化技术,大大提高了原子吸收的 灵敏度
二、原子吸收光谱法的特点
1、灵敏度高(火焰法:1 ng/ml,石墨炉100-0.01 pg); 2、准确度好(火焰法:RSD <1%,石墨炉 3-5%) 3、选择性高(可测元素达70个,相互干扰很小) 缺点:不能多元素同时分析
火焰原子化条件的选择
火焰类型 燃气-助燃气比例 测量高度
原子化过程
试样 雾化为雾滴 雾滴蒸发成固体颗粒 固体颗粒蒸发产生分子 分子 原子 激发分子 离子
火焰原子化器特点. 火焰原子化器特点.
第2章 光谱分析法概论

第2章 光谱分析法概论根据物质发射的电磁辐射或物质与辐射的相互作用建立起来的一类仪器分析方法,统称为光学分析法。
光是电磁辐射(又称电磁波),是一种不需要任何物质作为传播媒介就可以以巨大速度通过空间的光子流(量子流),具有波粒二象性(波动性与微粒性)。
光的波动性体现在反射、折射、干涉、衍射以及偏振等现象。
波长λ 、波数σ 和频率υ相互关系为:λν/c = 和c //1νλσ==,c =2.997925×1010cm/s 。
光的微粒性体现在吸收、发射、热辐射、光电效应、光压现象以及光化学作用等方面,用每个光子具有的能量E 作为表征。
光子的能量与频率成正比,与波长成反比,关系为: σλνhc hc h E ===/从γ 射线一直至无线电波都是电磁辐射,光是电磁辐射的一部分,若把电磁辐射按照波长或频率的顺序排列起来,就可得到电磁波谱(electromagnetic spectrum )。
波长在360~800nm 范围的光称为可见光,具有同一波长、同一能量的光称为单色光,由不同波长的光组合成的称为复合光。
复合光在与物质相互作用时,表现为其中某些波长的光被物质所吸收,另一些波长的光透过物质或被物质所反射,透过物质的光(或反射光)能被人眼观察到的即为物质所呈现的颜色。
不同波长的光具有不同的颜色,物质的颜色由透射光(或发射光)的波长所决定。
当物质与辐射能相互作用时,其内部的电子、质子等粒子发生能级跃迁,对所产生的辐射能强度随波长(或相应单位)变化作图,所得到的谱图称为光谱(也称波谱)。
利用物质的光谱进行定性、定量和结构分析的方法称为光谱分析法或光谱法。
以测量气态原子或离子外层或内层电子能级跃迁所产生的原子光谱为基础的成分分析方法为原子光谱法,由分子中电子能级(n )、振动能级(v )和转动能级(J )的变化而产生的光谱为基础的定性、定量和物质结构分析方法为分子光谱法。
有紫外-可见分光光度法(UV-Vis ),红外吸收光谱法(IR ),分子荧光光谱法(MFS )和分子磷光光谱法(MPS )等。
波谱学课件——红外光谱分析4IR2
例2:未知物分子式为C6H8N2,其红外谱图如下 图所示,试推其结构。
解:不饱和度计算式:US = 1+n4+ 1 (n3-n1)
2
1+6+1/2(2-8)=4
n4-四价原子数目 n3-三价原子数目 n1-一价原子数目
未知物的不饱和度为4,故有可能含苯环,此推 测由3031 cm-1的峰及苯环的骨架振动:在1450~ 1650 cm-1之间有2~4个峰所证实,由750cm-1的吸 收知该化合物含邻位二取代苯环。
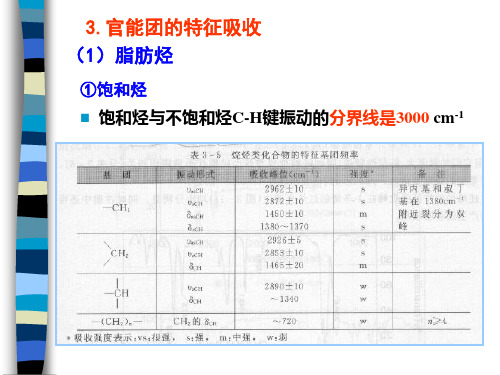
3.官能团的特征吸收 (1)脂肪烃
①饱和烃 饱和烃与不饱和烃C-H键振动的分界线是3000 cm-1
②烯烃
=C-H 3100 ~3000cm-1 C=C在双键区1680~1600 cm-1(w or m) 结构完全对称的双键是红外非活性,在该区无C=C吸
收 面外=C-H位于1000~650 cm-1,强度大,特征性强,
酰胺 酸酐
吸收峰位置(cm-1) 1735-1715 1720-1710 1770-1750 1745-1720
1700-1680(酰胺I带) 1820和1760
(6)胺基
伯胺:在3300-3500cm-1出现双峰(asN-H sN-H),特征性 较强
仲胺:在3500 cm-1有单峰 叔胺:红外光谱没有明显特征 成盐后伯胺、仲胺的N-H均移向低频
如:H2O和CO2及微量杂质
(4)红外谱图解析顺序 先观察官能团区,找出该化合物存在的官能团, 然后查看指纹区;
(5)标准红外谱图的应用 最常见的红外标准谱图为萨特勒(Sadtler) 红外谱图集和DMS(docementation of molecular spectroscopy)卡片
有机波谱解析-第二章 紫外光谱

有机波谱解析
4. 溶剂的选择
由于溶剂对电子光谱图影响很大,因此,在吸收光谱图 上或数据表中必须注明所用的溶剂。与已知化合物紫外光 谱作对照时也应注明所用的溶剂是否相同。 在进行紫外光谱法分析时,必须正确选择溶剂。选择溶 剂时注意下列几点: (1)溶剂应能很好地溶解被测试样,溶剂对溶质应该是惰性 的。即所成溶液应具有良好的化学和光学稳定性。 (2)在溶解度允许的范围内,尽量选择极性较小的溶剂。 (3)溶剂在样品的吸收光谱区应无明显吸收。 (4)尽量和文献中所用的溶剂一致。 (5)溶剂挥发性小、不易燃、无毒性、价格便宜。
λmax(nm) 254 261 263 266 272
ε max 200 300 300 305 300
π → π*与苯环振动引起; 含取代基时, B带简化, 红移。
有机波谱解析 4、n→π*跃迁
所需能量较n→σ* 跃迁小。 吸收波长为270~350nm,但跃迁禁阻ε值较小,通常在 100以内,一般在近紫外区或可见光区有吸收。 含杂原子的不饱和化合物(如羰基、C=N等)中均呈现
O 非极性
C
C
π 极性
非极性
n → π*跃迁:兰移; λ↓ ;ε↑
λmax(正己烷) λmax(氯仿)
π → π*跃迁:红移; λ↑;ε↓
λmax(甲醇) λmax(水)
π→π n→π
230 329
238 315
237 309
243 305
有机波谱解析
溶剂对芳香族化合物(B带)的影响
苯 酰 丙 酮 1 2 1:乙醚 2:水
有机波谱解析
3. 紫 外 光 谱 图
横坐标:波长或频率 纵坐标:吸光度(A) 或 透过率(T)
有机波谱解析 紫外光谱(图)的特点: 吸收谱带少; 吸收谱带宽; 通常以谱带吸收最强的波长表示谱带位置,称 为最大吸收波长(λmax) ,是分子的特征常数, 与分子电子结构相关,可推测化合物中生色团类 型和共轭大小; 吸收强度以最大吸收波长处的摩尔吸光系数 (εmax)表示,也是分子特征常数和鉴定化合物 的重要依据。
2 红外光谱法解读

另外,CO2分子为线性分子,它有 3n-5 = 4 个振动自由度。
← → O=C=O ← ← O=C=O ↑ ↑ ⊕ ⊕ O=C=O O=C=O
→
1
←
→
2
→
↓
3
面内弯曲振动
⊙
4
面外弯曲振动
对称伸缩振动
反对称伸缩振动
其中3、4的振动频率相等,它们可以合 并为简并振动。
4 产生红外吸收的必备条件
(必考内容)
2 红外吸收光谱的产生
用连续波长的红外光照射某种物质,由 于该物质对红外光的选择性吸收,使透射光 中部分波长的光线减弱或缺失,从而形成某 物质的红外光谱。
红外光谱可比紫外光谱提供更多的结构 信息,因而,红外光谱更多地用于分子结构 分析。
3 分子振动类型
(本节内容比较抽象,大家在学习中要充分发挥想象力)
以CO2分子为例:(CO 分子为线性分子)
2
← → O=C=O → ←
对称伸缩振动
← ← O=C=O → →
反对称伸缩振动
再以亚甲基为例:
对称伸缩振动
反对称伸缩振动
同理,3 个 以上原子分子或 基团如: -CH3、CH4 等 也存在对称伸缩 振动(完全同步)、 反对称伸缩振动
(不完全同步)。
H C
(必须牢记考试必考)
3.6 振动自由度 所谓的振动自由度即振动形式种数。 分子的振动自由度也就是分子总的振动形式种数。 如 H-Cl 分子振动自由度为 1,即表示 H-Cl 有一 种振动形式或者说有一种振动类型。 分子中每个原子都有三个自由度(x、y、z 三维空 间),n 个原子分子有 3n 个自由度。 但分子质心的平移运动(沿x、y、z轴方向)和整 体绕轴运动(以 x、y、z 为轴心)不产生振动,所以 n 个原子分子的振动形式有 3n-6 个(但直线型分 子为 3n-5 个——因为直线型分子只有二维结构)。
第七章 红外光谱分析法2

有机化合物分子中常见基团吸收峰
(3)C=O (1850 1600 cm-1 ) 碳氧双键的特征峰,强度大,峰尖锐。
有机化合物分子中常见基团吸收峰
3.叁键(C C)伸缩振动区:2500 1900 cm-1
酯类化合物红外谱图
D 羧酸(P182)
在羧酸中,羧基(-COOH)中的>c=o的伸缩振动,O-H 伸缩振动及O-H面外弯曲振动是红外光谱中识别羧酸的三个 重要特征频率。羧酸具有强的缔合作用,使>c=o的伸缩振动 频率比游离态低。未取代的饱和脂肪酸的Vc=o 在1760cm-1附 近,而缔合态则降到1720cm-1附近。同时,缔合作用使O-H 的伸缩振动频率降低,一般在3300~2600cm-1区可见到宽而 强的吸收峰。在指纹区955~915cm-1 区的O-H弯曲振动的强 吸收峰也是比较特征的。
(3)当分子含有四个以上—CH2—所组成 的长链时,在720cm-1附近出现较稳定的弱 吸收峰。 •n=1 770~785 cm-1 (中 ) • n=2 740 ~ 750 cm-1 (中 ) •n=3 730 ~740 cm-1 (中 ) • n≥ 722 cm-1 (中强 )
烷烃的红外谱图总结
1 单一组分的纯物质( > 98%):多组分要经过分离提纯, 否则各组分光谱相互重叠,难以解析
2 不含游离水:水有红外吸收,且侵蚀吸收池的盐 窗
3 浓度和测试厚度适当
制样方法
1)气体 ——气体池 (不同长度光程规格 10 cm; 10 m、 20 m、50 m ) ①液膜法: 将液体夹于两块晶面之间,适用于难 挥发液体. ②吸收池(石英比色皿):用注射器将样品注入 液体密封吸收池中,适用于易挥发液体。 溶剂: CCl4 ,CS2常用
第二章:紫外光谱分析

第二章 紫外光谱分析
作业:
返回
下列化合物,同时有n→π 、π→π 、σ→σ 跃迁
的化合物是:
A. 一氯甲烷
B. 丁酮
C. 环己
烷
D. 乙醇
E. 乙醚
第二章 紫外光谱分析
2.1.4. 常用术语
生色团:分子中含有非键或键的电子体系,能吸收特征外来辐 射时并引起n-* 和-*跃迁的基团。
2.1.1电磁波谱 2.1.2紫外吸收光谱的产生 2.1.3电子跃迁的类型 2.1.4常见的光谱术语 2.1.5光吸收定律 2.1.6偏离吸收定律的因素
返回
第二章 紫外光谱分析
2.1.1电磁波谱
区域 γ射线 X射线 远紫外 紫外 可见 红外 远红外 微波 无线电波
波长 10-3~0.1nm 0.1~10nm 10~200nm 200~400nm 400~800nm 0.8~50μm 50~1000μm 0.1~100cm
b.摩尔吸光系数小,吸收强度在10 ~100,属 于禁阻跃迁。
第二章 紫外光谱分析
2.1.4. 常用术语
2. K带 由共轭体系中π→π* 产生的吸收带。例:
>C=C—C=C—C=C< 。 特点:a. 吸收峰出现区域:210~250nm,即在近紫 外区。 b. ε >104 。
第二2章.1.4紫. 常外用光术语谱分析
第二章 紫外光谱分析
2.1.3 电子跃迁的类型
电子从基态(成键轨 道)向激发态(反键 轨道)的跃迁。
杂原子末成键电子被 激发向反键轨道的跃 迁
σn 电子
O π 电子
C
σn电子
第二章 紫外光谱分析
2.1.3 电子跃迁的类型
第二章原子发射光谱分析

2.原子吸收光谱分析法
利用特殊光源发射出待测元素的共振线,并将溶液中离 子转变成气态原子后,测定气态原子对共振线吸收而进行的 定量分析方法。
3.原子荧光分析法
气态原子吸收特征波长的辐射后,外层电子从基态或低 能态跃迁到高能态,在10-8s后跃回基态或低能态时,发射出 与吸收波长相同或不同的荧光辐射,在与光源成90度的方向 上,测定荧光强度进行定量分析的方法。
二、光分析法仪器的基本单元
1. 光源
依据方法不同,采用不同的光源:火焰、灯、激光、电 火花、电弧等;依据光源性质不同,分为:
连续光源:在较大范 围提供连续波长的光源, 氢灯、氘灯、钨丝灯等;
线光源:提供特定波 长的光源,金属蒸气灯( 汞灯、钠蒸气灯)、空心 阴极灯、激光等;
2.单色器
单色器:获得高光谱纯度辐射束的装置,而辐射束的波长 可在很宽范围内任意改变;
平行光经过棱镜后按波长顺序排列成为单色光;经聚焦 后在焦面上的不同位置上成像,获得按波长展开的光谱;
棱镜的分辨能力取 决于棱镜的几何尺寸和 材料;
棱镜的光学特性可 用色散率和分辨率来表 征;
棱镜的特性与参数
(1)色散率
角色散率:用dθ/dλ表示,偏向角θ对波长的变化率;
d d
2sin
2
4.分子荧光分析法
某些物质被紫外光照射激发后,在回到基态的过程中发 射出比原激发波长更长的荧光,通过测量荧光强度进行定量 分析的方法。
5. 分子磷光分析法
处于第一最低单重激发态分子以无辐射弛豫方式进入第 一激发态的三线态,再跃迁返回基态发出磷光。测定磷光强 度进行定量分析的方法。
第2章 光谱分析法导论

(3)基于上述两点,光学分析法的应用非常广泛。
线光谱
带光谱
三、电磁辐射的发射(emission)
3、连续光谱(continum spectra):
固体被加热到炽热状态时,无数原子和分子的运动或振动 所产生的热辐射称为 连续光谱,也称黑体辐射(blackbody radiation)。
通常产生背景干扰。温度越高,辐射越强,而且短波长的 辐射强度增加得最快!
6×1014~ 2 2.5 × 106~ 莫斯鲍尔光谱法
×1012
8.3×103
X 射线 10-3~10nm
3 × 1014~ 1.2×106 ~ X 射线吸收法
3×1010
1.2×102
X 射线荧光法
紫外光 10~400nm 可见光 400~750nm
3 × 1010 ~ 125~3.1 7.5×108
六、以电磁辐射为基础的常用光谱方法
波谱区 近红外光 中红外光 远红外光
微波
射频
波长 0.75~2.5m 2.5~50m 50~1990m 0.1~100cm 1~100 m
跃迁类型
分子振动
分子转动 电子、核自旋
近红外光谱区:配位化学的研究对象
红外吸收光谱法:红外光分子吸收
远红外光谱区
电子自旋共振波谱法:微波分子未成对电子吸收
核磁共振波谱法:射频原子核自旋吸收
Small balls on the surface of Mars: The constituents of small balls was proved to be FeS2 by using Musbal Spectrometry (莫斯鲍尔光谱法)
光的色散与光谱分析实验 (2)

光谱分析在其他领域的应用
农业:检测 植物营养状 况,指导施
肥和灌溉
环境监测: 监测水质、 空气质量, 评估环境污
染程度
医疗诊断: 分析血液、 尿液等样本, 辅助疾病诊
断
食品检测: 检测食品成 分,保障食
品安全
考古研究:分 析文物表面的 颜料和腐蚀情 况,了解文物 的历史和文化
价值
天文学:研 究恒星、星 系等天体的 光谱,了解 宇宙的起源
光的色散原因:不同颜色的光在棱镜中的折射率不同,导致光的传播方向发生 变化
光的色散实验:使用三棱镜或光栅进行实验,观察光的色散现象
光的色散应用:用于光谱分析,分析光的成分和结构
光的色散实验方法
• 实验器材:三棱镜、白光光源、彩色滤光片、光屏
• 实验步骤: a. 将三棱镜放置在白光光源前,调整角度使白光通过三棱镜。 b. 在三棱镜后方放置彩色 滤光片,观察通过三棱镜的光线颜色变化。 c. 使用光屏接收通过三棱镜的光线,观察光屏上的彩色 条纹。
光的色散与光谱分析实验
, a click to unlimited possibilities
汇报人:
目录
单击此处添加 目录项标题
光的色散现象
光谱分析实验
光谱分析的应 用
光谱分析实验 的注意事项
01
添加象:不同颜色的光在通过棱镜时,会分散成不同颜色的光带
光的色散现象的应用
光学仪器:如 望远镜、显微 镜等,利用光 的色散现象来 提高成像质量
光谱分析:通 过分析光的色 散现象,可以 获取物质的化 学成分和结构 信息
彩色印刷:利 用光的色散现 象,可以制作 出彩色印刷品
光学通信:利 用光的色散现 象,可以实现 高速、大容量 的光学通信
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
红外吸收光谱
Fourier transform infrared spectrometer, FTIR Definition of FTIR:
当分子振动导致其偶极矩的改变,造成分子键中电子云 分布的改变,在吸收特定波长的电磁辐射(红外线)的 情况下产生分子振动能级跃迁。
When molecular vibrations result in a change in the bond dipole moment, as a consequence of change in the electron distribution in the bond, it is possible to stimulate transitions between energy levels by interaction with EM radiation of an appropriate frequency. The detection of the energy absorption constitutes IR spectroscopy.
红外区域中的重要基团振动
1.红外吸收光谱的产生条件
辐射应具有刚好能满足物质跃迁时所需的能量。 ——物质内部能级的跃迁是量子化的。 ——外界红外辐射的频率必须与分子中某个基团的振动频 率一致 。
辐射与物质之间有相互作用。 ——分子必须有偶极矩的改变。
分子偶极矩:
——描述分子极性的大小。
偶极矩μ=q*d
k值增大则增大。即原子间的键能越大,振动频率越高。
各种碳碳键伸缩振动的吸收频率比较: C C = 1300cm-1,C = C =1600cm-1,C C = 2200cm-1。
关于虎克定律的讨论
由于伸缩振动力常数比弯曲振动的力常数大,所以伸缩振动的吸收出 现在较高的频率区,而弯曲振动的吸收则在较低的频率区。
i.面内变形振动(in plane bending vibration, ); 剪式振动(scissoring vibration, ); 面内摇摆振动(rocking vibration, );
ii.面外变形振动(out-of-plane bending vibration, );
面外摇摆振动(wagging vibration, ); 扭曲变形掘动(twisting vibration, )。
三、红外吸收谱
红外光:0.75-1000微米。 分子振动光谱,分子振动、转动能级的跃迁。 获取分子的键长、键角、键强等信息——“分子指纹” 。 现代结构化学、分析化学最常用和不可缺少的工具。
振动光谱
Vibrational spectroscopy
定义(Definition): 振动光谱是用于检测分子伸缩与弯曲振动能级跃迁的材料 分析手段。
面外摇摆振动
扭曲振动
亚甲基(-CH2-)的几种基本振动形式及红外吸收
伸缩 振动
反对称
对称
as: 2926cm-1 (s) s: 2853cm-1(s)
变形 振动
s:强吸收, m:中等强度吸收, w,弱吸收
剪式
摇摆
摇摆
扭曲
面内
面外
:1468cm-1 (m) :720cm-1 :1306~1303cm-1 (w) :1250cm-1(w)
变形或弯曲振动分类:
面内变形振动、面外变形振动
面内振动
剪式振动——振动方向与分子平面平行,键角改变。 面内摇摆振动——分子基团的键角不变,只是作为一个 整体相对于分子平面摇摆,这种摇摆在分子平面内。
剪式振动
面内摇摆振动
面外振动
面外摇摆振动——变形振动方向垂直于分子平面,分子基 团的键角不变,作为一个整体偏离分子平面摇摆。 扭曲变形振动——分子基团绕着与基团相连分子的价键扭 动。 若扭动时分子键角发生变化,称为扭曲振动。 若键角不变,为扭转振动。
丙二酸中的C=O存在两 个振动吸收带,分别是 1710和1740cm-1。
D. 费米共振
当一振动的倍频与另一振动的基频接近时,因相互作用而产生很强 的吸收峰或发生裂分,为费米共振现象。
的C=O有两个振动带(1773和1736cm-1), 其原因为C=O的1774cm-1基频带与 的C-C变角振动(880-860cm-1)的倍频发生费米共振,使 C=O产生裂分。
部分分子的振动频率相等,出现简并,实际振动吸收带较 少(理论3n-6)。
基团频率
Characteristic Frequencies (Characteristic group)
定义(Definition):
特征基团频率就是分子中的一些特定基团的振动频率,用 于与分子中的其他基团相区分。
Characteristic frequencies are based on the fact that the vibrational frequencies of particular chemical groups in molecules, e.g. C=O, ─CH3, tend to behave largely independently of the rest of the molecule of which they are apart.
基本振动频率除决定于化学键两端的原子质量,化学键的力常数外, 还与内部因素(结构因素)及外部因素(化学环境)有关。
2.分子振动的形式
分子运动:移动、振动、转动和分子内电子运动。 红外光波长:在分子振动能级跃迁范围内。 分子振动反映物质内部结构信息。
——分(原)子质量增加,振动频率下降。 ——分子键能增加,振动频率上升。 ——分子振动频率还与物质内部结构、外部化学环境有关。 分子的振动类型: ——伸缩振动、变形或弯曲振动。
• 分子振动能级
——在平衡状态,分子振动具有确定偶 极矩变化频率。外界辐射不引起分子偶 极矩变化。 ——外界特征辐射导致分子偶极矩变化。
引起偶极矩变化的振动——红外活性。 反之为非红外活性。
分子振动方程式 (Hook's Law)
分子中的原子以平衡点为中心,以非常小的振幅(与原子核之间的距 离相比)作周期性的振动,即所谓简谐振动。最简单的分子是双原子分 子。可用一个弹簧两端联着两个小球来模拟。mA和mB分别代表两小球 的质量(原子质量),弹簧的长度r就是分子化学键的长度。用经典力学 (虎克定律)可导出这个体系的振动频率(以波数表示):
(2)同一类型化学键,偶极矩变化与结构的对称性有关。 对称性差,吸收强度高;对称性好,吸收强度小。 R-CH=CH-R对称性好于R-CH=CH2,吸收强度较小。
(3)氢键导致原子间距离增大,偶极矩变化增大,吸收增 强。
(4)吸收强度还与振动形式有关。
FTIR的吸收强度和表示方法
例:C=C双键在下述三种结构中,吸收强度的差别就非常 明显:
(1)R—CH=CH2 摩尔吸光系数 = 40 (2)R—CH=CH—R 顺式摩尔吸光系数 = 10 (3)R—CH=CH—R 反式摩尔吸光系数 = 2
这是由于对于C=C双键来说,结构(1)的对称性最差,因此吸收较 强,而结构(3)的对称性相对最高,故吸收最弱。
6.吸收带的位置及其影响因素 (1)外部因素
共轭效应导致C=O双键电子云密度降低,振动频率降低。
羰基与双键共轭,C=O键长增加,降低了羰基的双键性, 使吸收频率移向 低波数。
c. 偶极场效应
分子内空间中的电子、键分布会导致键性变化,使振动频率偏移。
式中(1)、(2)中的Cl-与O2-发生负负相斥作用,使C=O上电子云 移向双键,C=O键强增加,振动频率提高。
3.振动吸收带的类型
吸收带:基频带、倍频带和合频带
基频带:分子的振动从一个能级跃迁到相邻高一能级产生 的跃迁,是分子的基本振动产生的吸收谱带。
倍频带:分子振动能级跃迁两个以上能级所产生的吸收谱 带,出现在基频带的n倍处,但强度为基频带的1/10左右。
合频带:两个以上基频带波数(波长的倒数)之和或差处 出现的吸收谱带,强度比基频带弱得多。
式中k为力常数,mA、mB分别为A、B原子的质量, 定义为简化质量,
c为光速,为振动频率。
虎克定律(Hooke‘s law)
定义(Definition): 分子振动频率 (v) 可表述为v = (k/μ)1/2/2π ,其中k 为力常 数,简化质量 μ= m1 m2 /( m1+ m2)。
The vibration frequency (v) is expressed by v = (k/μ)1/2/2π where k is the force constant and μ= m1 m2 /( m1+ m2) is the reduced mass.
试样状态、测定条件、溶剂极性等的不同会引起吸收带位置。 气态C=O伸缩振动频率较液、固态高。
(2)内部因素 A. 电效应
由化学键的电子分布不均匀引起,包括诱导效应、共轭效应和偶极场 效应。
a. 诱导效应
不同的电负性,通过静电诱导作用,引起分子中电子分布的变化, 从而引起键力常数的变化,改变了基团的特征频率。
亚甲基的基频峰
4. 红外光谱谱图
横坐标:波数,纵座标:吸收率或透过率。
红外光谱的吸收强度和表示方法
1.透光度
式中 I0—入射光强度; I —入射光被样品吸收后透过的光强度。
2.吸光度
横坐标:表示波长或波数, 波数是波长的倒数,即 (cm-1)=104/(m)
