药品不良反应新版表格
药品不良反应(表)
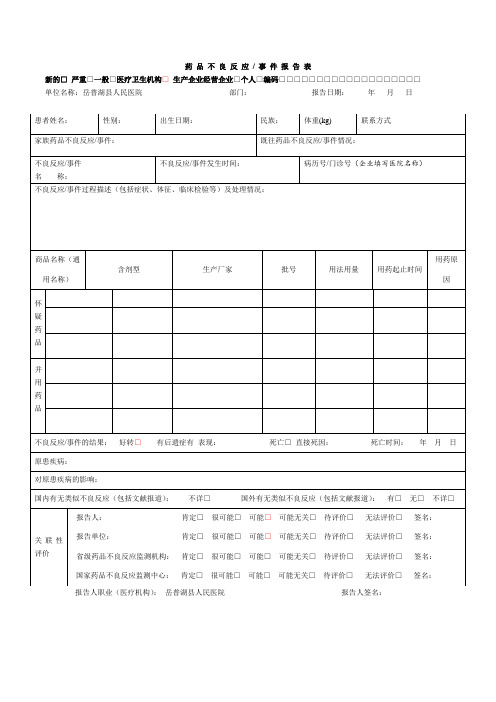
新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□
单位名称:岳普湖县人民医院部门:报告日期:年月日
患者姓名:
性别:
出生日期:
民族:
体重(kБайду номын сангаас)
联系方式
家族药品不良反应/事件:
既往药品不良反应/事件情况:
不良反应/事件
名 称:
不良反应/事件发生时间:
报告人职业(医疗机构):岳普湖县人民医院报告人签名:
病历号/门诊号(企业填写医院名称)
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
商品名称(通用名称)
含剂型
生产厂家
批号
用法用量
用药起止时间
用药原因
怀
疑
药
品
并
用
药
品
不良反应/事件的结果: 好转□有后遗症有表现:死亡□直接死因: 死亡时间:年 月 日
原患疾病:
对原患疾病的影响:
国内有无类似不良反应(包括文献报道):不详□国外有无类似不良反应(包括文献报道): 有□无□不详□
关联性评价
报告人:肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能无关□待评价□无法评价□签名:
省级药品不良反应监测机构: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
国家药品不良反应监测中心: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
药物不良反应报告表

药物不良反应报告表
药物不良反应报告表是一种重要的医学文书,它记录了药物治疗中的不良反应情况,有助于医生进行有效的治疗和防止病人出现不良后果。
以下是一份药物不良反应报告表的范例,供医生参考:
一、基本信息
姓名:xxx 性别:男/女年龄:xx岁住址:xxxxxxxx
病史:xxxxx
二、用药信息
药品名称:xxxxx 厂家:xxxxx 批号:xxxxx
用药剂量:xxxxx 用药时长:xxxxx
给药方式:口服/注射等
三、不良反应信息
表现症状:xxxxx
发生时间:xxxxx
严重程度:轻/中/重
处理方法:xxxxx
是否再次应用药品:是/否四、病人反应信息
语言描述:xxxxx
病人签字:_________
五、报告人信息
报告人姓名:xxxxx
报告人联系方式:xxxxx
报告日期:xxxxx
以上为药物不良反应报告表的基本信息和范例,医生们在进行
药物治疗时应该注意认真记录患者的药物使用情况和不良反应状况,及时进行统计和分析,以便更有效地进行治疗和预防。
同时,医生也应该积极鼓励患者配合填写不良反应报告表,共同维护医
学治疗的公平、科学和安全。
药品不良反应报告表

药品不良反响 / 事件报告表报告种类:新的□严重□一般□初次报告□追踪报告□报告根源:医疗机构□药品经营公司□药品生产公司□其余□患者姓名性别:男□女□出诞辰期:年代日民族联系方式:体大病历号 / 门诊号 (kg)或年纪家族药品不良反响 / 事件:有□无□不详□既往药品不良反响 / 事件状况:有□无□不详□既往病史:(如高血压、糖尿病、肝肾疾病等)不良反响 / 事件名称:有关重要状况:怀胎□抽烟□喝酒□药物滥用□放射治疗□其余□不良反响 / 事件发生时间:年代日不良反响 / 事件过程描绘(包含症状、体征、临床查验等)及办理状况(可附页):不良反响 / 事件的结果:治愈□好转□未好转□不详□有后遗症□表现:死亡□直接死因:死亡时间:年代日1.停药或减量后,反响 / 事件能否消逝或减少?是□否□不明□未停药或未减量□2.再次使用可疑药品后能否再次出现相同反响/ 事件?是□否□不明□未再使用□通用名称(含剂型,监商品名称生产厂家批号用法用量测期内品种用 *注明)怀疑药品用药起止时间用药原由合并用药报告人:一定□很可能□可能□可能没关□待评论□没法评论□署名:关系性评价报告单位:一定□很可能□可能□可能没关□待评论□没法评论□署名:姓名:报告人信息电子邮件:联系方式:职业:医生□药师□护士□其余□署名:假如不想您的个人信息共享给生产公司,请打√□电话:报告日期:年代日单位名称:联系人:报告单位信息能否已报告给生产公司□使用单位□经营或入口单位□ 备注除非获得同意,报告表中的个人信息将予以保密。
13严重药品不良反响 / 事件是指因使用药品惹起以下伤害情况之一的反响 / 事件: 1)致使死亡;2)危及生命;3)致癌、致畸、致出生缺点;4)致使明显的或永远的人体伤残或器官功能的伤害;5)致使住院或住院时间延伸6)其余存心义的重要医学事件。
如,只管事件不会立刻危及生命或致使死亡和 / 或需住院,但为了预防出现任一上述所列状况可能需要进行治疗,往常也被以为是严重的。
药品不良反应登记表格模板

关联性评价
报告人:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
省级药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
药品不良反应/事件报告表
新的□严重□一般□医疗卫生机构□生产企业□经营企业□个人□编码
单位名称:部门:电话:报告日期:年月日
患者姓名:
性别:
男□女□
出生日期:
年月日
民族:
体重(㎏)
联系方式:
家庭药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
不良反应/事件发生时间:
国家药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告人职业(医疗机构):医生□药师□护士□报告人职务职称(企业):报告人签名:
病历号/门诊号
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
商品名称
通用名称(含剂型,监用药起
止时间
用药原因
怀疑
药品
并用
药品
不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
原患疾病:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:
新版药品不良反应事件报告表药品不良反应报告表

新版药品不良反应事件报告表药品不良反应报告表药品不良反应/事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
微生物实验报告微生物的分布实验报告学号:微生物学大实验班级:姓名:1.培养基的配置及消毒灭菌1.1通用培养基的配制(液体、固体、半固体三种) 1.1.1实验目的(1)了解配制微生物培养基的原理和培养基的种类。
(2)掌握配制微生物通用培养基的一般方法和操作步骤。
1.1.2实验原理培养异养细菌最常用的培养基是牛肉膏蛋白胨培养基,它是一种天然培养基。
牛肉膏是牛肉浸液的浓缩物,含有丰富的营养物质,它不仅能为微生物提供碳源、氮源,还含有多种维生素。
药物不良反应表

5. 反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释? 报告人签名: 注:发生不良反应请立即电话联系罗先权.
Байду номын сангаас
疑
药
品 用法用量 批号
用药原因 生产厂家 病情加重 很可能 很可能 可能 可能
导致后遗症 可能无关 可能无关
导致死亡 无法评价 无法评价 是 是 是 是 否 否 否 否 不明 不明 不明 是 否 不明 签名: 签名:
待评价 待评价
1. 用药与不良反应的出现有无合理的时间关系? 2. 反应是否符合该药已知的不良反应类型? 不良反应分析 3. 停药或减量后,反应是否消失或减轻? 4. 再次使用可疑药品后是否再次出现同样反应?
药品不良反应/事件报告表
报告日期 姓名 家族药品不良反应: 不良反应/事 件名称 有 姓别 无 不良反应 发生时间 出生日期 既往药品不良反应情况: 医院名称 体重 有 无 病历号/门 诊号 联系电话
不良反应过程描述(包括症状、体征、临床检验等)及处理情况:
怀 商品名称 用药起止时间 不良反应的结果: 关联性评价 报告人: 报告单位: 治愈 好转 肯定 肯定 通用名称
药品不良反应报告表(示范模板)

附表1药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降(80/50mmHg)等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一下相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
附表8 药品不良反应

患者1.2日以“间断咳嗽,咳痰21年,活动后胸闷4年,再发加重1天”为主诉入院。1.4日患者发热38.7℃,给予布洛芬混悬液(10mL/次,once,po)退热,服药约40min后,患者出现恶心,烧心的症状,考虑为布洛芬混悬液所致,遂停用该药物,后患者症状减轻。后患者未再使用该药物。
9
患者以咳嗽、咳痰3天为主诉入院,患者1.13日晚上八点左右,左手手面出现散在的点状红斑,伴瘙痒,但可忍受,考虑为乳酸左氧氟沙星氯化钠注射液所致皮疹,鉴于1.13日左氧氟沙星医嘱已经执行,1.14日停用乳酸左氧氟沙星氯化钠注射液。后患者未再出现皮疹的不良反应。与左氧氟沙星同时使用的还有多索茶碱,布地奈德雾化液和孟鲁司特钠片,查阅该药物相关资料,孟鲁司特同样会导致皮疹的发生,但患者1.15日出现皮疹后继续使用此两种药物,皮疹未加重,即皮疹与孟鲁司特的使用关系不大。且患者支气管哮喘急性发作期不会引起皮疹的发生,所以排除患者病情的影响。患者入院时无皮疹。
6
患者以发热伴咳嗽、咳痰半个月为主诉入院,2021.12.29)在我院住院时诊断为“双肺间质纤维化、双肺肺气肿和肺大泡”,尚未接受治疗。患有“阵发性心房颤动”1年,曾规律口服“胺碘酮片半片/次1次/日”和“利伐沙班片10mg 1次/日”治疗,20天前上述药物已停用。
2022.1.1,患者无明显诱因开始出现发热,测体温最高达37.5℃,伴咳嗽、咳痰,呈阵发性,咳少量黄白痰,痰粘不易咳出,伴胸闷、气短,活动时加重,伴纳差、乏力。院期间患者查胸部CT示:间质性改变。遂停用胺碘酮片。
药品不良反应/事件登记表
序号
分析与评价要点
1
患者11.4日以“间断胸闷、气短4年,加重2天”为主诉入院。11.9-11.13日给予哌拉西林他做巴坦钠(4.5g/次,q8h),11.12日晚,患者诉大便次数增多(3次),为稀便,患者既往无腹泻史,考虑为哌拉西林他做巴坦钠引起的腹泻,更换哌拉西林他做巴坦钠为盐酸左氧氟沙星氯化钠注射液,并给予蒙脱石散(1袋/次,tid),枯草杆菌二联活菌肠溶胶囊(0.25g/次,bid)对症处理,后未再出现腹泻。
药品不良反应记录表

药品不良反应/ 事件记录表编号:部门:电话:记录日期:年月日患者姓名性别:男□女□出生日期:年月日民族体重(kg)联系方式家族药品不良反应/事件:有□无□不详□既往药品不良反应/事件情况:有□无□不详□不良反应/事件名称:不良反应/事件发生时间:年月日病历号/门诊号原患疾病:不良反应/事件过程描述(包括症状、体征、临床检验等)不良反应/事件处理情况(对病人的诊治情况):通用名称(含剂型,监测期内品种用*注明)生产厂家批号用法用量用药起止时间(日期、时分)国内外有无类似不良反应(包括文献报道)怀疑药品通用名称(含剂型,监测期内品种用*注明)生产厂家批号用法用量用药起止时间(日期、时分)国内外有无类似不良反应(包括文献报道)并用药品不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:导致死亡□可疑物品、药品采集、封存情况品种:状况:时间:可疑物品、药品送检情况是□否□物品、药品名称:检验结果细菌:有□无□菌种:热原:是否合格是□否□不良反应/事件后续调查、分析:不良反应/事件不良反应□(新的□严重□一般□)不良事件□及分类判定不良反应关联肯定□很可能□可能□可能无关□待评价□无法评价□性评价不良反应/事件后干预措施(向临床/药库/药房反馈、预警):记录人:报告人职业(医疗机构):医生□药师□护士□其他□报告人签名:◇不良反应/事件分析1.用药与不良反应/事件的出现有无合理的时间关系?有□无□2.反应是否符合该药已知的不良反应类型?是□否□不明□3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□◇严重药品不良反应/事件是指有下列情形之一者:①引起死亡□②致畸、致癌或出生缺陷□③对生命有危险并能够导致人体永久的或显著的伤残□④对器官功能产生永久损伤□⑤导致住院或住院时间延长□。
药品不良反应报告表

制表单位:国家食品药品监督管理局药品不良反应/ 事件报告表(医疗单位使用)
新的□严重□一般□编码:□□□□□□□□□□□□□□□□□□□
单位名称:科别:电话:报告日期:年月日
《药品不良反应报告表》填表说明
一、《药品不良反应报告表》是药品安全性监测工作的重要档案资料,需要
永久保存,务必要用钢笔填写。
填写的内容和字迹要清查、整洁;不用
不规范的符号、代号,不通用的缩写和草体签名。
二、编号一栏,由省、自治区、直辖市药品不良反应监测机构填写,按以下
排列方式:
省(自治区、医疗预防
直辖市)市(地区)县(区)保健机构年代流水号
□□□□□□□□□□□□□□□
注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和
国行政区划代码填写。
三、在表格相应的方框中,应填入√。
四、不良反应名称应填写不良反应中最主要的表现。
五、不良反应的表现,要求摘要描述,与可疑不良反应有关的临床检查结果
要尽可能明确填写。
六、如有两种怀疑引起不良反应的药品,可同时填上。
药品名称要填写完整,
不可用简称。
七、紧急情况,包括严重的,特别是致死的不良反应,应以最快通讯方式(包
括电话、传真、特快专递、E-mail等)将情况报告国家药品不良反应监
测中心。
药品不良反应报告表

药品不良反应报告表药品不良反应报告表报告编号:_____一、报告人信息姓名:_______性别:_______年龄:_______联系电话:_______联系邮箱:_______二、不良反应患者信息姓名:_______性别:_______年龄:_______联系电话:_______联系邮箱:_______三、不良反应药品信息药品名称:_______剂型:_______规格:_______生产企业:_______批号:_______使用日期:_______四、不良反应信息1. 不良反应症状描述:_______2. 发生时间:_______3. 是否停用药品:_______4. 是否再使用药品:_______5. 是否咨询医生:_______五、就诊信息就诊医院:_______就诊科室:_______就诊医生姓名:_______就诊日期:_______六、医学资质信息医院名称:_______科室名称:_______执业医生:_______执业证书号码:_______七、报告时间及方式报告时间:_______报告方式:_______八、其他补充信息________________________________________________________________________请将填写完毕的不良反应报告表发送至相关药品监管机构,并妥善保管好相关资料。
备注:请在填写报告表时务必如实、完整填写相关信息,以便相关部门对不良反应进行调查和分析。
注意事项:1. 填写报告表时,请以清晰、明确的文字描述不良反应的具体情况。
2. 报告人需保留好自己的联系方式,以便相关部门与您联系,获取进一步的信息。
3. 在填写报告表时,请将不良反应患者的相关病历资料和检查报告归类整理,并随报告表一同提交。
感谢您的配合和支持!。
药品不良反应报告表(模版
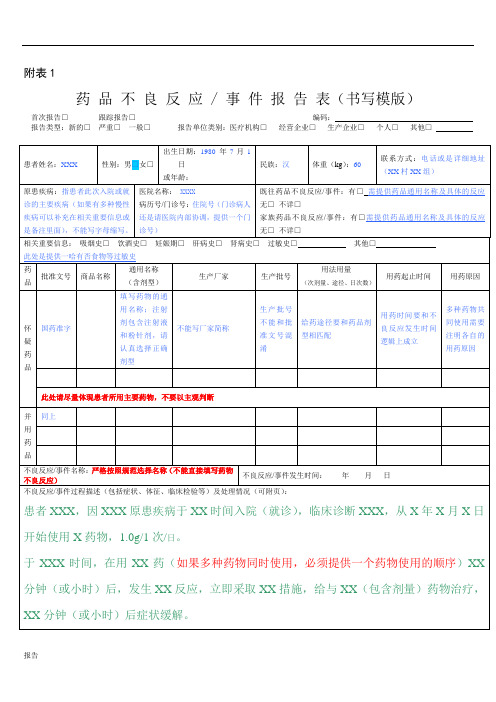
附表1药品不良反应 / 事件报告表(书写模版)首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□电子邮箱:签名:报告单位信息单位名称:联系人:电话:报告日期:年月日生产企业请医疗机构□经营企业□个人□文献报道□上市后研究□其他□填写信息来源备注药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
药品不良反应报告表(2020年最新版)

药品不良反应 / 事件报告表首次报告□跟踪报告□编码:
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1)导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告.
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次.
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为
药品的风险大于效益时,药品也会撤市.
不良反应/事件过程描述填写要求。
药品不良反应登记表

病历号/门诊号
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
商 品 名 称
通用名称(含剂型,监测期内品种用﹡注明)
生 产 厂 家
批 号
用法用量
用药起
止时间
用药原因
怀疑
药品
并用
药品
不良反应/事件的结果:治愈□好转□ 有后遗症□ 表现: 死亡□ 直接死因: 死亡时间: 年 月 日
省级药品不良反应监测机构:肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□ 签名:
国家药品不良反应监测机构:肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□ 签名:
报告人职业(医疗机构):医生□ 药师□ 护士□ 报告人职务职称(企业): 报告人签名:
原患疾病:
对原患疾病的影响:不明显□病程延长□ 病情加重□ 导致后遗症□ 表现:
国内有无类似不良反应(包括文献报道):有□ 无□ 不详□,国外有无类似不良反应(包括文献报道):有□ 无□ 不详□
关联性评价
报告人: 肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□签名:
报告单位:肯定□ 很可能□ 可能□ 可能有关□ 待评价□ 无法评价□ 签名:
药品不良反应/事件报告表
新的□ 严重□ 一般□医疗卫生机构□ 生产企业□经营企业□个人□ 编码
单位名称:部门:电话:报告日期:年月日
患者姓名:
性别:
男□女□
出生日期:ቤተ መጻሕፍቲ ባይዱ
年 月 日
民族:
体重(㎏)
联系方式:
家庭药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
药品不良反应报告表(2020年最新版)

药品不良反应 / 事件报告表首次报告□跟踪报告□编码:
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1)导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品.
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系.根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为
药品的风险大于效益时,药品也会撤市。
不良反应/事件过程描述填写要求。
药品不良反应报告表范例 .doc

药品不良反应报告表范例 .doc
药品不良反应记录
日期:xxxx年xx月xx日
药品名称:xxxx
制剂规格:xxxx
生产企业:xxxx
患者信息:
姓名:xxx
性别:xxx
年龄:xxx
病情/疾病诊断:xxx
不良反应记录:
1.反应名称:xxxx
发生时间:xxxx年xx月xx日xx时xx分
反应描述:患者出现了xxxx的症状,包括xxxx。
症状持续时间约为xx小时/天。
患者对此感到不适,并报告给医生。
处理措施:对患者的症状进行了观察,同时给予了xxxx的治疗。
结果:患者在接受治疗后,症状逐渐缓解,并在xx天后完全消失。
2.反应名称:xxxx
发生时间:xxxx年xx月xx日xx时xx分
反应描述:患者出现了xxxx的症状,包括xxxx。
症状持续时间约为xx小时/天。
患者对此感到不适,并报告给医生。
处理措施:对患者的症状进行了观察,同时给予了xxxx的治疗。
结果:患者在接受治疗后,症状逐渐缓解,并在xx天后完全消失。
备注:
1.患者的不良反应于xx年xx月xx日报告给医生,并得到及时处理。
2.对患者的不良反应进行了详细的记录,包括症状的描述、发生时间、处理措施和疗效结果。
3.患者在接受治疗后的症状得到缓解,并无其他严重不良反应发生。
以上是患者使用该药品期间出现的不良反应的详细记录。
如有进一步需要,请及时与我联系。
医师签名:xxxx
日期:xxxx年xx月xx日。
药品不良反应登记表格模板

不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
商品名称
通用名称(含剂型,监测期内品种用﹡注明)
生产厂家
批号
用法用量
用药起
止时间
用药原因
怀疑
药品
并用
药品
不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
原患疾病:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:
药品不良反应/事件报告表
新的□严重□一般□医疗卫生机构□生产企业□经营企业□个人□编码
单位名称:部门:电话:报告日期:年月日
患者姓名:
性别:
男□女□
出生日期:
年月日
民族:
体重(㎏)
联系方式:
家庭药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情
不良反应/事件发生时间:
国内有无类似不良反应(包括文献报道):有□无□不详□,国外有无类似不良反应(包括文献报道):有□无□不详□
关联性评价
报告人:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
省级药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
国家药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告人职业(医疗机构):医生□药师□护士□报告人职务职称(企业):报告人签名:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附表1
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
