碳硅及其化合物一轮复习精讲共33页文档
【教育资料】2019高考化学一轮复习碳硅及其化合物辅导讲义学习精品

1.C、Si单质的存在形态、物理性质及用途CO2+H2O H2CO3熟记硅及其化合物的特殊性质题组三硅的制取方法在设计制备纯硅的实验题中,常遇到的知识点有:1.正误判断,正确的打硅酸盐改写成氧化物形式的方法===BaCO3↓+H2O下列说法正确的是()A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值B.操作A与操作B完全相同C.该流程中硅元素的化合价发生改变D.反应器中发生的复分解反应为SiO2+2NaOH===Na2SiO3+H2O3.综合利用CO2、CO对构建低碳社会有重要意义。
(1)Li2O、Na2O、MgO均能吸收CO2。
如果寻找吸收CO2的其他物质,下列建议合理的是________(填字母)。
A.可在碱性氧化物中寻找B.可在ⅠA、ⅡA族元素形成的氧化物中寻找C.可在具有强氧化性的物质中寻找(2)Li4SiO4可用于吸收、释放CO2,原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,写出CO2与Li4SiO4反应的化学方程式:______________________________________________________________________________________________________________________________________;该反应为________(填“吸”或“放”)热反应,原因是_________________________________________________________________________________________________。
(3)CO和铁粉在一定条件下可以合成五羰基合铁[Fe(CO)5],该物质可用作无铅汽油的防爆剂,是一种浅黄色液体,熔点-20.5 ℃,沸点103 ℃,易溶于苯等有机溶剂,不溶于水,密度1.46~1.52 g·cm-3,有毒,光照时生成Fe2(CO)9,60 ℃发生自燃,五羰基合铁的制备原理如下:Fe(s)+5CO(g)200 ℃、20 MPaFe(CO)5(g)250 ℃~300 ℃①下列说法正确的是________(填字母)。
高考化学一轮复习1碳硅及其化合物课件

硅
物理 金刚石:熔点很___高__、硬度很__大___; 晶体硅为灰黑色固体,有金属 性质 石墨:硬度较___小__、良好的导电性 光泽、熔点_高__、硬度_大__、有脆性
_金__刚__石__用于制造切割刀具,石墨
_____ 用途
用于制造电极、铅笔芯。C60可作 催化剂或催化剂载体
半导体 晶体硅用作_______材料、硅芯片 和硅太阳能电池
提示:×。由于盐酸的酸性比碳酸的强,CO2与CaCl2溶液不反应。
(6)合成纤维和光导纤维都是新型无机非金属材料。
()
提示:×。合成纤维属于高分子材料,不属于新型无机非金属材料。
考点2:硅酸、硅酸盐和无机非金属材料 【核心知识自查】 1.硅酸和硅酸盐 (1)硅酸(H2SiO3)
(2)Na2SiO3
Na2SiO3+H2O+CO2====Na2CO3+H2SiO3↓
【易错警示】Na2SiO3的水溶液保存两提醒 (1)Na2SiO3易与空气中的CO2、H2O反应,要密封保存。 (2)可溶性碳酸盐、硅酸盐的水溶液呈碱性,保存该溶液的试剂瓶不能用 玻璃塞,应用橡胶塞。
2.无机非金属材料 (1)传统无机非金属材料
()
提示:×。石英玻璃的成分为SiO2,SiO2是氧化物不是盐。
(H提42S示)i向O:3N↓×a2+S。SiOO过323 溶量。液SO中2应通( 生入成过)H量S SO2。的离子方程式:O S32 i
+SO2+H2O====
(5)可依据反应Na2CO3+SiO2 O
3
Na2SiO3+CO2↑说明H2SiO3的酸性比H2CO3
强。 ( )
高温
提示:×。强酸+弱酸盐========强酸盐+弱酸,该规律仅适用于常温下水溶
碳、硅及其化合物(高考一轮复习使用稿)资料

矿石
BaO
CaO
H2O
Ba(OH)2 Ca(OH)2
CO2
BaCO3
例2 下列试剂的保存正确的是( A )
例3 已知,氮化硅是一种高温陶瓷,它硬度
大,熔点高,性质稳定,工业上用高纯硅和 氮气在高温下反应制得。
1)氮气的电子式为 2)氮化硅属于 学式为 。 。 (共价或离子)化合物,其化
3)氮化硅抗腐蚀性强,除氢氟酸外,它不与其它无机酸 反应。它与氢氟酸反应的产物为 。 4)四氯化硅和氮气在氢气氛保护下,加强热可得到高纯 度氮化硅。该反应的化学方程式为 。
例4 某碳酸盐矿石,主要成分为BaCO3 ,另外有少量
CaCO3 ,现需要获得BaCO3,并尽可能降低钙含量。为 此,查得有关溶解度数据如下表:
------------Ca(OH)2 Ba(OH)2
0 0C
0.173g 1.64g
50 0C
0.130g 13.1g
80 0 C
0.094g 101.5g
高 三 总 复 习
碳、硅及其化合物(碳族)
一、本讲教学主要内容 1.总结碳、硅两种元素的知识网络 2.比较碳、硅的两种单质和氧化物 二、重点、难点剖析及典型例析 (一)碳和硅及其重要化合物间的相互转化
碳及其化合物 金刚石: 石墨:
C60:
碳及其化合物(续)
CH4:
H H-C- H
H
(正四面体,属非极性分子, 电子式要求)
据此判断: Na (1)A、C、F中含有相同的元素是________ (2)该工业称为 制玻璃(硅酸盐工业) .化合物C的化学式为 Na2CO3 ,化合物A可溶于水,水溶液显____ 碱 性. (3)C的水溶液和D能否反应?其理由是___
高考化学一轮复习碳硅及其化合物辅导讲义-word

1.C、Si单质的存在形态、物理性质及用途CO2+H2O H2CO3熟记硅及其化合物的特殊性质题组三硅的制取方法在设计制备纯硅的实验题中,常遇到的知识点有:1.正误判断,正确的打硅酸盐改写成氧化物形式的方法===BaCO3↓+H2O下列说法正确的是()A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值B.操作A与操作B完全相同C.该流程中硅元素的化合价发生改变D.反应器中发生的复分解反应为SiO2+2NaOH===Na2SiO3+H2O3.综合利用CO2、CO对构建低碳社会有重要意义。
(1)Li2O、Na2O、MgO均能吸收CO2。
如果寻找吸收CO2的其他物质,下列建议合理的是________(填字母)。
A.可在碱性氧化物中寻找B.可在ⅠA、ⅡA族元素形成的氧化物中寻找C.可在具有强氧化性的物质中寻找(2)Li4SiO4可用于吸收、释放CO2,原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,写出CO2与Li4SiO4反应的化学方程式:______________________________________________________________________________________________________________________________________;该反应为________(填“吸”或“放”)热反应,原因是_________________________________________________________________________________________________。
(3)CO和铁粉在一定条件下可以合成五羰基合铁[Fe(CO)5],该物质可用作无铅汽油的防爆剂,是一种浅黄色液体,熔点-20.5 ℃,沸点103 ℃,易溶于苯等有机溶剂,不溶于水,密度1.46~1.52 g·cm-3,有毒,光照时生成Fe2(CO)9,60 ℃发生自燃,五羰基合铁的制备原理如下:Fe(s)+5CO(g)200 ℃、20 MPa250 ℃~300 ℃Fe(CO)5(g)①下列说法正确的是________(填字母)。
高三化学一轮复习精品 第4章 第1节 碳、硅及其化合物
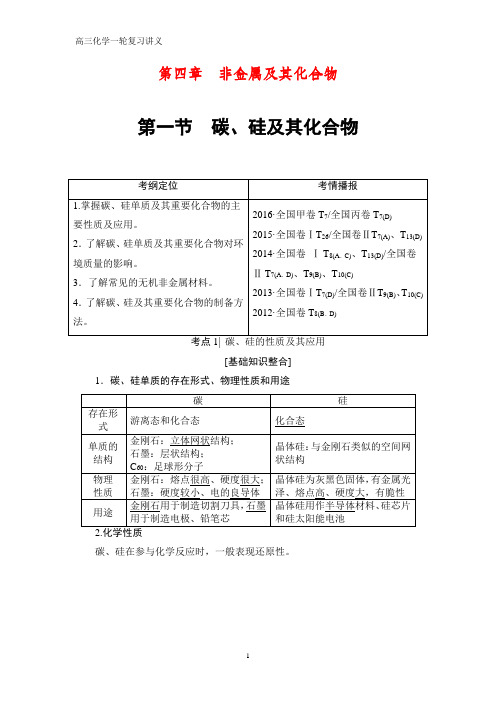
第四章非金属及其化合物第一节碳、硅及其化合物[基础知识整合]1.碳、硅单质的存在形式、物理性质和用途碳、硅在参与化学反应时,一般表现还原性。
[应用体验]1.从元素周期表的位置看,碳和硅均为ⅣA 族元素,自然界中有碳的多种单质存在,自然界中有硅的单质吗?为什么?[提示] 没有。
因为硅有很强的亲氧性,在地壳形成时硅与氧易结合,难分离,因而硅在自然界中主要以氧化物和硅酸盐的形式存在。
2.写出由SiO 2制备纯硅的化学方程式。
[提示] SiO 2+2C=====高温Si(粗)+2CO ↑, Si(粗)+2Cl 2=====△SiCl 4,SiCl 4+2H 2=====高温Si +4HCl 。
[考点多维探究]角度1 碳、硅的性质和应用1.科学家在不断深入的研究中,发现了一系列新的碳单质,对碳单质的研究已发展成一门独立的科学——碳科学。
下列关于碳单质的叙述正确的是( )A .碳的各种单质互称为碳的同素异形体B .碳元素的各种单质结构虽然不同,但性质差别不大C .碳元素的单质性质不同,其用途相同D .碳元素的单质只有金刚石与石墨A [碳的各种单质由于组成结构的不同,性质、应用也不一定相同。
]2.(2017·济南模拟)有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。
下列有关硅的说法中,不正确的是( )A .高纯度的硅广泛用于制作计算机芯片B .硅可由二氧化硅还原制得C .低温时,硅与水、空气和酸不反应,但能与氢氟酸反应D .自然界中硅的储量丰富,自然界中存在大量的单质硅D [硅为亲氧元素,在自然界中不存在游离态的单质。
]3.下列说法正确的是( )A .单质――→+O 2氧化物――→+H 2O 酸或碱――→+NaOH 或HCl盐,碳或硅单质可以按上述关系进行转化B .若a 、b 、c 分别为Si 、SiO 2、H 2SiO 3,则可以通过一步反应实现转化:b c ―→aC .太阳能电池板中的硅在元素周期表中处于金属元素与非金属元素的交界位置D .单质硅常用于制造光导纤维C [A 项,SiO 2与H 2O 不反应;B 项,SiO 2不能一步生成H 2SiO 3;D 项,SiO 2制造光导纤维。
碳硅及其化合物复习

SiO2的化学性质
1、与生石灰反应
SiO2+CaO
高温
CaSiO3
SiO2+2NaOH=Na2SiO3+H2O 2、NaOH溶液腐蚀玻璃 SiO2+4HF=SiF4+2H2O
3、HF不能用玻璃瓶盛装 高温 SiO2+Na2CO3 Na2SiO3+CO2↑ 4、生产玻璃原理 高温 SiO2+CaCO3 CaSiO3+CO2↑ 5、工业生产粗硅 SiO2+2C 高温 Si+2CO↑
比碳酸酸性弱的:H2S、HClO、H2SiO3、Al(OH)3 思考:怎样证明H2CO3比 HClO、H2SiO3、Al(OH) 3酸性强弱?用化学方程式表示。
Na2CO3与NaHCO3的化学性质比较 实验内容 与H+反应 与NaOH 与Ca(OH)2 与CaCl 2 实验现象 产生气泡 无明显现象
练习: 1、过量的CO2通入下列溶液中,最终出现 浑浊的是( D ) A.氯化钙溶液 B.石灰水 C.饱和亚硫酸钠溶液 D.水玻璃
练习: Ⅰ.(1)通常用NaHCO3除去混在CO2中的少量 CO2+2OH-=CO32-+H2O HCl气体,其反应的离子方程式为______。 CO32-( + CO2+H2O===2HCO3- (2)不用NaOH溶液的原因 用离子方程式表 示) ______。不用饱和Na2CO3溶液的原因 (用离子方程式表示)______________。 Ⅱ.向 NaOH溶液中通入CO2气体制备Na2CO3, 将 NaOH溶液分成两等份,向其中一份 由于通入 CO2的量难以控制,常混有NaOH或 中通入过量 CO2,然后再将另一份 NaHCO3,请利用所学知识设计方案制得纯 NaOH溶液加入第一份中,即得纯净的 净的Na2CO3溶液:_______。
