无机及分析化学第七章选择题及答案
无机及分析化学课后习题答案完整版

无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
无机及分析化学第七章 定量分析方法概述课后练习与答案

第七章分析化学概论一、选择题1.消除测量过程中的偶然误差的方法是( )A.空白实验 B.对照实验 C.增加平行测定次数 D.校正仪器2. 下列物质可采用直接法配制标准溶液的是 ( )A.NaOH B.HCl C.无水Na2CO3 D.KMnO43.下列说法错误的是 ( )A.系统误差又称为可测误差 B.系统误差具有单向性C.方法误差属于系统误差 D.偶然误差可完全消除4.下列属于偶然误差的是 ( )A.使用生锈的砝码称量B.标定HCl时所用Na2CO3不纯C.所用试剂含待测组分D.滴定管读数时最后一位估计不准5.05.2010 .01250.0的有效数字位数为( )A.4 B.2C.3 D.16.pH=10.02的有效数字位数为 ( )A.4 B.2C.3 D.无法确定7.用失去结晶水的Na2B4O7.10H2O标定HCl溶液,则测得的浓度会 ( ) A.偏高B.偏低C.与实际浓度一致D.无法确定8.滴定分析中,指示剂颜色发生突变的这一点称为 ( )A.化学计量点B.滴定终点C.既是化学计量点,也是滴定终点D.以上都不对9.测定CaCO3含量时,先加入一定量并且过量的HCl溶液,然后用NaOH标准溶液滴定剩余的HCl溶液,此滴定方式属于( )A.直接滴定B.返滴定C.置换滴定D.简接滴定10.常量分析的试样用量为 ( )A .大于1.0gB .1.0~10gC .大于0.1gD .小于0.1g11.滴定分析中,滴定管的读数误差为±0.01mL ,滴定管的一次滴定需读初、终两次读数,可能引起的最大误差为±0.02mL ,为使滴定的相对误差小于0.1%,终点时消耗的滴定剂的体积至少为 ( )A .10mLB .15mLC .20mLD .无法确定12.用25mL 常量酸碱滴定管进行滴定,结果记录正确的是( )A .18.2B .18.20C .18D .18.00013.已知T HCI/NaON =0.004000 g/ml 、则C HCI 为( )A .0.1000mol/LB .0.004000g/mlC .0.003600g/mlD .0.1097mol/L14.滴定管的读数误差为±0.02ml,若滴定时用去滴定液20.00ml ,则相对误差是( )A .±0.1%B .±0.01%C .±1.0%D .±0.001%15.在标定NaOH 溶液浓度时,某同学的四次测定结果分别为0.1023 mol ·L -1、0.1024 mol ·L -1、0.1022 mol ·L -1、0.1023 mol ·L -1,而实际结果应为0.1088 mol ·L -1,该学生的测定结果 ( )A .准确度较好,但精密度较差B .准确度较差,但精密度较好C .准确度较差,精密度也较差D .系统误差小,偶然误差大16.在定量分析结果的一般表示方法中,通常要求( )A .d R ≤2%B .d R ≤0.02%C .d R ≥0.2% D.d R ≤0.2% 17.T A/B 表示的意义是 ( )A .100ml 标准溶液A 中所含溶质的质量B .1ml 标准溶液A 中所含溶质的质量C .1L 标准溶液A 相当于被测物质B 的质量D .1ml 标准溶液A 相当于被测物质的质量18.T HCl/NaOH =0.003000g/ml ,终点时HCl 消耗40.00 ml ,试样中NaOH 的质量为( )A .0.1200gB .0.01200gC .0.001200gD .0.1200mg19.欲配制1000ml 0.1mol/L HCl 溶液,应取浓盐酸(12mol/L HCl)( )ml 。
无机及分析化学(下)智慧树知到答案章节测试2023年中国石油大学(华东)

第一章测试1.配合物K[Pt(NH3)Br2Cl2F]名称是一氨∙一氟∙二氯∙二溴合铂(II)化钾。
()A:对B:错答案:B2.配位滴定用的EDTA常用其二钠盐而不是乙二胺四乙酸。
()A:错B:对答案:B3.EDTA在水溶液中有七种存在形体,其中只有Y4-能与金属离子直接配位。
()A:错B:对答案:B4.金属指示剂与金属离子形成的配合物不够稳定,这种现象称为指示剂的僵化。
()A:对B:错答案:B5.酸效应系数越大,配合物稳定性越大。
()A:对B:错答案:B6.在配离子[CuI2]-中,Cu+离子接受配体孤对电子的杂化轨道是()。
A:spB:sp3C:sp3d2D:dsp2答案:A7.一般情况下,EDTA与金属离子形成的络合物的络合比是()。
A:2:1B:1:3C:1:1D:1:2答案:C8.αM(L) = 1表示()A:M与L没有副反应B:M的副反应较小C:[M]=[L]D:M与L的副反应相当严重答案:A9.EDTA的有效浓度[Y]与酸度有关,它随着溶液pH值增大而A:减小B:增大C:不变D:先增大后减小答案:B10.产生金属指示剂的僵化现象是因为()。
A:K′MIn < K′MYB:MIn溶解度小C:指示剂不稳定D:K′MIn > K′MY答案:D第二章测试1.Ag2CrO4、PbCrO4、BaCrO4均溶于强酸。
()A:对B:错答案:A2.KMnO4在酸中、碱中、受热、见光都不稳定。
()A:错B:对答案:B3.对于锰的各种氧化数的化合物,下列说法中错误的是()。
A:MnO2在碱性溶液中是强氧化剂。
B:Mn2+在酸性溶液中是最稳定的。
C:Mn3+在酸性或碱性溶液中很不稳定。
D:K2MnO4在中性溶液中发生歧化反应。
答案:A4.清洗长期盛放KMnO4的试剂瓶,应选用()。
A:稀HClB:HNO3C:酸性FeSO4 溶液D:浓H2SO4答案:C5.饮用含Cr(Ⅵ)的水会损害人的肠胃,而Cr(Ⅲ)毒性只有Cr(Ⅵ)的0.5%。
分析化学分析化学第七章 习题参考答案

第七章 习题参考答案14解:铝氟络合物的各累积形成常数lgβ1-lgβ6分别为:6.13,11.15,15.00,17.75,19.37,19.84665544332210][][][][][][113------++++++==+F F F F F F Al ββββββδδ6184.195137.194175.173100.152115.11113.6)10(10)10(10)10(10)10(10)10(10101011------⨯+⨯+⨯+⨯+⨯+⨯+=56.1484.1337.1475.1300.1215.913.51010101010101011-=++++++=可见,上式分母中第六项数值最大,故溶液中浓度最大的型体为AlF 52-。
19.05137.1956.14550510)10(1010][25----=⨯===-F AlF βδδδ[Al 52-]=5δ•C=10-0.19×0.010=10-2.19mol •L -1(6.5×10-3 mol •L -1)15解:Ni(NH 3)32+、Ni(NH 3)42+的累积形成常数分别为:lgβ3=6.77, lgβ4=7.963323233]][[])([NH Ni NH Ni ++=β4324243]][[])([NH NiNH Ni ++=β 依题意:[Ni(NH 3)42+]=10[Ni(NH 3)32+] 故33234324]][[10]][[NH Ni NH Ni ++=ββ [NH 3]=65.01010101010119.096.777.643=⋅=⨯=--L mol ββ mol•L -117解:(1)101004.01000.009.100/1005.03-⋅==L mol C COC a 0.01004×25.00=C EDTA ×24.90 C EDTA =0.01008 mol•L -1(2) T EDTA/ZnO = a/b mL g M C ZnO EDTA ⋅⨯=⨯⨯⨯=⨯---43310203.81038.8101008.0110因EDTA ≌Fe ≌3221O F e故 32/O F EDTA e T = a/b mL g M C O F EDTA e ⋅⨯=⨯⨯⨯=⨯---43310048.81069.15901008.021103218解:C 2O 42- + H + = HC 2O 4- K 1=452106.1104.611⨯=⨯=-a K HC 2O 42- + H + = H 2C 2O 4 K 2=21109.511-⨯=a K =16.9故 β1=K 1=452106.1104.611⨯=⨯=-a K β2=K 1·K 2=524107.2109.51106.1⨯=⨯⨯⨯- 3254221)(103.4)10.0(107.210.0106.11][][1242⨯=⨯⨯+⨯⨯+=++=++-H H H O C ββαlg )(242H OC -α=3.6319解:查附表4得:pH=5.5时,lg 51.5)(=H Y α7.627.8)(10100.1101][1=⨯⨯+=+=-Mg K MgY Mg Y αY α=)(H Y α+)(Mg Y α-1=105.51+106.7-1=106.7320解:(1) Zn 2+ + Y = ZnYpH=10.00时,lg 45.0)(=H Y α, lg 4.2)(=OH Zn α锌氨络合物的各累积形成常数lgβ1-lgβ4分别为:2.27,4.61,7.01,9.06锌氰络合物的累积形成常数lgβ4=16.7 43433323231)(][][][][13NH NH NH NH NH Zn ββββα++++==1+102.27×0.10+104.61×(0.10)2+107.01×(0.10)3+109.06×(0.10)4=1+101.27+102.61+104.01+105.06≈105.107.4437.1644)(10)10(101][1=+=+=--CN CN Zn βαZn α=)(3NH Zn α+)(CN Zn α+)(OH Zn α-2=105.10+104.7+102.4-2≈105.25lg 'ZnY K = lg ZnY K -lg Zn α- lg )(H Y α=16.50-5.25-0.45=10.80 (2)pZn SP ′=40.6)8.1000.2(21)lg (21,=+='+ZnY SP Zn K pC[Zn 2+′]=10-6.40mol•L -1 依 Zn α=][][22++'Zn Zn所以 [Zn 2+]=11225.540.62102.21010][---+⋅⨯=='L mol Zn Znα22解:根据Hg(CN)42-配离子的各级logK 值求得 Hg(CN)42-配离子的各级积累形成常数分别为: β1=K 1=1018.00 ,β2=K 1·K 2=1018.00×1016.70=1034.70 β3=K 1·K 2·K 3=1018.00×1016.70×103.83=1038.53β4=K 1·K 2·K 3·K 4=1018.00×1016.70×103.83×102.98=1041.5155.3351.3353.3270.3000.164251.413253.382270.34200.184433221)(10101010101)10(10)10(10)10(1010101][][][][1=++++=⨯+⨯+⨯+⨯+=++++=--------CN CN CN CN CN Hg ββββα查表得:lgk HgY =21.80 , pH=11.0时07.0lg )(=H Y α 9.15lg )(=OH Hg α故55.339.1553.33)()(10110101=-+=-+=OH Hg CN Hg Hg ααα82.1155.3307.080.21lg lg lg log )('-=--=--=∴H Y Hg HgY HgYK K αα26解:(1)5.135.1321101011===-a K β8.203.75.131221010110111=⋅=⋅=--a a K K β 5.32108.20105.13221)(10)10(1010101][][1≈⨯+⨯+=++=--++H H H In ββαpMg ep =pMgt=lg MgIn K -lgαIn(H)=7.6-3.5=4.1 (2) 查表得:lgK MgY =8.7,pH=10.00时, lg 45.0)(=H Y αlg 'MgY K = lg MgY K -lg )(H Y α=8.7-0.45=8.2513.5)25.82(21)lg (21,=+='+=MgY SP Mg Sp K pC pMg ΔpMg=pMg ep -pMg Sp =4.1-5.13=-1.03%8.0%10010010.01010%100101025.803.103.1,-=⨯⨯-=⨯'⋅-=-∆-∆MgYSp Mg pMgpMg t K C E(3)由例题6-6可知:采用铬黑T 时,pMg ep =pMgt=5.4故ΔpMg=pMg ep - pMg Sp =5.4-5.13=0.27而采用铬蓝黑R 时,ΔpMg=pMg ep -pMg Sp =4.1-5.13=-1.03由此可见,采用铬黑T 时,ΔpMg 更小,终点误差Et 也将更小,故选择铬黑T 更合适。
兰叶青无机及分析化学课后习题答案(所有章节)

第二章 习题解答2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×;(7)×;(8)×;(9);(10)×;(11)×2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系;2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ(2)Q =-100kJ W=500 kJ △U = Q + W=400 k2-13解:因为此过程为可逆相变过程,所以Q p =△H= ·mol -1W=-p 外△V ≈-n R T =-×=- kJ ·mol -1 △U = Q + W= +(-)= kJ ·mol -12-14解:(1)r m B f m Bf m 2f m f m f m 231B)3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯---=-⋅∑((,)+2()()()()+ΘΘΘΘΘΘ(2)r m B f m Bf m 2f m 2f m f m 21B)CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=-----=-⋅∑((,)+()()()()+ΘΘΘΘΘΘ(3)r m B f m Bf m 2f m f m 2f m 31B)6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯-⨯-=-⋅∑((,)+4()()()()+ΘΘΘΘΘΘ2-15解:乙醇的Θm f H ∆反应r m H ∆Θ为:(4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以:反应(4)=反应(2)×2+反应(3)×3-反应(1)r m r m r m r m -1(4)2(2)3(3)(1)2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ∆=∆+∆-∆=⨯-+⨯---=-⋅ΘΘΘΘ对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )r m f m f m 2f m 2f m 1()(H O,l)2(H ,g)2(C,s)1135.1(285.83)2020849.27kJ mol H H H H H -∆=∆-∆-∆-∆=----⨯-⨯=-⋅乙醇ΘΘΘΘΘ虽然,该反应的r m H ∆Θ<0(能量下降有利),但不能由r m H ∆Θ单一确定反应的方向,实际反应中还须考虑其他因素,如:混乱度、反应速率等。
分析化学第7章课后习题答案

分析化学第7章课后习题答案第七章氧化还原滴定1.条件电位和标准电位有什么不同影响电位的外界因素有哪些答:标准电极电位E′是指在⼀定温度条件下(通常为25℃)半反应中各物质都处于标准状态,即离⼦、分⼦的浓度(严格讲应该是活度)都是1mol/l(或其⽐值为1)(如反应中有⽓体物质,则其分压等于×105Pa,固体物质的活度为1)时相对于标准氢电极的电极电位。
电对的条件电极电位(E0f)是当半反应中氧化型和还原型的浓度都为1或浓度⽐为,并且溶液中其它组分的浓度都已确知时,该电对相对于标准氢电极电位(且校正了各种外界因素影响后的实际电极电位,它在条件不变时为⼀常数)。
由上可知,显然条件电位是考虑了外界的各种影响,进⾏了校正。
⽽标准电极电位则没有校正外界的各种外界的各种因素。
影响条件电位的外界因素有以下3个⽅⾯;(1)配位效应;(2)沉淀效应;(3)酸浓度。
2.是否平衡常数⼤的氧化还原反应就能应⽤于氧化还原中为什么答:⼀般讲,两电对的标准电位⼤于(K>106),这样的氧化还原反应,可以⽤于滴定分析。
实际上,当外界条件(例如介质浓度变化、酸度等)改变时,电对的标准电位是要改变的,因此,只要能创造⼀个适当的外界条件,使两电对的电极电位超过,那么这样的氧化还原反应也能应⽤于滴定分析。
但是并不是平衡常数⼤的氧化还原反应都能应⽤于氧化还原滴定中。
因为有的反应K虽然很⼤,但反应速度太慢,亦不符合滴定分析的要求。
3.影响氧化还原反应速率的主要因素有哪些答:影响氧化还原反应速度的主要因素有以下⼏个⽅⾯:1)反应物的浓度;2)温度;3)催化反应和诱导反应。
4.常⽤氧化还原滴定法有哪⼏类这些⽅法的基本反应是什么答:1)⾼锰酸钾法.2MnO4+5H2O2+6H+==2Mn2++5O2↑+8H2O.MnO2+H2C2O4+2H+==Mn2++2CO2+2H2O2) 重铬酸甲法. Cr2O72-+14H++Fe2+===2Cr3++Fe3++7H2OCH3OH+Cr2O72-+8H+===CO2↑+2Cr3++6H2O3)碘量法 3I2+6HO-===IO3-+3H2O,2S2O32-+I2===2I-+2H2OCr2O72-+6I-+14H+===3I2+3Cr3++7H2O5.应⽤于氧化还原滴定法的反应具备什么条件答:应⽤于氧化还原滴定法的反应,必须具备以下⼏个主要条件:(1)反应平衡常数必须⼤于106,即△E>。
农业出版社无机及分析化学习题解答汇总完整版

无机及分析化学(Ⅰ)习题解答目录第1章分散体系 (1)第2章化学热力学基础 (8)第3章化学反应速率和化学平衡 (15)第4章物质结构 (22)第5章分析化学概述 (27)第6章酸碱平衡 (31)第7章酸碱滴定法 (36)第8章沉淀溶解平衡 (44)第9章重量分析法和沉淀滴定法 (49)第10章配位化合物 (53)第11章配位滴定法 (62)第12章氧化还原反应 (67)第13章氧化还原滴定法 (78)第14章电势分析法 (83)第15章吸光光度分析法 (86)第16章试样分析中常用的分离方法简介 (90)第17章重要生命元素简述 (93)第18章原子核化学简介 (96)第1章 分散体系1-1.人体注射用的生理盐水中,含有NaCl 0.900%,密度为1.01g·mL -1,若配制此溶液3.00×103g ,需NaCl 多少克?该溶液物质的量浓度是多少?解:配制该溶液需NaCl 的质量为:m (NaCl)=0.900%×3.00×103g=27.0g该溶液的物质的量浓度为:-1-13-1-327.0g/58.5g mol (NaCl)==0.155mol L (3.0010g/1.01g m L )10c ⋅⋅⨯⋅⨯ 1-2.把30.0g 乙醇(C 2H 5OH)溶于50.0g 四氯化碳(CCl 4)中所得溶液的密度为1.28g∙mL -1,计算:(1)乙醇的质量分数;(2)乙醇的物质的量浓度;(3)乙醇的质量摩尔浓度;(4)乙醇的摩尔分数。
解:(1)w (C 2H 5OH) =25254(C H OH)30.0g (C H OH)(CCl )30.0g 50.0gm m m =++=0.38 (2)-12525-1-3(C H OH)30.0g/46g mol (C H OH)[(30.0+50.0)g /1.28g mL ]10n c V ⋅=⋅⨯==10.4mol·L -1 (3)b (C 2H 5OH) =-125-3430.0g(C H OH)46g mol (CCl )50.010kgn m ⋅=⨯=13.0mol·kg -1 (4)x (C 2H 5OH) =-125254-1-130.0g(C H OH)46g mol =30.0g 50.0g (C H OH)+(CCl )+46g mol 153.6g mol n n n ⋅⋅⋅ =0.650.660.650.33=+ 1-3.将5.0g NaOH 、NaCl 、CaCl 2分别置于水中,配成500mL 溶液,试求c (NaOH)、c (NaCl)、c (12CaCl 2)。
无机及分析化学第7章 习题解答

第七章 水溶液中的解离平衡 习题解答1.写出下列物质的共轭酸。
S 2-、SO 42-、H 2PO 4-、HSO 4-、NH 3、NH 2OH 、55C H N 。
1.依次为:HS -、HSO 4-、H 3PO 4、H 2SO 4、NH 4+、NH 2OH ⋅H +、55C H N ⋅H +。
2.写出下列物质的共轭碱。
H 2S 、HSO 4-、H 2PO 4-、H 2SO 4、NH 3、NH 2OH 、3+26[Al(H O)]。
2.依次为:HS -、SO 42-、HPO 42-、HSO 4-、NH 2-、NH 2O -、2+25[Al(OH)(H O)]。
3.根据酸碱质子理论,按由强到弱的顺序排列下列各碱。
NO 2-、SO 42-、HCOO -、HSO 4-、Ac -、CO 32-、S 2-、ClO 4-。
3.下列碱由强到弱的顺序:S 2-> CO 32-> Ac-> HCOO-> NO 2-> SO 42-> HSO 4-> ClO 4-1414.151010-- 1410.251010-- 144.741010-- 143.741010-- 143.371010-- 141.991010--4.pH =7.00的水溶液一定是中性水溶液吗?请说明原因。
4.不一定。
K w 随温度的改变而改变,在常温下它的值为10-14,此时的中性溶液pH 为7.005.常温下水的离子积w K θ=1.0×10-14,是否意味着水的解离平衡常数K θ=1.0×10-14?5.不。
w K θ=[H +][OH -],而K θ=[H +][OH -]/c (H 2O);c (H 2O)=11000/18.0255.5mol L 1-=⋅ 6.判断下列过程溶液pH 的变化(假设溶液体积不变),说明原因。
(1)将NaNO 2加入到HNO 2溶液中; (2)将NaNO 3加入到HNO 3溶液中; (3)将NH 4Cl 加入到氨水中; (4)将NaCl 加入到HAc 溶液中;6. (1)pH 变大。
国开作业无机及分析化学(本)-第7章单元测验46参考(含答案)

题目:在组成原电池时,盐桥的主要作用是提供电解质保持两个半电池中的电荷平衡,维持电池反应的进行。
选项A:对
选项B:错
答案:对
题目:将氢电极 (p(H2)=100kPa) 插入纯水中与标准氢电极组成原电池,则EMF为
选项A:0.828 V。
选项B:—0.414 V;
选项C:0.414 V;
选项D:0 V;
答案:0.414 V;
题目:下列反应均能正向进行:
FeCl3 + Cu → FeCl2 + CuCl2
KMnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
由此可以判断,其中电极电势最大的电对是
选项A:Cu2+ / Cu ;
选项B:Fe3+ / Fe2+ ;
选项C:H+ / H2 ;
选项D:MnO4- / Mn2+ 。
答案:MnO4- / Mn2+ 。
题目:在实际应用中,经常采用饱和甘汞电极作为参比电极,其电极电势是0.2415V,电极中的离子浓度为1.0 mol·L-1 。
选项A:对
选项B:错
答案:错
题目:p ( H2 ) = 100kPa 时,在下列各溶液中, E ( H+ / H2 )最小的是选项A:1.0 mol·L-1 H2SO4 ;
选项B:1.0 mol·L-1 NaOH。
选项C:0.50 mol·L-1 NaOH ;
选项D:1.0 mol·L-1 HCl ;
答案:1.0 mol·L-1 NaOH。
无机及分析化学第7章 习题解答

第七章 水溶液中的解离平衡 习题解答1.写出下列物质的共轭酸。
S 2-、SO 42-、H 2PO 4-、HSO 4-、NH 3、NH 2OH 、55C H N 。
1.依次为:HS -、HSO 4-、H 3PO 4、H 2SO 4、NH 4+、NH 2OH ⋅H +、55C H N ⋅H +。
2.写出下列物质的共轭碱。
H 2S 、HSO 4-、H 2PO 4-、H 2SO 4、NH 3、NH 2OH 、3+26[Al(H O)]。
2.依次为:HS -、SO 42-、HPO 42-、HSO 4-、NH 2-、NH 2O -、2+25[Al(OH)(H O)]。
3.根据酸碱质子理论,按由强到弱的顺序排列下列各碱。
NO 2-、SO 42-、HCOO -、HSO 4-、Ac -、CO 32-、S 2-、ClO 4-。
3.下列碱由强到弱的顺序:S 2-> CO 32-> Ac-> HCOO-> NO 2-> SO 42-> HSO 4-> ClO 4-1414.151010-- 1410.251010-- 144.741010-- 143.741010-- 143.371010-- 141.991010--4.pH =7.00的水溶液一定是中性水溶液吗?请说明原因。
4.不一定。
K w 随温度的改变而改变,在常温下它的值为10-14,此时的中性溶液pH 为7.005.常温下水的离子积w K θ=1.0×10-14,是否意味着水的解离平衡常数K θ=1.0×10-14?5.不。
w K θ=[H +][OH -],而K θ=[H +][OH -]/c (H 2O);c (H 2O)=11000/18.0255.5mol L 1-=⋅ 6.判断下列过程溶液pH 的变化(假设溶液体积不变),说明原因。
(1)将NaNO 2加入到HNO 2溶液中; (2)将NaNO 3加入到HNO 3溶液中; (3)将NH 4Cl 加入到氨水中; (4)将NaCl 加入到HAc 溶液中;6. (1)pH 变大。
无机及分析化学第七章定量分析方法概述课后练习与答案

无机及分析化学第七章定量分析方法概述课后练习与答案第七章分析化学概论一、选择题1.消除测量过程中的偶然误差的方法是( )A.空白实验 B.对照实验 C.增加平行测定次数 D.校正仪器2. 下列物质可采用直接法配制标准溶液的是 ( )A.NaOH B.HCl C.无水Na2CO3 D.KMnO43.下列说法错误的是 ( )A.系统误差又称为可测误差 B.系统误差具有单向性C.方法误差属于系统误差 D.偶然误差可完全消除4.下列属于偶然误差的是 ( )A.使用生锈的砝码称量B.标定HCl时所用Na2CO3不纯C.所用试剂含待测组分D.滴定管读数时最后一位估计不准5.05.2010 .01250.0的有效数字位数为( )A.4 B.2C.3 D.16.pH=10.02的有效数字位数为 ( )A.4 B.2C.3 D.无法确定7.用失去结晶水的Na2B4O7.10H2O标定HCl溶液,则测得的浓度会 ( ) A.偏高B.偏低C.与实际浓度一致D.无法确定8.滴定分析中,指示剂颜色发生突变的这一点称为 ( )A.化学计量点B.滴定终点C.既是化学计量点,也是滴定终点D.以上都不对9.测定CaCO3含量时,先加入一定量并且过量的HCl溶液,然后用NaOH标准溶液滴定剩余的HCl溶液,此滴定方式属于( ) A.直接滴定B.返滴定C.置换滴定D.简接滴定10.常量分析的试样用量为 ( )A .大于1.0gB .1.0~10gC .大于0.1gD .小于0.1g11.滴定分析中,滴定管的读数误差为±0.01mL ,滴定管的一次滴定需读初、终两次读数,可能引起的最大误差为±0.02mL ,为使滴定的相对误差小于0.1%,终点时消耗的滴定剂的体积至少为 ( )A .10mLB .15mLC .20mLD .无法确定12.用25mL 常量酸碱滴定管进行滴定,结果记录正确的是( )A .18.2B .18.20C .18D .18.00013.已知T HCI/NaON =0.004000 g/ml 、则C HCI 为( )A .0.1000mol/LB .0.004000g/mlC .0.003600g/mlD .0.1097mol/L14.滴定管的读数误差为±0.02ml,若滴定时用去滴定液20.00ml ,则相对误差是( )A .±0.1%B .±0.01%C .±1.0%D .±0.001%15.在标定NaOH 溶液浓度时,某同学的四次测定结果分别为0.1023 mol ·L -1、0.1024 mol ·L -1、0.1022 mol ·L -1、0.1023 mol ·L -1,而实际结果应为0.1088 mol ·L -1,该学生的测定结果 ( )A .准确度较好,但精密度较差B .准确度较差,但精密度较好C .准确度较差,精密度也较差D .系统误差小,偶然误差大16.在定量分析结果的一般表示方法中,通常要求( )A .d R ≤2%B .d R ≤0.02%C .d R ≥0.2% D.d R ≤0.2% 17.T A/B 表示的意义是 ( )A .100ml 标准溶液A 中所含溶质的质量B .1ml 标准溶液A 中所含溶质的质量C .1L 标准溶液A 相当于被测物质B 的质量D .1ml 标准溶液A 相当于被测物质的质量18.T HCl/NaOH =0.003000g/ml ,终点时HCl 消耗40.00 ml ,试样中NaOH 的质量为( )A .0.1200gB .0.01200gC .0.001200gD .0.1200mg。
兰叶青 无机及分析化学课后答案 第七章

第 习题答案7—1解:设BaSO 4在水中的溶解度为S 1(mol ·L -1);在0.10mol•L -1Na 2SO 4溶液中的溶解度为S 2(mol ·L -1).由 )()()(aq S O aq Ba s BaSO 2424-++= 222222sp 441010BaSO Ba SO c S .S K c /c c /c S /c ΘΘΘΘΘ+-⋅+⎡⎤⎡⎤===⎣⎦⎣⎦()()()()()(纯水中) (Na 2SO 4中)已知 10sp 4BaSO 10710K .Θ-=⨯()解得 S 1=1.03×10-5mol•L -1由同离子效应知,S 2<S 1=1.03×10-5mol•L -1 所以 0.10+ S 2≈0.10 解得S 2=1.1×10-9mol•L -1 7—2解:(1)7213sp AgBr 88107710K ..Θ--=⨯=⨯()()(2)5313sp 44Mg NH PO 63102510K ..Θ--=⨯=⨯(())()(3)55213sp 32Pb IO 3110101210K ..Θ---=⨯⨯⨯⨯=⨯(())(2 3.1)7—3 解:两液混合后,13132L m o l 1001L mol 1001001001002Pb ----+⋅⨯=⋅+⨯⨯=.....c)()( 11L mol 0200L mol 1001001000400I ---⋅=⋅+⨯=.....c )()(22PbI s Pb aq 2I aq +-+ƒ()()() 根据溶度积规则,计算离子积Q :22327Q P b I 101000204010c /c c /c ...ΘΘ+---⎡⎤⎡⎤==⨯⨯=⨯⎣⎦⎣⎦()() 查表得 9sp 2PbI 84910K .Θ-=⨯() 即 )(2sp PbI Q ΘK 〉应有PbI 2沉淀产生. 7—4解:查表39sp 3Fe OH 26410K .Θ-=⨯(()) 17sp 2Fe OH 48710K .Θ-=⨯(())Fe (OH )3沉淀完全时, c (Fe 3+)≤1.0×10-5mol·L -1,此时OH c /c Θ-==()解得 c (OH -)=6.4×10-12 mol·L -1pH=14-pOH=2.81,即pH 至少为2.81。
无机及分析化学第七章答案 (2)

第七章 要求作业答案7-1 判断题 解:(1)不正确。
有些化合物不存在外界,如[PtCl 2(NH 3)2]、[CoCl 3(NH 3)3]等。
(2)不正确。
少数高氧化数的非金属元素离子也可作为形成体,如[BF 4]-、[SiF 6]2-中的B 3+、Si 4+等;另外,有些中性原子也可作形成体,如[Ni(CO)4]中的Ni 原子。
(3)不正确。
在多齿配体的螯合物中,配位体数目就不等于配位数,如[Cu(en)2]2+中。
(4)不正确。
配离子电荷应是形成体和配位体电荷的代数和。
如[Fe(CN)6]3-。
(5)正确。
7-2 填空题 解:(1)五氟·一水合铁(Ⅲ)酸铵;Fe 3+; F -,H 2O ; F ,O ; 6; sp 3d 2; 外轨(2)Co 3+;Cl -,NH 3; Cl ,N ; 6;1s 22s 22p 63s 23p 63d 6 or [Ar]3d 6;四;Ⅷ;d ;d 2sp 3;八面体;内轨型;氯化一氯·五氨合钴(III)(3)乙二胺四乙酸;1:1 (4)pH <12.47-3 选择题解 (1)D (2)B (3)A (4)B7-4 计算题1.解:(1)())L (mol 0.041000.1040Ag 1•=×=+c , ()()13L mol 1.21006.020NH -⋅=⨯=c 设平衡时[Ag(NH 3)2]+ 解离产生的Ag +的浓度为x mol·L -1。
Ag + + 2 NH 3 = [Ag(NH 3)2]+c 0/ mol·L -1 0.04 1.2 0c / mol·L -1 x 1.2-2×0.04+2x ≈ 1.12 0.04-x ≈0.04()722323107.10.1/12.1)0.1/(0.1/04.0]/)([/)(/])([⨯=•=•=++x c NH c c Ag c c NH Ag c K f θθθθ解得 c (Ag +) = x = 1.88 ×10-9 (mol·L -1)c (NH 3) ≈ 1.12 (mol·L -1)c [Ag(NH 3)2+] ≈ 0.04 (mol·L -1)(2) 在混合稀释后的溶液中加入0.010mol KCl 固体,即c (Cl -) = 0.01010000.100100⨯= (mol·L -1) ∵Q = c (Ag +)/1.0×c (Cl -)/1.0 = (1.88×10-9/1.0)×(0.10/1.0 )= 1.88×10-10 ∴Q >[]AgCl θsp K = 1.77×10-10,所以能产生AgCl 沉淀。
(完整版)无机及分析化学课后习题第七章答案

一、选择题在给出的4个选项中,请选出1个正确答案。
1. 下列物质中,酸的强度最大的是( D )A. HAc 4.75HAc)p θa=(K B. HCN 219HCN)p θa .(K = C. NH 4+4.75O)H NH p 23θb =⋅(K D. HCOOH 25.10HCOONa)(p θb =K 2. 某混合碱用盐酸滴定至酚酞变色,消耗V 1ml ,继续以甲基橙为指示剂消耗V 2ml ,已知V 1>V 2 ,其组成是( C )A. Na 2CO 3B. Na 2CO 3与NaHCO 3C. NaOH 与Na 2CO 3D. NaOH3. 用Na 2CO 3 为基准物质标定HCl 溶液时,下列情况对HCl 溶液的浓度不产生影响的是( A )A. 用去离子水溶解锥形瓶中的Na 2CO 3时,多加了5.0mL 去离子水B. 烘干Na 2CO 3时,温度控制300℃以上C. 滴定管未用HCl 溶液润洗D. 滴定速度太快,附着在滴定管壁上的HCl 溶液来不及流下来就读取滴定体积4. 蒸馏法测定铵盐中N 含量时,能用作吸收液的是( B )A. 硼砂B. HClC. HAcD. NH 4Cl5. 下列溶液能用HCl 或NaOH 标准溶液直接滴定的是(浓度均为0.1mol·L -1) ( D )A. NaAcB. NH 4ClC. HCND. HCOOH(K θa (HAc) = 1.79×10-5 ;K θb (NH 3) = 1.8×10-5 ;K θa (HCN) = 4.99×10-10 ; K θa (HCOOH) =1.7×10-4)6. 用返滴定法测定氨水含量,应选用的指示剂是( D )A. 酚酞B. 甲基橙C. 钙红D. 甲基红7. 用c (NaOH)=0.1000 mol·L -1的NaOH 溶液滴定相同浓度的弱酸(K a1 =8.6 ×10-2K a2 =6.3×10-7 K a3 =4.0×10-13)( B )A.有两个滴定终点,第一终点用酚酞、第二终点用甲基红指示B.有两个滴定终点,第一终点用甲基红、第二终点用酚酞指示C.只有一个终点,用酚酞指示D.只有一个终点,用甲基红指示8. 酸碱滴定中,选择酸碱指示剂可以不考虑的因素是( C )A. pH 突跃范围B. 指示剂的变色范围C. 指示剂的摩尔质量D. 要求的误差范围9. H3PO4的pKθa1, pKθa2 pKθa3分别为2.12、7.20、12.36,当pH=8.0时,H3PO4溶液体系中浓度最大的组分是( A )A. HPO42-B. H2PO4- C . H3PO4 D. PO43-二、填空题1. 下列离子HCO3―,H2O,S2-,NH4+只能作碱的是S2-,只能作酸的是NH4+,即可作酸又能作碱的是HCO3―,H2O 。
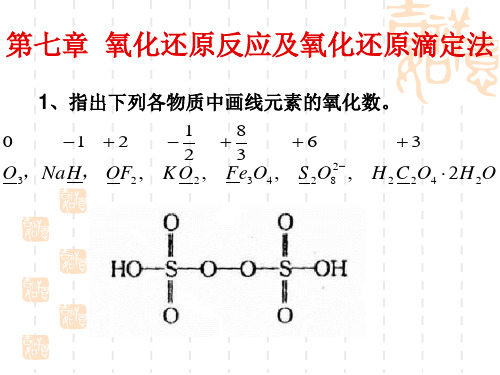
无机及分析化学 第七章氧化还原反应课后习题答案
7、求下列情况下在298.15K时有关电对的电极电势。 (忽略加入固体对溶液体积变化)
nCu 2 cNa S O VNa S O 0.1000 25.13 10 3 2.513 10 3 mol
2 7 2 7
1.967 10 4 mol
解:2Cr2 O72 28H 12e 3O2 12 H 12e nO2 nCr O2
2 7
4Cr 3 14 H 2O
6 H 2O nCr O2 1.967 104
2 7
3 2
1
COD(O2, mg L )
2
0.0592 E H / H lg(1.34 103 ) 2 2 2 0.17V
9、计算在H2SO4介质中,H+浓度分别为1mol.L-1和 0.1mol.L-1的溶液中,VO2+/VO2+电对的条件电极电势 (忽略离子强度的影响)。
解:查表得VO2 2 H e VO 2 H 2 O 2 E A (VO2 / VO 2 ) E ( VO / VO ) 0.0592 lg A 2 2 E ( VO / VO ) 1.000V A 2
2
0.0592 36 0.34 lg 6.3 10 2 0.70V
(3)100kPa氢气通入0.10 mol.L-1 HCI溶液中, E H / H2 ?
0.0592 (cH / c ) E H / H2 E H / H lg 2 n (p H2 /p )
电子教案与课件:无机及分析化学 课后习题和答案

绪论一、选择题1、按任务分类的分析方法是 ( )A.无机分析与有机分析 B.定性分析、定量分析和结构分析C.常量分析与微量分析 D.化学分析与仪器分析2、常量分析的称样量是 ( )A.>1g B.>0.1g C.0.01~0.1g D.>10mg3、鉴定物质的化学组成是属于 ( )A.定性分析 B.定量分析 C.结构分析 D.化学分析二.无机及分析化学的任务是什么?三.请简单阐述无机及分析化学在精细化学品、药学、食品及农业科学中的应用。
四.如何区分化学分析和仪器分析?五. 结合自己的实际情况谈一下自己将如何学习该课程。
本章答案:一.1.B 2.B 3.A 二.略三.略四.略五.略第一章物质的结构一、选择题1. 基态钠原子的最外层电子的四个量子数可能是( )A.3,0,0,+1/2B.3,1,0,+1/2C.3,2,1,+1/2D.3,2,0,-1/22. 已知某元素+3价离子的核外电子排布式为:1s22s22p63s23p63d5, 该元素在周期表中属于( )A.VIII族B.IIIA族C. IIIB族D. VA族3. 有d电子的原子,其电子层数至少是( )A. 1B. 2C. 3D. 44.某元素的价电子构型为3d14s2, 则该元素的原子序数为( )A.20B.21C.30D. 255.在Mn(25)原子的基态电子排布中,未成对电子数为( )A.2B.5C.8D. 16.最外层为5s1,次外层d轨道全充满的元素在( )A.IAB.IBC.IIAD. IIB7. 下列分子中属于极性分子的是( )A.O2 B.CO2 C.BBr3 D.NF38. 下列分子中中心原子采取sp杂化的是 ( )A.NH3 B.CH4C.BF3 D.BeCl29.下列分子中,偶极距为零的是 ( )A.CH3Cl B.NH3 C.BCl3 D.H2O10.下列液体只需要克服色散力就能沸腾的是 ( ) A.CCl4 B.H2O C.NH3 D.C2H5OH11.下列说法正确的是( )A.sp2杂化轨道是指1s轨道与2p轨道混合而成的轨道。
无机及分析化学课后习题答案完整版

无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20. 重量分析中的沉淀形式应当符合(D)
A. 溶解度小
B. 沉淀纯净含杂质少
C. 相对分子量尽量大
D. A、B和C
17. Ca
3
(PO4)2的溶解度为a/2 mol·L-1,其Ksp为 ( D)
(A). 36a5 (B) 4 a5/ 9 (C) 9a5 /4 (D) 27a5 /8
7.已知在一定的温度下,CdCO
3的K
sp
=×10-12,Cd(OH)
2
的K
sp
=×10-14,那么它们
在水中的溶解度:( B )
>Cd(OH)
2 <Cd(OH)
2
= Cd(OH)
2
D.不能确定
13. AgNO
3处理[Fe(H
2
O)
5
Cl]Br溶液,产生沉淀主要是 ( A )
A. AgBr
B. AgCl
C. AgBr和AgCl
D. Fe(OH)
3
存在下,AgCl的溶解度比纯水中大,原因是(C)
(A)同离子效应(B)酸效应(C)盐效应(D)配位效应
9. 在沉淀反应中,加入易溶电解质会使沉淀的溶解度增加,该现象是( B)
A. 同离子效应
B. 盐效应
C. 酸效应
D. 配位效应
5. 某物质的化学式是AB
3,其溶解度S和容度积常数K
sp
Θ的关系式是(C)
A. K
sp Θ=2S2 B. K
sp
Θ=2S3 C. K
sp
Θ=27S4 D. K
sp
Θ=4S2
9、已知在一定的温度下,CdCO
3的K
sp
=×10-12,Cd(OH)
2
的K
sp
=×10-14,那么它们
在水中的溶解度:B
(1)CdCO
3>Cd(OH)
2
(2)CdCO
3
<Cd(OH)
2
(3)CdCO
3= Cd(OH)
2
(4)不能确定
16、Ag
2S的溶度积K
sp
的表示式为:D
(1)K
sp =c(Ag+)c(s2-) (2)K
sp
= c(Ag+)c(s2-) 2
(3)K
sp = 2c(Ag+)c(s2-) (4)K
sp
= c(Ag+) 2c(s2-)
11. 过量AgCl溶解在下列各物质中,问哪种溶液中Ag+浓度最小(D)
A. 100 cm3水
B. 1000 cm3水
C. 1000 cm3 mol·dm-3KNO
3
溶液 D. 100 cm3 mol·dm-3KCl溶液
20.关于晶型沉沉淀的条件,下列说法错误的是: ( D)(A)沉淀反应应当在适当稀的溶液中进行;
(B)沉淀作用应当在热溶液中进行;
(C)沉淀完毕后进行陈化使沉淀晶体完整、纯净;
(D)当沉淀剂是挥发性物质时,沉淀剂用量应为其理论用量的200%为宜。
9.反应Mg(OH)2(s)+2NH 4+
Mg 2++2NH 3+2H 2O(l )的平衡常数表达式为 A 。
A.
2)
(ΘΘb
sp
K K B.
Θ
Θb sp
K K C. ΘΘ
w
b
K K D. ΘΘsp
b
K K
10. 已知某难溶盐AB 2的溶解度为S (单位为mol ·L -1),其溶度积为(C ) A. S 3 B. S 2 C. 4S 3 D. S 3/4
15. CaF 2的饱和溶液浓度为2×10-4 mol·L -1,它的溶度积常数是:( C )
A .4×10-4 B. 8×10-12 C. ×10-11
D. 8×10-10
24、在重量分析法中,具有挥发性的沉淀剂一般应该过量(A ) A. 50%~100% B. 20%~30% C. 45%~80% D. 30%~50
在下列哪种溶液中的溶解度较大(C )
(A )Ca(NO 3)2 (B )Na 2CO 3 (C )NaNO 3 (D )无法判断
存在下,AgCl 的溶解度比纯水中大,原因是 (C)
(A )同离子效应 (B )酸效应 (C )盐效应 (D )配位效应
15.沉淀滴定的佛尔哈德法的指示剂是 ( C )
(A )铬黑T (B )甲基橙 (C )铁铵矾 (D )铬酸钾
12. 1L Ag 2C 2O 4饱和溶液中质量为0.06257g ,若不考虑离子强度,水解等因素,Ag 2C 2O 4的K sp 是( B )[M(Ag 2C 2O 4)=302g·mol -1]
A. 4.24×10-8
B. ×10-11
C. ×10-10
D. ×10-12
13. 下列叙述中,正确的是( D )
A. 由于AgCl 水溶液的导电性很弱,所以它是弱电解质
B. 难溶电解质溶液中离子浓度的乘积就是该物质的溶度积
C. 溶度积大者,其溶解度就大
D. 用水稀释含有AgCl 固体的溶液时,AgCl 的溶度积不变,其溶解度也不变 9. AgCl 固体在下列哪一种溶液中的溶解度最大 A A. 1mol·L -1氨水溶液 B. 1mol·L -1氯化钠溶液 C. 纯水 D. 1mol·L -1硝酸银溶液
10. 欲使CaCO 3在水溶液中溶解度增大,可以采用的方法是D A. 加入 Na 2CO 3; B. 加入 ; C. 加入 ; D. 降低溶液的pH 值
7.已知在一定的温度下,CdCO3的K sp=×10-12,Cd(OH)2的K sp=×10-14,那么它们在水中的溶解度:( B )
>Cd(OH)2 <Cd(OH)2
= Cd(OH)2 D.不能确定
13. AgNO3处理[Fe(H2O)5Cl]Br溶液,产生沉淀主要是 ( A )
A. AgBr
B. AgCl
C. AgBr和AgCl
D. Fe(OH)3
20. 若BaCl2中含有NaCl、KCl、CaCl2等杂质,用H2SO4沉淀Ba2+时,生成的BaSO4最易吸附何种离子---------------------------------------------------------------------------------------------( C )
(A) Na+(B) K+
(C) Ca2+(D) H+
5. 某物质的化学式是AB3,其溶解度S和容度积常数K spΘ的关系式是( C )
A. K spΘ=2S2
B. K spΘ=2S3
C. K spΘ=27S4
D. K spΘ=4S2
10. 在下列浓度相同的溶液中,AgI具有最大溶解度的是:( D )
A.NaCl B. AgNO3 C. NH3 · H2O D. KCN。
